Lipofilling bij de ziekte van Dupuytren
Uitgangsvraag
Wat is de waarde van lipofilling?
Aanbeveling
De werkgroep adviseert om lipofilling respectievelijk PALF bij voorkeur alleen in studieverband toe te passen bij de behandeling van een primaire Dupuytren contractuur.
Overwegingen
Kwaliteit van bewijs
Ten aanzien van selectieve fasciëctomie / percutane naaldfasciotomie in combinatie met lipofilling versus alleen selectieve fasciëctomie / percutane naaldfasciotomie
De kwaliteit van bewijs van de onderzochte uitkomstmaten is zeer laag. Zeer lage kwaliteit van bewijs impliceert dat het zeer onzeker is of het werkelijke effect dichtbij of ver weg van het werkelijke effect ligt.
Ten aanzien van PALF versus selectieve fasciëctomie
De kwaliteit van bewijs van de onderzochte uitkomstmaten is zeer laag. Zeer lage kwaliteit van bewijs impliceert dat het zeer onzeker is of het werkelijke effect dichtbij of ver weg van het werkelijke effect ligt.
Professioneel perspectief
Op dit moment is er nog geen plaats voor lipofilling in de behandeling van primaire Dupuytren contracturen. Enerzijds omdat de meerwaarde van lipofilling nog niet is aangetoond, anderzijds omdat lipofilling ook donorsite morbiditeit kent. Het gebruik van lipofilling is een relatief nieuwe behandeling voor de ziekte van Dupuytren, welke pas sinds 5 jaar op bescheiden schaal wordt toegepast. Lange termijn resultaten zijn derhalve nog niet voorhanden.
Balans van gewenste en ongewenste effecten
Ten aanzien van selectieve fasciëctomie + lipofilling versus selectieve fasciëctomie
- Op korte termijn (tijdens het eerste jaar na de ingreep): het netto-gunstig effect lijkt niet ten voordele van lipofilling.
- Op lange termijn (5 jaar na de ingreep): niet bekend
Ten aanzien van PALF versus selectieve fasciëctomie
- Op korte termijn (tijdens het eerste jaar na de ingreep): er lijkt geen verschil te zijn in het netto-gunstig effect tussen de twee behandelopties.
- Op lange termijn (5 jaar na de ingreep): het netto-gunstig effect lijkt ten voordele van selectieve fasciëctomie.
Rationale van de aanbeveling(en)
Ten aanzien van selectieve fasciëctomie + lipofilling versus selectieve fasciëctomie
Bij het opstellen van de aanbeveling is veel gewicht toegekend aan de geringe huidige bewijslast van de literatuur om selectieve fasciëctomie te combineren met lipofilling. De richtlijncommissie vindt het wel belangrijk dat lipofilling in studieverband nader onderzocht wordt.
Ten aanzien van PALF versus selectieve fasciëctomie
Bij het opstellen van de aanbeveling is veel gewicht toegekend aan de geringe huidige bewijslast van de literatuur om PALF toe te passen. De richtlijncommissie vindt het wel belangrijk dat PALF in studieverband nader onderzocht wordt.
Onderbouwing
Achtergrond
Lipofilling is het opvullen van een subcutaan defect met elders in het lichaam gewonnen autoloog vetweefsel. Dit wordt over het algemeen gebruikt om contour- of volumedefecten op te vullen. Sinds 2016 wordt door sommige auteurs lipofilling gebruikt bij de ziekte van Dupuytren, als toevoeging tijdens een naaldaponeurotomie. Bij deze methode wordt onderhuids een kleine hoeveelheid autoloog vet achtergelaten na de correctie van het extensiedeficit.
Theoretisch zou het kunnen leiden tot zachtere, betere littekens en mogelijk een kleinere kans op recidief, of langere ziektevrije periode.
Conclusies / Summary of Findings
PICO-vraagstelling 1: review van selectieve fasciëctomie / percutane naaldfasciotomie in combinatie met lipofilling vergeleken met alleen selectieve fasciëctomie / percutane naaldfasciotomie
|
Zeer laag
GRADE |
Effectiviteit Totale passieve extensiebeperking (TPED) na 6 weken, 6 maanden en 12 maanden bij primaire Dupuytren patiënten boven de 40 jaar met een TPED van meer dan 30 graden in het MCP, PIP en DIP gewricht Selectieve fasciëctomie in combinatie met lipofilling lijkt op korte termijn (≤12 maanden na ingreep) geen extra effect te hebben op TPED vergeleken met alleen selectieve fasciëctomie.
Bron: Sambuy et al., 2020 |
|
Zeer laag
GRADE |
Effectiviteit (PROM’s) Handfunctie (BMHQ) en pijnintensiteit (VAS-scores) na 6 weken, 6 en 12 maanden bij primaire Dupuytren patiënten boven de 40 jaar met een TPED van meer dan 30 graden in het MCP, PIP en DIP gewricht Selectieve fasciëctomie in combinatie met lipofilling lijkt op korte termijn (≤12 maanden na ingreep) een minder gunstig effect te hebben op de handfunctie vergeleken met alleen selectieve fasciëctomie.
Selectieve fasciëctomie in combinatie met lipofilling lijkt zes weken na de ingreep met meer pijn gepaard te gaan dan alleen selectieve fasciëctomie. Zes en twaalf maanden na de ingreep lijken de twee behandelingen niet of nauwelijks te verschillen ten aanzien van pijn.
Bron: Sambuy et al., 2020 |
|
---------
GRADE |
Effectiviteit (PROMs) Werkhervatting en patiënttevredenheid bij primaire Dupuytren patiënten boven de 40 jaar met een TPED van meer dan 30 graden in het MCP, PIP en DIP gewricht Er werden geen gerandomiseerde studies geïdentificeerd die de uitkomstmaten werkhervatting en patiënttevredenheid hebben onderzocht.
Bron: Sambuy et al., 2020 |
|
Zeer laag
GRADE |
Complicaties Infectie, zenuwbeschadiging, peesbeschadiging, wonddehiscentie, hematoom en CRPS bij primaire Dupuytren patiënten boven de 40 jaar met een TPED van meer dan 30 graden in het MCP, PIP en DIP gewricht Selectieve fasciëctomie in combinatie met lipofilling lijkt met meer complicaties gepaard te gaan vergeleken met alleen selectieve fasciëctomie.
Bron: Sambuy et al., 2020 |
PICO-vraagstelling 2: review van percutane naaldfasciotomie in combinatie met lipofilling (PALF) vergeleken met selectieve fasciëctomie
|
Zeer laag
GRADE |
Effectiviteit Contractuurcorrectie 12 maanden na de ingreep bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP-gewricht, of beide Zowel PALF als selectieve fasciëctomie lijken op korte termijn MCP-contracturen volledig te corrigeren. Voor PIP-gewrichten lijkt echter enige contractuur te resteren na PALF.
Bron: Kan et al., 2016 |
|
Zeer laag
GRADE |
Effectiviteit Hersteltijd bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP gewricht, of beide De hersteltijd lijkt korter te zijn na PALF dan na selectieve fasciëctomie.
Bron: Kan et al., 2016 |
|
Zeer laag
GRADE |
Effectiviteit Recidief 12 maanden na de ingreep bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP gewricht, of beide Een jaar na de ingreep lijkt er geen verschil te zijn in het aantal recidieven tussen PALF en selectieve fasciëctomie.
Bron: Kan et al., 2016 |
|
Zeer laag
GRADE |
Effectiviteit Recidief 5 jaar na de ingreep bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP gewricht, of beide Vijf jaar na de ingreep lijken duidelijk minder recidieven op te treden na selectieve fasciëctomie dan na PALF. Het bewijs hiervoor is echter onzeker.
Bron: Selles et al., 2018 |
|
Zeer laag
GRADE |
Effectiviteit (PROM’s) Pijnintensiteit (VAS scores) en handfunctie (DASH-DLV score) bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP-gewricht, of beide Een jaar respectievelijk 5 jaar na de ingreep lijkt er geen verschil te zijn in VAS- score respectievelijk DASH-DLV score tussen PALF en selectieve fasciëctomie.
Bron: Kan et al., 2016; Selles et al., 2018 |
|
Zeer laag
GRADE |
Effectiviteit (PROM’s) Patiënttevredenheid bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP-gewricht, of beide Zes maanden na de ingreep en 5 jaar na de ingreep lijkt er geen verschil te zijn in patiënttevredenheid tussen PALF en selectieve fasciëctomie.
Een jaar na de ingreep leken patiënten in de groep selectieve fasciëctomie meer tevreden te zijn over het algehele behandelresultaat, de contractuurcorrectie en het behaalde t.o.v. het verwachte behandelresultaat dan in de PALF-groep.
Bron: Kan et al., 2016; Selles et al., 2018 |
|
Zeer laag
GRADE |
Complicaties bij primaire Dupuytren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP-gewricht, of beide Een jaar na de ingreep lijkt er geen verschil te zijn in het aantal complicaties tussen PALF en selectieve fasciëctomie.
Bron: Kan et al., 2016 |
Samenvatting literatuur
PICO-vraagstelling 1: review van selectieve fasciëctomie / percutane naaldfasciotomie in combinatie met lipofilling vergeleken met alleen selectieve fasciëctomie / percutane naaldfasciotomie
Sambuy et al., 2020
In een RCT werd bij 50 patiënten met de ziekte van Dupuytren selectieve fasciëctomie in combinatie met injecties van vettransplantaat (N=26) vergeleken met alleen selectieve fasciëctomie (N=24). Inclusiecriteria waren: patiënten ouder dan 40 jaar met een totale passieve extensiebeperking (TPED) van meer dan 30 graden in het metacarpofalangeale (MCP), proximale interfalangeale (PIP) en distale interfalangeale (DIP) gewricht. De uitkomstmaten waren totale passieve extensiebeperking 6 weken na behandeling en zes en twaalf maanden later, pijnintensiteit, handfunctie en complicaties van de behandeling. Extensiebeperking van een gewricht werd gemeten met een goniometer in graden, pijnintensiteit op een VAS schaal (0-10) en de handfunctie middels de ‘Brief Michigan Hand Questionnaire’ (BMHQ). Tijdens de wondgenezing werden de volgende complicaties systematisch geregistreerd: infectie, zenuwbeschadiging, peesbeschadiging, wonddehiscentie, hematoom en CRPS. Alle studiekarakteristieken staan vermeld in de evidence tabellen.
Resultaten voor kromstand van de vinger: 45 (90%) patiënten konden 12 maanden worden gevolgd.
Na 6 weken, 6 maanden en 12 maanden was er tussen beide behandelingen noch een relevant noch statistisch significant verschil in de totale passieve extensiebeperking (TPED).
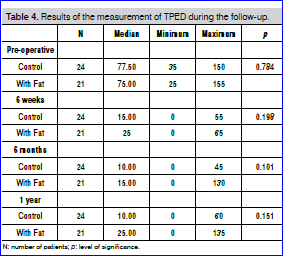
Ter info: postoperatief recidief kon niet worden geëvalueerd gezien de korte follow-uptijd van één jaar.
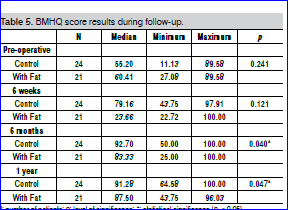
Resultaten voor handfunctie
Het effect van de behandelingen op de handfunctie werd bij 45 patiënten (21 lipofilling groep en 24 controlegroep) nagegaan met behulp van de BMHQ (0 zeer slechte handfunctie, 100 optimale handfunctie). De lipofilling-groep vertoonde een slechtere functionele score na 6 maanden en een jaar na de operatie. Ter info: de getallen voor handfunctie 6 weken na de ingreep kunnen niet juist zijn (drukfout in publicatie?).
Het effect van de behandelingen op de pijnintensiteit werd eveneens bij 45 patiënten (21 lipofilling groep en 24 controlegroep) nagegaan met behulp van de VAS score (0 geen pijn, 10 meest ernstige pijn). De lipofilling-groep vertoonde meer pijn na 6 weken follow-up.
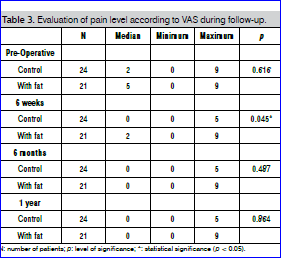
Patiënttevredenheid en werkhervatting werden niet gemeten.
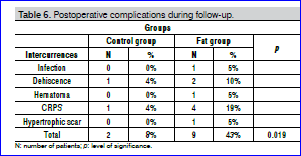
Resultaten voor complicaties
In de lipofilling-groep kwamen meer complicaties voor: 9 gevallen (43%) in de lipofilling-groep en 2 (8%) in de controlegroep.
Kwaliteit van bewijs
Voor studies over interventies starten gerandomiseerde onderzoeken in de categorie hoog. De evidence werd per uitkomstmaat getoetst aan de volgende criteria: beperkingen in onderzoeksopzet (zie de evidence tabellen), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Voor alle uitkomstmaten
Voor alle uitkomstmaten was het aantal events/patiënten <50/100. Op grond hiervan werd met twee niveaus afgewaardeerd voor zeer ernstige onnauwkeurigheid naar lage kwaliteit van bewijs. Er is onzekerheid of de patiëntenpopulatie in de studies (ouder dan 40 jaar en een TPED van >30 graden in MCP, PIP of DIP gewricht) vergelijkbaar is met de patiëntenpopulatie in Nederland (zie PICO). Daarom heeft de werkgroep het niveau van bewijskracht verder verlaagd naar zeer laag (indirectheid).
PICO-vraagstelling 2: review van percutane naaldfasciotomie in combinatie met lipofilling (PALF) vergeleken met selectieve fasciëctomie
Kan et al., 2016
In een RCT werden bij 69 patiënten (76 handen) met een primaire Dupuytren contractuur PALF (N=44 handen) vergeleken met selectieve fasciëctomie (N=32 handen) (Kan et al., 2016). Inclusiecriteria waren patiënten met een flexiecontractuur van tenminste 20 graden in het MCP-gewricht of tenminste 30 graden in het PIP gewricht, of beide. Metingen werden verricht bij aanvang en twee weken, drie weken, zes maanden en één jaar na de ingreep. De uitkomstmaten waren contractuurcorrectie, hersteltijd, recidief, pijnintensiteit, handfunctie, patiënttevredenheid en complicaties van de behandeling. Contractuurcorrectie werd gemeten door de totale passieve extensiebeperking (TPED) te meten met een goniometer (in graden). Hersteltijd werd gemeten op basis van het vermogen om de MPC-, PIP- en DIP-gewrichten te kunnen buigen (goniometrische metingen) en een dagboekvragenlijst waarin naar het aantal dagen tot terugkeer naar de normale dagelijkse activiteiten werd gevraagd. Een recidief werd gedefinieerd als een toename van de contractuur van tenminste 20 graden in een gewricht één jaar na de behandeling ten opzichte van de situatie 6 weken na de behandeling. Pijnintensiteit werd gemeten op een VAS schaal; de handfunctie middels de ‘Disabilities of the Arm, Shoulder, and Hand questionnaire’ (DASH-DLV score); en patiënttevredenheid middels een vragenlijst. Alle studiekarakteristieken staan vermeld in de evidence tabellen.
Selles et al., 2018
De studiedeelnemers in het onderzoek van Kan (2016) werden vijf jaar gevolgd (Selles et al., 2018). 52 patiënten (56 handen) konden worden geïncludeerd: 31 patiënten (34 handen) in de PALF-groep en 21 patiënten (22 handen) in de selectieve fasciëctomie groep. De uitkomstmaten waren recidief na 5 jaar, handfunctie na 5 jaar bij patiënten die geen revisie ondergingen en patiënttevredenheid na 5 jaar bij patiënten die geen revisie ondergingen.
De auteurs hanteerden twee definities voor de uitkomstmaat recidief: 1) het ondergaan van een secundaire ingreep voor een nieuwe of een verslechterende contractuur; of een toename van de extensiebeperking van meer dan 20 graden ten opzichte van week 3 na de behandeling; 2) een toename van de totale passieve extensiebeperking van tenminste 30 graden ter hoogte van een behandelde vinger.
Resultaten voor contractuurcorrectie:
In beide groepen werd vrijwel volledige MCP-contractuurcorrectie verkregen, terwijl voor het PIP gewricht enige contractuur resteerde. De manier waarop de contractuurcorrectie veranderde gedurende het eerste jaar na de ingreep, was in de beide groepen vergelijkbaar (Kan et al., 2016).
Resultaten voor hersteltijd:
Patiënten in de PALF-groep keerden significant eerder terug naar hun normale dagelijkse bezigheden (mediaan van 9 dagen versus 19 dagen) (Kan et al., 2016).
Resultaten voor recidief
Recidief na één jaar
Eén jaar na de ingreep verschilden de recidiefpercentages van PALF (10%) en selectieve fasciëctomie (9%) niet significant tussen de groepen (Kan et al., 2016).
Recidief na 5 jaar
Vijf jaar na de ingreep was het percentage recidieven in de PALF groep 74% (34/46 gewrichten) en 39% in de selectieve fasciëctomie groep (12/31 gewrichten). Dit verschil was statistisch significant (p=0,002) (Selles et al., 2018).
Bij het herdefiniëren van recidief als een toename van de totale passieve extensiebeperking van tenminste 30 graden ter hoogte van een behandelde vinger, was het percentage recidieven in de PALF groep 77% (35/46 gewrichten) en 32% in de selectieve fasciëctomie groep (10/31 gewrichten). Dit verschil was eveneens statistisch significant (p=0,001). Ook de totale extensiebeperking was ten nadele van PALF behandelde vingers (53 graden versus 31 graden; p <0,010) (Selles et al., 2018).
Resultaten voor pijnintensiteit
In beide groepen waren de pijnscores voor en na de operatie laag. De manier waarop de pijnintensiteit veranderde gedurende het eerste jaar na de ingreep, was in de beide groepen vergelijkbaar (Kan et al., 2016).
Resultaten voor handfunctie
In de loop van de tijd verbeterde de handfunctie significant in beide groepen. Eén jaar na de ingreep was er geen verschil in handfunctie tussen de groepen (Kan et al., 2016).
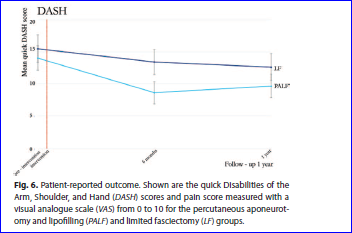
Resultaten voor handfunctie na 5 jaar bij patiënten die geen tweede ingreep ondergingen
Vijf jaar na de ingreep verschilde de DASH-DLV score niet significant tussen de groepen: 10.5 (18 patiënten) in de PALF-groep versus 9.3 (17 patiënten) in de selectieve fasciëctomie groep (Selles et al., 2018).
Resultaten voor patiënttevredenheid
Zes maanden na de ingreep was er geen significant verschil in patiënttevredenheid (Kan et al., 2016).
Eén jaar na de ingreep was de groep selectieve fasciëctomie significant meer tevreden met het algehele behandelresultaat, met de contractuurcorrectie en over of aan de behandelingsverwachtingen werd voldaan (Kan et al., 2016).
Eén jaar na de ingreep was er echter geen significant verschil tussen de groepen wat betreft het percentage patiënten die dezelfde operatie opnieuw wilden ondergaan en die hun type operatie wilden aanbevelen aan familie en vrienden (Kan et al., 2016).
Patiënttevredenheid na 5 jaar bij patiënten die geen tweede ingreep ondergingen (Selles et al., 2018):
Vijf jaar na de ingreep verschilden de scores voor patiënttevredenheid niet statistisch significant tussen de groepen.
Resultaten voor complicaties
Het complicatiepercentage was niet significant verschillend tussen de groepen. Selectieve fasciëctomie lijkt echter meer blijvende complicaties tot gevolg te hebben (Kan et al., 2016).
|
|
PALF |
Selectieve fasciëctomie |
|
Complex regionaal pijn syndroom |
2 |
1* |
|
Complicaties wondgenezing |
0 |
0 |
|
Neurovasculair of peesletsel |
0 |
2 |
|
* die leidden tot persisterende problemen 1 jaar na chirurgie |
||
Kwaliteit van bewijs
Gerandomiseerde studies over interventies starten in de categorie hoog en observationele studies over interventies in de categorie laag. De evidence werd per uitkomstmaat getoetst aan de volgende criteria: beperkingen in onderzoeksopzet (zie de evidence tabellen), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Voor alle uitkomstmaten ‘een jaar na de behandeling’ (RCT)
Voor deze uitkomstmaten was het aantal events/patiënten <50/100. Op grond hiervan werd met twee niveaus afgewaardeerd voor zeer ernstige onnauwkeurigheid naar lage kwaliteit van bewijs. Er is onzekerheid of de patiëntenpopulatie in de studies (ouder dan 40 jaar en een TPED van > 30 graden in MCP, PIP of DIP) vergelijkbaar is met de patiëntenpopulatie in Nederland (zie PICO). Daarom heeft de werkgroep het niveau van bewijskracht verder verlaagd naar zeer laag (indirectheid).
Voor alle uitkomstmaten ‘5 jaar na de behandeling’ (observationeel onderzoek)
Vanwege het observationele karakter van het onderzoek start de kwaliteit van bewijs voor deze uitkomstmaten laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag vanwege zeer ernstige onnauwkeurigheid (zie hierboven). Er is onzekerheid of de patiëntenpopulatie in de studies (ouder dan 40 jaar en een TPED van > 30 graden in MCP, PIP of DIP) vergelijkbaar is met de patiëntenpopulatie in Nederland (zie PICO). Daarom heeft de werkgroep het niveau van de bewijskracht verder verlaagd naar zeer laag (indirectheid).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep twee systematische literatuuranalyses verricht met de volgende PICO-vraagstellingen:
- Wat is bij patiënten met een primaire ziekte van Dupuytren en een kromstand* van de vinger, het effect van selectieve fasciëctomie of percutane naaldfasciotomie, beide in combinatie met lipofilling, vergeleken met alleen selectieve fasciëctomie of percutane naaldfasciotomie op de uitkomstmaten in onderstaande tabel?
- Wat is bij patiënten met een primaire ziekte van Dupuytren en een kromstand* van de vinger, het effect van percutane naaldfasciotomie in combinatie met lipofilling (PALF) vergeleken met selectieve fasciëctomie op de uitkomstmaten in onderstaande tabel?
* definitie kromstand van de vinger: totale passieve extensiebeperking (TPED)
In de databases Medline (OVID), Embase en de Cochrane library is een systematische search verricht. De search is beperkt tot gerandomiseerd onderzoek. De search is niet beperkt in publicatiejaren. De zoekverantwoording is weergegeven in de zoekverantwoording.
Selectiecriteria
|
Type studies |
|
|
Type patiënten |
|
|
Interventie [I] /control [C] |
PICO 1 (effectiviteit lipofilling)
PICO 2
|
|
Type uitkomstmaten |
handfunctie:
PROM’s:
complicaties:
|
|
Type setting |
|
|
Exclusiecriteria |
|
De literatuurzoekactie leverde 73 treffers op.
Zeven studies werden geselecteerd op basis van titel en abstract. Na het lezen van de volledige artikelen voldeden hiervan drie studies aan de selectiecriteria en werden deze meegenomen in de literatuuranalyse (Sambuy et al., 2020; Selles et al., 2018; Kan et al., 2016). In de evidence tabellen staan de redenen van exclusie van de andere vier studies vermeld.
Ten aanzien van selectieve fasciëctomie of percutane naaldfasciotomie, beide in combinatie met lipofilling vergeleken met alleen selectieve fasciëctomie of alleen percutane naaldfasciotomie (effectiviteit lipofilling)
Eén studie voldeed aan de selectiecriteria (Sambuy et al., 2020).
Ten aanzien van PALF vergeleken met selectieve fasciëctomie
Twee studies voldeden aan de selectiecriteria (Selles et al., 2018; Kan et al., 2016). Ter informatie: de studie van Selles et al. (2018) rapporteert de langetermijn resultaten van de gerandomiseerde studie van Kan (2016). De studie van Selles werd opgevat als een observationeel onderzoek, omdat patiënten na afloop van de studie van Kan (2016) zijn benaderd met de vraag of ze aan de studie van Selles (2018) willen deelnemen, waardoor de randomisatie is verbroken.
Referenties
- Hovius, S. E., et al. (2011). "Extensive percutaneous aponeurotomy and lipografting: a new treatment for Dupuytren disease." Plastic & Reconstructive Surgery 128(1): 221-228.
- Hovius, S. E. R. and C. Zhou (2018). "Advances in Minimally Invasive Treatment of Dupuytren Disease." Hand Clinics 34(3): 417-426.
- Kan, H. J., et al. (2016). "Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients with Primary Dupuytren's Contracture: A Prospective, Randomized, Controlled Trial." Plastic & Reconstructive Surgery 137(6): 1800-1812.
- Kan, H. J., et al. (2017). "Reply: Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients with Primary Dupuytren's Contracture: A Prospective, Randomized, Controlled Trial." Plastic & Reconstructive Surgery 140(2): 358e-359e.
- Konneker, S., et al. (2017). "Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients with Primary Dupuytren's Contracture: A Prospective, Randomized, Controlled Trial." Plastic & Reconstructive Surgery 140(2): 357e-358e.
- Sambuy, M. T. C., et al. (2020). "Randomized Controlled Trial of Limited Fasciotomy with Injection of Adipose Graft for Dupuytren's Disease." Acta Ortopedica Brasileira 28(4): 159-164.
- Selles, R. W., et al. (2018). "Percutaneous Aponeurotomy and Lipofilling versus Limited Fasciectomy for Dupuytren's Contracture: 5-Year Results from a Randomized Clinical Trial." Plastic & Reconstructive Surgery 142(6): 1523-1531.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|||||||||||||||
|
Kan 2016 |
Type of study: RCT
Setting: Enrolment between February 24, 2009, and October 1, 2011; Erasmus University Medical Center; Sint Franciscus Gasthuis
Country: The Netherlands
Source of funding: Funding for this study was provided by Fonds NutsOhra and Stichting Coolsingel. The authors have no financial interests to disclose. |
Inclusion criteria: Patients with primary Dupuytren’s contracture and a flexion contracture of at least 20 degrees at the MCP joint or at least 30 degrees at the PIP joint, or both.
Exclusion criteria: If the affected finger had a prior intervention or if anticoagulants could not be stopped.
N total at baseline & treatment: 69 patients (76 hands) Intervention: 39 patients (44 hands) Control: 30 patients (32 hands)
Important prognostic factors2: Baseline characteristics were not significantly different between groups
|
Percutaneous aponeurotomy and lipofilling (PALF) (44 hands were treated)
Notes: Patients received hand therapy and instructions to wear an extension splint at night for 6 months.
Five patients initially treated with limited fasciectomy received PALF on the contralateral hand.
|
Limited Fasciectomy (32 hands were treated)
Notes: Patients received hand therapy and instructions to wear an extension splint at night for 6 months.
Three patients initially treated with PALF had limited fasciectomy on their contralateral hand.
|
Length of follow-up: Patients were measured at baseline and at 2 weeks, 3 weeks, 6 months, and 1 year postoperatively.
Loss-to-follow-up: There are no signs for selective loss to follow up. |
Contracture correction Measured by the passive extension deficit (goniometer) of the MPC, PIP and DIP joints at all time points. Results: in both groups, almost full MCP joint contracture correction was obtained, whereas for the PIP joint, some residual contracture remained. The contracture correction in both groups changed similar over time (see figure 3 and 4 in the published article).
Convalescence period Estimated as the ability to flex the MPC, PIP and DIP joints based on goniometric measures and a diary questionnaire asking about the number of days until return to all normal daily activities.
Results: Patients in the PALF group returned significantly earlier to their normal daily activity. Intervention: 9 days (median) Control: 19 days (median) p = 0.001.
The results showed a significantly improved ability to make a fist early after treatment with PALF (p = 0.008).
Recurrence rate Measured by the passive extension deficit of the MPC, PIP and DIP joints at all time points. Defined as an increase in joint contracture in any treated joint of at least 20 degrees at 1 year after treatment compared to 6 weeks after treatment. Results: at 1 year after surgery, no significant differences in recurrence rate were present. At 1 year postoperatively there was some recurrence: Intervention: 15/85 (18%) Control: 5/58 (9%) P = 0,107
Pain (PROM) Measured by using a visual analogue scale. Results: pain scores before and after surgery were generally low in both groups, and we found no interaction effect of time and group for pain (p = 0.593).
Hand function (PROM) Measured by the Dutch translation of the Disabilities of the Arm, Shoulder, and Hand questionnaire (DASH-DLV score)
Results: hand function improved significantly over time in both groups (p = 0.007). At 1 year after surgery, no significant differences in hand function were present.
Patient satisfaction (PROM) Measured by a questionnaire consisting of seven questions
Results: At 6 months postoperatively: there was no significant difference in any of the satisfaction questions.
At 1 year after surgery: limited fasciectomy–treated patients were significantly more satisfied with the overall treatment outcome, contracture correction, and whether treatment expectations were met. However, no significance difference was found in percentages of patients who wanted to undergo the same operation again and who wanted to recommend their type of surgery to family and friends. Also, all other satisfaction related questions were similar between groups.
Complication rates The overall complication rate was not significantly different between the groups (p = 0.402).
At 1 year after surgery, limited fasciectomy seems to have a higher incidence of permanent complications. |
Authors’ conclusion: PALF demonstrates a significantly shorter convalescence, similar operative contracture correction, lower incidence of long-term complications, and no significant difference regarding 1-year postoperative results compared with limited fasciectomy. It is therefore a valuable, minimally invasive alternative to limited fasciectomy in the treatment of Dupuytren’s disease.
|
|||||||||||||||
|
Sambuy 2020 |
Type of study: single-blind, prospective, randomized clinical trial
Setting: Enrolment between February 2014 and November 2017; university hospital Sao Paulo
Country: Brazil
Source of funding: All authors declare no potential conflict of interest related to this article. |
Inclusion criteria: 45 Dupuytren’s disease (DD) patients over 40 years of age with Total Passive Extension Deficit (TPED) greater than 30 degrees in the metacarpophalangeal, proximal interphalangeal and distal interphalangeal joints were included.
Exclusion criteria: Patients with previous treatment or those with medical conditions that precluded general anesthesia.
N total at baseline: 50 Intervention: 26 Control: 24
Important prognostic factors2: Groups weren’t different with regard to gender, dominant side, presence of nodules and presence of cord. |
Limited fasciotomy + injection of adipose graft at the resected cord site (21 patients analysed)
Notes: the patients in both groups underwent exactly the same operative technique.
Surgery was followed by early mobilization and splinting in extension during the night for 6 weeks. |
Limited fasciotomy (24 patients analysed))
Notes: the patients in both groups underwent exactly the same operative technique.
Surgery was followed by early mobilization and splinting in extension during the night for 6 weeks. |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: 5 (21%) Two patients abandoned follow-up, and 3 did not undergo the minimum follow-up time of 1 year.
Control: 0
|
Total passive extension deficit (TPED) Measured with a goniometer in total passive extension at the 1-year follow-up consult. We assume as recurrence criterion a loss greater than or equal to 30 degrees when compared with postoperative measurements.
The total passive extension deficit results did not exhibit a significant difference.
Pain Measured by the visual analogue scale (VAS) values (from 0, no pain up to 10, worst pain)
Fat group exhibited more pain at 6 weeks follow-up
Hand function Measured by the Brief Michigan Hand Questionnaire (BMHQ) functional score
Fat group exhibited worse functional score at 6 months and 1 year postoperatively.
Complications Weekly or biweekly data were collected on infection, nerve damage, tendon injury, operative wound dehiscence, hematoma, and CRPS. This occurred until the skin healed.
Complex Regionaal Pijn Syndroom (CRPS)
Fat group showed higher complication rates: 9 cases (43%) in the fat group and 2 (8%) in the control group. |
Authors’ conclusion: Fat grafting associated with limited fasciotomy promotes worse functional results compared to conventional limited fasciotomy in the short term. However, long-term results and recurrence rates should be further assessed.
We believe that the decrease in the BMHQ functional score and the increase in pain at 6 weeks postoperatively in the fat group are due to the high complication rates in this group, in which some individuals shifted the median lower |
|||||||||||||||
|
Selles 2018 |
Type of study: Post-trial follow-up assessment (see Kan 2016)
Setting: see Kan 2016
Country: see Kan 2016
Source of funding: The authors have no financial interest to declare in relation to the content of this article. |
Inclusion criteria: All surviving patients originally assessed at baseline in the Dupuytren Rotterdam trial were considered Eligible (see Kan 2016).
Exclusion criteria: See Kan 2016
N total at baseline: 52 patients (56 hands) Intervention: 31 patients (34 hands) Control: 21 patients (22 hands)
Important prognostic factors2: Baseline characteristics were not significantly different between Groups
Mean age: 62 years Men: 82% The majority of the digits analyzed were Tubiana grade I (36 percent) or II (46 percent) before surgery. |
|
|
Length of follow-up: 5 years
|
Recurrence after 5 years a) Defined as either having undergone a secondary procedure for a new or worsening contracture, or as an increase in extension deficit of more than 20 degrees relative to week 3 after treatment. Results: I: 34/46 joints (74%) C: 12/31 joints (39%) P=0.002
b) Defined as an increase in total passive extension deficit of at least 30 degrees at the level of treated digits Results: I: 35/46 (77%) C: 10/31 (32%) P=0,001
Hand function in patients after 5 years who had not undergone a secondary procedure (PROM) I (18 patients): 10.5 points C (17 patients): 9.3 points Scores were not significantly different
Patient satisfaction after 5 years who had not undergone a secondary procedure (PROM) Scores were not significantly different |
|
|||||||||||||||
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Kan 2016 |
A computer random number generator selected random-permuted blocks of 10 patients. The patients received a trial number and the correspondingly numbered sealed envelope was given to them, with either a PALF or limited fasciectomy note inside.
Bilaterally affected patients who requested surgery for their contralateral hand served as their own control, with the contralateral hand given the opposite treatment. |
Unlikely |
Unclear
Patients were not blinded for group allocation. |
Unclear
Surgeons, hand therapists and the trial coordinator (H.J.K.) were not blinded for group allocation. |
Unlikely
To blind the examiners to the treatment allocation, patients wore blue nonlatex gloves during the measurements and were instructed not to discuss their treatment with the examiners.
|
Unlikely |
Unlikely |
Unlikely |
|
Sambuy 2020 |
The patients were stratified into four subgroups (I to IV) based on the severity of the disease according to the Tubiana Classification of 1986. Each of the four subgroups were randomized separately to obtain homogeneous groups according to the disease severity. The randomization into two groups was performed by electronic software. |
Unlikely |
Unclear |
Unclear |
Unlikely
We guaranteed the “blind” evaluation of the results performed by hand therapists in the rehabilitation Department of Hand Therapy, separate from the outpatient clinic. The evaluators assigned to the functional questionnaire and the goniometric measurement were not aware of the group to which the patient belonged. Only the surgeon was aware of this detail. |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Selles 2018 |
unlikely |
unlikely |
unlikely |
unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel exclusie na het lezen van het volledige artikel
|
Auteur |
Redenen van exclusie |
|
Hovius & Zhou (2018) |
Narratieve review |
|
Kan et al. (2017) |
Comment |
|
Konneker et al. (2017) |
Comment |
|
Hovius et al. (2011) |
Geen vergelijkend onderzoek |
|
Ntr (2009). http://www.who.int/trialsearch/Trial2.aspx?TrialID=NTR1692 |
Dit betreft een registratie van de trial in het Nederlandse trialregister. Gerapporteerd in Kan et al. 2016. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-04-2022
Beoordeeld op geldigheid : 15-02-2022
Uiterlijk in 2026 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Plastische Chirurgie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn ‘Ziekte van Dupuytren’ die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening is er onderzoek verricht waarin partiële fasciëctomie vergeleken is met naaldfasciotomie. Mogelijk kan er een antwoord worden gegeven in welke situatie de voorkeur moet worden gegeven aan een van de twee behandelingen.
Doelgroep
De richtlijn is met name bedoeld voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen en overige zorgverleners die de ziekte van Dupuytren behandelen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2020 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Dupuytren in alle stadia. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. M.A. Kemler (voorzitter), plastisch chirurg, Martini Ziekenhuis, Groningen
- Drs. R.S. de Wijn, plastisch chirurg, Rode Kruis Ziekenhuis, Beverwijk en het Spaarne Gasthuis, Haarlem/Hoofddorp
- Dr. A.L. Van Rijssen, plastisch chirurg, Isala, Zwolle
- Mevr. Y.E van Kooij, MSc, CHT-NL, handtherapeut / fysiotherapeut, Xpert Handtherapie, Zeist
- Mevr. M.P.M. Ottenhof, CHT-NL handtherapeut/fysiotherapeut, Hand & Pols Centrum Amsterdam
- dr. M. van Heijl, traumachirurg, Hand en Pols Centrum Diakonessenhuis, Utrecht/Zeist/Doorn en Traumazorgnetwerk Midden Nederland, Utrecht
- dr. R.J.H.M. Steenbakkers, radiotherapeut, Universitair Medisch Centrum, Groningen
- Drs. J.B.J. Geise, Stichting Dupuytren Nederland, Dronten
Meelezers
- de Werkgroep Hand- en Polsrevalidatie van de VRA
Met ondersteuning van
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Plastische Chirurgie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Intellectuele belangen en reputatie |
Extern gefinancierd onderzoek |
Overige belangen |
|
|
Kemler |
Plastisch chirurg in Martini Ziekenhuis Groningen en Wilhelmina Ziekenhuis Assen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
De Wijn |
Plastisch chirurg: Spaarne Gasthuis, Rode Kruis Ziekenhuis Beverwijk en Kliniek Blooming |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
Van Rijssen |
Plastisch Chirurg Isala & St Jansdal |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
|
van Kooij |
Fysiotherapeut/ Handtherapeut - Xpert Handtherapie |
Betaalde neven functies:
Onbetaalde nevenfuncties
|
Geen |
Geen |
Geen
|
Geen |
Geen |
|
|
Ottenhof |
Fysiotherapeut/handtherapeut Hand & Pols Centrum Amsterdam |
Docent handtherapiie opleiding NPI: onderwerp: klinimetrie |
geen |
geen |
geen |
geen |
geen |
|
|
van Heijl |
4 dagen per week: Traumachirurg, aandachtsgebied hand/pols letsel Hand-pols centrum Diakonessenhuis Utrecht/Zeist/Doorn
1 dag per week: traumanetwerk midden Nederland t.b.v. begeleiding wetenschappelijk onderzoek |
|
geen |
geen |
geen |
geen |
geen |
|
|
Steenbakkers |
Radiotherapeut-oncoloog, Universitair Medisch Centrum Groningen |
geen |
geen |
geen |
geen |
ZonMW: onderzoek naar effectiviteit radiotherapie bij ziekte van Lederhose |
geen |
|
|
Geise |
Als gepensioneerd chemicus heb ik geen werkgever. Mijn participatie aan deze NVPC commissie geschiedt vanuit mijn bestuurslidmaatschap van de Stichting Dupuytren Nederland. |
Mijn bestuursfunctie bij de Stichting Dupuytren Nederland betreft de behartiging van de belangen van patiënten met de ziekte van Dupuytren. Deze functie is onbetaald. |
geen |
geen |
Mogelijk (en hopelijk) zullen patiënten met de ziekte van Dupuytren baat hebben bij het opstellen van de nieuwe richtlijn. Voor zover dat door hen beschouwd zou kunnen worden als mede tot stand gebracht door mijn participatie in deze commissie dan slaat dat terug op het gehele stichtingsbestuur, waarvan ik zelf de afgevaardigde ben. |
geen |
geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Stichting Dupuytren Nederland en de Patiëntenfederatie te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door één afgevaardigde van de Stichting Dupuytren Nederland. Ook werd er gebruik gemaakt van de resultaten van een enquête die de Stichting Dupuytren Nederland in 2020 onder Dupuytren patiënten heeft uitgezet.
Tijdens de commentaarfase werd de Stichting Dupuytren Nederland en de Patiëntenfederatie gevraagd om input.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie de bijlage Implementatieplan).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (https://www.zorginstituutnederland.nl/).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Zorgverzekeraars Nederland, Patiëntenfederatie Nederland, Stichting Dupuytren Nederland, Nederlands Huisartsen Genootschap, Nederlandse Vereniging voor Plastische Chirurgie, Nederlandse Vereniging van Revalidatieartsen, Nederlandse Vereniging voor Heelkunde, Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging voor Radiotherapie en Oncologie, en de Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde.
Bijna tegelijkertijd werd ook de NHG-Standaard Hand- en polsklachten (beperkt) herzien. Met betrekking tot het onderwerp ‘Dupuytren in de eerste lijn’ hebben de verschillende werkgroepen onderling afgestemd, zodat de richtlijnen op elkaar aansluiten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
In de databases Ovid Medline en Embase werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
In de richtlijn 2012 werd de EBRO classificatie gebruikt voor het bepalen van de bewijskracht (“opzet en uitvoering”) van individuele studies en voor het bewijsniveau van de conclusies. Bij de revisie werd de EBRO-gradatie van de conclusies (“kwaliteit van bewijs”) vervangen door de GRADE-gradatie. Hiertoe zijn, waar nodig, de opzet en uitvoering van de individuele studies opnieuw beoordeeld.
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Redelijk |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De wenselijke en onwenselijke uitkomsten van de onderzochte interventies, de mate van zekerheid (‘bewijskracht’) hiervan (zie onder Beoordelen van de kracht van het wetenschappelijke bewijs) en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen (zie onder Overwegingen) bepalen samen de sterkte en richting van de aanbeveling. GRADE onderscheidt op basis hiervan vier categorieën van aanbevelingen: sterk (1A) en zwak (1B) voor een bepaalde interventie en sterk (2A) en zwak (2B) tegen een bepaalde interventie. Conform de GRADE-methodiek sluit een (zeer) geringe bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, de aard van de gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Ter informatie: de hiervoor genoemde aanduidingen voor de sterkte van een aanbeveling (1A, 1B etc.) wordt in Nederlandse richtlijnen, zo ook hier, niet gebruikt. In Nederland komt de sterkte van een aanbeveling terug in de bewoording. Zo worden bijvoorbeeld de termen ‘dienen’en ‘moeten’ gebruikt bij een sterke aanbeveling, ‘overwegen’ en ‘bij voorkeur’ bij een zwakke aanbeveling.
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Referenties
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Database: Ovid MEDLINE(R) ALL <1946 to August 27, 2020>
Search Strategy:
--------------------------------------------------------------------------------
1 "ziekte van Dupuytren".ti. (0)
2 Dupuytren Contracture/ (2700)
3 dupuytren*.tw. (2852)
4 dupuytren*.kf. (741)
5 (fibromatosis adj3 palmar*).tw. (96)
6 (fibromatosis adj3 palmar*).kf. (10)
7 or/2-6 (3351)
8 7 (3351)
9 limit 8 to yr="2012 -Current" (898)
10 (dutch or english or german or french).la. (28393874)
11 guideline/ or practice guideline/ (34473)
12 guideline?.ti,kf. (86252)
13 11 or 12 (106133)
14 9 and 10 and 13 (3)
15 "filter systematic reviews".ti. (0)
16 meta analysis.pt. (118853)
17 (meta-anal$ or metaanal$).tw,kf. (181299)
18 (quantitativ$ adj10 (review$ or overview$)).tw. (9604)
19 (systematic$ adj10 (review$ or overview$)).tw. (198553)
20 (methodologic$ adj10 (review$ or overview$)).tw. (12146)
21 (quantitativ$ adj10 (review$ or overview$)).kf. (76)
22 (systematic$ adj10 (review$ or overview$)).kf. (20647)
23 (methodologic$ adj10 (review$ or overview$)).kf. (78)
24 medline.tw. and review.pt. (79670)
25 (pooled adj3 analy*).tw. (20327)
26 (pooled adj3 analy*).kf. (274)
27 "cochrane$".fc_jour. (15005)
28 or/16-27 (366040)
29 9 and 10 and 28 (42)
30 "Radiotherapy of benign dermatoses: indications, practice, and results".fc_titl. (1)
31 "Radiotherapy of Dupuytren’s contracture in stage I.".fc_titl. (0)
32 "31".fc_vol. and "1981".fc_pubyr. and "6337".fc_pg. (0)
33 "hesselkamp$".fc_auts. and "1981".fc_pubyr. (0)
34 "Radiotherapy of early stage Dupuytren disease. Long-term results after a median follow-up period of".fc_titl. and "2001".fc_pubyr. (1)
35 "Radiotherapy in Dupuytren’s contracture".fc_titl. (0)
36 "Lack of effectiveness of alternative non-surgical treatment procedures of Dupuytren contracture".fc_titl. (1)
37 "Radiotherapy of Dupuytren’s disease".fc_titl. (3)
38 "Radiotherapy in fascial fibromatosis".fc_titl. (1)
39 "Dupuytren’s contracture a radiotherapeutic approach".fc_titl. (1)
40 "Dupuytren’s contracture".fc_titl. and "1955".fc_pubyr. (15)
41 from 40 keep 10 (1)
42 "T-cell-mediated response in Dupuytren’s disease".fc_titl. (1)
43 "Treatment of Dupuytren’s contracture with vitamin E".fc_titl. (2)
44 from 43 keep 2 (1)
45 30 or 34 or 36 or 37 or 38 or 39 or 41 or 42 or 44 (11)
46 "controle artikelen conform artikel Ball".ti. (0)
47 "Systematic review of non-surgical treatments for early dupuytren’s".fc_titl. (1)
48 45 or 47 (12)
49 exp Radiotherapy/ (185839)
50 exp Radiation/ (477034)
51 (radiother* or radiation).tw,kf. (499061)
52 or/49-51 (897066)
53 48 and 52 (10)
54 48 not 53 (2)
55 9 and 10 and 52 (26)
56 "rodrigues$".fc_auts. and "Surgery for Dupuytren's contracture of the fingers.".fc_titl. (1)
57 "soreide$".fc_auts. and "Treatment of Dupuytren's Contracture".fc_titl. (1)
58 "selles$".fc_auts. and "Percutaneous Aponeurotomy and Lipofilling versus Limited Fasciectomy for Dupuytren's Contracture: 5-Year Results from a Randomized Clinical Trial".fc_titl. (1)
59 "hester$".fc_auts. and "Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients with Primary Dupuytren's Contracture".fc_titl. (0)
60 "hester$".fc_auts. and "2016".fc_pubyr. and "1800".fc_pg. (0)
61 "Percutaneous Aponeurotomy and Lipofilling ".fc_titl. (9)
62 from 61 keep 2,5 (2)
63 56 or 57 or 58 (3)
64 "Orthopedic Procedures"/ (25794)
65 56 or 57 or 62 (4)
66 ((percutaneous adj2 aponeurotomy adj3 lipofilling) or PALF).tw,kf. (98)
67 Fasciotomy/ (3725)
68 (fasciectomy or fasciotomy).tw,kf. (2981)
69 67 or 68 (5579)
70 (dermatofasc* or dermofasci* or (skin adj2 graft*) or aponeurot*).tw,kf. (20413)
71 lipofillin*.tw,kf. (501)
72 *"Dermal Fillers"/ (663)
73 (fat adj2 transplant*).tw,kf. (695)
74 or/66-73 (27448)
75 8 and 10 and 74 (605)
76 66 or 71 or 72 or 73 (1896)
77 75 and 76 (8)
78 "medline rct filter".ti. (0)
79 controlled-clinical-trial.pt. (93820)
80 randomized-controlled-trial.pt. (511945)
81 randomized controlled trial/ (511945)
82 randomi?ed controlled trial?.tw. (180763)
83 randomi?ed controlled trial?.kf. (11481)
84 random-allocation.tw,kf. (1718)
85 double-blind-method.tw,kf. (495)
86 single-blind-method.tw,kf. (90)
87 (random adj8 (selection? or sample?)).kf,tw. (45948)
88 random*.tw,kf. (1157195)
89 or/79-88 (1366691)
90 75 and 89 (65)
91 7 and 76 and 89 (5)= med rct lipofilling
92 90 not 91 (60)= med rct rest
Database: Embase <1974 to 2020 August 27>
Search Strategy:
--------------------------------------------------------------------------------
1 "rodrigues$".fc_auts. and "Surgery for Dupuytren's contracture of the fingers.".fc_titl. (1)
2 "soreide$".fc_auts. and "Treatment of Dupuytren's Contracture".fc_titl. (1)
3 "selles$".fc_auts. and "Percutaneous Aponeurotomy and Lipofilling versus Limited Fasciectomy for Dupuytren's Contracture: 5-Year Results from a Randomized Clinical Trial".fc_titl. (1)
4 "hester$".fc_auts. and "Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients with Primary Dupuytren's Contracture".fc_titl. (0)
5 "hester$".fc_auts. and "2016".fc_pubyr. and "1800".fc_pg. (0)
6 [((percutaneous adj2 aponeurotomy adj3 lipofilling) or PALF).tw,kw.] (0)
7 Fasciotomy/ (4923)
8 [(fasciectomy or fasciotomy).tw,kw.] (0)
9 [(dermatofasc* or dermofasci* or (skin adj2 graft*) or aponeurot*).tw,kw.] (0)
10 *"Dermal Fillers"/ (91)
11 [(fat adj2 transplant*).tw,kw.] (0)
12 1 or 2 or 3 or 4 or 5 (3)
13 "Percutaneous Aponeurotomy and Lipofilling (PALF) versus Limited Fasciectomy in Patients".fc_titl. (3)
14 from 13 keep 3 (1)
15 12 or 14 (4)
16 Dupuytren contracture/ (3044)
17 dupuytren*.tw. (2791)
18 dupuytren*.kw. (702)
19 (contracture adj2 palmar).tw. (39)
20 (fibromatosis adj3 palmar*).tw. (113)
21 (contracture adj2 palmar).kw. (7)
22 (fibromatosis adj3 palmar*).kw. (26)
23 or/16-22 (3519)
24 23 (3519)
25 limit 24 to yr="2012 -Current" (1290)
26 (dutch or english or german or french).la. (31460929)
27 practice guideline/ (426915)
28 25 and 26 and 27 (20)
29 "filter systematic reviews & meta-analyses Embase ".ti. (0)
30 meta analysis/ (194282)
31 "systematic review"/ (258896)
32 (meta-analy$ or metaanaly$).tw. (234973)
33 (meta-analy$ or metaanaly$).kw. (56909)
34 (systematic$ adj4 (review$ or overview$)).tw. (243668)
35 (systematic$ adj4 (review$ or overview$)).kw. (30694)
36 (quantitativ$ adj5 (review? or overview?)).tw,kw. (5556)
37 (methodologic adj5 (overview? or review?)).tw,kw. (389)
38 (review$ adj3 (database? or medline or embase or cinahl)).tw,kw. (28776)
39 (pooled adj3 analy$).tw,kw. (31253)
40 (extensive adj3 review$ adj3 literature).tw,kw. (3824)
41 (meta or synthesis or (literature adj8 database?) or extraction).tw,kw. (1485227)
42 review.pt. (2613245)
43 41 and 42 (164651)
44 or/30-40,43 (583038)
45 25 and 26 and 44 (71)
46 exp radiotherapy/ (528055)
47 exp radiation dose/ (138555)
48 exp radiological parameters/ (226127)
49 (radiother* or radiation).tw,kw. (659066)
50 or/46-49 (932138)
51 25 and 26 and 50 (57)
52 "Systematic review of non-surgical treatments for early dupuytren’s".fc_titl. (2)
53 from 52 keep 1 (1)
54 51 and 53 (1)
55 "Embase rct filter".ti. (0)
56 Randomized Controlled Trial/ (617608)
57 randomization/ (87746)
58 controlled clinical trial/ (464762)
59 Double Blind Procedure/ (175457)
60 Single Blind Procedure/ (39985)
61 Crossover Procedure/ (64205)
62 (clinica$ adj3 trial$).tw. (558162)
63 ((singl$ or doubl$ or trebl$ or tripl$) adj3 (mask$ or blind$ or method$)).tw. (310709)
64 exp Placebo/ (354264)
65 placebo$.ti,ab. (312182)
66 random$.ti,ab. (1566882)
67 ((control$ or prospectiv$) adj3 (trial$ or method$ or stud$)).tw. (1436102)
68 (crossover$ or cross?over$).ti,ab. (76862)
69 or/56-68 (3293562)
70 exp animals/ or exp invertebrate/ or animal experiment/ or animal model/ or animal tissue/ or animal cell/ or nonhuman/ (27809476)
71 human/ or normal human/ or human cell/ (21354501)
72 70 and 71 (21289826)
73 70 not 72 (6519650)
74 69 not 72 (552692)
75 ((percutaneous adj2 aponeurotomy adj3 lipofilling) or PALF).tw,kw. (168)
76 fasciotomy.tw,kw. (3273)
77 fasciectomy.tw,kw. (491)
78 (dermatofasc* or dermofasci* or (skin adj2 graft*) or aponeurot*).tw. (23438)
79 (dermatofasc* or dermofasci* or (skin adj2 graft*) or aponeurot*).kw. (1707)
80 lipofillin*.tw,kw. (616)
81 exp adipose tissue/su [Surgery] (433)
82 (fat adj2 transplant*).tw,kw. (838)
83 75 or 80 or 81 or 82 (1995)
84 7 or 76 or 77 or 78 or 79 (29505)
85 10 or 83 (2085)
86 23 and 26 and 85 (11)
87 69 and 86 (5)
88 letter.pt. (1134504)
89 83 or 84 (31459)
90 23 and 26 and 69 and 89 (126)= P + talen + rct or sr
91 90 not 88 (122)
92 10 or 75 or 80 or 81 or 82 (2085)= lipofilling
93 91 and 92 (3)= P + talen + sr or rct + lipofilling
Cochrane search
Search Name: BN 20200825 dupuytren behandeling lipofilling
Last Saved: 28/08/2020 12:12:47
Comment: search
ID Search
#1 Dupuytren*:ti,ab,kw
#2 MeSH descriptor: [Dupuytren Contracture] this term only
#3 MeSH descriptor: [Fibroma] this term only
#4 Fibromatosis:ti,ab,kw
#5 MeSH descriptor: [Fascia] explode all trees
#6 palmar NEAR/3 (fibromatosis or fascia):ti,ab,kw
#7 #1 or #2 or #3 or #4 or #5 or #6=P
#8 (Fasciotom* OR surgery or fasciect* or collagenas*):ti,ab,kw
#9 MeSH descriptor: [Fasciotomy] this term only
#10 MeSH descriptor: [Microbial Collagenase] this term only
#11 collagenas*:ti,ab,kw
#12 #8 OR #9 OR #10 OR #11
#13 #7 AND #12
#14 #10 or #11
#15 #8 OR #9
#16 #7 AND #14 AND #15
#17 MeSH descriptor: [Radiotherapy] explode all trees
#18 MeSH descriptor: [Radiofrequency Therapy] explode all trees
#19 MeSH descriptor: [Radiation] explode all trees
#20 (radiation or radiother*):ti,ab,kw
#21 #17 or #18 or #19 or #20
#22 #7 and #21
#23 lipofilling:ti,ab,kw
#24 (fat near/2 transplant*):ti,ab,kw
#25 #23 or #24= lipofilling
#26 #7 and #25= P + lipofilling




