Samenwerking en afstemming vroeggeboorte / SGA
Uitgangsvraag
Wie heeft de zorgcoördinatie (c.q. is de casemanager) in welke fase van het nazorg- proces voor een te vroeg en/of SGA geboren kind?
Wat zijn de belangrijkste overdrachtsmomenten en welke gegevens dienen hierbij te worden overgedragen?
Op welke wijze kunnen overdracht, samenwerking en afstemming tussen kinderartsen, JGZ en huisartsen en andere disciplines het best worden vormgegeven, teneinde continuïteit in zorg voor ouders en kind te waarborgen?
Aanbeveling
Op het moment dat het kind naar huis gaat vanuit het ziekenhuis wordt voor elk kind een casemanager aangewezen die verantwoordelijk is voor de bewaking en coördinatie van het (na)zorgproces.
In de klinische fase is de kinderarts de casemanager. Als er geen klinische fase is, dan is een van de in de thuissituatie betrokken zorgverleners (bijvoorbeeld de JGZ of de huisarts) de casemanager.
In de nazorgfase is de kinderarts de casemanager totdat deze het casemanagement overdraagt aan een van de andere betrokken zorgverleners. Dit moment is afhankelijk van de ernst van de prematuriteit en van de problematiek (medisch en qua ontwikkeling) van het kind en wordt bepaald door de kinderarts. Het verdient aanbeveling om hier lokaal afspraken over te maken. Bij afwijken van deze afspraak wordt dit expliciet besproken en vastgelegd.
Gedurende de nazorgfase kan afhankelijk van de omstandigheden het casemanagement (al dan niet tijdelijk) wisselen.
Voor ouders en alle andere betrokkenen dient altijd duidelijk te zijn wie op welk moment de casemanager is van het zorgproces, wat de rol is van de casemanager en hoe zij de casemanager kunnen bereiken. Ook moet voor ouders altijd duidelijk zijn bij wie zij terechtkunnen met specifieke vragen.
De casemanager is verantwoordelijk voor een zorgvuldige en tijdige planning van het tijdstip van ontslag en voor de coördinatie van het nazorgtraject.
Vóór het moment dat het kind naar huis gaat vanuit het ziekenhuis is in het ziekenhuis bekend naar welke JGZ-locatie (consultatiebureau, CJG-locatie) het kind gaat.
Communicatie met de JGZ in de dagen rondom thuiskomst is nodig.
De aanwezigheid van eventuele risicofactoren bij kind en omgeving, met name de draagkracht van de ouders, moet meegewogen worden bij het bepalen van het moment van ontslag.
Benodigde professionele ondersteuning is bij ontslag geregeld.
Een sociale kaart van deskundigen die goed onderbouwde en onderzochte interventies kunnen doen ondersteunt een goede organisatie van de nazorg.
Vóór of direct bij het moment dat het kind naar huis gaat vanuit het ziekenhuis vindt een schriftelijke overdracht plaats van de meest relevante medische en verpleegkundige gegevens van de kinderarts aan de huisarts en de JGZ.
De definitieve overdracht volgt binnen twee weken na ontslag en wordt schriftelijk vastgelegd. De casemanager coördineert deze overdracht.
Ouders worden geïnformeerd over de overdracht aan de JGZ volgens de leidraad Schriftelijke communicatie tussen kinderartsen en artsen werkzaam in de jeugdgezondheidszorg (NVK, 2007).
Met name in situaties met een speciale zorgbehoefte (te bepalen door de casemanager) heeft het de voorkeur dat rond het ontslag een 'warme' verpleegkundige overdracht plaatsvindt tussen ziekenhuis en jeugdgezondheidszorg. Hierbij zijn ten minste de verpleegkundige uit het ziekenhuis, de jeugdverpleegkundige en de ouders aanwezig.
Deze warme overdracht kan zowel in het ziekenhuis als thuis plaatsvinden.
Vóór ontslag naar huis worden onder verantwoordelijkheid van de casemanager heldere afspraken over het nazorgtraject gemaakt tussen de betrokken zorgverleners, in overleg met de ouders. Controles worden zodanig op elkaar afgestemd dat de belasting voor ouders en kind minimaal is.
De werkgroep beveelt aan dat de relevante gegevens bij overdrachten ten minste schriftelijk en gestructureerd worden vastgelegd, bij voorkeur met behulp van een checklist.
De werkgroep adviseert betrokken hulpverleners gebruik te maken van uitwisselbare gegevens/onderzoeksmethoden. Een voor alle zorgverleners toegankelijk elektronisch dossier is hiervoor de beste oplossing. Een alternatieve mogelijkheid is een pendeldossier dat of een checklist die wordt ingevuld na bezoek aan consultatiebureau of kinderarts.
Casemanager, ouders, huisarts, neonatoloog (NICU), kinderarts en jeugdgezondheidszorg dienen te beschikken over de contactgegevens van de betrokken contactpersonen uit de eerste (huisarts, jeugdarts, jeugdverpleegkundige, JGZ-organisatie), tweede (kinderarts) en derde lijn (neonatoloog) en van andere betrokken zorgverleners.
Bij elk contactmoment in de JGZ wordt bepaald of een extra contactmoment nodig is en met welke discipline.
De werkgroep beveelt aan om per JGZ-organisatie een aandachtsfunctionaris aan te wijzen die de nazorg aan pasgeborenen met een gezondheidsrisico als aandachtsgebied heeft. Deze persoon kan zich inzetten om overdracht, scholing en regionale afspraken te ontwikkelen en te bewaken.
In geval de JGZ-organisaties 0-4 jaar en 4-19 jaar gescheiden zijn, is de JGZ 0-4 jaar ervoor verantwoordelijk dat op het moment dat de zorg overgaat naar de JGZ 4-19 jaar het complete dossier wordt overgedragen. Indien het kind nog onder controle of behandeling is van andere zorgverleners, zoals de kinderarts, worden deze van de overdracht op de hoogte gesteld.
Overwegingen
Nazorgmodellen
In diverse regio's zijn nazorgprotocollen ontwikkeld waarin duidelijke afspraken zijn gemaakt over de taakverdeling tussen JGZ en kinderarts. Belangrijk is dat eventuele problemen tijdig worden gesignaleerd en de juiste behandeling of begeleiding kan worden geboden. De (kosten)- effectiviteit van deze modellen is niet wetenschappelijk geëvalueerd. Uit het onderzoek van Van der Pal en Buitendijk (2009) blijkt dat ouders zeer tevreden zijn over dit soort nazorgmodellen. Hieronder worden enkele voorbeelden besproken.
Het Dordtse model (Regio Zuid-Holland Zuid) omvat een geprotocolleerde verdeling in multidisciplinair nazorgbureau, extra-aandachtbureaus bij thuiszorg en extra zorg op reguliere contactmomenten bij de JGZ. Cliënten- en medewerkertevredenheid zijn geëvalueerd en positief bevonden.
In de provincie Friesland werkt de JGZ nauw samen met het Medisch Centrum Leeuwarden (MCL), waar het ToP-programma (ToP = Transmurale Ontwikkelingsondersteuning voor Prematuur geboren kinderen en hun ouders) uitgevoerd wordt. ToP is een preventief interventieprogramma dat speciaal ontwikkeld is om ouders van vroeg geboren kinderen na ontslag uit het ziekenhuis te ondersteunen (https://www.amc.nl/web/specialismen/verloskunde/verloskunde/vroeggeboorte-in-voorgeschiedenis.htm). Het ToP-programma is evidence-based. Het wordt sinds 2010 in de regio Amsterdam geïmplementeerd en in een toenemend aantal andere regio s in Nederland toegepast, wat navolging van dit Friese model mogelijk maakt.
Het Groene Hart Ziekenhuis in Gouda werkt samen met de JGZ in de GO-poli (Groei en Ontwikkelingspoli). Op deze poli werken de afdeling kindergeneeskunde van het GHZ en de JGZ samen. Ouders hoeven daardoor niet naar een kinderarts én naar de JGZ, maar alleen naar de GO-poli. In de eerste week na thuiskomst vindt een huisbezoek plaats door de jeugdverpleegkundige van de JGZ. Daarna vinden controles plaats op de GO- poli in het ziekenhuis. Kinderen worden gezien door de kinderverpleegkundige en afwisselend een kinderarts en een jeugdarts, en volgens schema door een logopedist en een kinderfysiotherapeut. Indien nodig kan er een afspraak gemaakt worden bij maatschappelijk werk, een psycholoog of een revalidatiearts. De kinderen blijven in principe onder controle totdat ze 4,5 jaar zijn.
Ziekenhuis Gelderse Vallei heeft een couveusenazorgbureau, waarin de volgende disciplines samenwerken: kinderarts, jeugdarts, jeugdverpleegkundige (neonatologie), kinderfysiotherapeut, logopediste, lactatiekundige. Een kind komt in aanmerking voor het couveusenazorgbureau als het onder behandeling is van een kinderarts in het ziekenhuis (voorafgaand kan het kind in behandeling zijn geweest in een universitair medisch centrum), als het kind geboren is bij een zwangerschapsduur van minder dan 33 weken, het kind een geboortegewicht heeft lager dan 1500 gram of als het kind een bijzondere problematiek heeft.
In het nazorgprotocol van het St. Antonius Ziekenhuis Nieuwegein wordt onderscheid gemaakt tussen prematuren < 32+0 weken en/of een geboortegewicht < 1500 gram en prematuren 32+0 tot 37+0 weken en/of een geboortegewicht > 1500 gram. De eerste groep wordt tot 24 maanden begeleid door de kinderarts en niet door de JGZ. De tweede groep wordt na thuiskomst in principe begeleid door de JGZ. In het protocol is beschreven welke aspecten extra aandacht krijgen (naast de basiszorg) en welke extra zorg ingezet kan worden.
Onderbouwing
Achtergrond
Goede samenwerking en afstemming tussen de verschillende disciplines die betrokken zijn bij de nazorg voor te vroeg of SGA geboren kinderen zijn essentieel om de continuïteit in de zorg voor kind en ouders te waarborgen. Nazorg is de zorg voor kind en ouders die volgt op ziekenhuisopname en die door diverse instanties verleend kan worden.
Bij goede samenwerking en afstemming wordt optimaal gebruikgemaakt van ieders professie, professionaliteit en mogelijkheden. Zowel in de klinische fase (ziekenhuis) als na ontslag is het belangrijk dat de zorg voor te vroeg of SGA geboren kinderen verleend wordt door een team van deskundigen, waarbinnen duidelijke afspraken worden gemaakt over de onderlinge taakverdeling. Het doel van de multidisciplinaire aanpak is tijdige signalering van mogelijke gezondheids- en/of ontwikkelingsproblematiek, waarbij vanuit ieders eigen deskundigheid één gezamenlijk plan gemaakt wordt. Hiermee wordt gestreefd naar efficiëntere en kwalitatief betere zorg voor kind en ouders. Goede samenwerking vereist een continue uitwisseling van gegevens. Om dat in de praktijk te faciliteren is een veilig en gebruiksvriendelijk systeem van informatieoverdracht noodzakelijk.
In 2009 is het protocol 'Nazorg pre- en/of dysmature zuigelingen en andere pasgeborenen met een potentieel gezondheidsrisico' (NVK, NVJG, 1997) door een werkgroep van de Nederlandse Vereniging voor Kindergeneeskunde (NVK) en de Artsen Jeugdgezondheidszorg Nederland (AJN) herzien. Dit herziene document (Samenwerken en afstemmen. Samenwerking van kinderafdelingen van ziekenhuizen en jeugdgezondheidszorg van thuiszorginstellingen (NVK, AJN, 2009)) bevat aanbevelingen en aandachtspunten bij het opstellen van een protocol over de overdracht van gegevens van kinderen met een gezondheidsrisico en is een belangrijke leidraad voor deze richtlijn.
Er is systematisch naar onderbouwende literatuur gezocht (zie bijlage voor zoekstrategie), maar dit leverde weinig tot geen bruikbare onderzoeken op. Dit hoofdstuk is dan ook voornamelijk gebaseerd op het document Samenwerken en afstemmen (NVK, AJN, 2009), gecombineerd met het (concept)standpunt 'Gegevensoverdracht tussen het ziekenhuis en de jeugdgezondheidszorg, beschrijving randvoorwaarden' (NCJ, in ontwikkeling), goede praktijkvoorbeelden ('best practices') en de expertise van de individuele kern- en werkgroepleden. Waar mogelijk wordt verwezen naar relevante literatuur.
Ouders moeten altijd geïnformeerd worden over de toestand van hun kind, het zorgproces en de afspraken die hierin gemaakt worden. Dit moet op een zodanige manier gebeuren dat rekening gehouden wordt met hun begripsniveau, taal en cultuur. Indien nodig moet gebruikgemaakt worden van een tolk. Bespreek met ouders uit andere culturen of er een taboe is, of ze een sociaal netwerk hebben, of ze ondersteuning krijgen na eventuele stoornissen bij het kind geconstateerd zijn. Ook bij het geven van adviezen (bijvoorbeeld op het gebied van voeding) is het belangrijk om rekening te houden met eventuele cultuurverschillen.
Samenvatting literatuur
Zorgcoördinatie
Casemanagement
De werkgroep is van mening dat de nazorg gecoördineerd dient te worden door een casemanager. De casemanager is degene die verantwoordelijk is voor de bewaking en coördinatie van het zorgproces. Deze persoon is volledig op de hoogte van welke zorgverleners betrokken zijn bij een patiënt en in welk stadium het behandel/begeleidings- traject zich bevindt. De casemanager is eerste aanspreekpunt voor ouders en zorgverleners, tenzij voor specifieke vragen anders is afgesproken. Hij/zij zorgt ervoor dat de behandeling/begeleiding door verschillende zorgverleners gecoördineerd verloopt en dat afspraken waar mogelijk op elkaar afgestemd worden. In verschillende fases van het zorgtraject kan deze functie door verschillende personen ingevuld worden. Lokaal dient echter goed afgesproken te worden wie in welke fase van het proces de casemanager is. Ouders en andere zorgverleners dienen altijd op de hoogte te zijn wie op welk moment de casemanager is, wat er van de casemanager verwacht kan worden en hoe deze persoon te bereiken is. Ook moet voor ouders altijd duidelijk zijn bij wie zij terechtkunnen met specifieke vragen.
De Handreiking verantwoordelijkheidsverdeling bij' samenwerking in de zorg (2010) van de KNMG geeft aandachtspunten bij afspraken over verantwoordelijkheden bij samenwerking van diverse zorgverleners.
Klinische fase
In de klinische fase zijn de belangrijkste betrokken disciplines/beroepsgroepen: neonatoloog, kinderarts, kinderverpleegkundige, consulent medisch specialisten zoals kinderneuroloog, kinderfysiotherapeut en (kinder)revalidatiearts en andere disciplines/ beroepsgroepen zoals (pre)logopedist, (kinder)psycholoog, medisch maatschappelijk werker en zo nodig een (kinder)diëtist. De medische behandeling van de kinderen valt buiten het bestek van deze richtlijn.
De kinderarts is in deze fase de casemanager die alle betrokken disciplines coördineert en verantwoordelijk is voor de directe zorg voor het kind.
Als het kind niet in het ziekenhuis opgenomen is geweest, dan is een van de in de thuissituatie betrokken zorgverleners (bijvoorbeeld de JGZ of de huisarts) de casemanager.
Nazorgfase
Na thuiskomst uit het ziekenhuis volgt een nazorg- en follow-uptraject voor kind en ouders. Tijdens deze fase draagt de kinderarts in het ziekenhuis waaruit het kind ontslagen werd het casemanagement meestal over aan de JGZ. In sommige gevallen kan de huisarts de meest aangewezen persoon zijn voor de rol van casemanager. Gedurende de nazorgfase kan, afhankelijk van de omstandigheden, het casemanagement (al dan niet tijdelijk) wisselen.
De casemanager verzorgt de coördinatie tussen het NICU-centrum (de neonatoloog, indien van toepassing), de kinderarts, de JGZ en de huisarts. De kinderarts schat voorafgaand aan het ontslag in of er een gezondheidsrisico aanwezig is en welk controle- en/ of begeleidingstraject daarbij past.
De kinderarts bepaalt wanneer overdracht van het casemanagement plaatsvindt van de kinderarts naar een van de andere betrokken zorgverleners. Dit kan meteen na ontslag zijn of later in het traject, afhankelijk van de ernst van de prematuriteit en van de problematiek (medisch en met betrekking tot de ontwikkeling) van het kind. De overdracht van het casemanagement wordt door de kinderarts meegedeeld aan de ouders en de andere betrokken partijen. In uitzonderlijke situaties is de neonatoloog van de NICU casemanager. In dat geval is het aan de neonatoloog om dit mede te delen aan ouders, kinderarts en het JGZ-team.
Het verdient aanbeveling om lokaal af te spreken wie normaal gesproken na ontslag casemanager is. Wanneer afgeweken wordt van deze afspraak, wordt dit expliciet besproken en vastgelegd.
Tabel 1.
|
Fase |
casemanager |
|
Klinische fase |
Kinderarts (evt. neonatoloog). |
|
Na ontslag ziekenhuis/ thuiskomst (nazorgfase) |
Volgens afspraak: te bepalen door kinderarts bij ontslag (kinderarts/JGZ/huisarts). |
|
Niet in het ziekenhuis opgenomen Reguliere zorgverlener (zoals JGZ/huisarts). geweest |
|
Overdrachtsmomenten
Voor deze richtlijn ligt de nadruk op de overdrachtsmomenten bij thuiskomst na ziekenhuisopname en de overdracht tussen kinderarts en JGZ in de nazorgfase. Bij overdrachten binnen de klinische fase, bijvoorbeeld van NICU naar perifeer ziekenhuis, moet relevante medische informatie betreffende de zwangerschap, bevalling en neonatale periode, psychosociale en sociodemografische risicofactoren, het eventueel participeren in onderzoek alsmede een beschrijving van het follow-uptraject door het NICU-centrum worden overgedragen.
Afsluiten periode ziekenhuis en voorbereiden thuiskomst
Algemeen
Een goede en tijdige overdracht van gegevens is noodzakelijk voor alle pasgeboren kinderen die uit het ziekenhuis worden ontslagen. Dit geldt in het bijzonder voor pasgeborenen met een gezondheidsrisico die na thuiskomst uit het ziekenhuis extra zorg nodig hebben van de JGZ.
Om ervoor te zorgen dat de overgang en overdracht van ziekenhuiszorg naar thuiszorg en/of JGZ succesvol zullen verlopen, dient de planning van het ontslag en de nazorg zorgvuldig en tijdig gecoördineerd te worden. De periode van ontslag uit het ziekenhuis en de thuiskomst van een te vroeg of SGA geboren kind is een multidisciplinair proces waarbij het ziekenhuis en de JGZ een gezamenlijke verantwoordelijkheid hebben voor continuïteit van zorg en overdracht.
Landelijke afspraken voor criteria rondom dit moment ontbreken. Volgens de richtlijnen van de American Academy of Pediatrics (AAP) kan een kind pas naar huis als voldaan is aan de volgende criteria: het kind is fysiologisch stabiel (kan oraal gevoed worden, kan de lichaamstemperatuur op peil houden en is respiratoir stabiel), ouders/verzorgers kunnen de noodzakelijke zorg bieden, eventueel met behulp van ondersteuning, en er is een casemanager aangewezen die de verantwoordelijkheid en coördinatie van alle betrokken disciplines op zich neemt voor het nazorgtraject (AAP, 2008).
Naar de mening van de werkgroep dient bij deze beslissing altijd rekening gehouden te worden met eventuele risicofactoren (bijvoorbeeld de draagkracht van de ouders) en de mogelijkheden voor professionele ondersteuning en mantelzorg in de thuissituatie. De kinderarts bepaalt het moment dat het kind naar huis kan.
Met betrekking tot de overdracht van gegevens van kinderarts aan JGZ wordt de leidraad Schriftelijke communicatie tussen kinderartsen en artsen werkzaam in de jeugdgezondheidszorg (NVK, 2007) gevolgd. De kern daarvan is dat de kinderarts alle relevante medische correspondentie over een kind in kopie stuurt naar de arts werkzaam in de jeugdgezondheidszorg. Ouders moeten hierover worden geïnformeerd. Het standpunt Gegevensoverdracht tussen het ziekenhuis en de jeugdgezondheidszorg, beschrijving randvoorwaarden (NCJ, 2012) geeft aanbevelingen voor zorgverleners en ouders. In dit standpunt staat ook een voorbeeldtekst beschreven om ouders in de afdelingsfolder vanuit het ziekenhuis te informeren over deze gegevensoverdracht.
Verpleegkundige en medische overdracht
Direct bij ontslag uit het ziekenhuis vindt een verpleegkundige en een medische overdracht van gegevens plaats. Ook belangrijke psychosociale gegevens worden daarbij overgedragen. De kinderarts is eindverantwoordelijk voor deze overdracht. Lokaal kan worden afgesproken wie (arts of verpleegkundige) welke elementen overdraagt aan wie en op welke manier (schriftelijk of mondeling gevolgd door schriftelijk). De overdracht van zorg is een risicomoment waarop informatie verloren kan gaan of onduidelijkheden kunnen ontstaan, die kunnen leiden tot onzekerheid bij de ouders. Een gestructureerde multidisciplinaire overdracht kan dit risico beperken. Lokaal dient daarbij afgesproken te worden welke disciplines standaard bij dit overleg aanwezig zijn en welke onderwerpen besproken worden. Indien geen overdrachtsgesprek gehouden kan worden waarbij alle partijen aanwezig zijn, is het van belang dat er goed contact is (eventueel per telefoon) met de JGZ over het moment van ontslag. Tevens is er een gecombineerd medisch en verpleegkundig ontslaggesprek met de ouders.
Om deze overdracht tijdig te kunnen laten plaatsvinden, dient vóór het moment dat het kind naar huis gaat, bekend te zijn welke JGZ-locatie (consultatiebureau of CJG-locatie) het kind zal gaan bezoeken. En ook dient bij de JGZ vóór dat moment bekend te zijn dat het kind naar huis komt.
verpleegkundige overdracht
Bij de verpleegkundige overdracht worden de meest essentiële gegevens aan de jeugdverpleegkundige overgedragen vóórdat het kind naar huis gaat. De voorlopige overdracht kan schriftelijk of mondeling (per telefoon) plaatsvinden, in het laatste geval gevolgd door een schriftelijke bevestiging via de e-mail (e-mail alleen in beveiligde omgeving). De jeugdverpleegkundige verwerkt deze gegevens in het JGZ-dossier en geeft deze gegevens door aan de jeugdarts. De definitieve overdracht kan vlak voor of vlak na ontslag plaatsvinden, bij voorkeur binnen één week na thuiskomst, zodat de gegevens bekend zijn bij het eerste huisbezoek.
Warme overdracht
De werkgroep is van mening dat een warme overdracht belangrijk is wanneer sprake is van een situatie met een speciale zorgbehoefte. De casemanager bepaalt of dit het geval is. Bij een warme overdracht vindt een gesprek plaats tussen ten minste de kinder- verpleegkundige, de jeugdverpleegkundige en de ouders. Deze warme overdracht vindt bij voorkeur in het ziekenhuis plaats, voor ontslag, maar kan ook thuis plaatsvinden. Bij dit gesprek worden onder andere de volgende onderwerpen besproken: wie de casema- nager is, of verlengde kraamzorg nodig is, de speciale zorgbehoefte (bijvoorbeeld son- devoeding, monitoring) en mogelijkheden voor het betrekken van andere zorgverleners (fysiotherapie, logopedie, maatschappelijk werk). Ook worden afspraken gemaakt over de invulling van het nazorgtraject, met name wanneer daar verschillende zorgverleners bij betrokken zijn. Als voor bepaalde problemen andere personen dan de casemanager aanspreekpunt zijn, wordt dat aan de ouders meegedeeld. Besproken onderwerpen en gemaakte afspraken worden schriftelijk vastgelegd. Om de warme overdracht goed te kunnen uitvoeren is een goede ontslagplanning door het ziekenhuis essentieel.
Medische overdracht
De (voorlopige) medische overdracht wordt direct bij ontslag van het kind naar de huisarts en (indien de ouders hebben aangegeven hier geen bezwaar tegen te hebben) naar de jeugdarts gestuurd. De definitieve overdracht van kinderarts aan JGZ vindt schriftelijk plaats binnen 14 dagen na thuiskomst, zodat de JGZ volledig geïnformeerd is over het klinische traject. Zie de tabel Overdrachtsmomenten verderop voor een overzicht van over te dragen gegevens bij de voorlopige en definitieve overdracht. Het verdient aanbeveling ook de verloskundige (indien betrokken) een kopie van de ontslagbrief te sturen, als de ouders daar geen bezwaar tegen hebben.
Overdracht kan op verschillende manieren plaatsvinden. De over te dragen gegevens moeten schriftelijk en op een gestructureerde manier worden vastgelegd, waarbij alle gegevens die van belang zijn voor continuïteit in het zorgproces beschreven worden.
Het gebruik van formulieren of checklists kan hierbij helpen. De definitieve overdracht aan de huisarts vindt plaats via een ontslagbrief. De overdracht aan de jeugdarts kan plaatsvinden via een overdrachtboekje of -formulier (wat door de ouders overgedragen wordt aan de JGZ), via een kopie van de ontslagbrief aan de huisarts (zie ook leidraad NVK) of via een EPD waartoe kinderarts en jeugdarts beiden toegang hebben.
Gezien de huidige ontwikkelingen rondom de flexibilisering van de contactmomenten wordt aanbevolen om de kinderen een status toe te kennen waarbij zij extra aandacht krijgen.
Lokaal dient geregeld te zijn dat de verschillende zorgverleners (ziekenhuis, JGZ, huisarts) op de hoogte zijn van elkaars contactgegevens, zodat altijd duidelijk is wie men waar en wanneer kan bereiken.
Overdracht tijdens de nazorgfase
Ook in de nazorgfase geldt dat overdracht tussen de verschillende zorgverleners gestructureerd plaats moet vinden, bij voorkeur met behulp van formulieren of checklists. Het is belangrijk dat de gegevens uitwisselbaar en volledig zijn. Dit wil zeggen dat gegevens zoveel mogelijk op dezelfde wijze worden verkregen en genoteerd (bij bijvoorbeeld ontwikkelingsonderzoek, groei, ziekte) en dat alle relevante informatie overgedragen wordt. Hierdoor kunnen de hulpverleners uit de verschillende organisaties gebruikmaken van eikaars gegevens en hoeft onderzoek niet te worden overgedaan.
Na elk bezoek aan de jeugdarts/jeugdverpleegkundige respectievelijk de kinderarts dienen binnen een afgesproken termijn de volgende gegevens te worden overgedragen aan de andere partij (kinderarts, respectievelijk JGZ) en een kopie daarvan aan de casemanager als dat iemand anders is:
- Groei (bij problemen m.b.t. groei: diagnostiek/therapie/adviezen).
- Ontwikkeling (bij problemen m.b.t. ontwikkeling: diagnostiek/therapie/adviezen, uitslagen van test. bijv. Bayley).
- Voedingsadvies.
- Aanpassingen medicatie.
- Bijzondere aandachtspunten m.b.t. kind en ouders, eventuele ingestelde begeleiding ouders/kind.
- Eventuele verandering casemanager.
- Datum volgende controles poli/JGZ of andere hulpverleners.
De overdracht tussen kinderarts en JGZ tijdens de nazorgfase dient aan te sluiten bij de NCJ concept-handreiking Samenwerking en gegevensoverdracht tussen het ziekenhuis en de jeugdgezondheidszorg, beschrijving randvoorwaarden (NCJ, 2012). De handreiking beschrijft vooral de overdracht door de kinderarts aan de JGZ, maar de beschreven randvoorwaarden gelden ook voor de overdracht door de JGZ aan de kinderarts. Uit onderzoek in Noorwegen naar het gebruik van een door de ouders beheerd pendeldos- sier blijkt dat informatieoverdracht hierdoor wel kan verbeteren, maar er werden geen positieve effecten gevonden ten aanzien van samenwerking en afstemming (Grovdal, 2006). Hoewel er geen wetenschappelijk bewijs is dat een pendeldossier een verbeterde communicatie teweeg zou kunnen brengen, zijn de werkgroep positieve ervaringen hiermee bekend uit gerelateerde vakgebieden (kinderoncologie). Naar de mening van de werkgroep is een voor alle zorgverleners toegankelijk EPD de beste manier van gegevensoverdracht. Hier is echter landelijk veel discussie over. Een pendeldossier (bijvoorbeeld het 'groene boekje' dat al in het ziekenhuis aan ouders gegeven wordt met een speciaal inlegvel erin) kan bij goede afspraken en zelfdiscipline een alternatief zijn.
inhoud overdracht
In bijlage 1 bij deze richtlijn (te vinden bij de aanverwante producten) is een voorbeeld- overdrachtsformulier opgenomen. Op basis van het protocol 'Samenwerken en afstemmen' moeten de volgende elementen ten minste in de (voorlopige) medische en verpleegkundige overdracht beschreven worden:
Tabel 2.
|
Overdrachtsmomenten en gegevens die overgedragen moeten worden |
||
|
Overdrachtsmoment |
Gegevens die overgedragen moeten worden* |
|
|
1. Ontslag Kinderarts bepaalt moment van ontslag/naar huis gaan en draagt zorg voor overdracht** |
Zwangerschap |
|
|
Bevalling |
|
|
|
Opname |
|
|
|
Ontslag |
|
|
|
2. Nazorg Contactmoment (na)zorg kind |
|
|
Overdracht op de leeftijd van 4 jaar
Daar waar de JGZ echt integraal (van 0-19 jaar) werkt, is formeel geen sprake meer van een overdracht. Er bestaan echter nog op diverse plaatsen JGZ-organisaties die nog niet integraal werken. Het moment waarop het kind niet meer volgens vaste contactmomenten op kortere termijn (d.w.z. binnen 1 jaar) gezien wordt, verdient sowieso extra aandacht. Op dat moment kan bepaald worden hoe eventuele extra zorg in het vervolgtraject vormgegeven moet worden en kan er een goede overdracht (aan de JGZ 4-19 jaar) plaatsvinden. De JGZ 0-4 jaar is ervoor verantwoordelijk dat op het moment dat de zorg overgaat naar de jeugdarts 4-19 jaar het complete dossier wordt overgedragen. Als hierbij sprake is van een andere JGZ-organisatie en indien het kind nog onder controle of behandeling is van andere zorgverleners, zoals de kinderarts, worden deze van de overdracht op de hoogte gesteld.
Deze richtlijn kan ook als achtergrond gebruikt worden door de JGZ 4-19 jaar of in het zorgtraject op de schoolleeftijd.
Specifieke aandachtspunten bij de zorg van kinderen op de schoolleeftijd zijn mogelijke late gevolgen van vroeg- en/of SGA-geboorte die eerder nog niet evident zijn, maar wel in de schoolperiode zichtbaar kunnen worden. Een subtiele ontwikkelingsachterstand wordt vaak pas op de schoolleeftijd duidelijk. Ook aandacht voor lichamelijke gevolgen is belangrijk: een aanzienlijk deel van de te vroeg en/of SGA geboren kinderen ontwikkelt vóór de leeftijd van 19 jaar (pre)hypertensie (Keijzer-Veen, 2005).
De JGZ in de schoolleeftijd zal mogelijk een meer signalerende en verwijzende functie hebben. Een sociale kaart van deskundigen die goed onderbouwde en onderzochte interventies kunnen geven is daarbij ondersteunend.
Afstemming
Naast de 'reguliere' zorg en follow-up door het ziekenhuis en/of de JGZ kunnen andere vormen van zorg geïndiceerd zijn, zoals (kinder)fysiotherapie, logopedie, diëtetiek, (kinder- en jeugd)psychologie en maatschappelijk werk. In hoofdstuk 3 wordt ingegaan op de signalering van en mogelijke interventies bij specifieke problematiek. Indien dergelijke interventies geïnitieerd worden door een betrokken partij is communicatie onderling nodig. Daarom moeten ook in het NICU-centrum waar de uitgebreide follow-up plaatsvindt de contactgegevens van de betrokken jeugdarts bekend zijn.
Zolang een kind nog onder behandeling of controle van verschillende zorgverleners is, is het van belang dat er heldere afspraken gemaakt worden tussen de betrokken zorgverleners, in overleg met de ouders. Goede onderlinge afstemming kan voorkomen dat er meerdere afspraken in één week gepland worden en dat er verschillende adviezen gegeven worden. De kinderarts kan zijn/haar controles afstemmen op de JGZ-contactmomenten. Dit zijn vaak vaste contacten op bepaalde leeftijden. Lokaal zijn echter diverse variaties in die momenten. De kinderarts moet zich hiervan bewust zijn. Ook kunnen de JGZ en de kinderarts in het lokale ziekenhuis rekening houden met de tijdstippen van controles bij de NICU. De casemanager kan hierin een belangrijke rol spelen. Hij/zij bewaakt het proces, de terugkoppeling en de afstemming.
Casemanager, ouders, huisarts, kinderarts (lokaal en NICU-follow-up) en JGZ dienen te beschikken over een sociale kaart c.q. de contactgegevens van de betrokken contactpersonen uit de eerste (huisarts, jeugdarts, jeugdverpleegkundige), tweede (kinderarts) en derde lijn (neonatoloog) en van andere betrokken zorgverleners. Belangrijk is hierbij dat informatie niet alleen goed wordt overgedragen, maar dat ook informatie actief wordt opgevraagd bij of gedeeld wordt met andere zorgverleners indien nodig. Wanneer bijvoorbeeld de JGZ signaleert dat er sprake is van depressieve klachten bij de moeder, zou (in overleg met de moeder) de huisarts ingeschakeld kunnen worden. Ook kunnen zorgverleners makkelijker direct contact met elkaar opnemen (of zo nodig met de casemanager) indien er onduidelijkheden bestaan over afspraken.
Voorwaarde voor samenwerking
Voorwaarde voor een goede samenwerking en afstemming in de nazorgfase is dat er zowel regionaal als lokaal afspraken gemaakt worden die vastgelegd worden in een protocol.
In een aantal regio's in Nederland heeft een dergelijk samenwerkingsprotocol al vorm gekregen (zie appendix bij dit hoofdstuk). Het protocol Samenwerken en afstemmen benoemt een aantal aspecten die bij regionale samenwerking van belang zijn, zoals een regionale multidisciplinaire werkgroep, bij- en nascholing, inbedding in lokale procedures. Op regionaal niveau kan de samenwerking verbeterd worden door gezamenlijke bij-/ nascholingen of door onderlinge stages. Wanneer de verschillende zorgverleners elkaar persoonlijk kennen en bekend zijn met elkaars werkterrein stimuleert dat de onderlinge contacten en samenwerking.
Wanneer per zorginstelling een aandachtsfunctionaris op het gebied van te vroeg of SGA geboren kinderen of een vaste contactpersoon aangewezen is, kan deze evalueren, tijdig knelpunten opmerken, contact onderhouden met de collega's uit de aanpalende zorginstellingen en initiatieven nemen tot gezamenlijke scholing.
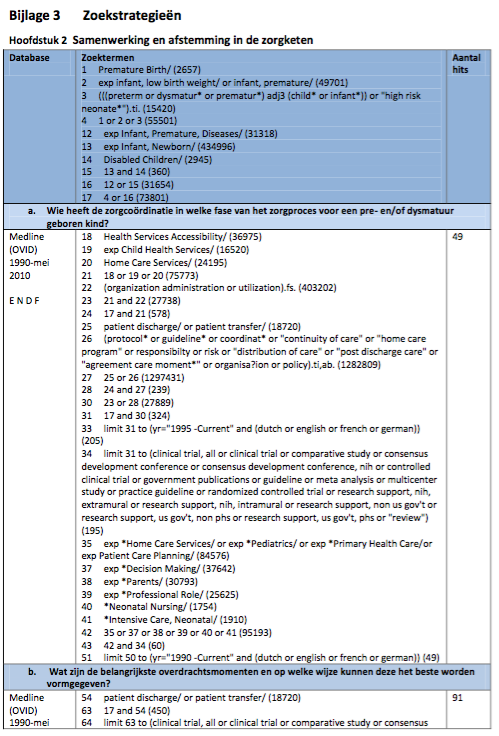
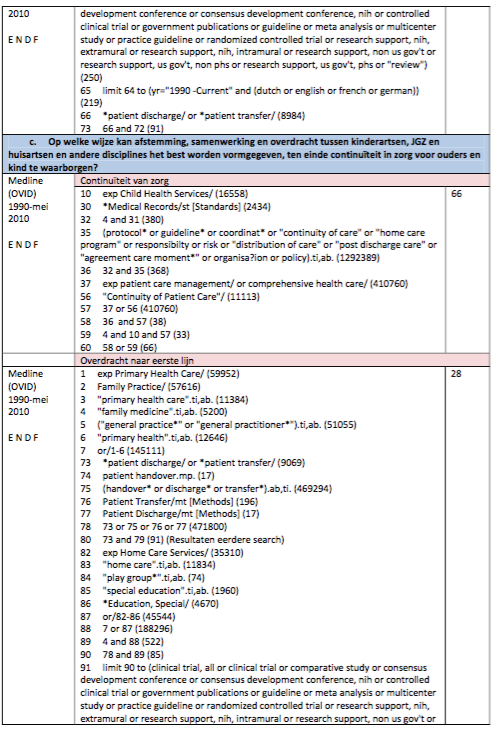
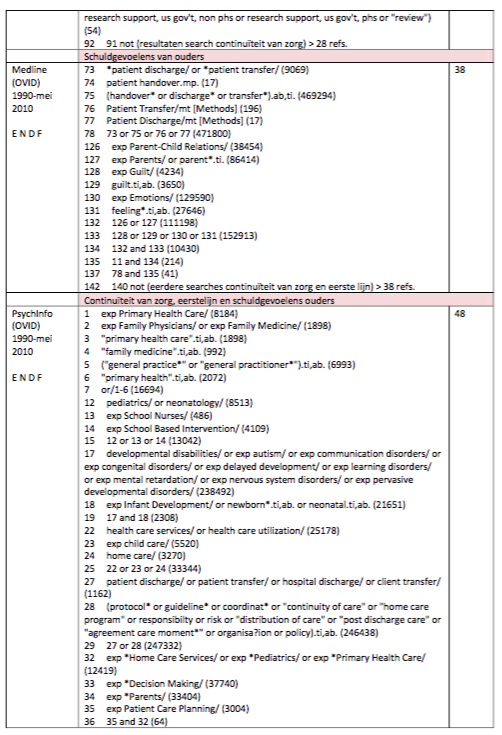
Zoeken en selecteren

Referenties
- AAP (2008). Hospital discharge of the high-risk neonate. Pediatrics, 122, 1119-1126.
- Aarnoudse-Moens CS, Weisglas-Kuperus N, van Goudoever JB, et al. Meta-analysis of neurobehavioral outcomes in very preterm and/or very low birth weight children. Pediatrics 2009;124(2):717-28.
- Aggett PJ, Agostoni C, Axelsson I, et al. Feeding preterm infants after hospital discharge: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2006;42(5):596-603.
- Amesz E, Schaafsma A, et al. (2010). Optimal growth and lower fat mass in preterm infants fed a protein- enriched postdischarge formula. J Pediatr Gastroenterol Nutr 50: 200-207.
- Anderson P, Doyle LW. Neurobehavioral outcomes of school-age children born extremely low birth weight or very preterm in the 1990s. JAMA 2003;289(24):3264-72.
- Baar van AL, Vermaas J, Knots E, et al. Functioning at school age of moderately preterm children born at 32 to 36 weeks' gestational age. Pediatrics 2009;124(1):251-7.
- Blair C. Early intervention for low birth weight, preterm infants: the role of negative emotionality in the specifica- tion of effects. Dev Psychopathol 2002;14(2):311-32.
- Bocca-Tjeertes IF, Kerstjens JM, Reijneveld SA, de Winter AF, Bos AF. Growth and predictors of growth restraint in moderately preterm children aged 0 to 4 years. Pediatrics. 2011;128(5):e1187-94.
- Bocca-Tjeertes IF, van Buuren S, Bos AF, Kerstjens JM, Ten Vergert EM, Reijneveld SA. Growth of preterm and full-term children aged 0-4 years: integrating median growth and variability in growth charts. J Pediatr. 2012;161(3):460-465.
- Breslau N, Johnson EO, Lucia VC. Academic achieve- ment of low birthweight children at age 11: the role of cognitive abilities at school entry. J Abnorm Child Psychol 2001;29(4):273-9.
- Breslau N, Paneth NS, Lucia VC. The lingering academic deficits of low birth weight children. Pediatrics 2004;114(4):1035-40.
- Bucher HU, Killer C, Ochsner Y, et al. Growth, develop- mental milestones and health problems in the first 2 years in very preterm infants compared with term infants: a population based study. Eur J Pediatr 2002;161(3):151-6.
- Callanan C, Doyle L, Rickards A, et al. Children followed with difficulty: how do they differ? J Paediatr Child Health 2001;37(2):152-6.
- Caravale B, Tozzi C, Albino G, et al. Cognitive develop- ment in low risk preterm infants at 3-4 years of life. Arch Dis Child Fetal Neonatal Ed 2005;90(6):F474-F479
- Carvalho AE, Martinez FE, Linhares MB. Maternal anxiety and depression and development of prematurely born infants in the first year of life. Span J Psychol. 2008;11(2):600-8.
- Cerro N, Zeunert S, Simmer KN, et al. Eating behaviour of children 1.5-3.5 years born preterm: parents' perceptions. J Paediatr Child Health 2002;38(1):72-8.
- Commissie evaluatie basistakenpakket JGZ. Een stevig fundament. Evaluatie van het basistakenpakket jeugdgezondheidszorg. Februari 2013.Te downloaden via http://www.ncj.nl/actueel/766/jeugdgezond- heidszorg-een-stevig-fundament-advies-commissie-de- winter-
- Cooke R, Griffin I, et al. (2010). Adiposity is not altered in preterm infants fed a nutrient-enriched formula after hospital discharge. Pediatr Res 67(6): 660-664.
- Cooke R, McCormick K, et al. (1999). Feeding preterm infants after hospital discharge: effect of diet on body composition. Pediatr Res 46(4): 461-465.
- Cosgrave E, Scott C, Goble R. Ocular findings in low birthweight and premature babies in the first year: do we need to screen? Eur J Ophthalmol 2008;18(1):104-11.
- Cserjesi R, Van Braeckel KN, Butcher PR, Kerstjens JM, Reijneveld SA, Bouma A, Geuze RH, Bos AF. Functioning of 7-year-old children born at 32 to 35 weeks' gesta- tional age. Pediatrics. 2012;130(4):e838-46.
- Da Costa SP, van der Schans CP, Zweens MJ, et al. Development of sucking patterns in pre-term infants with bronchopulmonary dysplasia. Neonatology 2010a;98(3):268-77.
- Da Costa SP, van der Schans CP, Zweens MJ, et al. The development of sucking patterns in preterm, small-for-gestational age infants. J Pediatr 2010b;157(4):603-9, 609.
- De Kieviet JF, Piek JP, arnoudse-Moens CS, et al. Motor development in very preterm and very low-birth-weight children from birth to adolescence: a meta-analysis. JAMA 2009;302(20):2235-42.
- De Vries AM, De Groot L. Transient dystonias revisited: a comparative study of preterm and term children at 2 1/2 years of age. Developmental Medicine & Child Neurology 2002;44415-21.
- Del Canho R, Hulsman A. Vaccinatie van prematuur geboren kinderen. Praktische Pediatrie 2:2007: pp.34-7.
- Doyle LW, Roberts G, Anderson PJ. Outcomes at age 2 years of infants < 28 weeks' gestational age born in Victoria in 2005. J Pediatr 2010;156(1):49-53.
- Dusseldorp E, Boere-Boonekamp MM, Coenen-van Vroonhoven E. Pilotstudie D-screening: screening op ontwikkelingsachterstand bij het jonge kind, uitgevoerd door de jeugdarts. Leiden, TNO, 2011. Publicatienum¬mer: TNO/LS 2011.003. Rapport en flyer te downloaden via: http://www.tno.nl/ (zoeken naar 'pilot D-screening').
- Duys-Fransen HMTW. Eerder dan verwacht: onderzoek naar de ervaringen en behoeftes van ouders van een prematuur geboren kind na een zwangerschap tussen de 32 en 37 weken gedurende de eerste 6 maanden. Tilburg: Hogeschool Fontys, 2008. Master in Advanced Nursing Practice.
- Embleton N and Cooke R (2003). Protein requirements in preterm infants: effect of different levels of protein intake on growth and body composition. Pediatr Res 58(5): 855-860.
- Erikson C, Allert C, Carlberg EB, et al. Stability of longitudinal motor development in very low birthweight infants from 5 months to 5.5 years. Acta Paediatr 2003;92(2):197-203.
- Fallang B, Oien I, Hellem E, et al. Quality of reaching and postural control in young preterm infants is related to neuromotor outcome at 6 years. Pediatr Res 2005;58(2):347-53.
- Feldman R, Eidelman AI. Neonatal state organization, neuromaturation, mother-infant interaction, and cognitive development in small-for-gestational-age premature infants. Pediatrics 2006;118(3):e869-e878
- Forcada-Guex M, Borghini A, Pierrehumbert B, et al. Prematurity, maternal posttraumatic stress and conse- quences on the mother-infant relationship. Early Hum Dev 2010;
- Furck AK, Richter JW, Kattner E. Very low birth weight infants have only few adverse events after timely immunization. J Perinatol 2010;30(2):118-21.
- Gianni ML, Picciolini O, Ravasi M, et al. The effects of an early developmental mother-child intervention program on neurodevelopment outcome in very low birth weight infants: a pilot study. Early Hum Dev 2006;82(10):691-5.
- Goyen TA, Lui K. Longitudinal motor development of 'apparently normal' high-risk infants at 18 months, 3 and 5 years. Early Hum Dev 2002;70(1-2):103-15.
- Graaf de JP, Ravelli ACJ, Wildschut HIJ, Denktas S, Voorham AJJ, Bonsel GJ, Steegers EAP. Perinatale uitkomsten in de vier grote steden en de prachtwijken in Nederland. Ned Tijdschr Geneeskd. 2008 Dec 13; 152(50):2734-40
- Grovdal LB, Grimsmo A. & Ivar Lund N T (2006). Parent-held child health records do not improve care: a randomized controlled trial in Norway. Scand.J.Prim. Health Care, 24, 186-190.
- Van Haastert IC, de Vries LS, Helders PJ, Jongmans MJ. Early gross motor development of preterm infants according to the Alberta Infant Motor Scale. J Pediatr. 2006;149(5):617-22.
- Van Haastert IC, Groenendaal F, Uiterwaal CS, Termote JU, van der Heide-Jalving M, Eijsermans MJ, Gorter JW, Helders PJ, Jongmans MJ, de Vries LS. Decreasing incidence and severity of cerebral palsy in prematurely born children. J Pediatr. 2011;159(1):86-91.
- Hafkamp-de Groen E, Dusseldorp E, Boere-Boonekamp MM, et al. Relatie tussen het Van Wiechenonderzoek (D-score) op 2 jaar en het intelligentieniveau op 5 jaar. Tijdschrift voor jeugdgezondheidszorg 41:2009: pp.10-4.
- Heerdink-Obenhuijsen N, Boere-Boonekamp MM, Tjon A Ten WE, Wensing A & Wensing-Souren C (2004). Nazorg van de risicopasgeborenen: een reden tot zorg voor de kindergeneeskunde en de jeugdgezond¬heidszorg. NVK Nieuwsbrief, 23, 19-20.
- Heerdink-Obenhuijsen N, Boere-Boonekamp MM, Tjon A Ten WE, Wensing A & Wensing-Souren C (2005). Nazorg van de risicopasgeborenen: een reden tot zorg voor de kindergeneeskunde en de jeugdgezond¬heidszorg. JGZ Tijdschrift voor Jeugdgezondheidszorg, 37, 51-54.
- Henderson G, Fahey T, McGuire W. Calorie and protein-enriched formula versus standard term formula for improving growth and development in preterm or low birth weight infants following hospital discharge. Cochrane Database Syst Rev 2005;(2):CD004696.
- Henderson G, Fahey T, McGuire W. Nutrient-enriched formula versus standard term formula for preterm infants following hospital discharge. Cochrane Database Syst Rev 2007;(4):CD004696.
- Hill JL, Brooks-Gunn J, Waldfogel J. Sustained effects of high participation in an early intervention for low-birth- weight premature infants. Dev Psychol 2003;39(4):730-44.
- Hille ET, Weisglas-Kuperus N, van Goudoever JB, et al. Functional outcomes and participation in young adulthood for very preterm and very low birth weight infants: the Dutch Project on Preterm and Small for Gestational Age Infants at 19 years of age. Pediatrics 2007;120(3):e587-e595.
- Hoffenkamp HN, Tooten A, Hall RA, Croon MA, Braeken J, Winkel FW, Vingerhoets AJ, van Bakel HJ. The impact of premature childbirth on parental bonding. Evol Psychol. 2012;17;10(3):542-61.
- Houtzager BA, Gorter-Overdiek B, van SL, et al. Improvement of developmental outcome between 24 and 36 months corrected age in very preterm infants. Acta Paediatr 2010;99(12):1801-6.
- Ingemarsson I. Gender aspects of preterm birth. BJOG. 2003 Apr;110 Suppl 20:34-8. Review.
- Jacobusse G, van BS, Verkerk PH. An interval scale for development of children aged 0-2 years. Stat Med 2006;25(13):2272-83.
- Jacobusse GW, Van Buuren S, Verkerk PH. Ontwikkeling van de D-score. Een samenvattende maat voor het Van Wiechenonderzoek. Tijdschrift voor jeugdgezond¬heidszorg 40:2008: pp. 8-11.
- Janssen AJ, Nijhuis-van der Sanden MW, Akkermans RP, Oostendorp RA, Kollée LA. Influence of behaviour and risk factors on motor performance in preterm infants at age 2 to 3 years. Dev Med Child Neurol. 2008;50(12):926-31.
- Janssen AJ, Nijhuis-van der Sanden MW, Akkermans RP, Tissingh J, Oostendorp RA, Kollée LA. A model to predict motor performance in preterm infants at 5 years. Early Hum Dev. 2009;85(9):599-604.
- Janssen AJ, Akkermans RP, Steiner K, de Haes OA, Oostendorp RA, Kollée LA, Nijhuis-van der Sanden MW. Unstable longitudinal motor performance in preterm infants from 6 to 24 months on the Bayley Scales of Infant Development--Second edition. Res Dev Disabil. 2011;32(5):1902-9.
- Jeng SF, Chen LC, Yau KI. Kinematic analysis of kicking movements in preterm infants with very low birth weight and full-term infants. Phys Ther. 2002;82(2):148-59.
- Johnson S. Cognitive and behavioural outcomes following very preterm birth. Semin Fetal Neonatal Med 2007;12(5):363-73.
- Johnson S, Hollis C, Kochhar P, et al. Autism spectrum disorders in extremely preterm children. J Pediatr 2010;156(4):525-31.
- Johnson S, Whitelaw A, Glazebrook C, et al. Random- ized trial of a parenting intervention for very preterm infants: outcome at 2 years. J Pediatr 2009;155(4):488-94.
- Karatzias T, Chouliara Z, Maxton F, et al. Post-traumatic symptomatology in parents with premature infants: A systematic review of the literature. [References]. Journal of Prenatal & Perinatal Psychology & Health 2007;21(3):249-60.
- Keijzer-Veen MG, Finken MJ, Nauta J, Dekker FW, Hille ET, Frölich M, Wit JM, van der Heijden AJ; Dutch POPS-19 Collaborative Study Group. Is blood pressure increased 19 years after intrauterine growth restriction and preterm birth? A prospective follow-up study in The Netherlands. Pediatrics. 2005 Sep;116(3):725-31.
- Kerstjens JM, Bos AF, ten Vergert EM, et al. Support for the global feasibility of the Ages and Stages Question¬naire as developmental screener. Early Hum Dev 2009;85(7):443-7.
- Kerstjens JM, de Winter AF, Bocca-Tjeertes I, ten Vergert EM, Reijneveld SA, Bos AF. Developmental delay in moderately preterm-born children at school-entry. J Pediatrics 2011; 159: 92-8.
- Kerstjens JM, DE Winter AF, Bocca-Tjeertes IF, Bos AF, Reijneveld SA. Risk of developmental delay increases exponentially as gestational age of preterm infants decreases: a cohort study at age 4 years. Dev Med Child Neurol. 2012; 54(12):1096-101.
- De Kleine MJ, den Ouden AL, Kollée LA, Nijhuis-van der Sanden MW, Sondaar M, van Kessel-Feddema BJ, Knuijt S, van Baar AL, Ilsen A, Breur-Pieterse R, Briët JM, Brand R, Verloove-Vanhorick SP.Development and evaluation of a follow up assessment of preterm infants at 5 years of age. Arch Dis Child. 2003;88(10):870-5.
- KNMG Handreiking verantwoordelijkheidsverdeling bij samenwerking in de zorg, 2010.
- Knops NB, Sneeuw KC, Brand R, et al. Catch-up growth up to ten years of age in children born very preterm or with very low birth weight. BMC Pediatr 2005;526.
- Koldewijn K, van WA, Wolf MJ, et al. A neurobehavioral intervention and assessment program in very low birth weight infants: outcome at 24 months. J Pediatr 2010;156(3):359-65.
- Küpers AM, Dekkers DAM, de Coo D & Tjon A Ten, WE (2009). Evaluatie van de transmurale zorg voor pasge-borenen met een gezondheidsrisico. JGZ Tijdschrift voor Jeugdgezondheidszorg, 41, 74-77.
- Lafeber H, van Zoeren-Grobben D, et al. (2012). Werkboek Enterale en parenterale voeding bij pasge¬borenen. Amsterdam, VU Uitgeverij.
- Van de Lagemaat M, Rotteveel J, et al. (2011). Post term dietary-induced changes in DHA and AA status relate to gains in weight, length, and head circumference in preterm infants. Prostaglandins Leukot Essent Fatty Acids 85: 311-316.
- Van de Lagemaat M, Rotteveel J, et al. (2012, in press). Increased bone mass gain in preterm-born infants fed protein- and mineral-enriched postdischarge formula. J Pediatr Gastroenterol Nutr.
- Lando A, Klamer A, Jonsbo F, et al. Developmental delay at 12 months in children born extremely preterm. Acta Paediatr 2005;94(11):1604-7.
- Lapillonne A, Salle B, et al. (2004). Bone mineralization and growth are enhanced in preterm infants fed an isocaloric, nutrient-enriched preterm formula through term. Am J Clin Nutr 80: 1595-1603.
- Larroque B, Ancel PY, Marret S, et al. Neurodevelop- mental disabilities and special care of 5-year-old children born before 33 weeks of gestation (the EPIPAGE study): a longitudinal cohort study. Lancet 2008;371(9615):813-20.
- Laughon M, O'Shea MT, Allred EN, Bose C, Kuban K, Van Marter LJ, Ehrenkranz RA, Leviton A; ELGAN Study Investigators. Chronic lung disease and developmental delay at 2 years of age in children born before 28 weeks' gestation. Pediatrics. 2009;124(2):637-48.
- Laurent de Angulo MS e.a. (red.) Ontwikkelingsonder¬zoek in de jeugdgezondheidszorg. Het Van Wiechenon- derzoek - De Baecke-Fassaert Motoriektest. 2008 (4e druk), Van Gorcum Uitgeverij, Assen, 432 pagina's, ISBN 9789023241911.
- Lee SY, Kimble LP. Impaired sleep and well-being in mothers with low-birth-weight infants. J Obstet Gynecol Neonatal Nurs 2009;38(6):676-85.
- Luu TM, Vohr BR, Schneider KC, et al. Trajectories of receptive language development from 3 to 12 years of age for very preterm children. Pediatrics 2009;124(1):333-41.
- Maguire CM, Walther FJ, Sprij AJ, et al. Effects of individualized developmental care in a randomized trial of preterm infants <32 weeks. Pediatrics 2009a;124(4):1021-30.
- Maguire CM, Walther FJ, van Zwieten PH, et al. Follow-up outcomes at 1 and 2 years of infants born less than 32 weeks after Newborn Individualized Developmental Care and Assessment Program. Pediatrics 2009b;123(4):1081-7.
- Maguire CM, Walther FJ, van Zwieten PH, et al. No change in developmental outcome with incubator covers and nesting for very preterm infants in a randomised controlled trial. Arch Dis Child Fetal Neonatal Ed 2009c;94(2):F92-F97.
- Marin Gabriel MA, Pallas Alonso CR, De La Cruz BJ, et al. Age of sitting unsupported and independent walking in very low birth weight preterm infants with normal motor development at 2 years. Acta Paediatr 2009;98(11):1815-21.
- Melnyk BM, Crean HF, Feinstein NF, et al. Maternal anxiety and depression after a premature infant's discharge from the neonatal intensive care unit: explanatory effects of the creating opportunities for parent empowerment program. Nurs Res 2008;57(6):383-94.
- Mikkola K, Ritari N, Tommiska V, et al. Neurodevelop- mental outcome at 5 years of age of a national cohort of extremely low birth weight infants who were born in 1996-1997. Pediatrics 2005;116(6):1391-400.
- Miles MS, Holditch-Davis D, Schwartz TA, Scher M. Depressive symptoms in mothers of prematurely born infants. J Dev Behav Pediatr. 2007;28(1):36-44.
- Milligan DW. Outcomes of children born very preterm in Europe. Arch Dis Child Fetal Neonatal Ed 2010;95(4):F234-F240.
- Ministerie van Volksgezondheid, Welzijn en Sport. Basistakenpakket jeugdgezondheidszorg 0-19 jaar. Den Haag 2002.
- Moore M, Gerry TH, Klein N, et al. Longitudinal changes in family outcomes of very low birth weight. J Pediatr Psychol 2006;31(10):1024-35.
- Nederlandse Vereniging voor Kindergeneeskunde (NVK), Artsen Jeugdgezondheidszorg Nederland (AJN). Samenwerken en afstemmen. Overdracht en samen¬werking bij pre- en dysmatuur geboren kinderen en andere kinderen met een gezondheidsrisico, 2009.
- Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Jeugdgezondheidszorg (NVJG). Protocol nazorg pre- en/of dysmature zuigelin¬gen en andere pasgeborenen met een potentieel gezondheidsrisico, 1997.
- Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Obstetrie en Gynaecolo¬gie (NVOG). Richtlijn perinataal beleid bij extreme vroeggeboorte, 2010.
- Nederlandse Vereniging voor Kindergeneeskunde. Leidraad NVK Schriftelijke communicatie tussen kinderartsen en jeugdartsen. Utrecht, 29-8-2007.
- Nederlandse Vereniging voor Kindergeneeskunde. Standpunt 'Passieve immunisatie tegen RSV-ziekte'. 2005. www.nvk.nl (geraadpleegd 12-11-2012).
- Niklasson A, Engstrom E, Hard AL, et al. Growth in very preterm children: a longitudinal study. Pediatr Res 2003;54(6):899-905.
- Nuysink J, van Haastert IC, Eijsermans MJ, Koopman- Esseboom C, van der Net J, de Vries LS, Helders PJ. Prevalence and predictors of idiopathic asymmetry in infants born preterm. Early Hum Dev. 2012;88(6):387-92.
- Orton J, Spittle A, Doyle L, et al. Do early intervention programmes improve cognitive and motor outcomes for preterm infants after discharge? A systematic review. Dev Med Child Neurol 2009;51(11):851-9.
- Padovani FH, Carvalho AE, Duarte G, Martinez FE, Linhares MB. Anxiety, dysphoria, and depression symptoms in mothers of preterm infants. Psychol Rep. 2009 Apr;104(2):667-79.
- Van der Pal SM, Maguire CM, Cessie SL, et al. Staff opinions regarding the Newborn Individualized Develop- mental Care and Assessment Program (NIDCAP). Early Hum Dev 2007a;83(7):425-32.
- Van der Pal SM, Maguire CM, Le CS, et al. Parental experiences during the first period at the neonatal unit after two developmental care interventions. Acta Paediatr 2007b;96(11):1611-6.
- Van der Pal SM, Maguire CM, Bruil J, et al. Health-relat- ed quality of life of very preterm infants at 1 year of age after two developmental care-based interventions. Child Care Health Dev 2008;34(5):619-25.
- Van der Pal SM, Maguire CM, Cessie le S, et al. Parental stress and child behavior and temperament in the first year after the newborn individualized develop- mental care and assessment program. [References]. Journal of Early Intervention 2008a;30(2):102-15.
- Van der Pal SM, Maguire CM, Bruil J, et al. Very pre-term infants' behaviour at 1 and 2 years of age and parental stress following basic developmental care. [References]. British Journal of Developmental Psychology 2008b;26(1):103-15.
- Van der Pal SM, Buitendijk SE. In gesprek met ouders over de (na)zorg voor hun te vroeg geboren kind. Leiden: TNO Kwaliteit van Leven, 2009. Publ. nr. 09.047.
- Van der Pal SM, Walther FJ. Experience with develop- mental care for children born preterm in a Dutch setting [Ervaringen met ontwikkelingsgerichte zorg voor te vroeg geboren kinderen in een Nederlandse setting]. Tijdschrift voor Kindergeneeskunde 76: 4.2011: pp.165-71.
- Van der Pal SM, van der Pal-de Bruin, KM. Vroegge¬boorte in Nederland. Leiden: TNO-rapport, 2012. Publ. nr. TNO/CH 2012 R10565.
- Potharst ES, Schuengel C, Last BF, van Wassenaer AG, Kok JH, Houtzager BA. Difference in mother-child interaction between preterm- and term-born preschool- ers with and without disabilities. Acta Paediatr. 2012;101(6):597-603.
- Potijk M, de Winter AF, Bos AF, Kerstjens JM, Reijneveld SA. Higher rates of behavioral and emotional problems at pre-school age in children born moderately preterm. Arch Dis Child 2012; 97: 112-7.
- Pritchard MA, Colditz PB, Beller EM. Parental experi- ences and preferences which influence subsequent use of post-discharge health services for children born very preterm. J Paediatr Child Health 2008;44(5):281-4.
- PRNa (Stichting Perinatale Registratie Nederland). Perinatale Zorg in Nederland 2008. Jaarboek 2008. Utrecht: Stichting Perinatale Registratie Nederland, 2011. ISBN 978-90-809666-8-0. Pagina 95 en 100. Te downloaden via: www.perinatreg.nl.
- PRNb (Stichting Perinatale Registratie Nederland). Grote lijnen 10 jaar Perinatale Registratie Nederland. Utrecht: Stichting Perinatale Registratie Nederland, 2011. ISBN 978-90-809666-0-4. Pagina 32-34. Te downloaden via: www.perinatreg.nl.
- Ravelli ACJ, Tromp M, Eskes M, Droog JC, van der Post JAM, Jager KJ, Mol BW, Reitsma, JB. Ethnic differences in stillbirth and early neonatal mortality in The Nether- lands. J Epidemiol Community Health 2011;65:696-701.
- Reijneveld SA, de Kleine MJK, Van Baar AL, Kollee LAA, Verhaak CM, Verhulst FC, Verloove-Vanhorick SP. Behavioural and emotional problems in very preterm and very low birth weight infants at age 5 years. Arch Dis Child 2006; 91: F423-8.
- Rijken M, Stoelhorst GM, Martens SE, et al. Mortality and neurologic, mental, and psychomotor development at 2 years in infants born less than 27 weeks' gestation: the Leiden follow-up project on prematurity. Pediatrics 2003;112(2):351-8.
- RIVM/Centrum Jeugdgezondheid. Concept standpunt 'Samenwerking en gegevensoverdracht tussen het ziekenhuis en de jeugdgezondheidszorg', 2011.
- Roberts G, Howard K, Spittle AJ, et al. Rates of early intervention services in very preterm children with developmental disabilities at age 2 years. J Paediatr Child Health 2008;44(5):276-80.
- Roze E, Ta BD, van der Ree MH, Tanis JC, van Braeckel KN, Hulscher JB, Bos AF. Functional impairments at school age of children with necrotizing enterocolitis or spontaneous intestinal perforation. Pediatr Res. 2011;70(6):619-25.
- Schadler G, Suss-Burghart H, Toschke AM, et al. Feeding disorders in ex-prematures: causes--response to therapy--long term outcome. Eur J Pediatr 2007;166(8):803-8.
- Singer LT, Fulton S, Kirchner HL, et al. Parenting very low birth weight children at school age: maternal stress and coping. J Pediatr 2007;151(5):463-9.
- Skellern CY, Rogers Y, O'Callaghan MJ. A parent-com- pleted developmental questionnaire: follow up of ex-premature infants. J Paediatr Child Health 2001;37(2):125-9.
- Slaughter JL, Meinzen-Derr J, Rose SR, et al. The effects of gestational age and birth weight on false-positive newborn-screening rates. Pediatrics 2010;126(5):910-6.
- Spittle AJ, Orton J, Doyle LW, et al. Early developmental intervention programs post hospital discharge to prevent motor and cognitive impairments in preterm infants. Cochrane Database Syst Rev 2007;(2):CD005495.
- Stoelhorst GM, Rijken M, Martens SE, et al. Develop- mental outcome at 18 and 24 months of age in very preterm children: a cohort study from 1996 to 1997. Early Hum Dev 2003;72(2):83-95.
- Stolt S, Haataja L, Lapinleimu H, et al. The early lexical development and its predictive value to language skills at 2 years in very-low-birth-weight children. J Commun Disord 2009;42(2):107-23.
- Strathearn L, Gray PH, O'Callaghan MJ, et al. Child- hood neglect and cognitive development in extremely low birth weight infants: a prospective study. Pediatrics 2001;108(1):142-51.
- Symington A, Pinelli J. Developmental care for promot¬ing development and preventing morbidity in preterm infants. Cochrane Database Syst Rev 2006;(4):CD001814.
- Ta BD, Roze E, van Braeckel KN, Bos AF, Rassouli-Kirch- meier R, Hulscher JB. Long-term neurodevelopmental impairment in neonates surgically treated for necrotizing enterocolitis: enterostomy associated with a worse outcome.Eur J Pediatr Surg. 2011;21(1):58-64.
- Tooten A, Hoffenkamp HN, Hall RA, Winkel FW, Eliëns M, Vingerhoets AJ, van Bakel HJ. The effectiveness of video interaction guidance in parents of premature infants: A multicenter randomised controlled trial. BMC Pedi- atr.2012; 18;12:76.
- Underwood MA, Danielsen B, Gilbert WM. Cost, causes and rates of rehospitalization of preterm infants. J Perinatol 2007;27(10):614-9.
- Vickers A, Ohlsson A, Lacy JB, et al. Massage for promoting growth and development of preterm and/or low birth-weight infants. Cochrane Database Syst Rev 2000;(2):CD000390.
- Vrijlandt EJ, Boezen HM, Gerritsen J, et al. Respiratory health in prematurely born preschool children with and without bronchopulmonary dysplasia. J Pediatr 2007;150(3):256-61.
- Vrijlandt EJ, Gerritsen J, Boezen HM, et al. Gender differences in respiratory symptoms in 19-year-old adults born preterm. Respir Res 2005;6117.
- Vrijlandt EJ, Gerritsen J, Boezen HM, et al. Lung function and exercise capacity in young adults born prematurely. Am J Respir Crit Care Med 2006;173(8):890-6.
- Wang LW, Wang ST, Huang CC. Preterm infants of educated mothers have better outcome. Acta Paediatr 2008;97(5):568-73.
- Wightman A, Schluchter M, Drotar D, et al. Parental protection of extremely low birth weight children at age 8 years. J Dev Behav Pediatr 2007;28(4):317-26.
- Wilson SL, Cradock MM. Review: Accounting for prematurity in developmental assessment and the use of age-adjusted scores. J Pediatr Psychol 2004;29(8):641-9.
- Woodward IJ, Moor S, Hood KM, et al. Very preterm children show impairments across multiple neurodevel-opmental domains by age 4 years. Arch Dis Child Fetal Neonatal Ed 2009;94(5):F339-F344
- Yeo CL, Chan C. Motor development of very low birthweight infants with chronic lung disease - a comparative study. Ann Acad Med Singapore. 2005;34(7):411-6.
- Young L, Morgan J, et al. (2012). Nutrient-enriched formula versus standard term formula for preterm infants following hospital discharge. Cochrane Database of Syst Rev 14(3).
- Yu JW, Buka SL, McCormick MC, et al. Behavioral problems and the effects of early intervention on eight-year-old children with learning disabilities. Matern Child Health J 2006;10(4):329-38.
- Zelkowitz P, et al. Anxiety affects the relationship between parents and their very low birth weight infants. Infant Mental Health Journal 2007;28(3):296-313.
- Zelkowitz P, Papageorgiou A, Bardin C, et al. Persistent maternal anxiety affects the interaction between mothers and their very low birthweight children at 24 months. Early Hum Dev 2009;85(1):51-8.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-08-2014
Beoordeeld op geldigheid : 01-01-2013
De richtlijn heeft een geldigheidsduur van vijf jaar na implementatie, tenzij nieuwe ontwikkelingen of wetenschappelijk onderzoek noodzaak geven de richtlijn eerder te wijzigen en te actualiseren.
Algemene gegevens
Financiering
Deze richtlijn is tot stand gekomen met financiële steun van ZonMw in het kader van het programma 'Richtlijnen Jeugdgezondheid'.
Samenvatting, overzichtskaart en foldertekst ouders
Er is een handzame samenvatting van de richtlijn ontwikkeld die geraadpleegd kan worden binnen de dagelijkse JGZ-praktijk. De richtlijn kan dan als naslagwerk dienen waarbinnen achtergrond en nadere informatie opgezocht kunnen worden. Ook is een overzichtskaart ontwikkeld, die op een A4 een kort overzicht geeft van de belangrijkste punten binnen de richtlijn. Daarnaast is een foldertekst voor ouders ontwikkeld, die aansluit op de aanbevelingen binnen deze richtlijn.
Doel en doelgroep
Het doel van de richtlijn is allereerst het optimaliseren van de (na)zorg aan risicopasge- borenen en hun ouders door middel van uniforme begeleiding en advisering, signalering van mogelijke problemen en tijdige doorverwijzing. Het uiteindelijke doel is het voorkómen van (secundaire) gezondheids- en ontwikkelingsschade en het op tijd inzetten van gepaste interventies. Om de continuïteit te waarborgen in de (na)zorg voor vroeg en/ of SGA geboren kinderen en hun ouders zijn goede afspraken noodzakelijk tussen JGZ, kinderartsen (follow-uppoliklinieken) en huisartsen. De richtlijn maakt hiertoe gebruik van het rapport van de NVK en AJN 'Samenwerken en afstemmen' (NVK, AJN, 2009) en van verschillende lokale of regionale protocollen.
Daarnaast is een belangrijk doel van de richtlijn het vergroten van de kennis van zorgverleners in de JGZ (0-4 jaar) omtrent risicopasgeborenen en de nazorg.
De JGZ-richtlijn 'Te vroeg en/of small for gestational age (SGA) geboren kinderen' is primair bedoeld voor (jeugd)artsen, (jeugd)verpleegkundigen, verpleegkundig specialisten en doktersassistenten werkzaam in de JGZ (vooral met de doelgroep 0-4 jaar). De richtlijn is tevens bestemd voor andere professionals die betrokken zijn bij de nazorg van vroeg en/ of SGA geboren kinderen en hierin samenwerken met de JGZ. Hierbij zijn voornamelijk de overdracht door de kinderarts aan de JGZ en de eventuele overdracht vanuit de JGZ 0-4 jaar aan de JGZ 4-19 jaar van belang, evenals de communicatie en terugverwijzing vanuit de JGZ naar de kinderarts.
Samenstelling werkgroep
Participerende verenigingen/organisaties
- Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Artsen Jeugdgezondheidszorg Nederland (AJN)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Vereniging van Ouders van Couveusekinderen (VOC)
- Nederlandse Vereniging van Doktersassistenten (NVDA)
- Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV)
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Nederlandse vereniging van pedagogen en onderwijskundigen (NVO)
- Nederlands Instituut van Psychologen (NIP)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Nederlandse Vereniging van Revalidatieartsen (VRA)
- Nederlandse Vereniging van Maatschappelijk Werkers (NVMW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
Bij de ontwikkeling van de richtlijn is gewerkt met een kerngroep en een werkgroep.
De kerngroep is een kleine groep, die het uitvoerende werk heeft gedaan. Hierin zijn de jeugdgezondheidszorg en de kindergeneeskunde vertegenwoordigd, met daarbij tevens de belangrijkste aanpalende disciplines.
De werkgroep is een brede groep, waarin alle betrokken organisaties vertegenwoordigd zijn. Deze is ingesteld om de producten van de kerngroep te becommentariëren. De brede werkgroep is op een aantal momenten gedurende het hele proces van richtlijnontwikkeling betrokken geweest: bij het vaststellen van de uitgangsvragen en voor commentaar van de conceptrichtlijn in verschillende stadia. Betrokkenheid van de werkgroep heeft tevens als doel het creëren van draagvlak.
TNO en de Orde van Medisch Specialisten (OMS) traden op als adviseurs en hebben de organisatie en de wetenschappelijke onderbouwing van deze richtlijn verzorgd.
Werkgroep
- Mw. S.P. Verloove-Vanhorick (voorzitter)
- Mw. N. Heerdink, arts maatschappij en gezondheid (AJN)
- Mw. H. Duys, nurse-practitioner jeugdgezondheidszorg (V&VN)
- Mw. S. Veen, kinderarts-neonatoloog (NVK)
- Mw. N.K.S. de Vries, kinderarts-neonatoloog (NVK)
- Mw. A.G. van Wassenaer-Leemhuis, kinderarts (NVK)
- Dhr. M. Hofkamp, kinderarts (NVK)
- Dhr. G. van Steenbrugge, directeur VOC Mw. D. Mooij-Kiebert (V&VN)
- Mw. Y. van Straten, doktersassistente jeugdgezondheidszorg (NVDA)
- Mw. M. Beentjes, verloskundige (KNOV)
- Mw. C. de Groot, gynaecoloog (NVOG)
- Dhr. D. Oepkes, gynaecoloog (NVOG)
- Mw. E. Sigmond, orthopedagoog (NVO)
- Mw. B. Houtzager, ontwikkelingspsycholoog (NIP)
- Mw. A. Janssen, kinderfysiotherapeut, fysiotherapiewetenschapper (KNGF)
- Dhr. W.J. IJspeert, kinderrevalidatiearts (VRA)
- Mw. S. Haafkes, maatschappelijk werkster (NVMW)
- Mw. S. de Groot, (pre)logopedist (NVLF)
Kerngroep
- Mw. S.P. Verloove-Vanhorick (voorzitter)
- Mw. N. Heerdink, arts maatschappij en gezondheid (AJN)
- Mw. H. Duys, nurse-practitioner jeugdgezondheidszorg (V&VN)
- Mw. S. Veen, kinderarts-neonatoloog (NVK)
- Mw. N.K.S. de Vries, kinderarts-neonatoloog (NVK)
- Mw. A.G. van Wassenaer-Leemhuis, kinderarts (NVK)
- Dhr. M Hofkamp, kinderarts (NVK)
- Dhr. G. van Steenbrugge, directeur VOC Mw. D. Mooij-Kiebert (V&VN)
Methode ontwikkeling
Evidence based
Implementatie
Hulpmiddelen voor implementatie
Op basis van de (concept)richtlijn werden kernelementen en meetbare proces-indica- toren opgesteld voor gebruik in het vervolgtraject van proefimplementatie, effectonderzoek en evaluatie, en voor het registreren in het elektronische dossier.
Proefimplementatie
Er heeft een regionale proefimplementatie van de conceptrichtlijn plaatsgevonden in Amsterdam, waar zes JGZ-teams van de GGD Amsterdam deelnamen uit de omgeving van de twee deelnemende ziekenhuizen (het Onze Lieve Vrouwe Gasthuis en het Sint Lucas Andreas Ziekenhuis). De proefimplementatie liep van februari tot mei 2012. Over de ervaringen van de JGZ en ziekenhuizen met het werken met de richtlijn is een TNO- rapport geschreven. Vervolgens is de richtlijn aangepast.
Werkwijze
Bij het uitwerken van de inhoud van de richtlijn en het beantwoorden van de uitgangs- vragen is waar mogelijk gebruikgemaakt van bewijs verkregen uit wetenschappelijk onderzoek. Waar (nog) geen wetenschappelijk bewijs gevonden werd, is uitgegaan van best practice en van de mening van de deskundigen uit de kern- en werkgroep.
Literatuuronderzoek
Aan de hand van specifieke zoektermen werd met hulp van de informatiespecialisten van TNO Child Health en de Orde van Medisch Specialisten gezocht naar gepubliceerde wetenschappelijke studies in de elektronische database Medline en voor één uitgangsvraag ook in PsycINFO. De literatuursearch richtte zich op de periode 2000 tot 2010. Indien nodig werd aanvullend gezocht naar studies. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCT's). Bij afwezigheid van RCT's werd verder gezocht naar prospectieve vergelijkende gecontroleerde onderzoeken en prospectieve niet-vergelijkende onderzoeken. De taal werd gelimiteerd tot Nederlands en Engels, tenzij anders vermeld (voor de zoekstrategieën zie aanverwant product 'Literatuursearch'.
De gevonden literatuur is aan een uitgangsvraag toegekend door op de trefwoorden van de artikelen te zoeken. Hieruit volgde per uitgangsvraag een lijst met abstracts. Per uitgangsvraag zijn de abstracts door twee kerngroepleden beoordeeld op relevantie voor het beantwoorden van de uitgangsvraag. Dit resulteerde in een overzichtstabel per uitgangsvraag, die vervolgens is besproken met de kerngroepleden. De geselecteerde artikelen zijn beoordeeld op hun methodologische kwaliteit. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. Nadat het literatuuronderzoek heeft plaatsgevonden zijn nog artikelen gepubliceerd die relevant waren voor deze richtlijn (vanaf 2010) of toegevoegd op advies van de werkgroep. Deze zijn beoordeeld op relevantie en volgens onderstaande EBRO-methode en vervolgens alsnog toegevoegd aan deze richtlijn.
Beoordeling van literatuur werd gedaan aan de hand van de EBRO-methode. Individuele studies werden beoordeeld op onderzoeksopzet/design. Naar aanleiding van deze beoordeling werd het bewijsniveau van studies bepaald volgens de classificatie in tabel 1 en 2.
Tabel 1. EBRO-indeling van de kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade/bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau. |
||
|
A2 |
Gerandomiseerd dubbel-blind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang. |
Onderzoek ten opzichte van een referentietest (een 'gouden standaard') met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad. |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor 'confounding' en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controle onderzoek, cohort-onderzoek). |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd. |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiënt-controle onderzoek. |
|
C |
Niet-vergelijkend onderzoek. |
||
|
D |
Mening van deskundigen. |
||
Tabel 2. Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau Al of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2. |
|
2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B. |
|
3 |
1 onderzoek van niveau B of C. |
|
4 |
Mening van deskundigen. |
Knelpuntenanalyse: focusgroepen
De ontwikkeling van de richtlijn startte met een knelpuntenanalyse door middel van diverse focusgroep gesprekken met zowel de Vereniging van Ouders van Couveusekin- deren (VOC) als met zorgverleners. De resultaten uit focusgroep gesprekken met ouders van te vroeg geboren kinderen over de knelpunten bij de (na)zorg van hun kind zijn daarbij gebruikt (Van der Pal & Buitendijk 2009). Daarnaast zijn in november 2009 twee aanvullende focusgroep gesprekken met vertegenwoordigers uit diverse disciplines gehouden. Het eerste gesprek vond plaats met afgevaardigden namens de KNGF, AJN, NIP, V&VN, NVO, NVMW en NVLF (logopedisten). Het tweede focusgroep gesprek vond plaats met afgevaardigden van de NVK (kinderartsen), KNOV (verloskundigen) en NVLF (logopedisten). De knelpunten zijn samengevat en de uitgangsvragen van de richtlijn zijn hieraan aangepast.
Consensusvorming: Synmind
Op twee momenten in het ontwikkelingstraject is gebruikgemaakt van Synmind, een webbased methode voor discussie en consensusvorming (modified Delphi-methode), met als doel het proces van consensusvorming tussen de werkgroepleden transparant en gestructureerd te laten verlopen. Met behulp van Synmind werden werkgroepleden binnen een periode van enkele weken geconsulteerd over de door de kerngroep voorgestelde uitgangsvragen (eerste ronde) en conceptaanbevelingen (tweede ronde).
Via Synmind konden werkgroepleden hun mening geven en op elkaar reageren. Deze werkwijze maakt de manier waarop de aanbevelingen tot stand komen meer transparant en gestructureerd: reacties van experts staan op schrift en worden bewaard. Doordat deelnemers op een kwantitatieve schaal aangaven in hoeverre zij het eens waren met een aanbeveling en dit grafisch werd weergegeven (spinnenwebgrafieken), was in één oogopslag te zien in welke mate er consensus bestond over een uitgangsvraag of aanbeveling. Op deze manier konden snel die uitgangsvragen of aanbevelingen worden geïdentificeerd waarvoor breed draagvlak bestond en die welke aanpassing behoefden. Omdat deelnemers hun score motiveerden met argumenten, was ook direct zichtbaar waarom deelnemers het al dan niet eens waren met een aanbeveling. Op basis van de resultaten van deze consultatie werden de uitgangsvragen en aanbevelingen bijgesteld.
De samenvatting van de Synmind-discussie is op te vragen bij de afdeling Ondersteuning Professionele Kwaliteit van de Orde van Medisch Specialisten.
Commentaarronde
De richtlijn is ter becommentariëring voorgelegd aan de deelnemende beroepsgroepen en de patiëntenorganisatie (VOC). De commentaren zijn door de werkgroep verwerkt.
