Organisatie van Zorg
Uitgangsvraag
Hoe dient de zorg voor kinderen met neonatale cholestase te worden georganiseerd?
De uitgangsvraag omvat de volgende deelvragen:
- Hoe dient de zorgketen georganiseerd te zijn voor neonaten of zuigelingen met ontkleurde ontlasting?
- Hoe dient de zorgketen georganiseerd te zijn voor kinderen die na de derde levensweek geel zijn?
Aanbeveling
- Screen alle neonaten met de ontlastingskleurenkaart voor vroegherkenning van een cholestatische leverziekte.
- Verwijs een baby die jonger is dan 3 weken en ontkleurde ontlasting heeft rechtstreeks naar de kinderarts.
- Verricht bloedonderzoek naar de directe bilirubinefractie bij elke baby van 3 weken of ouder met ontkleurde ontlasting, onafhankelijk of het kind borstvoeding of flesvoeding krijgt. Verwijs met spoed naar de kinderarts in het geval van een verhoogde directe bilirubinefractie (>20% bij totaal bilirubine >50 µmol/L).
- Verricht bloedonderzoek naar de directe bilirubinefractie bij elke baby met persisterende geelzucht op de leeftijd van 3 weken. Verwijs naar de kinderarts in het geval van een afwijkende uitslag (directe bilirubinefractie >20% bij totaal bilirubine >50 µmol/L)
- Neem direct contact op met een kinderarts MDL in het regionale UMC wanneer een zuigeling met persisterende geelzucht of ontkleurde ontlasting een directe hyperbilirubinemie heeft.
- Bespreek de timing en inhoud van het verdere diagnostische plan
- Zorg dat verloskundigen, kraamverzorgsters, de jeugdgezondheidszorg, huisartsen en kinderartsen geïnformeerd zijn over deze richtlijn.
Overwegingen
Welke aanpassingen in de zorgketen kunnen helpen om de leeftijd waarop de Kasai operatie plaatsvindt te verlagen?
1. Screening van alle neonaten met behulp van de ontlastingskleurenkaart
1a. Verwachte voordelen t.o.v. de huidige situatie:
Gebruik van de ontlastingskleurenkaart kan leiden tot het eerder herkennen van een galafvloedbelemmering. Daarnaast kan implementatie van de ontlastingskleurenkaart ouders, jeugdverpleegkundigen, jeugdartsen en huisartsen bewust maken van het fenomeen cholestase.
1b. Nadelen:
Gebruik van de ontlastingskleurenkaart bij alle neonaten zal gepaard gaan met aanzienlijke aantallen fout-positieve en fout-negatieve testuitslagen. Een deel van deze foutieve uitslagen is het gevolg van het beoordelen van een ontlastingsfoto of van luiers bij kunstlicht. Niet alleen dient de kleur van de ontlasting in de luier bij daglicht beoordeeld te worden, ook de kleurweergave van de ontlastingskleurenkaart (zowel op papier als op een beeldscherm) dient een kwaliteitseisen te voldoen.
2. Relevante subgroepen:
Normaal gekleurde ontlasting bij een gele baby met een leeftijd ≥ 3 weken ontslaat de professional niet om bloedonderzoek te (laten) verrichten ter identificatie van directe hyperbilirubinemie
3. Bewijskracht van de literatuur:
Zeer laag.
4. Patiëntenperspectief:
De screeningsmethode aan de hand van de ontlastingskleurenkaart is pijnloos, eenvoudig en snel. Vanwege de lage prevalentie van neonatale cholestase zal een vals-positieve testuitslag regelmatig voorkomen. In dat geval zullen ouders onnodig ongerust gemaakt zijn. Bij een vals-negatieve testuitslag is er onterechte geruststelling en treedt er vertraging op in het stellen van de juiste diagnose.
5. Oordeel van de werkgroep:
Implementatie van de ontlastingskleurenkaart leidt tot grotere bewustwording bij ouders en zorgverleners van het ziektebeeld neonatale cholestase. Gebruik de ontlastingskleurenkaart in de eerste drie weken na de geboorte. Elk kind <3 weken met ontkleurde ontlasting en elk geel kind op de leeftijd van 3 weken dient bloedonderzoek te ondergaan ter identificatie van directe hyperbilirubinemie. Deze strategie kan leiden tot een snellere herkenning van neonatale cholestase en tot een snellere verwijzing. Zowel de jeugdarts als de huisarts kunnen een zuigeling naar de kinderarts verwijzen.
6. Kosten:
De kosten van het drukken van een kaart of van het toevoegen van de digitale versie aan het online CB-dossier zullen laag zijn. Kinderen met een vals-positieve uitslag worden naar de tweedelijn verwezen waar dan kosten gemaakt worden voor het verrichten van bloedonderzoek. Aan de andere kant zal een vroegere verwijzing leiden tot het eerder diagnosticeren van neonatale cholestase en, in geval van galgangatresie, eerder uitvoeren van de Kasai operatie en mogelijk tot langer overleven met de eigen lever. Een dure en ingrijpende levertransplantatie wordt daarmee mogelijk jaren uitgesteld. De verwachte voordelen zullen waarschijnlijk opwegen tegen de kosten die gemoeid gaan met de implementatie van de ontlastingskleurenkaart.
7. Aanvaardbaarheid:
De screeningsmethode is aanvaardbaar. Het gaat om circa 180.000 zuigelingen per jaar.
8. Haalbaarheid:
De ontlastingskleurenkaart kan toegevoegd worden aan het groeiboekje, het online CB-dossier of aan een app. Elk kind wordt op de leeftijd van twee weken bij een huisbezoek door de jeugdverpleegkundige gezien. Tijdens dat bezoek kan de verpleegkundige met de ouders aandacht schenken aan de ontlastingskleurenkaart.
9. Eindoordeel:
Sterke aanbeveling voor (Doen).
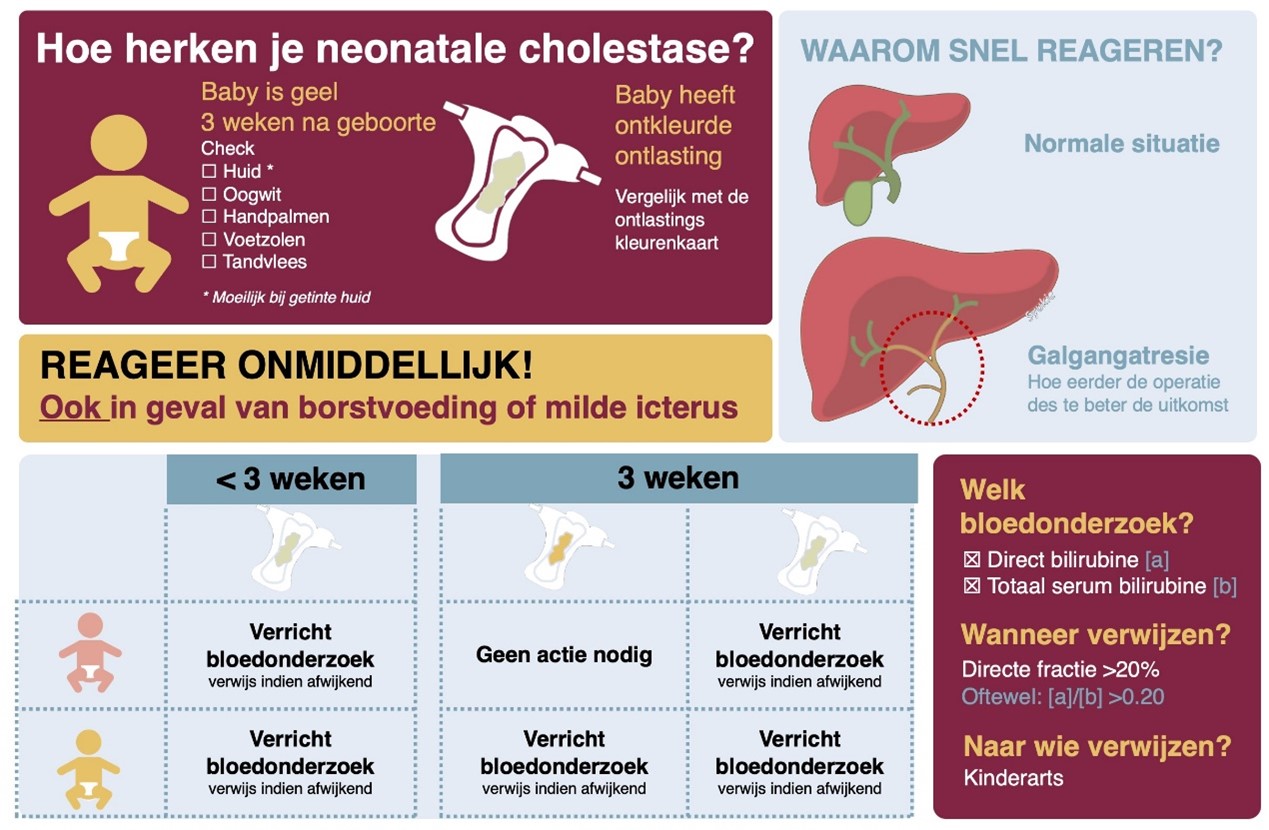
Figuur 2 | Vroege herkenning van neonatale cholestase
Infographic voor de jeugdgezondheidszorg en huisartsen
2. Bloedonderzoek bij elke gele baby op de leeftijd van 3 weken, ongeacht of het moedermelk of kunstvoeding krijgt, en ongeacht de kleur van de ontlasting.
1a. Verwachte voordelen t.o.v. de huidige situatie:
Aan de hand van bloedonderzoek (de directe bilirubinefractie)
>0,20
kan op betrouwbare wijze onderscheid worden gemaakt tussen indirecte en directe hyperbilirubinemie. Met deze methode worden geen kinderen met cholestase gemist. In de meeste gevallen zullen ouders van borstgevoede gele baby’s na het bekend worden van de bloeduitslag gerustgesteld kunnen worden. Een positieve testuitslag, d.w.z. een directe hyperbilirubinemie, moet leiden tot een snelle verwijzing naar de tweedelijn, waarmee een aanzienlijke gezondheidswinst behaald kan worden.
Verduidelijking betreffende directe en geconjugeerde bilirubinebepaling: Met de directe bilirubinefractie wordt beoogd het gedeelte van het totaal bilirubine weer te geven dat bestaat uit geconjugeerd bilirubine. In Nederland wordt echter niet rechtstreeks het "geconjugeerde" bilirubine bepaald maar wel het "directe" bilirubine, dat grotendeels (maar niet volledig) overeenkomt met geconjugeerd bilirubine. Het is daarom gebruikelijk om een direct bilirubinefractie van meer dan 20% van totaal bilirubine te beschouwen als een geconjugeerde (en dus pathologische) hyperbilirubinemie. De werkgroep is van mening dat deze “20% regel” pas relevant is wanneer de totale bilirubine concentratie tenminste 50 µmol/l bedraagt.
1b. Nadelen:
Lage prevalentie van cholestase. Vinger- of hielprikafname is niet bij elk priklab mogelijk.
2. Relevante subgroepen:
Bij kinderen met een gepigmenteerde huid is het herkennen van geelzucht lastig. Kijk in dergelijke situaties naar de kleur van het tandvlees nadat er gedurende 3 seconden op gedrukt is, of naar de kleur van de sclerae (oogwit).
3. Bewijskracht van de literatuur:
Zeer laag
4. Professioneel perspectief:
Alle gele baby’s met directe hyperbilirubinemie hebben recht op een snelle verwijzing naar de kinderarts. Een minderheid van de verwezen kinderen zal galgangatresie blijken te hebben, maar bij de andere kinderen zal naar alle waarschijnlijkheid een andere vorm van neonatale cholestase gediagnosticeerd worden. In theorie kunnen zowel de jeugdarts als de huisarts een zuigeling voor een bloedafname doorsturen naar het priklab. Bij beide routes dient het principe gewaarborgd te worden dat een directe hyperbilirubinemie tijdig herkend wordt en leidt tot snelle verwijzing door de aanvrager van het bloedonderzoek naar de tweedelijn, de kinderarts. Met “snelle verwijzing” wordt bedoeld dat het kind binnen 2 werkdagen door een kinderarts wordt beoordeeld.
5. Patiëntenperspectief:
Persisterende geelzucht op de leeftijd van drie weken is altijd reden voor bloedonderzoek, ongeacht of het kind flesvoeding of moedermelk krijgt en ongeacht de overige klinische conditie van het kind. Bij zuigelingen die vanaf de geboorte flesvoeding hebben gekregen is persisterende geelzucht zeldzaam en blijkt een hoog percentage een onderliggend gezondheidsprobleem te hebben. Bij kinderen die met moedermelk gevoed zijn is persisterende geelzucht meestal een indirecte hyperbilirubinemie en daarbij meestal onschuldig van aard (borstvoeding-geassocieerde icterus). Voor het onderscheid met cholestatische kinderen is bloedonderzoek noodzakelijk. De vraag is of het acceptabel wordt gevonden dat er jaarlijks 9000 gele borstgevoede baby’s geprikt moeten worden om circa 50 kinderen met neonatale cholestase in een vroeg(er) stadium te diagnosticeren en te behandelen. Met andere woorden, er moeten 180 gele borstgevoede kinderen geprikt worden om 1 geval met neonatale cholestase eerder te herkennen (= number needed to screen, NNS). Ter vergelijking: voor de neonatale hielprikscreening moet er jaarlijks bij 180.000 pasgeborenen bloed afgenomen worden om 133 kinderen met een metabole of endocriene stoornis op een vroeg tijdstip te identificeren (NNS 1353:1).[2]
6. Oordeel van de werkgroep:
Bloedonderzoek bij zuigelingen die op de leeftijd van drie weken nog geel zijn levert voor kinderen met galgangatresie of andere vormen van neonatale cholestase een aanmerkelijke gezondheidswinst op. Fout-positieve en fout-negatieve testuitslagen zullen nauwelijks voorkomen, en de negatieve gevolgen van een bloedafname zijn gering.
7. Kosten:
Het laten prikken van iedere gele baby met een leeftijd van 3 weken zal leiden tot een kostentoename ten opzichte van de huidige situatie. Vroege herkenning van cholestase aan de hand van het screenende bloedonderzoek leidt tot het eerder verrichten van de Kasai operatie en mogelijk tot langer overleven met de eigen lever, en dus met het uitstellen van een levertransplantatie. De verhouding tussen de kosten die gemoeid gaan met het correct volgen van deze aanbeveling en de kostenbesparing door vroeg herkenning van neonatale cholestase is niet goed te voorspellen.
8. Aanvaardbaarheid:
De screeningsmethode is aanvaardbaar. Het gaat jaarlijks om circa 9000 moedermelk drinkende zuigelingen (zie figuur 1) en minder dan 100 zuigelingen die artificiële voeding krijgen.
9. Haalbaarheid:
Elk kind wordt op de leeftijd van vier weken door een jeugdarts onderzocht. Als de ouders de geelzucht zelf nog niet hebben opgemerkt dan kan dit reguliere consult als vangnet dienen.
10. Eindoordeel:
Sterke aanbeveling voor (Doen).
3. Contact opnemen met een kinderarts MDL in een UMC
1a. Verwachte voordelen t.o.v. de huidige situatie:
Wanneer een zuigeling vanwege persisterende geelzucht of ontkleurde ontlasting naar de kinderarts is verwezen, dient bloedonderzoek ingezet te worden naar de etiologie van de afwijking. Om af te stemmen op welke manier het snelste belangrijke uitslagen verkregen kunnen worden wordt geadviseerd contact op te nemen met een kinderhepatologisch centrum. In dit overleg kan dan worden besproken de snelste diagnostiek naar bijvoorbeeld structurele galwegafwijkingen, CF, panhypopituarisme, hypocortisolisme en hypothyreoïdie. Indien galgangatresie niet uitgesloten kan worden op basis van deze onderzoeken is het uitvoeren van een leverbiopsie op korte termijn gerechtvaardigd.
1b. Nadelen:
Niet van toepassing.
2. Relevante subgroepen:
Kinderen met een directe hyperbilirubinemie en gekleurde ontlasting, waarvoor geen andere etiologische verklaring gevonden kan worden, dienen eveneens een leverbiopsie te ondergaan.
3. Bewijskracht van de literatuur:
Geen studies beschikbaar.
4. Professioneel perspectief:
Alle cholestatische baby’s hebben recht op een snelle verwijzing naar een kinderhepatologisch centrum voor het ondergaan van een leverbiopsie, tenzij er onderweg een verklarende diagnose wordt gevonden.
5. Patiëntenperspectief:
Niet relevant.
6. Oordeel van de werkgroep:
Kinderen die uiteindelijk galgangatresie blijken te hebben, hebben een duidelijk voordeel bij een snelle verwijzing naar een kinderhepatologisch centrum.
7. Kosten:
Niet van toepassing.
8. Aanvaardbaarheid:
Het gaat jaarlijks om zo’n 30 kinderen die vanwege een verdenking op galgangatresie verwezen moeten worden naar een kinderhepatologisch centrum.
9. Haalbaarheid:
In de praktijk laten met name de uitslag van het alfa-1-antitrypsine in het serum en het cholestase panel lang op zich wachten. De overige diagnostiek zou in drie dagen afgerond moeten kunnen zijn.
10. Eindoordeel:
Sterke aanbeveling voor (Doen).
4. Deze richtlijn onder de aandacht brengen bij alle schakels in de keten van zorg voor neonatale cholestase
Oordeel van de werkgroep:
Deze richtlijn kan uitgewerkt worden tot publicaties in het Nederlands Tijdschrift voor Geneeskunde en Huisarts & Wetenschap. Daarnaast zou er vanuit de website BabyZietGeel.nl doorgelinkt kunnen worden naar deze richtlijn. Tenslotte is er op het jaarlijkse NVK-congres altijd een gezamenlijke dag voor jeugdartsen en kinderartsen, waar deze richtlijn ook onder de aandacht gebracht kan worden.
Onderbouwing
Achtergrond
Cholestase is een symptoom van een aantal relatief zeldzame, maar ernstige leverziekten bij jonge zuigelingen die vaak (maar niet altijd!) gekenmerkt worden door een directe hyperbilirubinemie. Eén van de cholestatische leverziekten is galgangatresie, waarbij er geen afvloed van gal naar de darm is en de ontlasting dientengevolge ontkleurd is. Indien onbehandeld, leidt galgangatresie op jonge leeftijd tot leverfalen en de noodzaak tot levertransplantatie. Vroege herkenning van cholestatische leverziekten is belangrijk om bedreigingen door vetmalabsorptie, zoals slechte groei en bloedingen door een vitamine K afhankelijke stollingsstoornis, te kunnen voorkomen en behandelen.
Bij het vermoeden op galgangatresie is een tijdige verwijzing naar het Universitair Medisch Centrum Groningen (UMCG) noodzakelijk om de kans op het welslagen van de hepatoportoenterostomie volgens Kasai te vergroten. Als de galafvloed vanuit de darm chirurgisch hersteld kan worden zal het serumbilirubine dalen, de cholestase afnemen, de ontlasting weer gekleurd zijn en kan het moment dat een levertransplantatie nodig zal zijn mogelijk jaren uitgesteld worden. Retrospectieve data suggereren dat hoe eerder na de geboorte een Kasai operatie uitgevoerd wordt, des te beter de uitkomsten van deze operatie [1].
Het probleem in de huidige situatie
De helft van de zuigelingen met galgangatresie ondergaat in Nederland een Kasai operatie na de 60ste levensdag. Het gevolg is dat het succespercentage van deze operatie suboptimaal is, en dat kinderen met galgangatresie daardoor op jongere leeftijd een levertransplantatie moeten ondergaan.
De leeftijd waarop de Kasai operatie wordt uitgevoerd kan verlaagd worden wanneer (1) baby’s jonger dan 3 weken met ontkleurde ontlasting, en (2) baby’s met persisterende geelzucht op de leeftijd van 3 weken herkend worden als situaties die om onverwijlde actie vragen. Bij ontkleurde ontlasting gaat het om een directe verwijzing naar de kinderarts, terwijl er bij persisterende geelzucht direct bloedonderzoek moet worden verricht ter identificatie van directe hyperbilirubinemie. Directe hyperbilirubinemie is altijd pathologisch en vereist eveneens een verwijzing naar de kinderarts voor nadere analyse.
Knelpunten
- Ouders hebben vaak geen referentie voor een normale neonatale ontlastingskleur (zeker als het hun eerste kind betreft)
- Omdat een meerderheid van de baby’s met persisterende geelzucht na de derde levensweek onschuldige borstvoeding-geassocieerde icterus zal hebben, bestaat het beleid van zorgverleners in de nulde- en eerstelijn meestal uit geruststellen en afwachten, zowel bij borstgevoede als ook bij flesgevoede zuigelingen.
- Er zijn signalen dat milde icterus of afnemende icterus op de leeftijd van drie weken en/of borstvoeding redenen zijn om geen bloedonderzoek te verrichten. Deze redenen zijn onterecht.
- Vanwege het laagfrequente voorkomen van neonatale cholestase zijn huisartsen niet bekend met het aanvragen van de directe bilirubinefractie.
- Er is onduidelijkheid over de definitie van directe hyperbilirubinemie, hetgeen voortkomt uit de BabyZietGeel richtlijn. Daarin staat vermeld dat de diagnose neonatale cholestase kan worden gesteld bij een concentratie direct bilirubine > 10 µmol/l of een directe bilirubinefractie >20% van totale serumbilirubine concentratie (TSB).
- Het beeld dat er jaarlijks 9000 gele borstgevoede baby’s geprikt moeten worden om 10 baby’s met galgangatresie op een jongere leeftijd te opereren zet ouders en zorgverleners op het verkeerde been. Naast de 10 met galgangatresie zijn er namelijk nog 40 met een andere vorm van cholestase die ook baat hebben bij vroege herkenning (zie figuur 1).
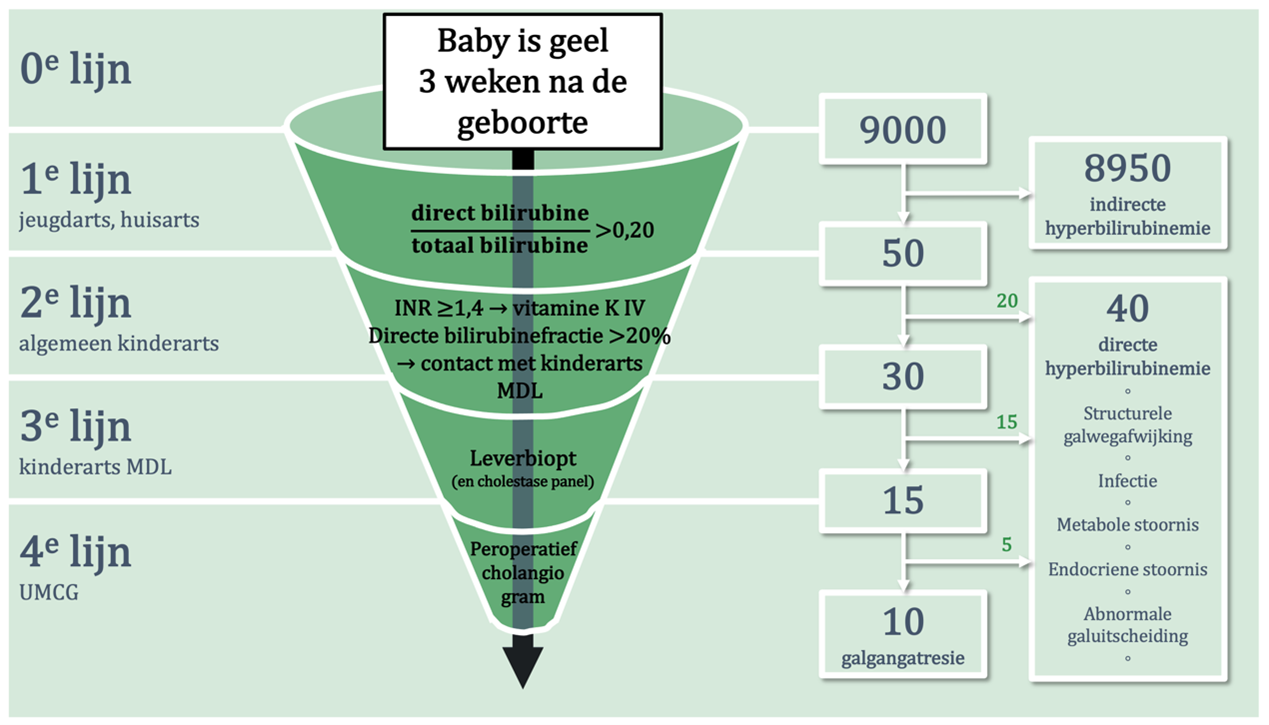
Figuur 1 | Neonatale cholestase zorgketen
Jaarlijks zullen naar schatting 9000 gele baby’s bloedonderzoek krijgen om bij 50 van hen directe hyperbilirubinemie te kunnen vaststellen. Het streven is om bij deze baby’s binnen een week de noodzakelijke diagnostiek in eerste-, tweede- en zo nodig derdelijn af te ronden om circa 10 kinderen met galgangatresie en 40 kinderen met een andere vorm van neonatale cholestase zo vroeg mogelijk te kunnen herkennen en behandelen. In het geval van galgangatresie is dit opereren.
Samenvatting literatuur
Er is geen systematische literatuuranalyse verricht.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is geen systematische literatuuranalyse verricht, omdat deze uitgangsvraag logischerwijs niet in een RCT kan worden onderzocht. Deze vraagstelling heeft betrekking op afspraken die tussen zorgverleners gemaakt moeten worden om de zorg voor kinderen met neonatale cholestase zo effectief en veilig mogelijk te maken. Internationale literatuur is niet zonder meer van toepassing op de Nederlandse situatie. Bovendien zal de effectiviteit van verschillende organisatiestructuren enkel relevant zijn wanneer zij zorg hebben verleend volgens de in deze richtlijn gestelde aanbevelingen. Omdat het onwaarschijnlijk is, is besloten om geen systematische analyse van de literatuur uit te werken.
Referenties
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 22-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten bij wie diagnostiek naar galgangatresie plaatsvindt.
Samenstelling van de werkgroep
- Prof. dr. H.J. (Henkjan) Verkade, kinderarts- MDL, werkzaam in het Universitair Medisch Centrum Groningen (Beatrix Kinderziekenhuis) te Groningen, NVK (voorzitter)
- Dr. P.F. (Patrick) van Rheenen, kinderarts-MDL, werkzaam in het Universitair Medisch Centrum Groningen (Beatrix Kinderziekenhuis) te Groningen, NVK (vicevoorzitter)
- Drs. J.M. (Jessica) Pruisen, fellowship MDL, werkzaam in het Universitair Medisch Centrum Groningen (Beatrix Kinderziekenhuis) te Groningen, NVK
- Prof. dr. C.D.M. (Clara) van Karnebeek, kinderarts en geneticus metabole ziekten, werkzaam in het Amsterdam UMC, NVK
- Dr. T.W. (Tjalling) de Vries, algemeen kinderarts (niet praktiserend). Indertijd werkzaam in het Medisch Centrum Leeuwarden, NVK
- Prof. dr. J.B.F. (Jan) Hulscher, chirurg, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvH
- Drs. C. (Carlijn) Frantzen, klinisch geneticus, werkzaam in het Universitair Medisch Centrum Groningen (Beatrix Kinderziekenhuis) te Groningen, VKGN
- Drs. C.A. (Lineke) Dogger, arts Maatschappij en Gezondheid, jeugdarts werkzaam bij NSPOH als opleider/adviseur, AJN
Samenstelling klankbordgroep
- J. (Janine) Pingen, St. Kind en Ziekenhuis
- Drs. J.A. (José) Willemse, directeur Nederlandse Leverpatiënten Vereniging
- Dr. V.M. (Victorien) Wolters, kinderarts-MDL, werkzaam in het Universitair Medisch Centrum Utrecht (Wilhelmina Kinderziekenhuis) te Utrecht, NVK
Met ondersteuning van:
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst – Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. (Mattias) Göthlin, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. S. (Sjoukje) van der Werf, medisch informatiespecialist, UMCG
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Werkgroep |
||||
|
Prof. dr. H.J. (Henkjan) Verkade |
Hoogleraar kindergeneeskunde/ Kinderarts Maag-, Darm- en Leverziekten
|
Consultancy voor Ausnutria, Albireo AB, Mirum, Friesland Campina, Vivet, lntercept, GMP-Orphan en Shire (elk op ad interim basis) |
n.v.t. |
Geen actie, genoemde nevenwerkzaamheden betreffen een andere aandoening en oudere leeftijdsgroep
|
|
Dr. P.F. (Patrick) van Rheenen |
Kinderarts-MDL |
Geen |
n.v.t. |
Geen actie
|
|
Drs. J.M. (Jessica) Pruisen |
Kinderarts-MDL |
Geen |
Geen |
Geen actie |
|
Prof. dr. C.D.M. (Clara) van Karnebeek |
Hoofd afdeling kindermetabole ziekten |
Programma directeur United for Metabolic Diseases (0,05fte betaald door St Metakids) |
n.v.t. |
Geen actie |
|
Dr. T.W. (Tjalling) de Vries |
Algemeen kinderarts |
Redactielid Praktische Pediatrie, waarvoor vergoeding wordt ontvangen. Mede auteur boeken, waarvoor royalties worden ontvangen |
Geen |
Geen actie, genoemde nevenwerkzaamheden betreffen een ander onderwerp
|
|
Prof. dr. J.B.F. (Jan) Hulscher |
Kinderchirurg UMCG, Hoogleraar Kinderchirurgie |
Voorzitter Nederlandse Vereniging voor Kinderchirurgie Algemeen Bestuurslid Nederlandse Vereniging |
Ik ben nauw betrokken bij de ontwikkeling en het uitrollen van de ontlasting kleurenkaart voor het screenen van neonatale cholestase. Deze kaart is initieel mede gefinancieerd door het zeldzame
|
Geen actie. Ontving geen betaling van Proctor & Gamble (Pampers) bij de ontwikkeling en het uitrollen van de ontlastingskleurenkaart
|
|
Drs. C. (Carlijn) Frantzen |
Klinisch Geneticus |
Geen |
Geen |
Geen actie |
|
Drs. C.A. (Lineke) Dogger |
Arts Maatschappij en Gezondheid |
Geen |
Geen |
Geen actie |
|
Klankbordgroep |
||||
|
J. (Janine) Pingen |
Junior Projectmanager en Beleidsmedewerker (tot 1-12-2020) |
Geen |
Geen |
Geen actie |
|
Mevr. R. (Rowy) Uitzinger |
Junior Projectmanager en Beleidsmedewerker (vanaf 1-12-2020) |
Geen |
Geen |
Geen actie |
|
Drs. J.A. (José) Willemse |
Directeur Nederlandse Leverpatiënten Vereniging
|
Zitting diverse experts commissies NASH (onbezoldigd)
|
Deelname aan de richtlijn zal hooguit positieve publiciteit bij de achterban opleveren. |
Geen actie |
|
Dr. V.M. (Victorien) Wolters |
Kinderarts-MDL, werkzaam in het Universitair Medisch Centrum Utrecht (Wilhelmina Kinderziekenhuis) te Utrecht, NVK |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers voor de invitational conference en het uitnodigen van afgevaardigden van patiëntenverenigingen in de klankbordgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Organisatie van Zorg |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een verdenking op galgangatresie. Ook zijn er knelpunten aangedragen door:
- Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Nederlandse Vereniging voor Heelkunde (NVVH)
- Vereniging Klinische Genetica Nederland (VKGN)
- NHG (Nederlands Huisartsen Genootschap)
- Jeugdartsen Nederland (AJN)
- Stichting Kind en Ziekenhuis
- Nederlandse Leverpatiënten Vereniging
- IGJ (Inspectie Gezondheidszorg en Jeugd)
- NFU (Nederlandse Federatie van Universitair Medische Centra)
- NVZ (Nederlandse Vereniging van Ziekenhuizen)
- Patiëntenfederatie Nederland
- STZ (Samenwerkende Topklinische opleidingsZiekenhuizen)
- V&VN (Verpleegkundigen & Verzorgenden Nederland)
- NAPA (Nederlandse Associatie Physician Assistants)
- ZiNL (Zorginstituut Nederland)
- ZKN (Zelfstandige Klinieken Nederland)
- ZN (Zorgverzekeraars Nederland) via een schriftelijke invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht. De gebruikte risk-of-bias instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
