Keuze tussen open en dubbelblinde provocatie
Uitgangsvraag
- Hoe vaak komen fout-positieve en ongewenste provocatie-uitkomsten voor en kunnen deze kansen vooraf worden geschat?
- Kan de kans op een overtuigend positieve uitkomst of negatieve uitkomst vooraf worden geschat?
Aanbeveling
Bij keuze tussen open en dubbelblinde provocatie:
Aanbeveling 1
Aanbevolen wordt om voor een dubbelblinde provocatie te kiezen wanneer er een redelijke kans is op een positieve of onbesliste uitkomst.
Aanbeveling 2
Te overwegen valt om voor een open provocatie te kiezen indien de kans op een negatieve uitkomst hoog wordt geschat.
Aanbeveling 3
Aanbevolen wordt om de diagnose voedselallergie niet te stellen op basis van een open provocatie die eindigde met subjectieve, milde objectieve, late klachten of klachten waarbij de aard van deze klachten niet passen bij de te verwachten reactie op dit allergeen. In dat geval wordt geadviseerd een dubbelblinde provocatie te laten volgen ter bevestiging van de uitkomst van de open provocatie.
Rationale aanbeveling 1
Omdat de kans op een onbesliste uitkomst en fout positieve uitkomst bij een DBPGVP kleiner is dan bij een OVP, heeft de dubbelblinde provocatie, de voorkeur boven de open provocatie. Bij een hoge kans op een onbesliste uitkomst is het advies altijd te kiezen voor een dubbelblinde provocatie. Situaties met een verhoogde kans op een onbesliste uitkomst zijn:
Wanneer anamnestisch de te verwachten klachten subjectief of niet overtuigend objectief zijn;
Wanneer de patiënt pre-existent eczeem heeft;
Wanneer de klachten later dan 2 uur na inname optraden;
Wanneer de patiënt angst heeft voor een reactie.
Er wordt vaak aangenomen dat de kans op een fout positieve uitkomst bij kinderen jonger dan 3 jaar een stuk kleiner is, omdat jonge kinderen zich nog niet bewust zijn van wat ze eten en subjectieve klachten minder gerapporteerd worden. Echter er is geen bewijs dat fout-positieve reacties vaker optreden bij kinderen jonger dan 3 jaar; integendeel één studie laat zien dat fout positieve uitkomsten zelfs iets vaker voorkwamen bij jonge kinderen. Er wordt dan ook niet geadviseerd op basis van de leeftijd de keuze tussen een OVP en een DBPGVP te maken. Figuur 4.1 geeft een beslisschema voor de keuze tussen OVP en DBPGVP.
Rationale aanbeveling 2
Door bij een grotere kans op een negatieve uitkomst initieel te kiezen voor een OVP, kan een aantal duurdere en arbeidsintensievere DBPGVP’s voorkomen worden. Een negatieve OVP sluit een allergie voldoende uit. Als een OVP eindigt met milde klachten wordt geadviseerd om op de OVP nog een DBPGPV te laten volgen. Besparing van tijd en kosten wordt echter alleen bereikt als slechts in een laag percentage DBPVGP-vervolgtesten nodig zijn. Om die reden wordt aanbevolen bij een redelijke kans op een positieve of onbesliste uitkomst te kiezen voor een dubbelblinde provocatie.
Situaties met een grote kans op een negatieve uitkomst zijn:
Als de patiënt op inname van een allergeen reageerde, maar niet gesensibiliseerd is voor dat allergeen. Provocaties met tarwe en koemelk dienen bij voorkeur altijd dubbelblind getest te worden, omdat patiënten aan deze allergenen vaak klachten toeschrijven als het opvlammen van eczeem en buikpijn. Deze klachten zijn niet typisch voor een allergische reactie. Bovendien is de ervaring dat huidtesten met soja en walnoot fout-negatief kunnen zijn; daarom verdienen dubbelblinde provocaties ook de voorkeur bij een anamnese verdacht voor walnoot- of soja-allergie;
Als de patiënt nooit een hazelnoot, amandel of pinda heeft gegeten, gesensibiliseerd is voor een van deze allergenen en de sensibilisatie verklaard kan worden door kruissensibilisatie.
Open provocaties zijn ook geschikt voor de follow up van een koemelk of kippenei allergie nadat initieel een dubbelblinde provocatie is gedaan. Alleen een negatieve uitkomst van de provocatie is dan relevant.
Rationale aanbeveling 3
Omdat aangetoond is dat subjectieve klachten en milde objectieve klachten frequent optreden op een placebo dosis wordt aangeraden nog een DBPGVP te laten volgen op een OVP eindigend met dergelijke klachten (zie figuur).
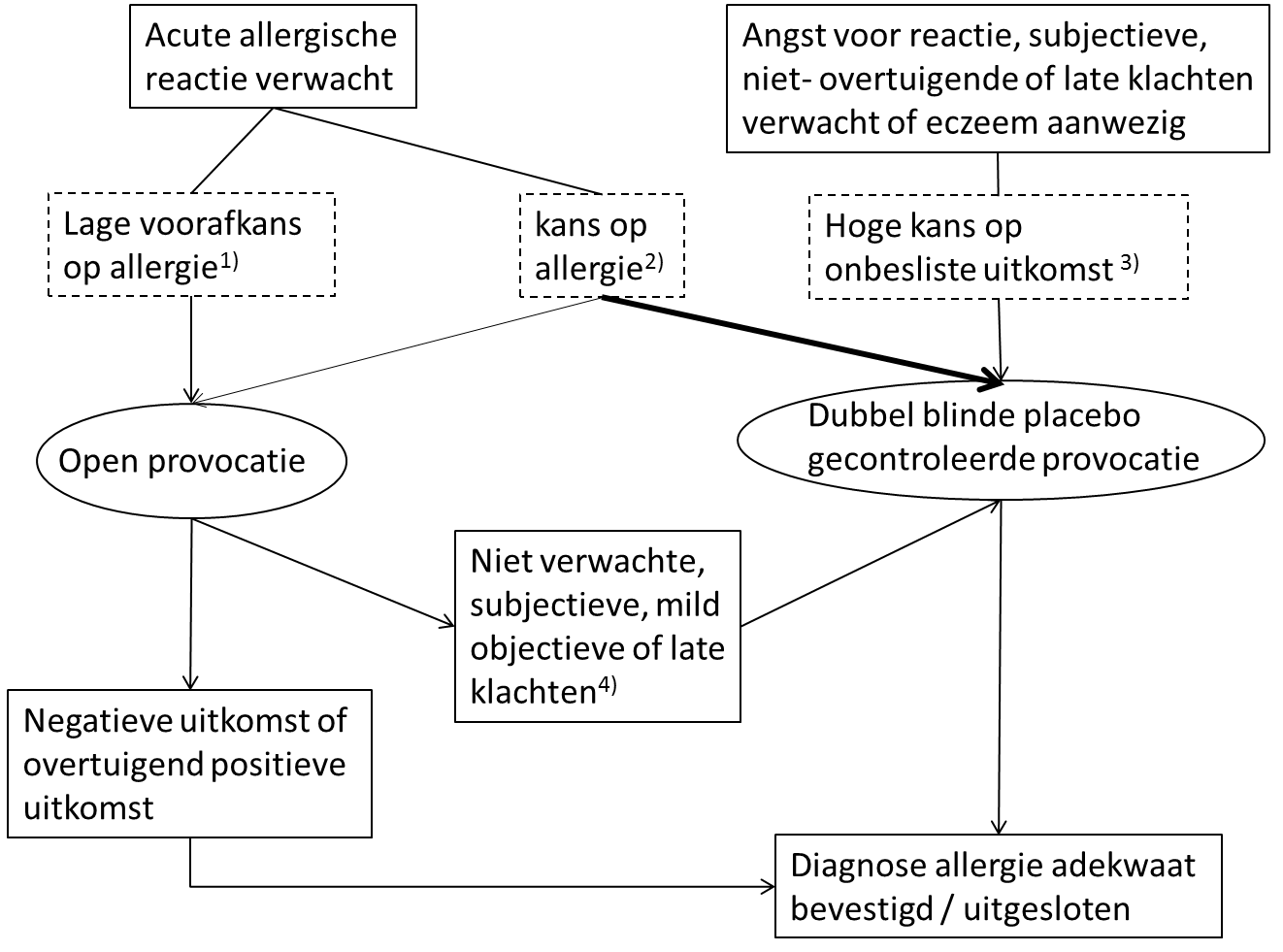
Beslisschema voor de keuze tussen OVP en DBPGVP
Toelichting bij beslisschema voor de keuze tussen OVP en DBPGVP
Ad 1. Situaties waarbij de voorafkans op allergie laag is:
Niet overtuigende reactie na inname en niet gesensibiliseerd;
Nooit ingenomen en sensibilisatie waarschijnlijk verklaard door kruissensibilisatie (profiline, PR10);
Lage sensibilisatie waarden voor veel allergenen bij atopische patiënt
Aanwijzingen dat kind tolerant is geworden voor koemelk of kippenei
Ad 2. Situaties met kans op allergie:
Als er een redelijke kans is op een allergische reactie dan ligt de voorkeur altijd bij een dubbelblinde provocatie om de kans op een fout negatieve uitkomst zo klein mogelijk te maken.
Ad 3. Situaties waarbij de voorafkans op een onbesliste uitkomst hoog is:
De te verwachten klachten zijn subjectief of niet overtuigend objectief of atypisch;
Bij aanwezigheid van eczeem;
Bij te verwachten klachten > 2 uur na inname;
Bij angst van de patiënt voor een reactie.
Ad 4: Bij een OVP eindigend met de volgende klachten wordt geadviseerd nog een DBPGPVP te doen omdat de uitkomst fout positief kan zijn:
Subjectieve en/of mild objectieve klachten;
Andere klachten dan verwacht op basis van de anamnese of de uitkomst van het sensibilisatie onderzoek;
Klachten later dan 2 uur na inname.
Overwegingen
Kwaliteit van bewijs
Er zijn enkel observationele studies gevonden die relevant bleken voor het beantwoorden van deze uitgangsvraag. De kwaliteit van het bewijs hiervan is niet beoordeeld.
Balans van voordelen en nadelen
Het lijkt logisch om altijd te kiezen voor een test met het laagste percentage ongewenste uitkomsten, dus de DBPGVP. Als men echter provocaties wil uitvoeren bij patiënten van wie men vermoedt dat zij niet allergisch zijn, dan kan men ook eerst kiezen voor een OVP. Er is dan een lage voorafkans (pretest probability) op een allergische reactie. Omdat in die situaties OVP’s vaak een negatief resultaat opleveren, kan men veel dure en arbeidsintensieve DBPGVP’s voorkomen. Als de uitkomst van de OVP onbeslist is, dan dient alsnog een DBPGVP verricht te worden. De keuze voor OVP als eerste test valt alleen te rechtvaardigen als daaropvolgende DBPGVP’s in de praktijk slechts in een laag percentage nodig blijken te zijn. Als de OVP positief uitvalt, zou de diagnose voedselallergie gesteld kunnen worden als de kans op een fout-positieve uitslag verwaarloosbaar is.
Keuze tussen OVP en DBPGVP
Om tot een goede aanbeveling te kunnen komen over de keuze tussen eerst OVP en direct DBPGVP, moet men zowel de voorafkans op een negatief of positief resultaat kunnen schatten als de kans op een onbesliste of fout-positieve uitkomst van de OVP. Als de kans op een fout-positief of onbeslist resultaat hoog wordt ingeschat, dan kan beter voor een DBPGVP gekozen worden. Als de kans op een negatief resultaat hoog wordt ingeschat, dan zou gestart kunnen worden met een OVP.
Patiëntperspectief en perspectief van de professional
Een fout-positieve provocatie bestempelt de patiënt ten onrechte als allergisch. Het gevolg is dat hij het allergeen vermijdt, wat bij allergenen als tarwe en melk het risico geeft op tekorten in de voeding, en angst kan hebben op een nieuwe reactie bij accidentele inname en op zoek moet naar dure alternatieven. Een onbesliste uitslag betekent dat de provocatie geen uitsluitsel biedt of de patiënt wel of niet allergisch is. Dit maakt dat de patiënt onzeker is en dat de test herhaald moet worden. Omdat de kans op deze ongewenste uitkomsten met een DBPGVP aanzienlijk lager is dan met een OVP, wordt aanbevolen een DBPGVP te doen wanneer de kans op een dergelijk ongewenste uitkomst groot wordt geacht.
Voordelen van de OVP boven de DBPGVP
- Bij een OVP wordt het voedingsmiddel in een pure, onbewerkte vorm toegediend. Als men kiest voor een DBPGVP, moet altijd nagegaan worden of de patiënt niet allergisch is voor een ander ingrediënt in het recept. Dan kan men namelijk niet gebruik maken van het gevalideerde recept; vaak is er geen alternatief gevalideerd recept voorhanden.
- Bij een DBPGVP bestaat de kans dat het allergeen door de bewerking, zoals matrixeffecten en verhitting, (een deel van) de allergeniciteit heeft verloren of dat de allergeniciteit juist is versterkt.
- Bij een OVP is maximaal 1 testdag nodig, waardoor tijd en kosten worden bespaard.
- Voor een DBPGVP wordt verum- en placebotestmateriaal gemaakt. Bereiding en distributie van een geblindeerd voedingsmiddel moeten aan aanvullende eisen voldoen en zijn daarom duurder en gecompliceerder.
- De laatste stap kan de hoeveelheid zijn die een patiënt normaal in het dagelijkse leven in een keer zou eten (‘leeftijdsadequate portie’). In een DBPGVP is het lastiger en soms onmogelijk om een dergelijke hoeveelheid nog te maskeren. Als de laatste dosis van de DBPGVP niet gelijk is aan een leeftijdadequate portie, dan is na een negatieve test de kans op een acute reactie bij de introductie thuis verhoogd. Zo nodig kan de hoogste stap open worden gedaan.
- Bij een OVP (of een open gift aan het einde van de DBPCFC) is er het voordeel dat de patiënt ziet wat hij eet, waardoor al een stukje angst wordt overwonnen. Dit kan de introductie thuis (bij een negatieve uitkomst) gemakkelijker maken.
Voordelen van DBPGVP t.o.v. OVP
De mogelijke uitkomsten van OVP en DBGVP zijn fout-negatief, echt negatief, fout-positief, echt positief en onbeslist. Fout-negatieve, fout-positieve en onbesliste resultaten zijn ongewenste uitkomsten. De DBPGVP heeft hierin een potentieel belangrijk voordeel boven de OVP. Bij een DBPGVP wordt het provocatiemateriaal gemaskeerd en wordt de verumdag met een placebodag vergeleken. Op deze wijze wordt bias gereduceerd en zijn de te verwachten percentages fout-positieve en onbesliste uitkomsten lager dan bij OVP’s.
Inschatting voorafkans op negatief of positief resultaat
In de praktijk maakt een arts mede op basis van zijn ervaring een individuele inschatting over de grootte van de kans die een patiënt heeft op een reactie. Dit valt niet in maat en getal uit te drukken. Bij de aanbevelingen worden de situaties genoemd waarin de kans op een positieve of negatieve uitkomst hoog of laag wordt geschat.
Er is niet onderzocht wat de kans is op een placeboreactie bij kinderen of volwassenen zonder eczeem. Op basis van de aard van de klachten tijdens placeboreacties, die met name uit urticaria en buikpijn bestonden, wordt echter niet verwacht dat die minder vaak zullen voorkomen dan bij kinderen met eczeem. Op basis van expert opinion veronderstelt de werkgroep dat de kans op een onbesliste uitkomst verhoogd is bij patiënten met pre-existent eczeem. Bij patiënten zonder eczeem met een verhoogde kans op een negatieve uitkomst kan gekozen worden voor een initiële OVP. Bij patiënten met eczeem wordt geadviseerd initieel altijd te kiezen voor een DBPGVP.
Richtlijnen
De aanbevelingen van de verschillende richtlijnen van WAO (DRACME), NIAID, EAACI, AAAAI, SFAIC/SP2A en PRACTALL staan hieronder samengevat.
|
Aanbevelingen |
Evidence level |
Grade |
Key reference |
|
De voedselprovocatietest (met name de DBPCVP) is de gouden standaard voor het stellen van de objectieve diagnose IgE- of niet-IgE-gemedieerde voedselallergie |
IV |
D |
Expert opinion |
|
Voedselprovocaties moeten gebruikt worden om allergie en tolerantie aan te tonen, zodat het dieet veilig kan worden uitgebreid of het voedingsmiddel gericht kan worden vermeden |
IV |
1A |
Eigenmann, 2005 (14); Niggemann, 1994 (15); Sicherer, 1999 (16); Taylor, 2004 (17); Niggemann, 2005 (18); Bindslev-Jensen, 2004 (19); Werfel, 2007 (20); expert opinion |
|
OVP kan verricht worden als eerste test als het een jong kind betreft met objectieve symptomen |
|
1C |
Host, 2003 (21); Bindlev-Jensen, 2004 (19) |
|
De DBPCFC moet verricht worden bij subjectieve, late of atypische symptomen, als de patiënt en zijn ouders/verzorgers angstig zijn en bij wetenschappelijk onderzoek |
IV |
D |
Bindslev-Jensen, 2004 (19); Sampson, 2012 (6); Sicherer, 2006 (22) |
|
Elke negatieve DBPCVP moet gevolgd worden door een OVP met een adequate (dagelijkse, aan de leeftijd aangepaste) hoeveelheid voedingsmiddel |
IV |
1B |
Expert opinion; Caffarelli, 2001 (23) |
|
Een voedselprovocatie moet verricht worden in een specialistische setting met direct beschikbare spoedinterventie; als er een matig-tot-hoog risico is op een ernstige reactie, moet direct beschikbare IC-ondersteuning aanwezig zijn |
IV |
D |
Expert opinion |
DRACME (alleen koemelkallergie)
|
Algemene indicaties Voor DBPCFC Eerste keus voor wetenschappelijke protocollen; Eerste keus voor late reacties met zich chronisch ontwikkelende symptomen; In geval van subjectieve symptomen; Na een onbesliste OVP.
Voor OVP Ter evaluatie van directe symptomen bij IgE-gemedieerde voedselallergie; Bij grote kans op een negatieve voedselprovocatie; Een negatieve DBPGVP moet altijd gevolgd worden door een OVP. |
|
Open provocatie thuis
|
|
Open provocatie in het ziekenhuis
|
|
DBPCFC in het ziekenhuis
|
Middelenbeslag en haalbaarheid
Voor een groot aantal allergenen zijn nog geen gevalideerde recepten voor dubbelblinde provocaties beschikbaar. Er zijn wel recepten voor de diagnostiek van de meest voorkomende voedselallergieën: koemelk, kippenei, soja, hazelnoot, pinda, sesam, tarwe.
Idealiter zou elke provocatie dubbelblind moeten worden uitgevoerd. Provocaties zijn arbeidsintensieve kostbare tests die in de praktijk vaak negatief uitvallen. Om tijd en geld te besparen, valt te overwegen om met een OVP te starten als geschat wordt dat de kans op een negatieve uitkomst of overtuigend positieve uitkomst hoog is. Zo wordt de bestaande capaciteit efficiënter benut.
Onderbouwing
Achtergrond
Provocatie van een voedingsmiddel kan op verschillende manieren plaatsvinden. Een provocatie kan verricht worden met het verdachte voedingsmiddel in een zo onbewerkt mogelijke vorm, de zogenaamde open voedselprovocatie (OVP). Een tweede mogelijkheid is een provocatie uit te voeren waarbij de ene keer een placebo en de andere keer het verdachte voedingsmiddel gemaskeerd in bijvoorbeeld een drank, koek, reep of pannenkoek wordt gegeven, de zogenaamde dubbelblinde placebogecontroleerde voedselprovocatie (DBPGVP). Om een voedingsmiddel te maskeren wordt het verwerkt in een matrix (recept) en worden ingrediënten toegevoegd waardoor smaak, geur, textuur en kleur van het product (verum) niet te onderscheiden valt van die van de placebo (zie hoofdstuk 6). Bij beide provocaties wordt de testdosis stapsgewijs met regelmatige intervallen in oplopende dosering gegeven.
Door dubbelblinde provocaties te verrichten kan men nagaan hoe vaak fout-positieve of onbesliste resultaten gevonden zouden kunnen worden. Het aantal reacties met overtuigende objectieve klachten op de placebodag van een DBGVP geeft dan een indicatie van het potentieel aantal fout-positieve reacties als men alleen OVP’s zou doen. Het aandeel reacties met niet-persisterende, progressieve subjectieve of niet overtuigende objectieve klachten geeft dan een indicatie van het potentiële percentage onbesliste uitkomsten. Een andere mogelijkheid om achter deze ongewenste uitkomsten te komen is op elke OVP met een positieve uitkomst een DBPGVP te laten volgen en na te gaan hoeveel van deze OVP’s fout-positief bleken.
De OVP en de DBGVP hebben beide voor- en nadelen. In dit deel wordt beschreven wanneer welke type provocatie de voorkeur verdient. Bij de keuze tussen OVP en DBPGVP wordt in dit hoofdstuk niet rekening gehouden met de kans op vooringenomenheid (bias). De werkgroepleden realiseren zich dat er bij vrijwel elke provocatie vooraf een bepaald verwachtingspatroon (bias) is bij de patiënt en arts met betrekking tot de mogelijke uitkomst. Omdat wat vooraf verwacht wordt door de arts en/of patiënt subjectief is, en de grootte daarvan niet valt uit te drukken, is gekozen om de verwachting van een positieve of negatieve uitkomst geen rol te laten spelen bij de keuze voor de ene of de andere vorm van provocatie.
In dit hoofdstuk wordt ook nagegaan wat de kans is op ongewenste uitkomsten bij een OVP en of de voorafkans op een ongewenste uitkomst valt in te schatten.
Conclusies / Summary of Findings
Kans op fout-positieve of onbesliste uitkomst
Bij kinderen met eczeem bij wie alleen open provocaties worden verricht, ligt de kans op een fout-positieve of onbesliste uitkomt van de provocatie, afgemeten aan het aantal gerapporteerde placeboreacties, tussen 25% en 75% (8, 13).
Leeftijd speelde in de studie van Ahrens et al. (8) geen rol bij de kans op een fout-positieve uitkomst; integendeel, de kans op een placeboreactie was verhoogd bij kinderen< 1,5 jaar in een studie. In deze studie bleek de kans op huidreacties significant hoger als de kinderen fors eczeem hadden. In andere studies is niet expliciet gekeken naar bepaalde risicofactoren voor placeboreacties.
Gegevens over de kans op een fout-positieve reactie bij kinderen zonder eczeem en bij volwassenen met of zonder eczeem ontbreken. Gezien de aard van in de studies beschreven placeboreacties (urticaria, gastro-intestinale en respiratoire klachten) kan men verwachten dat, met uitzondering van de huidreacties, klachten niet vaker optreden bij patiënten met eczeem dan bij patiënten zonder eczeem. Met andere woorden: elke patiënt loopt een onbekende kans op een placeboreactie.
Kans op een negatieve of duidelijk positieve uitkomst
De voorafkans op een positieve uitkomst van een provocatie bij met SPT of sIgE bepaalde zeer sterke sensibilisatie, is verhoogd, maar nooit 100%> Voor de meeste allergenen is dit niet veel hoger dan maximaal 50%. In centra met in hun eigen populatie bepaalde afkapwaarden kunnen bij verdenking op pinda- en hazelnootallergie met CRD soms positieve voorafkansen van 90% worden bereikt.
Samenvatting literatuur
Kans op een fout-positief of onbeslist resultaat
In de studie van Ahrens et al. (8) werden retrospectief 740 DBPGVP’s onderzocht op het voorkomen van placeboreacties. Bij 2,8% (21/740) was een placeboreactie opgetreden. Bij de kinderen onder 1,5 jaar trad in 4% van de provocaties een placeboreactie op, bij de kinderen boven de 1,5 jaar in 1,5%. Huidreacties werden vooral gezien bij kinderen met fors atopisch eczeem.
In de studie van Vlieg-Boerstra et al. (9) werden de percentages subjectieve en objectieve, onmiddellijke en late reacties op de placebostap van de DBPGVP geanalyseerd. In totaal ondergingen 105 gesensibiliseerde kinderen (mediaan 5,3 jaar, spreiding 0,7–16,6 jaar; 68 jongens, 89% met eczeem) 132 DBPGVP’s met koemelk, kippenei, pinda, hazelnoot en soja. Sommigen ondergingen dus meer dan 1 provocatie. In 17 provocaties (12,9%) ontstond een reactie op de placebodag. De hoeveelheid directe en late placeboreacties waren gelijk verdeeld; circa 65% betrof objectieve, 35% subjectieve placeboreacties. Er werden huidreacties genoteerd (gegeneraliseerde jeuk en urticaria: n = 3), gastro-intestinale symptomen (misselijkheid en buikpijn; n = 5) en lokale, bovenste- en onderste luchtwegsymptomen (stridor, dikke keel, jeukende keel, mond of tong; n = 1). Geen van de kinderen had een anafylactische (cardiovasculaire) reactie op placebo.
In de studie van Venter et al. (10) ondergingen kinderen met een voor allergie verdachte anamnese een OVP. Indien de OVP positief was, werd deze gevolgd door een DBPGVP met hetzelfde allergeen. Het percentage kinderen met eczeem werd niet vermeld. Van de 181 OVP’s bij 137 kinderen (leeftijd 1-15 jaar) waren er 80 positief bij 69 kinderen. Bij 41 kinderen (totaal 46 DBPGVP’s: 11 gedurende één dag, 35 gedurende een week) konden de resultaten van OVP en DBPGVP vergeleken worden. In 61% van de gevallen werd de positieve OVP bevestigd met de DBPGVP, dus 39% was fout-positief. Het percentage fout-positieve uitkomsten bij kinderen < 3 jaar was niet hoger dan dat bij kinderen > 3 jaar.
In de studie van Brouwer et al. (11), die besproken wordt in de in ontwikkeling zijnde richtlijn betreffende koemelkallergie, is bij kinderen jonger dan 5 maanden met eczeem en verdenking op koemelkallergie (gastro-intestinale en soms respiratoire klachten bij gebruik van een zuigelingenvoeding op basis van koemelk) nagegaan of probiotica de progressie van eczeem en het ontstaan van nieuwe sensibilisaties kon voorkomen. In deze studie ondergingen 22 kinderen in de eerste lijn een OVP na gedurende 3-5 weken een weihydrolysaat te hebben gebruikt. Als er tijdens de OVP geen klachten optraden, werd thuis nog 5-7 dagen een zuigelingenvoeding op basis van koemelk gegeven.
Als tijdens de OVP of in de periode van 5-7 dagen erna geen klachten optraden, werd de diagnose koemelkallergie verworpen. Als bij de OVP een acute reactie optrad, volgde nog een DBPGVP. De ouders van patiënten met een reactie in de periode na de OVP kregen het advies om na de DBPGVP-dag placebo of verum nog in opklimmende hoeveelheden te geven. 14 van de 22 kinderen, die een OVP ondergingen, reageerden positief (n = 6) of hadden een dubieuze reactie (n = 8). Alle 14 ondergingen ze een DBPGVP, maar bij slechts 4 van degenen met een positieve OVP, viel deze positief uit.
In een pilotstudie van de Richtlijn Diagnostiek van koemelkallergie bij kinderen in Nederland (12) zijn de resultaten van de eerste 50 DBPGVP’s bij flesgevoede kinderen, uitgevoerd op de consultatiebureaus van Zuidzorg, retrospectief vergeleken met die van de 50 laatste, in diezelfde regio volgens de tot dan gebruikelijke procedure, meestal thuis uitgevoerde OVP’s. (7) In de OVP-groep was de provocatie bij 36 van de 50 (72%) kinderen positief, bij 2 (4%) dubieus, en bij 12 (24%) negatief. In de DBPGVP-groep was de provocatie bij 13 van de 50 kinderen (26%) positief, bij 4 (8%) dubieus en bij 33 (66%) negatief. Het aantal positieve testen was bij de DBPGVP’s significant lager dan in de OVP groep (p = 0,01).
Er zijn meer studies die het aantal onbesliste uitkomsten vermelden. Omdat het altijd studies betreft waarbij DBPGVP’s zijn gedaan en strikte inclusiecriteria en strenge stopcriteria zijn gehanteerd, zijn de gevonden percentages onbesliste uitkomsten vaak minimaal en niet representatief voor de dagelijkse praktijk, waarin ook OVP’s worden verricht met minder strenge stopcriteria en bij patiënten die niet voldoen aan strenge inclusiecriteria.
Zoeken en selecteren
Aangezien er te weinig studies van voldoende omvang zijn die OVP en DBPGVP met elkaar vergelijken, zijn via de experts in de werkgroep sleutelartikelen opgevraagd en is via de referenties gezocht naar aanvullende studies (sneeuwbalmethode). Gezocht is naar studies die als doel hadden het percentage fout-positieven en onbesliste resultaten op te sporen of studies waarbij deze uitkomsten zijn vermeld. Het selectiecriterium was een uitgangsvraag gelijk aan die van deze module. Er werden uiteindelijk 2 studies geïncludeerd. Ook is gekeken in bestaande richtlijnen, te weten die van de WAO (DRACMA), de NIAID, de EAACI, de AAAAI, SFAIC en SP2A, en PRACTALL (1-6), wat de aanbevelingen zijn ten aanzien van de keuze voor open of dubbelblinde provocatie en op welke bronnen die zijn gebaseerd. Er is gebruik gemaakt van een relevante passage uit een andere, in ontwikkeling zijnde richtlijn en de studie die daarvoor is gebruikt (7).
Referenties
- 1 - Fiocchi A, Brozek J, Schünemann H, Bahna SL, von Berg A, Beyer K, et al. World Allergy Organisation (WAO) Diagnosis and Rationale for Action against Cows Milk Allergy (DRACMA) Guidelines. Ped Allergy Immunol 2010;21:1-125.
- 2 - Boyce JA, Assa'ad A, Burks AW, Jones SM, Sampson HA, Wood RA, et al. Guidelines for the diagnosis and management of food allergy in the United States: summary of the NIAID-sponsored Expert Panel Report. J Allergy Clin Immunol 2010;126:1105-18.
- 3 - Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al. EAACI food allergy and anafylaxis guidelines. Diagnosis and management of food allergy. Allergy 2014;69:1008-25.
- 4 - Nowak-Wegrzyn A, Assa'ad AH, Bahna SL, Bock SA, Sicherer SH, Teuber SS, et al. Work Group report: oral food challenge testing. J Allergy Clin Immunol 2009;123(Suppl):S365-83.
- 5 - Rancé F, Deschildre A, Villard-Truc F, Gomez SA, Paty E, Santos C, et al. Oral food challenge in children: an expert review. Eur Ann Allergy Clin Immunol 2009;41:35-49.
- 6 - Sampson HA, Gerth van Wijk R, Bindslev-Jensen C, Sicherer S, Teuber SS, Burks AW, et al. Standardizing double-blind, placebo-controlled oral food challenges: American Academy of Allergy, Asthma & Immunology-European Academy of Allergy and Clinical Immunology PRACTALL consensus report. J Allergy Clin Immunol 2012;130:1260-74.
- 7 - Vlieg-Boerstra BJ, Heide S van der, Bijleveld CM, Kukler J, Duiverman EJ, Dubois AE. Placebo reactions in double-blind, placebo-controlled food challenges in children. Allergy 2007;62:905-12.
- 8 - Venter C, Pereira B, Voigt K, Grundy J, Clayton CB, Gant C, et al. Comparison of open and double-blind placebo-controlled food challenges in diagnosis of food hypersensitivity amongst children. J Hum Nutr Diet 2007;20:565-79.
- 9 - Brouwer ML, Wolt-Plompen SA, Dubois AE, Heide S van der, Jansen DF, Hoijer MA, et al. No effects of probiotics on atopic dermatitis in infancy: a randomized placebo-controlled trial. Clin Exp Allergy 2006;36:899-906.
- 10 - Vlieg-Boerstra BJ, Wensing CL, Kneepkens CMF, Meijer Y, de Vries E, Sprikkelman AB. 1 richtlijn voor diagnostiek van koemelkallergie; voor de eerste, tweede en derde lijn in Nederland. Ned Tijdschr Geneeskd 2013;157:A6311.
- 11 - Vlieg-Boerstra BJ, Tissen I, Sprikkelman AB. Diagnostiek van koemelkallergie op het CB aanzienlijk verbeterd door dubbelblinde provocatietest. Nederlands Tijdschrift voor Allergologie [aangeboden].
- 12 - Ahrens B, Niggemann B, Wahn U, Beyer K. Positive reactions to placebo in children undergoing double-blind, placebo-controlled food challenge. Clin Exp Allergy 2014;44:572-8.
- 13 - Niggemann B. Role of oral food challenges in the diagnostic work-up of food allergy in atopic eczema dermatitis syndrome. Allergy 2004;59(Suppl 78):32-4.
- 14 - Eigenmann PA. Are specific immunoglobulin E titres reliable for prediction of food allergy? Clin Exp Allergy 2005;35:247-9.
- 15 - Niggemann B, Wahn U, Sampson H. Proposals for standardization of oral food challenge tests in infants and children. Pediatr Allergy Immunol 1994;5:11-3.
- 16 - Sicherer SH. Food allergy: when and how to perform oral food challenges. Pediatr Allergy Immunol 1999;10:226-34.
- 17 - Taylor S, Hefle S, Bindslev-Jensen C, et al. A consensus protocol for the determination of the threshold doses for allergenic foods: how much is too much? Clin Exp Allergy 2004;34:689-95.
- 18 - Niggemann B, Rolinck-Werninghaus C, Mehl A, Binder C, Ziegert M,Beyer K. Controlled oral food challenges in children when indicated, when superfluous? Allergy 2005;60:865-70.
- 19 - Bindslev-Jensen C, Ballmer-Weber BK, Bengtsson U, Blanco C, Ebner C, Hourihane J, et al. Standardization of food challenges in patients with immediate reactions to foods-position paper from the European Academy of Allergology and Clinical Immunology. Allergy 2004;59:690-7.
- 20 - Werfel T, Ballmer-Weber B, Eigenmann PA, Niggemann B, Rance F, Turjanmaa K, Worm M. Eczematous reactions to food in atopic eczema: position paper of the EAACI and GA2LEN. Allergy 2007;62:723-8.
- 21 - Høst A, Andrae S, Charkin S, Diaz-Vázquez C, Dreborg S, Eigenmann PA, et al. Allergy testing in children: why, who, when and how? Allergy 2003;58:559-69.
- 22 - Sicherer SH, Bock A. An expanding evidence base provides food for thought to avoid indigestion in managing difficult dilemmas in food allergy. J Allergy Clin Immunol 2006;117:1419-22.
- 23 - Caffarelli C, Petroccione T. False-negative food challenges in children with suspected food allergy. Lancet 2001;358:1871-2.
- 24 - Ahrens B, Niggemann B, Wahn U, Beyer K. Positive reactions to placebo in children undergoing double-blind, placebo-controlled food challenge. Clin Exp Allergy 2014;44:572-8.
Evidence tabellen
Er zijn voor deze richtlijn geen evidence tabellen opgesteld.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-03-2016
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2019 wordt door de NVvA, na raadpleging van of op advies van aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de huidige richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten.
Algemene gegevens
De richtlijn is gefinancierd met het gealloceerde budget van de stichting Kwaliteitsgelden Medisch specialisten (SKMS) dat bestemd is voor de individuele projecten van de NVvA.
Doel en doelgroep
- Aanbevelingen te doen over de indicatiestelling voor provocatie, de provocatieprocedure, de keuze van het provocatiemateriaal, de beoordeling van de uitkomst van de provocatie en het optimale beleid na provocatie, op basis van het beschikbare bewijs en consensus binnen de werkgroep, teneinde de kwaliteit van diagnostiek van voedselallergie te verbeteren;
- Aanbevelingen te doen over de eisen van de provocatiesetting en het personeel betrokken bij provocaties, teneinde de provocatie zo veilig mogelijk te laten verlopen;
- De indicatiestelling, de provocatieprocedure en de beoordeling van uitkomsten van provocaties te harmoniseren, teneinde de vergelijkbaarheid te vergroten tussen de ziekenhuizen en andere tweedelijnszorginstellingen waar provocaties worden gedaan;
- Het aanwezige bewijs en de hiaten in het bewijs voor verschillende aspecten van de voedselprovocatie inzichtelijk te maken;
- Inzichtelijk te maken waar deze Nederlandse richtlijn afwijkt van ander nationale en internationale richtlijnen;
- Indicatoren te formuleren die beogen de effectiviteit en veiligheid van de voedselprovocatie te kunnen meten;
- Een medical audit te ontwikkelen waarmee specialisten kunnen evalueren in hoeverre zij de richtlijn opvolgen.
Doelgroep
De beoogde gebruikers van deze richtlijn zijn medische specialisten, verpleegkundigen, diëtisten en doktersassistenten werkzaam in de 2e of 3e lijn die op wat voor manier dan ook betrokken zijn bij de indicatiestelling of begeleiding van patiënten voor, tijdens of na een voedselprovocatie.
Samenstelling werkgroep
Belangenverklaringen
Er zijn voor deze richtlijn geen belangenverklaringen opgesteld.
Inbreng patiëntenperspectief
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. Daarbij is expliciet gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Daarnaast is er een patiëntenversie van de richtlijn ontwikkeld. De richtlijn wordt verspreid onder alle relevante beroepsgroepen, patiëntenorganisaties en onderwijsinstellingen. Er wordt aandacht voor de richtlijn gevraagd via publicaties in tijdschriften en websites van de verschillende verenigingen. Ook is de richtlijn te downloaden vanaf de website van het CBO: www.cbo.nl.
Werkwijze
Deze richtlijn is ontwikkeld in lijn met het adviesrapport Medisch Specialistische Richtlijnen 2.0 en volgens andere adviezen over de wijze waarop richtlijnen tot stand komen. In hoofdlijnen hebben de volgende activiteiten plaatsgevonden:
Inventarisatie
In opdracht van de Nederlandse Vereniging voor Allergie (NVvA) is er een werkgroep voedselprovocatie in het leven geroepen. Het doel van deze werkgroep was een richtlijn te ontwikkelen die aangeeft hoe voedselprovocaties het beste uitgevoerd kunnen worden. De werkgroep wordt gevormd door kinderartsen, dermatologen, allergologen, diëtisten, een mdl-arts, een longarts, een klinisch chemicus en vertegenwoordigers van patiënten. Aan twee verpleegkundigen die betrokken zijn bij voedselprovocaties is gevraagd aanwezig te zijn bij de bijeenkomsten en commentaar te geven op de teksten. Zij schreven niet zelf mee. De leden van de werkgroep komen uit verschillende delen van het land en zijn werkzaam in de academie of de periferie. Tijdens de eerste bijeenkomst zijn zoveel mogelijk knelpunten met betrekking tot voedselprovocaties in kaart gebracht. De vragen die deze knelpunten opleverden, komen aan de orde in de richtlijn.
Om na te gaan of er nog knelpunten ontbraken, zijn er 2 landelijke enquêtes uitgevoerd:
- Er is een digitale enquête verspreid onder 246 artsen, diëtisten en overige leden van de NVvA en NVK-SKA. Van 83 personen is respons gekregen, van wie 78 arts, diëtist of overig lid waren (5 respondenten hadden niets ingevuld en zijn niet meegenomen in de analyse). In totaal waren er 71 artsen die provocaties aanvragen binnen hun eigen ziekenhuis of zorginstelling;
- Een tweede enquête is gestuurd aan 1.600 leden van de Stichting Voedselallergie (SVA) en 1.216 leden van het Nederlandse Anafylaxie Netwerk (NAN). Tevens is de link van de digitale enquête getwitterd naar 950 volgers van de SVA. In totaal hebben 418 personen de enquête ingevuld. De respons was daarmee 11% (en 19% als de 950 twittervolgers niet meegerekend worden).
Knelpunten en uitgangsvragen
In 2008 is door individuele leden van de Vakgroep Allergologie (die gelieerd is aan de NVvA) gestart met het inventariseren van de bestaande protocollen aangaande voedselprovocatietests. Daarnaast zijn enkele uitgangsvragen opgesteld voor het ontwikkelen van een richtlijn. Voor de ontwikkeling van deze richtlijn heeft de werkgroep de relevante uitgangsvragen geselecteerd die in 2008 zijn opgesteld. Gelijktijdig zijn de verschillende werkwijzen in de Nederlandse praktijken in kaart gebracht aangaande de diagnostiek van voedselallergie en de voedselprovocatietest (zie inventarisatie/twee landelijke enquêtes). Op basis van de enquête is een knelpuntenanalyse opgesteld.
Knelpunten
- Er zijn nog geen goede en gevalideerde recepten voor veel voedselprovocaties. De hoogste dosering is daarom soms niet afdoende. Ook weigeren kinderen soms grote hoeveelheden voedsel.
- Bereiding van de recepten is kostbaar en lastig vanwege de eisen die er aangesteld worden.
- Er is geen enkele standaardisatie en validatie voor open provocaties.
- Er ontbreekt een centraal punt waar recepten besteld kunnen worden.
- Er zijn geen uniforme provocatieprotocollen waarin provocatieprocedures, stopcriteria, observatietijden en veiligheidsmaterialen zijn opgenomen.
- Provocaties zijn arbeidsintensief en de vergoeding ervoor schiet te kort.
- De diëtist wordt niet meer vergoed, waardoor veel ouders afzien van een bezoek aan de diëtist.
- Er is een tekort aan gekwalificeerd personeel.
- Een betere uniforme begeleiding na provocaties ontbreekt. Bijvoorbeeld wat betreft de handelwijze bij klachten thuis na provocatie of na een ‘shock’-reactie tijdens provocatie en een ‘verloren’ gevoel thuis.
- De informatieverstrekking aan patiënten en ouders kan beter, bijvoorbeeld over de risico’s tijdens de provocatie (bijvoorbeeld welke medicatie gestaakt moet worden en welke doorgebruikt mag worden). Dit geldt ook voor de informatie voor de huisarts.
- Te lange wachttijd, zeker bij meerdere allergenen.
Deze knelpunten vormen samen met de relevante uitgangsvragen uit 2008 het startpunt voor de vastgestelde uitgangsvragen.
Uitgangsvragen
- Wat is de voorspellende waarde van sensibilisatieonderzoek op de uitkomst van de provocatie?
- Wat zijn relatieve en absolute contra-indicaties van voedselprovocaties?
- Wanneer kan er voor een open en wanneer voor een dubbelblinde placebogecontroleerde voedselprovocatie gekozen worden?
- Kunnen we onderscheid maken tussen hoogrisico- en laagrisicoprovocaties, en is dit zinvol?
- Aan welke eisen moet de receptuur voor provocatie voldoen?
- Hoe ziet het ideale provocatieschema er uit?
- Welke stopcriteria kan men het best hanteren?
- Welk beleid kan gevolgd worden na de voedselprovocatie?
- Welke instructies en adviezen moeten gegeven worden aan patiënten en personeel betrokken bij provocaties?
Werkwijze werkgroep
De werkgroep heeft gedurende een periode van ongeveer tweeënhalf jaar gewerkt aan de beantwoording van de uitgangsvragen en opstellen van de tekst voor de conceptrichtlijn. De conclusies uit de literatuur vormden de basis voor het opstellen van de aanbevelingen. De verantwoordelijke werkgroepleden deden daarvoor een voorzet, die tijdens de werkgroepvergadering werd besproken en desgewenst aangevuld met praktijkinformatie. De uiteindelijke aanbevelingen zijn tot stand gekomen op basis van (informele) consensus binnen de werkgroep.
Tijdens plenaire vergaderingen werden de teksten besproken en geaccordeerd na verwerking van het commentaar. De door de werkgroep geaccordeerde conceptrichtlijn is vervolgens voor commentaar aangeboden aan de betrokken beroeps- en patiëntenverenigingen. Na de verwerking van dit commentaar is een definitief concept van de richtlijn op 27 mei 2015 door de werkgroep vastgesteld. De definitieve versie van de richtlijn is op 29 september 2015 vastgesteld.
Wetenschappelijke onderbouwing
Er is gewerkt volgens de methodiek van het adviesrapport Medisch Specialistische Richtlijnen 2.0. Aangezien alle uitgangsvragen en publicaties betrekking hebben op validiteit, betrouwbaarheid en normering van diagnostische instrumenten, is afgezien van een gradering van de kwaliteit van bewijs. Hoewel voor het type uitgangsvragen en publicaties de toepassing van GRADE als beoordelingssystematiek niet goed toepasbaar is, is er wel voor gekozen om de opbouw van hoofdstukken volgens het GRADE-format te doen. Dit betekent dus dat na de beschrijving van de toegepaste zoek- en selectiemethode en de beschrijving van de studies een passage ‘van bewijs naar aanbeveling’ is opgenomen. Dit leidt tot de formulering van aanbevelingen, die volgens de GRADE-systematiek worden afgesloten met een rationale.
Consensus
Binnen de werkgroep Voedselprovocatie zijn voldoende disciplines en gezaghebbende experts vertegenwoordigd om de bereikte consensus over de aanbevelingen autoriteit te geven. Daarnaast zullen de standpunten van experts in recent gepubliceerde nationale/internationale richtlijnen en ´position papers´ geïncorporeerd worden. Hierbij wordt rekening gehouden met de implementeerbaarheid. De aanbevelingen moeten immers een leidraad bieden voor de praktijkvoering van de medisch specialist, opdat de best beschikbare zorg aan de patiënt geboden wordt.
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs ook andere aspecten van belang, bijvoorbeeld balans van gewenste en ongewenste effecten, belasting van een provocatie, patiëntvoorkeuren, professioneel perspectief, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties en kosten.
Ter inventarisatie van het professioneel perspectief werden ook buitenlandse richtlijnen aangaande de diagnostiek, behandeling, begeleiding en beoordeling van voedselallergie/voedselprovocatie geraadpleegd. Hiervoor is gezocht in de databases van de US National Guideline Clearinghouse (https://www.ahrq.gov) en het Guidelines International Network (www.g-i-n.net).
Deze aspecten worden besproken na de ‘Conclusie’ onder het kopje ‘Van bewijs naar aanbeveling’. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met de overige overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit format heeft als doel de transparantie van de richtlijn te vergroten. Door aan de aanbeveling een rationale toe te voegen werd getracht deze transparantie te effectueren. Het bood ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
De sterkte van aanbevelingen is een combinatie van het beschikbare bewijs en de overige aspecten die door de werkgroep van belang werden geacht. De werkgroep heeft ervoor gekozen om dit in de aanbevelingen terug te laten komen door consequent twee formuleringen te gebruiken:
- Aanbevolen wordt …… (sterke aanbeveling)
- Overwogen kan worden om …… (zwakke aanbeveling).
Zoekverantwoording
Bij analyse van de uitgangsvragen constateerde de werkgroep dat de meeste uitgangsvragen zich niet leenden voor een systematische zoekstrategie, om verschillende redenen:
- De werkgroep was van mening dat er over de diverse onderwerpen slechts beperkte literatuur beschikbaar is en dat de meeste beschikbare artikelen al in het bezit waren van de werkgroep;
- De meeste gepubliceerde artikelen hebben de uitgangsvragen in deze richtlijn niet als uitgangsvraag / hypothese. Veel antwoorden op de vragen kunnen alleen verkregen worden door analyse van de resultaten in de kantlijn van het artikel. De meeste artikelen zouden daarom wellicht niet gevonden zijn met ‘search terms’ of er zouden zoveel artikelen gevonden worden dat de selectieprocedure eindeloos veel tijd in beslag zou gaan nemen, zonder dat dit vermoedelijk belangrijke consequenties zou hebben voor de conclusies of aanbevelingen;
- Over geen van de onderwerpen zijn randomized placebo-controlled trials beschikbaar: dit maakt dat de sterkte van de aanbevelingen altijd lager is dan graad A.
Om bovenstaande redenen is gekozen voor een meer pragmatische aanpak, waarvan een grotere opbrengst werd verwacht. Om de waarde van sensibilisatieonderzoek na te gaan, is een systematische search uitgevoerd. De European Academy of Allergy and Clinical Immunology (EAACI) heeft over dit onderwerp begin 2014 een review gepubliceerd. Hiervan is gebruik gemaakt.
Voor de andere onderwerpen is als alternatieve methode gekozen om in de artikelen die de werkgroep al bezat, de artikelen van de referenties te beoordelen (snowballing) en na te gaan of er nog artikelen gemist werden, en om te kijken naar richtlijnen. Daarbij is gezocht in relevante databases, zoals de Cochrane Library, Medline, Embase. Bij elke uitgangsvraag in de richtlijn is de daar toegepaste zoekstrategie kort beschreven; deze is opvraagbaar bij het CBO. Naast de literatuur uit de search zijn er bij een aantal vragen ook publicaties meegenomen uit de archieven van de werkgroepleden, mits zij aan de inclusiecriteria voldeden. Publicaties die niet voldeden aan de inclusiecriteria werden niet gebruikt voor de wetenschappelijke onderbouwing, maar eventueel per module in het kader van het professionele perspectief besproken als onderdeel van ‘Zoeken en selecteren’.
