Energiemetabolisme monitoren
Uitgangsvraag
Wat is de plaats van het monitoren van (energie)metabolisme aan de hand van indirecte calorimetrie versus conservatieve rekenmethodes bij de patiënt op de IC?
Aanbeveling
Overweeg het gebruik van indirecte calorimetrie voor het optimaliseren van de energie-inname en ter voorkoming van hypo- of hyperalimentatie bij patiënten op de Intensive Care.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de effectiviteit van het monitoren van (energie)metabolisme aan de hand van indirecte calorimetrie vergeleken met het monitoren van (energie)metabolisme aan de hand van conservatieve rekenmethodes bij IC patiënten. Er werd één systematische review geïncludeerd in de literatuursamenvatting, die studies bevatte die deze vergelijking onderzochten.
Voor de cruciale uitkomstmaten ‘korte- en lange termijn mortaliteit’ is er erg veel onzekerheid (bewijskracht zeer laag) en kunnen er geen conclusies worden getrokken. De totale bewijskracht voor de cruciale uitkomstmaten komt daarmee uit op zeer laag.
Voor de belangrijke uitkomstmaten ‘malnutritie’, ‘ondervoeding’, ‘hyperalimentatie’, en ‘adequate voeding’ werd geen bewijs gevonden. Er kunnen daarom geen conclusies worden getrokken op basis van deze uitkomstmaten. Wel werd het best beschikbare bewijs beschreven (tabel 2 in de literatuursamenvatting). Wat betreft de belangrijke uitkomstmaten ‘duur van mechanische ventilatie’ en ‘duur van ziekenhuisopname’ is er erg veel onzekerheid (bewijskracht zeer laag) en kunnen er geen conclusies worden getrokken.
De totale bewijskracht voor de belangrijke uitkomstmaten komt daarmee uit op zeer laag.
Een belangrijke beperking in alle studies in de systematische review van Duan (2021) is het ontbreken van de blindering, wat een mogelijk risico geeft op vertekening voor de ‘zachte’ uitkomstmaten (alle uitkomstmaten behalve mortaliteit). Daarnaast werd de lage bewijskracht veelal veroorzaakt door inconsistentie en imprecisie, dan wel door een groot betrouwbaarheidsinterval rondom de gepoolde puntschatter en/of een kleine patiëntengroep.
De beschikbare studies geven geen antwoord op de vraag of indirecte calorimetrie beter is dan het monitoren van (energie)metabolisme aan de hand van conservatieve rekenmethodes bij patiënten op de IC. De uitkomstmaten uit deze onderzoeken komen ook niet overeen met de uitkomstmaten die relevant zijn voor de richtlijnaanbeveling, dit is een kennislacune.
Echter, in de ESPEN-richtlijn wordt wel een positieve aanbeveling gedaan voor indirecte calorimetrie boven het gebruik van conservatieve rekenmethodes (Singer, 2019). In de ESPEN richtlijn is de bewijskracht hiervoor geclassificeerd als laaggradig met een hoog niveau van consensus. Voor patiënten met obesitas (BMI ≥ 30 kg/m2) is de aanbeveling om indirecte calorimetrie te gebruiken om de energiebehoefte te meten, sterker (Elke, 2019). Voor deze groep patiënten zou het energiedoel 60% van het mREE (measured Resting Energy Expenditure) zijn. Indien indirecte calorimetrie niet voorhanden is voor patiënten op de IC met een BMI ≥ 30 kg/m2 kunnen rekenformules op basis van actueel of ideaal gewicht worden toegepast.
Overige beschrijvende bronnen die niet voldeden aan de PICO laten wel een voorzichtig voordeel zien voor het gebruik van indirecte calorimetrie (Achamtrah, 2021; de Waele, 2021; Gostyńska, 2019; de Waele, 2022).
De ESPEN-aanbeveling is gebaseerd op retrospectief onderzoek waarin gepoogd wordt om de beademde patiënten 100% van het mREE te voeden. Deze studie laat zien dat de mortaliteit bij IC-patiënten het laagst is indien de hoeveelheid energie die IC-patiënten kregen toegediend, 70% van het mREE bedraagt (Zusman, 2016). In 2011 zijn vergelijkbare resultaten gepubliceerd van een observationele multicenter studie bij 7,872 beademde patiënten (Heyland, 2011). De laagste mortaliteit werd gevonden bij toediening van 85% van de calorieën t.o.v. de berekende energiebehoefte. Het verschil zit in de methode van statistische analyse en bij een klein percentage van de patiënten in de Heyland studie werd indirecte calorimetrie gebruikt. De voorzichtige conclusie kan zijn dat toedienen van te veel energie (> 100% van het REE) en te weinig energie (<70%) resulteert in een hogere mortaliteit bij beademde patiënten op de IC.
Indien energie- of calorieadvies gewenst is voor de individuele patiënt op de IC, dan is indirecte calorimetrie accurater dan de rekenmethodes, met afwijkingen tot wel 60% (ESPEN)(Stapel, 2015; Zusman, 2016).
In een retrospectieve cohort studie met 1171 beademde patiënten werd gestreefd naar een inname van 100% van de gemeten calorieën met indirecte calorimetrie. In deze studie blijkt de overlevingskans het grootst te zijn indien de toegediende hoeveelheid energie 70% bedraagt van het gemeten mREE (Zusman, 2016). Zowel een lagere als een hogere energie-inname dan 70% van het mREE resulteert in een toename van de mortaliteit bij IC-patiënten. Mogelijk wordt die 70% beïnvloed door de lengte van het IC-verblijf (Berger, 2017). Indien IC-patiënten die korter dan twee dagen zijn opgenomen, worden geëxcludeerd van de analyse, dan is de optimale energie-inname 71% van het mREE. De optimale energie-inname wordt 80% van het mREE indien alleen wordt gekeken naar patiënten die meer dan tien dagen worden gevoed (Zusman, 2017). Door de IC-opnameduur op te nemen in de optimale energie-inname, wordt deze 70-80% van het mREE en nooit 95-105% van het mREE (Berger, 2017; Zusman, 2017).
Gezien de resultaten van de retrospectieve onderzoeken (Zusman en Heyland) en de nadere analyses (Zusman en Berger) naar de optimale energie-inname door beademde patiënten op de IC, zou het advies zijn om de inname van te weinig energie (<70% van het mREE) of te veel (>100% van het mREE) te voorkomen tijdens de late fase van de opname op de IC. Tijdens de acute fase moet terughoudendheid worden betracht (ESPEN 2019), omdat door de hoge endogene energieproductie door gluconeogenes, glycolyses, proteolysis en lipolysis, er al veel energie beschikbaar is. Door het toedienen van substantiële hoeveelheden exogene energie gebaseerd op indirecte calorimetrie of berekeningen kan dit aanleiding geven tot hyperalimentatie wat geassocieerd is met een hogere mortaliteit. Bij verdenking op een hoge endogene energie productie door patiënt zelf wordt geadviseerd om voeding in een rustig tempo op te bouwen (ESPEN, 2019). Tekenen van een hoge endogene energie productie zijn het oplopen van glucose spiegels boven de 10 mmol/L ondanks doseringen insuline (Elke, 2019).
Ideaal zou het zijn om bij beademde IC-patiënten gedurende meerdere uren, meerdere dagen in de week het energieverbruik te meten en de energie-inname te optimaliseren als 80% van het mREE. Een redelijk alternatief voor het berekende energiedoel bij beademde patiënten zou de CO2-productie (VCO2) gemeten met het beademingsapparaat kunnen zijn (Stapel, 2015). Dit onderzoek laat zien dat de berekende energiebehoefte middels de formule van Weir en de gemeten VCO2 141 kcal/24 uur van in totaal 1823 kcal/24 uur (7,7%) afwijkt van indirecte calorimetrie. Dit bleek beter en significant lager dan de energiebehoefte berekend met formules als Harris-Benedict, Faisy, Penn State University (PSU) en 20-25 kcal/kg lichaamsgewicht. In een recentere studie werd bij beademde IC-patiënten de uitkomst van de gemeten VCO2 gecombineerd met de formule van Weir met daarin een Respiratoir Quotient van 0,85 vergeleken met die van indirecte calorimetrie (Oshima, 2017). Het verschil tussen gemeten VCO2 met formule van Weir en indirecte calorimetrie was 21 tot 48 kcal/dag en een 10% accuraatheid van 77,3 tot 77,7% en 5% accuraatheid van 46 tot 46,4%. De auteurs zijn van mening dat de gemeten VCO2 in combinatie met de formule van Weir, onvoldoende accuraat is om als een alternatief voor indirecte calorimetrie te worden beschouwd. De accuraatheid van de gemeten VCO2 bleek niet te worden beïnvloed door het tijdstip van meten en de toegediende hoeveelheid voeding. Ter vergelijking met de rekenformules, zoals Harris-Benedict, Faisy, PSU en 20-25 kcal/kg lichaamsgewicht, voor optimaal energiedoel is de gemeten VCO2 met formule van Weir wel veel beter. De veelgebruikte 20-25 kcal/kg/dag blijkt de meest inaccurate methode om de energiebehoefte te berekenen. Gezien de onnauwkeurigheid van de rekenmethodes en om hyperalimentatie te voorkomen wordt daarom door ESPEN geadviseerd om lager dan de 70% van het berekende energiedoel voeding te doseren.
Bij patiënten met extra zuurstof zonder mechanische ventilatie en patiënten met extracorporale membraanoxygenatie of een luchtproducerende thoraxdrain kan met de huidige techniek géén indirecte calorimetrie worden gebruikt.
Waarden en voorkeuren van patiënten
Waarden en voorkeuren van patiënten of hun naasten zijn bij dit onderwerp niet relevant. Het inschatten van energiemetabolisme heeft als doel om de best mogelijke voedingstherapie te geven op individuele basis aan de patiënt.
Kosten (middelenbeslag)
De huidige apparatuur, ontwikkeld naar aanleiding van een tender door ESPEN en ASPEN, is bereikbaar voor de meeste IC’s. Voor IC’s waar deze apparatuur momenteel niet voorhanden is, dient naast aanschafkosten apparatuur rekening te worden gehouden met eventuele bijkomende kosten voor calibratie set, disposables en onderhoudscontract. Per meting wordt een set disposables gebruikt. De set disposables kan eventueel worden gebruikt bij meerdere patiënten bij gebruik van een bacterie en virus Heat Moisture Exchange (HME) filter. Het hergebruik wordt afgeraden indien de beademde patiënt actief wordt bevochtigd gezien het mogelijk negatief beïnvloeden van het gemeten energieverbruik. Indien deze kosten te hoog worden bevonden, dan is het meten van de VCO2 in combinatie met de formule van Weir een beter alternatief dan het berekenen van het optimale energiedoel door middel van formules zoals Harris Benedict, Faisy, PSU of een simpele 20-25 kcal/kg lichaamsgewicht. De VCO2 kan door de meeste IC-ventilatoren worden gemeten.
Voor het leren meten is scholing nodig van diëtisten en indien mogelijk IC-verpleegkundigen. De metingen dienen zoveel mogelijk in rust gedaan te worden, bij voorkeur ’s nachts. De kosten van scholing in tijd en geld zullen variëren per IC-afdeling, inzetbaarheid van IC-verpleegkundigen, diëtisten en artsen.
Aanvaardbaarheid, haalbaarheid en implementatie
Het gebruik van indirecte calorimetrie vereist specifieke kennis en vaardigheden. Het apparaat dient te worden geïntegreerd in het beademingscircuit bij elke meting. De meting met de indirecte calorimetrie kan worden uitgevoerd door de diëtist in samenwerking met de IC-verpleegkundige of een intensivist. Dit is nodig vanwege de impact op het beademingscircuit. De metingen kunnen ook worden uitgevoerd door de IC-verpleegkundige zonder afhankelijk te zijn van de beschikbaarheid van de diëtist. De diëtist kan in dat geval dus een advies geven op basis van de meting, zonder daarbij aanwezig te moeten zijn.
Er worden geen belemmeringen verwacht ten aanzien van de implementatie vanwege de beschikbaarheid van de apparatuur en disposables.
De rekenmethode strategie vereist het meten van vitale functies, lengte, gewicht etc. en een toegewijde diëtist om advies te geven. Het gebruik van indirecte calorimetrie vereist extra training van diëtisten en IC-personeel, danwel de intensivist of IC-verpleegkundigen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Zoals eerder benoemd, kan de beschikbare literatuur niet de doorslag geven in een aanbeveling voor of tegen indirecte calorimetrie. Er zijn echter meer publicaties over het gebruik van indirecte calorimetrie en ook deze moeten in acht genomen worden bij de keuze voor het monitoren van energiemetabolisme als onderdeel van de dagelijkse routine op de IC.
Vanwege de huidig beschikbare literatuur kan geen sterke aanbeveling worden gemaakt. Echter, op basis van de ESPEN-guideline uit 2019 en additionele literatuur omtrent energiebehoefte bepalen volgens conservatieve rekenmethodes versus indirecte calorimetrie, kan een genuanceerder beeld over indirecte calorimetrie worden geschetst. Daarbij kan men overwegen indirecte calorimetrie een plaats te geven voor het berekenen van het energieverbruik en daarop het voedingsadvies af te stellen.
Onderbouwing
Achtergrond
Om het aantal calorieën te doseren, wordt van oudsher gebruik gemaakt van formules die het energieverbruik schatten zoals de Harris-Benedict vergelijking (predicted resting energy expenditure). De laatste jaren wordt steeds vaker gebruik gemaakt van indirecte calorimetrie waarmee het energieverbruik gemeten kan worden in plaats van geschat (measured resting energy expenditure). Deze nieuwe techniek is arbeidsintensiever dan het gebruik van formules en gaat gepaard met kosten door het gebruik van disposables. Studies laten zien dat door het gebruik van indirecte calorimetrie er een betere dekking van de energiebehoefte kan worden bereikt, maar de meeste van deze studies gebruiken indirecte calorimetrie tegelijkertijd als interventie en als uitkomstmaat. Het effect van het doseren van voeding met indirecte calorimetrie versus conventionele berekeningen op klinische uitkomsten is onduidelijk.
Conclusies / Summary of Findings
Mortality (short-term and long-term; critical)
|
Very low GRADE |
The evidence is very uncertain about the effect of use of indirect calorimetry- guided nutrition on short-term mortality compared to use of a simple predictive equations strategy (PE) in intensive care patients.
Source: Duan, 2021 (Gonzalez-Granda, 2018; Singer, 2021; Singer, 2011) |
|
Very low GRADE |
The evidence is very uncertain about the effect of use of indirect calorimetry-guided nutrition on long-term mortality compared to use of a simple predictive equations strategy (PE) in intensive care patients.
Source: Singer, 2021 |
Duration of mechanical ventilation (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of use of indirect calorimetry-guided nutrition on duration of mechanical ventilation compared to use of a simple predictive equations strategy (PE) in intensive care patients.
Source: Duan, 2021 (Gonzalez-Granda, 2018; Singer, 2021; Singer, 2011) |
Malnutrition/ Underfeeding/ Hyperalimentation/ Nutritional adequacy (important)
|
No GRADE |
No evidence was found regarding the effect of use of indirect calorimetry-guided nutrition on malnutrition, underfeeding, hyperalimentation, and nutritional adequacy when compared to use of a simple predictive equations strategy (PE) in intensive care patients.
Source: Duan, 2021 (Gonzalez-Granda, 2018; Singer, 2021; Singer, 2011) |
Length of hospital stay (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of use of indirect calorimetry-guided nutrition on length of hospital stay compared to use of a simple predictive equations strategy (PE) in intensive care patients.
Source: Duan, 2021 (Gonzalez-Granda, 2018; Singer, 2021; Singer, 2011) |
Samenvatting literatuur
Description of studies
One systematic review and meta-analyses was included. Duan (2021) sought to investigate whether indirect calorimetry (IC)-guided energy delivery strategy in critically ill patients may be more effective in reducing short-term mortality and other clinical outcomes than simple predictive equations (PE). Relevant outcome measures included short- and long-term mortality; clinical nutrition parameters after treatment (Mean energy delivered/day; Mean protein delivered/day); duration of mechanical ventilation; and length of hospital stay. They included eight RCTs, of which three studies fulfilled our inclusion criteria (i.e., PICO) and were included in the current review and analyses (no reporting of clinical end points (2); wrong comparison (1); wrong language (2)). Table 1 presents the main characteristics of the included RCTs. All RCTs recruited ventilated patients, with 294 patients in the IC group and 293 patients in the PE group, respectively. The IC measurements and predictive equations used were described in all trials. According to Duan (2021) the quality of the included RCTs was moderate, with the high-performance bias related to the lack of blinding of participants and personnel among most studies. In addition they reported that no obvious publication bias was observed by a visual inspection of the funnel plots in the meta-analysis.
Table 1. Main study characteristics.
|
Study |
Patients |
N; age (I/C) |
Intervention: Repeated indirect calorimetry-guided nutrition |
Control: Simple predictive equations strategy (PE) |
Nutrition therapy** |
|
|
Gonzalez-Granda, 2018 |
Ventilated patients, expected to stay in ICU 2 days |
20/20; 57/56 |
Frequency: Weekly test (until ICU discharge) |
Device: COSMED Quark RMR |
25 kcal/kg/day |
Fed preferentially by EN, supplemental or sole PN as required. Gradual increase in feeds from Day 1 to Day 4 |
|
Singer, 2020 |
Ventilated patients, expected to stay in ICU 2 days |
209/ 208; 59/61 |
Frequency: Everyday (two weeks) |
Device: Deltatrac II, COVX and Quark |
25 kcal/kg/day |
Fed preferentially by EN, supplemental PN as required |
|
Singer, 2011 |
Ventilated patients, expected to stay in ICU 3 days |
65/65; 59/62 |
Frequency: Measured every 2 days |
Device: Deltatrac II |
25 kcal/kg/day |
Aim of reaching energy goal within 24h of inclusion (EN+PN). |
**EN, enteral nutrition; ICU, intensive care unit; PN, parenteral nutrition.
Results
1. Mortality
1.1. Short-term mortality
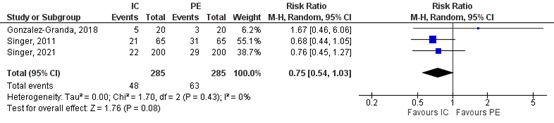
All three studies reported on short-term mortality, defined as ICU or hospital mortality or mortality within a 90-day follow-up after admission, with the longest observation period preferred. In the indirect calorimetry group 48 out of 285 (16.8%) patients died, versus 63 out of 285 (22.1%) in the PE-group. The pooled relative risk (RR) was 0.75 (95% CI 0.54 to 1.03; Figure 1). This was considered a clinically relevant difference in favor of indirect calorimetry, RR<0.95.
Figure 1. Short-term mortality; indirect calorimetry versus PE.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
IC, indirect calorimetry; PE, predictive equations strategy
1.2. Long-term mortality
Singer (2021) reported on long-term mortality, defined as mortality between hospital discharge and at least 180 days follow-up thereafter. In the indirect calorimetry group 7 out of 198 (3.5%) patients died, versus 8 out of 199 (4.0%) in the PE-group (RR 0.88; 95% CI 0.33 to 2.38). This was considered a clinically relevant difference in favor of indirect calorimetry, RR<0.95.
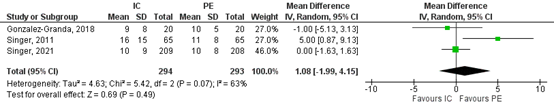
- Duration of mechanical ventilation
All three studies reported on duration of mechanical ventilation. The mean difference (MD) in duration of mechanical ventilation between the indirect calorimetry group (n=294) and PE-group (n=293) was 1.08 days in favor of PE (95%CI -1.99 to 4.15, Figure 2). This difference was considered a clinically relevant difference, MD >1 day.
Figure 2. Duration of mechanical ventilation; indirect calorimetry versus PE.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
IC, indirect calorimetry; PE, predictive equations strategy
- Malnutrition
Not reported.
- Underfeeding
Not reported.
- Hyperalimentation
Not reported.
- Nutritional adequacy
Not reported.
All three studies did not report on the above predefined outcomes (3-6); but did report information on metabolic and nutritional parameters. An overview of the parameters and associated MDs is provided in Table 2.
Overall, the nutritional parameters reported in table 2 are in favor of the indirect calorimetry intervention group.
Table 2. Metabolic and nutritional parameters; indirect calorimetry versus PE.
|
Study |
Enterally delivered (N) |
Parenterally delivered (N) |
Enterally and parenterally delivered (N) |
REE targets, kcal/day, mean ± SD |
Mean energy delivered/day, kcal/day, mean ± SD |
MD [95% CI] |
Mean parenterally delivered energy/day (kcal/d), mean ± SD |
MD [95% CI] |
Mean daily energy balance, kcal, mean ± SD |
MD [95% CI] |
Mean protein delivered/day, g/day |
MD [95% CI] |
Percent delivered energy over measured REE, % |
|||||||||
|
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
|||||
|
Gonzalez-Granda, 2018 |
12 |
14 |
1 |
1 |
7 |
5 |
21 ± 6 a |
25 a |
20 ± 6 a |
20 ± 8 a kcal/kg body weight/d |
0.00 [-4.38, 4.38] |
NR |
NR |
NR |
98% ±8% b |
79% ±29% b |
19.00 [-17.88, 55.88] |
78 ± 18 |
59 ± 21 |
19.00 [6.88, 31.12] |
98 |
79 |
|
Singer, 2020 |
NR |
NR |
NR |
NR |
NR |
NR |
1953 ± 580 |
1942 ± 360 |
1746 ± 755 |
1301 ± 535 |
445.00 [319.45, 570.55] |
1250 ± 502 |
772 ± 643 |
478.00 [367.24, 588.76] |
-282 ± 896 |
-885 ± 535 |
507.00 [379.79, 634.21] |
77 ± 53 |
62 ± 34 |
15.00 [6.46, 23.54] |
89 |
67 |
|
Singer, 2011 |
34 |
48 |
3 |
1 |
19 |
7 |
1976 ± 468 |
1838 ± 468 |
2086 ± 460 |
1480 ± 356 |
606.00 [464.59, 747.41] |
571 ± 754
|
164 ± 294
|
407.00 [210.26, 603.74] |
186 ± 206 |
-312 ± 481 |
507.00 [379.79, 634.21] |
76 ± 16 |
53 ± 16 |
23.00 [17.50, 28.50] |
106 |
81 |
a kcal/kg/day; b percent of reaching the target
CI, confidence interval, MD, mean difference; NR, not reported; REE, resting energy expenditure; SD, standard deviation
- Length of hospital stay
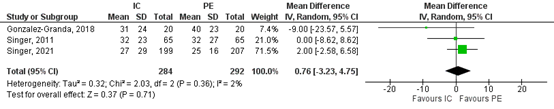
All three studies reported on length of hospital stay. The MD in duration of mechanical ventilation between the indirect calorimetry group (n=284) and PE-group (n=292) was 0.76 days in favor of PE (95%CI -3.23 to 4.75, Figure 3). This difference was considered not clinically relevant, MD <1 day.
Figure 3. Length of hospital stay; indirect calorimetry versus PE.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
IC, indirect calorimetry; PE, predictive equations strategy
Level of evidence of the literature
The level of evidence regarding the outcome measure short-term mortality started at high and was downgraded by three levels to very low because of study limitations (risk of bias; allocation concealment, lack of blinding, and incomplete outcome data, -1); conflicting results (inconsistency, -1); and the confidence interval crossing the threshold for clinical relevance (imprecision, -1).
The level of evidence regarding the outcome measure long-term mortality started at high and was downgraded by three levels to very low because of study limitations (risk of bias; allocation concealment, lack of blinding, and incomplete outcome data, -1); and the confidence interval crossing both thresholds for clinical relevance (imprecision, -2).
The level of evidence regarding the outcome measure duration of mechanical ventilation started at high and was downgraded by three levels to very low because of study limitations (risk of bias; allocation concealment, lack of blinding, and incomplete outcome data, -1); conflicting results (inconsistency, -1); and the confidence interval crossing both thresholds for clinical relevance (imprecision, -2).
There was no evidence regarding the outcome measure malnutrition, underfeeding, hyperalimentation, and nutritional adequacy.
The level of evidence regarding the outcome measure length of hospital stay started at high and was downgraded by three levels to very low because of study limitations (risk of bias; allocation concealment, lack of blinding, and incomplete outcome data, -1); conflicting results (inconsistency, -1); and the confidence interval crossing both thresholds for clinical relevance (imprecision, -2).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of monitoring a patient’s energy metabolism using indirect calorimetry versus conservative methods (simple predictive equations) in intensive care unit (ICU) patients?
Relevant outcome measures
The guideline development group considered mortality (short-term and long-term) as a critical outcome measure for decision making; and duration of mechanical ventilation, malnutrition, underfeeding, hyperalimentation, nutritional adequacy, and length of hospital stay as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following as a minimal clinically (patient) important difference:
- Mortality: a 5% difference relative risk was considered clinically relevant (0.95≤RR≥1.05);
- Duration of mechanical ventilation: a mean difference of >1 day was considered clinically relevant;
- Malnutrition: a 10% difference relative risk was considered clinically relevant (0.91≤RR≥1.10);
- Underfeeding: a 10% difference relative risk was considered clinically relevant (0.91≤RR≥1.10);
- Hyperalimentation: a 10% difference relative risk was considered clinically relevant (0.91≤RR≥1.10);
- Nutritional adequacy: a 10% difference relative risk was considered clinically relevant (0.91≤RR≥1.10);
- Length of hospital stay: a mean difference of >1 day was considered clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 19-07-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 143 hits. Studies were selected based on the following criteria:
- systematic reviews or randomized controlled trials;
- full-text English language publication;
- adults aged > 18 years;
- studies according to the PICO.
Six studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study (a systematic review and meta-analysis) was included.
Results
One systematic review and meta-analysis (Duan, 2021) was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Berger MM, Pichard C, Fontaine E. Optimal energy delivery and measured energy expenditure-impact of length of stay. Crit Care. 2017 Feb 22;21(1):39. doi: 10.1186/s13054-017-1612-6. PMID: 28222803; PMCID: PMC5320653.
- De Waele E, Jonckheer J, Wischmeyer PE. Indirect calorimetry in critical illness: a new standard of care? Curr Opin Crit Care. 2021 Aug 1;27(4):334-343. Doi: 10.1097/MCC.0000000000000844. PMID: 33990505; PMCID: PMC8367824.
- De Waele E, van Zanten ARH. Routine use of indirect calorimetry in critically ill patients: pros and cons. Crit Care. 2022 May 5;26(1):123. Doi: 10.1186/s13054-022-04000-5. PMID: 35513872; PMCID: PMC9069947.
- Duan JY, Zheng WH, Zhou H, Xu Y, Huang HB. Energy delivery guided by indirect calorimetry in critically ill patients: a systematic review and meta-analysis. Crit Care. 2021 Feb 27;25(1):88. Doi: 10.1186/s13054-021-03508-6. PMID: 33639997; PMCID: PMC7913168.
- Elke G, Hartl WH, Kreymann KG, Adolph M, Felbinger TW, Graf T, de Heer G, Heller AR, Kampa U, Mayer K, Muhl E, Niemann B, Rümelin A, Steiner S, Stoppe C, Weimann A, Bischoff SC. Clinical Nutrition in Critical Care Medicine - Guideline of the German Society for Nutritional Medicine (DGEM). Clin Nutr ESPEN. 2019 Oct;33:220-275. doi: 10.1016/j.clnesp.2019.05.002. Epub 2019 Jul 9. PMID: 31451265.
- Gosty?ska A, Stawny M, Dettlaff K, Jeli?ska A. Clinical Nutrition of Critically Ill Patients in the Context of the Latest ESPEN Guidelines. Medicina (Kaunas). 2019 Dec 2;55(12):770. Doi: 10.3390/medicina55120770. PMID: 31810303; PMCID: PMC6955661.
- Heyland DK, Cahill N, Day AG. Optimal amount of calories for critically ill patients: depends on how you slice the cake! Crit Care Med. 2011 Dec;39(12):2619-26. doi: 10.1097/CCM.0b013e318226641d. PMID: 21705881.
- Lakenman PLM, van der Hoven B, Schuijs JM, Eveleens RD, van Bommel J, Olieman JF, Joosten KFM. Energy expenditure and feeding practices and tolerance during the acute and late phase of critically ill COVID-19 patients. Clin Nutr ESPEN. 2021 Jun;43:383-389. Doi: 10.1016/j.clnesp.2021.03.019. Epub 2021 Apr 2. PMID: 34024544; PMCID: PMC8016730.
- Oshima T, Graf S, Heidegger CP, Genton L, Pugin J, Pichard C. Can calculation of energy expenditure based on CO2 measurements replace indirect calorimetry? Crit Care. 2017 Jan 21;21(1):13. doi: 10.1186/s13054-016-1595-8. Erratum in: Crit Care. 2017 Apr 12;21(1):95. PMID: 28107817; PMCID: PMC5251283.
- Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, Hiesmayr M, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Oczkowski S, Szczeklik W, Bischoff SC. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019 Feb;38(1):48-79. Doi: 10.1016/j.clnu.2018.08.037. Epub 2018 Sep 29. PMID: 30348463. Achamtrah et al, Clin Nutr 40(2021):4-14
- Stapel SN, de Grooth HJ, Alimohamad H, Elbers PW, Girbes AR, Weijs PJ, Oudemans-van Straaten HM. Ventilator-derived carbon dioxide production to assess energy expenditure in critically ill patients: proof of concept. Crit Care. 2015 Oct 22;19:370. doi: 10.1186/s13054-015-1087-2. PMID: 26494245; PMCID: PMC4619027.
- Zusman O, Theilla M, Cohen J, Kagan I, Bendavid I, Singer P. Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study. Crit Care. 2016 Nov 10;20(1):367. doi: 10.1186/s13054-016-1538-4. PMID: 27832823; PMCID: PMC5105237.
- Zusman O, Singer P. Resting energy expenditure and optimal nutrition in critical care: how to guide our calorie prescriptions. Crit Care. 2017 Jun 5;21(1):128. doi: 10.1186/s13054-017-1717-y. PMID: 28583147; PMCID: PMC5460320.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Duan, 2021
[individual study characteristics deduced from Duan, 2021]
PS., study characteristics and results are extracted from the SR (unless stated otherwise, indicated by **) |
SR and meta-analysis of RCTs
Literature search up to October 25, 2020
A: Gonzalz-Granda, 2018 B: Singer, 2021 C: Singer, 2011
Study design: RCT [parallel / cross-over], cohort [prospective / retrospective], case-control
Setting and Country: Beijing Tsinghua Changgung Hospital, China
Source of funding and conflicts of interest: Funding: none; Conflict: The authors declare that they have no competing interests.
|
Inclusion criteria SR: critical adult patients (≥18 years) receiving calories either guided by repeated IC (IC group) or a simple predictive equation (control group).
Exclusion criteria SR: Studies that used the combined energy delivery and any other nutritional regimens; studies recruiting children, breastfeeding women or pregnant, or studies without reporting any predefined outcomes; Animal studies, case reports, and reviews; Articles available only in abstract form or meeting reports.
The SR included eight RCTs, of which three studies included in this literature review.
Important patient characteristics at baseline:
N (I/C); mean age (I/C) A: 20/20; 57/56 B: 209/ 208; 59/61 C: 65/65; 59/62
Male N% (I/C) A: 65/55 B: 44/53 C: 35/41
BMI, kg/m2 (I/C) A: 28/25 B: 28/28 C: 28/27
IC device A: COSMED Quark RMR B: Deltatrac II, COVX and Quark C: Deltatrac II
Nutrition therapy: A: Fed preferentially by EN*, supplemental or sole PN* as required. Gradual increase in feeds from Day 1 to Day 4 B: Fed preferentially by EN*, supplemental PN* as required C: Aim of reaching energy goal within 24h of inclusion (EN+PN*).
*EN, enteral nutrition; PN, parenteral nutrition
Groups comparable at baseline? Yes. |
Repeated indirect calorimetry (IC)-guided nutrition
Frequency: A: Weekly test B: Everyday C: Measured every 2 days
|
Simple predictive equations strategy (PE)
A: 25 kcal/kg/day B: 25 kcal/kg/day C: 25 kcal/kg/day
|
End-point of follow-up:
A: until ICU discharge B: two weeks C: two weeks
For how many participants were no complete outcome data available? (intervention/control)
Not described; but analyses show missing data for Singer 2020 for length of stay in hospital.
|
Mortality Short-term mortality Defined as ICU or hospital mortality or mortality within a 90-day follow-up after admission, with the longest observation period preferred
(events) A: I: 5 of 20 B: I: 22 of 200 C: I: 21 of 65
Long-term mortality Defined as mortality between hospital discharge and at least 180 days follow-up thereafter
Ventilator free days à Duration of mechanical ventilation (mean, SD) A: I: 9, 8 (N=20) B: I: 10, 9 (N=209) C: I: 16, 15 (N=65)
Nutrition therapy (SEE TABLE BELOW) àMalnutrition; Underfeeding; Hyperalimentation (Mean parenterally delivered energy/day (kcal/d)); Nutritional adequacy
Length of hospital stay (mean, SD) A: I: 31, 24(N=20) B: I: 27, 29 (N=199) C: I: 32, 23 (N=65)
|
SR/MA objective: To evaluate the clinical outcomes of an IC-guided nutrition therapy compared to predictive equations strategy in critically ill patients |
|
Study |
REE targets, kcal/day, mean ± SD |
Mean energy delivered/day, kcal/day, mean ± SD |
Mean parenterally delivered energy/day (kcal/d)** |
Mean daily energy balance, kcal, mean ± SD |
Mean protein delivered/day, g/day |
Percent delivered energy over measured REE, % |
||||||
|
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
I |
C |
|
|
A: Gonzalez-Granda, 2018 |
21 ± 6 a |
25 a |
20 ± 6 a |
20 ± 8 a |
EN/PN: N=7 PN: N=1 |
EN/PN: N=5 PN: N=1 |
98% ±8% b |
79% ±29% b |
78 ± 18 |
59 ± 21 |
98 |
79 |
|
B: Singer, 2020 |
1953 ± 580 |
1942 ± 360 |
1746 ± 755 |
1301 ± 535 |
1250 ± 502 |
772 ± 643 |
-282 ± 896 |
-885 ± 535 |
77 ± 53 |
62 ± 34 |
89 |
67 |
|
C: Singer, 2011 |
1976 ± 468 |
1838 ± 468 |
2086 ± 460 |
1480 ± 356 |
571 ± 754
EN/PN: N=19 PN: N=3 |
164 ± 294
EN/PN: N=7 PN: N=1 |
186 ± 206 |
-312 ± 481 |
76 ± 16 |
53 ± 16 |
106 |
81 |
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Duan, 2021 (including A: Gonzalz-Granda, 2018 B: Singer, 2021 C: Singer, 2011) |
Yes |
Yes |
Yes, flow chart with selection process for studies included in the meta-analysis is presented |
Yes (study/year; study design; patients characteristics; study regimen; IC device; nutrition therapy parameters; study period) |
N.a. |
Potential evidence of bias using the Cochrane risk-of-bias tool for RCTs: A value of high, unclear, low was assigned to the following items: (1) sequence generation; (2) allocation concealment; (3) blinding; (4) incomplete outcome data; (5) selective outcome reporting; and (6) other sources of bias.
The quality of the included RCTs was moderate, with the high-performance bias related to the lack of blinding of participants and personnel among most studies.
A: high 2,3,4 |
Yes |
Yes, authors report that no obvious publication bias was observed by a visual inspection of the funnel plots in the present meta-analysis. |
Not reported |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Cattani, 2022 |
wrong publication type |
|
Allingstrup, 2017 |
wrong intervention |
|
Azevedo, 2019 |
wrong intervention |
|
Gonzalez-Granda, 2021 |
wrong outcome |
|
Landes, 2016 |
in SR (Duan, 2021) |
|
Gonzalez-Granda, 2019 |
in SR (Duan, 2021) |
|
Tatucu-Babet, 2020 |
less recent and complete SR compared to Duan (2021) |
|
Singer, 2021 |
in SR (Duan, 2021) |
|
Tatucu-Babet, 2016 |
wrong outcome |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-03-2024
Beoordeeld op geldigheid : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de
samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die gevoed worden op de intensive care.
Werkgroep
dr. R. (Robert) Tepaske, intensivist, (voorzitter) NVIC
Prof. dr. A.R.H. (Arthur) van Zanten, intensivist, NVIC
dr. M.C.G. (Marcel) van de Poll, intensivist, NVIC
drs. B. (Ben) van der Hoven, internist, NIV
drs. E.J. (Lisa) Mijzen, anesthesioloog-intensivist, NVA
dr. F.J. (Jeannette) Schoonderbeek, chirurg-intensivist, NVvH
L. (Lea) van Duijvenbode - den Dekker, MSc, intensive care verpleegkundige, V&VN Intensive Care
M. (Manon) Mensink, diëtist, NVD
Ir. S. (Suzanne) ten Dam, diëtist, NVD
I. (Idske) Dotinga, ervaringsdeskundige, FCIC/IC Connect
Klankbordgroep
Mevr. E.R. (Elske) van Liere, logopedist, NVLF
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Actie |
|
* Voorzitter werkgroep Tepaske |
Anesthesioloog-Intensivist Begeleider Nurse practitioners profielen circulation & ventilation apotheek |
Allen onbezoldigd:
|
geen |
geen |
geen |
geen |
Eenmalig vergoeding voor deelname aan masterclass 'meten van metabolisme' van Hamilton, Zwitserland |
Geen actie vereist. |
|
Van Zanten |
lnternist-intensivist |
Onbetaald: |
Geen aandelen, opties, patenten of producten |
Echtgenote leidt Congres- en Organisatiebureau Interactie dat voor vele wetenschappelijke |
Precise trial (MUMC+), MC RCT, ZonMW/KCE NL/Belgie. studie naar hoog-eiwit vs. normaal eiwit voor |
richtlijnmaker van ESPEN richtlijn |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van Zanten zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
Mensink |
Diëtist Rijnstate Arnhem |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
Schoonderbeek |
Chirurg-intensivist staflid Intensive Care |
medisch adviseur, freelance |
nvt |
nvt |
nvt |
nvt |
nvt |
Mevr. Schoonderbeek werkt als freelance medisch adviseur voor Veduma in Zaltbommel. Ze adviseert voornamelijk in letselschade zaken (na aanrijdingen e.d.). Dit heeft nooit iets met voeding te maken. Waardoor geen restricties hoeven worden opgelegd. |
|
Van Duijvenbode-Den Dekker |
Intensive care verpleegkundige - Amphia ziekenhuis Breda |
Visitatie commissie NVIC via V&VN IC |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Mijzen |
Anesthesioloog- Intensivist Beatrix ziekenhuis Gorinchem |
FCCS- instructeur, betaald Bestuurslid sectie IC-NVA, onbetaald. |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Dotinga |
Functienaam: Trainee beleid en management in zorg en welzijn |
nvt |
nvt |
nvt |
nvt |
nvt |
|
Geen actie vereist. |
|
van de Poll |
Chirurg-intensivist, Staflid Maastricht UMC |
geen |
geen |
geen |
Contractant:ZONMW (Doelmatigheid): INCEPTION trial (multicenter RCT naar ECPR bij OHCA), ZONMW/KCE (BeNeFIT) PRECISe trial (multicenter RCT naar hoog vs normaal eiwit in enterale voeding bij IC patienten), Fresenius-kabi: traceronderzoek naar glutaminemetabolisme in sepsis, Cytosorb CYTATION trial (single center RCT naar gebruik van cytosorb bij vasoplegie), Getinge: co-financiering INCEPTION trial, Nutricia:co-financiering (in-kind) PRECISe trial, NUTRICIA research foundation/Nestle ESICM research grant: single center RCT naar elementaire voeding bij diarree. Consultancy Bayer R&D (data based algorithm development in ARDS) |
geen |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van der Poll zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
van der Hoven |
Internist-intensivist, staflid IC Volwassenen, Erasmus MC te Rotterdam |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
ten Dam |
Diëtist-onderzoeker OPRAH studie, Amsterdam UMC |
Bestuurslid NVO (Nederlandse Voedingsteam Overleg), onbetaald. Docent Focus op Voeding, VBNU, betaald, Docent Master Health Sciences, VU, onbetaald.
|
geen |
geen |
OPRAH_CT studie; RCT effect sarcopenie op fysiek functioneren. Subsidie AMS. OPRAH_PRO studie; haalbaarheidsstudie OPRAH RCT. Subsidie CCA. |
geen |
geen |
Geen actie vereist. |
|
van Liere |
Logopedist, Adrz |
nvt |
Logopedist in dienst van ziekenhuis, o.a. ICU |
nvt |
nvt |
Nvt |
nvt |
Geen actie vereist. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van FCIC/IC Connect voor de schriftelijke knelpunteninventarisatie, en afvaardiging van FCIC/IC Connect in de werkgroep. Het verslag van de schriftelijke knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FCIC/IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Monitoren energiemetabolisme |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die voeding op de intensive care krijgen. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden daarom meegewogen. Voorbeelden zijn: Aanvullende argumenten uit de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. Deze overwegingen kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag. Zij zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd onder alle mogelijke omstandigheden en voor elke individuele patiënt van toepassing zijn.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: Alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur) zijn in de overwegingen meegenomen. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Database(s): Ovid/Medline, Embase.com |
Datum: 19 juli 2022 |
|
Periode: 2012 - heden |
Talen: Engels, Nederlands |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
39 |
27 |
40 |
|
RCT |
96 |
57 |
103 |
|
|
|
|
|
|
Totaal |
135 |
84 |
143 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#13 |
#11 OR #12 |
135 |
|
#12 |
#8 AND #10 NOT #11 = RCT |
96 |
|
#11 |
#8 AND #9 = SR |
39 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1934168 |
|
#9 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#8 |
#6 AND #7 AND ([english]/lim OR [dutch]/lim) AND [2012-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
678 |
|
#7 |
'critically ill patient'/exp OR 'intensive care'/exp OR 'intensive care unit'/exp OR 'critical illness'/exp OR (((intensive OR critical*) NEAR/3 (care OR patient* OR ill*)):ti,ab,kw) OR icu:ti,ab,kw OR 'pneumonia'/exp OR 'burn'/exp OR 'respiratory failure'/exp OR 'head injury'/exp OR 'pancreatitis'/exp OR pneumonia:ti,ab,kw OR burn*:ti,ab,kw OR pancreatitis:ti,ab,kw OR trauma:ti,ab,kw OR injur*:ti,ab,kw OR failure*:ti,ab,kw OR severe:ti,ab,kw OR 'artificial ventilation'/exp OR (((artificial OR mechanical) NEAR/3 (ventilation OR respiration)):ti,ab,kw) |
5359904 |
|
#6 |
'indirect calorimetry'/exp OR ((indirect* NEAR/2 calorimet*):ti,ab,kw) |
10666 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
8 or 9 |
84 |
|
9 |
(5 and 7) not 8 = RCT |
57 |
|
8 |
5 and 6 = SR |
27 |
|
7 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1531644 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
606896 |
|
5 |
4 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
529 |
|
4 |
limit 3 to ((english language or dutch) and yr="2012 -Current") |
579 |
|
3 |
1 and 2 |
1572 |
|
2 |
exp Calorimetry, Indirect/ or (indirect* adj2 calorimet*).ti,ab,kf. |
8657 |
|
1 |
exp Critical Care/ or exp Critical Illness/ or exp Intensive Care Units/ or ((intensive or critical*) adj3 (care or patient* or ill*)).ti,ab,kf. or ICU.ti,ab,kf. or exp Pneumonia/ or exp Burns/ or exp Respiratory Insufficiency/ or exp Craniocerebral Trauma/ or exp Pancreatitis/ or (pneumonia or burn* or pancreatitis or trauma or injur* or failure* or severe).ti,ab,kf. or exp Respiration, Artificial/ or ((artificial or mechanical) adj3 (ventilation or respiration)).ti,ab,kf. |
3557878 |