Eiwitten bij nierinsufficiëntie
Uitgangsvraag
Wat is de optimale dosering van eiwitten voor patiënten op de IC met nierinsufficiëntie?
Aanbeveling
Geef een standaard hoeveelheid eiwit (1,3-1,5 g/kg lichaamsgewicht/dag) bij patiënten op de IC met nierinsufficiëntie die (nog) niet worden behandeld met nierfunctievervangende therapie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek verricht naar de effectiviteit van eiwitverrijking in vergelijking met een standaard hoeveelheid eiwit bij patiënten met nierinsufficiëntie op de IC. Hierbij zijn drie RCT’s geïncludeerd. Als cruciale uitkomstmaten voor de besluitvorming zijn mortaliteit, IC-opnameduur en ziekenhuis opnameduur meegenomen. Daarnaast werden duur van mechanische beademing, duur van nierinsufficiëntie en het gebruik van nierfunctievervangende therapie als belangrijke uitkomstmaten meegenomen.
Subgroep analyses suggereren een mogelijk schadelijk effect van hoog-eiwit voeding voor IC-patiënten met nierinsufficiëntie op mortaliteit na 60 dagen. Dit is gebaseerd op één enkele studie (Heyland 2013, low GRADE).
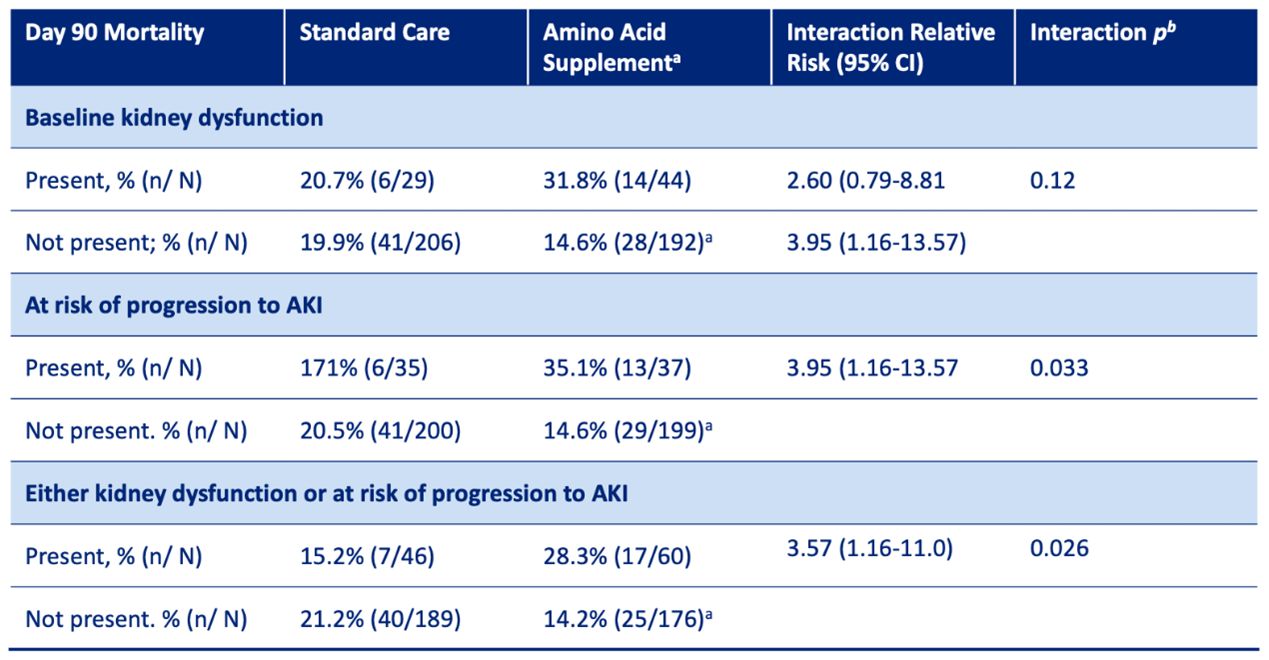
In een post-hoc, hypothese-genererende subgroepanalyse van de studie van Doig (2015) werden in totaal 474 patiënten gerandomiseerd, waarvan 235 standaardzorg kregen en 239 intraveneuze aminozuursuppletie ontvingen. Er was een statistisch significante interactie tussen de nierfunctie bij aanvang en suppletie met aminozuren (p-waarde voor interactie = 0,026) (Zhu, 2018). Bij patiënten met risico op acute nierinsufficiëntie (AKI) en/of het bestaan van nierinsufficiëntie met een verhoogd risico op AKI bij IC-opname werd een verhoogd risico op 90-dagen sterfte waargenomen (zie tabel).
Het effect van eiwitverrijking op de IC- en ziekenhuisopnameduur is erg onzeker. Dit komt door risico op bias, brede betrouwbaarheidsintervallen en ook het feit dat er mensen zonder nierinsufficiëntie of een andere vorm van orgaanfalen werden geïncludeerd. Daarom is er ook voor deze uitkomstmaten geen eenduidige conclusie te trekken en is de GRADE beoordeling zeer laag.
Voor duur van mechanische beademing en duur van nierinsufficiëntie lijkt er niet tot nauwelijks effect te zijn van eiwitverrijking. Voor duur van mechanische beademing is er afgewaardeerd vanwege risico op bias en indirectheid (niet iedereen was nierinsufficiënt).
Voor duur van nierinsufficiëntie is er afgewaardeerd vanwege imprecisie, en ook vanwege indirectheid (niet iedereen was nierinsufficiënt). Bovendien zijn er voor beide uitkomstmaten geen klinisch relevante verschillen gevonden. De GRADE beoordeling komt uit op laag.
Voor het gebruik van nierfunctievervangende therapie is het effect van eiwitverrijking erg onzeker. De GRADE beoordeling komt uit op zeer laag. Er is afgewaardeerd vanwege indirectheid (niet iedereen was nierinsufficiënt) en een laag aantal patiënten en events.
Na het afronden van de search met de PICO-vragen is nog een belangrijke RCT gepubliceerd: de NUTRIREA-3 studie van Reignier (2023). De NUTRIREA-3 studie onderzocht wat de optimale energie- en eiwitinname is bij patiënten in de acute fase van een ernstige kritieke ziekte. De studie wees uit dat een vroege beperking van energie- en eiwitinname, in vergelijking met standaard energie- en eiwittargets, niet leidde tot een vermindering van de mortaliteit, maar wel geassocieerd was met een snellere herstelperiode en minder complicaties. 3044 patiënten werden willekeurig toegewezen aan de interventie, waarbij 628 (41,3%) van de patiënten in de beperkte energie- en eiwitgroep en 648 (42,8%) van de patiënten in de standaardgroep overleden waren op dag 90. Ook was er geen verschil in de toepassing van nierfunctievervangende therapie. Het is van belang te beseffen dat de volledige voedingsgroep 0.9 gram eiwit/kg lichaamsgewicht per dag kreeg toegediend en de restrictieve groep 0.2 gram eiwit/kg lichaamsgewicht per dag. Verder was er ook een aanzienlijk verschil in calorieën waarmee het effect van eiwittoediening niet los te zien is van de energie-inname (7,4 vs. 22.0 kcal/kg per dag). Een post-hoc analyse onder de 12% nierinsufficiëntie patiënten bij aanvang van de studie ontbreekt nog. De uitkomsten van deze studie veranderen daarom de bevindingen van de PICO-search en analyse niet.
Een praktisch probleem van het verhogen van de beoogde eiwitdosis is het feit dat het meer toedienen van sondevoeding of parenterale voeding per dag ook leidt tot een toename van de energie-inname. Overvoeding is geassocieerd met slechtere uitkomsten en dient vermeden te worden. Daarom dient overwogen te worden voeding te selecteren met een hogere eiwit/aminozuur:energie-ratio te selecteren. Inmiddels zijn deze producten toenemend beschikbaar. In een recente studie die vanuit Nederland werd gecoördineerd bleek dat een sondevoeding met meer dan 30% energie bestaand uit eiwit in staat was een intake van 1,5 gram/kg lichaamsgewicht per dag kon realiseren waarbij een standaard hoog-eiwit voeding niet verder kwam dan 0,75 gram/kg lichaamsgewicht per dag, zonder aanleiding te geven tot overvoeding, en met een goede enterale voedingstolerantie (van Zanten, 2018).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het bepalen van de eiwitdosis is één van de vele “ondersteunende therapieën” op de Intensive Care. Het is om deze reden niet gebruikelijk om de beslissing m.b.t de eiwitdosis over te laten aan de patiënt of diens vertegenwoordiger.
Kosten (middelenbeslag)
Het toepassen van de aanbeveling heeft geen (negatief) effect op de kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Gezien de uitkomst in voordeel van standaard care is, worden er geen bijzonderheden verwacht wat betreft aanvaardbaarheid, haalbaarheid en implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Een eiwitverrijkt dieet (> 1,6 gram/kg lichaamsgewicht per dag) vergeleken met een standaard dieet bij patiënten op de IC met nierinsufficiëntie kan mogelijk mortaliteit verhogen en heeft niet tot nauwelijks invloed op duur van de mechanische beademing en duur van nierinsufficiëntie. Het is onduidelijk wat het effect is op het gebruik van nierfunctievervangende therapie en opnameduur in het ziekenhuis en de IC. Aangezien in deze literatuuranalyse geen gunstige effecten, maar wel een ongunstig effect op mortaliteit (lage bewijskracht) met een eiwitverrijkt dieet werd gevonden, bevelen we een standaard hoeveel eiwit aan bij patiënten op de IC met nierinsufficiëntie die (nog) niet worden behandeld met nierfunctievervangende therapie. Ter verduidelijking, deze aanbeveling is niet van toepassing op patiënten met nierinsufficiëntie die nierfunctievervangende therapie krijgen of patiënten zonder nierinsufficiëntie, aangezien deze patiënten mogelijk profiteren van een eiwitrijk dieet.
Onderbouwing
Achtergrond
Bij patiënten met multiple orgaanfalen kan spiermassaverlies in de eerste 10 dagen oplopen tot 1 kg per dag (Puthucheary, 2013). Dit verlies wordt veroorzaakt door immobilisatie en inflammatie, wat resulteert in een continue katabole respons, zelfs bij adequate voeding en anabole hormoontherapie, zoals insuline. Het verlies van spiermassa is in verband gebracht met ICU acquired weakness en lange-termijnuitkomsten zoals functionele beperkingen die deel uitmaken van het Post-Intensive Care Syndroom (PICS). Ditzelfde effect wordt ook waargenomen bij patiënten met ernstige COVID-19-pneumonie (long-COVID of Past-Acute-COVID-19 Syndrome of PACS).
De katabole respons kan vaak alleen worden behandeld door optimale behandeling van het onderliggende lijden. Echter, het toedienen van exogeen eiwit via voeding kan helpen door het aanbieden van substraat in de vorm van aminozuren. Hoewel een hogere eiwitinname leidt tot een betere stikstofbalans, kan het spiermassaverlies niet volledig worden omgekeerd. Desondanks kan een hogere eiwitdosis wel spiermassaverlies verminderen (Boelens, 2022).
De dosering en toediening van aminozuren zijn cruciaal voor het bereiken van de gewenste effecten. De voorschriften voor aminozuurdosering zijn vaak te laag en de gerealiseerde dosis is frequent ontoereikend door voedingsintolerantie bij enterale voeding. Bovendien wordt vaak op het totale lichaamsgewicht of ideaal lichaamsgewicht gedoseerd, terwijl het doseren op de vetvrije massa een logischere benadering zou zijn. Om deze benadering toe te passen, moet echter eerst de individuele lichaamssamenstelling worden bepaald, wat in de praktijk weinig gebeurt.
Hoewel de digestie en absorptie van aminozuren bij IC-patiënten verrassend goed blijken te zijn, speelt de utilisatie in de spiercel een cruciale rol (Chapple, 2022). Bij IC-patiënten is er sprake van anabole resistentie, waarbij aangeboden aminozuren niet kunnen worden gebruikt voor eiwitsynthese omdat de spier minder gevoelig is voor eenzelfde hoeveelheid eiwit. Dit fenomeen wordt verergerd door de mitochondriële dysfunctie die bij deze patiënten aanwezig is. Wanneer er een gebrek aan energie in de cel is, wordt een proteostatisch fenotype geïnduceerd dat verdere afbraak van spiermassa bevordert.
Als aminozuren te hoog worden gedoseerd, kunnen er nadelige gevolgen optreden die samenhangen met de volgende pathofysiologische mechanismen (Gunst, 2023):
- Aminozuren kunnen worden omgezet in glucose via de gluconeogenese, potentieel bijdragend aan een toename van hyperglycemie en insulineongevoeligheid.
- In de context van mitochondriële disfunctie, productie van reactieve zuurstofspecies.
- Autofagie is een opruimmechanisme voor grote eiwitfragmenten in cellen. Een autofagie deficiënt fenotype is geassocieerd met cellulaire apoptose, en orgaanfalen in tal van ziektebeelden. Onderdrukking van autofagie kan optreden bij hoge doses aminozuren.
- Het remmen van ketogenese als alternatieve energiebron bij mitochondriële dysfunctie.
- Het versneld afbreken van hepatische eiwitten in de context van verhoogd glucagon (vaak voorkomend bij katabole IC-patiënten, ondanks de toediening van insuline).
- Productie van afvalstoffen zoals ureum door verhoogde ureagenese door het niet kunnen utiliseren van aminozuren voor spiereiwitsynthese.
De meest recente ESPEN-richtlijn adviseert om geleidelijk een eiwitdoel van tenminste 1,3 gram eiwit/kg lichaamsgewicht na te streven over meerdere dagen (Singer, 2019). Bij patiënten met nierinsufficiëntie is het echter onduidelijk wat de beste strategie is. Deze patiënten zijn doorgaans ernstig katabool en lopen daardoor een groot risico op spiermassaverlies, wat verergerd kan worden door een te laag eiwitaanbod. Aan de andere kant kan eiwittoediening resulteren in een hogere ureumproductie, dat vanwege de nierinsufficiëntie minder efficiënt via de urine uit het lichaam kan worden verwijderd. Te veel eiwit kan potentieel schadelijk zijn, dus het is belangrijk om te weten wat de optimale eiwitdosis is voor patiënten met nierinsufficiëntie op de IC.
Conclusies / Summary of Findings
Mortality
|
Low GRADE |
A high-protein diet (> 1.6 grams/kg bodyweight per day) may increase mortality when compared with a standard diet in ICU patients with renal insufficiency.
Source: Heyland, 2023 |
Length of ICU and hospital stay
|
Very low GRADE |
It is unclear what the effect is of a high-protein diet (> 1.6 grams/kg bodyweight per day) on length of ICU and hospital stay, as compared to a standard diet in ICU patients with renal insufficiency.
Source: Doig, 2015; Heyland, 2023 |
Duration of mechanical ventilation
|
Low GRADE |
A high-protein diet (> 1.6 grams/kg bodyweight per day) may result in little to no difference in duration of mechanical ventilation when compared with a standard diet in ICU patients with renal insufficiency.
Source: Doig, 2015; Heyland, 2023 |
Duration of renal dysfunction
|
Low GRADE |
A high-protein diet (> 1.6 grams/kg bodyweight per day) may result in little to no difference in duration of renal dysfunction when compared with a standard diet in ICU patients with renal insufficiency.
Source: Doig, 2015 |
Use of renal replacement therapy
|
Very low GRADE |
It is unclear what the effect is of a high-protein diet (> 1.6 grams/kg bodyweight per day) on use of RRT, as compared to a standard diet in ICU patients with renal insufficiency.
Source: Doig, 2015; Singer, 2007 |
Samenvatting literatuur
Description of studies
An overview of the three included studies is depicted in table 1.
Table 1. Characteristics of included studies.
|
Author, year |
Population |
Intervention |
Control |
N (I/C) |
|
Singer (2007) |
Critically ill patients with acute renal failure |
150 g/day of IV amino acids |
75 g/day of IV amino acids |
8/6 |
|
Doig (2015) |
Critically ill |
100 g/day of IV amino acids Maximum protein intake of 2.0 g/kg/day |
Standard care
|
239/235 |
|
Heyland (2023) |
Critically ill patients |
≥2.2 g protein/kg/day
Protocol adherence: mean 1.6 (SD 0.5) g/kg per day
|
≤1.2 g protein /kg/day
Protocol adherence: mean 0.9 (0.3) g/kg per day |
645/656 AKI-subgroup 163/149 |
Singer (2007) performed an RCT (randomized controlled trial) to examine the effect of high-dose amino acids on the glomerular filtration rate and nitrogen balance in critically ill patients with acute renal failure. Patients had a creatinine clearance of < 50 ml/min and conserved diuresis above 2000 ml/day. Patients received either high-dose amino acids (150g/day) (n = 8), or normal-dose amino acids (75g/day) (n = 6). All participants received 2000 kcal/day of non-protein calories. Relevant outcome measures include the need for hemodialysis (important).
Doig (2015) performed a multicenter, phase II, RCT to determine whether daily IV amino acid supplementation preserves kidney function in critically ill patients. A total of 474 patients, expected to remain in the study ICU for longer than two days, were randomized at the ICU. Patients in the intervention group received a daily supplement of up to 100 g of IV amino acids (n = 239) and achieved a maximum total daily protein intake of 2.0 g/kg/day. 18.4% of these patients had renal dysfunction at study entry. The control group received standard nutrition care (n = 235), and 12.3 % of these patients had renal dysfunction at study entry. Relevant outcome measures include day-90 mortality (critical), length of ICU and hospital stay (critical), mechanical ventilation days (important), duration renal dysfunction (important) and use of renal replacement therapy (important).
Heyland (2023) performed a single-blinded, RCT to investigate whether higher protein dosing improves clinical outcomes in critically ill patients. A total of 1329 adult patients, expected to remain mechanically ventilated for at least 48h from screening with at least one nutritional risk factor were randomized within 96h of ICU admission. Patients were randomly assigned to the high-dose (≥2.2 g/kg/day) protein group (n = 645, 25% of patients had AKI at time of randomization), or the usual dose (≤1.2 g/kg/day) protein group (n = 656, 23% of patients had AKI at time of randomization). Patients in the high-dose group received a mean of 1.6 (SD 0.5) g/kg per day protein compared with 0.9 (0.3) g/kg per day in the usual dose group. Relevant outcome measures include 60-day mortality (critical) and length of ICU, hospital stay (critical) and duration of mechanical ventilation (important).
Results
1. Mortality
Two studies (Doig, 2015; Heyland, 2023) reported on mortality.
Heyland (2023) reported on 60-day mortality rate. Subgroup analyses were performed based on the presence of acute kidney injury (AKI) at baseline. For patients with baseline AKI, the 60-day mortality rate was 55.2% (90/163 patients) in the high-dose protein group and 39.6% (59/149 patients) in the usual dose protein group. The relative risk (RR) was 1.4 (95% CI 1.1 to 1.8). This difference was clinically relevant in favor of usual dose protein. For patients without baseline AKI, the 60-day mortality rate was 26.6% (128/482 patients) in the high-dose protein group and 29.4% (149/507 patients) in the usual dose protein group. The RR was 0.9 (95% CI 0.8 to 1.1). This difference was clinically relevant in favor of high protein.
Doig (2015) reported on day-90 mortality in the critically ill IC population. Day-90 mortality was reported in 42 out of 236 (17.8%) patients in the amino acid supplement group and 47 out of 235 (20.0%) patients in the standard care group. The RR was 0.89 (95% CI 0.61 to 1.29). This difference was clinically relevant in favor of amino acid supplementation. This outcome is not included in the conclusion because we are interested in the renal insufficient group.
2. Length of ICU stay
Two studies (Doig, 2015; Heyland, 2023) reported on length of ICU stay. Data could not be pooled because different types of values were reported.
Doig (2015) reported a mean ICU stay of 11.6 days (95% CI 10.8 to 12.5) in the amino acid supplement group and 10.7 days (95% CI 10.0, 11.5) in the standard care group. The mean difference (MD) was 0.91 days (95% CI -0.62 to 2.68) in favor of the standard care group.
Heyland (2023) reported a median (Q1-Q3) ICU stay of 10.0 days (5.6-18.2) in the high-dose protein group and 9.4 days (5.1-19.2) in the usual dose protein group.
3. Length of hospital stay
Two studies (Doig, 2015; Heyland, 2023) reported on length of hospital stay. Data could not be pooled because different types of values were reported.
Doig (2015) reported a mean hospital stay of 26.0 days (95% CI 24.2 to 28.0) in the amino acid supplement group and 24.8 days (95% CI 23.0 to 26.6) in the standard care group. The MD was 1.3 days (95% CI -2.2 to 5.3). This difference was clinically relevant in favor of the standard care group.
Heyland (2023) reported a median (Q1-Q3) hospital stay of 19.3 days (9.7-39.0) in the high-dose protein group and 18.9 days (9.4-37.9) in the usual dose protein group.
4. Duration of mechanical ventilation
Two studies (Doig, 2015; Heyland, 2023) reported on duration of mechanical ventilation. Data could not be pooled because different units were reported.
Doig (2015) reported a mean duration of mechanical ventilation of 7.33 days per 10 patient ICU days (95% CI 7.00 to 7.68) in the amino acid supplement group, and 7.26 days per 10 patient ICU days (95% CI 6.94 to 7.61) in the standard care group. The MD (95% CI) was 0.07 days per 10 patient ICU days (-0.57 to 0.77) in favor of the standard care group, which was not clinically different.
Heyland (2023) reported a median (Q1-Q3) duration of mechanical ventilation of 5.7 days (2.8-12.6) in the high-dose protein group and 5.8 days (2.2-11.8) in the usual dose protein group.
5. Duration of renal dysfunction
One study (Doig, 2015) reported on duration of renal dysfunction. Renal dysfunction was defined using the validated threshold for clinically significant kidney dysfunction determined by the Brussels table (creatinine 168 µmol/L). Doig (2015) reported a mean duration of renal dysfunction of 1.20 days per 10 patient ICU days (95% CI 0.93 to 1.56) in patients receiving the amino acid supplement, and 0.99 days per 10 patient ICU days (95% CI 0.76 to 1.28) in patients receiving standard care. The MD was 0.21 days per 10 patient ICU days (95% CI -0.27 to 1.04) favoring the standard care group, which was not clinically different.
6. Use of renal replacement therapy (RRT)
Two studies (Doig, 2015; Singer, 2007) reported on use of RRT. Data could not be pooled, due to the different operationalization of this outcome measure.
Doig (2015) reported on the proportion of patients receiving RRT. A total of 25 out of 239 (10.5%) patients in the amino acid supplement group received RRT, and 13 out of 235 (5.5%) patients in the standard care group received RRT. The RR was 1.89 (95% CI 0.99 to 3.61). This difference was clinically relevant in favor of the standard care group.
Singer (2007) reported on the proportion of patients that required hemodialysis. A total of 2 out of 8 (25%) patients in the high-dose protein group required hemodialysis, and 1 out of 6 (16.7%) patients in the low-dose protein group required hemodialysis. The RR was 1.50 (95% CI 0.17 to 12.94). This difference was clinically relevant in favor of the low-dose protein group.
Level of evidence of the literature
The level of evidence of the literature was assessed per outcome, using the GRADE-methodology. Evidence from RCTs started at high certainty.
Mortality
The level of evidence for the outcome measure mortality starts high. The level of evidence was downgraded by three levels because of conflicting results (inconsistency; -1), applicability (bias due to indirectness; -1) and imprecision (-1, crossing threshold of clinical relevance). Reason of downgrading for indirectness was that in both studies not all patients were renal insufficient at baseline (according to PICO). The level of evidence regarding the outcome measure mortality is very low.
The subgroup analyses of Heyland (2023) in the AKI group are graded as low, two levels were downgraded for imprecision (1 study and not reaching the optimal information size).
Length of ICU and hospital stay
The level of evidence for the outcome measure length of ICU and hospital stay starts high. It was downgraded by three levels because of study limitations (risk of bias; -1), imprecision (-1, crossing threshold of clinical relevance) and applicability (bias due to indirectness; -1). Reason of downgrading for indirectness was that in both studies not all patients were renal insufficient at baseline (according to PICO). The level of evidence regarding the outcome measure length of ICU and hospital stay is very low.
Duration of mechanical ventilation
The level of evidence for the outcome measure duration of mechanical ventilation starts high. It was downgraded by two levels because of study limitations (risk of bias; -1), and applicability (bias due to indirectness; -1). Reason of downgrading for indirectness was that in both studies not all patients were renal insufficient at baseline (according to PICO). The level of evidence regarding the outcome measure duration of mechanical ventilation is low.
Duration of renal dysfunction
The level of evidence for the outcome measure duration of renal dysfunction starts high. It was downgraded by two levels because of imprecision (-1, crossing threshold of clinical relevance) and applicability (bias due to indirectness; -1). Reason of downgrading for indirectness was that in both studies not all patients were renal insufficient at baseline (according to PICO). The level of evidence regarding the outcome measure duration of renal dysfunction is low.
Use of renal replacement therapy
The level of evidence of the outcome measure use of renal replacement therapy starts high. It was downgraded by three levels because of applicability (bias due to indirectness; -1), and imprecision (-2). Reason of downgrading for indirectness was multiple differences in PICO between the two studies. Reason of downgrading for imprecision was the low number of patients and events. The level of evidence regarding the outcome measure use of RRT is very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)favorable effects of a protein enrichment compared to a standard amount of protein in the diet of patients on the ICU with renal insufficiency without renal replacement therapy?
P: ICU patients with renal insufficiency
I: High protein intake (> 1.5 g/kg)
C: Usual care or low protein intake
O: Mortality, length of ICU and hospital stay, duration of mechanical ventilation, duration of renal dysfunction and use of renal replacement therapy
Relevant outcome measures
The guideline development group considered mortality and length of ICU and hospital stay as critical outcome measures for decision making; and duration of mechanical ventilation, duration of renal dysfunction, and use of renal replacement therapy as important outcome measures for decision making.
Per outcome, the working group defined the following differences as a minimally clinically (patient) important difference.
Dichotomous outcomes:
- Use of renal replacement therapy: a difference of 10% was considered clinically relevant (RR < 0.91 or > 1.10, RD > 0.10).
- Mortality: a difference of 5% was considered clinically relevant (RR < 0.95 or > 1.05, RD > 0.05).
Continuous outcomes:
- Length of ICU stay: a difference of 1 day was considered clinically relevant.
- Length of hospital stay: a difference of 1 day was considered clinically relevant.
- Duration of mechanical ventilation: a difference of 1 day was considered clinically relevant.
- Duration of renal dysfunction: a difference of 1 day was considered clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until 14 March 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 815 hits. Studies were selected based on the following criteria:
- systematic reviews or randomized controlled trials
- full-text English language publication
- adults aged > 18 years
- studies according to the PICO.
Eight studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Boelens, Y. F. N., Melchers, M., & Van Zanten, A. R. H. (2022). Poor physical recovery after critical illness: incidence, features, risk factors, pathophysiology, and evidence-based therapies. Current Opinion in Critical Care, 28(4), 409-416.
- Chapple, L. A. S., Kouw, I. W., Summers, M. J., Weinel, L. M., Gluck, S., Raith, E., ... & Chapman, M. J. (2022). Muscle protein synthesis after protein administration in critical illness. American Journal of Respiratory and Critical Care Medicine, 206(6), 740-749.
- Doig, G. S., Simpson, F., Bellomo, R., Heighes, P. T., Sweetman, E. A., Chesher, D., ... & Reade, M. C. (2015). Intravenous amino acid therapy for kidney function in critically ill patients: a randomized controlled trial. Intensive care medicine, 41, 1197-1208.
- Gunst, J., Casaer, M. P., Preiser, J. C., Reignier, J., & Van den Berghe, G. (2023). Toward nutrition improving outcome of critically ill patients: How to interpret recent feeding RCTs?. Critical Care, 27(1), 43.
- Heyland, D. K., Patel, J., Compher, C., Rice, T. W., Bear, D. E., Lee, Z. Y., ... & Day, A. G. (2023). The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. The Lancet, 401(10376), 568-576.
- Puthucheary, Z. A., Rawal, J., McPhail, M., Connolly, B., Ratnayake, G., Chan, P., ... & Montgomery, H. E. (2013). Acute skeletal muscle wasting in critical illness. Jama, 310(15), 1591-1600.
- Reignier, J., Plantefève, G., Mira, J. P., Argaud, L., Asfar, P., Aissaoui, N., ... & De Montmollin, E. (2023). Low versus standard calorie and protein feeding in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group trial (NUTRIREA-3). The Lancet Respiratory Medicine.
- Singer, P. (2007). High-dose amino acid infusion preserves diuresis and improves nitrogen balance in non-oliguric acute renal failure. Wiener Klinische Wochenschrift, 119.
- Singer, P., Blaser, A. R., Berger, M. M., Alhazzani, W., Calder, P. C., Casaer, M. P., ... & Bischoff, S. C. (2019). ESPEN guideline on clinical nutrition in the intensive care unit. Clinical nutrition, 38(1), 48-79.
- van Zanten, A. R., Petit, L., De Waele, J., Kieft, H., de Wilde, J., van Horssen, P., ... & Hofman, Z. (2018). Very high intact-protein formula successfully provides protein intake according to nutritional recommendations in overweight critically ill patients: a double-blind randomized trial. Critical Care, 22(1), 1-12.
- Zhu, R., Allingstrup, M. J., Perner, A., Doig, G. S., & Nephro-Protective Trial Investigators Group. (2018). The effect of IV amino acid supplementation on mortality in ICU patients may be dependent on kidney function: post hoc subgroup analyses of a multicenter randomized trial. Critical Care Medicine, 46(8), 1293-1301.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Singer, 2007 |
Type of study: RCT
Setting: Rabin Medical Center
Country: Israel
Funding and conflicts of interest: NR |
Inclusion criteria: - Patients should be critically ill and on ventilation - Patients should require parenteral nutrition - Creatinine clearance <50 ml/min - Furosemide-induced diuresis >2000 ml/day
Exclusion criteria: - Patients receiving dopamine or mannitol - Patients in shock or hemodynamically unstable
N total at baseline: 14 Intervention: 8 Control: 6
Important prognostic factors2: Age: Intervention: 74 ± 6 Control: 55 ± 20
Sex: NR
Groups comparable at baseline? Yes: no differences between both groups regarding baseline, except for age. |
A regimen of 2000 kCal/day of non-protein calories (dextrose and Intralipid, Fresenius-Krabi, Germany) plus 150 g/day of amino acids (Aminoplasmal 10%, B Braun, Germany).
|
A regimen of 2000 kCal/day of non-protein calories (dextrose and Intralipid, Fresenius-Krabi, Germany) plus 75 g/day of amino acids (Aminoplasmal 10%, B Braun, Germany).
|
Length of follow-up: 3 days
Loss-to-follow-up: Intervention: 5/8 (62,5%) Reasons: three patients died and two required hemodialysis
Control: 3/6 (50%) Reasons: two patients died and one required hemodialysis
|
Need for hemodialysis Control: 2/6 (33.3%) Intervention: 3/8 (37.5%) |
Authors conclusion: in non-oliguric ARF requiring large amounts of furosemide for conserved diuresis, high rates of amino acids infusion may not increase BUN more than a moderate dose and may reduce furosemide requirements and improve nitrogen balance.
Limitations: the size of the study group was small and the difference in age between the two groups may have influenced the results. |
|
Doig, 2015 |
Type of study: RCT
Setting: ICUs of 16 hospitals
Countries: Australia and New Zealand
Funding and conflicts of interest: This work was supported by a peer-reviewed academic grant from the Australian National Health and Medical Research Council (NH&MRC). Baxter Healthcare Pty Ltd supplied the study amino acids. No conflicts to declare.
|
Inclusion criteria: - Patients should be on their first or second calendar day of admission to the study ICU - Patients should be expected to remain in ICU at least 2 additional days - Patients should have a working central venous access line - Patients should not be fluid restricted to less than 1L/day - Patients should be 18 years or older
Exclusion criteria: - Patients with severe acute kidney injury
N total at baseline: 474 Intervention: 239 Control: 235
Important prognostic factors2: Age: Intervention: 63.3 ± 15.4 Control: 62.7 ± 16.6
Sex: n (%) females Intervention: 81 (33.9) Control: 88 (37.5)
Groups comparable at baseline? Patients in the intervention group had higher APACHE II severity of illness scores and more patients had pre-existing renal dysfunction compared to the control group.
|
Standard nutrition care plus a daily supplement of up to 100g of IV amino acids (Synthamin 17 Electrolyte Free; Baxter Healthcare, Sydney, NSW, Australia) to achieve a total protein intake of 2.0 g/kg/day |
Standard nutrition care |
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: 3 Reasons: short ICU stay, withdrawal of consent
Control: 0 Reasons: NA |
Mean duration of renal dysfunction Days per 10 patient ICU days Intervention: 1.20 days (95%CI: 0.93-1.56) Control: 0.99 days (95%CI: 0.76-1.28) p-value = 0.45
Patients receiving RRT Intervention: 25 (10.5%) Control: 13 (5.5%) Difference: 12 p-value = 0.062
Day-90 mortality Control: 20.0% Intervention: 17.8% Risk difference = -2.20% (-11.1-6.9)
ICU stay Control: 10.7 (10.0-11.5) Intervention: 11.6 (10.8-12.5) Difference = 0.91 (-0.62-2.68)
Hospital stay Control: 24.8 (23.0-26.6) Intervention: 26.0 (24.2-28.0) Difference = 1.3 (-2.2-5.3)
Mechanical ventilation days Control: 7.26 [6.94-7.61] Intervention: 7.33 [7.00-7.68] Difference = 0.07 [-0.57-0.77] |
Authors conclusion: IV amino acid supplementation did not alter the primary outcome of this study, duration of renal dysfunction, but it did increase eGFR and urine output. These physiological effects suggest the existence of renal functional reserve in critical illness.
Limitations: pre-critical illness creatinine levels were unavailable in 45% of ICU patients enrolled. The standard approach of imputing ‘normal’ pre-disease creatinine values introduces significant uncertainty into a clinical trial. Additionally, the study intervention was not blinded. |
|
Heyland, 2023 |
Type of study: RCT
Setting: 85 ICUs across 15 countries
Countries: Argentina, Australia, Brazil, Canada, China, Greece, India, Iran, Japan, Malaysia, Mexico, Panama, Puerto Rico, Saudi Arabia, UK, and USA
Funding and conflicts of interest: No
|
Inclusion criteria: - Patients should be >18 years - Patients should be enrolled within 96h of ICU admission - Patients should be expected to remain mechanically ventilated for at least 48h - Patients should have one or more of the following nutritional risk factors: 1. Low (≤25 kg/m²) or high (≥35 kg/m²) BMI 2. Moderate to severe malnutrition (defined by local assessments) 3. Frailty (defined by a Clinical Frailty Scale) 4. Sarcopenia (defined by a SARC-F score) 5. From point of screening, projected duration of mechanical ventilation of more than 4 days
Exclusion criteria: - Patients who had received more than 96 continuous hours of mechanical ventilation before screening - Patients expected to die - Patients expected to undergo withdrawal of life-sustaining treatments within 7 days from screening - Pregnant women - Patients for whom the responsible clinician felt that the patient either needed low or high protein - Patients who required parenteral nutrition only in which the site did not have products to reach the high protein dose targets
N total at baseline: 1301 Intervention: 645 Control: 656
Important prognostic factors2: Age: Intervention: 57 (17[18-95]) Control: 57 (17[18-93])
Sex: n (%) male Intervention: 395 (61%) Control: 388 (59%)
Groups comparable at baseline? Yes |
At least 2·2 g/kg protein per day |
At least 1·2 g/kg protein per day |
Length of follow-up: 28 days, until death or until transition to full and permanent oral feeding
Loss-to-follow-up: Intervention: 17 Reasons: leaving study before receiving intervention, useable data could not be obtained, withdrawal of consent.
Control: 22 Reasons: leaving study before receiving intervention, useable data could not be obtained, withdrawal of consent.
|
60-day mortality Intervention: 222 (34.6%) Control: 208 (32.1%) (RR 1.08, 95%CI 0.92-1.26)
Duration of mechanical ventilation Control: 6.1 [2.8-12.8] Intervention: 6.1 [3.0-13.8] Difference: 0
Duration of ICU stay Control: 9.4 [5.1-19.2] Intervention: 10.0 [5.6-18.2] Difference: 0.6
Duration of hospital stay Control: 18.9 [9.4-37.9] Intervention: 19.3 [9.7-39.0] Difference: 0.4 |
Authors conclusion: prescribing 1.2 g/kg/day and striving to achieve 80% of what was prescribed seems like a reasonable and safe approach for all critically ill patients. Delivering higher doses of protein to critically ill patients might have worsened outcomes for AKI patients and greater severity of illness.
Limitations: study staff and clinicians were not blinded. This study had not enough power with respect to 60-day mortality, because the planned sample size was reduced, and primary and secondary outcomes were switched. There was no collection of functional, performance-based or longer-term outcome measures. This trial did not consider the theoretical phases of critical illness and administered the same dose throughout the 28-day study period. Considerable within-group variation in nutrition intake was observed. Furthermore, time-to-discharge-alive can be a problematic endpoint in unblinded trials |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference |
Was the allocation sequence adequately generated? |
Was the allocation adequately concealed?
|
Was knowledge of the allocated interventions adequately prevented? Were patients/healthcare providers/data collectors/outcome assessors/data analysts blinded? |
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias If applicable/necessary, per outcome measure
|
|
Singer, 2007 |
No information
|
No information
|
No information |
Definitely yes
Reason: Missing outcome data is balanced across the two groups, with similar reasons for missing data. |
Probably yes
Reason: All relevant outcomes were reported, but no study protocol previously published. |
Probably no
Reasons: (1) Small sample size. (2) Baseline difference in age between the two groups. |
LOW (a lot of information is missing, but it is uncertain that it affected the outcome measures) |
|
Doig, 2015 |
Probably yes
Reason: The sequence was generated using blocks of variable size with random seeds and stratified within study site by high risk of renal dysfunction and BMI greater than 18 kg/m2 |
Definitely yes
Reason: A central randomization web server was used. |
Definitely no
Reason: The study intervention was not blinded |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. Mean imputation (‘normal’ pre-disease creatinine values) was used. |
Probably yes
Reason: All relevant outcomes were reported, but no study protocol previously published. |
Definitely yes
Reason: No other problems noted. |
LOW (uncertain that outcome measures are affected by not blinding) |
|
Heyland, 2023 |
Probably yes
Reason: Using random-sized permuted blocks of either 2, 4, or 8, a central randomisation system used a computer-generated randomisation schedule prepared by the study statistician stratified by site to allocate patients. |
Definitely yes
Reason: A secure, web-based randomization system that was accessible to practitioners 24h a day was used. |
Definitely no
Reason: Patients were blinded but blinding of clinicians and study staff was not possible (single-blind trial). |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group, and both groups have similar reasons for missing data. |
Probably yes
All of the study’s outcomes of interest have been reported in the pre-specified way. However, the primary and secondary outcome were switched. |
Probably no
Reason: (1) The planned sample size was reduced, creating not enough power with respect to 60-day mortality. (2) Within group variation in nutrition intake. |
Some concerns (study was not blinded, and other problems that potentially increase risk of bias) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Bellomo R, Cass A, Cole L, Finfer S, Gallagher M, Lee J, Lo S, McArthur C, McGuinness S, Norton R, Myburgh J, Sheinkestel C; RENAL Study Investigators. Daily protein intake and patient outcomes in severe acute kidney injury: findings of the randomized evaluation of normal versus augmented level of replacement therapy (RENAL) trial. Blood Purif. 2014;37(4):325-34. doi: 10.1159/000363175. Epub 2014 Aug 23. PMID: 25171270. |
Wrong intervention |
|
Pu H, Doig GS, Heighes PT, Allingstrup MJ, Wang A, Brereton J, Pollock C, Chesher D, Bellomo R. Intravenous amino acid therapy for kidney protection in cardiac surgery patients: A pilot randomized controlled trial. J Thorac Cardiovasc Surg. 2019 Jun;157(6):2356-2366. doi: 10.1016/j.jtcvs.2018.11.097. Epub 2018 Dec 15. PMID: 30685166. |
Wrong population |
|
Li Y, Tang X, Zhang J, Wu T. Nutritional support for acute kidney injury. Cochrane Database Syst Rev. 2012 Aug 15;(8):CD005426. doi: 10.1002/14651858.CD005426.pub3. PMID: 22895948. |
Wrong intervention |
|
Scheinkestel CD, Kar L, Marshall K, Bailey M, Davies A, Nyulasi I, Tuxen DV. Prospective randomized trial to assess caloric and protein needs of critically Ill, anuric, ventilated patients requiring continuous renal replacement therapy. Nutrition. 2003 Nov-Dec;19(11-12):909-16. doi: 10.1016/s0899-9007(03)00175-8. PMID: 14624937. |
Wrong outcome |
|
Zhu R, Allingstrup MJ, Perner A, Doig GS; Nephro-Protective Trial Investigators Group. The Effect of IV Amino Acid Supplementation on Mortality in ICU Patients May Be Dependent on Kidney Function: Post Hoc Subgroup Analyses of a Multicenter Randomized Trial. Crit Care Med. 2018 Aug;46(8):1293-1301. doi: 10.1097/CCM.0000000000003221. PMID: 29771700. |
Uses data of Doig, 2015 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-03-2024
Beoordeeld op geldigheid : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de
samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die gevoed worden op de intensive care.
Werkgroep
dr. R. (Robert) Tepaske, intensivist, (voorzitter) NVIC
Prof. dr. A.R.H. (Arthur) van Zanten, intensivist, NVIC
dr. M.C.G. (Marcel) van de Poll, intensivist, NVIC
drs. B. (Ben) van der Hoven, internist, NIV
drs. E.J. (Lisa) Mijzen, anesthesioloog-intensivist, NVA
dr. F.J. (Jeannette) Schoonderbeek, chirurg-intensivist, NVvH
L. (Lea) van Duijvenbode - den Dekker, MSc, intensive care verpleegkundige, V&VN Intensive Care
M. (Manon) Mensink, diëtist, NVD
Ir. S. (Suzanne) ten Dam, diëtist, NVD
I. (Idske) Dotinga, ervaringsdeskundige, FCIC/IC Connect
Klankbordgroep
Mevr. E.R. (Elske) van Liere, logopedist, NVLF
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Actie |
|
* Voorzitter werkgroep Tepaske |
Anesthesioloog-Intensivist Begeleider Nurse practitioners profielen circulation & ventilation apotheek |
Allen onbezoldigd:
|
geen |
geen |
geen |
geen |
Eenmalig vergoeding voor deelname aan masterclass 'meten van metabolisme' van Hamilton, Zwitserland |
Geen actie vereist. |
|
Van Zanten |
lnternist-intensivist |
Onbetaald: |
Geen aandelen, opties, patenten of producten |
Echtgenote leidt Congres- en Organisatiebureau Interactie dat voor vele wetenschappelijke |
Precise trial (MUMC+), MC RCT, ZonMW/KCE NL/Belgie. studie naar hoog-eiwit vs. normaal eiwit voor |
richtlijnmaker van ESPEN richtlijn |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van Zanten zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
Mensink |
Diëtist Rijnstate Arnhem |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
Schoonderbeek |
Chirurg-intensivist staflid Intensive Care |
medisch adviseur, freelance |
nvt |
nvt |
nvt |
nvt |
nvt |
Mevr. Schoonderbeek werkt als freelance medisch adviseur voor Veduma in Zaltbommel. Ze adviseert voornamelijk in letselschade zaken (na aanrijdingen e.d.). Dit heeft nooit iets met voeding te maken. Waardoor geen restricties hoeven worden opgelegd. |
|
Van Duijvenbode-Den Dekker |
Intensive care verpleegkundige - Amphia ziekenhuis Breda |
Visitatie commissie NVIC via V&VN IC |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Mijzen |
Anesthesioloog- Intensivist Beatrix ziekenhuis Gorinchem |
FCCS- instructeur, betaald Bestuurslid sectie IC-NVA, onbetaald. |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Dotinga |
Functienaam: Trainee beleid en management in zorg en welzijn |
nvt |
nvt |
nvt |
nvt |
nvt |
|
Geen actie vereist. |
|
van de Poll |
Chirurg-intensivist, Staflid Maastricht UMC |
geen |
geen |
geen |
Contractant:ZONMW (Doelmatigheid): INCEPTION trial (multicenter RCT naar ECPR bij OHCA), ZONMW/KCE (BeNeFIT) PRECISe trial (multicenter RCT naar hoog vs normaal eiwit in enterale voeding bij IC patienten), Fresenius-kabi: traceronderzoek naar glutaminemetabolisme in sepsis, Cytosorb CYTATION trial (single center RCT naar gebruik van cytosorb bij vasoplegie), Getinge: co-financiering INCEPTION trial, Nutricia:co-financiering (in-kind) PRECISe trial, NUTRICIA research foundation/Nestle ESICM research grant: single center RCT naar elementaire voeding bij diarree. Consultancy Bayer R&D (data based algorithm development in ARDS) |
geen |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van der Poll zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
van der Hoven |
Internist-intensivist, staflid IC Volwassenen, Erasmus MC te Rotterdam |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
ten Dam |
Diëtist-onderzoeker OPRAH studie, Amsterdam UMC |
Bestuurslid NVO (Nederlandse Voedingsteam Overleg), onbetaald. Docent Focus op Voeding, VBNU, betaald, Docent Master Health Sciences, VU, onbetaald.
|
geen |
geen |
OPRAH_CT studie; RCT effect sarcopenie op fysiek functioneren. Subsidie AMS. OPRAH_PRO studie; haalbaarheidsstudie OPRAH RCT. Subsidie CCA. |
geen |
geen |
Geen actie vereist. |
|
van Liere |
Logopedist, Adrz |
nvt |
Logopedist in dienst van ziekenhuis, o.a. ICU |
nvt |
nvt |
Nvt |
nvt |
Geen actie vereist. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van FCIC/IC Connect voor de schriftelijke knelpunteninventarisatie, en afvaardiging van FCIC/IC Connect in de werkgroep. Het verslag van de schriftelijke knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FCIC/IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Eiwitten bij nierinsufficiëntie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die voeding op de intensive care krijgen. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden daarom meegewogen. Voorbeelden zijn: Aanvullende argumenten uit de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. Deze overwegingen kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag. Zij zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd onder alle mogelijke omstandigheden en voor elke individuele patiënt van toepassing zijn.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: Alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur) zijn in de overwegingen meegenomen. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: Voeding op de IC |
|
|
Uitgangsvraag/modules: Wat is de optimale dosering van eiwitten voor nierinsufficiënte patiënten? |
|
|
Database(s): Ovid/Medline, Embase.com |
Datum: 24-10-2022 |
|
Periode: 2000 - heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
De sleutelartikelen worden gevonden behalve de ESPEN guideline (Fiaccadori) omdat deze niet binnen de SR of RCT valt. Qua terminologie zou de studie wel gevonden worden. |
|
|
In de databases Embase.com en Ovid/Medline is op 24 oktober met relevante zoektermen gezocht naar systematische reviews en RCT over de optimale dosering van eiwitten voor nierinsufficiënte patiënten. De literatuurzoekactie leverde 780 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
191 |
149 |
222 |
|
RCT |
406 |
420 |
558 |
|
Observationele studies |
|
|
|
|
Totaal |
|
|
780 |
Zoekstrategie
Embase
|
Zoektermen |
||
|
No. |
Query |
Results |
|
#10 |
#8 OR #9 |
597 |
|
#9 |
#5 AND #7 NOT #8 = RCT |
406 |
|
#8 |
#5 AND #6 = SR |
191 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1965416 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#5 |
#1 AND #2 AND #3 AND #4 AND ([english]/lim OR [dutch]/lim) AND [2000-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3902 |
|
#4 |
'diet supplementation'/exp OR 'diet therapy'/exp OR 'enteric feeding'/exp OR 'parenteral nutrition'/exp OR 'malnutrition'/exp OR 'nutritional parameters'/exp OR 'nutritional support'/exp OR nutri*:ti,ab,kw OR diet*:ti,ab,kw OR supplement*:ti,ab,kw OR feed*:ti,ab,kw OR (((protein* OR 'amino acid*') NEAR/3 (restrict* OR low OR high OR dose* OR dosage*)):ti,ab,kw) |
2718053 |
|
#3 |
'protein'/exp/mj OR 'protein intake'/exp/mj OR 'protein restriction'/exp/mj OR 'amino acid'/exp/mj OR protein*:ti,ab,kw OR 'amino acid*':ti,ab,kw |
4862933 |
|
#2 |
'kidney disease'/exp/mj OR 'kidney failure'/exp/mj OR 'kidney function'/exp/mj OR 'kidney dysfunction'/exp/mj OR 'renal replacement therapy'/exp/mj OR 'continuous hemofiltration'/exp/mj OR (((kidney OR renal) NEAR/3 (fail* OR funct* OR dysfunct* OR disease* OR insufficiency OR dialysis OR injur*)):ti,ab,kw) OR 'renal replacement therapy':ti,ab,kw OR cvvh:ti,ab,kw OR ((continuous NEAR/3 (haemofiltration OR hemofiltration)):ti,ab,kw) |
1039072 |
|
#1 |
'critically ill patient'/exp/mj OR 'intensive care'/exp/mj OR 'intensive care unit'/exp/mj OR 'critical illness'/exp/mj OR (((intensive OR critical*) NEAR/3 (care OR patient* OR ill*)):ti,ab,kw) OR icu:ti,ab,kw OR 'pneumonia'/exp/mj OR 'burn'/exp/mj OR 'respiratory failure'/exp/mj OR 'head injury'/exp/mj OR 'pancreatitis'/exp/mj OR pneumonia:ti,ab,kw OR burn*:ti,ab,kw OR pancreatitis:ti,ab,kw OR trauma:ti,ab,kw OR injur*:ti,ab,kw OR failure*:ti,ab,kw OR severe:ti,ab,kw OR 'artificial ventilation'/exp OR (((artificial OR mechanical) NEAR/3 (ventilation OR respiration)):ti,ab,kw) |
4927320 |
Medline (OVID)
|
Zoektermen |
||
|
No. |
Query |
Results |
|
12 |
10 or 11 |
569 |
|
11 |
(7 and 9) not 10 = RCT |
420 |
|
10 |
7 and 8 = SR |
149 |
|
9 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1555805 |
|
8 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
625383 |
|
7 |
limit 6 to ((english language or dutch) and yr="2000 -Current") |
3818 |
|
6 |
5 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
5990 |
|
5 |
1 and 2 and 3 and 4 |
8250 |
|
4 |
exp Dietary Supplements/ or exp Diet Therapy/ or exp Enteral Nutrition/ or exp Parenteral Nutrition/ or exp Malnutrition/ or exp Nutritional Status/ or exp Nutritional Support/ or nutri*.ti,ab,kf. or diet*.ti,ab,kf. or supplement*.ti,ab,kf. or feed*.ti,ab,kf. or ((protein* or 'amino acid*') adj3 (restrict* or low or high or dose* or dosage*)).ti,ab,kf. or Amino Acids/ad [Administration & Dosage] |
1888622 |
|
3 |
exp *Proteins/ or exp *Amino Acids/ or *Dietary Proteins/ or exp *Diet, Protein-Restricted/ or protein*.ti,ab,kf. or 'amino acid*'.ti,ab,kf. |
6714111 |
|
2 |
exp *Renal Insufficiency/ or exp *Kidney Diseases/ or exp *Acute Kidney Injury/ or exp *Renal Replacement Therapy/ or exp *Hemofiltration/ or ((kidney or renal) adj3 (fail* or funct* or dysfunct* or disease* or insufficiency or dialysis or injur*)).ti,ab,kf. or 'renal replacement therapy'.ti,ab,kf. or cvvh.ti,ab,kf. or (continuous adj3 (haemofiltration or hemofiltration)).ti,ab,kf. |
775099 |
|
1 |
exp Critical Care/ or exp Critical Illness/ or exp Intensive Care Units/ or ((intensive or critical*) adj3 (care or patient* or ill*)).ti,ab,kf. or ICU.ti,ab,kf. or exp Pneumonia/ or exp Burns/ or exp Respiratory Insufficiency/ or exp Craniocerebral Trauma/ or exp Pancreatitis/ or (pneumonia or burn* or pancreatitis or trauma or injur* or failure* or severe).ti,ab,kf. or exp Respiration, Artificial/ or ((artificial or mechanical) adj3 (ventilation or respiration)).ti,ab,kf. |
3620608 |