Kinderen met visuele beperkingen
Uitgangsvraag
Wanneer is verwijzing van kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking voor revalidatie noodzakelijk?
De uitgangsvraag omvat de volgende deelvragen:
- Welke verwijscriteria voor diagnostiek en/of revalidatie zijn van toepassing bij kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking?
- Welke revalidatie interventies hebben de voorkeur bij kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking?
Aanbeveling
Uitgangsvraag 1: Welke verwijscriteria voor diagnostiek en/of revalidatie zijn van toepassing bij kinderen van 0 tot 4 jaar met (het vermoeden op) een visuele beperking?
Verwijs kinderen van 0 tot 4 jaar met een afwijkende visuele ontwikkeling en het vermoeden van een erfelijke of aangeboren netvlies- of oogzenuwaandoening voor klinische diagnostiek (oogheelkundig en elektrofysiologisch) naar een gespecialiseerde kinderoogarts in een tertiair oogheelkundig centrum.
Wees alert op een congenitale of erfelijke oogaandoening wanneer sprake is van de volgende signalen en symptomen:
- afwijkend kijkgedrag, geen fixeren en/of volgen;
- afwijkende oogbewegingen: dwalen, congenitale nystagmus;
- anatomische zichtbare oogafwijkingen, zoals voorsegmentafwijkingen, irisdiafanie, cataract, chorioretinale colobomen, opticushypoplasie, macula-afwijkingen;
- hoge refractieafwijking, met name in combinatie met nystagmus;
- opvallende lichtschuwheid of nachtblindheid.
Overweeg kinderen van 0 tot 4 jaar te verwijzen naar een tertiair centrum bij
- syndromen waarbij een groot risico bestaat op oogheelkundige afwijkingen of visuele stoornissen;
- vermoeden op een visuele stoornis bij een belaste perinatale voorgeschiedenis of een afwijkende neurologische ontwikkeling (link).
Voor de verwijzing van kinderen voor diagnostiek voor CVI wordt verwezen naar de richtlijn CVI (link).
Verwijs kinderen van 0 tot 4 jaar bij een vastgestelde diagnose of sterke aanwijzingen van een visuele beperking naar een centrum voor revalidatie van slechtziende en blinde mensen voor revalidatie en begeleiding. Deze verwijzing kan parallel lopen aan het diagnostische traject in het ziekenhuis.
Voor de verwijzing van kinderen met een verstandelijke beperking wordt verwezen naar de richtlijn Visuele beperkingen bij mensen met een verstandelijke beperking (link).
Verwijs kinderen van 0 tot 4 jaar naar een centrum voor revalidatie van slechtziende en blinde mensen voor bepaling van de visuele functies wanneer dit binnen een perifeer en/of universitair medisch centrum niet mogelijk is.
Uitgangsvraag 2: Welke revalidatie interventies hebben de voorkeur bij kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking?
Zorg als oogarts voor onderlinge afstemming met andere zorgprofessionals in de tweede lijn/ centra voor revalidatie van slechtziende en blinde mensen wie het kind vervolgt met betrekking tot de visuele ontwikkeling en de algemene ontwikkeling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Slechts één studie werd gevonden die aan de selectiecriteria voldeed. Deze studie vergeleek ontwikkelingsbegeleiding door middel van video-feedback met gebruikelijke zorg en vond geen significante en ook geen klinisch relevante verschillen tussen de groepen op de uitkomst ouder-kind interactie. Daarbij is de bewijskracht zeer laag door beperkingen in opzet van de studie. Voor de overige uitkomstmaten en vergelijkingen werd geen bewijs gevonden. Op basis van de literatuur kunnen daarom geen aanbevelingen worden gedaan. Hieronder worden op basis van expertise in de werkgroep verdere overwegingen besproken.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Ouders van een visueel beperkt kind komen allereerst met een diagnostische vraag: wat is de aandoening, wat is de prognose en de erfelijkheid? Vervolgens worden vooral participatievragen gesteld over meedoen in het gezin, sociale interactie met vriendjes en kunnen meedoen op school. Participatie is cruciaal voor de ontwikkeling van een kind en heeft grote invloed op de kwaliteit van leven.
Kosten (middelenbeslag)
De aanbevelingen voor verwijzing leiden tot een adequater diagnostisch traject, waardoor kinderen geen onnodige onderzoeken hoeven te ondergaan. De diagnostiek van slechtziende kinderen valt onder verzekerde zorg, waarbij het voorkomen van overbodig onderzoek leidt tot kostenbesparing.
Aanvaardbaarheid voor de overige relevante stakeholders
Kinderen met een visuele beperking zijn schaars en de aandoeningen die deze kinderen hebben zeer divers. Dit is een heel andere situatie dan bij ouderen met een visuele beperking: bij hen zijn een aantal veelvoorkomende diagnoses en is de doelgroep veel groter. Dit bemoeilijkt het opzetten van RCT’s voor interventies bij visueel beperkte kinderen. Als er al een voldoende grote en redelijk homogene onderzoeksgroep kan worden samengesteld, dan zijn de resultaten vaak niet zomaar vertaalbaar naar kinderen met andere visuele aandoeningen. Bovendien is het vaak ethisch niet verantwoord om een controlegroep zonder interventie te hebben, met name als het gaat om heel jonge kinderen.
Het is verder de vraag of alle aspecten van (vroeg)begeleiding moeten worden bewezen met wetenschappelijk onderzoek. Sommige onderdelen zijn namelijk evident, bijvoorbeeld uitleg aan ouders zodat ze de reacties van hun kind beter begrijpen, het inzetten van kleur en goede contrasten om het kind beter voorwerpen te laten detecteren, et cetera.
Bij de begeleiding en revalidatie van kinderen met een visuele beperking wordt uitgegaan van de normale levensloop van kinderen als kader. De basis van dat kader wordt gevormd door de domeinen binnen de ICF-onderdelen Activiteiten en Participatie: 1. Leren en toepassen van kennis, 2. Algemene taken en eisen, 3. Communicatie, 4. Mobiliteit, 5. Zelfverzorging, 6. Huishouden, 7. Tussenmenselijke interacties en relaties, 8. Belangrijke levensgebieden: studie, 9. Financiën en werk, 10. Maatschappelijk, sociaal en burgerlijk leven. Bij kinderen tussen 0 en 4 jaar zullen sommige onderdelen nog niet aan de orde zijn.
Er wordt geïnventariseerd welke invloed de visuele beperking heeft op de ontwikkeling van het kind en het uitvoeren van ontwikkelingstaken. Daarnaast wordt gekeken wat een kind nodig heeft om aan de bij de leeftijd behorende opgaven te voldoen. Deze inventarisatie wordt op de kinderleeftijd periodiek herhaald, omdat natuurlijk de ontwikkelingstaken met de leeftijd veranderen. Daarbij is de ontwikkeling van het jonge kind niet los te zien van de ouders en zal de zorg zich ook moeten richten op de ouders. Zij hebben vaak vragen en zorgen rondom de ontwikkeling van hun kind en hebben over het algemeen behoefte aan handvatten in de omgang met de visuele beperking van hun kind.
Rationale bij de aanbeveling
Voor diagnostiek van congenitale retina- en opticusaandoeningen kan verwezen worden naar een tertiair centrum (universitair medische centra, Oogziekenhuis Rotterdam en Bartiméus) waar elektrofysiologisch onderzoek van kleine kinderen gedaan kan worden.
Onderbouwing
Achtergrond
In de huidige situatie vindt niet altijd tijdig verwijzing plaats. Slechtziende kinderen participeren soms al langere tijd in schoolsituaties zonder dat visuele stoornissen worden opgemerkt. Een visuele beperking bij kinderen heeft grote invloed op alle aspecten van de ontwikkeling van een kind tot volwassene. Hoewel de prevalentie en incidentie van visuele beperkingen bij kinderen lager is dan bij volwassenen, is het aantal jaren dat een kind visueel beperkt is groter. De invloed op het persoonlijke en sociale leven en de economische kosten zijn aanzienlijk (Rahi, 2003). Om de ontwikkeling van kinderen met visuele beperking zo optimaal mogelijk te laten verlopen, is het belangrijk om vroegtijdig te verwijzen voor revalidatie en begeleiding. In landen met een hoge sociaaleconomische status heeft minstens de helft van de kinderen met een visuele beperking ook bijkomende beperkingen, bijvoorbeeld motorisch, sensorisch (gehoor), leerproblemen of een chronische aandoening (Rahi, 2012).
Bij heel jonge kinderen is visusbepaling in de reguliere praktijk niet altijd mogelijk en zal moeten worden afgegaan op symptomen die wijzen op mogelijk visuele beperking. Voor optimale begeleiding en revalidatie is het essentieel dat een goede diagnose wordt gesteld van de oorzaak van de visuele beperking en een eenduidig verwijsbeleid voor de revalidatie van deze kinderen is geformuleerd.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onduidelijk of ontwikkelingsbegeleiding met video-feedback effectief is ten opzichte van gebruikelijke zorg of geen behandeling op de uitkomst ouder-kind interactie bij kinderen van 0 tot 4 jaar met visuele beperkingen.
Bronnen: (Platje, 2018) |
|
- GRADE |
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding ten opzichte van gebruikelijke zorg of geen behandeling op de uitkomst: • visueel functioneren; • motorische ontwikkeling; • mobiliteit; • ADL functioneren; • spelen; • sociale interactie, bij kinderen van 0 tot 4 jaar met visuele beperkingen. |
|
- GRADE |
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van visuele stimulatie en training ten opzichte van gebruikelijke zorg of geen behandeling op de uitkomsten: • ouder-kind interactie; • visueel functioneren; • motorische ontwikkeling; • mobiliteit; • ADL functioneren; • spelen; • sociale interactie, bij kinderen van 0 tot 4 jaar met visuele beperkingen. |
|
- GRADE |
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van revalidatie ten opzichte van gebruikelijke zorg of geen behandeling op de uitkomst • ouder-kind interacti; • visueel functioneren; • motorische ontwikkeling; • mobiliteit; • ADL functioneren; • spelen; • sociale interactie, bij kinderen van 0-4 jaar met visuele beperkingen. |
Samenvatting literatuur
Uitgangsvraag 1: Welke verwijscriteria voor diagnostiek en/of revalidatie zijn van toepassing bij kinderen van 0 tot 4 jaar met (het vermoeden op) een visuele beperking?
Verloop normale visuele ontwikkeling en bepaling van de visus bij kinderen jonger dan 4 jaar
De ontwikkeling van normale visuele functies loopt parallel met de ontwikkeling van de ogen en de hersenen. Na de geboorte groeit het oog en emmetropiseert, in de retina ontwikkelt zich de fovea, de myelinisatie van de oogzenuw wordt voltooid en de visuele gebieden in de hersenen ontwikkelen zich onder invloed van visuele prikkels. Deze anatomische ontwikkelingen gaan gepaard met een toename van visuele functies. Rond 80% van de normaal ontwikkelende kinderen heeft op vierjarige leeftijd een visus > 0.5 (Grönlund, 2016).
Bij heel jonge kinderen kan de visus bepaald worden met preferential looking (PL) of met visual evoked potentials (VEP). De stimuli bestaan uit repeterende patronen, vaak strepen (‘gratings”, grating acuity). De visus bepaald met VEP komt bij heel jonge kinderen meestal hoger uit dan bepaald met PL, mogelijk omdat bij PL visuele aandacht nodig is (Sokol, 1992). Kinderen met een verstandelijke beperking komen bij PL gemiddeld een octaaf lager uit (halvering van de spatiele frequentie,) ook als er geen oogheelkundige afwijkingen zijn (Mayer, 1983).
Bij kinderen vanaf 2½ tot 3 jaar kan de visus met benoemen of matchen van symbolen bepaald worden (Kay pictures en Lea symbols) en bij kleuters met E-haken (zie ook richtlijn JGZ ‘opsporen oogafwijkingen’ https://www.ncj.nl/richtlijnen/alle-richtlijnen/richtlijn/opsporen-oogafwijkingen-2019). De gemeten visus moet altijd vergeleken worden met de normale range voor de leeftijd.
Taylor (2017) heeft voor kinderen van 0 tot 2 jaar de ontwikkeling van de visus een grating acuity tabel (tabel 1) opgesteld met een 95% predictie interval die ingezet kan worden voor de bepaling of een baby of peuter slechtziend is.
Eveneens heeft Taylor (2017) voor kinderen vanaf 3 jaar de ontwikkeling van de visus een symbol acuity tabel (tabel 2) opgesteld met een 95% predictie interval die ingezet kan worden voor de bepaling van eventuele slechtziendheid bij een kind van 3 jaar of ouder.
Tabel 1
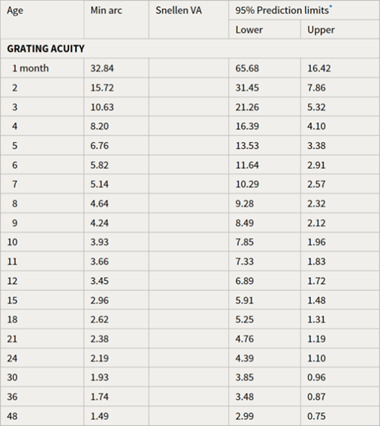
Tabel 2
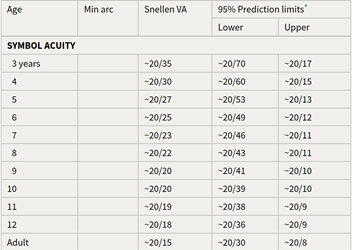
Prevalentie en oorzaken van visuele beperking bij kinderen
In Noordwest Europa is de prevalentie van slechtziendheid bij kinderen jonger dan 16 jaar ongeveer 10 tot 22 per 10.000 en de prevalentie van blindheid 3 tot 4 per 10.000 (Gilbert, 2001). De afgelopen decennia zijn de resultaten van chirurgie van cataract en glaucoom sterk verbeterd. Daardoor zijn erfelijke retinale afwijkingen als oorzaak van visuele beperkingen relatief toegenomen. Ook is er een betere overleving van extreem te vroeggeboren kinderen waardoor de incidentie van perinatale oorzaken is gestegen. De meest voorkomende niet-erfelijke oorzaken van visuele beperking bij kinderen zijn CVI en congenitale opticushypoplasie/-atrofie. De meest voorkomende erfelijke oorzaken van visuele beperking bij kinderen zijn albinisme, retinale dystrofieën en erfelijke opticopathieën (Boonstra, 2012; Gilbert, 2011; Rahi, 2003).
Symptomen van albinisme zijn vertraagde visuele rijping, nystagmus, irisdiafanie, foveahypoplasie en fundus hypopigmentatie. Kinderen met oculocutaan albinisme zijn vaak lichter van huid en haar dan hun broertjes en zusjes. Het fenotypisch spectrum van albinisme is echter heel breed waardoor sommige symptomen kunnen ontbreken, ook hypopigmentatie hoeft niet aanwezig te zijn (Kruijt, 2018). Aanvullende diagnostiek bestaat uit een VEP op misrouting en DNA-diagnostiek.
Erfelijke retinale aandoeningen zijn een relatief frequente oorzaak van visuele beperkingen bij kinderen en de overgrote meerderheid is nog niet therapeutisch te behandelen. Van de meeste aandoeningen zijn inmiddels de genetische oorzaken bekend. De erfelijke retinale aandoeningen kunnen grofweg worden ingedeeld in stationaire en progressieve aandoeningen (retinale dystrofieën).
Afwijkende visuele ontwikkeling, diagnostiek en verwijzing
Een gezonde à terme geboren baby zal rond de leeftijd van 2 maanden kunnen fixeren en volgen. Als dit niet gebeurt zal het kind verwezen worden naar de oogarts voor onderzoek. Er kan sprake zijn van geïsoleerde vertraagde rijping, of een oogheelkundige of neurologische afwijking waardoor het kind niet kijkt. Oogheelkundige afwijkingen worden gediagnosticeerd door inspectie van voorsegment en media, funduscopie en elektrofysiologisch onderzoek (elektroretinogram (ERG) en/of VEP). Als bij oogheelkundig onderzoek geen afwijkingen worden gevonden kan sprake zijn van een onderliggende neurologische aandoening zoals CVI. Met name kinderen met een belaste medische voorgeschiedenis zoals prematuriteit of perinatale asfyxie en met een afwijkende neurologische ontwikkeling hebben een verhoogd risico op CVI.
Belangrijk bij een beslissing voor doorverwijzing zijn de anamnese en de familieanamnese. Informatie over de zwangerschap, de bevalling en vroegkinderlijke ontwikkeling kan aanwijzingen geven voor een mogelijke CVI. De familieanamnese en navraag van consanguiniteit kan leiden tot het vermoeden van een erfelijke aandoening. Ouders nemen vaak veel foto’s en maken filmpjes van hun kinderen, ook hieruit kan soms bruikbare informatie gehaald worden.
Zoals uit voortgaande uitwerking blijkt is sprake van zeldzaamheid en variabiliteit van de aangeboren en erfelijke oogheelkundige aandoeningen en daarom hebben de meeste oogartsen geen routine in de diagnostiek en is het kunnen herkennen van symptomen daarom van groot belang. De volgende signalen en symptomen kunnen volgens Morgan (2017) wijzen op een congenitale danwel erfelijke visuele aandoening:
- afwijkend kijkgedrag, geen fixeren en volgen;
- afwijkende oogbewegingen: dwalen, congenitale nystagmus;
- anatomische zichtbare oogafwijkingen, zoals voorsegmentafwijkingen, irisdiafanie, cataract, chorioretinale colobomen, opticushypoplasie, macula-afwijkingen;
- hoge refractieafwijking, met name in combinatie met nystagmus;
- opvallende lichtschuwheid of nachtblindheid;
Verder is het aan te bevelen naar een tertiair centrum te verwijzen bij
- syndromen waarbij er een groot risico bestaat op oogheelkundige afwijkingen of visuele stoornissen;
- het vermoeden van een visuele stoornis bij een belaste perinatale voorgeschiedenis of een afwijkende neurologische ontwikkeling (zie ook richtlijn CVI).
Bij baby’s met congenitale nystagmus is de meest voorkomende oorzaak een oogheelkundige (netvlies-)afwijking. Oogheelkundig onderzoek inclusief elektrofysiologie is daarom meer zinvol als eerste diagnostisch onderzoek dan een MRI (Bertsch, 2017).
Bij peuters en kleuters is de combinatie van een subnormale visus bij hoge refractieafwijkingen, met name hoge myopie, een indicatie voor verder (elektrofysiologisch) onderzoek.
Voor diagnostiek van congenitale retina- en opticusaandoeningen kan verwezen worden naar een tertiair centrum (universitair medische centra, Oogziekenhuis Rotterdam en Bartiméus) waar elektrofysiologisch onderzoek van kleine kinderen gedaan kan worden.
Als er sprake is van een erfelijke oogaandoening of het vermoeden daarop, is verwijzing naar een klinisch geneticus te overwegen, Dit zal meestal vanuit het tertiaire centrum gebeuren.
Uitgangsvraag 2: Welke revalidatie interventies hebben de voorkeur bij kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking?
Relevante uitkomstmaten
In de review worden de volgende uitkomstmaten uitgewerkt: functioneren, ouder-kind interactie en sociale interactie voor de besluitvorming, en de overige uitkomsten voor de besluitvorming.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Resultaten
Eén studie is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Beschrijving studies
In de gerandomiseerde trial van Platje (2018) werd een ontwikkelingsbegeleidings-interventie op basis van video-feedback vergeleken met gebruikelijke zorg bij kinderen tussen de 1 en 5 jaar met een visuele beperking. Van de 86 kinderen in de studie was 6,9% blind, had 17,2% een intellectuele beperking en had 20,7% een fysieke beperking). De interventie (n=37, gemiddelde leeftijd=3,4 ±1,2 jaar) was gericht op de ouders van het kind en bestond uit 7 huisbezoeken verspreid over 5 maanden door een getrainde zorgverlener waarbij steeds een ander thema centraal stond. Tijdens bezoek 1 werd de interactie tussen ouder en kind gefilmd. Tijdens bezoek 2 en 5 werden de opnamen gebruikt als uitgangspunt voor discussies over de volgende thema’s: exploreren versus hechtingsgedrag, spreken voor het kind, sensitieve responsiviteit op signalen van het kind en delen van emoties. Tijdens bezoek 6 en7 werden voorgaande thema’s herhaald (booster sessies). De interventie werd aangeboden naast vroege-interventie zorg. De gebruikelijke zorg groep (n=40, gemiddelde leeftijd=3,2 ±1,0 jaar) ontving uitsluitend vroege-interventie zorg. De gemeten uitkomstmaten waren ouderlijke sensitiviteit en kwaliteit van ouder-kind interactie (gemeten met de drie dozen procedure, waarbij ouders met hun kinderen spelen met verschillend speelgoed aangeboden in specifieke volgorde; observatoren scoren het gedrag van ouder en kind op vijf 7-punts Likert schalen). Deze uitkomsten werden gemeten op pretest (gemiddeld 7,2 ±6,6 weken voor de start van de interventie), posttest (gemiddeld 6,9 ±4,9 weken na afloop van de interventie) en follow-up (gemiddeld 6,3 ±1,7 maanden na afloop van de interventie). Verschillen tussen groepen over tijd werden getoetst met ANOVA voor herhaalde metingen.
Resultaten
• Ouder-kind interactie
Vergelijking: ontwikkelingsbegeleiding versus gebruikelijke zorg of geen behandeling
Eén studie vergeleek ontwikkelingsbegeleiding door middel van video-feedback (n=37) met gebruikelijke zorg (n=40) bij kinderen met visuele beperkingen op de uitkomsten ouderlijke sensitiviteit en kwaliteit van ouder-kind-interactie. Er werden geen significante verschillen gevonden tussen de groepen over tijd op de uitkomst ouderlijke sensitiviteit (video-feedback: pretest=16,3 ±2,4, posttest=16,7 ±2,3 en follow-up=16,4 ±2,0; gebruikelijke zorg: pretest=16,2 ±2,2, posttest=16,3 ±2,5, follow-up=16,4 ±2,3; p-waarde voor tijd×groep interactie=0,72). Er werden geen significante verschillen gevonden tussen de groepen over tijd op de uitkomst kwaliteit van ouder-kind interactie (video-feedback: pretest=4,4 ±1,3, posttest=5,0 ±1,1 en follow-up=4,8 ±1,0; gebruikelijke zorg: pretest=4,7 ±1,1, posttest=4,8 ±1,1, follow-up=4,7 ±1,2; p-waarde voor tijd×groep interactie=0,26).
Vergelijking: visuele stimulatie of training versus gebruikelijke zorg of geen behandeling
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van een visuele stimulatie of training vergeleken met gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst ouder-kind interactie.
Vergelijking: revalidatie versus gebruikelijke zorg of geen behandeling
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van een revalidatie vergeleken met gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst ouder-kind interactie.
• Visueel functioneren
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst visueel functioneren.
• Motorische ontwikkeling
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst motorische ontwikkeling.
• Mobiliteit
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst mobiliteit.
• ADL functioneren
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst ADL functioneren.
• Spelen
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst spelen.
• Sociale interactie
Er zijn geen studies gevonden die bewijs leveren voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomst sociale interactie.
Bewijskracht van de literatuur
Ouder-kind interactie
De bewijskracht voor de uitkomstmaat ouder-kind interactie is gebaseerd op een gerandomiseerde trial en start daarmee op ‘hoog’. De bewijskracht is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: gebrek aan blindering bij een subjectieve uitkomstmaat en afwijken van de intention-to-treat analyse) en het geringe aantal patiënten (imprecisie: 1 studie met in totaal 86 deelnemers). De bewijskracht komt daarmee uit op ‘zeer laag’.
Visueel functioneren, motorische ontwikkeling, mobiliteit, ADL functioneren, spelen, sociale interactie
Er is geen bewijs gevonden voor de effectiviteit van ontwikkelingsbegeleiding, visuele stimulatie of training, of revalidatie ten opzichte van gebruikelijke zorg of geen behandeling bij kinderen van 0 tot 4 jaar met visuele beperkingen op de uitkomsten visueel functioneren, motorische ontwikkeling, mobiliteit, ADL functioneren, spelen en sociale interactie. De bewijskracht kan daarom voor deze uitkomsten niet gegradeerd worden.
Zoeken en selecteren
Om de deelvragen te kunnen beantwoorden is gepoogd een systematische literatuuranalyse te verrichten naar de volgende zoekvragen:
Zoekvraag 1: Welke verwijscriteria zijn voor diagnostiek en/of revalidatie van toepassing bij kinderen van 0 tot 4 jaar met (het vermoeden van) een visuele beperking?
P: kinderen van 0 tot 4 jaar;
I: observatieschalen, verwijscriteria, signalen, nystagmus, visueel gedrag;
C: niet van toepassing;
O: visuele beperking, indicatoren voor revalidatie.
Zoekvraag 2: Welke revalidatie interventies zijn er voor slechtziende kinderen van 0 tot 4 jaar?
P: kinderen van 0 tot 4 jaar met visuele beperking;
I: ontwikkelingsbegeleiding, visuele stimulatie, visuele training, revalidatie;
C: gebruikelijke zorg, wachtlijst, geen behandeling;
O: ouder-kind interactie, visueel functioneren, motorische ontwikkeling, mobiliteit, ADL, spelen, sociale interactie.
Zoeken en selecteren (methods):
Voor zoekvraag 1 (verwijscriteria) is een systematische literatuursearch opgezet, echter bleek dat de resultaten niet bruikbaar waren voor de uitwerking van deze module. Daarom is deze vraag beantwoordt op basis van expert opinie. Voor zoekvraag 2 (revalidatie interventies) wordt uitgegaan van een recent gepubliceerde systematische review (Elsman, 2019). In deze review voldeed één artikel (Platje, 2018) aan het leeftijdscriterium van 0 tot 4 jaar. Dit artikel is meegenomen in de literatuuranalyse.
Referenties
- Elsman, E. B., Al Baaj, M., van Rens, G. H., Sijbrandi, W., van den Broek, E. G., van der Aa, H. P. & Steenbergen, B. (2019). Interventions to improve functioning, participation, and quality of life in children with visual impairment: a systematic review. Survey of ophthalmology.
- Platje, E., Sterkenburg, P., Overbeek, M., Kef, S., & Schuengel, C. (2018). The efficacy of VIPP-V parenting training for parents of young children with a visual or visual-and-intellectual disability: a randomized controlled trial. Attachment & human development, 20(5), 455-472.
- Rahi, J., Cable, N. (BCVISG). BCVISG: Severe visual impairment and blindness in children in the UK. Lancet. 362:1359-1365 2003.
- Rahi J., Solebo A. (2012). Childhood eye disease and visual impairment. In: Hollar D., editor: Handbook on children with special health care needs. New York NY: Springer: 131-32.
- Taylor’s & Hoyt’s Pediatric Ophthalmology and Strabismus, 5e druk, 2017, blz 33 en 34.
- S Sokol, A Moskowitz, G McCormack, VEP Infant: and preferential looking acuity measured with phase alternating gratings. Invest Ophthalmol Vis Sci. 33:3156-3161 1992
- DL Mayer, AB Fulton, PL Sossen: Preferential looking acuity of pediatric patients with developmental disabilities. Behav Brain Res. 10:189-197 1983
- Boonstra N1, Limburg H, Tijmes N, van Genderen M, Schuil J, van Nispen R. Changes in causes of low vision between 1988 and 2009 in a Dutch population of children. Acta Ophthalmol. 2012 May;90(3):277-86.
- C Gilbert, A Foster: Childhood blindness in the context of VISION 2020: the right to sight. Bull World Health Organ. 79:227-232 2001
- C Gilbert, J Rahi: Magnitude and causes. G Johnson D Minassian R Weale S West Epidemiology of Eye Disease. 3rd ed 2011 Imperial College Press/World Scientific London
- J Aboshiha, AM Dubis, J Carroll, et al.: The cone dysfunction syndromes. Br J Ophthalmol. 100:115-121 2016
- Kruijt CC, de Wit GC, Bergen AA, Florijn RJ, Schalij-Delfos NE, van Genderen MM. The phenotypic spectrum of albinism. Ophthalmology. 2018 Aug 8.
- Mieke M.C. Bijveld, Ralph J. Florijn, Arthur A.B. Bergen, L. Ingeborgh van den Born, Maarten Kamermans, Liesbeth Prick, Frans C.C. Riemslag, Mary J. van Schooneveld, Astrid M.L. Kappers, Maria M. van Genderen. Genotype and Phenotype of 101 Dutch Patients with Congenital Stationary Night Blindness. Ophthalmology. 2013 Oct;120(10):2072-81.
- Morgan Bertscha, Michael Floyda,b, Taylor Kehoea, c, Wanda Pfeifera, and Arlene V. Dracka. The clinical evaluation of infantile nystagmus: What to do first and why. Ophthalmic Genetics 2017, Vol. 38, No 1, 22-33.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Platje, 2018 |
Type of study: RCT
Setting and country: Netherlands
Funding and conflicts of interest: -government funded -no conflicts of interests |
Inclusion criteria: - Parents of young children aged 1–5 years with a visual or visual-and-intellectual disability
Exclusion criteria:
N total at baseline: Intervention: 44 Control: 42
Important prognostic factors2: For example age ± SD: I: 3.4 ±1.2 C:3.2 ±1.0
Sex: I: 62% M C: 55% M
Groups comparable at baseline? yes |
Video-feedback intervention to promote positive parenting (VIPP-V)
The VIPP-V program was offered in addition to early-intervention care (see control group for details). VIPP consists of four themes in a standardized order; (1) exploration versus attachment behaviour, (2) “speaking for the child,” (3) “sensitivity chain,” and (4) sharing emotions, followed by two booster sessions, yet individualized to each specific parent–child dyad. The program was adapted to suit families with a young child with visual or visual and intellectual disability (VIPP-V). VIPP-V consists of seven 1.5-h sessions. The first five sessions are similar to the original VIPP themes, with an added component each session: predictability, safety, independence, making demands of the child, dealing with changes and frustration, sharing of attention, joint attention, recognizing and naming emotions, and empathy and induction. The sixth and seventh sessions are booster sessions. The intervention focuses on the primary caregiving parent. The five regular home-visits are scheduled every 2–3 weeks, and the two booster sessions are scheduled in the next2 months (every 4–5 weeks). In these booster sessions, the other parent is also invited to participate. Extensively trained professionals (see Overbeek et al., 2015) used a standardized protocol describing the goals and activities of each home-visit, but also leaving sufficient flexibility to adapt for specific needs of the parent–child dyad. Each home-visit starts with video-taping the parent–child dyad in various tasks, after which feedback on the video of the previous home-visit is discussed and the intervention worker provides information on sensitive responsiveness and visual/visual-and-intellectual disabilities. At the end of the last home-visit, parents receive a brochure with a summary of the most important elements discussed in the intervention, including several tips, and the video-recordings. |
Care as usual: early-intervention care.
The frequency in contact between care worker and parents is determined by the parents’ needs
|
Length of follow-up: - The pretest assessment (T0) took place after randomization, and on average 7.18 (SD = 6.64) weeks before the intervention started. The intervention lasted approximately 5 months and on average 6.90 (SD = 4.92) weeks after the last home-visit, the posttest, took place, with the follow-up assessment on average 6.31 (SD = 1.68) months later.
Loss-to-follow-up: Intervention: N (%): 7 (15.9%) Reasons (describe) -did not receive allocated intervention (4) due to insufficient developmental age (2) or declined (2) -medical circumstances (1)
Control: N (%): 2 (4,8%) Reasons (describe) -did not participate in assessment due to medical circumstances (1) -declined (1) |
Outcome: parental sensitivity Three Boxes-procedure. The National Institute of Child Health and Human Development Scales were used to code parental sensitivity (7-point Likert scale on 5 scales). I: pretest=16.3 ±2.4 posttest=16.7 ±2.3 follow-up=16.4 ±2.0 C: pretest=16.2 ±2.2 posttest=16.3 ±2.5 follow-up=16.4 ±2.3 ANOVA: p-value for time×group interaction=0.72
Outcome: quality of parent-child interaction Three Boxes-procedure. The National Institute of Child Health and Human Development Scales were used to code pare quality of parent–child interaction (7-point Likert scale on 5 scales). I: pretest=4.4 ±1.3 posttest=5.0 ±1.1 follow-up=4.8 ±1.0 C: pretest=4.7 ±1.1 posttest=4.8 ±1.1 follow-up=4.7 ±1.2 ANOVA: p-value for time×group interaction=0.26.
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Platje 2018 |
Randomization was performed as stratified (on age and organization) block randomization with a 1:1 allocation using a computerized random number generator. |
Unlikely |
unclear |
Likely |
Likely |
Unlikely |
unclear – 3 participant in the intervention group (1 medical reason, 2 declined) were lost and 1 in the control group (declined); |
Likely - participants who withdrew differed from those who completed the study, but only data from completers were analysed. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-12-2020
Voor het beoordelen van de actualiteit van deze richtlijn beoordeelt de initatiefnemende vereniging, het Nederlands Oogheelkundig Gezelschap, of de werkgroep in stand wordt gehouden. Uiterlijk in 2023 bepaalt het bestuur van Het Nederlands Oogheelkundig Gezelschap of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Oogheelkundig Gezelschap is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Kinderen |
NOG |
2020 |
2025 |
Elke 5 jaar |
NOG |
Aanwezigheid van nu ontbrekende bewijskracht |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering van de oogarts. Het doel van de richtlijn is te komen tot:
- de identificatie van potentieel te verwijzen slechtziende en blinde mensen;
- een doelmatige ketenzorg door transparante, doelmatige en efficiënte verwijzing van slechtziende en blinde mensen naar een centrum voor revalidatie van slechtziende en blinde mensen en andere vormen van hulpverlening;
- de optimale (revalidatie) interventies bij patiënten met een visuele beperking (zie de afzonderlijke modules voor de specifieke subgroepen).
Daarnaast beoogt de richtlijn daar waar nodig te komen tot betere informatie over de visuele beperking naar patiënten en overige zorgprofessionals. De richtlijn omvat een advies wanneer en bij welke visuele beperking patiënten te verwijzen naar een centrum voor revalidatie van slechtziende en blinde mensen of overige zorgprofessionals. De richtlijn kan een hulp zijn bij de keuze van de aard van revalidatie. De werkgroep benadrukt dat binnen Nederland, afhankelijk van de lokale situatie, de aanwezige deskundigheid op het gebied van revalidatie bij slechtziendheid of blindheid sterk kan verschillen. Hiermee dient de verwijzer natuurlijk rekening te houden.
Doelgroep
Deze richtlijn is primair bedoeld voor oogartsen. Daarnaast kan de richtlijn ook een leidraad zijn voor zorgprofessionals die op een andere manier betrokken zijn bij mensen met een visuele beperking.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor patiënten met visusstoornissen te maken hebben (zie hiervoor Samenstelling van de werkgroep). De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
Werkgroep
- Prof. dr. G.H.M.B. van Rens, medisch manager oogheelkunde, werkzaam in het Elkerliek Ziekenhuis te Helmond, hoogleraar oogheelkunde, werkzaam bij het Amsterdam UMC, vrije universiteit te Amsterdam, NOG (voorzitter)
- Dr. F.N. Boonstra, oogarts, werkzaam voor Koninklijke Visio Expertisecentrum te Nijmegen, NOG
- Prof. dr. M. van Genderen, oogarts, werkzaam bij Stichting Bartimeus te Zeist, oogarts/ bijzonder hoogleraar, werkzaam bij UMC Utrecht te Utrecht, NOG
- J. Koopman, algemeen klinisch fysicus, werkzaam voor Koninklijke Visio Extertisecentrum te Amsterdam, NVKF
- P.J. Kortenhoeven, projectleider, werkzaam bij Oogvereniging Nederland te Utrecht
- Dr. R.M.A. van Nispen, associate professor/ universitair hoofddocent, werkzaam bij Amsterdam UMC te Amsterdam
- H.L.M. Stam, optometrist en low vision specialist, werkzaam bij Stichting Bartimeus te Amsterdam, OVN
- A.J. Verpoorten - van Sorge, oogarts, werkzaam bij Boven IJ Ziekenhuis en Koninklijke Visio Expertisecentrum te Amsterdam, NOG
- Dr. E.H. Bosch - Driessen, oogarts, werkzaam bij Stichting Bartimeus te Zeist, van september 2017 tot juni 2019, NOG
Met ondersteuning van
- G. Peeters, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, tot oktober 2019
- T. Geltink, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, vanaf oktober 2019
- A. Hagemeijer, senior beleidsadviseur NOG
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (zelf in te vullen door adviseur) |
|
Sorge, van |
Oogarts Boven IJ Ziekenhuis (tot 31-12-2018), (Revalidatie) Oogarts Visio Amsterdam Kinderoogarts Amsterdam UMC (AMC) |
Wetenschappelijke aanstelling LUMC in NEDROP2 onbetaald (tot 1-1-2018)
Richtlijn ROP en richtlijn Visusstoornissen betaald / vacatiegelden |
geen |
geen |
geen |
geen |
nee |
25-9-2020 |
geen |
|
Boonstra |
Oogarts Koninklijke Visio Onderzoeker Donders Instituut DCN |
Aanstelling "met toestemming aanwezig" Donders Instituut DCN |
geen |
geen |
geen |
geen |
nee |
29-9-2020 |
geen |
|
Stam |
Optometrist, Low Vision specialist bij Bartiméus |
geen |
geen |
geen |
geen |
geen |
nee |
24-8-2020 |
geen |
|
Koopman |
Algemeen Klinisch fysicus (speciale focus op visuele revalidatie) bij Koninklijke Visio |
geen |
geen |
geen |
geen |
geen |
nee |
21-8-2020 |
geen |
|
Rens, van |
Medisch Manager oogheelkunde Elkerliek Ziekenhuis, Helmond 0,7 fte |
Bestuurslid International Society for Low Vision Rehabilitation and research (ontbetaald) |
geen |
geen |
Mijn onderzoeksgroep in het Amsterdam UMC, locatie VUmc doet veel onderzoek gezamenlijk met Koninklijk Visio en Bartimeus. Deels bekostigd door ZonMw. |
Op verzoek van het NOG voor de derde keer voorzitter van deze richtlijn. |
nee |
26-8-2020 |
geen; medicatie valt buiten de afbakening van de richtlijn |
|
|
|
|
|
|
|
|
|
||
|
Genderen, van |
oogarts bij Stichting Bartimeus, 08FTE |
Stuurgroep Inzicht onbetaald |
geen |
geen |
geen |
geen |
nee |
21-08-2020 |
geen |
|
Kortenhoeven |
Projectleider, Oogvereniging |
geen |
geen |
Leden van oogpatiëntenverenigingen en met een aantal medewerkers van de Oogvereniging |
geen |
Bescherming van de reputatie Oogvereniging en andere oogpatiëntenverenigingen. Verwerven erkenning patiënten/cliëntenperspectief. |
nee |
24-8-2020 |
geen |
|
Nispen, van |
Associate professor / universitair hoofddocent, 1.0 fte |
Waarnemend voorzitter stuurgroep ZonMw Inzicht; betaald via vacatiegelden (tot … 2020)
Voorzitter Vereniging voor Revalidatie bij Slechtziendheid (VRS); onbetaald
Lid bestuur International Society for Low vision Research and Rehabilitation (ISLRR); onbetaald
Lid ARVO Annual Meeting Program Committee (2020-2023): onbetaald
Consultant MeiraGTx UK II Limited: betaald, adviseur methodologie onderzoek gentherapie voor retinitis pigmentosa, validatiestudie en RCT (vanaf ...) |
geen |
geen |
Financiële ondersteuning ontvangen voor investigator initiated research van Bayer |
Mogelijk door expertise op gebied van psychosociale gevolgen van visuele beperking, meer erkenning door werken aan richtlijn. |
nee |
30-8-2020 |
geen; medicatie valt buiten de afbakening van de richtlijn |
|
Bosch-Driessen |
Oogarts Bartimeus |
geen |
geen |
geen |
geen |
geen |
nee |
14-2-2019 |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door aan de Oogvereniging te vragen om te participeren in de werkgroep. Tevens is de conceptrichtlijn ter commentaar voorgelegd aan de Oogvereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Per module is een implementatieplan beschreven.
De werkgroep heeft tevens kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten. De werkgroep beoordeelde de modules uit de vorige richtlijn op noodzaak tot revisie. Naast de deelnemende partijen uit de werkgroep zijn ook de volgende partijen gevraagd om knelpunten aan te dragen via een enquête:
IGJ, NFU, NHG, NVZ, Patiëntenfederatie Nederland, STZ, V&VN, ZiNL, ZKN, ZN, NAPA, Nederlands Instituut van Psychologen (NIP), Vereniging van specialisten ouderengeneeskunde (Verenso), Nederlands Huisartsen Genootschap (NHG), Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse vereniging van pedagogen en onderwijskundigen (NVO), Nederlandse Vereniging van Revalidatieartsen (VRA), Vilans, Vereniging van Geestelijk Verzorgers in Zorginstellingen (VGVZ), Vereniging Gehandicaptenzorg Nederland (VGN), Oogvereniging, Nederlandse Vereniging Neurologie (NVN), Beroepsvereniging van Professionals in Sociaal Werk (BPSW), Nederlandse Vereniging voor Kinderneurologie (NVKN), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse Vereniging van Artsen voor Verstandelijk Gehandicapten (NVAVG), Nederlandse Internisten Vereniging (NIV), Nederlands Centrum Jeugdgezondheid (NCJ), Stichting Kind en Ziekenhuis (K&Z), Artsen Jeugdgezondheidszorg Nederland (AJN), Landelijke vereniging medische psychologie (LVMP), Nederlandse Vereniging Gezondheid Psychologen (NVGzP)
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken, waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. De gedetailleerde zoekstrategieën zijn vermeld in de aanverwante producten van de betreffende module.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen.
De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie).
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, en bruikbaarheid in de praktijk
(naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die rand voorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten (secretariaat@kennisinstituut.nl). Indicatoren worden tijdens de commentaarfase ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de volgende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar:
Nederlands Oogheelkundig Gezelschap (NOG), NUVO, IGJ, NFU, NHG, NVZ, STZ, V&VN, ZiNL, ZKN, ZN, NAPA, Vilans, Oogvereniging/Vereniging Oog in Oog, Patiëntenfederatie Nederland, Nederlandse Vereniging voor Klinisch Fysici (NVKF), Nederlands Instituut van Psychologen (NIP), Optometristen Vereniging Nederland (OVN), Vereniging van specialisten ouderengeneeskunde (Verenso), Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse vereniging van pedagogen en onderwijskundigen (NVO), Nederlandse Vereniging van Revalidatieartsen (VRA), Vereniging van Geestelijk Verzorgers in Zorginstellingen (VGVZ), Vereniging Gehandicaptenzorg Nederland (VGN), Vereniging van Nederlandse Gemeenten (VNG), Nederlandse Vereniging Neurologie (NVN), Beroepsvereniging van Professionals in Sociaal Werk (BPSW), Nederlandse Vereniging voor Kinderneurologie (NVKN), Nederlandse Vereniging van Artsen voor Verstandelijk Gehandicapten (NVAVG), Nederlandse Internisten Vereniging (NIV), Nederlands Centrum Jeugdgezondheid (NCJ), Stichting Kind en Ziekenhuis (K&Z), Artsen Jeugdgezondheidszorg Nederland (AJN), Landelijke vereniging medische psychologie (LVMP), Nederlandse Vereniging Gezondheid Psychologen (NVGzP)
De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep.
De definitieve richtlijn wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18): E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul; 87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj. a139. PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
