Profylaxe na een UWI
Uitgangsvraag
Wat is de effectiviteit van het gebruik van antibiotische of niet-antibiotische profylaxe bij kinderen die een UWI hebben gehad?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de effectiviteit van het gebruik van antibiotische profylaxe bij kinderen die een UWI hebben gehad?
- Wat is de effectiviteit van het gebruik van niet-antibiotische profylaxe bij kinderen die een UWI hebben gehad?
Aanbeveling
Rationale/ balans tussen de argumenten voor en tegen de interventie
Er is lage bewijskracht voor het voorschrijven van antibiotische profylaxe in de totale groep van kinderen met recidiverende UWIs en er is geen bewijs dat antibiotische profylaxe nierschade voorkomt. Naast het feit dat de meeste ouders bezwaren hebben tegen het langdurig moeten toedienen van medicatie aan hun kind zou toename van antibioticaresistentie een nadeel kunnen zijn van deze behandeling maar dit effect blijkt bij profylactisch gebruik statistisch noch klinisch relevant te zijn.
De kosten van behandelen zijn slechts marginaal hoger dan van niet behandelen.
De commissie is van mening dat verkleining van de kans op het optreden van UWIs een doel om na te streven zou moeten blijven. In dat licht is het voorschrijven van antibiotische profylaxe aan kinderen met (ernstige) anatomische afwijkingen en kinderen met bijkomende geestelijke, lichamelijke of functionele beperkingen een valide optie.
Schrijf geen antibiotische profylaxe voor aan kinderen met recidiverende UWI waarbij anatomische afwijkingen zijn uitgesloten.
Overweeg voorschrijven van antibiotische profylaxe voor 12 tot 24 maanden bij kinderen die een UWI gehad hebben en zijn gediagnostiseerd met hooggradige VUR.
De werkgroep kan geen aanbevelingen geven over het gebruik van cranberrypreparaten en/of probiotica vanwege onvoldoende bewijs.
Overwegingen
Sinds de publicatie van de vorige richtlijn zijn twee systematische reviews gepubliceerd die een antwoord proberen te geven op de waarde van het voorschrijven van antibiotische profylaxe. De heterogeniteit en de kwaliteit van de geïncludeerde studies is zodanig wisselend dat een eensluidend advies niet te geven is.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Antibiotische profylaxe
De kwaliteit van studies die een antwoord proberen te geven op de vraag wat het effect is van AB profylaxe op het optreden van recidiverende UWI en parenchymschade is erg wisselend en in het algemeen matig. De meeste studies onderzochten profylaxe versus geen profylaxe. Bij het geringe aantal studies dat profylaxe versus placebo onderzochten was het placebo (ook door ouders) te onderscheiden van het werkzame medicijn. Behalve studies met maximaal behandelduur van 12 maanden en follow-up van 12 maanden zijn er ook studies met behandelduur beschreven van 10 dagen en follow up tot 6 maanden, tijdsspannes die niet voldoende lang zijn om iets te kunnen zeggen over de invloed op het in het algemeen weinig frequent voorkomen van recidiverende UWI. De meeste studies beschrijven kinderen met anatomische afwijkingen; meestal VUR.
De studies die een uitspraak doen over de waarde van profylaxe bij kinderen zónder anatomische afwijkingen baseren zich meestal op de anamnese van de ouders waarin gemeld wordt dat er geen anatomische afwijkingen bekend zijn en is geen specifieke beeldvorming gedaan bij inclusie in de studie. In de studies met de grootste geïncludeerde aantallen wordt voor de groep kinderen met terugkerende UWIs een voordeel beschreven van AB profylaxe maar het betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie niet. In ieder geval is duidelijk dat geen enkele interventie invloed heeft op het optreden van nierparenchymschade.
Niet antibiotische profylaxe
De studies die een uitspraak doen over niet antibiotische profylaxe zijn zeer heterogeen en zeer matig van kwaliteit. In de studies over cranberrypreparaten was bij 2 van de 3 studies de toegediende hoeveelheid van proanthocyanidines (de vermoede werkzame stof in cranberrypreparaten) niet vermeld. In 2 van de 3 studies die gebruikt zijn in de systematische review dat een uitspraak probeert te doen over het nut van cranberrypreparaten bij “normale” kinderen met UWI zijn kinderen met VUR geïncludeerd. Uit dit review blijkt dat kinderen die cranberry gebruiken significant minder UWI hebben dan kinderen die placebo gebruiken (maar de betrouwbaarheidinterval overschrijdt de grens voor klinische relevantie ook hier niet)
Hetzelfde systematische review dat het effect van cranberry profylaxe op terugkerende UWIs bij kinderen mét anatomische afwijkingen heeft vergeleken met placebo beschrijft geen voordeel voor cranberrypreparaten bij kinderen zonder anatomisch afwijkingen. Ook hier kennen geïncludeerde studies kennen veel bias.
De literatuur die gepubliceerd is biedt zeer weinig houvast om routinematig gebruik van cranberrypreparaten ter voorkoming van recidiverende UWI bij kinderen zonder en mét anatomische afwijkingen van de urinewegen te rechtvaardigen.
De meeste studies naar de waarde van probiotica zijn uitgevoerd bij kinderen die nooit een UWI gehad hebben. Onderzoek naar de waarde van probiotica bij kinderen zónder anatomische afwijkingen en recidiverende UWI is niet gepubliceerd.
Er is in de literatuur geen bewijs dat toediening van probiotica aan kinderen met VUR die antibiotische profylaxe krijgen zinnig is.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De ouders hebben veelal bezwaren tegen het gedurende zo lange tijd moeten geven van medicatie maar het meest gegeven argument: het gevaar voor resistentievorming blijkt weinig valide. Het doel: voorkomen van UWIs is voor ouders duidelijk en wordt door hen onderschreven.
In het algemeen is het toedienen van antibiotische profylaxe geen grote belasting voor ouder en kind. De medicatie is verkrijgbaar in vloeibare vorm en hoeft maar éen keer per dag, bij voorkeur voor het slapengaan, te worden toegediend. De hulpstoffen zoals smaakstoffen en fruitzuren maken het noodzakelijk dat de medicatie gegeven wordt vóór het tandenpoetsen om tandbederf als gevolg van de medicatie te voorkomen. Gastro-intestinale en pulmonale bijwerkingen van nitrofurantoïne zijn alleen bij volwassenen beschreven.
Kosten (middelenbeslag)
Wat betreft de kosten van het voorschrijven van AB profylaxe zijn weinig zorgen te verwachten. De gebruikte medicatie is al lang uit patent. De kosten van een therapeutische dagdosis nitrofurantoïne liggen, afhankelijk van de toedieningsvorm, tussen de 16 en 78 eurocent, bij trimethoprim is dit 41 en 50 eurocent (bron: farmacotherapeutisch kompas 2019). Bij profylactisch gebruik zijn de doses en dus de kosten nog aanzienlijk lager.
De kosten van niet antibiotische methoden van profylaxe vallen niet binnen de verzekerde zorg en zullen door de ouders moeten worden betaald. (Voor de volledigheid: een dagdosis cranberrypreparaat kost tussen 16 en 75 eurocent)
Voor de situatie in de VS is een onderzoek naar kosteneffectiviteit gedaan waarvoor ook de kosten van opname, eventueel operatie en met name ook inkomstenderving door de ouders is beschouwd (Palmer, 2018). Deze uitkomsten zijn niet geheel vergelijkbaar met de Nederlandse situatie. Deze studie rapporteert marginaal hogere kosten voor antibiotische profylaxe ($ 3092) vergeleken met placebo ($ 2932) waarbij er in de antibioticagroep 12,7 infecties per 100 kinderen minder voorkomen dan in de placebogroep.
Onderbouwing
Achtergrond
Bij kinderen met recidiverende UWIs die conservatief behandeld worden kan antibiotische of niet-antibiotische profylaxe de kans op een nieuwe UWI verkleinen. Bij anatomische afwijkingen, met name ernstige vesico-ureterale reflux (VUR) en in mindere mate bij megaureters is het nut van antibiotische profylaxe wetenschappelijk aangetoond. Bij laaggradige VUR en functionele mictiestoornissen is die relatie veel minder duidelijk. Vanuit microbiologisch standpunt is het geven van langdurige laaggedoseerde antibiotica discutabel met het oog op resistentievorming. Ouders hebben vaak bezwaar tegen het jarenlang geven van medicatie.
Conclusies / Summary of Findings
Niet-antibiotische profylaxe
Kinderen die een UWI hebben gehad (met of zonder VUR)
|
Laag GRADE |
Cranberry profylaxe (gegeven voor 6 tot 12 maanden) zou recidiverende UWIs bij kinderen die een UWI hebben gehad enigszins kunnen verminderen vergeleken met placebo.
Bronnen: (Durham, 2015; Ledda, 2017) |
|
Zeer laag GRADE |
We zijn onzeker over het effect van probiotica profylaxe op recidiverende UWIs bij kinderen die een UWI hebben gehad.
Bronnen: (Hosseini, 2017) |
Kinderen met anatomische afwijkingen
|
Zeer laag GRADE |
We zijn onzeker over het effect van cranberry en probiotica profylaxe op recidiverende UWIs bij kinderen met anatomische afwijkingen die een UWI hebben gehad.
Bronnen: (Durham, 2015; Hosseini, 2017) |
Antibiotische profylaxe
Kinderen die een UWI hebben gehad (met of zonder VUR)
|
Laag GRADE |
Antibiotische profylaxe (gegeven voor 6 tot 12 maanden) zou recidiverende UWIs bij kinderen die een UWI hebben gehad kunnen verminderen vergeleken met placebo of geen behandeling.
Bronnen: (Williams, 2011) |
|
Laag GRADE |
Antibiotische profylaxe (gegeven voor 6 tot 12 maanden) zou mogelijk de antibioticaresistentie kunnen verhogen bij kinderen met een UWI, maar dit effect is niet statistisch significant of klinisch relevant.
Bronnen: (Williams, 2011) |
Kinderen met VUR (graad I-V)
|
Laag GRADE |
Antibiotische profylaxe (gegeven voor 12 tot 24 maanden) is mogelijk meer effectief dan placebo of geen behandeling in het verminderen van recidiverende UWIs bij kinderen met VUR (met name VUR graad III-V) die een UWI hebben gehad.
Bronnen: (Wang, 2015) |
|
Redelijk GRADE |
Antibiotische profylaxe (gegeven voor 12 tot 24 maanden) verhoogt waarschijnlijk de antibioticaresistentie bij kinderen met VUR die een UWI hebben gehad.
Bronnen: (Wang, 2015) |
|
Laag GRADE |
Antibiotische profylaxe (gegeven voor 1 tot 3 jaar) lijkt nierschade niet te verminderen bij kinderen met VUR na een eerste UWI vergeleken met placebo of geen behandeling.
Bronnen: (Wang, 2015) |
Samenvatting literatuur
Beschrijving studies
A. Antibiotische profylaxe
Williams (2011) verrichte een systematische review naar de effectiviteit en schade van langdurige antibiotica om terugkerende UWI bij kinderen te voorkomen. De search werd verricht in november 2010 in Medline, Embase, Cochrane Central Register of Controlled Trials (CENTRAL in de Cochrane Library) en the Cochrane Renal Group's Specialised Register. Er werden 4 studies geïncludeerd en geanalyseerd die het effect van antibiotica op terugkerende UWIs onderzochten, met in totaal 1024 kinderen. De duur van de antibiotische profylaxe varieerde in deze studies van 10 weken tot 12 maanden en de follow-up van 6 tot 12 maanden. Maar 1 van deze studies (Craig, 2009) gebruikte een placebo als controle, de andere studies (Smellie, 1978; Savage, 1975; Montini, 2008) vergeleken met geen profylaxe.
Wang (2015) verrichtte een systematische review naar de effectiviteit van het gebruik van continue antibiotische profylaxe versus geen behandeling bij kinderen met VUR na een eerste UWI. Er werd gezocht naar RCT’s tussen januari 2010 en mei 2014 in Medline, Embase, Cochrane Controlled Trals Register en Google scholar. Er werden 8 RCT’s geïncludeerd met in total 1592 patiënten. De gemiddelde leeftijd varieerde tussen 8,6 en 21,3 maanden en gemiddeld 63% van de patiënten was jongen. De follow-up varieerde tussen 1 en 3 jaar. Blindering gaf in veel studies een belangrijk risico op bias: in maar 2 studies werd een placebo gegeven dat vergelijkbaar was met het actieve antibioticum (Craig, 2009; Hoberman, 2014). Deze studies werden uitgevoerd bij respectievelijk 243 kinderen in de leeftijd van 0 tot 18 jaar met VUR graad I-V (Craig, 2009) en bij 607 kinderen in de leeftijd van 2 tot 72 maanden met VUR graad I-IV (Hoberman, 2014).
B. Niet-antibiotische profylaxe
Hosseini (2017) verrichtte een systematische review naar de effectiviteit van probiotica om UWI bij kinderen te voorkomen. Er werd gezocht in Medline en Embase tot eind 2016. Van de 10 geïncludeerde studies was er maar 1 RCT uitgevoerd bij kinderen met een eerste UWI om recidiverende UWIs te voorkomen (Cetin, 2014), 3 studies werden uitgevoerd bij kinderen met VUR. De resultaten van de andere 6 studies waren niet bruikbaar, omdat deze studies waren uitgevoerd ter voorkoming van een UWI en niet als profylaxe ter voorkoming van een recidiverende UWI (n=5) of een retrospectieve studie was (n=1). De studie van Cetin werd verricht bij 80 kinderen (leeftijd en geslacht werden niet gerapporteerd) en vergeleek Saccharomyces boulardii (5 x 109 CFU) + antibiotica met alleen antibiotica gegeven voor 1 jaar. De studie had een onduidelijk risico op bias voor alle elementen. De studies bij kinderen met VUR includeerden 333 kinderen in totaal en vergeleken Lactobacillus acidophilus (en Bifidobacterium lactis + antibiotica in Mohseni, 2013) met alleen antibiotica.
Durham (2015) verrichtte een systematische review naar het effect van cranberry producten om UWI bij kinderen te voorkomen. De search werd verricht in juli 2015 in Pubmed. Er werden 3 studies geïncludeerd die het effect onderzochten bij normaliter gezonde kinderen (Afshar, 2012; Ferrara, 2009; Salo, 2012) met in totaal 345 kinderen en 5 studies bij 338 kinderen met anatomische afwijkingen, zoals neuropatische blaas (Foda, 1995; Schlager, 1999; Mutli, 2012) en kinderen met VUR (Nishizaki, 2009; Uberos, 2012).
Er werd nog 1 RCT, gepubliceerd na de zoekdatum van Durham, geïncludeerd die het effect van een cranberry supplement (N=19) vergeleek met een standaardbehandeling (N=17) bij kinderen die een UWI hadden gehad (Ledda, 2017). De interventiegroep kreeg een oraal supplement met 120 mg cranberry extract (Anthocran®) dat gelijk staat aan 36 mg proanthocyanidinen (PACs) voor 30 achtereenvolgende dagen.
Resultaten
A. Antibiotische profylaxe
1. Terugkerende UWIs
In de systematische review van Williams was er geen effect van antibiotica op terugkerende UWIs vergeleken met placebo/geen behandeling (gepoold RR 0,75; 95% BI 0,36 tot 1,53) (figuur 1). Echter, de heterogeniteit tussen de studies bleek hoog (I2 = 62%) en de kwaliteit van de studies liep erg uiteen. In een sensitiviteitanalyse waarin alleen de 2 grote studies werden geïncludeerd (Craig, 2009; Montini, 2008) was er wel een statistische significante afname van het aantal terugkerende UWIs bij gebruik van antibiotica ten opzichte van geen profylaxe of placebo (gepoold RR 0,68; 95% BI 0,48 tot 0,95), maar het betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie (RR 0,75).
Figuur 1 Forest plot van recidiverende UWIs voor kinderen met UWI (uit Williams, 2011)
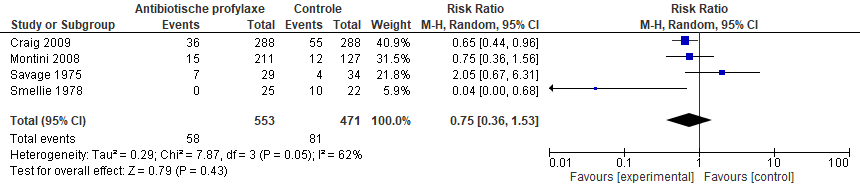
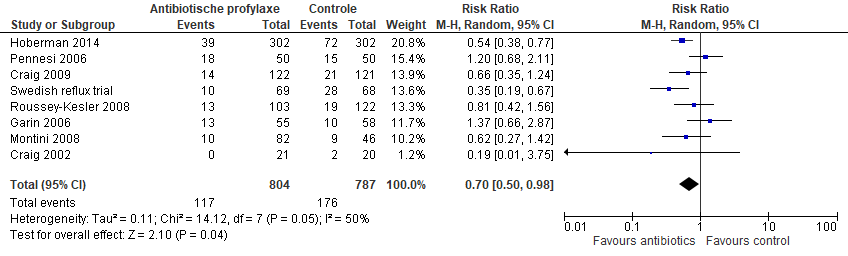
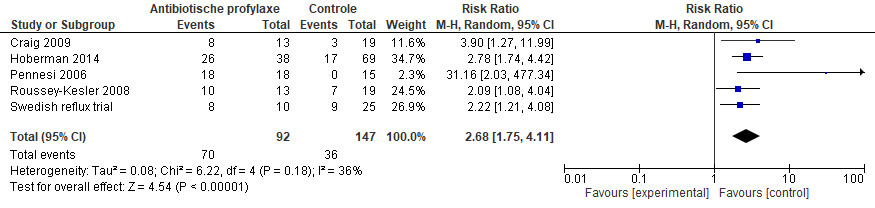
In de subgroepanalyses voor VUR was er in de meta-analyse van Williams geen effect van antibiotica op terugkerende UWIs in zowel de groep kinderen zonder VUR (gepoold RR 0,56; 95% BI 0,15 tot 2,12) als de groep met VUR (gepoold RR 0,65; 95% BI 0,39 tot 1,07). Een recentere review van Wang (2015), welke gericht was op kinderen met VUR, was er wel een statistisch significant effect van antibiotica op terugkerende UWIs (gepoold RR 0,70; 95% BI 0,50 tot 0,98), maar het betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie (figuur 2). In een subgroepanalyse met alleen de studies met laag risico op bias (Craig, 2009; Hoberman, 2014) was het effect van antibiotica nog groter vergeleken met placebo (gepoold RR 0,57; 95% BI 0,42 tot 0,77). Dit komt doordat in deze meta-analyse naast de PRIVENT-studie van Craig (2009) ook de RIVUR-studie van Hoberman (2014) werd geïncludeerd die een nog groter effect liet zien.
Figuur 2 Forest plot van recidiverende UWIs voor kinderen met VUR (uit Wang, 2015)
2. Nierschade
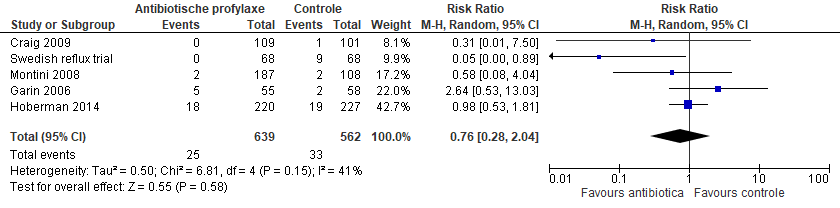
In de meta-analyse van Wang (2015) was er geen effect van antibiotica op het ontwikkelen van nieuwe parenchymafwijkingen in de nieren bij kinderen met VUR (gepoold RR 0,76; 95% BI 0,28 tot 2,04) (figuur 3). Ook in de subgroepanalyse met alleen de studies met laag risico op bias (Craig, 2009; Hoberman, 2014) was er geen effect op parenchymafwijkingen in de nieren (gepoold RR 0,94; 95% BI 0,51 tot 1,72).
Figuur 3 Forest plot van parenchymafwijkingen in de nieren bij kinderen met VUR (uit Wang, 2015)
3. Antibioticaresistentie
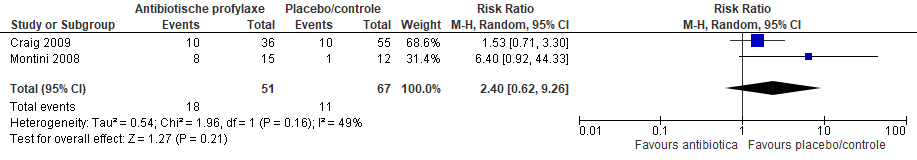
Twee van de geïncludeerde studies in Williams rapporteerden resistentiecijfers voor de gegeven antibiotica (figuur 4). De kans op antibiotica resistentie was 2 keer hoger in de antibiotica groep vergeleken met de controlegroep, maar dit verschil was niet statistisch significant (gepoold RR 2,40; 95% CI 0,62 tot 9,26).
Figuur 4 Forest plot van antibiotica resistentie bij kinderen met UWI (Williams, 2011)
In de meta-analyse van Wang (2015) was antibiotica geassocieerd met een groter risico op het ontwikkelen van antibioticaresistentie bij kinderen met VUR (gepoold RR 2,92; 95% BI 1,90 tot 4,49) (figuur 5). Ook in de subgroepanalyse met alleen de studies met laag risico op bias (Craig, 2009; Hoberman, 2014) was het risico op antibioticaresistentie nog iets hoger (gepoold RR 2,92; 95% BI 1,90 tot 4,49).
Figuur 5 Forest plot van antibiotica resistentie bij kinderen met VUR (Wang, 2015)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij kinderen met UWI is met 2 niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie, vanwege verschillende resultaten afhankelijk van de analyse) en imprecisie (breed betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie).
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij kinderen met VUR is met 2 niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie, vanwege verschillende resultaten afhankelijk van de analyse) en imprecisie (betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie).
De bewijskracht voor de uitkomstmaat antibioticaresistentie bij kinderen met UWI is met 2 niveaus verlaagd vanwege imprecisie (gering aantal patiënten en betrouwbaarheidsinterval overschrijdt beide grenzen voor klinische relevantie).
De bewijskracht voor de uitkomstmaat antibioticaresistentie bij kinderen met VUR is met 1 niveau verlaagd vanwege imprecisie (gering aantal patiënten en breed betrouwbaarheidsinterval).
De bewijskracht voor de uitkomstmaat nierschade bij kinderen met VUR is met 2 niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias vanwege ontbreken van blindering in 2 studies) en extrapoleerbaarheid (bias ten gevolge van indirectheid door verschillende duur van antibiotische profylaxe).
B. Niet-antibiotische profylaxe
1. Terugkerende UWIs
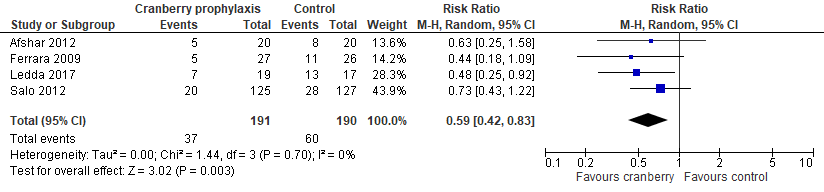
In de systematische review van Durham werden 3 studies geïncludeerd die het effect van cranberry profylaxe op terugkerende UWIs vergeleken met placebo bij normaliter gezonde kinderen. Er was een statistisch significante afname van het aantal terugkerende UWIs bij gebruik van cranberry profylaxe ten opzichte placebo (gepoold RR 0,64; 95% BI 0,43 tot 0,96), maar het betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie (RR 0,75). De proanthocyanidines (PAC) concentraties van de cranberry producten was niet bekend in 2 van de 3 RCT’s en verschillende doseringen werden gebruikt. Ook werden in 2 van de 3 studies kinderen met VUR geïncludeerd (alhoewel kleine aantallen en lage graad VUR). De resultaten van de RCT van Ledda (2017) werden toegevoegd aan de meta-analyse, met als uitkomstmaat symptomatische UWI. Dit resulteerde in een lager relatief risico, maar het betrouwbaarheidsinterval overschrijdt de grens voor klinische relevantie nog steeds (gepoold RR 0.59; 95% BI 0,42 tot 0,83) (figuur 6).
Figuur 6 Forest plot van recidiverende UWIs bij normaliter gezonde kinderen met UWI (Durham, 2015; Ledda, 2015)
In de RCT van Cetin, geïncludeerd in de systematische review van Hosseini, was er geen verschil tussen de groep die probiotica (Saccharomyces boulardii) in combinatie met antibiotica kreeg in vergelijking met alleen antibiotica bij kinderen met UWI (RR 0,40; 95% BI 0,09 tot 1,83).
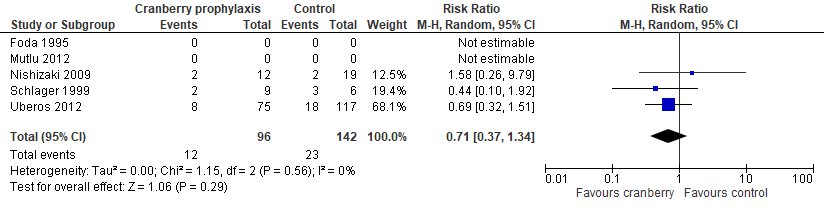
In de systematische review van Durham werden 5 studies geïncludeerd die het effect van cranberry profylaxe op terugkerende UWIs vergeleken met placebo bij kinderen met anatomische afwijkingen (gepoold RR 0,71; 95% BI 0,37 tot 1,34) (figuur 7). Van 2 studies werden geen aantallen van recidiverende UWIs genoemd, dus kon geen RR worden geschat. Twee van de drie studies in de meta-analyse (Nishizaki, 2009; Uberos, 2012) vergeleken cranberry profylaxe met antibiotica in de controlegroep.
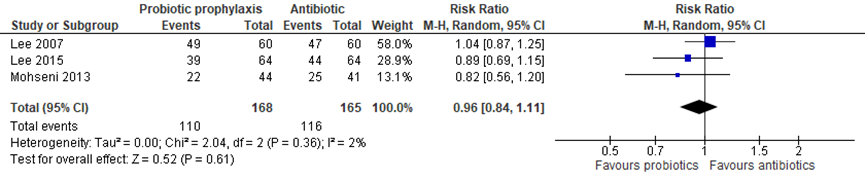
In de systematische review van Hosseini was er bij kinderen met VUR geen verschil tussen de groep die probiotica (Lactobacillus acidophilus, Bifidobacterium lactis) kreeg in vergelijking met alleen antibiotica (gepoold RR 0,96; 95% BI 0,84 tot 1,11) (figuur 8).
Figuur 7 Forest plot cranberry profylaxe van recidiverende UWIs bij kinderen met anatomische afwijkingen met UWI (Durham, 2015)
Figuur 8 Forest plot probiotische profylaxe van recidiverende UWIs bij kinderen met VUR (Hosseini, 2017)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij normaliter gezonde kinderen met UWI voor cranberry profylaxe is met 2 niveaus verlaagd gezien extrapoleerbaarheid (bias ten gevolge van indirectheid door verschillende doseringen) en imprecisie (gering aantal patiënten en betrouwbaarheidsinterval overschrijdt beide grenzen voor klinische relevantie).
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij kinderen met UWI voor probiotische profylaxe is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door onbekende blindering); extrapoleerbaarheid (bias ten gevolge van indirectheid door verschillende vergelijking met antibiotica) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij kinderen met anatomische afwijkingen voor cranberry profylaxe is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door beperkte of afwezigheid van blindering); tegenstrijdige resultaten (inconsistentie); extrapoleerbaarheid (bias ten gevolge van indirectheid door verschillende doseringen en vergelijking met placebo/niets/antibiotica) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat terugkerende UWIs bij kinderen met VUR voor probiotica profylaxe is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door beperkte of afwezigheid van blindering); extrapoleerbaarheid (bias ten gevolge van indirectheid door vergelijking met antibiotica als controle) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat is de effectiviteit van antibiotische profylaxe versus placebo bij kinderen die een UWI hebben gehad op recidiverende UWIs en/of nierschade?
P: kinderen met een doorgemaakte UWI;
I: antibiotische profylaxe, profylaxe;
C: placebo, conservatief beleid;
O: recidiverende UWI, nierschade.
2. Wat is de effectiviteit van niet-antibiotische profylaxe versus placebo bij kinderen die een UWI hebben gehad op recidiverende UWIs en/of nierschade?
P: kinderen met een doorgemaakte UWI;
I: niet-antibiotische profylaxe: probiotische en cranberry profylaxe;
C: placebo, conservatief beleid;
O: recidiverende UWI, nierschade, antibioticaresistentie.
Relevante uitkomstmaten
De werkgroep achtte recidiverende UWI een voor de besluitvorming cruciale uitkomstmaat; en nierschade en antibioticaresistentie voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: Een recidiverende UWI is gedefinieerd als twee of meer episodes van UWIs met koorts en/of duidelijke flankpijn of een episode van één UWI met koorts en/of duidelijke flankpijn PLUS één of meer episodes met UWI zonder koorts, of drie of meer episodes van UWI zonder koorts. Nierschade is gedefinieerd als: Littekens in de vorm van wigvormige corticale, fotopene gebieden in het nierparenchym bij DMSA onderzoek waarbij moet worden opgemerkt dat congenitale parenchymafwijkingen/nierdysplasie niet te onderscheiden zijn van door pyelonefritis veroorzaakte schade.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde een verschil van 25% op het relatief risico op recidiverende UWI als een klinisch patiënt relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 21 januari 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde trials over antibiotische en niet-antibiotische profylaxe bij kinderen die een UWI hebben gehad. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 294 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: SRs en RCT’s die antibiotische profylaxe of niet-antibiotische profylaxe vergeleken met een placebo of conservatief beleid of alternatief antibioticum bij kinderen die een UWI hebben gehad, en ten minste één van de volgende uitkomstmaten rapporteerden: recidiverende UWI, nierschade of antibioticaresistentie. Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 33 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 5 studies definitief geselecteerd.
Resultaten
Vijf onderzoeken zijn opgenomen in de literatuuranalyse, waarvan 4 systematische reviews en 1 RCT. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Durham, S. H., Stamm, P. L., & Eiland, L. S. (2015). Cranberry products for the prophylaxis of urinary tract infections in pediatric patients. Annals of Pharmacotherapy, 49(12), 1349-1356.
- Hosseini, M., Yousefifard, M., Ataei, N., Oraii, A., Razaz, J. M., & Izadi, A. (2017). The efficacy of probiotics in prevention of urinary tract infection in children: A systematic review and meta-analysis. Journal of pediatric urology, 13(6), 581-591.
- Ledda, A., Belcaro, G., Dugall, M., Riva, A., Togni, S., Eggenhoffner, R., & Giacomelli, L. (2017). Highly standardized cranberry extract supplementation (Anthocran®) as prophylaxis in young healthy subjects with recurrent urinary tract infections. Eur Rev Med Pharmacol Sci, 21(2), 389-393.
- Palmer LS, Seideman CA, Lotan Y. Cost-effectiveness of antimicrobial prophylaxis for children in the RIVUR trial. 2018; World Journal of Urology. 36(9):1441-7.
- Wang, H. H. S., Gbadegesin, R. A., Foreman, J. W., Nagaraj, S. K., Wigfall, D. R., Wiener, J. S., & Routh, J. C. (2015). Efficacy of antibiotic prophylaxis in children with vesicoureteral reflux: systematic review and meta-analysis. The Journal of urology, 193(3), 963-969.
- Williams, G., & Craig, J. C. (2011). Long‐term antibiotics for preventing recurrent urinary tract infection in children. Cochrane Database of Systematic Reviews, (3).
Evidence tabellen
Evidence table for systematic review of RCT’s and observational studies (intervention studies)
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ledda, 2017 |
Type of study: RCT
Setting: children with a previous history of recurrent UTIs
Country: Italy
Source of funding: commercial |
Inclusion criteria: 12-18 years, recurrent UTIs and previous negative experience or reaction with different antibiotics
Exclusion criteria: any chronic clinical condition or risk factors, immunological diseases, concomitant infections of any nature, blood in the urines, antibiotic or corticosteroid treatment for any reason in the last 6 months, allergy or intolerance to cranberry
N total at baseline: Intervention: 19 Control: 17
Important prognostic factors2: For example age ± SD: I: 15.1 ± 2.4 C:14.3 ± 2.7
Sex: I: 42% M C: 53% M
Groups comparable at baseline? yes |
Oral supplementation: 1 capsule containing 120 mg of the highly-standardized cranberry extract (Anthocran®), corresponding to 36 mg PACs, for 60 consecutive days.
|
Standard management: lifestyle and hygiene advice
|
Length of follow-up: 2 months
Loss-to-follow-up: none
|
1. Recurrent UTI Defined as number of UTIs, mean (SD)
I: 0.32 (0.2) C: 2.3 (1.3) P=0.0001
Defined as symptoms of UTI I: 7/19 (36.8%) C: 13/17 (76.5%) RR: 0.48 (0.25 to 0.92)
|
|
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher,2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Durham, 2015 |
No |
No, only Pubmed searched |
No |
No |
NA |
No |
Unclear |
No |
No, only for systematic review |
|
Hosseini, 2017 |
Yes |
Yes |
No, excluded studies nog described |
Yes |
NA |
Yes |
Yes |
Yes |
No, only for systematic review |
|
Wang, 2015 |
Yes |
Yes |
No, excluded studies nog described |
Yes |
NA |
Yes |
Yes |
Yes |
No |
|
Williams, 2011 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCT’s).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2).
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
|
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ledda, 2017 |
Not described |
Unclear, not described |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely, no loss to follow-up |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematic reviews |
|
|
Lashkar 2018 |
Search only in Medline. Not only focus on prophylaxis. Studies included for prophylaxis also included in Wiliiams or Wang (except 1 RCT among children with VUR: Hari, 2015=B103), no meta-analysis |
|
Sutton 2017 |
Overview of studies about diagnosis, management, imaging and follow-up for UTI |
|
Beyitler 2017 |
No systematic review (probiotic profylaxis) |
|
Schlager 2016 |
No systematic review |
|
Tewary 2015 |
No systematic review |
|
Stein 2015 |
No systematic review |
|
Simoes 2015 |
No systematic review |
|
Schwenger 2015 |
Probiotic therapy for preventing UTI |
|
Larcombe 2015 |
Search date Dec 2013 (Williams 2013 and Nagler 2013 (VUR) included) |
|
Paintsil 2013 |
No systematic review |
|
Jepson 2013 |
Cochrane review: cranberries to prevent UTI. Only 2 studies included among children (Foda, 1995; Schlager, 1999), but not included in meta-analysis because data from pre-crossover period was not available. |
|
Wang 2012 |
No focus on children (cranberries profylaxis) |
|
Nickavar 2011 |
No systematic review |
|
Finnell 2011 |
Antimicrobial prophylaxis to prevent febrile UTI when VUR is found |
|
Dessi 2011 |
Cranberries to prevent UTI |
|
Larcombe 2010 |
Larcombe 2015 is update from this review |
|
Dai 2010 |
Studies also included in Williams, 2011 |
|
Mogelijke RCT’s |
|
|
Palmer 2018 |
Cost-effectiveness of antibiotic prophylaxis |
|
Merrikhi 2018 |
Vitamin D supplementation to prevent recurrent UTI |
|
Gehissari 2018 |
Preventief effect van L-carnitine op littekenvorming |
|
Dlin 2018 |
Herbal medicinal product |
|
Korbel 2017 |
No systematic review |
|
Antachopoulos 2016 |
Crossover trial comparing cotrimoxazole vs second generation cephalosporins |
|
Mattoo 2015 |
Secondary analysis of RIVUR trial in children with VUR |
|
Mathews 2015 |
Secondary analysis of RIVUR trial in children with VUR |
|
Mohseni 2013 |
Included in Hosseini 2017 |
|
Uberos 2012 |
Included in Hosseini 2017 |
|
Salo 2012 |
Included in Durham 2015 |
|
Beetz 2012 |
Non systematic review about management of UTI in the neonate |
|
Afshar 2012 |
Included in Durham 2015 |
|
Perez-Gaxiola 2011 |
Commentary article |
|
Pishi 2011 |
No RCT, 14 children received prophylactic cefdinir |
|
Merguerian 2010 |
Critical appraisal of literature published in the past 5 years |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2019
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze evidence-based richtlijn geeft richting aan risico’s op UWIs bij kinderen en eventuele late gevolgen, diagnostiek, methodes voor het afnemen van een kweek bij UWI en de behandeling ervan specifiek bij kinderen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen met UWIs, zoals.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met UWIs te maken hebben.
- Dr. D. (Dasja) Pajkrt, kinderarts-infectioloog/immunoloog, werkzaam in het AMC te Amsterdam, NVK (voorzitter)
- Dr. Med. F.G. (Fabienne) Ropers, kinderarts, werkzaam in het LUMC te Leiden, NVK
- Dr. A.T. (Sandra) Bernards, arts-microbioloog, werkzaam in het LUMC te Leiden, NVMM
- Dr. A (Anne) Brandts, kinderradiologie fellow, werkzaam in het in het Erasmus MC te Rotterdam, NVvR
- Drs. H.J.R. (Eric) van der Horst, kinderuroloog, werkzaam in het VUmc te Amsterdam, NVU
- Drs. J. (Joop) van den Hoek, kinderuroloog, werkzaam in het Erasmus MC te Rotterdam, NVU
- Dr. Ir. M.A.C. (Maarten) Broeren, laboratoriumspecialist klinische chemie, werkzaam in het Máxima Medisch Centrum te Eindhoven, NVKC
- Drs. S. (Sanne) Klinkhamer, huisarts, NHG
- Dr. V. (Vivian) Bongers, nucleair geneeskundige, werkzaam in het Diakonessenhuis te Utrecht, NVNG
Meelezer
- E. (Eva) Schmidt-Cnossen MSc, projectmanager & Relatiemanager Smiley, Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M.W. (Maya) Keuning, arts-onderzoeker, werkzaam in het AMC te Amsterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bernards |
Arts-microbioloog bij het Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Bongers |
Nucleair geneeskundig Diakonessenhuis Utrecht |
Geen |
Geen |
Geen actie |
|
Brandts |
Fellow Kinderradiologie, Erasmus Medisch Centrum, |
Geen |
Geen |
Geen actie |
|
Broeren |
Laboratoriumspecialist klinische chemie (klinisch chemicus) |
Geen |
Geen |
Geen actie |
|
Hoek |
Uroloog Erasmus MS - Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
Keuning |
Projectondersteuning revisie Richtlijn Urineweginfecties bij kinderen - selectie en analyse |
Arts-onderzoeker Pediatrische infectieziekten AMC - dataverzameling en schrijven |
Deelname ter ontwikkeling eigen competenties en netwerk in het kader van medische |
Geen actie |
|
Klinkhamer |
Deelnemend huisarts (juliusgezondheidscentrum Vleuterweide Utrecht) |
Geen |
Geen |
Geen actie |
|
Pajkrt |
Kinderarts-infectioloog-immunoloog Emma Kinderziekenhuis AMC |
Geen |
Geen |
Geen actie. |
|
Ropers |
Algemeen kinderarts Leids universitair medisch centrum |
Geen |
Geen |
Geen actie |
|
Van der Horst |
Kinderuroloog Vu medisch centrum Amsterdam |
Lid cie. ontwikkeling skillslab Vumc (onbetaald, tot dec 2018) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Stichting Kind en Ziekenhuis af te vaardigen in de klankbordgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. In het licht van de bevindingen van de Kwaliteits & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVK, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NVK, NVNG, NVU, V&VN, NHG, en Stichting Kind en Ziekenhuis via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Gedurende het ontwikkeltraject is afstemming met de NHG gezocht, omdat de herziening van de NHG standaard nagenoeg gelijk liep met deze richtlijn. Van belang was dat er geen discrepanties waren tussen de richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Vanwege een beperkt aantal searches dat kon worden ingezet, is voor een aantal uitgangsvragen besloten geen (nieuwe) search uit te voeren, maar de tekst van de oude richtlijn te behouden. Bij deze uitgangsvragen werd geen nieuwe literatuur verwacht. Er kon voor deze uitgangsvragen geen GRADE beoordeling plaatsvinden, omdat de literatuur niet (her)beoordeeld is.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
