Empirische behandeling antibiotica bij UWI
Uitgangsvraag
Wat is de meest effectieve empirische behandeling met antibiotica van een cystitis/ pyelonefritis bij kinderen?
Aanbeveling
1. De keuze van antibioticum
Behandel een eerste cystitis, na afname van een urinemonster voor kweek, empirisch met nitrofurantoine of fosfomycine (≥ 12 jaar). Op basis van het antibiogram wordt therapie aangepast naar het meest smalle antibioticum.
2. De duur van de behandeling
Behandel een pyelonefritis met amoxicilline/clavulaanzuur of ceftibuten per os gedurende 10 tot 14 dagen. Op basis van het antibiogram wordt therapie aangepast naar het meest smalle antibioticum.
Wanneer orale antibiotica bij aanvang van behandeling niet gegeven kunnen worden, behandel dan eerst intraveneus gedurende 2 tot 4 dagen met een 2e of 3e generatie cefalosporine, gevolgd door orale antibiotica op geleide van het gevoeligheidspatroon.
Behandel cystitis gedurende 2 tot 4 dagen.
Regel, wanneer het kind niet wordt opgenomen, met de ouders of verzorgers een belafspraak voor 24 uur na starten van de behandeling om u ervan te vergewissen dat de behandeling is aangeslagen. Adviseer ouders om contact op te nemen wanneer het kind zieker wordt.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Rationale/ balans tussen de argumenten voor en tegen de interventie
1. De keuze van antibioticum
Sinds de vorige richtlijn zijn geen relevante studies gepubliceerd, waarin verschillende antibiotica regimes met elkaar zijn vergeleken.
Voor de keuze van de empirische behandeling dient men rekening te houden met de lokale resistentiegegevens. Voor de gerichte behandeling is het gevoeligheidspatroon van de verwekker leidend.
De gevoeligheidspatronen van urinewegisolaten in Nederland zijn in te zien op de website van het RIVM (www.isis-web.nl). De vermelde resistentiegetallen zijn hoogstwaarschijnlijk hoger dan in werkelijkheid het geval is. Dit komt omdat lang niet altijd een kweek wordt verricht bij een eerste episode van UWI en pas bij falen van de behandeling. E. coli is nog steeds veruit de meest voorkomende verwekker van UWIs, ook bij kinderen.
Cystitis
Nitrofurantoine en fosfomycine tonen geringe resistentiepercentages (2016: 0.2 % respectievelijk 0.8 % en 2017: 0.2 % respectievelijk 0.6 %) bij E. coli. Beide middelen zijn geschikt voor de empirische behandeling van cystitis. Fosfomycine is niet geïndiceerd voor kinderen jonger dan 12 jaar.
Nitrofurantoine is ook geschikt voor de behandeling van enterokokken, maar onwerkzaam tegen Proteus soorten. Fosfomycine is niet werkzaam tegen enterokokken en bij Proteus en Klebsiella soorten moet rekening gehouden worden met resistentie.
Pyelonefritis
De op de ISIS-web vermelde resistentiepercentages van amoxicilline/clavulaanzuur zijn hoog, ca. een kwart van E. coli isolaten zou resistent zijn. De praktijk laat echter zien dat amoxicilline/clavulaanzuur nog steeds een bruikbaar middel is voor de behandeling van pyelonefritis bij kinderen, mede omdat het middel renaal geklaard wordt en daardoor hoge spiegels bereikt in de urine.
Ceftibuten werd in de richtlijn van 2010 genoemd als alternatief voor amoxicilline/ clavulaanzuur. Dit is een oraal cefalosporine, dat qua werkzaamheid tussen die van 2e en 3e generatie cefalosporines in zit. Het middel kan gebruikt worden voor de orale behandeling van een pyelonefritis. Andere orale cefalosporines zoals cefuroximaxetil en cefalexin zijn alleen geschikt voor de behandeling van ongecompliceerde UWIs.
Voor de empirische intraveneuze behandeling van een pyelonefritis komen amoxicilline/clavulaanzuur, 2e (cefuroxim) of 3e generatie cefalosporines (cefotaxim of ceftriaxon) in aanmerking. Bij ernstig zieke kinderen is toevoeging van éénmalig gentamicine in de empirische behandeling gewenst. Ondanks dat er geen studies zijn naar empirisch cotrimoxazol of ciprofloxacine gebruik voor UWIs bij kinderen, zijn beide middelen bruikbaar ook omdat deze middelen oraal gegeven kunnen worden.
Onder druk van het gebruik van antibiotica worden bacteriën resistent. De in deze richtlijn aanbevolen antibiotica kunnen in de komende periode tot aan de volgende revisie onbruikbaar worden in de empirische behandeling. Kweken van urinemonsters is van groot belang om de gevoeligheidspatronen op de voet te kunnen volgen.
2. De duur van de behandeling
Pyelonefritis
De literatuur, die sinds de vorige richtlijn is verschenen over de duur van de intraveneuze behandeling van pyelonefritis, geeft geen aanleiding het advies van 2010 aan te passen. Orale behandeling met amoxicilline/clavulaanzuur gedurende 10 dagen bleek even goed als 3 dagen intraveneuze behandeling met ceftriaxon, gevolgd door 7 dagen amoxicilline/clavulaanzuur. Ook bij ceftibuten was er geen verschil tussen 14 dagen volledig orale behandeling met 3 dagen ceftriaxon gevolgd door 11 dagen ceftibuten. Pyelonefritis kan dus met oraal amoxicilline/clavulaanzuur of ceftibuten behandeld worden zonder voorafgaande intraveneuze behandeling.
Cystitis
In de vorige richtlijn werden studies beschreven, die een kortdurende behandeling 2 tot 4 dagen vergeleken met behandeling gedurende 10 dagen. Sindsdien zijn studies gedaan naar het verschil tussen éénmalige dosering en 10 dagen behandeling. Alhoewel geen significant verschil werd gevonden tussen beide regimes, waren de aantallen onderzochte patiënten in alle studies gering en leek er een tendens naar vaker persisterende bacteriurie in de groepen, die één dosis kregen.
Een review uit 2012 over de vergelijking tussen 3 tot 7 dagen en 10 tot 14 dagen omvatte geen recente studies en levert geen aanvullende informatie op ten opzichte van de richtlijn uit 2010. Het advies om cystitis 2 tot 4 dagen te behandelen blijft gehandhaafd.
Onderbouwing
Achtergrond
In de huidige richtlijn uit 2010 wordt een aantal antibiotica vermeld, geschikt voor de behandeling van UWIs bij kinderen. Sinds 2010 is de resistentie tegen antibiotica toegenomen. De vraag is of het huidige beleid ten aanzien van de empirische behandeling van UWIs bij kinderen nog voldoet.
Conclusies / Summary of Findings
1. Pyelonefritis
A. Orale therapie versus intraveneuze therapie gevolgd door orale therapie bij pyelonefritis
|
Laag GRADE |
Orale therapie lijkt even effectief als intraveneuze gevolgd door orale therapie als het gaat om microbiologische genezing bij kinderen met acute pyelonefritis.
Bronnen: (Strohmeier, 2014) |
|
Redelijk GRADE |
Orale therapie is waarschijnlijk even effectief als intraveneuze gevolgd door orale therapie als het gaat om klinische genezing bij kinderen met acute pyelonefritis.
Bronnen: (Strohmeier, 2014) |
|
Zeer laag GRADE |
We zijn onzeker over het effect van orale therapie op terugkeer van UWIs vergeleken met intraveneuze therapie bij kinderen met acute pyelonefritis.
Bronnen: (Strohmeier, 2014) |
B. Kortdurende (3-4 dagen) intraveneuze gevolgd door orale therapie versus langdurende (7 tot 14 dagen) intraveneuze therapie bij pyelonefritis
|
Laag GRADE |
Kortdurende (3 tot 4 dagen) intraveneuze gevolgd door orale therapie lijkt even effectief als langdurende (7 tot 14 dagen) intraveneuze therapie als het gaat om microbiologische genezing bij kinderen met acute pyelonefritis.
Bronnen: (Strohmeier, 2014) |
|
Redelijk GRADE |
Kortdurende (3 tot 4 dagen) intraveneuze gevolgd door orale therapie is waarschijnlijk even effectief als langdurende (7 tot 14 dagen) intraveneuze therapie als het gaat om terugkeer van UWIs bij kinderen met acute pyelonefritis.
Bronnen: (Strohmeier, 2014) |
C. Verschillende antibiotica bij pyelonefritis
|
Laag GRADE |
Derde generatie cefalosporinen lijken even effectief als andere antibiotica als het gaat om microbiologische en klinische genezing en terugkeer van UWIs bij kinderen met pyelonefritis. We zijn onzeker over het effect van andere antibiotica.
Bronnen: (Strohmeier, 2014) |
2. Cystitis
A. Eenmalige dosis versus kortdurende (3-7 dagen) behandeling bij cystitis
|
Zeer laag GRADE |
We zijn onzeker over het effect van een eenmalige dosis versus kortdurende (3 tot dagen) behandeling op microbiologische genezing en recidief bij kinderen met cystitis.
Bronnen: (Fitzgerald, 2012) |
B. Eenmalige dosis versus langdurende (10 dagen) behandeling bij cystitis
|
Zeer laag GRADE |
We zijn onzeker over het effect van een conventionele 10-daagse antibiotische behandeling versus een eenmalige dosis antibiotica op persisterende bacteriurie bij kinderen met cystitis.
Bronnen: (Fitzgerald, 2012) |
|
Zeer laag GRADE |
We zijn onzeker over het effect van een conventionele 10-daagse antibiotische behandeling versus een eenmalige dosis antibiotica op klinische genezing en recidief bij kinderen met cystitis.
Bronnen: (Fitzgerald, 2012) |
C. Kortdurende (3 tot 7 dagen) versus langdurende (10 tot 14 dagen) antibiotica bij cystitis
|
Zeer laag GRADE |
We zijn onzeker over het effect van een kortdurende (3 tot 7 dagen) behandeling versus langdurende behandeling op microbiologische en klinische genezing en recidief bij kinderen met cystitis.
Bronnen: (Fitzgerald, 2012) |
Samenvatting literatuur
Beschrijving studies
1. Pyelonefritis
Strohmeijer (2014) evalueerde de voordelen en nadelen van antibiotica voor het behandelen van kinderen met acute pyelonefritis, met betrekking tot de soorten antibiotica, verschillende doseringen, verschillende duur van de behandeling, en verschillende manieren van toediening. Er werd gezocht in het Cochrane Renal Group’s Specialised Register, CENTRAL, Medline, Embase, referentie lijsten van artikelen en conferentie verslagen tot april 2014. Gerandomiseerde en quasi-gerandomiseerde gecontroleerde trials werden geïncludeerd die verschillende antibiotica met elkaar vergeleken, manier van toediening, frequenties of duur van behandeling bij kinderen van 0 tot 18 jaar met bewezen UWI en acute pyelonefritis. Er werden 27 studies geïncludeerd, met in totaal 4452 kinderen. Voor deze literatuuranalyse werden alleen de resultaten van de studies gebruikt die verschillende antibiotica vergeleken of verschillende manieren van toediening (n=20). Verschillende korte en lange termijn uitkomsten werden meegenomen, waaronder persisterende symptomen, persistente bacteriurie en terugkerende UWI.
Vazouras (2018) deed een systematische review naar antibiotica voor febriele UWIs (acute pyelonefritis) in pediatrische klinische trials en voerde een meta-analyse uit naar de geobserveerde genezing (subgroep analyses uitgevoerd voor microbiologische en klinische genezing) en falen van behandeling. Er werd gezocht in Medline, Embase en Cochrane centrale database tussen 1990 en 2016. RCT’s die data over klinische en/of microbiologische effectiviteit van antibiotica of andere soorten van antibacteriële of anti-inflammatoire middelen bij kinderen met een acute febriele UWI. Er werden 30 studies geïncludeerd in de analyse, met in totaal 3913 kinderen van 1 week tot 18 jaar oud, 59% van deze totale groep was meisje. De genezing werd in 24 studies gerapporteerd. Er werden 10 verschillende intraveneuze en 12 verschillende orale antibiotica gebruikt in de studies. Penicilline, cefalosporine en aminoglycoside waren de meest gebruikte antibiotica.
Munir (2018) vergeleek de effectiviteit van orale fosfomycine met intraveneuze ceftriaxon voor behandeling UWI bij kinderen tot 16 jaar (n=390). Kinderen met een eerste UWI werden gerandomiseerd naar een groep die fosfomycine kreeg (N=195, gemiddelde leeftijd 9,4; SD 2,4 jaar) en een groep die ceftriaxon kreeg (N=195, gemiddelde leeftijd 9,3; SD 2,2 jaar). Als uitkomstmaat werd een negatieve urinekweek na 5 dagen gebruikt.
2. Cystitis
Fitzgerald (2012) evalueerde de voordelen en nadelen van antibiotica voor behandeling van lagere UWIs (cystitis) bij kinderen. Er werd gekeken naar soort antibiotica, duur en dosering en wijze van toediening. Er werd gezocht in het Renal Group’s Specialised Register, CENTRAL, Medline en Embase tot april 2012. Gerandomiseerde en quasi-gerandomiseerde gecontroleerde trials werden geïncludeerd die een antibiotica behandeling onderzochten voor bacteriologisch bewezen, symptomatische, lagere UWI bij kinderen van 0 tot 18 jaar in de eerstelijn gezondheidszorg setting. Er werden 16 studies geïncludeerd, met in totaal 1116 kinderen. Voor deze literatuuranalyse werden alleen de resultaten van de studies gebruikt die verschillende antibiotica vergeleken of verschillende manieren van toediening. Verschillende korte en lange termijn uitkomsten werden meegenomen, waaronder persisterende symptomen, persisterende bacteriurie, terugkerende symptomatische UWI en ontwikkeling van resistentie.
Resultaten
1. Pyelonefritis
A. Orale therapie versus intraveneuze therapie gevolgd door orale therapie bij pyelonefritis
1. Microbiologische genezing
Op basis van 1 studie vond Strohmeier (2014) geen verschil in effect op het aantal aanhoudende UWIs na 72 uur na start van de behandeling van orale therapie versus intraveneuze gevolgd door orale therapie (RR 1,10; 95% BI 0,07 tot 17,41).
In de RCT van Munir (2018) had de groep met orale therapie (fosfomycine) minder vaak een persisterende UWI na 5 dagen (27,7%) vergeleken met de groep die intraveneuze therapie (cefriaxon) kreeg (40%). Dit resulteerde in een RR van 0,69 (95% BI 0,52 tot 0,92) ten gunste van de fosfomycine groep. Echter, in de ceftriaxon groep werd de intraveneuze therapie niet gevolgd door orale therapie zoals in de vergelijking van Strohmeier.
2. Klinische genezing
Op basis van 2 studies vond Strohmeier (2014) geen verschil in effect op de tijd tot verdwijnen van koorts van orale therapie versus intraveneuze gevolgd door orale therapie (gepoold gemiddeld verschil 2,05; 95% BI -0,84 tot 4,94).
3. Recidief
Op basis van 1 studie vond Strohmeier (2014) geen verschil in effect op het aantal terugkerende UWIs binnen 6 maanden uur van orale therapie versus intraveneuze gevolgd door orale therapie (RR totale UWI 0,65; 95% BI 0,28 tot 1,51; RR symptomatische UWI 0,67; 95% BI 0,27 tot 1,67).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat microbiologische genezing is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (incomplete rapportage van uitkomsten) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat klinische genezing is met 1 niveau verlaagd gezien de brede betrouwbaarheidsintervallen door de grote standaarddeviaties rondom de gemiddelde duur van koorts (imprecisie).
De bewijskracht voor de uitkomstmaat recidief is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling en incomplete rapportage van uitkomsten) en het geringe aantal patiënten (imprecisie).
B. Kortdurende (3-4 dagen) intraveneuze gevolgd door orale therapie versus langdurende (7 tot 14 dagen) intraveneuze therapie bij pyelonefritis
1. Microbiologische genezing
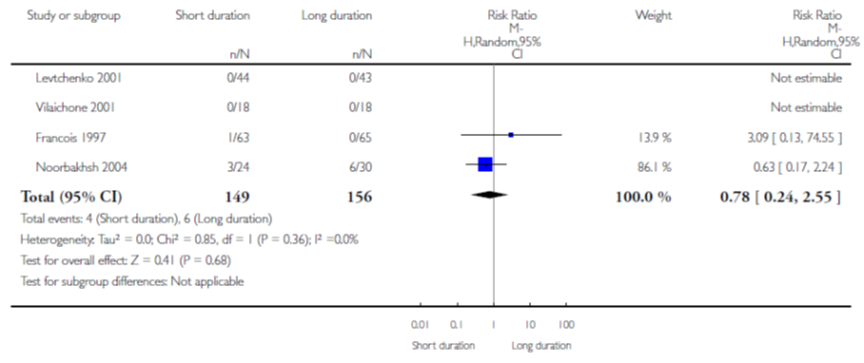
Op basis van 4 studies (waarbij van 2 studies geen data gepoold kon worden) vond Strohmeier geen verschil in effect op persisterende bacteriurie na behandeling van kortdurende intraveneuze gevolgd door orale therapie versus langdurende intraveneuze therapie (gepoold RR 0,78; 95% BI 0,24 tot 2,55) (figuur 1).
Figuur 1 Persisterende bacteriurie van kortdurende versus langdurende intraveneuze therapie
2. Klinische genezing
Strohmeier rapporteerde geen studies met als uitkomstmaat klinische genezing.
3. Recidief
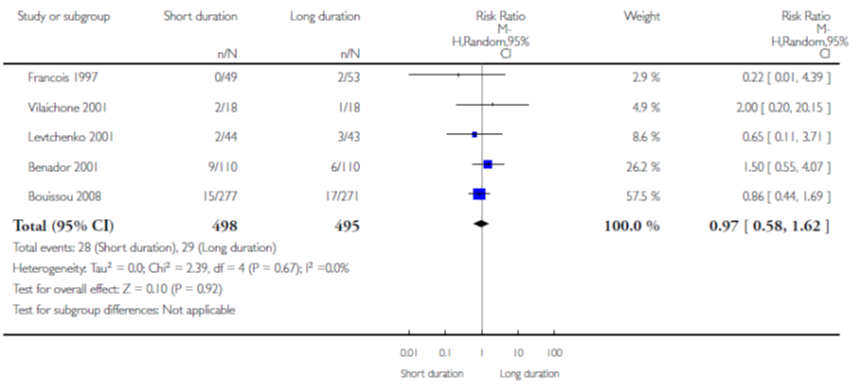
Op basis van 5 studies vond Strohmeier geen verschil in effect op het aantal terugkerende UWIs binnen 6 maanden van kortdurende intraveneuze gevolgd door orale therapie versus langdurende intraveneuze therapie (gepoold RR 0,97; 95% BI 0,58 tot 1,62) (figuur 2).
Figuur 2 Terugkerende UWIs van kortdurende versus langdurende intraveneuze therapie
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat microbiologische genezing is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke of ontoereikende toewijzing van behandeling) en het geringe aantal patiënten en events (imprecisie).
De bewijskracht voor de uitkomstmaat recidief is met 1 niveau verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke of ontoereikende toewijzing van behandeling).
C. Verschillende antibiotica bij pyelonefritis
Strohmeier (2014) includeerde 7 studies die verschillende antibiotica met elkaar vergeleken. Geen van de onderzochte antibiotica had een voordeel bovenop het antibiotica waarmee het vergeleken werd. Vier studies vergeleken cefalosporine met amoxicilline/clavulaanzuur of TMP/SMX.
Vazouras (2018) extraheerde het genezingspercentage uit 24 studies, waarbij het genezingspercentage varieerde tussen 80 en 100% met een gemiddelde schatting van 95,3% (95% BI 82,8 tot 100%). Er was grote heterogeniteit tussen de studies (I2 76.7%). Daarom werden subgroepanalyses uitgevoerd voor type genezing (klinisch versus microbiologisch) en de timing van het meten van genezing (tijdens behandeling of aan het einde).
1. Microbiologische genezing
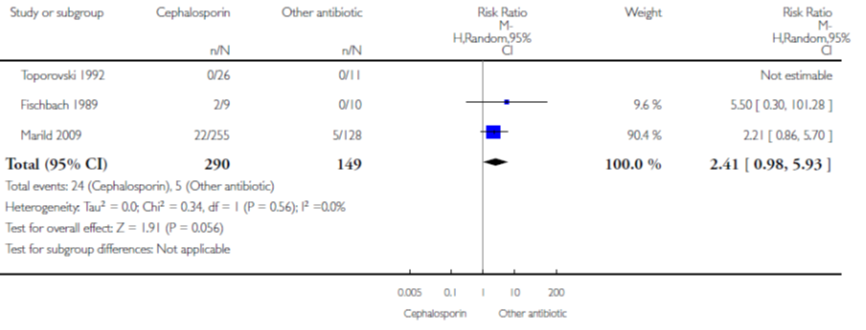
In een meta-analyse van 3 studies (waarbij van 1 studie geen data gepoold kon worden) vond Strohmeijer geen statistisch significant verschil op het aantal persisterende bacteriurie van derde generatie cefalosporine versus andere antibiotica (gepoold RR 2,41; 95% BI 0,98 tot 5,93) (figuur 3).
Figuur 3 Persisterende bacteriurie van cefalosporine versus andere antibiotica
Vazouras (2018) vond een microbiologisch genezingspercentage van 97.3% (95% BI 98,7 tot 98,6) van alle antibiotica, gemeten in de intention to treat populatie. Dit waren echter maar 3 studies (Carpetis, 2001; Francois, 1997; Marild, 2009).
2. Klinische genezing
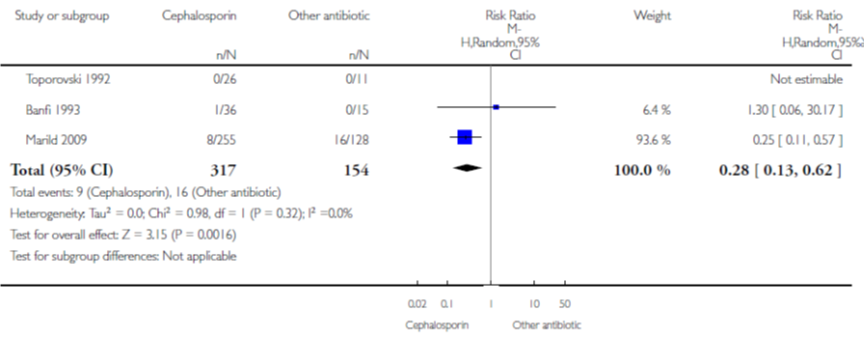
In een meta-analyse van 3 studies (waarbij van 1 studie geen data gepoold kon worden) gaven orale ceftibuten een betere klinische genezing dan TMP/SMX (gepoold RR 0,28; 95% BI 0,13 tot 0,62) (figuur 4). Echter, 1 grote studie (Marild, 2009) droeg voor het grootste gedeelte bij aan de weging van de analyse. Marild definieerde klinische genezing als het verdwijnen van alle symptomen behorende bij de infectie binnen 10 dagen. Het is mogelijk dat er een cross-over was van symptomen behorende bij de infectie en symptomen door bijwerkingen van de medicatie zoals braken. Verder toonde de studie geen verschil in bacteriologische eliminatie ondanks dat 15% van de pathogenen verantwoordelijk voor de infectie resistent zijn tegen TMP/SMX vergeleken met 2% dat resistent was tegen ceftibuten.
Figuur 4 Persisterende symptomen van cefalosporine versus andere antibiotica
In de review van Vazouras (2018) was het klinische genezingspercentage 96,5% (91,1% BI tot 96,6), gemeten in de intention to treat populatie. Dit waren echter maar 3 studies (Carpetis, 2001; Francois, 1997; Marild, 2009).
3. Recidief
In een meta-analyse van 4 studies (waarbij van 2 studies geen data gepoold kon worden) vond Strohmeijer geen verschil op het aantal terugkerende UWIs na de behandeling van derde generatie cefalosporine versus andere antibiotica (gepoold RR 1,23; 95% BI 0,32 tot 4,74) (figuur 5).
Figuur 5 Terugkerende UWIs van cefalosprine versus andere antibiotica
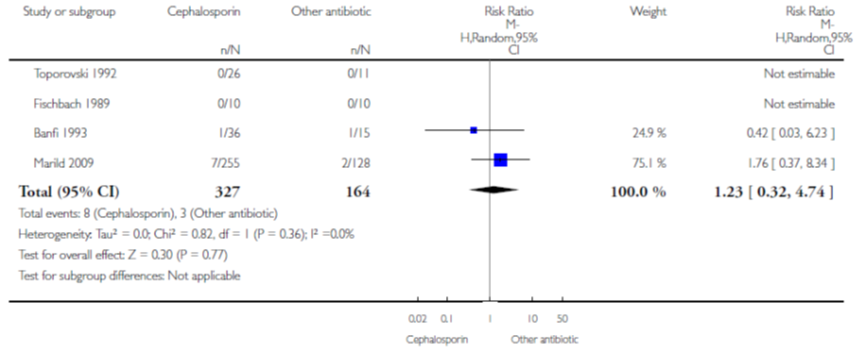
Bij 3,9% van kinderen (118/3002) met een pyelonefritis vond Vazouras een falende behandeling. Daarvan hadden 20 patiënten (16,9%) aanhoudende tekenen van een UWI tijdens de behandeling en 33 patiënten (28%) terugkerende UWI symptomen na de behandeling. Verder hadden 135 kinderen (4,5%) een microbiologisch gefaalde behandeling. Daarvan hadden 9 patiënten een aanhoudende positieve urinekweek en 77 patiënten (57%) een recidief van een uropathogeen. Onder de kinderen met een microbiologisch gefaalde behandeling werden bij 17,8% (24/135) pathogenen met resistentie tegen de gebruikte antibiotica gevonden en 29,6% (40/135) was gevoelig voor de gebruikte antibiotica. Resistentiegegevens ontbraken bij 51,1% (69/135) van de patiënten met microbiologisch falen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat microbiologische genezing is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling in verschillende studies) en het geringe aantal patiënten en events (imprecisie).
De bewijskracht voor de uitkomstmaat klinische genezing is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling in verschillende studies) en inconsistentie (meta-analyse wordt overheerst door enkele trial en inconsistentie met bacteriologische resultaten).
De bewijskracht voor de uitkomstmaat recidief is met 2 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling in verschillende studies) het geringe aantal patiënten en events (imprecisie).
2. Cystitis
A. Eenmalige dosis versus kortdurende (3-7 dagen) behandeling bij cystitis
1. Microbiologische genezing
Op basis van 2 studies vond Fitzgerald geen verschil in effect op persisterende bacteriurie na behandeling met een eenmalige dosis versus kortdurende behandeling (gepoold RR 1,30; 95% BI 0,65 tot 2,62).
2. Klinische genezing
Fitzgerald rapporteerde geen studies met als uitkomstmaat klinische genezing.
3. Recidief
Op basis van 2 studies vond Fitzgerald geen verschil in effect op het aantal terugkerende UWIs na behandeling met een eenmalige dosis versus kortdurende behandeling (gepoold RR 1.50; 95% BI 0,43 tot 5,26). In de groep met een eenmalige dosis antibiotica had 15% (11/75) een terugkerende UWI en in de groep met kortdurende behandeling 10% (7/70).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat microbiologische genezing is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling en blindering) en het geringe aantal patiënten en brede betrouwbaarheidsintervallen (imprecisie).
De bewijskracht voor de uitkomstmaat recidief is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling en blindering) en het geringe aantal patiënten en brede betrouwbaarheidsintervallen (imprecisie).
B. Eenmalige dosis versus langdurende (10 dagen) behandeling bij cystitis
1. Microbiologische genezing
Een conventionele 10-daagse antibiotische behandeling leidde tot statistisch significant meer kinderen zonder persisterende bacteriurie vergeleken met een eenmalige dosis antibiotica (gepoold RR 2,01; 95% BI 1,06 tot 3.80). Kinderen die een eenmalige dosis ontvingen hadden 2.01 hogere kans op een persisterende bacteriurie dan kinderen die een conventionele 10-daagse antibiotische behandeling ondergingen (figuur 6). De ondergrens van het betrouwbaarheidsinterval overschrijdt echter de default grens voor klinische besluitvorming. Een subgroep analyse voor type antibiotica (amoxicilline versus andere antibiotica) liet geen verschil zien.
Figuur 6 Persisterende bacteriurie eenmalige dosis versus 10-daagse behandeling
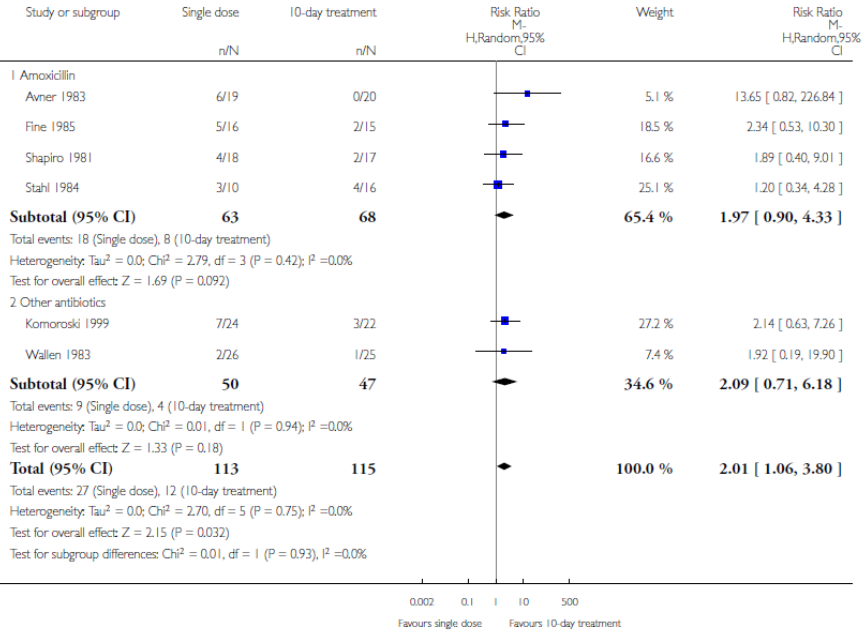
2. Klinische genezing
Op basis van 1 studie vond Fitzgerald geen verschil in effect op persisterende symptomen na behandeling met een eenmalige dosis antibiotica versus conventionele 10-daagse antibiotica (RR 0,29; 95% BI 0,03 tot 2,50).
3. Herhaling
Op basis van 2 studies vond Fitzgerald geen verschil in effect op het aantal terugkerende symptomatische UWIs na behandeling met een eenmalige dosis antibiotica versus conventionele 10-daagse antibiotica (gepoold RR 1,38; 95% BI 0,55 tot 3,50). In de groep met een eenmalige dosis antibiotica had 22% (9/41) een terugkerende symptomatische UWI en in de groep met 10-daagse antibiotica 16% (6/38).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten microbiologische en klinische genezing is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling, randomisatie en blindering) en het geringe aantal patiënten en overlap van grens klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat recidief is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias ten gevolge van onduidelijke toewijzing van behandeling en ITT-analyse) en het geringe aantal patiënten en brede betrouwbaarheidsintervallen (imprecisie).
C. Kortdurende (3 tot 7 dagen) versus langdurende (10 tot 14 dagen) antibiotica bij cystitis
1. Microbiologische genezing
Op basis van 3 studies vond Fitzgerald geen verschil in effect op persisterende bacteriurie na behandeling met een kortdurende versus langdurende behandeling met antibiotica (RR 1,09; 95% BI 0,67 tot 1,76) (figuur 7).
Figuur 7 Persisterende bacteriurie van kortdurende versus langdurende behandeling
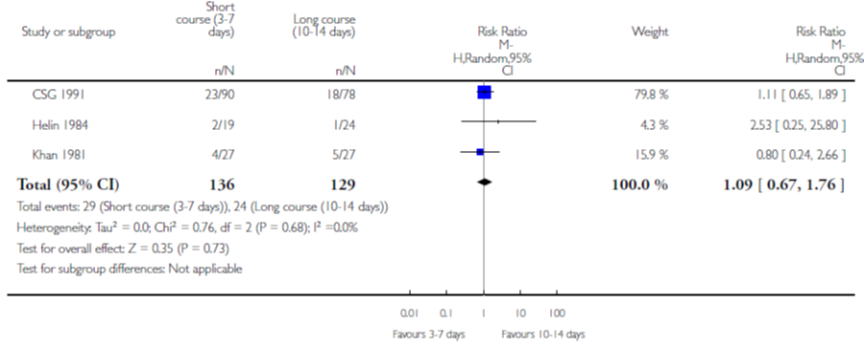
2. Klinische genezing
Fitzgerald rapporteerde geen studies met als uitkomstmaat klinische genezing.
3. Recidief
Op basis van 4 studies vond Fitzgerald geen verschil in effect op het aantal terugkerende symptomatische UWIs na behandeling met een kortdurende versus langdurende behandeling met antibiotica (RR 1,25; 95% BI 0,74 tot 2,13). In de groep met een 3-daagse behandeling had 15% (25/163) een terugkerende symptomatische UWI en in de groep met 10-daagse behandeling 13% (21/165).
Figuur 8 Terugkerende symptomatische UWIs van kortdurende versus langdurende behandeling
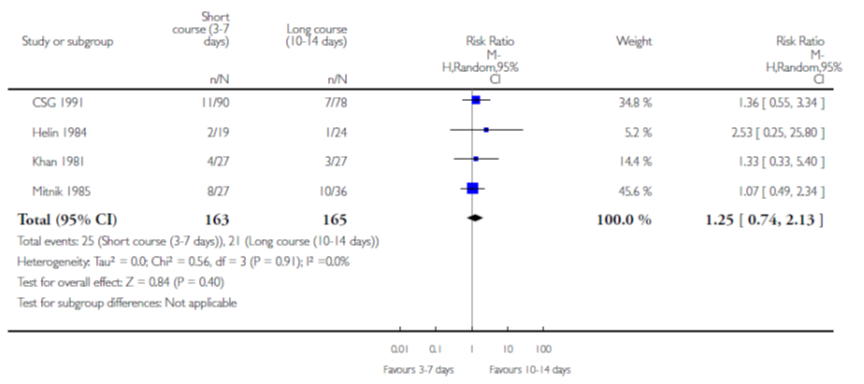
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten microbiologische genezing en herhaling is met 3 niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias Ten gevolge van onduidelijke randomisering, blindering en toewijzing van behandeling) en het geringe aantal patiënten en brede betrouwbaarheidsintervallen (imprecisie).
D. Verschillende antibiotica bij cystitis
In de systematische review van Fitzgerald (2012) werden verschillende antibiotica met elkaar vergeleken, maar de resultaten zijn gebaseerd op weinig evidence en de vergelijkingen (netlimicine, trimetoprim en sulfamethoxazole) zijn niet meer relevant voor de huidige klinische praktijk. Daarom worden de verschillende antibiotica bij cystitis niet nader uitgewerkt.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van een empirische behandeling met antibiotica vergeleken met een controle of alternatief antibioticum bij kinderen met een UWI?
P: kinderen met een cystitis/pyelonefritis;
I: empirische behandeling met antibiotica;
C: controle/alternatief antibioticum (nitrofurantoïne, trimethoprim, amoxicilline/ clavulaanzuur, augmentin, 1e generatie cefalosporine);
O: microbiologische genezing (microbiological cure), klinische genezing (clinical cure), herhaling (recurrence).
Relevante uitkomstmaten
De werkgroep achtte microbiologische genezing, klinische genezing en herhaling van een UWI voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt: er is sprake van microbiologische genezing als er geen persisterende bacteriurie na de behandeling is, er is sprake van klinische genezing als er geen terugkerende symptomen zijn van UWI en recidief gaat om terugkerende UWIs met hetzelfde micro-organisme.
De werkgroep definieerde vooraf geen klinisch (patiënt) relevant verschil. Daarom wordt de GRADE default grens aangehouden van 25% risicoverschil voor dichotome uitkomstmaten (grenzen bij RR=0,75 en RR=1,25).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 21 november 2018 met relevante zoektermen gezocht naar systematische reviews (SRs) en randomized controlled trials (RCT’s) die de effectiviteit van een empirische behandeling met antibiotica onderzochten en een vergelijking rapporteerden van 1) soort antibiotica, 2) duur/frequentie behandeling en 3) wijze van toediening (oraal vs intraveneus), gepubliceerd vanaf 2010.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 285 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: SRs en RCT’s die een empirische behandeling met antibiotica (soort, duur en wijze van toediening) vergeleken met een controle of alternatief antibioticum bij kinderen met een UWI, en ten minste één van de volgende uitkomstmaten rapporteerden: microbiologische genezing (microbiological cure), klinische genezing (clinical cure) en recidief (recurrence).
Op basis van titel en abstract werden in eerste instantie 20 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 16 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd.
Resultaten
Drie systematische reviews en 1 aanvullende RCT zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Fitzgerald, A., Mori, R., Lakhanpaul, M., & Tullus, K. (2012). Antibiotics for treating lower urinary tract infection in children. Cochrane Database of Systematic Reviews, (8).
- Strohmeier, Y., Hodson, E. M., Willis, N. S., Webster, A. C., & Craig, J. C. (2014). Antibiotics for acute pyelonephritis in children. Cochrane Database of Systematic Reviews, (7).
- Vazouras, K., Basmaci, R., Bielicki, J., Folgori, L., Zaoutis, T., Sharland, M., & Hsia, Y. (2018). Antibiotics and cure rates in childhood febrile urinary tract infections in clinical trials: a systematic review and meta-analysis. Drugs, 1-12.
Evidence tabellen
Evidence table for systematic review of RCT’s and observational studies (intervention studies)
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Munir, 2018 |
Type of study: RCT
Setting: Department pediatrics
Country: Pakistan
Source of funding: not reported |
Inclusion criteria: UTI on urine culture, age 5-16 yrs.
Exclusion criteria: history of intake of any type of antibiotic in the last week.
N total at baseline: Intervention: 195 Control: 195
Important prognostic factors: age ± SD: I: 9.4±2.4 yrs C:9.3±2.2 yrs
Sex: I: 62% M C: 68% M
Groups comparable at baseline? Yes |
Fosfomycin (oral), standard dose of the drug according to international protocols
|
Ceftriaxon (iv), standard dose of the drug according to international protocols
|
Length of follow-up: 5 days
Loss-to-follow-up: 0
|
1. Microbiological cure Defined as positive urine culture after 5 days, n/N (%) I: 54/195 (27.7%) C: 78/195 (40.0%) RR: 0.69 (95% CI 0.52 to 0.92) P=0.01
|
|
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
|
Appropriate and clearly focused question?1 |
Comprehensive and systematic literature search?2
|
Description of included and excluded studies?3
|
Description of relevant characteristics of included studies?4 |
Appropriate adjustment for potential confounders in observational studies?5 |
Assessment of scientific quality of included studies?6
|
Enough similarities between studies to make combining them reasonable?7 |
Potential risk of publication bias taken into account?8
|
Potential conflicts of interest reported?9 |
|
First author, year |
Yes/no/unclear |
Yes/no/unclear |
Yes/no/unclear |
Yes/no/unclear |
Yes/no/unclear/NA |
Yes/no/unclear |
Yes/no/unclear |
Yes/no/unclear |
Yes/no/unclear |
|
Fitzgerald, 2012 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Yes |
|
Strohmeijer, 2014 |
Yes |
Yes |
No, excluded studies not described with reasons |
Yes |
NA |
Yes |
Yes |
Yes |
No, only for the SR |
|
Vazouras, 2018 |
Yes |
Yes |
No, excluded studies not described with reasons |
Yes, in appendix |
NA |
Yes |
Yes |
No |
No, only for the SR |
-
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCT’s).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematische reviews |
|
|
Vazouras 2018 |
SR of effect of antimicrobials on observed cure rates (pyelonefritis) |
|
Lashkar 2018 |
No meta-analysis of antibiotics performed (and only searched in Medline) |
|
Jansaker 2018 |
Integrated literature review of efect of Mecillinam |
|
Sutton 2017 |
No meta-analysis (management 1 of 4 topics searched) |
|
Pinart 2017 |
Vergelijking verschillende pivmecillinam doseringen |
|
Fitzgerald 2012 |
Benefits and harm of antibiotics (cystitis) |
|
Seupaul 2010 |
Commentary op Cochrane Review Hodson 2009 |
|
Mathew 2010 |
SR of effect antibiotic prophylaxis on recurrence, renal scarring, long term complications |
|
Larcombe 2010 |
Old SR: included Cochrane review Hodson 2007 (updated by Strohmeijer, 2014) |
|
Mogelijke RCT's |
|
|
Munir 2018 |
RCT: Fosfomycin vs cetriaxone (n=390 children) |
|
Madhi 2018 |
Observational study of antibiotic treatment (no randomization) |
|
Daniel 2018 |
Timing: RCT of 7 vs 10 days cefuroxime |
|
Lewis-de Los Angeles, 2017 |
Retrospective study of trends in duration of intravenous antibiotics |
|
Schroeder 2016 |
Retrospective cohort study about predictors of duration |
|
Salomonsson 2016 |
Retrospective study about effective oral antibiotic treatment (no randomization) |
|
Uberos 2012 |
Cranbarry syrup vs trimethoprim. Randomization? |
|
Bocquet 2012 |
Included in SR Strohmeijer. RCT: oral cefixime vs intravenous ceftriaxone (n=171 children). O=renal scarring |
|
Bocquet 2012 |
Same article as B155 |
|
Seupaul 2010 |
Same article as A79 |
|
Brady 2010 |
Retrospective study of short vs long duration intravenous antibiotic therapy |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2019
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze evidence-based richtlijn geeft richting aan risico’s op UWIs bij kinderen en eventuele late gevolgen, diagnostiek, methodes voor het afnemen van een kweek bij UWI en de behandeling ervan specifiek bij kinderen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen met UWIs, zoals.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met UWIs te maken hebben.
- Dr. D. (Dasja) Pajkrt, kinderarts-infectioloog/immunoloog, werkzaam in het AMC te Amsterdam, NVK (voorzitter)
- Dr. Med. F.G. (Fabienne) Ropers, kinderarts, werkzaam in het LUMC te Leiden, NVK
- Dr. A.T. (Sandra) Bernards, arts-microbioloog, werkzaam in het LUMC te Leiden, NVMM
- Dr. A (Anne) Brandts, kinderradiologie fellow, werkzaam in het in het Erasmus MC te Rotterdam, NVvR
- Drs. H.J.R. (Eric) van der Horst, kinderuroloog, werkzaam in het VUmc te Amsterdam, NVU
- Drs. J. (Joop) van den Hoek, kinderuroloog, werkzaam in het Erasmus MC te Rotterdam, NVU
- Dr. Ir. M.A.C. (Maarten) Broeren, laboratoriumspecialist klinische chemie, werkzaam in het Máxima Medisch Centrum te Eindhoven, NVKC
- Drs. S. (Sanne) Klinkhamer, huisarts, NHG
- Dr. V. (Vivian) Bongers, nucleair geneeskundige, werkzaam in het Diakonessenhuis te Utrecht, NVNG
Meelezer
- E. (Eva) Schmidt-Cnossen MSc, projectmanager & Relatiemanager Smiley, Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M.W. (Maya) Keuning, arts-onderzoeker, werkzaam in het AMC te Amsterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bernards |
Arts-microbioloog bij het Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Bongers |
Nucleair geneeskundig Diakonessenhuis Utrecht |
Geen |
Geen |
Geen actie |
|
Brandts |
Fellow Kinderradiologie, Erasmus Medisch Centrum, |
Geen |
Geen |
Geen actie |
|
Broeren |
Laboratoriumspecialist klinische chemie (klinisch chemicus) |
Geen |
Geen |
Geen actie |
|
Hoek |
Uroloog Erasmus MS - Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
Keuning |
Projectondersteuning revisie Richtlijn Urineweginfecties bij kinderen - selectie en analyse |
Arts-onderzoeker Pediatrische infectieziekten AMC - dataverzameling en schrijven |
Deelname ter ontwikkeling eigen competenties en netwerk in het kader van medische |
Geen actie |
|
Klinkhamer |
Deelnemend huisarts (juliusgezondheidscentrum Vleuterweide Utrecht) |
Geen |
Geen |
Geen actie |
|
Pajkrt |
Kinderarts-infectioloog-immunoloog Emma Kinderziekenhuis AMC |
Geen |
Geen |
Geen actie. |
|
Ropers |
Algemeen kinderarts Leids universitair medisch centrum |
Geen |
Geen |
Geen actie |
|
Van der Horst |
Kinderuroloog Vu medisch centrum Amsterdam |
Lid cie. ontwikkeling skillslab Vumc (onbetaald, tot dec 2018) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Stichting Kind en Ziekenhuis af te vaardigen in de klankbordgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. In het licht van de bevindingen van de Kwaliteits & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVK, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NVK, NVNG, NVU, V&VN, NHG, en Stichting Kind en Ziekenhuis via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Gedurende het ontwikkeltraject is afstemming met de NHG gezocht, omdat de herziening van de NHG standaard nagenoeg gelijk liep met deze richtlijn. Van belang was dat er geen discrepanties waren tussen de richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Vanwege een beperkt aantal searches dat kon worden ingezet, is voor een aantal uitgangsvragen besloten geen (nieuwe) search uit te voeren, maar de tekst van de oude richtlijn te behouden. Bij deze uitgangsvragen werd geen nieuwe literatuur verwacht. Er kon voor deze uitgangsvragen geen GRADE beoordeling plaatsvinden, omdat de literatuur niet (her)beoordeeld is.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
