Afnamewijze
Uitgangsvraag
Op welke wijze dienen urinemonsters te worden afgenomen?
Deelvraag 1
Welke methoden zijn geschikt voor het afnemen van een urinemonster?
Deelvraag 2
Wat is de plaats van aanvullende maatregelen (zoals (gewassen) midstream) ten opzichte van spontaan geloosde urine zonder maatregelen om te voorkomen dat in de urinekweek contaminerende flora wordt aangetroffen?
Aanbeveling
-
Neem bij voorkeur een urinemonster af middels spontaan geloosde urine.
-
-
Neem bij voorkeur eerste ochtendurine.
-
-
Probeer een urinemonster af te nemen middels gewassen midstream urine bij patiëntgroepen (zoals ouderen en kinderen) waarbij het lastig is om een representatieve urine te krijgen.
-
Overweeg in samenspraak met de patient (vertegenwoordiger) een eenmalige katheterisatie indien het afnemen van een gewassen midstream niet mogelijk is.
-
Instrueer de patiënt hoe urine verzameld dient te worden.
-
Gebruik van urine uit een katheterzak/plaszak of urine uit een luier wordt sterk afgeraden in verband met een verhoogde kans op contaminatie.
-
-
Verwijder of vervang de katheter voor urine afname.
-
-
-
Indien de katheter vervangen wordt, neem dan de urine af uit de nieuwe katheter
-
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor deelvraag 1 met betrekking tot de verschillende afnamewijze van een urinekweek is geen systematisch literatuuronderzoek uitgevoerd. De werkgroep heeft haar aanbevelingen gebaseerd op expert opinion en door het bestuderen van internationale richtlijnen en relevante wetenschappelijke artikelen.
Voor deelvraag 2 is een literatuuranalyse verricht naar de toegevoegde waarde van additionele (niet-invasieve) maatregelen om bij afname van urine t.b.v. een urinekweek het risico op contaminatie te beperken. Het risico op contaminatie en diagnostische waarde van de kweek zijn als belangrijke uitkomstmaten meegenomen.
Met betrekking tot contaminatie van de kweek is de bewijskracht beoordeeld als zeer laag. Op basis van deze uitkomstmaat kan daarom geen richting worden gegeven aan de besluitvorming.
Met betrekking tot de diagnostische waarde van de kweek werd in de systematische literatuuranalyse geconcludeerd dat de sensitiviteit (75%-99%), specificiteit (62%-92%), PPV (52%-91%) en de NPV (79%-97%) van het afnemen van een urine zonder additionele maatregelen matig tot hoog waren in vergelijking met het afnemen van een urine met additionele maatregelen. De GRADE-beoordeling is laag. Dit houdt in dat er met lage zekerheid gezegd kan worden dat de daadwerkelijke sensitiviteit, specificiteit, positief voorspellende waarde en de negatief voorspellende waarde overeenkomt met de waarden gevonden in de studies.
Timing van het urinemonster
Bij voorkeur wordt er gebruik gemaakt van ochtendurine. Dat is urine dat na overnacht bedrust als eerste uitgeplast wordt en tenminste 4-8 uur in de blaas opgehouden is geweest. Dit geeft bacteriën de kans te groeien en komt de sensitiviteit van de urinekweek ten goede. Een tweede portie ochtendurine is urine dat 2-4 uur na de ochtendurine uitgeplast wordt. Bacteriën hebben minder lang de kans gehad om uit te groeien en daarom bestaat een grotere kans op fout negatieve uitslagen. Echter het is niet altijd mogelijk ochtendurine op te vangen. Latere porties kunnen dan wel ingestuurd worden.
Spontaan geloosde urine
De meest eenvoudige manier van urinemonstername is die van de spontaan geloosde urine. De NHG-standaard Urineweginfecties adviseert bij volwassenen geen speciale maatregelen zoals ‘gewassen’ of ‘midstream’. In de richtlijnen van de Urineweginfecties (UWI) bij volwassenen en Urineweginfecties bij kwetsbare ouderen wordt ‘midstream’ urine vermeld zonder nadere onderbouwing. Midstream houdt in dat de patiënt de eerste hoeveelheid urine laat aflopen en daarna geloosde urine opvangt in een steriele container (potje).
De richtlijn UWI bij kinderen en NHG-standaard Urineweginfecties adviseren voor zindelijke kinderen ‘gewassen midstream’. ‘Wassen’ houdt in het reinigen van de externe genitalia met schoon kraanwater voorafgaand aan het lozen van de urine. Bij niet-zindelijke kinderen wordt ook ‘gewassen midstream’ geadviseerd of eenmalige katheterisatie in het geval dit niet mocht lukken. Om een gewassen midstream te verkrijgen bij zuigelingen wordt de zgn. ‘quick wee’ methode beschreven met een verwijzing naar beeldmateriaal online. In de NHG-standaard Urineweginfecties wordt ook de ‘stimulatiemethode’ beschreven voor hetzelfde doel.
Aanvullende maatregelen
De diverse onderzoeken naar het nut van gewassen midstream (of alleen midstream) versus spontane lozing van urine zonder maatregelen vooraf werden gedaan bij mannen of gezonde, jonge vrouwen (18-60 jaar).
Urine verlaat de vrouwelijke urethra in een brede straal, die de labia, de vagina en de vulva raakt. Als gevolg hiervan kunnen plaveiselcellen en bacteriën van deze plaatsen in het urinemonster terecht komen en kan het monster gecontamineerd raken.
Zonder nader onderzoek kan men er niet van uitgaan dat bij met name kwetsbare oude vrouwen spontaan geloosde urine even betrouwbaar is als gewassen midstream. Op het microbiologisch laboratorium wordt bij deze patiëntengroep echter wel vaker contaminatie opgemerkt.
Bij een gecontamineerde urine kan niet met zekerheid een uitspraak worden gedaan over de aan- of afwezigheid van een urineweginfectie of de verwekker, waardoor herhalen van de urinekweek overwogen moet worden. Echter, door inzet van een nieuwe kweek gaan tijd en geld verloren.
Wanneer opvang van een urinemonster niet mogelijk is, dan is een eenmalige katheterisatie aangewezen indien een kweek met resistentiebepaling gewenst is. Katheterisatie dient op aseptische wijze gedaan te worden door hiertoe geschoold personeel waarbij de eerste portie opgevangen urine dient te worden weggegooid.
Urine bij een katheter à demeure (verblijfskatheter) in situ
Voor afname van een urinemonster voor kweek bij een katheter in situ dient eerst de katheter verwijderd of vervangen te worden. Indien de katheter vervangen wordt, neem dan de urine af uit de nieuwe katheter. De tip van de verblijfskatheter is niet geschikt voor een urinekwek
Blaaspunctie
Bij blaaspunctie is de kans op contaminatie zo goed als nihil. Hooguit kan wat huidflora in het monster terecht komen. Voor de wijze van afname verwijst deze werkgroep naar bestaande protocollen.
Niet geschikt urinemonsterafname
In verband met een verhoogd risico op contaminatie zijn de volgende urinemonsters niet geschikt voor kweek:
-
Urine uit een katheterzak/plaszakje
-
Urine uit een luier
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Niet iedereen is in staat om midstream urine op te vangen (bijvoorbeeld ouderen en kinderen). Om toch een betrouwbaar urinemonster te verkrijgen kan het inbrengen van een katheter in de blaas nodig zijn. Deze procedure kan door de patiënt als zeer belastend en hinderlijk worden ervaren en er kan iatrogene schade ontstaan evenals de kans op nieuwe urineweginfecties.
Het belang van een betrouwbaar microbiologisch onderzoek moet dus worden afgewogen tegen de hinder of schade, die de patiënt kan ondervinden.
Kosten (middelenbeslag)
Het toepassen van de aanbeveling zal geen effect hebben op de structurele kosten, omdat de aanbevelingen aansluiten op de bestaande praktijk.
Aanvaardbaarheid, haalbaarheid en implementatie
De aanvaardbaarheid en haalbaarheid van de verschillende methodes van urine afname is niet kwalitatief of kwantitatief onderzocht. Er worden geen problemen voorzien met de aanvaardbaarheid van deze module, aangezien de meeste aanbevelingen niet afwijken van de huidige praktijk. Het vervangen van een katheter voorafgaand aan urine afname behoort niet overal tot de huidig praktijk en kan in sommige gevallen zorgen voor extra werkzaamheden.
Rationale van de aanbeveling
Bij volwassenen zijn in principe geen speciale maatregelen nodig voor het opvangen van urine. De meest eenvoudige manier van urinemonstername is daarom die van de spontaan geloosde urine. Er is geen wetenschappelijk bewijs gevonden dat contaminatie verschilt binnen verschillende leeftijdsgroepen. Echter, bij met name kwetsbare oude vrouwen en kinderen is aannemelijk dat spontaan geloosde urine niet even betrouwbaar is als gewassen midstream. De kans op contaminatie is denkbaar groter in deze patiëntengroepen. De werkgroep adviseert daarom om een gewassen midstream urine af te nemen bij patiëntgroepen waarbij het lastig is om een representatieve urine te krijgen.
Onderbouwing
Achtergrond
Tijdens afname of lozing van urine kan het monster besmet raken met micro-organismen van de uitwendige geslachtsorganen en de huid. Deze micro-organismen (bacteriën, gisten) groeien op de voedingsbodems in de kweek net als de eventueel aanwezige ziekteverwekkers. Het onderscheid tussen ziekteverwekker en toevallig aanwezig micro-organisme is dan niet goed te maken. Immers, de ziekteverwekkers kunnen ook aan de buitenkant van het lichaam aanwezig zijn zonder dat ze daar ziekte veroorzaken.
Het is daarom belangrijk om bij afname van de urine deze besmetting (contaminatie) te voorkomen. Contaminatie van urine wordt gedefinieerd als de aanwezigheid van microorganismen in een urinemonster die niet uit de urine in de urineblaas afkomstig zijn. Onbekend is echter wat de toegevoegde waarde is van gewassen midstream (of alleen midstream) versus spontane lozing van urine zonder maatregelen in het voorkomen van de aanwezigheid van contaminerende flora in een urinekweek.
Het doel van deze module is om te beschrijven op welke wijze urinemonsters dienen te worden afgenomen.
Conclusies / Summary of Findings
|
Very low GRADE |
Contamination
The evidence is uncertain about the effect of urine sample collection with additional measures to prevent contamination of culture compared to urine sample collection without additional measures.
Source: 1e Llor, 2023; Larocco, 2015 |
|
Low GRADE |
Diagnostic value
The diagnostic value of home-voided and midstream urine collection may be moderate to high for the screening of urinary tract infections when compared to midstream clean-catch urine collection.
Source: Llor, 2023 |
|
Low GRADE |
The diagnostic value of first-void urine collection may be moderate to high for the screening of urinary tract infections in adults when compared to midstream urine collection.
Source: Llor, 2023 |
Samenvatting literatuur
Description of studies
Llor (2023) conducted a systematic review evaluating the accuracy of urine culture from different non-invasive sampling techniques in symptomatic non-pregnant women >16 years old to diagnose urinary tract infection (UTI). Llor (2023) covers the literature until 19 April 2022 and searches were conducted in PubMed. Reference lists and citations of included studies were backward searched for additional studies. No restrictions were applied in ways of publication language. Llor (2023) included studies using a paired design or controlled trials comparing the result of urine culture obtained with two or more collection techniques in self-helped, nonpregnant adult women with symptoms of acute UTI in any healthcare setting. The patient, index test, and target condition, known as PIT for a test accuracy question, were as follows: P. the population was constituted by any woman aged 16 or older with symptoms of UTI with urine cultures collected; I. studies comparing exclusively non-invasive sample collections were considered, such as midstream-clean-catch with soap or disinfectants, the midstream-clean-catch technique with the use of only water, first-void urine samples, first-void urine samples, home-voided samples with instructions, and random voiding samples; and T. the target condition was definitive diagnosis of UTI. In total, 6 studies were included with a total of 1010 patients. Assessment of article quality was evaluated using the Quality Assessment of Diagnostic Accuracy Studies tool (QUADAS-2). Four components were assessed: patient selection, index test, reference standard, flow, and timing. Each study was scored according to whether the assessment criteria are met or not, and then classified as being of “high risk,” “low risk,” or “unclear risk” of bias. The main outcome was the diagnostic accuracy of urine culture, but Llor (2023) also determined the contamination rates of the urine collection methods.
Larocco (2015) conducted a systematic review to identify and evaluate preanalytic practices associated with urine specimens and to assess their impact on the accuracy of urine culture microbiology. Larocco (2015) covers the literature until 2014 and searches were conducted in Pubmed, SCOPUS, and CINAHL. In addition, hand searching of bibliographies from relevant information sources was performed. Larocco (2015) included any study published in English if it was considered likely to provide valid and useful information and met the following PICO criteria: “Population” is any patients who have urine cultures collected; “Intervention” is clinical practice; Comparison” midstream clean-catch collection of urine without cleansing versus with cleansing (men and women); “Outcomes” are the results of determining the contamination rate and the diagnostic accuracy of urine culture. In total, 8 studies were included with a total of 1010 patients (both men and women from all ages). Assessment of article quality was evaluated using the Quality Assessment of Diagnostic Accuracy Studies tool (QUADAS-2). Four components were assessed: patient selection, index test, reference standard, flow, and timing. Each study was scored according to whether the assessment criteria are met or not, and then classified as being of “high risk,” “low risk,” or “unclear risk” of bias. The main outcome was the diagnostic accuracy of urine culture, but Larocco (2015) also determined the contamination rates of the urine collection methods.
Results
Contamination
Midstream urine without cleansing vs. midstream-clean-catch samples
Llor (2023) included two studies that examined the impact of perineal cleansing on contamination, comparing midstream-clean-catch and midstream-clean-catch samples from women (Morris, 1970; Bradbury, 1988, see Figure 1). The definitions of contamination varied between the two studies and included the presence of mixed growth in quantities of >105 colony-forming units (CFU)/ml or 104–105 CFU/ml.
Larocco (2015) included 5 studies that reported on the difference in percentages of contamination between midstream urine collection with cleansing versus without cleansing in women being tested for a UTI. Definitions of contamination varied among studies and included any growth of normal vaginal flora and/or small quantities (>2000 CFU/ml) of pathogenic bacteria (Blake, 2006), the presence of epithelial cells (Bradbury, 1998), mixed growth in quantities of >105 CFU/ml (Holliday, 1991) or at any quantity (Schneeberger, 2013), and growth of any nonpathogen or pathogen in quantities of >104 CFU/ml (Schneeberger, 2013) or >105 CFU/ml (Schlager, 1995).
In summary, 6 studies examined the impact of perineal cleansing on contamination of midstream urine specimens collected from females is shown in Figure 1 (one study (Bradbury 1988) was reported in both systematic reviews). Data from the six included studies found no difference in the odds of contamination between midstream urine specimens collected with or without cleansing. The pooled OR was 1.05 (95% CI 0.71 to 1.55).
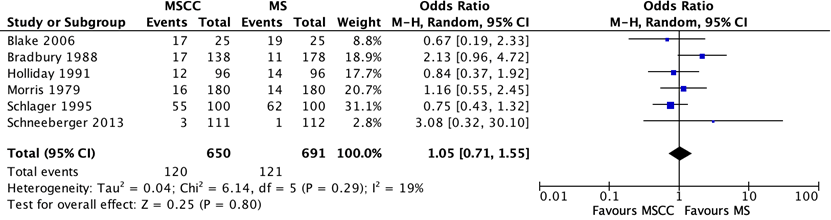
Figure 1. Difference in contamination levels between midstream urine collected with cleansing (MSCC) versus without cleansing (MS) in women being tested for urinary tract infection. M-H, Mantel-Haenszel statistic; 95% CI, 95% confidence interval.
Larocco (2015) included 2 studies that reported on the difference in percentages of contamination between midstream urine collection with cleansing versus first voided urine in men being tested for a UTI. One study also reported on the difference between percentages of contamination between midstream urine collection with cleansing versus without cleansing in men being tested for a UTI. The evidence comparing levels of contamination after midstream urine collection and uncleansed first-void collection is shown in Figure 2 and 3.
Two studies found a large (77%) reduction in the odds of contamination in favour of midstream clean-catch over first-void specimens. The pooled OR was 0.33 (95% CI 0.15 to 0.77) One study comparing midstream collection with cleansing to midstream collection without cleansing (Figure 3) showed no significant difference in contamination between the two methods of collection (OR=0.57; 95% CI 0.25-1.31)
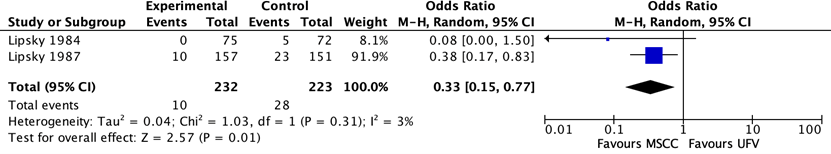
Figure 2. Difference in contamination levels between midstream collection with cleansing (MSCC) and first-void urine collection without cleansing (UFV) in men being tested for urinary tract infection M-H, Mantel-Haenszel statistic; 95% CI, 95% confidence interval.
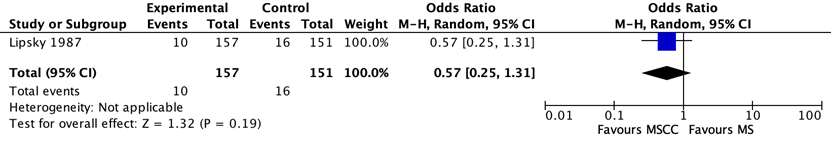
Figure 3. Difference in contamination levels between midstream collection with cleansing (MSCC) and midstream collection without cleansing (MS)) in men being tested for urinary tract infection M-H, Mantel-Haenszel statistic; 95% CI, 95% confidence interval.
Home-voided samples vs. midstream-clean-catch samples
Llor (2023) included one study (Bærheim, 1990) that examined the diagnostic accuracy of home voiding specimens (n=63) with midstream-clean-catch samples among women (aged 18-70) with suspected UTIs (n=73). Bacteriuria, considered with a cut-off point of ≥ 104 CFU/ml, was observed in 52 (71.2%) specimens in home voided samples and 54 (73.9%) in midstream-clean-catch samples samples. Contaminated samples (coagulase-negative staphylococci and other grampositives) in 3 (4.1%) and 7 (9.6%) samples, respectively. The OR for contamination was 0.47, (95% CI 0.12 to 1.91). Overall, similar results were observed between the two groups.
Midstream-clean-catch samples with verbal instructions vs. midstream-clean-catch samples with illustrated instructions
Llor (2023) included one study that compared two groups of women in a pseudorandomized
clinical trial (Eley, 2016). The first group of women (aged > years) was asked to provide midstream-clean-catch samples after receiving verbal instructions (n=120) and the second group was given illustrated instructions (n=120). Definitive infections confirmed in 11 cases in the group assigned to verbal instructions (9.2%) and in 15 cases among those with illustrated instructions (12.5%). The number of contaminated samples, defined as the presence of 10 or more epithelial cells per high power field, was significantly Higher in the first group (47, 39.2% vs. 30, 25%). The OR for contamination was 1.93 [1.11, 3.36].
Random voiding vs. midstream-clean-catch samples
Llor (2023) included one randomized clinical trial allocating adult women with suspected UTIs to any of these three arms: a first group with random voiding samples (n=77) and two groups of women assigned to midstream-clean-catch with two levels of intervention: the first group carried out the normal procedure of cleansing the perineal area with the use of a bactericidal wipe (n=84) and the second group was requested to do the same but also inserting a vaginal tampon prior to the urine sample collection (n=81). Definitive infection defined as the growth of bacteria ≥ 104 CFU/ml in 44 specimens of the group without cleansing (57.1%), 42 in the midstream-clean-catch group without tampon (50%) and 46 in the midstream-clean-catch group with tampon (56.8%). Contamination defined as mixed growth and low levels (<104 CFU/ml) of organisms commonly found on the skin and external and internal genitalia. Contaminated samples in 22 samples of the group without cleansing (28.6%), 27 in the midstream-clean-catch group without tampon (32.1%) and 25 patients with midstream-clean-catch + tampon insertion (30.9%). Overall, the number of contaminated samples was slightly lower when random voiding specimens were collected, albeit without statistical differences.
First-void urine vs. midstream urine samples
Llor (2023) included one study that reported on the accuracy of first-void urine samples over first-void urine samples in a paired sample study performed in general practice (Hølmkjær, 2018). This study examined the overall agreement of urine collection at different times with the current endorsed gold standard of considering UTI above the cut-off point of 1,000 CFU/ml. When the analysis was performed immediately after urine collection the overall agreement was higher when a midstream urine sample was considered (98/117, 83.8% vs. 90/117, 76.9% observed in first-void urine specimens). The reason for the lower accuracy with first-void urine was mainly due to the presence of Enterococcus spp. in the sample. There was no data provided on contaminated samples.
Diagnostic value
Table 1 shows the accuracy parameters of the paired sample studies. However, this information could not be obtained from one of the studies. In addition, because of the randomized design, accuracy could not be calculated from the other two studies.
Table 1. Diagnostic accuracy of the different studies (95% confidence intervals in brackets).
|
Study |
Cut-off |
n |
TP |
TN |
FP |
FN |
Sens. |
Spec. |
PPV |
NPV |
|
Home-voided samples vs. midstream-clean-catch samples |
||||||||||
|
Barheim, 1990 |
≥104 CFU/ml |
73 |
48 |
15 |
6 |
4 |
0.92 (0.81–0.98) |
0.71 (0.48–0.89) |
0.89 (0.80–0.94) |
0.79 (0.58–0.91) |
|
Midstream urine without cleansing vs. midstream-clean-catch samples |
||||||||||
|
Bradbury, 1988 |
≥105 CFU/ml |
158 |
12 |
131 |
11 |
4 |
0.75 (0.48–0.93) |
0.92 (0.87–0.96) |
0.52 (0.37–0.67) |
0.97 (0.37–0.67) |
|
First-void urine vs. midstream urine samples |
||||||||||
|
Hølmkjær, 2018 |
≥103 CFU/ml |
117 |
89 |
18 |
9 |
1 |
0.99 (0.94–1.00) |
0.67 (0.46–0.83) |
0.91 (0.85–0.94) |
0.95 (0.72–0.99) |
CFU, colony-forming units; FN, false negatives; FP, false positives; NPV, negative predictive value; PPV, positive predictive value; Sens., sensitivity; Spec., specificity; TN, true negatives; TP, true positives.
Level of evidence of the literature
Contamination
The level of evidence regarding the outcome measure contamination was downgraded with three levels because the 95% confidence intervals crossing the border for clinical relevance (imprecision; -2), and due to applicability concerns (risk of bias; -1). The level of evidence is graded as ‘very low’.
Diagnostic performance
The level of evidence regarding the outcome measures diagnostic value for different noninvasive urine collection methods was downgraded with two levels because of heterogeneity (execution of studies, differences in reference method; -1) and because of risk of bias (unclear if reference without knowledge of the index test and vice versa; -1). The level of evidence is graded as ‘low’.
Zoeken en selecteren
Sub question -1
No systematic literature analysis was performed for this sub question. Instead the guidelines NHG-standaard Urineweginfecties; Urineweginfecties bij kwetsbare ouderen; Urineweginfecties (UWI) bij volwassenen and UWI bij kinderen were examined including all relevant references on which recommendations were based.
Sub question-2
A systematic review of the literature was performed to answer the following question: What is the role of a (clean-catch) midstream as a method of collection compared to spontaneously voided urine without measures to prevent the presence of contaminating flora in the urine culture?
| P: | Urine of adults with suspected urinary tract infection |
| I: | Sample collection with additional measures (e.g., midstream urine with or without cleansing) |
| C: | Spontaneous urine sample |
| O: | Contamination, diagnostic value (sensitivity, specificity, positive predicted value (PPV), negative predicted value (NPV)) |
Relevant outcome measures
Subquestion-1
Not applicable.
Subquestion-2
The guideline development group considered contamination and diagnostic value as critical outcomes measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the GRADE-standard limit of 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25), and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
Subquestion-1
Not applicable.
Subquestion-2
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from inception until 3 April 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 253 hits. Studies were selected based on the following criteria systematic revies systematic reviews, randomized controlled trials answering the research question. Ten studies were initially selected based on title and abstract screening. After reading the full text eight studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included (Llor, 2023 and LaRocco, 2015).
Results
Subquestion-1
Not applicable.
Subquestion-2
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables. The summary of literature, results and evidence tables are included in 'Samenvatting literatuur'.
Referenties
- Llor C, Moragas A, Aguilar-Sánchez M, García-Sangenís A, Monfà R, Morros R. Best methods for urine sample collection for diagnostic accuracy in women with urinary tract infection symptoms: a systematic review. Fam Pract. 2023 Feb 9;40(1):176-182. doi: 10.1093/fampra/cmac058. PMID: 35652481.
- LaRocco MT, Franek J, Leibach EK, Weissfeld AS, Kraft CS, Sautter RL, Baselski V, Rodahl D, Peterson EJ, Cornish NE. Effectiveness of Preanalytic Practices on Contamination and Diagnostic Accuracy of Urine Cultures: a Laboratory Medicine Best Practices Systematic Review and Meta-analysis. Clin Microbiol Rev. 2016 Jan;29(1):105-47. doi: 10.1128/CMR.00030-15. PMID: 26598386; PMCID: PMC4771218.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Llor, 2023
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs and observational studies
Literature search up to April 2022
A: Morris, 1979 B: Bradbury, 1988 C: Bærheim, 1990 D: Lifshitz, 2000 E: Eley, 2016 F: Hølmkjær, 2018
Setting and Country: A: General practice, UK B: General practice, UK C: General practice, Norway D: University clinic, US E: Emergency department, Australia F: General practice, Denmark
Source of funding and conflicts of interest: Not reported
|
Inclusion criteria SR: Studies needed to use a paired design or a controlled trial to compare the result of urine culture obtained with two or more collection techniques in self-helped, nonpregnant adult women with symptoms of acute UTI in any healthcare setting
Exclusion criteria SR:
Studies were excluded if they compared invasive methods for obtaining a urine sample, such as the use of catheters, suprapubic aspirate, cystoscopy, ureteric, ileal conduit, urostomy, or nephrostomy urine. Studies investigating patients who were asymptomatic, pregnant, children, and/ or men were excluded.
N, A: 180 patients B: 158 patients C: 73 patients D: 242 patients D: 240 patients E: 117 patients
Groups comparable at baseline? Yes |
Describe intervention:
A: Midstream B: Midstream C: Home voided D: Midstream E: Midstream-clean-catch with verbal instruction F: First-void urine
|
Describe control:
A: Midstream-clean-catch B: Midstream-clean-catch C: Midstream-clean-catch D: Midstream-clean-catch E: Midstream-clean-catch with illustrated instruction F: Midstream
|
End-point of follow-up:
A-F: NA
For how many participants were no complete outcome data available? (intervention/control) A-F: not reported
|
Outcome measure-1 Defined as.contamination
Effect measure: OR [95% CI]: A: 1.16 [0.55, 2.45] B: 2.13 [0.96, 4.72] C: 0.47 [0.12, 1.91] D: NR E: 1.93 [1.11, 3.36] F: NR
Outcome measure-2 Defined as.diagnostic value
Sensitivity (95% ci) B: 0.92 (0.81–0.98) C: 0.75 (0.48–0.93] F: 0.99 (0.94–1.00)
Specificity (95% ci) B: 0.71 (0.48–0.89) C: 0.92 (0.87–0.96) F: 0.67 (0.46–0.83)
NPV (95% ci) B: 0.79 (0.58–0.91) C: 0.97 (0.37–0.67) F: 0.95 (0.72–0.99)
PPV (95% ci) B: 0.89 (0.80–0.94) C: 0.52 (0.37–0.67) F: 0.91 (0.85–0.94)
|
Risk of bias (high, some concerns or low): A: High B: High C: Moderate D: High E: High F: High
Facultative: The authors conclude that despite being widely recommended, they did not find consistent evidence that asking women to provide midstream samples with or without cleansing is better.
|
|
Larocco, 2015 |
SR and meta-analysis of RCTs and observational studies
Literature search up to 2014
A: Balke, 2006 B: Bradbury, 1988 C: Holliday, 1981 D: Schlager, 1995 E: Schneeberger, 2013 F: Lipsky, 1984 G: Lipsky, 1987
Setting and Country: A: Adolescent Clinic, USA B: General practice, UK C: Royal Air Force Institute of Pathology and Tropical Medicine, UK D: Teen Health Center, US E: Obstetric clinic, Netherlands F: University clinic USA G: University clinic USA
Source of funding and conflicts of interest: Not reported
|
Inclusion criteria SR: any study published in English if it was considered likely to provide valid and useful information and met the following PICO criteria: “Population” is any patients who have urine cultures collected; “Intervention” is clinical practice; Comparison” midstream clean-catch collection of urine without cleansing versus with cleansing (men and women)
Exclusion criteria SR:
Studies failing to meet the inclusion criteria (not considered to report a relevant practice, did not include a practice of interest, or did not present an outcome measure of interest) were excluded from further review.
Important patient characteristics at baseline: N, A: 25 patients B: 158 patients C: 96 patients D: 180 patients D: 100 patients E: 112 patients F: 75 patients G: 157 patients
Groups comparable at baseline? Yes |
Describe intervention:
A: Midstream B: Midstream C: Midstream D: Midstream E: Midstream F: Midstream G: Midstream/first-void urine
|
Describe control:
A: Midstream-clean-catch B: Midstream-clean-catch C: Midstream-clean-catch D: Midstream-clean-catch E: Midstream-clean-catch F: Midstream-clean-catch G: Midstream-clean-catch |
End-point of follow-up:
A-G: NA
For how many participants were no complete outcome data available? (intervention/control) A-G: not reported
|
Outcome measure-1 Defined as.contamination
Effect measure: OR [95% CI]: Women A: 0.67 [0.19, 2.33] B: 2.13 [0.96, 4.72] C: 0.75 [0.43, 1.32] D: 0.75 [0.43, 1.32] E: 3.08 [0.32, 30.10]
Men F: 0.08 [0.00, 1.50] G: 0.38 [0.17, 0.83]
|
Risk of bias (high, some concerns or low): A: Moderate B: Moderate C: Low D: Low E: Moderate F: Low F: Moderate
Facultative: The authors conclude that if noninvasive collection is being considered for women, midstream collection with cleansing is recommended, but no recommendation for or against is made for midstream collection without cleansing. If noninvasive collection is being considered for men, midstream collection with cleansing is recommended and collection of first-void urine is not recommended. No recommendation for or against is made for collection of midstream urine without cleansing.
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Llor, 2023 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Unclear |
No |
|
Laroco, 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Unclear |
No |
-
Research question (PICO) and inclusion criteria should be appropriate and predefined
-
Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
-
Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
-
Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
-
Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
-
Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
-
Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
-
An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
-
Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Collier S, Matjiu F, Jones G, Harber M, Hopkins S. A prospective study comparing contamination rates between a novel mid-stream urine collection device (Peezy) and a standard method in renal patients. J Clin Pathol. 2014 Feb;67(2):139-42. doi: 10.1136/jclinpath-2013-201686. Epub 2013 Aug 28. PMID: 23986555; PMCID: PMC3913209. |
C does not meet PICO |
|
Hayward G, Mort S, Yu LM, Voysey M, Glogowska M, Croxson C, Yang Y, Allen J, Cook J, Tearne S, Blakey N, Tonner S, Sharma V, Patil M, Kelly S, Butler CC. Urine collection devices to reduce contamination in urine samples for diagnosis of uncomplicated UTI: a single-blind randomised controlled trial in primary care. Br J Gen Pract. 2022 Feb 24;72(716):e225-e233. doi: 10.3399/BJGP.2021.0359. PMID: 34990390; PMCID: PMC8803092. |
C does not meet PICO |
|
Holm A, Aabenhus R. Urine sampling techniques in symptomatic primary-care patients: a diagnostic accuracy review. BMC Fam Pract. 2016 Jun 8;17:72. doi: 10.1186/s12875-016-0465-4. PMID: 27278078; PMCID: PMC4898352. |
Relevant studies also included in Llor (2023) |
|
Jackson SR, Dryden M, Gillett P, Kearney P, Weatherall R. A novel midstream urine-collection device reduces contamination rates in urine cultures amongst women. BJU Int. 2005 Aug;96(3):360-4. doi: 10.1111/j.1464-410X.2005.05631.x. PMID: 16042730. |
C does not meet PICO |
|
Michielsen WJ, Geurs FJ, Verschraegen GL, Claeys GW, Afschrift MB. A simple and efficient urine sampling method for bacteriological examination in elderly women. Age Ageing. 1997 Nov;26(6):493-5. doi: 10.1093/ageing/26.6.493. PMID: 9466302. |
I does not meet PICO |
|
Moragas A, García-Sangenís A, Llor C. Do external urine collection devices reduce contamination in urine samples for women with symptoms of urinary tract infection? A systematic review. Enferm Infecc Microbiol Clin (Engl Ed). 2023 Jan 25:S2529-993X(23)00012-6. doi: 10.1016/j.eimce.2022.04.012. Epub ahead of print. PMID: 36707281. |
C does not meet PICO |
|
Naber, K. G. Urine sampling method and significance of bacteriuria in men. Infection. 1994; 22 :S44-S46 |
Wrong publication type (short communication) |
|
Pernille H, Lars B, Marjukka M, Volkert S, Anne H. Sampling of urine for diagnosing urinary tract infection in general practice - First-void or mid-stream urine? Scand J Prim Health Care. 2019 Mar;37(1):113-119. doi: 10.1080/02813432.2019.1568708. Epub 2019 Jan 28. PMID: 30689471; PMCID: PMC6452804. |
I and O do not meet PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 08-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep).
Werkgroep
- Dr. A.T. Bernards (voorzitter), arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Drs. I.O Lede MBA, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. A.P. van Dam, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. E.M de Koff, Arts in opleiding tot arts-microbioloog (onder begeleiding van Dr. A.P. van Dam)
- Dr. E.C.H.J. Michielsen, Laboratoriumspecialist klinische chemie, Nederlandse Vereniging voor Klinische Chemie (NVKC)
- Dr. T.N. Platteel, Huisarts, Nederlands Huisartsen Genootschap (NHG) (tot 1 september 2023 en vanaf 1 januari 2024)
- Dr. L. Boelman, Huisarts, Nederlands Huisartsen Genootschap (NHG) (vanaf 1 september 2023 tot 1 januari 2024)
- Drs. J.H. Wolterbeek, uroloog, Nederlandse Vereniging voor Urologie (NVU)
Klankbordgroep:
- Dr. P.D.J. Sturm, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dr. M.T. van der Beek, arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Drs. S.C.M. Tops arts in opleiding tot arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Drs. K. Prantl, Nierpatiëntenvereniging Nederland (NVN)
Met ondersteuning van:
- M. van der Maten, literatuurspecialist, Kennisinstituut van de Medisch Specialisten
- A. van der Wal, literatuurspecialist, Kennisinstituut van de Medisch Specialisten
- A. Eikelenboom-Boskamp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J Versteeg, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. A.T. Bernards |
Voorzitter werkgroep |
Geen |
Geen |
Geen
|
|
Drs. I.O Lede MBA |
Arts-microbioloog Tergooi MC betaald |
Aspirant bestuurslid Stichting Pensioenfonds Medisch Specialisten (SPMS) (bezoldigd) |
Geen
|
Geen
|
|
Dr. A.P. van Dam |
Arts-microbioloog Amsterdam UMC (0,9 FTE) waarbij detachering naar - GGD Amsterdam, Streeklaboratorium, (0,2 FTE) - RIVM, consulent openbare gezondheidszorg/microbiologie (COMmer) (0,2 FTE) |
Vanuit Amsterdam UMC: lid redactieraad Tijdschrift voor Infectieziekten (onbetaald) - Vanuit GGD: laboratoriumvertegenwoordiger NL voor SOA-European Center of Disease Control ECDC (onbetaald) |
Onderzoek naar effectiviteit van zolidoflacin voor behandeling van gonorroe, opdrachtgever GARDP Onderzoek naar belang van Mycoplasma genitalium bij PID, financier OLVG research fonds Onderzoek naar diagnostische waarde geautomatiseerde moleculaire test voor Treponema pallidum, Hologic financiert hierbij alleen kits, geen personele kosten en geen honoraria |
Geen
|
|
Dr. E.M. de Koff |
Arts in opleiding tot arts-microbioloog bij Amsterdam Universitair Medisch Centrum |
Geen |
Geen |
Geen |
|
Dr. E.C.H.J. Michielsen |
Laboratoriumspecialist klinische chemie - Diagnostiek voor U (betaald) Technical assessor Raad voor Accreditatie (betaald) |
NHG LESA commissie NHG werkgroep diagnostische bepalingen |
Geen
|
Geen
|
|
Dr. T.N. Platteel |
Waarnemend huisarts Assistant professor Julius centrum, UMC Utrecht |
Lid regionaal coördinatieteam ABR zorgnetwerk Gain. afgevaardigd als werkgroeplid namens NHG |
Geen
|
Geen
|
|
Dr. L. Boelman |
Huisarts, Huisartsenpraktijk de Brink, Werkhoven (0,3 FTE) Wetenschappelijk medewerker, cluster Richtlijnontwikkeling, NHG (0,6 FTE) |
Geen |
Geen |
Geen |
|
Drs. J.H. Wolterbeek |
Uroloog Franciscus Rotterdam |
Commissie kwaliteitsvisitatie Urologie vanuit de NVU |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntfederatie Nederland (PFNL) en de Nierpatiëntenvereniging Nederland voor de schriftelijke knelpuntenanalyse. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan PFNL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module afnamewijze |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten met betrekking tot de technische uitwerking van urinekweken. Tevens zijn er knelpunten aangedragen door ZiNL, NVZ, NVN, NVMM, NVKC, NVKG, NVU, V&VN, ZKN, NVOG, VIG via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html .
