Hydronefrose bij UWI bij volwassenen
Uitgangsvraag
Wat is de behandeling van een hydronefrose bij een patiënt met een urineweginfectie?
Aanbeveling
Bespreek met de patiënt de voor- en nadelen van een nefrostomie- en JJ-katheter, ga na wat voor de patiënt belangrijke voor- en nadelen zijn, en kom samen tot een besluit.
Overwegingen
> Kwaliteit van bewijs
De algehele kwaliteit van bewijs is laag tot zeer laag omdat de kwaliteit van bewijs van kritieke uitkomstmaten zoals klinische verbetering c.q. normalisatie van leukocyten, trombocyten en lichaamstemperatuur laag tot zeer laag is.
> Waarden en voorkeuren
Er zijn twee reele opties om obstructieve urolithiasis te draineren: het plaatsen van een JJ-katheter of een nefrostomie-katheter. Naar mening van de werkgroep zullen sommige patienten kiezen voor de optie JJ-katheter en sommige patienten voor de optie nefrostomie-katheter. Een van de redenen hiervoor is dat niet elke patient een korte verblijfsduur in het ziekenhuis even belangrijk vindt. Gezamenlijke besluitvorming is daarom aangewezen.
> Kosten en middelen
In één gerandomiseerde studie (Pearle et al., 1998) werd over de kosten gerapporteerd. Toepassen van een JJ-katheter zou tweemaal zo veel kosten met zich meebrengen als een nefrostomiekatheter. Sammon et al. (2013) berekenden op basis propensity score matching in een observationele studie dat toepassen van een JJ-katheter juist met minder kosten gepaard ging dan toepassen van een nefrostomie-katheter. Nederlandse kosteneffectiviteitsstudies ontbreken.
> Professioneel perspectief
In één observationele studie, verricht in de Verenigde Staten (Sammon et al., 2013), werd bij gebruik van een nefrostomie-katheter in vergelijking met een JJ-katheter een aanzienlijk verhoogd risico op mortaliteit tijdens verblijf in het ziekenhuis gerapporteerd. In hoeverre het hier een causale relatie betreft, daarover kan de studie geen uitsluitsel geven, zoals ook de auteurs erkennen.
Het is mogelijk dat bij ziekere patiënten frequenter een nefrostomie-katheter werd toegepast. Dat strookt ook met de klinische ervaring van Nederlandse urologen. Dit zou grotendeels het verhoogde risico op mortaliteit kunnen verklaren. Tegelijkertijd is de ervaring van Nederlandse urologen dat gebruik van een nefrostomie-katheter wel meer complicaties kan geven, zoals sepsis, pneumothorax, of hematurie waarvoor transfusie noodzakelijk is. Het is echter niet waarschijnlijk dat de meeste van deze complicaties zorgen voor een sterk verhoogd risico op sterfte. Alles bijeengenomen is er reden om het gebruik van een nefrostomie-katheter als de oorzaak van een verhoogd risico op mortaliteit te relativeren.
> Aanvaardbaarheid en haalbaarheid van de aanbeveling(en)
De aanbevelingen sluiten goeddeels aan bij de huidige Nederlandse praktijk. Op grond hiervan kan verwacht worden dat de aanbevelingen aanvaardbaar en haalbaar zijn.
> Balans van gewenste en ongewenste effecten
De balans van gewenste en ongewenste effecten is moeilijk te maken, omdat de effecten van een nefrostomie- en JJ-katheter op de uitkomsten klinische verbetering, verblijfsduur in het ziekenhuis en spontane passage van stenen, onzeker zijn; en omdat patiënten de voor- en nadelen van de twee types katheters waarschijnlijk anders tegen elkaar afwegen.
Rationale van de aanbeveling(en)
De werkgroep heeft de geringe mate van zekerheid ten aanzien van de effecten van gebruik van een nefrostomie- en JJ-katheter op de uitkomsten klinische verbetering, verblijfsduur in het ziekenhuis en spontane passage van stenen zwaar laten wegen. Zij meent daarom dat gedeelde besluitvorming een belangrijke plaats moet hebben.
Onderbouwing
Achtergrond
Er bestaat onduidelijkheid over wat optimale methoden van drainage zijn voor obstructieve urolithiasis, met name wat betreft de relatieve voor- en nadelen (effectiviteit, complicaties, pijn) van het gebruik van een nefrostomie-katheter (NSK) en een dubbel-J (JJ) katheter.
Conclusies / Summary of Findings
Ad: review van gerandomiseerde studies over nefrostomie-katheter (NSK) vergeleken met JJ-katheter bij patiënten met obstructief urinesteenlijden
|
Laag
GRADE |
Klinische verbetering: tijd tot normalisatie van leukocyten en van lichaamstemperatuur Mogelijk leidt gebruik van een nefrostomie-katheter tot een iets snellere normalisatie van het aantal leukocyten en van de lichaamstemperatuur dan gebruik van een JJ-katheter.
Bronnen: Mokhmalji et al., 2001; Pearle et al., 1998 |
|
GRADE |
Mortaliteit Hierover werd in gerandomiseerde studies niet gerapporteerd. |
|
Laag
GRADE |
Verblijfsduur in het ziekenhuis Mogelijk leidt gebruik van een JJ-katheter tot een korter verblijf in het ziekenhuis dan gebruik van een nefrostomiekatheter.
Bron: Pearle et al., 1998 |
|
GRADE |
Spontane passage van stenen Hierover werd in gerandomiseerde studies niet gerapporteerd. |
Ad PICO-vraagstelling 1: review van niet-gerandomiseerde studies over nefrostomie-katheter vergeleken met JJ-katheter bij patiënten met urinesteenlijden
|
Zeer laag
GRADE |
Klinische verbetering: piekwaarden leukocyten en C-reactief proteïne; trombocytopenie De evidence is zeer onzeker of er een verschil is in de piekwaarden van leukocyten, C-reactief proteïne en trombocytopenie tussen gebruik van nefrostomie-katheter en JJ-katheter.
Bron: Yoshimura et al., 2015 |
|
Laag
GRADE |
Mortaliteit Mogelijk gaat het gebruik van een JJ-katheter gepaard met een geringer risico op mortaliteit dan gebruik van een nefrostomie-katheter.
Bron: Sammon et al., 2013 |
|
Laag
GRADE |
Verblijfsduur ziekenhuis Mogelijk gaat gebruik van een JJ-katheter gepaard met een korter verblijf in het ziekenhuis dan gebruik van een nefrostomie- katheter.
Bronnen: Goldsmith et al., 2013; Sammon et al., 2013 |
|
Zeer laag
GRADE |
Spontane passage van stenen De evidence is zeer onzeker of er een verschil is in de mate van spontane passage van stenen tussen gebruik van nefrostomie-katheter en JJ-katheter.
Bronnen: De Sousa Morais et al., 2018; Goldsmith et al., 2013 |
Samenvatting literatuur
Ad: review van gerandomiseerde studies over nefrostomie-katheter (NSK) vergeleken met JJ-katheter bij patiënten met obstructief urinesteenlijden
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie en kwaliteit van bewijs zie de evidence tabellen.
Studiepopulaties
De studies onderzochten mannelijke en vrouwelijke patiënten met hydronefrose als gevolg van urineleider- of nierstenen, en met klinische tekenen van infectie. In de drie studies waren de redenen voor het inbrengen van een katheter of stent: infectie (Rammohan et al., 2015; Pearle et al., 1998); infectie, pijn, verlies van nierfunctie (Mokhmalji et al., 2001).
Interventies
De studies onderzochten het effect van een nefrostomie-katheter ten opzichte van een JJ-katheter. In de studies werden verschillende maten katheters gebruikt. Pearle et al. (1998) vermeldden: 8F nefrostomie-katheters bij 90% van de patiënten, 10F katheters bij 5% en 12F katheters bij 5%. Bij de JJ-katheter was dat 7F. Rammohan et al. (2015) vermeldden: een 12F nefrostomie-katheter bij 85% van de patiënten, een 14F katheter bij 15%, en de maat voor de JJ-katheter was bij 90% van de patienten een 4.5F katheter en bij 10% een 5F katheter. Mokhmalji et al. (2001) vermeldden alleen de afmeting van de nefrostomie-katheter: 12F.
De katheters werden meestal in een operatiekamer ingebracht onder lokale anesthesie, al of niet aangevuld met intraveneuze sedatie-medicatie.
Klinische verbetering: tijd tot normalisatie van leukocyten en lichaamstemperatuur
Twee studies onderzochten de normalisatie van leukocyten. Pearle et al. (1998) hanteerden als normaalwaarde voor leukocyten 10.000/mm3 en voor de lichaamstemperatuur ≤37.4 C. Rammohan et al. (2015) hanteerden als normaalwaarde voor leukocyten 11.000/mm3. De normaalwaarde voor de lichaamstemperatuur werd niet vermeld. Pooling van de twee studies laat zien dat het aantal leukocyten in de groep met patienten die een nefrostomie-katheter kregen, in nauwelijks minder tijd (-0,06 dag; 95% BI: -0,50 tot 0,38) normaliseerde (figuur 1). De boven- en ondergrens van het betrouwbaarheidsinterval laten echter zien dat ook een verschil van ongeveer een halve dag ten gunste van een nefrostomie-katheter of een JJ katheter nog mogelijk is.
Figuur 1. Analyse nefrostomie-katheter (hier weergegeven als PCN, percutaneous nefrostomy) versus JJ-katheter; uitkomst ‘tijd tot normalisatie leukocyten’
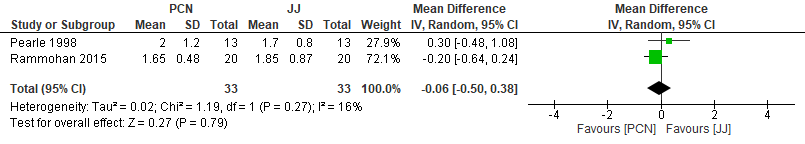
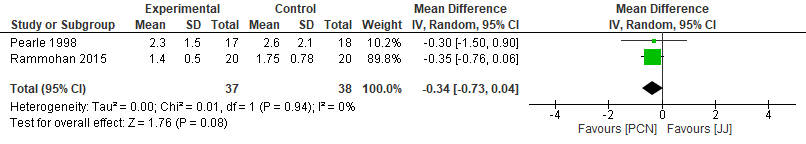
Pooling van de twee studies laat zien dat normalisatie van de lichaamstemperatuur met een nefrostomiekatheter minder tijd (-0,34 dag; 95% BI: -0,73 tot 0,04) vergt (figuur 2). De bovengrens van het betrouwbaarheidsinterval laat echter zien dat ook een verwaarloosbaar verschil nog mogelijk is.
Figuur 2. Analyse nefrostomie-katheter (PCN) versus JJ-katheter; uitkomst ‘tijd tot normalisatie lichaamstemperatuur’
Mortaliteit
Geen data in review van Weltings et al. (2019).
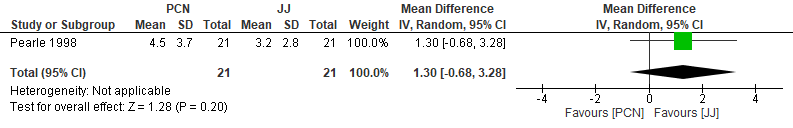
Verblijfsduur in het ziekenhuis
Een studie onderzocht deze uitkomstmaat (figuur 3). Patiënten met een JJ-katheter verbleven gemiddeld 1,3 dagen (95% BI: -0,68 tot 3,28) korter in het ziekenhuis. De ondergrens (-0,68) laat zien dat ook een wat korter verblijf bij gebruik van een nefrostomie-katheter tot de mogelijkheden behoort. Omgekeerd laat de bovengrens (3,28) zien dat een aanzienlijk korter verblijf bij gebruik van een JJ-katheter ook nog mogelijk is.
Figuur 3. Analyse nefrostomie-katheter (PCN) versus JJ-katheter; uitkomst ‘verblijfsduur ziekenhuis’
Spontane passage van stenen
Geen data in review van Weltings et al. (2019).
Kwaliteit van bewijs
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies starten gerandomiseerde onderzoeken in de categorie hoog en observationele studies in de categorie laag. Zie ook de evidence tabellen.
Klinische verbetering: tijd tot normalisatie van leukocyten en van lichaamstemperatuur
De kwaliteit van bewijs werd verlaagd van hoog naar redelijk vanwege ernstig risico op vertekening (evidence tabellen). Daarnaast werd afgewaardeerd van redelijk naar laag vanwege ernstige onnauwkeurigheid (wijd betrouwbaarheidsinterval; figuur 1 en 2).
Verblijfsduur in het ziekenhuis
De kwaliteit van bewijs werd verlaagd van hoog naar redelijk vanwege ernstig risico op vertekening (evidence tabellen). Daarnaast werd afgewaardeerd van redelijk naar laag vanwege ernstige onnauwkeurigheid (wijd betrouwbaarheidsinterval; figuur 3.
Ad PICO-vraagstelling 1: review van niet-gerandomiseerde studies over nefrostomie-katheter vergeleken met JJ-katheter bij patiënten met urinesteenlijden
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie en kwaliteit van bewijs zie de evidence tabellen.
Studiepopulaties
De niet-gerandomiseerde studies onderzochten mannelijke en vrouwelijke patiënten met hydronefrose als gevolg van urineleider- of nierstenen, en met klinische tekenen van infectie. In de vier studies waren de redenen voor het inbrengen van een katheter of stent: infectie (Sammon et al., 2013; Goldsmith et al., 2013; Yoshimura et al., 2005); infectie, pijn, verlies van nierfunctie (De Sousa Morais et al., 2018).
Interventies
De studies onderzochten (onder andere) het effect van een nefrostomie-katheter ten opzichte van een JJ-katheter. Deze studies rapporteerden noch over type anesthesie noch over de afmetingen van de gebruikte katheters.
Klinische verbetering: piekwaarden leukocyten en C-reactief proteïne; trombocytopenie
Yoshimura et al. (2015) onderzochten onder andere de piekwaarden van leukocyten en C-reactief Proteïne (CRP). Patiënten met een JJ-katheter hadden hogere piekwaarden dan patiënten met een nefrostomie-katheter. Voor CRP was dit verschil: 1,1 (mg/L) [19,4 ± 6,7 versus 20,5 ± 8,3; p=0,30] en voor leukocyten: 1,7 (x1000/mm3) [18,7 ± 9,5 versus 17,0 ± 9,8; p=0,25]. Daarnaast hadden patiënten met een JJ-katheter meer trombocytopenie dan patiënten met een nefrostomie-katheter: 34% versus 25% (odds ratio: 1,57; 95% BI: 0,49 tot 4,98).[1]
Nota bene: patiënten die een nefrostomie-katheter kregen hadden grotere stenen dan patiënten met een JJ-katheter: 9,7 versus 2,6 mm (p=0,006).
Mortaliteit
Op basis van propensity score matching vonden Sammon et al. (2013) dat toepassen van een nefrostomie-katheter gepaard ging met een ongeveer driemaal zo grote kans op mortaliteit dan gebruik van een JJ-katheter: OR 3,14 (95% BI: 2,13 tot 4,63). Deze uitkomst is waarschijnlijk niet het gevolg van het zieker-zijn van patiënten die een nefrostomie-katheter kregen. Immers, wanneer voor subgroepen (pyelonefritis versus cystitis en electief versus spoed) de uitkomsten van JJ en nefrostomie-katheter werden vergeleken, bleven de verschillen (in dezelfde orde van grootte) bestaan. In absolute termen: per jaar sterven tijdens ziekenhuisopname 9 per 1.000 patiënten bij wie een nefrostomie-katheter werd toegepast tegen 3 per 1.000 patiënten bij wie een JJ-katheter werd toegepast.[2]
Verblijfsduur in het ziekenhuis
Goldsmith et al. (2013) vonden dat toepassen van een JJ-katheter gepaard ging met een korter verblijf dan toepassen van een nefrostomie-katheter. Univariate analyse wees op een verschil van 2,4 dagen (p=0,001).[3] Multivariate analyse, waarbij rekening werd gehouden met leeftijd, APACHE score en Charlson Comorbidity Index score, leverde een verschil van 2,1 dagen (p=0,001) op.[4]
Sammon et al. (2013) berekenden op basis propensity score matching dat de kans op een verblijf langer dan 5 dagen bij gebruik van een nefrostomie-katheter ruim tweemaal zo groot was (OR 3,18, 95% BI: 3,01 tot 3,34): in plaats van 19% - ca. 2.000 patiënten per jaar – bij gebruik van een JJ-katheter dus bijna 50% - ruim 5.000 patiënten per jaar – in geval van een nefrostomie-katheter.[5]
Spontane passage van stenen
Twee studies onderzochten deze uitkomstmaat. Pooling van de twee studies laat ca 50% meer kans op spontane passage van stenen zien met een nefrostomie-katheter (odds ratio (OR) 1,49; 95% BI: 0,66 tot 3,38 (figuur 4)) dan een JJ-katheter.[6] De ondergrens laat echter zien dat de omvang van de studies te gering was om een gunstig effect van een JJ-katheter uit te sluiten.
Figuur 4. Analyse nefrostomie-katheter versus JJ-katheter; uitkomst ‘spontane passage van stenen’

De Sousa Morais et al. (2018) toonden in een multivariate analyse waarin werd gecorrigeerd voor expulsieve medicamenteuze therapie, eerdere manipulatie van de urethra, grootte en plaats (distaal/proximaal) van de stenen, een sterk verhoogde kans op spontane passage bij gebruik van een nefrostomie-katheter ten opzichte van een JJ-katheter: OR 6,67; 95% BI: 1,034–42,970.[7]
Goldsmith et al. (2013) corrigeerden het gevonden verschil in spontane passage van stenen niet voor grootte van de stenen, terwijl er wel een verschil in grootte was: 10 mm voor de nefrostomie-kathetergroep en 7 mm voor de JJ-kathetergroep.
Kwaliteit van bewijs
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies starten gerandomiseerde onderzoeken in de categorie hoog en observationele (c.q. niet-gerandomiseerde) studies in de categorie laag. Zie ook de evidence tabellen.
Klinische verbetering: piekwaarden leukocyten en C-reactief proteïne
De kwaliteit van bewijs werd verlaagd van laag naar zeer laag vanwege vanwege ernstige onnauwkeurigheid (ontbreken betrouwbaarheidsinterval; klein aantal patiënten). Zie ook toelichting op risk op bias beoordeling (evidence tabellen).
Mortaliteit
De kwaliteit van bewijs (laag) werd niet verder verlaagd vanwege risk of bias of andere GRADE-factoren. Zie ook toelichting op risk op bias beoordeling (evidence tabellen).
Verblijfsduur in het ziekenhuis
De kwaliteit van bewijs (laag) werd niet verder verlaagd vanwege risk of bias of andere GRADE-factoren. Zie ook toelichting op risk op bias beoordeling (evidence tabellen).
Spontane passage van stenen
De kwaliteit van bewijs werd verlaagd van laag naar zeer laag vanwege ernstige onnauwkeurigheid (wijde betrouwbaarheidsintervallen). Zie ook toelichting op risk op bias beoordeling (evidence tabellen).
[1] Berekend door de werkgroep op basis van Yoshimura et al. (2005; tabel 2).
[2] De auteurs schatten de sterfte op ca. 0,3% wanneer een JJ- katheter wordt toegepast. De 10-jaars prevalentie kan dan op basis van De Sousa Morais et al. (2018; tabel 4 en 5) geschat worden op bijna 30 per 1.000, per jaar dus bijna 3 per 1.000. Bij een odds ratio van 3,14 (nefrostomie- versus JJ-katheter) is het aantal sterftegevallen onder patiënten met nefrostomie-katheter dus ca. 9 per 1.000, ofwel ca. 6 per 1.000 patiënten per jaar meer.
[3] Geen spreidingsmaat of betrouwbaarheidsinterval gerapporteerd door auteurs.
[4] Geen spreidingsmaat of betrouwbaarheidsinterval gerapporteerd door auteurs.
[5] Gebaseerd op Sammon et al. (2013; tabel 4 en 10-jaars prevalentie). Odds ratio’s niet te verwarren met relatieve risico’s (RR). Bij lage incidenties is OR=RR. Bij incidenties vanaf 10% RR<OR.
[6] Berekend door de werkgroep.
[7] In de review van Weltings et al. (2019) staat als ondergrens 1.1034 vermeld. De Sousa Moiras et al. (2018) vermeldden in tabel 2 van hun artikel als betrouwbaarheidsinterval 1.034–42.970.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep zich gebaseerd op een systematische literatuuranalyse van Weltings et al. (2019) met de volgende PICO-vraagstelling[1]:
Wat is bij patiënten met obstructief urinesteenlijden (eng: obstructive urolithiasis) het effect van het plaatsen van een nefrostomie-katheter (NSK) vergeleken met het plaatsen van een JJ-katheter op de uitkomstmaten in tabel 1?
Tabel 1. Inclusie- en selectiecriteria PICO 1
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Control |
|
|
Type uitkomstmaten |
Effectiviteit
|
|
Type setting |
|
|
Exclusiecriteria |
|
Literatuurzoekactie
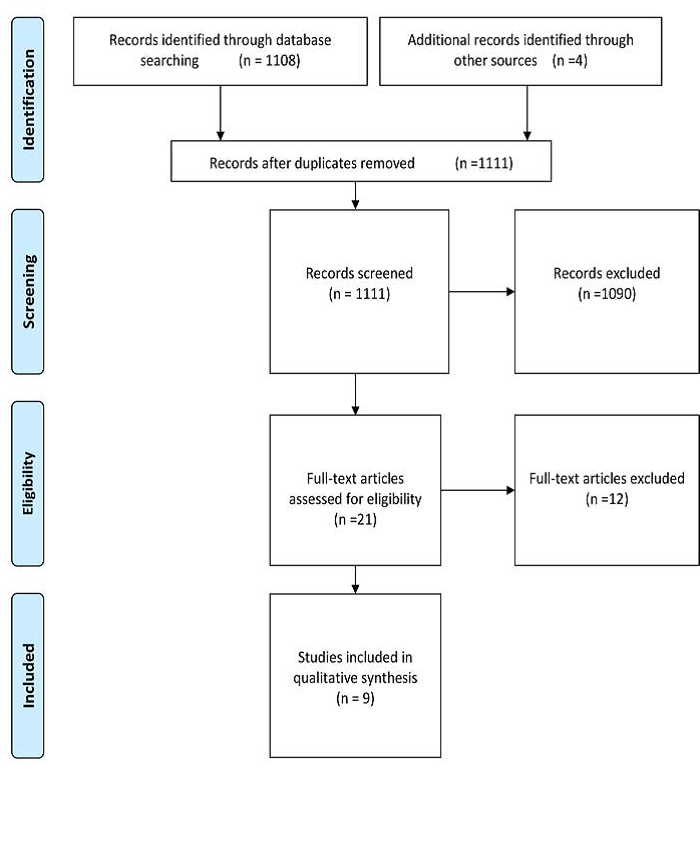
In de databases Web of Science, Medline, Embase, Emcare en de Cochrane controlled trial databases werd door Weltings et al. (2019) een search verricht naar publicaties tot november 2018 voor de PICO-vraagstelling. De search is niet beperkt in jaren, wel naar taal (Engels en Nederlands). Zoektermen die werden gebruikt waren onder meer: urolithiasis, nephrolithiasis, calculi, stones, drainage, nephrostomy, JJ, stent, decompression, obstruction, ureteral, hydronephrosis, dilatation, acute and costs. Zie de zoekverantwoording voor het PRISMA flow diagram.
De literatuurzoekactie leverde 1111 unieke treffers op. De reviewers selecteerden op basis van titel en abstract 21 artikelen waarvan de volledige tekst werd gelezen. Na lezing werden hiervan uiteindelijk negen studies opgenomen in de literatuuranalyse (Pearle et al., 1998; Mokhmalji et
al, 2001; Yoshimura et al., 2005; Song Yan et al., 2012; Goldsmith et al., 2013; Sammon et al., 2013; Wang et al., 2014; Rammohan et al., 2015; De Sousa Morais et al., 2018). De werkgroep heeft twee studies (Wang et al., 2014; Song Yan et al., 2013) buiten beschouwing gelaten omdat deze specifiek zwangere vrouwen betreffen; deze behoren niet tot de doelgroepen van de richtlijn.
Onderzoeksdesigns
Drie studies hebben een gerandomiseerde onderzoeksopzet (Pearle et al., 1998; Mokhmalji et al., 2001; Rammohan et al., 2015); vier studies zijn observationele cohortstudies (tabel 2).
Tabel 2. Overzicht onderzoeksdesign
|
Onderzoeksdesign |
Aantal studies |
|
Gerandomiseerde gecontroleerde trial (RCT) |
3 studies (Rammohan et al., 2015; Mokhmalji et al., 2001; Pearle et al., 1998) |
|
Prospectief cohort onderzoek met controlegroep |
1 studie (de Sousa Morais et al., 2018) |
|
Retrospectief cohortonderzoek zonder vergelijkende studieopzet |
3 studies (Sammon et al., 2013*; Goldsmith et al., 2013; Yoshimura et al., 2005) |
*gebruikt propensity score matching om gerandomiseerde gecontroleerde trial na te bootsen.
Omdat zowel gerandomiseerd als niet-gerandomiseerde studies zijn meegenomen, worden deze studies en de beoordeling van de kwaliteit ervan afzonderlijk gepresenteerd. De reden is dat bij de beoordeling van het kwaliteit van bewijs gerandomiseerde studies beginnen als hoge kwaliteit van bewijs en niet-gerandomiseerde studies als lage kwaliteit van bewijs.[2]
[1] Deze review is gepubliceerd als Weltings S, Schout BMA, Roshani H, Kamphuis GM, Pelger RCM. Lessons from
literature, nephrostomy versus double J ureteral catheterization in patients with obstructive urolithiasis - Which method is superior? J Endourol. 2019 Jun 28. doi: 10.1089/end.2019.0309. De tweede auteur maakt deel uit van de richtlijnwerkgroep.
Ten behoeve van deze richtlijn is de reviewtekst van Weltings et al. (2019) bewerkt. De reden hiervoor is dat de literatuursamenvatting en -beoordeling dient te voldoen aan de criteria van het kwaliteitsdocument richtlijnen 2.0.
[2] The Cochrane Collaboration focuses particularly on systematic reviews of randomized trials because they are more likely to provide unbiased information than other study designs about the differential effects of alternative forms of health care. Bron: https://handbook-5-1.cochrane.org/chapter_13/13_1_2_why_consider_non_randomized_studies.htm
Referenties
- Goldsmith, Z.G., et al., Emergent ureteric stent vs percutaneous nephrostomy for obstructive urolithiasis with sepsis: patterns of use and outcomes from a 15-year experience. BJU Int, 2013. 112(2): p. E122-E128.
- Mokhmalji, H., et al., Percutaneous nephrostomy versus ureteral stents for diversion of hydronephrosis caused by stones: a prospective, randomized clinical trial. J Urol, 2001. 165(4): p. 1088-1092.
- Pearle, M.S., et al., Optimal method of urgent decompression of the collecting system for obstruction and infection due to ureteral calculi. J Urol, 1998. 160(4): p. 1260-1264.
- Rammohan, T., et al., A Comparative Study of Percutaneous Nephrostomy Versus Dj Stenting in Infective Hydronephrosis in Calculous Disease. Journal of Evolution of Medical and Dental Sciences-Jemds, 2015. 4(18): p. 3143-3153.
- Sammon, J.D., et al., Temporal trends, practice patterns, and treatment outcomes for infected upper urinary tract stones in the United States. Eur Urol, 2013. 64(1): p. 85-92.
- Schünemann HJ, Cuello C, Akl EA, Mustafa RA, Meerpohl JJ, Thayer K, Morgan RL, Gartlehner G, Kunz R, Katikireddi SV, Sterne J, Higgins JP, Guyatt G, GRADE Working Group, Schünemann HJ, Cuello C, Akl EA, Mustafa R, Thayer K, Morgan R, Meerpohl J, Higgins J, Guyatt G, GRADE Guidelines 18. How ROBINS-I and other tools to assess risk of bias in nonrandomized studies should be used to rate the certainty of a body of evidence, Journal of Clinical Epidemiology (2018), Volume 111, 105 – 114.
- de Sousa Morais, N., et al., Percutaneous nephrostomy vs ureteral stent for hydronephrosis secondary to ureteric calculi: impact on spontaneous stone passage and health-related quality of life-a prospective study. Urolithiasis, 2018.
- Yoshimura, K., et al., Emergency drainage for urosepsis associated with upper urinary tract calculi. J Urol, 2005. 173(2): p. 458-62.
Evidence tabellen
Samenvatting van studiekarakteristieken
|
Study |
Study design (level of evidence) |
Gender distribution (M:F) |
Mean age in years (range or SD) |
Procedure of PCN |
Procedure of JJ |
N total (PCN/JJ) |
Reason for drainage |
Inclusion criteria |
Exclusion criteria |
Primary outcome |
Secondary outcome |
|
Pearle et al 1998 |
Randomized controlled trial (1b)
1995-1997 |
PCN group: (8:13)
JJ group: (10:11)
P value not significant |
PCN group: 41.3 (+/- 13)
JJ group: 41.3 (+/- 14.5) |
Angiography suite by interventional radiologist
Local anesthesia supplemented with iv sedation |
Operating room, under supervision of a urologist and under general anesthesia
|
42 (21/21) |
- infection
|
Obstructing ureteral calculi + clinical signs of infection *
*T>38C and/or white blood count (WBC) > 17,000/mm
|
Contraindication to either form of drainage
|
Time to normalization of WBC or temperature
|
Length of hospitalization |
|
Mokhmalji et al 2001 |
Randomized prospective study (1b)
1996-1998 |
PCN group: (12:8)
JJ group: (9:11)
Comparable groups |
PCN group: 55 (24-78)
JJ group: 49 (24 - 76)
Comparable groups |
Sonographically guided renal puncture, facial dilatation over guidewire.
Local anesthesia
Placement under fluoroscopy of 12 French (F) drain
|
Rigid cystoscopy
Prior local anesthetic using lidocaine instillation
Fluoroscopic guidance, placement over guidewire |
40 (20/20)
|
- infection - pain - loss of renal function
|
Hydronephrosis caused by urolithiasis and: Renal colic or T>38 or stone >15 mm or urosepsis or creatinin increase or UTI and incipient sepsis in blood count
|
End stage hydronephrosis, choice for 1 procedure to facilitate further diagnostic imaging. Anatomical; pouch, solitary kidney, poor coagulation, children
|
Course of procedure, subsequent progress and quality of life (QoL) |
Use of analgesics, duration of x-ray exposure, success, iv antibiotics, duration of diversion
|
|
Rammohan et al 2015 |
Randomized prospective study (1b)
2012-2014 |
PCN group: (8:12)
JJ group: (9:11)
P value not significant |
Overall 46.47 (+/- 9.36) |
In the operating room
Local anesthesia
12F or 14F drain |
In the operating room
Local anesthesia
4.5F or 5Fstent
|
40 (20/20)
|
- infection |
Obstructing ureteral or renal pelvic stones with clinical signs of infection*
*fever, WBC elevated |
Calculus > 15mm, multiple calculi, pregnancy, urinary diversion, ureteral/urethral stricture, coagulopathy, solitary kidney |
Time to normalization WBC, normalization of temperature, resolution of pyuria if seen
|
Procedural time, fluoroscopy time, complications, VAS. Time to definitive treatment and modality |
|
Sammon et al 2013 |
Observational cohort (2b)
1999-2009 |
PCN group: (35:65)
JJ group: (28:72)
P< 0.001 |
PCN group: 53 (40-68)
JJ group: 51 (37 - 65)
P< 0.001 |
No information on procedure |
No information on procedure |
396.385
(13.967 / 99.492)
|
- infection |
Adult patients hospitalized with infected urolithiasis |
Patients undergoing URS or PCNL |
Sepsis, organ failure, mortality length of hospital stay, cost |
Procedural time, fluoroscopy time, complications, VAS. Time to definitive treatment and modality |
|
De Sousa Morais et al 2018 |
Prospective cohort (2b)
2017 |
PCN group: (6:12)
JJ group: (19:13)
P=0.077 |
PCN group: 63.1 (+/- 12.5)
JJ group: 54.5 (+/- 15.5)
P=0.048 |
No information on procedure |
No information on procedure |
50 (18/32) = 36% vs 64% |
- infection - pain - loss of renal function
|
Adult patients with urinary tract obstruction due to kidney stones, confirmed on non-contrast enhanced computed tomography (NCCT) |
Not mentally capable, patients lost to follow-up after urinary diversion and pregnant women |
Spontaneous stone passage (SSP) and quality of life (QoL |
|
|
Yoshimura et al 2005 |
Retrospective case study (2c)
1994-2003 |
PCN group: (12:12)
JJ group: (12:23)
P=0.034
|
PCN group: 67.3 (+/- 15.7)
JJ group: 59.5 (+/- 17.4)
P=0.042 |
No information on procedure |
No information on procedure |
59 (24/35)
= 41% vs 59%
|
- infection |
Patients with urosepsis associated with upper urinary tract and requiring emergency drainage |
Prior antibiotic, negative urine culture, other focus of sepsis |
Course of procedure and subsequent progress |
Blood tests for infection parameters (CRP/leukocytes/thrombocytes) Antibiotics |
|
Goldsmith et al 2013 |
Retrospective case study (2c)
1995-2011 |
NR |
56 (19–88) |
No information on procedure |
No information on procedure |
130 (59/71)
= 45% vs 55% |
- infection |
CT diagnosis of obstructive urolithiasis and 2/4 SIRS criteria (T / HR / RR / WBC) |
Non-infectious indication (pain / acute renal failure) |
Stone related and clinical variables which predicted use of each treatment method APACHE/ BMI / CCI / age etc) |
Length of hospital stay, risk of ICU admission, surgical approach for definitive stone management |
|
Study |
Technical aspects and outcome (success / complications) |
Efficacy |
QoL |
Length of stay and costs |
Other results |
Conflict of interest or sources of funding |
|
Pearle et al 1998 |
Procedural and fluoroscopy times were significantly shorter for JJ compared with PCN
Success PCN: 95% Success JJ: 100%
Complication; unsuccessful PCN requiring salvage ureteric stenting |
No significant difference in normalization of clinical parameters (WBC / temperature) |
More back pain in PCN group compared with the stenting group (37.2 versus 6.5 on a scale of 0 to 100, p<0.05).
No difference in the use of analgesics
|
No difference in length of stay (4.5 days in PCN group vs. 3.2 days in the JJ group).
JJ under general anesthesia was twice costly at $2401 versus $1137 for PCN |
No significant difference in time to definitive drainage |
NR |
|
Mokhmalji et al 2001 |
X-ray exposure shorter in PCN group (NS)
Success PCN: 100% Success JJ: 80% (20% conversion to nephrostomy)
Stent failure more frequently with proximal stones and age >60 |
Antibiotics >5 days 64% in stent group vs 0% in PCN group
|
Analgesics more frequently in stent group (NS) QoL reduction bigger in stent group. QoL improved in PCN group and deteriorated in stent group, especially in males and people <40
|
NR |
PCN indwelling time significantly shorter due to persisting infection in JJ group This was more pronounced in patients with hydronephrosis and stones in the proximal ureter
|
Financial interest and/or other relationship with Storz America, Inc. and Storz Medical. |
|
Rammohan et al 2015 |
Procedural and fluoroscopy time significantly shorter in stenting group
1PCN related complication (dislodgement of tube) |
No significant difference in time to clinical improvement |
Back pain significantly greater in PCN group
No significant difference in duration of pain.
|
NR |
NR |
None |
|
Sammon et al 2013 |
PCN showed higher rates of sepsis and mortality in matched analysis |
NR |
NR |
PCN showed prolonged length of stay and elevated hospital charges in matched analysis
Procedural costs and length of stay strongly favored JJ on propensity-score-matched analysis. |
28.6% of hospitalized patients underwent immediate decompression (n=113459)
Women >2 likely to have associated infection and more likely to experience sepsis when intervention is needed |
None |
|
De Sousa Morais et al 2018 |
No significant difference for need of antibiotics and urinary infections was found |
NR |
Decrease of QoL pre- and post- intervention - in JJ group (P<0.001) - in PCN group (p=0.206)
Patients in JJ group more urinary symptoms, mostly hematuria (p<0.001) and dysuria (p<0.001)
More analgesics needed in JJ group (p=0.004) |
NR |
Rate of spontaneous stone passage (SSP) - 25% in JJ group - 38.9% in PCN group (NS in univariate analysis)
SSP influenced by stone size (NS)
30.2% (n=13) of stones in JJ group upward displaced
Stone size higher in PCN group vs JJ (p=0.12) |
None
|
|
Yoshimura et al 2005 |
NR |
More rapid progression of inflammation and more severe thrombocytopenia in JJ group vs PCN group Peak CRP en WBC did not differ |
NR |
Patients undergoing emergency drainage required more treatment interventions and a longer hospital stay than other patients with urolithiasis (10 days longer) P<0.001 |
Stones larger in PCN group (9.7 vs 2.6mm) Performance status, patient age and sex were independent risk factors
|
NR
|
|
Goldsmith et al 2013 |
Overall rate of failed procedure = 2,3% (3/130) with 1 hospital death (0,8%)
2 JJ failures à PCN 1 PCN failure à JJ (P = 0.571)
|
NR |
NR |
PCN group significant longer hospital stay on multivariable analysis and higher rate of ICU admission. No difference in stone location
|
More severely ill patients (Higher APACHE scores) and larger stones (10 vs 7mm) in PCN group
Method of drainage correlated with later treatment method
Time from drainage to definitive treatment and rates of spontaneous stone passage equal in both groups |
None |
*NS = Non significant; *NR= Not reported
Methodologische beoordeling van gerandomiseerde studies
Onderstaande beoordeling is verricht door de methodologen van de richtlijnwerkgroep.
Pearle et al., 1998
|
Bias |
Judgment reviewer |
Support for judgement |
|
Random sequence generation |
Unclear |
Quote: “A total of 42 patients were randomized to receive percutaneous nephrostomy (21) or retrograde ureteral catheterization (21).” This is the one and only sentence pertaining to randomization. |
|
Allocation concealment |
Unclear |
No information on allocation concealment was reported. |
|
Baseline differences between intervention groups suggest a problem with the randomization process? |
No |
Quote: “The 2 groups were comparable in patient, stone and clinical characteristics (table 1); p values were not significant”. |
|
Blinding of outcome assessment |
Low risk |
Outcome assessor was not blinded. However, the outcome measures were objective measures. |
|
Incomplete outcome data |
High risk |
There is no specific information on attrition. However table 3 and text below this table shows that 15 patients are missing for the outcome time to normal WBC, and 7 patients for the outcome time to normal temperature. Whether or not attrition occurred for the outcomes back or bladder pain, duration of pain medication is unclear. |
|
Selective reporting
|
Low risk |
No reason to suspect selective reporting. |
|
Overall risk of bias: serious risk of bias for all outcome measures above (GRADE: rate down by one level for serious risk of bias). |
||
Mokhmalji et al., 2001
|
Bias |
Judgment reviewer |
Support for judgement |
|
Random sequence generation |
High risk |
Quote: “From March 1, 1996 to April 3, 1998, 20 patients (even numbered birth year) were randomized into the ureteral stent (pigtail) group and 20 (uneven numbered birth year) into the percutaneous nephrostomy group.” Birth year is not a random element.! |
|
Allocation concealment |
High risk |
No information on allocation concealment was reported. Concealment of allocation is difficult to realize when even and uneven ‘random’ number are used because the investigator may know the allocation of the next patient after some allocations have taken place. |
|
Baseline differences between intervention groups suggest a problem with the randomization process? |
Unclear |
No specific information on baseline characteristics was reported. |
|
Blinding of outcome assessment |
Unclear |
Outcome assessor was probably not blinded. This may have influenced Quality of Life measures (WHO instrument; back pain) since it was unclear how assessment of this subjective measures did take place. |
|
Incomplete outcome data |
Low risk |
There is no specific information on attrition. But it seems there was no attrition: tables report the included number of patients. |
|
Selective reporting
|
Unclear |
Study was not registered as clinical trial. |
|
Overall risk of bias: serious risk of bias for all outcome measures (GRADE: rate down by one level for serious risk of bias). |
||
Rammohan et al., 2015
|
Bias |
Judgment reviewer |
Support for judgement |
|
Random sequence generation |
Unclear |
Quote: “The study was conducted from October 2012 to January 2014 patients of obstructing ureteral or renal pelvic stones with clinical signs of infection were randomized for decompression by either percutaneous nephrostomy or double J stenting in a tertiary care teaching hospital”. This is the one and only sentence pertaining to randomization. |
|
Allocation concealment |
Unclear |
No information on allocation concealment was reported. |
|
Baseline differences between intervention groups suggest a problem with the randomization process? |
No |
Table 3 reports more or less equal values for both treatment groups. No significant p values. |
|
Blinding of outcome assessment |
Low risk |
Outcome assessor was probably not blinded. However, all outcome measures were objective measures. |
|
Incomplete outcome data |
Low risk |
There is no specific information on attrition. But it seems there was no attrition: tables report the included number of patients. |
|
Selective reporting
|
High risk |
Outcome measures are reported that were measured by other researches but were presented as their own research results. |
|
Other bias |
High risk |
p-values were infrequently reported. Instead the authors reported “not significant”. So, it is unknown whether or not some results were borderline significant (<0.05<p<0.10). |
|
Overall risk of bias: very serious risk of bias for all outcome measures (GRADE: rate down by two levels for very serious risk of bias). |
||
Methodologische beoordeling niet-gerandomiseerde studies
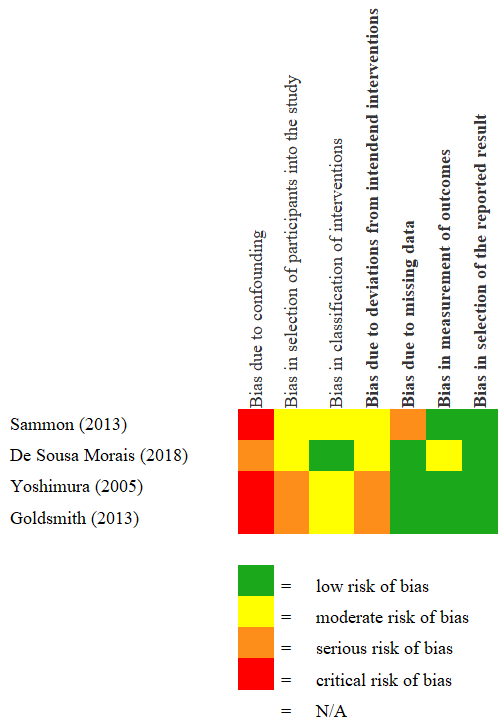
Onderstaande beoordeling is beschikbaar gesteld door de 1e auteur van de review (Saskia Weltings).
Toelichting: Beoordeling met ROBINS-I veronderstelt dat de niet-gerandomiseerde studies een gerandomiseerde studie nabootsen. Voor de toepassing van GRADE betekent dit dat niet gestart wordt met lage maar met hoge kwaliteit van bewijs. Volgens de GRADE working group betekent dit echter dat in de praktijk veelvuldig zal worden afgewaardeerd tot lage kwaliteit van bewijs vanwege confounding (d.w.z. geen balans tussen prognostische factoren in interventie- en controlegroep) en selectiebias (Schünemann et al., 2018).
Onderstaande beoordeling bevestigt dit gezien het veelvuldig voorkomen van ‘critical risk’ in het domein bias due to confouding en serious risk in het domein selectie bias.
De “klassieke” GRADE-benadering die in de hiervoor gepresenteerde literatuursamenvatting en -beoordeling is gehanteerd -observationele studies starten als lage kwaliteit van bewijs- leidt dus tot dezelfde eindbeoordeling van de risk of bias.
ROBINS-l
|
Uit Pearle et al., 1998 (Results section, p. 1263) |
Uit Rammohan et al., 2015 (Results section, p. 3146 |
|
“When the patient was questioned about generalized back or bladder pain during or immediately after the procedure (when awake enough to answer appropriately), only back pain was perceived to be greater in the percutaneous nephrostomy compared with the retrograde ureteral catheterization group (37.2 versus 6.5 on a scale of 0 to 100, where 100 is the worst pain imaginable, p<0.05). General anesthesia in the retrograde ureteral catheterization group undoubtedly contributed to decreased pain during the procedure. There was no significant difference in the duration of pain medication used after the procedure between the 2 groups (2.1 days in the percutaneous nephrostomy versus 1.5 in the retrograde ureteral catheterization group, p = 0.83). |
When the patient was questioned about generalized back pain or bladder pain during or immediately after the procedure (when awake enough to answer appropriately), only back pain was perceived to be greater in the percutaneous nephrostomy compared with the double j stenting (37.2 versus 6.5 on a scale of 0 to 100, where 100 is the worst pain imaginable, p < 0.05). There was no significant difference in the duration of pain medication used after the procedure between the 2 groups (2.1 days in the percutaneous nephrostomy versus 1.5 in the double J stenting group (p = 0.83). |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-02-2020
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van de revisie is het ontwikkelen van een up-to-date multidisciplinaire richtlijn voor volwassen patiënten met een urineweginfectie om daarmee de zorg voor deze patiënten in Nederland te optimaliseren.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met urineweginfecties in de tweede lijn, zoals urologen, internisten, klinisch geriaters, en artsen-microbioloog. Voor patiënten is aparte informatie beschikbaar.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor volwassen patiënten met urineweginfecties in de tweede lijn.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Dr. E.P. van Haarst (voorzitter), uroloog, OLVG, Amsterdam; NVU
- Mw. drs. A.M.J. Bootsma, uroloog, Treant zorggroep , Emmen; NVU
- Dr. F.H. Jansen, uroloog, Tegooi Ziekenhuis, Hilversum; NVU
- Dr. E.L. Koldewijn, uroloog, Catharina ziekenhuis, Eindhoven; NVU
- Mw. drs. L.C. Gerbrandy-Schreuders, uroloog, Amsterdam UMC & Bergman Clinics Vrouwenzorg, Amsterdam; NVU
- Mw. dr. B.M.A. Schout, uroloog, Alrijne ziekenhuis, Leiden/Leiderdorp; NVU
- Drs. O.J.D. Snieders, uroloog, St. Antonius Ziekenhuis/ Diakonessenhuis, Utrecht; NVU
- Dr. G.J. van der Wielen, uroloog, Haaglanden MC, Den Haag; NVU
- Dr. A.P. van Dam, arts-microbioloog, Academisch Medisch Centrum, Amsterdam; NVMM
- Mw. dr. M.C. Faes, klinisch geriater, Amphia Ziekenhuis, Breda; NVKG
- Mw. dr. J.E. Stalenhoef, internist-infectioloog, OLVG, Amsterdam; NIV
- Mw. dr. T.N. Platteel, huisarts, Nijmegen; NHG
- Mw. K. Spijkers; Patiëntenfederatie Nederland
Meelezer:
- Prof. dr. J.P. Roovers, Amsterdam UMC & Bergman Clinics Vrouwenzorg, Amsterdam; NVOG
Met ondersteuning van:
- Mw. drs. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Urologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Ernst van Haarst |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Flip Jansen |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Evert Koldewijn |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Lara Gerbrandy-Schreuders |
uroloog |
|
nee |
nee |
nee |
nee |
nee |
|
Barbara Schout |
uroloog |
|
nee |
nee |
Ik probeer financiën te werven voor onderzoek naar urinesteenbehande-lingen. Vooralsnog nog niets hiervan kunnen regelen. Dit heeft geen conflict met de richtlijn urineweginfecties. |
nee |
nee |
|
Jikke Bootsma |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Gerard van der Wielen |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Okke Snieders |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
A.P. van Dam |
arts-microbioloog |
|
nee |
nee |
Onderzoek naar de waarde van diagnostiek op Mycoplasma genitalium, gefinancierd door GGD Amsterdam en door de firma Hologic (in de vorm van testkits). Het betreffende onderzoek gaat niet over urineweginfecties. |
Zowel ikzelf als de organisaties waar ik voor werk zullen gebaat zijn bij een succesvol en inhoudelijk goed advies. Dit is onafhankelijk van bepaalde specifieke uitkomsten van het advies. |
nee |
|
Janneke Stalenhoef |
internist-infectioloog |
geen |
geen |
geen |
geen |
Ik werk aan onderzoek op het gebied van urineweginfecties (pyelonefritis en recidiverende urineweginfecties), maar zie zelf geen intellectueel gewin of erkenning bij deelname aan deze commissie. |
geen |
|
Tamara Platteel |
huisarts (o.a. weten-schappelijk medewerker NHG) |
|
geen |
geen |
geen |
geen |
geen |
|
Klaartje Spijkers |
senior projectmanager Patiëntenfederatie Nederland |
|
nee |
nee |
nee |
Voorzitter van Stichting Samen voor Duchenne |
nee |
|
Miriam Faes |
klinisch geriater |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van de Patiëntenfederatie Nederland. Ook tijdens de commentaarfase is de Patiëntenfederatie Nederland gevraagd om input.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het implementatieplan).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Patiëntenfederatie Nederland, Nederlands Huisartsen Genootschap, Nederlandse Vereniging voor Kindergeneeskunde, Verenso en Zorgverzekeraars Nederland.
Tegelijkertijd werd de herziening van de volgende richtlijn opgestart: NHG-Standaard Urineweginfecties; SWAB richtlijn antimicrobiële therapie bij gecompliceerde urineweginfecties; Richtlijn urineweginfecties bij kinderen (NVK). Welke onderwerpen/knelpunten in welke richtlijn geadresseerd werden, hebben de verschillende richtlijnwerkgroepen onderling afgestemd.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Vanwege een beperking in financiering en tijd kon slechts een beperkt aantal knelpunten geanalyseerd worden. De werkgroep heeft een keuze gemaakt naar relevantie.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National guideline clearinghouse en Guidelines International Network. Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alleplausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Toelichting ten aanzien van de term “overwegen”: gebruik van de term “overwegen” – in het Angelsaksische taalgebied doorgaans aangeduid met de term “consider” - in de aanbevelingen geeft aan dat onzekerheid bestaat over de balans van effectiviteit versus bijwerkingen/complicaties en behandellast van alternatieve [optie A versus optie B] diagnostische of therapeutische interventies, en/of onzekerheid bestaat over andere factoren die van invloed kunnen zijn op een aanbeveling, zoals de aanvaardbaarheid van alternatieve diagnostische of therapeutische interventies voor patiënten, behandelaars en andere belanghebbenden. In geval van aanbevelingen met daarin de term “overwegen” zal de aanbevolen optie lang niet op alle patiënten van toepassing zijn en zal voor een deel van de patiënten, mede afhankelijk van hun waarden en voorkeuren, een alternatieve behandeling (met inbegrip van niet-behandelen) eerder in aanmerking komen”.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Search terms:
(("Urolithiasis"[Mesh] OR "urolithiasis"[tw] OR "urinary lithiasis"[tw] OR
"Nephrolithiasis"[tw] OR "Kidney Calculi"[tw] OR "Staghorn Calculi"[tw] OR
"Ureterolithiasis"[tw] OR "Ureteral Calculi"[tw] OR "Urinary Calculi"[tw] OR "Urinary
Bladder Calculi"[tw] OR "Kidney Stones"[tw] OR "Kidney Stone"[tw] OR "Renal
Stones"[tw] OR "Renal Stone"[tw] OR "Staghorn Stones"[tw] OR "Staghorn Stone"[tw]
OR "Ureteral Stones"[tw] OR "Ureteral Stone"[tw] OR "Urinary Stones"[tw] OR "Urinary
Stone"[tw] OR "Bladder Calculi"[tw] OR "Bladder Stones"[tw] OR "Bladder Stone"[tw]
OR "Kidney Calculus"[tw] OR "Staghorn Calculus"[tw] OR "Ureteral Calculus"[tw] OR
"Urinary Calculus"[tw] OR "Urinary Bladder Calculus"[tw] OR "Bladder Calculus"[tw])
AND ("Drainage"[Mesh:noexp] OR "drainage"[tw] OR drain*[tw] OR "Nephrostomy,
Percutaneous"[Mesh] OR "nephrostomy"[tw] OR nephrostom*[tw] OR
"Stents"[Mesh:NoExp] OR "stent"[tw] OR "stents"[tw] OR "stenting"[tw] OR
"decompression"[tw] OR "double j"[tw] OR "doublej"[tw] OR doublej*[tw]) AND
("intrinsic obstruction"[tw] OR "intrinsic obstructions"[tw] OR "Ureteral
Obstruction"[Mesh] OR "Ureteral Obstruction"[tw] OR "Ureteral Obstructions"[tw] OR
"Ureteropelvic obstruction"[tw] OR "Ureteropelvic obstructions"[tw] OR
"Hydronephrosis"[Mesh] OR "hydronephrosis"[tw] OR "renal dilatation"[tw] OR "kidney
dilatation"[tw] OR "renal dilation"[tw] OR "kidney dilation"[tw] OR "acute"[tw] OR
("obstruction"[tw] AND ("ureteral"[tw] OR ureteral*[tw] OR "ureteropelvic"[tw] OR
ureteropelvic*[tw]))) NOT (("Case Reports"[ptyp] OR "case report"[ti]) NOT ("Clinical
Study"[ptyp] OR "RCT"[ti] OR random*[ti])) NOT ("Animals"[mesh] NOT
"Humans"[mesh]) AND (english[la] OR dutch[la]))
Bron: Weltings et al. (2019)
Prisma flowdiagram
Bron: Weltings et al. (2019)
