Oraal antibioticum bij transrectale prostaatbiopten
Uitgangsvraag
Wat is het optimale orale antibioticum als profylaxe bij transrectale prostaatbiopten?
Aanbeveling
Geef altijd eenmalige antibioticum profylaxe bij transrectale prostaatbiopten.
Overweeg het antibiogram van een rectale kweek als leidraad te houden voor de antibiotische profylaxe.
Geef een fluoroquinolon als profylaxe indien het antibiogram van een rectale kweek niet beschikbaar is.
In het geval van een rectale kweek
- Kies bij aanwezigheid van voor fluorquinolonen resistente Enterobacteriaceae een alternatief antibioticum op basis van het antibiogram. Kies dan bij voorkeur cotrimoxazol.
Overwegingen
> Kwaliteit van bewijs
De algehele kwaliteit van bewijs is zeer laag, omdat de kwaliteit van bewijs van de kritieke uitkomstmaten sepsis en postbiopsie infecties zeer laag is.
> Waarden en voorkeuren
Niet van toepassing, omdat er geen keuzeoptie is.
> Kosten en middelen
Indien er overgegaan wordt op rectumkweken alvorens tot biopsie over te gaan zal dit leiden tot een kostenverhoging. Aan de andere kant kan dit ook weer leiden tot een kostenverlaging als dit leidt tot minder infecties en bijbehorende opnames. Er bestaan echter nog geen Nederlandse studies die deze uitkomstmaat hebben onderzocht.
> Professioneel perspectief
Op basis van de beschikbare evidence is er zeer beperkt bewijs dat het afnemen van rectale kweken leidt tot minder infectieuze complicaties na transrectale prostaatbiopten in vergelijking met standaard fluorquinolonen profylaxe. Volgens de meest recente NethMap gegevens ligt de resistentie van E.coli in Nederland voor fluorquinolonen rond de 22%. De in de studies genoemde prevalentie van fluoroquinolonen resistentie lijkt voor het grootste deel in dezelfde orde van grootte te liggen. Uit een Cochrane review uit 2011 blijkt dat een eenmalige gift van een fluorquinolon niet minder effectief is dan verlengde profylaxe.
Recent werd door de EAU geadviseerd om geen fluorquinolonen meer voor te schrijven gezien mogelijke nieuw ontdekte bijwerkingen op het vaatstelsel en de reeds bekende bijwerkingen als peesletsel en neuropathie. Hierin wordt echter niet gesproken over de duur van de profylaxe en het risico hierop. Aangezien de ernstige en blijvende complicaties als gevolg van het eenmalig gebruik van een fluorquinolon als profylaxe extreem zelden lijken te ontstaan en fluorquinolonen het meest effectieve middel zijn ter voorkoming van infectieuze complicaties na transrectale biopten volgt deze richtlijn het advies van de SWAB om het eenmalig profylactisch gebruik van een fluorquinolon wel toe te staan.
> Aanvaardbaarheid en haalbaarheid van de aanbeveling(en)
Onderstaande aanbevelingen zijn haalbaar en aanvaardbaar voor de belangrijkste stakeholders omdat zij grotendeels aansluiten bij de huidige klinische praktijk.
> Balans van gewenste en ongewenste effecten
Gezien de zeer lage grade van evidence valt niet goed in te schatten hoe de balans van gewenste en ongewenste effecten zal uitvallen.
Rationale van de aanbeveling(en)
Leidend bij het opstellen van de aanbevelingen is het feit dat de evidence dat gerichte antibioticaprofylaxe op basis van rectale kweken tot minder infectieuze complicaties leidt, beperkt is; de fluoroquinolonen resistentie in Nederland momenteel nog relatief laag is; en dat ernstige en blijvende complicaties van fluoroquinolonen zeldzaam zijn.
Onderbouwing
Achtergrond
Bij het afnemen van transrectale prostaatbiopten worden kleine perforaties in de rectale mucosa gemaakt om het prostaatweefsel te kunnen afnemen. Door de aanwezigheid van darmbacteriën gaat dit onderzoek gepaard met een verhoogde kans op infectieuze complicaties. In Nederland ontwikkelen na het afnemen van transrectale biopten jaarlijks naar schatting 1100 patiënten koorts. Om dit te voorkomen wordt voor het nemen van prostaatbiopten antibiotische profylaxe gestart. Hoewel het gebruik van antibiotische profylaxe wijdverbreid is, heerst over de duur, het startmoment en de keuze van het antibioticum grote onduidelijkheid.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Sepsis Er zijn aanwijzingen dat gerichte antibioticaprofylaxe geassocieerd is met klinisch relevant minder sepsis gevallen in vergelijking met standaard fluorquinolone profylaxe bij mannen die een transrectale prostaatbiopsie ondergaan.
Bron: Dai et al., 2015; Duplessis et al., 2012; Suwantarat et al., 2013; Taylor et al., 2012; Farrell et al., 2015; Elshal et al., 2018; Farrell et al., 2017; Ryu et al., 2016 |
|
Zeer laag GRADE |
Totaal aantal postbiopsie infecties
Gerichte antibioticaprofylaxe lijkt een klinisch relevant gunstig effect te hebben op de reductie van postbiopsie infecties in vergelijking met standaard fluorquinolone profylaxe bij mannen die een transrectale prostaatbiopsie ondergaan.
Bron: Dai et al., 2015; Duplessis et al., 2012; Suwantarat et al., 2013; Taylor et al., 2012; Farrell et al., 2015; Boeri et al., 2017; Elshal et al., 2018; Summers et al., 2015; Ryu et al., 2016 |
|
__ |
Kosten Er werden geen Nederlandse studies geïdentificeerd die deze uitkomstmaat hebben onderzocht. |
Samenvatting literatuur
Review over antibiotische profylaxe gekozen op basis van de gevoeligheid van de micro-organismen in een rectumswab vergeleken met standaard fluoroquinolone profylaxe
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie zie de evidence tabellen.
Onderzoeksdesign
Eén onderzoek is een RCT (Elshal et al., 2018); negen studies betreffen observationele cohortstudies (zie tabel hieronder).
Tabel 2 Overzicht onderzoeksdesign
|
Onderzoeksdesign |
Aantal studies |
|
Gerandomiseerde gecontroleerde trial (RCT) |
1 studie (Elshal et al., 2018) |
|
Prospectief cohortonderzoek |
3 studies (Suwantarat et al., 2013; Taylor et al., 2012; Farrell et al., 2017) |
|
Prospectief cohort onderzoek met historische controlegroep |
2studies (Duplessis et al., 2012; Summers et al., 2015) |
|
Retrospectief cohortonderzoek |
4 studies (Dai et al., 2015; Farrell et al., 2015; Boeri et al., 2017; Ryu et al., 2016) |
Studiepopulaties
De studies onderzochten mannelijke patiënten die een transrectale prostaatbiopsie ondergingen.
Tabel 3 Overzicht van prevalentie fluoroquinolone resistentie
|
|
Prevalentie van Fluoroquinolone resistentie |
|
Dai 2015 |
12,7% |
|
Duplessis 2012 |
13,6% |
|
Suwantarat 2013 |
13,2% |
|
Taylor 2012 |
19,6% |
|
Farrell 2015 |
17,5% |
|
Summers 2015 |
14% |
|
Farrell 2017 |
12,5% |
|
Ryu 2016 |
28,8% |
|
Boeri 2017 |
23,5% |
|
Elshal 2018 |
83,2% |
Interventies
De studies onderzochten het effect van gerichte antibiotische profylaxe op basis van gevoeligheid van micro-organismen in een rectumswab. Patiënten in de controlegroep kregen standaard fluoroquinolone profylaxe.
Sepsis
Acht studies onderzochten deze uitkomstmaat. Pooling van de acht studies liet een 52% reductie in sepsis zien ten voordele van de groep gerichte antibioticaprofylaxe: relatief risico (RR) 0,48; 95% betrouwbaarheidsinterval (BI) 0,19 tot 1,21 (zie figuur hieronder). 52% reductie is de beste schatting van het effect van gerichte antibioticaprofylaxe. De bovengrens (RR: 1,21) van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een gunstig effect van de empirische fluorquinoloneprofylaxe uit te sluiten.
In absolute termen geformuleerd: een absolute reductie van 7 per 1000 (95% BI: -0.011; +0.003) is de beste schatting van het effect van gerichte antibioticaprofylaxe. De bovengrens (+3 per 1000) van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een gunstig effect van fluorquinoloneprofylaxe uit te sluiten.
Op te merken valt dat het RCT van Elshal et al. (2018) een gunstig effect liet zien in het voordeel van de standaard fluorquinolone groep (statistisch niet significant). Dit is buiten verwachting, zeker omwille van het feit dat de resistentie tegen fluoroquiolones in deze studie zeer hoog was (83,2%).
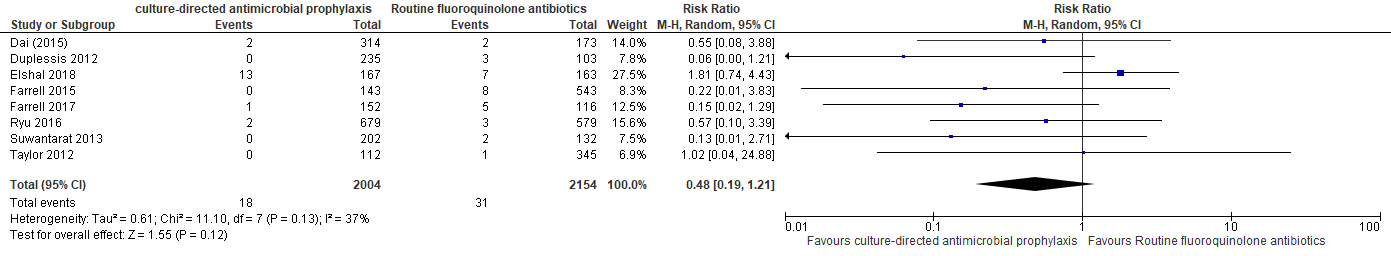
Ter info: sensitiviteitsanalyse laat zien dat het gepoolde resultaat van de observationele studies (zonder het RCT van Elshal 2018) RR 0,31 (95% BI: 0,13 tot 0,75) is.
Totaal aantal postbiopsie infecties
Negen studies onderzochten deze uitkomstmaat. Pooling van de negen studies liet een 64% reductie in het aantal postbiopsie infecties zien ten voordele van de groep gerichte antibioticaprofylaxe, met een spreiding van maximaal 81% reductie en minimaal 31% reductie: RR 0,36; 95% BI 0,19 tot 0,69 (zie figuur hieronder).
In absolute termen betekent dat dat het aantal postbiopsie infecties daalt van 40 per 1000 naar 14 per 1000 wanneer men gerichte antibiotische profylaxe krijgt in plaats van standaard fluorquinoloneprofylaxe. Het 95% BI geeft aan dat gerichte antibioticaprofylaxe in het beste geval het aantal postbiopsie infecties terugbrengt van 40 per 1000 naar 8 per 1000, en in het slechtste geval van 40 per 1000 naar 28 per 1000.
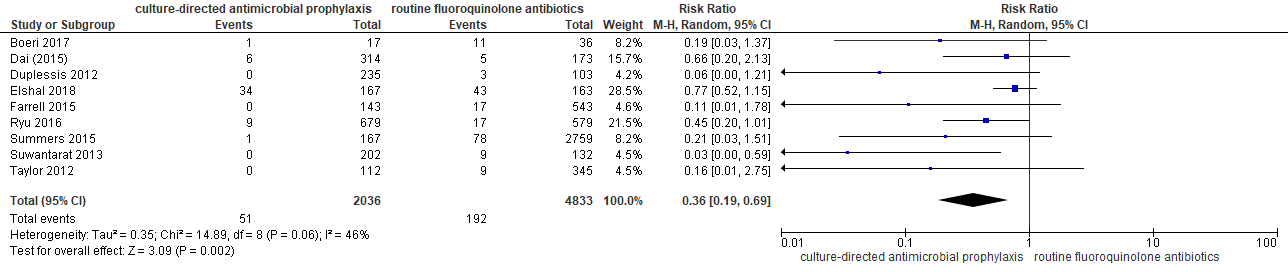
Kwaliteit van bewijs
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies starten gerandomiseerde onderzoeken in de categorie hoog en observationele studies in de categorie laag.
Sepsis
Vanwege het observationele karakter van negen van de tien onderzoeken start de kwaliteit van bewijs laag (slechts 330 van de 4158 patiënten komen uit gerandomiseerd onderzoek). De kwaliteit van bewijs werd verlaagd van laag naar zeer laag vanwege het brede betrouwbaarheidsinterval (imprecisie).
Totaal aantal postbiopsie infecties
Vanwege het observationele karakter van negen van de tien onderzoeken start de kwaliteit van bewijs voor alle uitkomstmaten laag (slechts 330 van de 6869 patiënten komen uit gerandomiseerd onderzoek). Er is sprake van matige statische heterogeniteit (chi-kwadraat 46%) en het is onzeker of er beperkingen in onderzoeksopzet en uitvoering zijn (zie de evidence tabellen). De werkgroep heeft echter de kwaliteit van bewijs om die redenen niet verlaagd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische literatuuranalyse verricht met de volgende PICO-vraagstelling:
Wat is het effect van antibiotische profylaxe gekozen op basis van gevoeligheid van micro-organismen in een rectumswab vergeleken met standaard fluoroquinolone profylaxe op de uitkomstmaten in onderstaande tabel 1 bij mannen die een transrectaal prostaatbiopt ondergaan?
In de databases Medline (OVID), Embase and Cochrane is een overkoepelende, systematische search verricht voor de PICO-vraagstelling. De search is niet beperkt in jaren of in talen (zie de zoekverantwoording).
Tabel 1 Inclusie- en selectiecriteria PICO 1
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Control |
standaard fluoroquinolone profylaxe |
|
Type uitkomstmaten |
Effectiviteit
Kosten
|
|
Type setting |
|
|
Exclusiecriteria |
|
Selectie:
Systematic review van Cussons (2016)
Uitgangspunt bij de selectie van de artikelen was de search strategie van de systematic review van Cussons (2016). Hierin waren negen studies geïncludeerd (Dai et al., 2015; Duplessis et al., 2012; Suwantarat et al., 2013; Taylor et al., 2012; Aradas et al., 2015; Caskurlu et al., 2015; Trujillo et al., 2015; Farrell et al., 2015; Cook et al., 2015). De werkgroepleden besloten van deze negen artikelen vier artikelen toch niet mee te nemen in de literatuuranalyse om de volgende redenen: twee artikelen waren alleen congres abstracts (Aradas et al., 2015; Caskurlu et al., 2015); en bij twee studies kregen patiënten in de controlegroep naast fluoroquinolonen ook nog andere antibiotica (Trujillo et al., 2016; Cook et al., 2015).
Ter info: aanvankelijk dacht de werkgroep om de review van Cusson (2016) mee te nemen in de literatuuranalyse om deze, zo mogelijk, met recenter studies te updaten. Omdat bij nader inzicht deze review echter niet voldeed aan de vereiste AMSTAR criteria (onder andere geen risk of bias beoordeling), werd de review uiteindelijk toch niet meegenomen in de literatuuranalyse.
Literatuurzoekactie
De literatuurzoekactie leverde 327 treffers op. De werkgroepleden selecteerden op basis van titel en abstract tien artikelen (Roberts et al., 2014; Scott et al., 2018; Baldissera-Aradas et al., 2018; Boeri et al., 2017; Elshal et al., 2018; Fahmy et al., 2016; Ozgur et al., 2017; Yassein, A. and T. O. Davies; 2017; Yassein, A. et al., 2017; Szerkus et al., 2016). Na het lezen van de volledige artikelen werden hiervan uiteindelijk twee studies opgenomen in de literatuuranalyse (Boeri et al., 2017; Elshal et al., 2018). In de evidence tabellen staan de redenen van exclusie van de andere acht studies vermeld.
Referentiecheck
Referentie-check van de geëxcludeerde review van Scott (2018) leverde drie extra artikelen op (Summers et al., 2015; Farrell et al., 2017; Ryu et al., 2016).
Samengevat
Tien studies voldeden aan de selectiecriteria en werden opgenomen in de literatuuranalyse (Dai et al., 2015; Duplessis et al., 2012; Suwantarat et al., 2013; Taylor et al., 2012; Farrell et al., 2015; Boeri et al., 2017; Elshal et al., 2018; Summers et al., 2015; Farrell et al., 2017; Ryu et al., 2016).
Referenties
- Boeri, L., et al. Rectal Culture-Guided Targeted Antimicrobial Prophylaxis Reduces the Incidence of Post-Operative Infectious Complications in Men at High Risk for Infections Submitted to Transrectal Ultrasound Prostate Biopsy - Results of a Cross-Sectional Study. PLoS ONE [Electronic Resource] 2017; 12(1): e0170319.
- Cook I, Angel JB, Vera PL, Demos J, Preston D. Rectal swab testing before prostate biopsy: experience in a VA Medical Center urology practice. Prostate Cancer Prostatic Dis 2015; 18: 365–9
- Dai J, Leone A, Mermel L et al. Rectal swab culture-directed antimicrobial prophylaxis for prostate biopsy and risk of postprocedure infection: a cohort study. Urology 2015; 85: 8–14
- Duplessis CA, Bavaro M, Simons MP et al. Rectal cultures before transrectal ultrasound-guided prostate biopsy reduce post-prostatic biopsy infection rates. Urology 2012; 79: 556–61
- Elshal, A. M., et al. Chemoprophylaxis during transrectal prostate needle biopsy: critical analysis through randomized clinical trial. World journal of urology 2018; 36(11): 1845-1852.
- Farrell J, Salter C, Cullen J, Mordkin R, Joel A. Culture directed antibiotic prophylaxis reduces post-prostate biopsy infectious complications in the community: a “how-to” for urologists in the trenches. Urol Pract 2015; 2: 166–71
- Farrell JJ, Hicks JL, Wallace SE, Seftel AD. Impact of preoperative screening for rectal colonization with fluoroquinolone-resistant enteric bacteria on the incidence of sepsis following transrectal ultrasound guided prostate biopsy. Res Rep Urol. 2017 Feb 24;9:37-41.
- Ryu JW, Jung SI, Ahn JH, Hwang EC, Yu HS, Kang TW, Kwon DD, Park K, Kim JW. Povidone-iodine rectal cleansing and targeted antimicrobial prophylaxis using rectal swab cultures in men undergoing transrectal ultrasound-guided prostate biopsy are associated with reduced incidence of postoperative infectious complications. Int Urol Nephrol. 2016 Nov; 8(11):1763-1770.
- Summers SJ, Patel DP, Hamilton BD, Presson AP, Fisher MA, Lowrance WT, Southwick AW. An antimicrobial prophylaxis protocol using rectal swab cultures for transrectal prostate biopsy. World J Urol 2015; 33:2001–2007
- Suwantarat N, Dumford DM 3rd, Ponce-Terashima R et al. Modification of antimicrobial prophylaxis based on rectal culture results to prevent fluoroquinolone-resistant Escherichia coli infections after prostate biopsy. Infect Control Hosp Epidemiol 2013; 34: 973–6
- Taylor AK, Zembower TR, Nadler RB et al. Targeted antimicrobial prophylaxis using rectal swab cultures in men undergoing transrectal ultrasound guided prostate biopsy is associated with reduced incidence of postoperative infectious complications and cost of care. J Urol 2012; 187: 1275–9
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Dai 2015 |
Type of study: Retrospective cohort
Location: Washington, USA; Rhode Island, USA
Source of funding: The authors declare that they have no relevant financial interests. |
Inclusion criteria: All men receiving prostate biopsies from February 2013 to February 2014
Exclusion criteria: prisoner status or unavailable medical records
N total at baseline: 487 Intervention: 314 Control: 173
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (typically < 1 month before prostate biopsy)
Most received TMP-SMX, some received ampicillin/clavulanic acid, cephalexin, gentamicin, cefadroxil. No doses reported.
Note: 65% of patients received supplemental IM gentamicin at time of biopsy
|
Routine fluoroquinolone antibiotics: Ciprofloxacin 500 mg taken for three doses preoperatively
Note: 32% of patients received supplemental IM gentamicin at time of biopsy
|
Length of follow-up: 30 days
Loss-to-follow-up: Not reported
|
Infectious complications requiring antibiotic treatment:
Postbiopsy infections without sepsis: I: 4/314 C: 3/173
Sepsis: I: 2/314 C: 2/173
Overall postbiopsy infections: I: 6/314 C: 5/173 |
FQ-R prevalence rate: 12,7% (40/314)
Some urologists within the practice also routinely supplement this with 80 mg of intramuscular (IM) gentamicin given just before biopsy. |
|
Duplessis 2012 |
Type of study: Prospective cohort with historical control group
Location: Califormia, USA
Source of funding: Unknown |
Inclusion criteria: From May 2010 to March 2011, all male patients (no age restrictions) undergoing TRUS-guided biopsy
Exclusion criteria: Not reported
N total at baseline: 338 Intervention: 235 Control: 103
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis
Ceftriaxone (1 g i.v. or i.m. given pre-procedure), gentamicin (3 mg/kg i.v. or i.m. given pre-procedure), cefpodoxime (500 mg), or TMP-SMX (1 double-strength tablet), all given for 3 days perioperat ively |
Routine fluoroquinolone antibiotics: Ciprofloxacin 500 mg taken for three days starting 1 day before biopsy
|
Length of follow-up: 7 days
Loss-to-follow-up: Not reported
|
Infectious complications post prostatic-biopsy including sepsis, bacteremia, urinary tract infections, pyelonephritis, prostatitis,and fever.
Postbiopsy infections without sepsis: I: 0/235 C: 0/103
Sepsis: I: 0/235 C: 3/103
Overall postbiopsy infections: I: 0/235 C: 3/103
|
FQ-R prevalence rate: 13,6% (32/235) |
|
Suwantarat 2013 |
Type of study: Prospective cohort
Location: Ohio, USA
Source of funding: All authors report no conflicts of interest relevant to this article. All authors submitted the ICMJE Form for Disclosure of Potential Conflicts of Interest, and the conflicts that the editors consider relevant to this article are disclosed here. |
Inclusion criteria: All men receiving prostate biopsies from July 2011–Dec 2012
Exclusion criteria: Not reported
N total at baseline: 334 Intervention: 202 Control: 132
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (typically < 1 month before prostate biopsy)
Cephalosporins, TMP-SMX, intramuscular gentamicin. No doses reported. 9 months into the study, a modification was made and patients with FQ-R received CIP in addition to their targeted antibiotics |
Routine fluoroquinolone antibiotics: Ciprofoxacin (no dose reported) for 3 days starting 1 day before biopsy |
Length of follow-up: Not reported
Loss-to-follow-up: Not reported
|
UTI was defined as a positive urine culture plus signs or symptoms of UTI. Bloodstream infection was defined as a positive blood culture and signs of systemic infection.
Postbiopsy infections without sepsis: I: 0/202 C: 7/132
Sepsis: I: 0/202 C: 2/132
Overall postbiopsy infections: I: 0/202 C: 9/132
|
FQ-R prevalence rate: 13,2% (44/334) |
|
Taylor 2012
|
Type of study: Prospective cohort
Location: Illinois, USE
Source of funding: The authers had financial interest and/or other relationship with Astellas Pharma U.S. and Baylor Health Care System. |
Inclusion criteria: From May 2010 to March 2011, all male patients undergoing TRUS-guided biopsy
Exclusion criteria: Not reported
N total at baseline: 457 Intervention: 112 Control: 345
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (preferably at least 5 to 7 days before the biopsy
TMP-SMX or cephalosporins. No doses |
Routine fluoroquinolone antibiotics: Ciprofloxacin 500 mg 2 h before and 12 h after biopsy
|
Length of follow-up: 30 days
Loss-to-follow-up: Not reported
|
Infectious complications examined included postoperative fever greater than 38.5C, UTI, pyelonephritis, prostatitis, bacteremia and systemic inflammatory response syndrome, as well as sepsis and death defined by standard diagnostic criteria
Postbiopsy infections without sepsis: I:0/112 C: 8/345
Sepsis: I: 0/112 C: 1/345
Overall postbiopsy infections: I: 0/112 C: 9/345
|
FQ-R prevalence rate: 19,6% (22/112) |
|
Farrell 2015 |
Type of study: Retropsective cohort
Location: Washington, USA
Source of funding: No direct or indirect financial incentive associated with publishing this article. |
Inclusion criteria: 686 consecutive patients who underwent TRUS guided prostate biopsy from March 2010 through April 2013.
Exclusion criteria: Not reported
N total at baseline: 686 Intervention: 143 Control: 543
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (preferably at least 3 weeks before the biopsy).
3-day oral regimen of TMP-SMX 160–800 mg twice daily, or 3-day oral regimen of CFDN 600 mg once daily. If Augmentin was the only effective oral antibiotic, double antibiotic coverage was given with ceftriaxone, ertapenem or an aminoglycoside administered once within an hour of biopsy |
Routine fluoroquinolone antibiotics: Levofloxacin 500 mg daily or ciprofloxacin 500 mg twice daily the day before, day of and day after biopsy. |
Length of follow-up: 4 weeks after biopsy
Loss-to-follow-up: Not reported
|
Postbiopsy infections without sepsis: I: 0/143 C: 9/543
Sepsis: I: 0/143 C: 8/543
Overall postbiopsy infections: I: 0/143 C: 17/543 |
FQ-R prevalence rate: 17,5% (25/143) |
|
Summers 2015 |
Type of study: Prospective cohort with historical control
Location: Salt Lake City, Utah, USA
Source of funding: The authors declare that they have no conflict of interest |
Inclusion criteria: Prospective cohort: adult men undergoing TRUS prostate biopsy between June 1, 2013, and June 1, 2014
Historical control:
Exclusion criteria:
N total at baseline: Intervention: 167 participated (185 enrolled) Control: 2759
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (1-4 weeks before the biopsy).
See control. Antimicrobial prophylaxis in FQ-resistant men was at the direction of the clinician in accordance with AUA guidelines and local resistance patterns |
Routine fluoroquinolone antibiotics: Cipofoxacin 500 mg 1 h prior to procedure, and 500 mg twice daily for 3 days following the procedure.
Note: although empiric prophylaxis varied between providers, most patients received FQ monotherapy for 1–3 days. |
Length of follow-up: 30 days
Loss-to-follow-up: Not reported
|
Infectious complications included
Postbiopsy infections without sepsis: Not reported
Sepsis: Not reported
Overall postbiopsy infections: I: 1/167 C: 78/2759
Note: patients who received targeted prophylaxis had fewer infectious complications (1.9 vs. 2.9 % p > 0.05) and decreased odds of infection (OR 0.70; 95 % CI 0.2–2.5) on multivariate analysis, although the results did not achieve statistical significance. |
FQ-R prevalence rate: 14% (23/167) |
|
Farrell 2017
|
Type of study: Prospective, nonrandomized, controlled study
Location: Illinois, USA
Source of funding: The authors report no conflicts of interest in this work. |
Inclusion criteria: All patients scheduled for transrectal ultrasound-guided prostate biopsy
Exclusion criteria: Patients already receiving antibiotic treatment (eg, patients with suspected prostatitis or patients with urinary tract infections); immunocompromised patients, patients on chemotherapy for treatment of malignancy, patients with HIV infection, and patients with a history of allergic or adverse reactions to fluoroquinolone antibiotics
N total at baseline: 268 Intervention: 152 Control: 116 |
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (1-4 weeks before the biopsy).
See control. Antimicrobial prophylaxis in FQ-resistant men was:
|
Routine fluoroquinolone antibiotics: ciprofloxacin 500 mg by mouth twice daily beginning 1 day prior to TRUPB and then for 6 days following TRUPB. |
Length of follow-up: 6 weeks
Loss-to-follow-up: 1 patient in the intervention group
|
Sepsis: Sepsis: inpatient hospitalization with evidence of infection within 30 days of TRUPB based on a positive blood culture or fever (T>38°C /100.4°F) plus one of the following: tachycardia (heart rate > 90 bpm), abnormal white blood cell (WBC) count (WBC<4,000 or >12,000 cells/mm3), or a positive urine culture. I: 1/152 C: 5/116
|
FQ-R prevalence rate: 12,5% (19/152) |
|
Ryu 2016 |
Type of study: Retrospective cohort
Location: South-Korea
Source of funding: The authors declare that they have no conflicts of interest. |
Inclusion criteria: All patients who underwent prostate biopsy at our institution from January 2011 to December 2015.
Exclusion criteria: Not reported
N total at baseline: 1258 Intervention: 679 Control: 579 |
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (within 2 weeks before the biopsy).
See control. Antimicrobial prophylaxis in FQ-resistant men was third-generation cephalosporin or aminoglycoside for three or more days.
Note: rectal cleansing with povidone-iodine was performed immediately before TRUSPB |
Routine fluoroquinolone antibiotics: Fluoroquinolone for three or more days
Note: rectal cleansing with povidone-iodine was performed immediately before TRUSPB |
Length of follow-up: 4 weeks
Loss-to-follow-up: Unclear
|
Post-biopsy infectious complications included fever (37.8 °C), febrile UTI, acute prostatitis, and bacteremia and sepsis within 30 d after the procedure.
Postbiopsy infections without sepsis: I: 7/679 C: 14/579
Sepsis: I: 2/679 C: 3/579
Overall postbiopsy infections: I: 9/679 C: 17/579 |
FQ-R prevalence rate: 28,8% (196/679)
|
|
Boeri 2017 |
Type of study: Retrospective cohort (cross-sectional study)
Location: Canada
Source of funding: The authors received no specific funding for this work. The authors have declared that no competing interests exist. |
Inclusion criteria: Consecutive white-European individuals submitted to prostate biopsy for the suspicion of PCa between October 2015 and May 2016 at a single academic clinic. Inclusion criteria were the presence of one or more known risk factors for PTICs: zie table* below
Exclusion criteria: Dipstick urinalysis: nitrite positive, leukocyte esterase-positive
N total at baseline: 53 Intervention: 17 Control: 36 |
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (within 10 days before the biopsy).
See control. Antimicrobial prophylaxis in FQ-resistant men was rectal swab culture-based prophylaxis
|
Routine fluoroquinolone antibiotics: 500mg ciprofloxacin 2 hours before and 12 hours after the procedure |
Length of follow-up: 30 days
Loss-to-follow-up: Not reported
|
Post-biopsy infectious complications included postoperative fever >38oC, UTIs, prostatitis, bacteremia and sepsis.
Overall postbiopsy infections: I: 1/17 C: 11/36
|
FQ-R prevalence rate: 23,5% (4/17)
|
|
Elshal 2018 |
Type of study: Randomized controlled trial
Location: Egypt
Source of funding: The authors declare that they have no competing interests. |
Inclusion criteria: Men undergoing transrectal ultrasound-guided prostate biopsy between April/2015 and January/2017
Exclusion criteria: Serum creatinine > 1.6 mg/dl, known antibiotics hypersensitivity and uncontrolled diabetes mellitus (DM), or on steroid or immunosuppressive treatment.
N total at baseline: Intervention: Control:
|
Preprocedural rectal swab and culture-directed antimicrobial prophylaxis (2 weeks prior to biopsy)
See control. Antimicrobial prophylaxis in FQ-resistant men was given just before biopty according to rectal swab culture. |
Routine fluoroquinolone antibiotics: Ciprofloxacin 3 days 500 mg B.I.D 3 days starting the night prior to biopsy (standard prophylaxis) |
Length of follow-up: 2 weeks: patients were invited for post-TRUSPB visit after 2 weeks (planned visit). Patients were instructed to come back to the hospital for any fever or to call to report any events (unplanned visit).
Loss-to-follow-up: I: n=0 C: n=3 (did not receive allocated intervention (Hypersensitivity) |
Post-biopsy infectious complications included simple UTI, febrile UTI or sepsis.
Postbiopsy infections without sepsis: I: 21/167 C: 36/163
Sepsis: I: 13/167 C: 7/163
Overall postbiopsy infections: I: 34/167 C: 43/163 |
FQ-R is defined as bacterial growth in spite of being cultured on MacConkey agar plate with 10 μg/ml ciprofloxacin.
FQ-R prevalence rate: 83,2% (139/167)
Conclusion: With increasing FQ-R, ciprofloxacin alone does not seem to be an optimal prophylactic approach. Augmented prophylaxis with single-dose gentamicin is an effective and practical approach. Targeted prophylaxis might be reserved for cases with contraindication to gentamicin. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Dai 2015 |
unclear |
unclear |
unclear |
unclear |
|
Duplessis 2012 |
unclear |
likely (1 week follow-up) |
unclear |
unclear |
|
Suwantarat 2013 |
unclear |
unclear |
unclear |
unclear |
|
Taylor 2012 |
unclear |
unclear |
unclear |
unclear |
|
Farrell 2015 |
unlikely (consecutive patients) |
unclear |
unclear |
unclear |
|
Summers 2015 |
unclear |
unclear |
unclear |
unclear |
|
Farrell 2017 |
unlikely |
unlikely |
unlikely |
unlikely (intention-to-treat analysis) |
|
Ryu 2016 |
unclear |
unclear |
unclear |
unclear |
|
Boeri 2017 |
unclear |
unclear |
unclear |
unclear |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Elshal 2018 |
Stratified blocked randomization was performed using computer-generated random tables. The presence of DM and pre-TRUSPB urinary catheter was used as criteria for stratification |
unlikely |
unlikely (objective outcomes) |
unlikely (objective outcomes) |
unlikely (objective outcomes) |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel exclusie na het lezen van het volledige artikel
|
Auteur |
Redenen van exclusie |
|
Aradas (2015) |
Abstract congres |
|
Baldissera-Aradas (2018) |
Spaans (Hans) |
|
Caskurlu (2015) |
Abstract congres |
|
Cook (2015) |
Empirische therapie bestond niet alleen uit quinolonen |
|
Cussans (2016) |
Exclusie, omdat de review niet voldoet aan AMSTAR criteria (geen risk of bias beoordeling) |
|
Fahmy (2016) |
Empirische therapie bestond uit ciprofloxacin and metronidazole. |
|
Ozgur (2017) |
Spaans |
|
Roberts (2014) |
Zie Scott |
|
Scott (2018) |
Systematic review: exclusie, omdat andere in- en exclusiecriteria gehanterd worden dan PICO 1 (in controlegroep kregen patiënten fluoroquinolones in combinatie met aanvullende empirische antibiotica) |
|
Szerkus (2016) |
Andere vraagstelling |
|
Trujillo (2016) |
Empirische therapie bestond uit ciprofloxacin in combinatie met andere antibiotica. Ter info: deze studie was als congres abstract in de review van Cussans (2016) geïncludeerd. |
|
Yassein I. (2017) |
Kosteneffectiviteit in Noord-Amerika |
|
Yassein, A. and T. O. Davies; 2017 (2017) |
Kosteneffectiviteit in Noord-Amerika |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-02-2020
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van de revisie is het ontwikkelen van een up-to-date multidisciplinaire richtlijn voor volwassen patiënten met een urineweginfectie om daarmee de zorg voor deze patiënten in Nederland te optimaliseren.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met urineweginfecties in de tweede lijn, zoals urologen, internisten, klinisch geriaters, en artsen-microbioloog. Voor patiënten is aparte informatie beschikbaar.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor volwassen patiënten met urineweginfecties in de tweede lijn.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Dr. E.P. van Haarst (voorzitter), uroloog, OLVG, Amsterdam; NVU
- Mw. drs. A.M.J. Bootsma, uroloog, Treant zorggroep , Emmen; NVU
- Dr. F.H. Jansen, uroloog, Tegooi Ziekenhuis, Hilversum; NVU
- Dr. E.L. Koldewijn, uroloog, Catharina ziekenhuis, Eindhoven; NVU
- Mw. drs. L.C. Gerbrandy-Schreuders, uroloog, Amsterdam UMC & Bergman Clinics Vrouwenzorg, Amsterdam; NVU
- Mw. dr. B.M.A. Schout, uroloog, Alrijne ziekenhuis, Leiden/Leiderdorp; NVU
- Drs. O.J.D. Snieders, uroloog, St. Antonius Ziekenhuis/ Diakonessenhuis, Utrecht; NVU
- Dr. G.J. van der Wielen, uroloog, Haaglanden MC, Den Haag; NVU
- Dr. A.P. van Dam, arts-microbioloog, Academisch Medisch Centrum, Amsterdam; NVMM
- Mw. dr. M.C. Faes, klinisch geriater, Amphia Ziekenhuis, Breda; NVKG
- Mw. dr. J.E. Stalenhoef, internist-infectioloog, OLVG, Amsterdam; NIV
- Mw. dr. T.N. Platteel, huisarts, Nijmegen; NHG
- Mw. K. Spijkers; Patiëntenfederatie Nederland
Meelezer:
- Prof. dr. J.P. Roovers, Amsterdam UMC & Bergman Clinics Vrouwenzorg, Amsterdam; NVOG
Met ondersteuning van:
- Mw. drs. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Urologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Ernst van Haarst |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Flip Jansen |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Evert Koldewijn |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Lara Gerbrandy-Schreuders |
uroloog |
|
nee |
nee |
nee |
nee |
nee |
|
Barbara Schout |
uroloog |
|
nee |
nee |
Ik probeer financiën te werven voor onderzoek naar urinesteenbehande-lingen. Vooralsnog nog niets hiervan kunnen regelen. Dit heeft geen conflict met de richtlijn urineweginfecties. |
nee |
nee |
|
Jikke Bootsma |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Gerard van der Wielen |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
Okke Snieders |
uroloog |
geen |
nee |
nee |
nee |
nee |
nee |
|
A.P. van Dam |
arts-microbioloog |
|
nee |
nee |
Onderzoek naar de waarde van diagnostiek op Mycoplasma genitalium, gefinancierd door GGD Amsterdam en door de firma Hologic (in de vorm van testkits). Het betreffende onderzoek gaat niet over urineweginfecties. |
Zowel ikzelf als de organisaties waar ik voor werk zullen gebaat zijn bij een succesvol en inhoudelijk goed advies. Dit is onafhankelijk van bepaalde specifieke uitkomsten van het advies. |
nee |
|
Janneke Stalenhoef |
internist-infectioloog |
geen |
geen |
geen |
geen |
Ik werk aan onderzoek op het gebied van urineweginfecties (pyelonefritis en recidiverende urineweginfecties), maar zie zelf geen intellectueel gewin of erkenning bij deelname aan deze commissie. |
geen |
|
Tamara Platteel |
huisarts (o.a. weten-schappelijk medewerker NHG) |
|
geen |
geen |
geen |
geen |
geen |
|
Klaartje Spijkers |
senior projectmanager Patiëntenfederatie Nederland |
|
nee |
nee |
nee |
Voorzitter van Stichting Samen voor Duchenne |
nee |
|
Miriam Faes |
klinisch geriater |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door een afgevaardigde van de Patiëntenfederatie Nederland. Ook tijdens de commentaarfase is de Patiëntenfederatie Nederland gevraagd om input.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het implementatieplan).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Patiëntenfederatie Nederland, Nederlands Huisartsen Genootschap, Nederlandse Vereniging voor Kindergeneeskunde, Verenso en Zorgverzekeraars Nederland.
Tegelijkertijd werd de herziening van de volgende richtlijn opgestart: NHG-Standaard Urineweginfecties; SWAB richtlijn antimicrobiële therapie bij gecompliceerde urineweginfecties; Richtlijn urineweginfecties bij kinderen (NVK). Welke onderwerpen/knelpunten in welke richtlijn geadresseerd werden, hebben de verschillende richtlijnwerkgroepen onderling afgestemd.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Vanwege een beperking in financiering en tijd kon slechts een beperkt aantal knelpunten geanalyseerd worden. De werkgroep heeft een keuze gemaakt naar relevantie.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National guideline clearinghouse en Guidelines International Network. Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alleplausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Toelichting ten aanzien van de term “overwegen”: gebruik van de term “overwegen” – in het Angelsaksische taalgebied doorgaans aangeduid met de term “consider” - in de aanbevelingen geeft aan dat onzekerheid bestaat over de balans van effectiviteit versus bijwerkingen/complicaties en behandellast van alternatieve [optie A versus optie B] diagnostische of therapeutische interventies, en/of onzekerheid bestaat over andere factoren die van invloed kunnen zijn op een aanbeveling, zoals de aanvaardbaarheid van alternatieve diagnostische of therapeutische interventies voor patiënten, behandelaars en andere belanghebbenden. In geval van aanbevelingen met daarin de term “overwegen” zal de aanbevolen optie lang niet op alle patiënten van toepassing zijn en zal voor een deel van de patiënten, mede afhankelijk van hun waarden en voorkeuren, een alternatieve behandeling (met inbegrip van niet-behandelen) eerder in aanmerking komen”.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
