Postoperatieve verwijdering blaaskatheder
Uitgangsvraag
Wanneer wordt een blaaskatheter postoperatief verwijderd?
Aanbeveling
Urethrotomie interna
Verwijder de blaaskatheter bij voorkeur binnen 3 dagen na een ongecompliceerde ingreep.
Urethraplastiek
Laat na een urethraplastiek de katheter maximaal 3 weken zitten.
Sluit naadlekkage uit met behulp van een urethrogram onder lage druk of een mictiecystourethrogram alvorens de katheter definitief uit te laten.
Leg het postoperatieve katheterbeleid vast in een protocol voor urethrachirurgie.
Overwegingen
Kwaliteit van bewijs
De kwaliteit van het bewijs is zeer laag voor zowel de gunstige effecten als voor de postoperatieve complicaties, deels vanwege beperkingen in opzet en uitvoering van de studies, deels omdat door de relatief kleine studieomvang alle geschatte effecten zeer onnauwkeurig (wijd betrouwbaarheidsinterval) zijn.
Ter informatie: de kwaliteit van bewijs is niet gerelateerd aan alle uitkomstmaten die de werkgroep voor de patiënt als relevant achtte (zie tabel 1), omdat een aantal niet zijn onderzocht.
Waarden en voorkeuren
Het is aannemelijk dat patiënten kiezen voor een zo kort mogelijke katheterisatieduur, omdat het hebben van een verblijfskatheter hinder kan veroorzaken.
Kosten en middelen
Het toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie geen effect hebben op de kosten, omdat de aanbevelingen al aansluiten bij de huidige praktijk.
Professioneel perspectief
Urethrotomie interna
Uit vergelijkende studies is gebleken dat het geen voordeel heeft de transurethrale katheter langer dan 3 dagen in situ te houden bij een verder ongecompliceerde procedure. Een langere katheterisatieduur geeft wel meer kans op een infectieuze complicaties (Nielsen et al, 1985; Hansen et al, 1984; Albers et al, 1996). Een verblijfskatheter niet langer als nodig te gebruiken is hiermee ook in lijn met de WIP-richtlijn “Preventie van infecties als gevolg van blaaskatheterisatie via de urethra” (2014).
Urethraplastiek
Er is slechts 1 vergelijkende studie over de optimale katheterisatieduur na urethraplastiek, en die heeft alleen betrekking op membraneuze urethrastricturen na een bekkentrauma. De richtlijncommissie heeft daarom besloten tot een expert opinion en is van mening dat de verblijfskatheter na een urethraplastiek voldoende lang in situ moet blijven om een goede genezing van de urethra mogelijk te maken. De lengte van de katheterisatieduur hangt af van het soort urethraplastiek (anastomotic repair versus graftplastiek) en van de ervaring van de operateur met deze ingreep. Een voldoende lange katheterisatieduur is maximaal 3 weken volgens de commissie. Ervaren operateurs kunnen ook kiezen voor een kortere katheterisatieduur.
Van groot belang vindt de commissie dat, voordat besloten wordt de katheter definitief te verwijderen, beeldvorming van de urethra wordt verricht (retrograad urethrogram onder lage druk of een mictiecysto-urethrografie) ter uitsluiting van lekkage van de anastomose(n) in de urethra. De richtlijncommissie acht het verstandig om een protocol te maken waarin de katheterisatieduur na een urethraplastiek is vastgelegd.
Aanvaardbaarheid van de aanbeveling(en)
Het willen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders, omdat dit aansluit bij de huidige praktijk.
Haalbaarheid van de te implementeren aanbeveling(en)
Het kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders, omdat dit aansluit bij de huidige praktijk.
Rationale van de aanbeveling(en)
Urethrotomie interna
Bij het opstellen van de aanbeveling is geen rekening gehouden met de conclusies van de systematic review, omdat er weinig vertrouwen is in de schatting van de effecten. . De richtlijncommissie heeft veel gewicht toegekend aan de ervaringen van experts, zoals die te vinden zijn in wetenschappelijke artikelen en leerboeken over urethrachirurgie, de wens van de patiënt en het grotere risico op het optreden van infectieuze complicaties bij een langere katheterisatieduur. Het opvolgen van de aanbevelingen is voor alle stakeholders haalbaar en aanvaardbaar.
Urethraplastiek
Bij het opstellen van de aanbeveling is geen rekening gehouden met de conclusies van de systematic review, omdat er het om een zeer specifieke patiëntencatagorie gaat (urethrastrictuur na bekkentrauma) en deze conclusies zich niet laten vertalen naar de situatie bij andere urethraplastieken. Verder heeft de commissie weinig vertrouwen in de schatting van de effecten van de sytematic review. De werkgroep heeft veel gewicht toegekend aan de ervaringen van experts, zoals die te vinden zijn in wetenschappelijke artikelen en leerboeken over urethrachirurgie , de ervaringen van de operateur en aan de wenselijkheid de procedure te standaardiseren en vast te leggen in een protocol. De richtlijncommissie acht de huidige bewijslast uit de literatuur te gering om nu al te kiezen voor een standaard kortere katheterisatieduur. Het opvolgen van de aanbevelingen is voor alle stakeholders haalbaar en aanvaardbaar.
Onderbouwing
Achtergrond
Er is onduidelijkheid over de duur van de katheterisatie na een urethrotomia interna en na een urethraplastiek. Landelijk blijkt er een grote variatie te zijn in de duur van de katheterisatie, variërend van kort (1-3 dagen) tot lang (2-4 weken) voor de urethrotomia interna en van 1 week tot 3 weken voor urethraplastieken. In deze module wordt uitgezocht wat de optimale katheterisatieduur is.
Definities
- Ongecompliceerde ingreep: dat is een ingreep waarbij geen complicaties optreden per- en postoperatief.
- Gecompliceerde ingreep: dat is een ingreep die gecompliceerd verloopt per en/of postoperatief.
- Mogelijke complicaties van een urethrotomia interna zijn: bloedingen in en om de urethra en haematomen (scrotaal, perineaal), infecties (blaasontsteking, urethrale infectie, epididymitis, urosepsis), perforatie van de urethra met fausse route en urinoom, urineretentie, urine-incontinentie door sfincterletsel.
- Mogelijke complicatie van een urethraplastiek zijn: bloedingen, infecties (blaasontsteking, urethrale infectie, wondinfecties, abces), urinoom door lekkage van de anastomose, fistelvorming, necrose van de graft, erectiestoornis, urine-incontinentie.
Conclusies / Summary of Findings
1) Bij patiënten die een interne urethrotomie (Sachse) ondergaan
|
zeer laag GRADE |
Patiënten die een interne urethrotomie ondergaan
Succes ingreep Na een interne urethrotomie lijkt een transurethale blaaskatheter voor de duur van 1 tot 3 dagen in vergelijking met een duur van 2 tot 4 weken, bij ten minste evenveel patiënten te resulteren in een geslaagde ingreep bij een follow-up van 6-12 maanden.
Maximale urineflow > 12ml/s Er lijkt geen verschil te zijn in het aantal patiënten met een maximale urineflow >12ml/s na een interne urethrotomie wanneer de blaaskatheter verwijderd werd 1 dag na de ingreep in vergelijking met 2 weken na de ingreep. Epididymitis, urineretentie en urethrale pijn met afscheiding uit penis Deze complicaties lijken na een interne urethroromie vaker op te treden wanneer de blaaskatheter pas 4 weken na de ingreep verwijderd wordt in vergelijking met 3 dagen na de ingreep.
Bron Nielsen et al, 1985; Hansen et al, 1984 |
|
̶ |
Patiënten die een interne urethrotomie ondergaan
Lekkage, ICI-Q male SF Er werden geen vergelijkende studies geïdentificeerd omtrent de duur van postoperatieve blaaskatheterisatie met deze effecten als uitkomstmaat.
Erectiele dysfunctie, incontinentie, bloeding, fistel, divertikel Er werden geen vergelijkende studies geïdentificeerd omtrent de duur van postoperatieve blaaskatheterisatie met deze postoperatieve complicaties als uitkomstmaat. |
2) Bij patiënten die een urethraplastiek ondergaan
Bij patiënten die een “anterior anastomotic” urethraplastiek ondergaan:
|
zeer laag GRADE |
Patiënten die een “anterior anastomotic” urethraplastiek ondergaan
Lekkage Het risico op lekkage lijkt klein wanneer een blaaskatheter 3 dagen na een “anterior anastomotic” urethraplastiek verwijderd wordt ten opzichte van na 8 dagen.
Uitblijven recidief Er lijkt geen verschil te zijn in het aantal recidieven urethrastrictuur wanneer een blaaskatheter 3 dagen na een “anterior anastomotic” urethraplastiek verwijderd wordt ten opzichte van na 8 dagen.
Bron Al-Qudah et al, 2005 |
|
zeer laag GRADE |
Patiënten die een “ventral buccal mucosal graft onlay” urethraplastiek ondergaan
Lekkage Er lijkt geen verschil te zijn in het risico op lekkage wanneer een blaaskatheter 7 dagen na een “ventral buccal mucosal graft onlay” urethraplastiek verwijderd wordt ten opzichte van na 12 dagen.
Uitblijven recidief Er lijkt geen verschil te zijn in het aantal recidieven urethrastrictuur wanneer een blaaskatheter 7 dagen na een “ventral buccal mucosal graft onlay” urethraplastiek verwijderd wordt ten opzichte van na 12 dagen.
Bron Al-Qudah et al, 2005 |
|
̶ |
Patienten die een anterior anastomotic” urethraplastiek of een “ventral buccal mucosal graft onlay” urethraplastiek ondergaan
Lange termijn effecten: Verbeteren urineflow, ICI-Q male SF Er werden geen vergelijkende studies geïdentificeerd omtrent de duur van postoperatieve blaaskatheterisatie met deze lange termijn effecten als uitkomstmaat.
Postoperatieve complicaties: erectiele dysfunctie, incontinentie, infectie, bloeding, fistel, divertikel Er werden geen vergelijkende studies geïdentificeerd omtrent de duur van postoperatieve blaaskatheterisatie met deze postoperatieve complicaties als uitkomstmaat. |
Samenvatting literatuur
1) Bij patiënten die een interne urethrotomie (Sachse) ondergaan
In twee RCT’s werd een postoperatieve katheterisatieduur van 3 dagen (Nielsen et al, 1985) respectievelijk 1 dag (Hansen et al, 1984) vergeleken met 28 dagen (Nielsen et al, 1985) respectievelijk 14 dagen (Hansen et al, 1984) (zie evidencetabel). De postoperatieve follow-up duurde 12 maanden (Hansen et al, 1984) respectievelijk 6 maanden (Nielsen et al, 1985).
Lekkage
Geen studie heeft dit als uitkomstmaat gehanteerd.
Succes ingreep
Beide studies hanteerden ‘succes ingreep’ als uitkomstmaat. Nielsen (1985) definieerde succes ingreep als tevredenheid van de patiënt een jaar na de ingreep (interview) in combinatie met een maximale urineflow van ≥ 10 ml/seconde. Hansen (1984) definieerde succes ingreep alleen als tevredenheid van de patiënt zes maanden na de ingreep (interview). In beide studies is onduidelijk hoe tevredenheid van patiënt precies gemeten is.
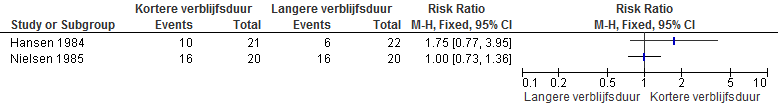
Nielsen (1985) vond geen verschil tussen de groepen. In de studie van Hansen (1984) was de puntschatter in het voordeel van een kortere postoperatieve katheterisatieduur, statistisch niet significant (zie figuur 1). Een verklaring voor de uiteenlopende resultaten zou de klinische heterogeniteit kunnen zijn: tussen de studies verschilden o.a. de definities van succes ingreep, de postoperatieve katheterisatieduur en de periode van follow-up. Gezien de aanwezigheid van klinische en statistische heterogeniteit werden de data niet gepoold.
Figuur 1 Succes ingreep
Maximale urineflow > 12ml/s
Zes maanden na de ingreep is in de studie van Hansen (1984) geen verschil waargenomen in het aantal patiënten met een maximale urineflow van >12 ml/seconde (9/21 versus 11/22, statistisch niet significant).
Postoperatieve complicaties
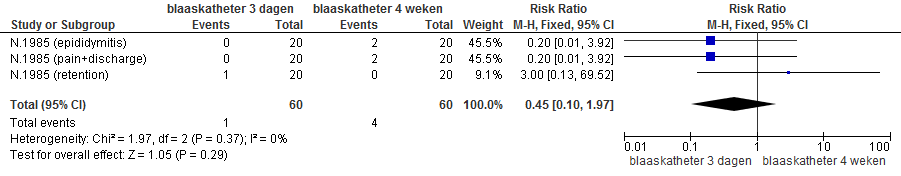
Nielsen (1985) rapporteerde de uitkomstmaten epididymitis, urineretentie en urethrale pijn met afscheiding uit de penis (zie figuur 2). Het is onduidelijk hoe deze uitkomstmaten gemeten zijn. In de groep “verwijderen blaaskatheter 28 dagen na de ingreep” had 20% (4/20) van de patiënten complicaties, in de groep “verwijderen blaaskatheter 3 dagen na de ingreep” had 5% (1/20) van de patiënten een complicatie.
Figuur 2 Postoperatieve complicaties

Lekkage, ICI-Q male SF, uitblijven recidief
Deze effecten zijn niet onderzocht.
Erectiele dysfunctie, incontinentie, bloeding, fistel, divertikel
Deze postoperatieve complicaties zijn niet onderzocht.
Bewijskracht van de literatuur
Succes ingreep, maximale urineflow > 12ml/s, postoperatieve complicaties
De kwaliteit van bewijs voor de uitkomstmaten succes ingreep, maximale urineflow >12ml/s en postoperatieve complicaties verandert van hoog naar zeer laag, omdat het bij beide studies onduidelijk is of de randomisatie geblindeerd was (beperkingen in onderzoeksopzet) en het aantal onderzochte patiënten klein is (imprecisie). Voor de uitkomstmaat ‘succes ingreep’ zijn de resultaten uiteenlopend (inconsistentie). Tevens is het onzeker of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat in Nederland vaak de ‘Otis-techniek’ wordt toegepast in tegenstelling tot in de studies, waar de Sachse techniek werd toegepast.
Indirect bewijs voor de uitkomstmaat recidief urethrastrictuur:
De kwaliteit van bewijs is zeer laag, omdat het bewijs een retrospectief onderzoek betreft en de auteurs in de analyse niet corrigeerden voor confounding.
2) Bij patiënten die een urethraplastiek ondergaan
Bij patiënten die een “anterior anastomotic” urethraplastiek ondergaan:
In een retrospectief cohortonderzoek (N=19) werd een postoperatieve verblijfskatheterisatie van 3 dagen vergeleken met een postoperatieve verblijfskatheterisatie van gemiddeld 8 dagen bij patiënten die een “anterior anastomotic” urethraplastiek ondergingen vanwege een urethrastrictuur (Al-Qudah et al, 2005). De strategie was als volgt: bij 12 patiënten werd een eerste mictiecysto-urethrogram gemaakt op de derde postoperatieve dag en bij 7 patiënten op gemiddeld de achtste postoperatieve dag. Bij een normale uitslag van dit onderzoek werd op diezelfde dag de Foley katheter verwijderd. Bij een afwijkende uitslag werd de Foleykatheter vervangen en 7 dagen later een tweede mictiecysto-urethrogram gemaakt. De follow-up duurde gemiddeld 14 maanden (range 3-30 maanden).
Lekkage
In de groep ‘eerste mictiecysto-urethrogram op dag 3 na de ingreep’ was de uitslag van het onderzoek bij meer dan 80 % (10/12) van de patiënten normaal en kon de katheter op de derde postoperatieve dag worden verwijderd. In de groep ‘eerste mictie-cystourethrogram op dag 8 na de ingreep’ kon bij alle patiënten (7/7) de katheter op dag 8 worden verwijderd.
Uitblijven recidief strictuur
In de groep ‘eerste mictiecysto-urethrogram op dag 3 na de ingreep’ bleef bij 11/12 (92%) van de patiënten een recidief structuur uit; in de groep ‘eerste mictiecysto-urethrogram op dag 8 na de ingreep’ bij 6/7 (86%) van de patiënten.
Verbeteren urineflow, ICI-Q male SF
Deze lange termijn effecten zijn niet onderzocht.
Erectiele dysfunctie, incontinentie, infectie, bloeding, fistel, divertikel
Deze postoperatieve complicaties zijn niet onderzocht.
Bij patiënten die een “ventral buccal mucosal graft onlay” urethraplastiek:
In een retrospectief cohort (N=10) werd een postoperatieve verblijfskatheterisatie van 7 dagen vergeleken met een postoperatieve verblijfskatheterisatie van gemiddeld 12 dagen bij patiënten die een “ventral buccal mucosal graft onlay” urethraplastiek ondergingen vanwege een urethrastrictuur (Al-Qudah et al, 2005). De strategie was als volgt: bij 5 patiënten werd een eerste mictiecysto-urethrogram gemaakt op de zevende postoperatieve dag en bij 5 patiënten op gemiddeld de twaalfde postoperatieve dag. Bij een normale uitslag van dit onderzoek werd op diezelfde dag de Foley katheter verwijderd. Bij een afwijkende uitslag werd de Foleykatheter vervangen en 7 dagen later een tweede mictiecysto-urethrogram gemaakt. De follow-up duurde gemiddeld 14 maanden (range 3-30 maanden).
Lekkage
In de groep ‘eerste mictiecysto-urethrogram op dag 7 na de ingreep’ was de uitslag van het onderzoek bij alle patiënten (5/5) normaal en kon de katheter op de zevende postoperatieve dag worden verwijderd. In de groep ‘eerste mictie-cystourethrogram op gemiddeld dag 12 na de ingreep’ kon bij 80% (4/5) van de patiënten de katheter op dag 8 worden verwijderd.
Uitblijven recidief strictuur
In beide groepen bleef een recidief structuur uit.
Verbeteren urineflow, ICI-Q male SF
Deze lange termijn effecten zijn niet onderzocht.
Erectiele dysfunctie, incontinentie, infectie, bloeding, fistel, divertikel
Deze postoperatieve complicaties zijn niet onderzocht.
Bewijskracht van de literatuur
De kwaliteit van bewijs voor de uitkomstmaten lekkage en uitblijven recidief verandert van laag* naar zeer laag, omdat het onduidelijk is op basis van welke criteria een patiënt in de vroege of late groep terecht kwam, de follow-up voor alle patiënten niet even lang was en de auteurs in de analyse niet corrigeerden voor confounding (beperkingen in onderzoeksopzet). Tevens is het aantal onderzochte patiënten zeer laag is (imprecisie).
* Ter informatie: een systematic review van RCTs start hoog in de indeling van ‘Kwaliteit van bewijs’, een systematic review van observationele onderzoeken start hierin laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep twee systematische literatuuranalyses gepland met de volgende PICO-vraagstellingen:
- Wat is het effect van een katheterisatieduur van ongeveer 1 tot 3 dagen vergeleken met een katheterisatieduur van ongeveer 2 tot 4 weken op de uitkomstmaten genoemd in onderstaande tabel 1, bij patiënten met een urethrastrictuur die een interne urethrotomie (Sachse) ondergaan?
- Wat is het effect van een katheterisatieduur van ongeveer een week vergeleken met een katheterisatieduur van ongeveer 3 weken op de uitkomstmaten in onderstaande tabel bij patiënten met een urethrastrictuur die een urethraplastiek ondergaan?
In de databases Medline (OVID) en Embase is met relevante zoektermen gezocht naar de verblijfsduur van een blaaskatheter na een urethrotomie interna of een urethraplastiek. De literatuurzoekactie leverde 154 treffers op. Studies die voldeden aan de selectiecriteria in onderstaande tabel zijn opgenomen in de samenvatting van de literatuur.
Tabel 1 Inclusie- en selectiecriteria
|
Type studies |
|
|
Type patiënten |
|
|
Interventie |
|
|
Controle |
|
|
Type uitkomstmaten |
Effecten ingreep na vroegtijdig verwijderen postoperatieve blaaskatheter
Postoperatieve complicaties na vroegtijdig verwijderen postoperatieve blaaskatheter
|
|
Type setting |
|
|
Exclusiecriteria |
|
Resultaten selecteren van literatuur
Acht studies werden geselecteerd op basis van titel en abstract. Na het lezen van de volledige artikelen werden hiervan uiteindelijk drie studies opgenomen in de literatuuranalyse (Al-Qudah et al, 2005; Hansen et al, 1984; Nielsen et al, 1985).
Over de 4 geïncludeerde studies:
1) Studies bij patiënten die een interne urethrotomie (Sachse) ondergingen:
Twee RCTs onderzochten het effect van de verblijfsduur van een blaaskatheter na een interne urethrotomie (Nielsen et al, 1985; Hansen et al, 1984).
2) Studies bij patiënten die een urethraplastiek ondergingen:
In een retrospectief vergelijkend cohort werd het effect van de verblijfsduur van een blaaskatheter onderzocht na een urethraplastiek (Al-Qudah et al, 2005).
Referenties
- Albers PF. Long-term results of internal urethrotomy. Journal of Urology 1996;156[5], 1611-1614.
- Al-Qudah HSC. Early catheter removal after anterior anastomotic (3 days) and ventral buccal mucosal onlay (7 days) urethroplasty. International Braz J Urol. 2005;31[5], 459-464.
- Asklin B, Pettersson S. Visual internal urethrotomy with postoperative cystostomy or urethral catheter. Scand J Urol Nephrol. 1983;17(1):5-10.
- Islam MR, Alam MM, Siddique MI, Rahman MA, Sami-Al-Hasan, Islam MR. Comparative study of early and conventional catheter removal following buccal mucosal graft urethroplasty. Mymensingh Medical Journal. 2015; MMJ 24[2], 290-294.
- Iversen Hansen R, Reimer Jensen A. Recurrency after optical internal urethrotomy. A comparative study of long-term and short-term catheter treatment. Urol Int. 1984;39(5):270-1.
- Nguyen DPG. How long should patients keep the transurethral catheter in situ after internal urethrotomy? Preliminary results of a prospective randomised study. European Urology 2012, Supplements Conference[var.pagings], e611-e611b.
- Nielsen HO, Christensen K, Larsen CF, Dyreborg U. Visual internal urethrotomy. A prospective controlled trial comparing the results after 3 versus 28 days of postoperative catheterisation. Ann Chir Gynaecol. 1985;74(5):244-6.
- WIP-richtlijn Preventie van infecties als gevolg van blaaskatheterisatie via de urethra (2014).
- Xu NX, X. Outcome analysis of tubularized incised plate repair in hypospadias: Is a catheter necessary? Urologia Internationalis 2013;90[3], 354-357.
Evidence tabellen
Tabel exclusie na het lezen van het volledige artikel
|
Auteur |
Redenen van exclusie |
|
Albers 1996 |
Geen vergelijkend interventieonderzoek |
|
Asklin 1983 |
Andere vergelijking: urethrale katheterisatie versus suprapubische katheterisatie |
|
Islam 2015 |
Publicatie in Nederland niet te verkrijgen |
|
Nguyen 2012 |
Abstract van congres. Onderzoek is niet gepubliceerd. |
|
Xu NX 2013 |
Andere vraagstelling: urethrale katheterisatie versus geen urethrale katheterisatie bij jongens met hypospadie die een TIP-urethraplastiek ondergaan. |
Evidence table
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Nielsen 1985 |
Type of study: RCT
Setting: University hospital
Country: Denmark
Source of funding: Unknown |
Inclusion criteria: 40 consecutive patients with urethral strictures treated by direct visual urethrotomy (7 patients had 2 strictures)
Exclusion criteria: Not reported.
N total at baseline: 40 Intervention: 20 Control: 20
Important prognostic factors: Age: I: 64 (21-28) C: 64 (16-78)
Stricture length (mm): I: 7 (3-50) C: 7 (2-40)
Aetiology of the strictures External trauma: I/C: 2:20/2:20 Prostatectomy: I/C: 8:20/7:20 Instrumentation: I/C: 4:20/9:20 Unknown: I/C: 6:20/2:20
To note: it is unknown whether the groups were comparable for a) patients with multiple strictures (7/40 patients) and b) the localisation of the urethral strictures. |
3 days postoperative catheterisation (16 CH silicone catheter)
To note: patients did not received antibiotic treatment.
|
28 days postoperative catheterisation (16 CH silicone catheter)
To note: patients did not received antibiotic treatment.
|
Length of follow-up: 12 months postoperatively
Loss-to-follow-up: I:none C: none
|
Success rate urethrotomy after 12 months follow-up Defined as patient satisfied (interview) and maximal urinary flow ≥ 10 ml/sec. I: 16/20 (80%) C: 16/20 (80%)
Postoperative complications: Epididymitis Not defined. I: 0/20 C: 2/20
Retention after catheter removal Not defined. I: 1/20 C: 0/20
Urethral pain and discharge Not defined. I: 0/20 C: 2/20
|
Authors: the success rates were comparable in both groups, but the complication rate was higher in the 28 days catheterisation group. |
|
Hansen 1984 |
Type of study: RCT
Setting:
Country: Denmark
Source of funding: |
Inclusion criteria: 66 consecutive patients with urethral strictures undergoing optical internal urethrotomy (Sachse)
Exclusion criteria: Not reported.
N total at baseline: 66 Intervention: not reported;
Control: not reported
Important prognostic factors: It is not reported whether the groups were comparable for a) age (median: 70 years); b)multiple strictures; c) localisations of the urethral strictures; d) aetiology of the strictures |
1 day postoperative catheterisation
To note: antibiotics were not administered routinely. Patients with UTI pre- or postoperatively were treated with antibiotics according to urine culture. |
14 days postoperative catheterisation
To note: antibiotics were not administered routinely. Patients with UTI pre- or postoperatively were treated with antibiotics according to urine culture. |
Length of follow-up: 6 months postoperatively
Loss-to-follow-up: 23/66 patients did not complete the programme.
Intervention: N (%): ? Reasons (describe): ?
Control: N (%): ? Reasons (describe): ?
|
Maximal flow rate >12 ml/s after 6 months I (21): 9/21 C (22): 11/22
Restenosis after 6 months Measured by urethrography I (21): 16/21 C (22): 14/21
Patient satisfied after 6 months Measured by interview I (21): 10/21 C (22): 6/22
Postoperative complications: None of the complications were defined; insufficient data were presented to calculate the risk in each group. Epididymitis I: 0/? C: 5/?
Urethral pain and discharge I: 1/? C: 7/?
|
|
|
Al-Qudah 2005 |
Type of study: retrospective comparative cohort study
Setting: 2 reconstructive urology centers
Country: Brazil and USA
Source of funding: |
Inclusion criteria: Patients (N=32) who underwent anterior anastomotic urethroplasty (N=19) or ventral buccal mucosal graft onlay urethroplasty (N=10) in the period from October 2002 to August 2004 at 2 referral centers for urologic reconstruction.
Exclusion criteria: Local radiotherapy; dialysis because of end stage renal disease.
Important prognostic factors: Mean age (range): 43 (19-75)
Mean stricture length (range): a) for anastomotic urethroplasty: 1,2cm (0.5-3)
b) for buccal urethroplasty: 3.6cm (2.5-5)
Aetiology: Inflammatory: N=8 Trauma: N-6 Iatrogenic: N=3 Unknown: N=12
It is not reported whether the groups were comparable for the above factors. |
For patients undergoing anterior anastomotic urethroplasty (early group): In 12 patients a voiding cystourethrogram (VCUG) was performed on the 3nd postoperative day (POD):
For patients undergoing ventral buccal mucosal graft onlay urethroplasty (early group): In 5 patients a voiding cystourethrogram (VCUG) was performed on the 7th postoperative day:
|
For patients undergoing anterior anastomotic urethroplasty (late group): In 7 patients a voiding cystourethrogram (VCUG) was performed on average 8 days after surgery:
For patients undergoing ventral buccal mucosal graft onlay urethroplasty (late group): In 5 patients a voiding cystourethrogram (VCUG) was performed on average 12 days after surgery:
|
Length of follow-up: Patient follow-up averaged 14 months (range 3-30 months).
Loss-to-follow-up: One patient with previous local radiotherapy and 2 patients with end stage renal disease on dialysis were excluded from the study.
|
For patients undergoing anterior anastomotic urethroplasty
Leakage Seen on first voiding cystourethrogram I (on 3nd POD): 2/12 (17%) C (on average 8th POD): 0/7 (0%)
To note: both patients had a normal second VUCG (7 days after the first VUCG).
Stricture recurrence I (on 3nd POD): 1/12 (8%) C (on average 8th POD): 1/7 (14%)
For patients undergoing ventral buccal mucosal graft onlay urethroplasty Leakage Seen on first voiding cystourethrogram I (on 7th POD): 0/5 (0%) C (on average 12th POD): 1/5 (20%)
To note: the one patient had a normal second VUCG (7 days after the first VUCG).
Stricture recurrence I (on 7nd POD): 0/5 C (on average 12th POD): 0/5
|
Catheter removal after anastomotic and buccal mucosal urethroplasty can be safely attempted on the 3rd and 7th postoperative days respectively, with a low rate of extravasation on VCUG. Getting the Foley out earlier did not increase recurrence rates on short-term follow-up. Eliminating the catheter as soon as possible has beneficial effects on patient comfort and the overall negative “impact” of surgery. |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Nielsen 1985 |
Not described |
Unclear |
Not possible |
Not possible |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Hansen 1984 |
Not described |
Unclear |
Not possible |
Not possible |
Unclear |
Unclear |
Unclear |
Unclear |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Risk of bias table for intervention studies
|
Study reference
|
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Al-Qudah 2005 |
Unclear |
Unclear |
Unlikely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-01-2018
Beoordeeld op geldigheid : 02-01-2018
Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Urologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Urologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancierd uit [de Kwaliteitsgelden Medisch Specialisten (SKMS) of andere bron].
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een up-to-date multidisciplinaire richtlijn voor de behandeling van volwassen, mannelijke patiënten met verdenking op een urethrastrictuur die een uroloog consulteren, onder meer verwezen via de huisarts, via intercollegiale consulten van andere specialismen, en tertiaire verwijzingen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met urethrastricturen: urologen, radiologen en dermatologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met urethrastrictuur (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. R. I. Nooter (voorzitter), uroloog, Franciscus Gasthuis, Rotterdam
- Dr A. de Vylder, uroloog, Jeroen Bosch ziekenhuis ‘s Hertogenbosch
- Drs. G. Pigot, uroloog, VU Medisch Centrum, Amsterdam
- Drs. F.M.J.A. Froeling, uroloog, HagaZiekenhuis, Den Haag
- Dr. K. D'Hauwers, uroloog, Radboud Universitair Medisch Centrum, Nijmegen.
- Prof. dr. J.L.HR. Bosch, uroloog, Universitair Medisch Centrum Utrecht, Utrecht.
- Dr. G.R. Dohle, uroloog, Erasmus Medisch Centrum, Rotterdam
- Dr. E. Taubert, uroloog, Slingeland ziekenhuis, Doetinchem
- Dr. R. L. Miclea, radioloog, Maastricht Universitair Medisch Centrum, Maastricht
Meelezers:
- Dr. E.M. van der Snoek, dermatoloog, Erasmus Medisch Centrum, Rotterdam
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog,
- Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Urologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Ronald Nooter |
uroloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Ann de Veylder |
uroloog |
Werkgroep kinderurologie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Garry Pigot |
uroloog |
|
|
|
|
|
|
|
|
Frank Froeling |
uroloog |
geen |
geen |
geen |
Lid commissie externe betrekkingen van de NVU. |
geen |
geen |
geen |
|
Kathleen WM d'Hauwers |
uroloog |
Lesgever SOMT Fysiotherapie-opleiding: betaald |
geen |
geen |
Klinefelter patiënten organisatie: geen boegbeeldfunctie, wel contactpunt als mensen met Klinefelter vragen hebben over urologische gerelateerde onderwerpen. Zie ook Cyberpoli - Klinefelter [internet]. |
geen |
geen |
geen |
|
Ruud Bosch |
uroloog |
geen |
Adviseur en Signatory Investigator Ferring AG, Kopenhagen, DK; adviseur Astellas-NL; spreker-faculty lid Update in Urology (AstraZeneca). |
geen |
Lid van EAU richtlijncommissie Urine-incontinentie; voorzitter Continentie Stichting Nederland (CSN). |
geen |
geen |
geen |
|
Gert Dohle |
uroloog |
Medisch adviseur |
Invited speaker astra zeneca en bayer |
geen |
Voorzitter EAU guideline on male hypogonadism |
geen |
geen |
geen |
|
Erich Taubert |
uroloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Eric van der Vorm |
arts-microbioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Razvan Miclea |
radioloog |
n.v.t. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Hans de Beer |
richtlijnmethodoloog
|
Lid GRADE Working Group. Lid Guidance committee GRADE network Netherlands. Alle onbetaald. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Barbara Niël-Weise |
richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Omdat er geen specifieke patiëntenorganisatie voor urethrastrictuur bestaat, heeft de Patiëntenfederatie Nederland de Nederlandse Federatie van Kankerpatiënten organisaties (Leven met blaas- of nierkanker) hiervoor benaderd. Er werden geen knelpunten aangedragen. Tevens heeft de werkgroep een focusgroep bijeenkomst gehouden, waaraan 22 patiënten hebben deelgenomen. Een verslag van de focusgroep is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is te vinden bij de aanverwante producten. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deelnemers van de focusgroep en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het implementatieplan bij de aanverwante producten).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit (www.kwaliteitskoepel.nl). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.cvz.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Patiëntenfederatie Nederland, Nederlands Huisartsen Genootschap en Zorgverzekeraars Nederland. Er werden geen additionele knelpunten geïdentificeerd.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht op de website van de European Association of Urology en in de databases van National guideline clearinghouse, UpToDate, Guidelines International Network en PubMed. Voor bestaande systematic reviews is gezocht in databases Ovid Medline, Cochrane database of systematic reviews en Epistemonikos.
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’ of ‘certainty of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs (Eng: quality / certainty of evidence) volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs (Eng: quality / certainty of evidence) wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 waarschijnlijk - 2 zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 groot + 2 zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele residuele ‘confounding’[1] |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle onderzoeken samen (body of evidence).
Overwegingen
Om tot een aanbeveling te komen zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak nog andere aspecten van belang.
Naast de afweging van gunstige en ongunstige effecten kunnen genoemd worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in module 9.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes onder aanverwante producten.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan alle deelnemers van de focusgroep bijeenkomst en de volgende organisaties ter becommentariëring: het Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Patiëntenfederatie Nederland, Nederlands Huisartsen Genootschap en Zorgverzekeraars Nederland. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6. 2008
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
[1] Dit criterium wordt sporadisch toegepast. Soms doet zich de situatie voor dat alle plausibele ‘confounders’ (variabelen die vertekening van resultaten veroorzaken) waarvoor in ‘high-quality’ observationele studies niet is gecorrigeerd (residuele ‘confounders’) zouden resulteren in een onderschatting van een ogenschijnlijk behandeleffect. Als bijvoorbeeld alleen ziekere patienten een experimentele behandeling ondergaan, en ze toch beter af zijn, dan is het waarschijnlijk dat het werkelijke behandeleffect zelfs groter is dan de data suggereren. Een analoge situatie doet zich voor wanneer observationele studies geen behandeleffect laten zien.
Zoekverantwoording
|
Zoektermen met als onderwerp [Naam module] |
|
|
Medline 1946 to February 25th 2016 |
1 "controle refs blaaskatheter".ti. (0) 2 "early and conventional catheter removal following buccal mucosal ".fc_titl. and "2015".fc_pubyr. (1) 3 "Recurrency after optical internal urethrotomy".fc_titl. and "1984".fc_pubyr. (1) 4 "Visual internal urethrotomy. ".fc_titl. and "1985".fc_pubyr. (1) 5 "catheter removal after anterior anastomotic ".fc_titl. and "2005".fc_pubyr. (1) 6 or/2-5 (4) 7 urologic surgical procedures/ or urologic surgical procedures, male/ (11000) 8 Urethral Stricture/su [Surgery] (2316) 9 (urethral adj3 (stricture? or stenos*)).tw. (3903) 10 su.fs. (1677857) 11 9 and 10 (2363) 12 urethr?plast*.tw. (2445) 13 urethr?plast*.kf. (121) 14 urethral stricture/ (4355) 15 "concept P".ti. (1) 16 7 or 8 or 9 or 11 or 12 or 13 or 14 (17064) 17 catheterization/ or exp urinary catheterization/ (60245) 18 catheter*.tw. (165206) 19 catheter*.kf. (7228) 20 or/17-19 (199384) 21 16 and 20 (2061) 22 Device Removal/ (9343) 23 (catheter* adj3 (period or remov*)).tw. (6540) 24 (catheter* adj3 (period or remov*)).kf. (13) 25 (catheter adj3 discont*).tw. (84) 26 (catheter adj3 discont*).kf. (0) 27 (early adj5 remov*).tw. (3394) 28 (conventional adj5 remov*).tw. (1472) 29 (postoperative adj5 catheter*).tw. (1979) 30 or/22-29 (21577) 31 21 and 30 (341) 32 duration?.tw. (459250) 33 27 or 28 or 32 (463815) 34 31 and 33 (61) 35 6 and 31 (4) 36 "filter medline observationele studies".ti. (0) 37 epidemiologic studies/ (6992) 38 exp case-control studies/ (756777) 39 exp cohort studies/ (1497471) 40 cross-sectional studies/ (207093) 41 (case adj3 control).af. (241556) 42 (cohort adj5 (study or studies or analy$)).af. (273268) 43 (cohort adj5 (study or studies or analy$)).af. (273268) 44 (follow-up adj5 (study or studies)).af. (569588) 45 (longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (1610381) 46 (observational adj5 (study or studies)).af. (87124) 47 or/37-46 (2283913) 48 "filter observationele studies einde".ti. (0) 49 "sensitief filter voor RCT's van Cochrane".ti. (0) 50 randomized controlled trial.pt. (407708) 51 controlled clinical trial.pt. (90144) 52 (randomized or randomised).ab. (402605) 53 placebo.ab. (166631) 54 drug therapy.fs. (1822580) 55 randomly.ab. (243030) 56 trial.ab. (348108) 57 groups.ab. (1519564) 58 or/50-57 (3674559) 59 58 not (exp animals/ not humans/) (3161031) 60 "filter rct cochrane sensitief".ti. (0) 61 "filter systematic reviews".ti. (0) 62 meta analysis.pt. (61860) 63 (meta-anal$ or metaanal$).af. (109701) 64 (quantitativ$ adj10 (review$ or overview$)).tw. (5529) 65 (systematic$ adj10 (review$ or overview$)).tw. (86480) 66 (methodologic$ adj10 (review$ or overview$)).tw. (7382) 67 medline.tw. and review.pt. (50833) 68 (pooled adj3 analy*).tw. (10605) 69 or/62-68 (198013) 70 "filter systematic reviews".ti. (0) 71 "cochrane$".fc_jour. (11744) 72 69 or 71 (199293) 73 31 and 72 (3) systrev 74 31 and 59 (80) 75 (31 and 47) not (59 or 72) (123) 76 34 and 75 (28)=observat 77 8 or 11 or 12 or 13 (4678) 78 74 and 77 (43)=rct |
|
Embase 1980 to February 25th 2016 |
1 "controle refs blaaskatheter".ti. (0) 2 "early and conventional catheter removal following buccal mucosal ".fc_titl. and "2015".fc_pubyr. (0) 3 "Recurrency after optical internal urethrotomy".fc_titl. and "1984".fc_pubyr. (1) 4 "Visual internal urethrotomy. ".fc_titl. and "1985".fc_pubyr. (1) 5 "catheter removal after anterior anastomotic ".fc_titl. and "2005".fc_pubyr. (1) 6 or/2-5 (3) 7 urologic surgical procedures/ or urologic surgical procedures, male/ (8769) 8 Urethral Stricture/su [Surgery] (253) 9 urethr?plast*.tw. (3346) 10 urethral stricture/ (894) 11 "concept P".ti. (2) 12 Device Removal/ (13027) 13 (catheter* adj3 (period or remov*)).tw. (9970) 14 (catheter adj3 discont*).tw. (132) 15 (early adj5 remov*).tw. (4343) 16 (conventional adj5 remov*).tw. (1838) 17 (postoperative adj5 catheter*).tw. (2669) 18 urethroplasty/ (3876) 19 urinary catheter/ or exp urethral catheter/ (4269) 20 urethrotomy/ (1470) 21 exp catheterization/ (144242) 22 19 or 21 (147636) 23 8 or 9 or 18 or 20 (5730) 24 urethr?plast*.kw. (529) 25 23 or 24 (5777) 26 22 and 25 (582) 27 12 or 13 or 14 or 15 or 16 or 17 (30251) 28 26 and 27 (117) 29 6 not 28 (1) 30 13 or 14 or 17 or 22 (155845) 31 23 and 27 and 30 (246) 32 "filter systematic reviews & meta-analyses Embase".ti. (0) 33 meta analysis/ (104610) 34 "systematic review"/ (102029) 35 (meta-analy$ or metaanaly$).tw. (114573) 36 (systematic$ adj4 (review$ or overview$)).tw. (106454) 37 (quantitativ$ adj5 (review? or overview?)).tw. (3215) 38 (methodologic adj5 (overview? or review?)).tw. (297) 39 (review$ adj3 (database? or medline or embase or cinahl)).tw. (15885) 40 (pooled adj3 analy$).tw. (15972) 41 (extensive adj3 review$ adj3 literature).tw. (2489) 42 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1046010) 43 review.pt. (2113947) 44 42 and 43 (97300) 45 or/33-41,44 (314091) 46 "einde filter systrev meta analysis embase".ti. (0) 47 "filter rct embase".ti. (0) 48 controlled clinical trial/ or randomized controlled trial/ (533223) 49 randomization/ (69423) 50 Major Clinical Study/ (2086106) 51 random$.tw. (1045437) 52 Double Blind Procedure/ (126375) 53 or/48-52 (3078792) 54 "einde filter rct embase".ti. (0) 55 "filter observationele studies embase".ti. (0) 56 Clinical study/ (74381) 57 Case control study/ (101749) 58 Family study/ (11157) 59 Longitudinal study/ (84829) 60 Retrospective study/ (448385) 61 Prospective study/ (322686) 62 Randomized controlled trials/ (91514) 63 61 not 62 (320098) 64 Cohort analysis/ (231727) 65 (Cohort adj (study or studies)).mp. (158211) 66 (Case control adj (study or studies)).tw. (91188) 67 (follow up adj (study or studies)).tw. (48847) 68 (observational adj (study or studies)).tw. (86973) 69 (epidemiologic$ adj (study or studies)).tw. (82179) 70 (cross sectional adj (study or studies)).tw. (113973) 71 or/55-60,63-69 (1371751) 72 "einde filter observationele studies embase volgens SIGN".ti. (0) 73 31 and 45 (2)=systrev 74 (31 and 53) not 45 (62)=rct 75 (31 and 71) not (45 or 53) (19)=observat |
