Allergeen immunotherapie
Uitgangsvraag
Wat is de plaats van allergeen immunotherapie in de behandeling van patiënten met niet-ernstig astma?
Aanbeveling
Overweeg immunotherapie bij patiënten met astma met persisterende allergische rhinitis klachten ondanks maximale therapie voor allergische rhinitis. Het effect op astma controle is niet consistent.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de literatuuranalyse werden een aantal studies gevonden die het effect van SCIT/SLIT op astma controle, medicijngebruik en exacerbaties onderzochten in volwassen patiënten met allergische astma. Doordat deze studies verschillende uitkomstmaten gebruikten of niet alle individuele data kon worden gereproduceerd uit de systematic review, was het niet mogelijk alle uitkomstmaten te poolen.
Voor de cruciale uitkomstmaat ‘astma controle’ kon een meta-analyse van zes studies worden uitgevoerd. Hieruit bleek een klinisch relevant effect op astma controle in het voordeel van de interventie, maar niet alle studies konden dit bevestigen. Een laatste studie gaf een klein niet klinisch relevant relatief risico in het voordeel van de interventie. De bewijskracht voor deze bevinding blijkt zeer laag waardoor er geen positief of negatief effect kan worden vastgesteld.
Voor de cruciale uitkomstmaat ‘medicatiegebruik’ kon een meta-analyse van drie studies worden gemaakt. Deze liet een klinisch relevant verschil in standardized mean difference zien. Verder werd in een studie nog een verschil gezien in afname van het budesonide equivalente dosis, maar het kon niet worden berekend of deze klinisch relevant was. De laatste studie rapporteerde alleen dat er geen significant verschil was in medicijngebruik tussen de twee groepen. Hoewel in alle uitkomsten er sprake is van invloed van de sponsor, hebben we ervoor gekozen om voor deze uitkomstmaat niet af te waarden voor risk of bias. De reden hiervoor is dat alle studies eenzelfde effect laten zien, waardoor we de kans lager inschatten dat de invloed van de sponsor daaraan heeft bijgedragen. Op basis van deze studies lijkt SCIT/SLIT een effect te kunnen hebben op het medicatiegebruik, maar de bewijskracht hiervan is laag.
Tenslotte rapporteerden drie studies de belangrijke uitkomstmaat ‘exacerbaties’. Een studie rapporteerde alleen dat er geen significant verschil was tussen beide groepen. Een andere studie vond geen verschil in de incidentie van exacerbaties tussen de interventie en placebo groepen. De laatste studie vond een klinisch relevante hazard ratio in het voordeel van de interventie en een niet klinisch relevant verschil. De bewijskracht voor deze bevindingen zijn zeer laag waardoor er geen richting aan het effect kan worden gegeven.
In de behandeling van astma wordt er gestreefd naar zo min mogelijk, bij voorkeur geen, exacerbaties onder een zo laag mogelijke dosering inhalatiecorticosteroïden. Het moduleren van de allergeenrespons op allergenen zou in theorie kunnen bijdragen aan het optimaliseren van de astma controle dan wel de mate van corticosteroïden gebruik. Echter laten de studies zien dat de bewijskracht voor exacerbatie reductie en verbeterde astma controle zeer laag is. De bewijskracht voor verbetering van medicatie gebruik is laag. Belangrijk is hierbij dat in de meeste studies een minimale FEV1 van 70% is aangehouden.
Bij subcutane desensibilisatie ontvangen patiënten in eerste instantie wekelijks een dosis allergenen door middel van injectie. Elke week wordt de dosering iets opgehoogd. Dit gebeurt in het ziekenhuis in geval van een allergische reactie (kans 0.5%), na instellen volgt er een onderhoudsfase van een injectie elke 4-6 weken, wat eventueel ook in de huisartsenpraktijk kan. Na elke injectie volgt een wachttijd van 30min. Bijwerkingen zijn met name in het begin toename van klachten en verlies van astmacontrole.
Sublinguale immunotherapie omvat dagelijks 1 tabletje met allergenen onder de tong te laten smelten. De eerste keer vindt plaats in het ziekenhuis met een wachttijd van 30min. De bijwerkingen zijn oraal en gastro-intestinaal (10%) van aard en zelden anafylactisch. De Slit tabletten bevatten 1 allergeen en zijn beschikbaar voor een beperkt aantal allergenen.
Voor de algemene populatie is zowel sublinguale als subcutane immunotherapie een bewezen effectieve behandeling, met een percentage van 80-90% van afname van rhinitis klachten (Radulovic 2010). Tevens laten meta-analyses geen verschil zien in effectiviteit (Tie, 2022).
Mogelijk zou in bepaalde subgroepen van patiënten met astma de interventie een hogere bewijskracht kunnen leveren, bijvoorbeeld bij degenen met meer ernstige rhinitis klachten ondanks adequate pulmonale en rhinitis medicatie, gezien bij dit laatste de bewijskracht voor SLIT en SCIT ligt. Dit is niet in de huidige studies meegenomen.
De bewijskracht voor meer astmacontrole danwel minder medicatie gebruik bij het toepassen van SCIT of SLIT is meerdere niveaus verlaagd. Dit heeft te maken met verschillende biases die op de studies van toepassing zijn, onder andere betreffende de onderzoeksopzet (risk of bias), sponsoring van de studie (influence bij sponsor), tegenstrijdige resultaten (inconsistentie) en kleine onderzoekspopulaties (imprecisie). Onafhankelijk onderzoek in grotere populaties zijn nodig om met beter bewijskracht te kunnen komen voor de effectiviteit van immunotherapie op astma.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Indien een patiënt duidelijk allergeen gerelateerde klachten heeft waarbij vermijding en farmacotherapeutische opties niet afdoende effect hebben, kan desensibilisatie als behandeling overwogen kunnen worden. Er is bewijs dat de behandeling bewezen effectief is voor vermindering van rhinitis klachten bij 80-90% van de (niet-astma) populatie welke maximaal behandeling ontvangen voor hun rhinitis.
Echter moeten de voor- en nadelen van deze behandeling duidelijk met de patiënt besproken worden. Evenals het feit dat de bewijskracht dat hierdoor de astma meer onder controle komt dan wel dat de behandeling gaat leiden tot minder medicatie gebruik laag is.
Voordelen zijn vooral afname van allergische klachten en misschien minder medicatie gebruik. Nadelen zijn de lange duur van de behandeling (3 jaar) waarbij therapietrouw noodzakelijk is en risico’s op bijwerkingen. De patiënt moet zich bewust zijn dat de therapie in sommige gevallen zelfs voor (tijdelijke) verslechtering van astma kan zorgen (tot 10%) en zelfs anafylaxie (0.1-1%) in zeldzame gevallen. Wat betreft de belasting voor de patiënt is dit bij SCIT relatief hoog, met name bij de instelfase. Bij SLIT ligt dit aanzienlijk lager, echter kunnen ook minder allergenen aangepakt worden.
Het doel om meer astma controle te krijgen door middel van SCIT/SLIT lijkt gezien de bewijskracht niet de juiste.
Kosten (middelenbeslag)
De kosten van immunotherapie liggen relatief hoog. Zowel SCIT als SLIT gemiddeld genomen 70-90 euro per maand bij een behandelduur van 3 jaar. Hier staat tegenover dat de patiënt daarna vaak geen tot weinig therapie voor zijn allergie nodig heeft gedurende een lange periode (neusspray, antihistamine). Dit is niet alleen fijn voor de patiënt die minder klachten en minder medicatie nodig heeft. Maatschappelijk gezien zal dit mogelijk leiden tot minder uitval door allergie gerelateerde klachten en bijwerkingen van anti-histamine. Echter is hier weinig bewijskracht voor in de literatuur. Een systematic review naar de economische kosten laat wel zien dat SCIT en SLIT vanaf de leeftijd van 6 jaar kosten-effectiever kan zijn dan standaardtherapie (Meadows 2013).
Aanvaardbaarheid, haalbaarheid en implementatie
De interventie immunotherapie voor allergie door middel van tabletten (SLIT) of injecties (SCIT) is aanvaardbaar en haalbaar als de praktijk erop ingericht kan worden. De medisch specialist kan de interventie voorschrijven echter moet zich hier ook bekwaam in voelen, dit zit veelal niet in de opleiding en derhalve zal nascholing op dit onderwerp nodig zijn. De specialist moet weten hoe de medicatie werkt, voor wie het toepasbaar is en bewust zijn van de bijwerkingen. Ook moet de kliniek ingericht zijn op geven van de injecties dan wel toezien op inname van de tablet en adequaat handelen in geval van een allergische of anafylactische reactie. Hiervoor zijn getrainde doktersassistentes of verpleegkundigen nodig.
Er zijn meerdere specialisten die getraind kunnen worden in het geven van immunotherapie, zoals longarts, dermatologen, allergologen, KNO-artsen, kinderartsen. Concentratie van zorg binnen 1 ziekenhuis kan hierin kosteneffectief zijn en de kennis verhogen. Als een patiënt goed is ingesteld op SCIT kan de zorg ook overgedragen worden aan de huisarts, indien deze zich daar bekwaam toe voelt. Ook hier is een goede samenwerking nodig.
Ook de patiënt moet zich bewust zijn van de bijwerkingen en goed begrijpen bij welke bijwerkingen hij/zij direct contact moet opnemen en wanneer de behandeling te staken. Zowel arts als patiënt moeten zich bewust zijn van de lange behandelduur en met name de patiënt moet hier gemotiveerd voor zijn.
In Nederland heeft in principe iedereen toegang tot deze behandeling, en het wordt vergoed door de meeste zorgverzekeraars. Echter moet de voorschrijver zich ervan bewust zijn dat vooral patiënten met lage gezondheidsvaardigheden het belang van therapietrouw goed begrijpen, evenals de bijwerkingen. De basis van de behandeling start in een ziekenhuis, dit kan wel een nadeel zijn voor patiënten met een lager inkomen, deze verwijzing kost hen (een deel van) hun eigen bijdrage van de zorgverzekering, evenals de medicatie dat doet. Dit kan een belemmering zijn voor starten.
Voor deze behandeling is er geen uitzondering voor subgroepen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Immunotherapie is bewezen effectief in de populatie van allergische rhinitis klachten, dit zal ook gelden voor patiënten met astma. Echter is de bewijskracht voor het effect op de astma zelf niet hoog. Nadelen van immunotherapie zijn de lange behandelduur, intensieve start periode bij SCIT en de bijwerkingen. Echter is de groep met milde bijwerkingen beperkt en met ernstige bijwerkingen zeldzaam. Ook de studies laten nagenoeg geen ernstige adverse events zien in de astma populatie. Derhalve lijkt SLIT en SCIT veilig toepasbaar onder de juiste omstandigheden en is er geen harde negatieve aanbeveling voor starten. Arts en patiënt moeten zich bewust zijn dat het verwachten effect vooral in de rhinitis klachten zal liggen, en mogelijk zal er een effect zijn op de medicatie inname voor de astma.
Belangrijk is hierbij aan te geven dat de studies verricht in patiënten met mild astma en een FEV1 >70%. Vooraf aan starten wordt geadviseerd de richtlijn “immunotherapie voor patiënten met allergische rhinoconjunctivitis met of zonder astma” erop na te slaan.
Onderbouwing
Achtergrond
Allergische sensibilisatie is een risico factor voor zowel het ontstaan van astma als wel een onderhoudende factor voor ongecontroleerd astma. De huidige behandeling van astma is vooral gericht op het behandelen van klachten en de onderliggende chronische inflammatie. De abnormale immuunreactie op allergenen is wordt vaak niet behandeld. Immunotherapie zou deze immuunreactie wel kunnen behandelen. Het is echter onduidelijk of immunotherapie door middel van desensibilisatie effect heeft op de astma controle in volwassenen met allergisch astma.
Conclusies / Summary of Findings
|
Very Low GRADE |
The evidence is very uncertain about the effect of SLIT on asthma control when compared with placebo in patients with allergic asthma.
Sources: Bousquet, 1990; Bozek, 2022; Bødtger, 2002; Dahl, 2006; Garcia-Robaina, 2006; Kuna, 1989; Virchow, 2016 |
|
Low GRADE |
The evidence suggests SCIT/SLIT improves medication use when compared with placebo in patients with allergic asthma.
Sources: Bozek, 2022; Bødtger, 2002; Garcia-Robaina, 2006; Devillier, 2016; Mosbech, 2014 |
Exacerbations
|
Very low GRADE |
The evidence is very uncertain about the effect of SCIT/SLIT on exacerbations when compared with placebo in patients with allergic asthma.
Sources: Devillier, 2016; Mosbech, 2014; Virchow, 2016 |
Samenvatting literatuur
Description of studies
The systematic review by Dhami (2017) was used as the basis for the literature analysis as this was the most recent study with the highest methodological quality. Articles published after the search date (2015) of this systematic review were assessed for inclusion and this resulted in four additional randomized controlled trails (RCTs).
Dhami (2017) performed a systematic review on allergen immunotherapy in allergic asthma. Nine databases were searched for double-blind RCTs comparing subcutaneous immunotherapy (SCIT) or sublingual immunotherapy (SLIT) to placebo in patients with allergic asthma. The primary outcomes were short-term and long-term effectiveness as assessed by symptom and/or medication scores. Secondary outcomes were asthma control; asthma-specific quality of life (QoL); exacerbations; lung function; response to environmental exposure chamber or bronchial allergen challenge; health economic analysis from the perspective of the health system/payer; and safety as assessed by local and systemic reactions. 98 studies were included, from which 89 were RCTs. Fifteen of these were included in a meta-analysis, of which five were relevant for this literature analysis (Bousquet, 1990; Bødtger, 2002; Dahl, 2006; Garcia-Robaina, 2006; Kuna, 1989).
Bozek (2022) performed a randomized double-blind placebo-controlled trial in adult patients diagnosed with local allergic rhinitis with concomitant asthma who underwent a 12-month treatment course of SLIT for house-dust mite (HDM) allergies. In the final analysis, sixteen patients received the intervention, which consisted of allergen extracts of D. pteronyssinus and D. farinae (50/50%), and fourteen patients received a placebo. The total rhinitis score (TRSS), total asthma symptom score (TASS), combined total symptom score (TSS), total medication score (TMS), and FEV1 were analysed.
Devillier (2016) performed a randomized double-blind placebo-controlled trial in adults patients diagnosed with mild-to-moderate, persistent asthma who received twelve months of daily SLIT treatment of D. pteronyssinus and D. farinae extracts or a placebo. A total of 484 patients were included in the study, from which 322 in the intervention group and 162 in the placebo group. Main outcome measures were treatment-related adverse events and incidence of asthma exacerbations, lung function and quality of life.
Mosbech (2014) performed a randomized double-blind placebo-controlled trial in patients who were fourteen years or older with HDM allergic rhinitis and mild-to-moderate asthma. The study was designed around four groups; three intervention groups received a different active dose and the fourth group received a placebo. The groups received one, three, or six doses of the intervention and included 146, 159, and 156 patients respectively, and the placebo group 143 patients. Main outcome measures were a reduction in ICS dose compared to baseline, asthma control, and the number of exacerbations.
Virchow (2016) performed a randomized double-blind placebo-controlled trial in patients who were fourteen years or older with HDM allergic asthma. The study was designed around three groups; two of which received a different active dose and the third group received a placebo. The groups who received six or twelve doses of the intervention consisted of 275 and 282 patients respectively, and the placebo group of 277 patients. Primary outcome was time to first moderate or severe asthma exacerbation during the ICS reduction period. Secondary outcomes were deterioration in asthma symptoms, change in allergen-specific immunoglobulin G4 (IgG4), change in asthma control or asthma quality-of-life questionnaires, and adverse events.
Results
The data were pooled wherever possible and described narratively where the data were not adequately reported in the original study. In Table 1, the group sizes of the intervention and placebo groups are listed per study.
Table 1. Number of participants per study
|
Study |
Intervention group* (N) |
Placebo group (N) |
|
Bousquet (1990) |
39* |
18 |
|
Bozek (2022) |
16 |
14 |
|
Bødtger (2002) |
17 |
18 |
|
Dahl (2006) |
74 |
40 |
|
Devillier (2016) |
322 |
162 |
|
Garcia-Robaina (2006) |
32 |
32 |
|
Kuna (1989) |
12 |
12 |
|
Mosbech (2014) |
461* |
143 |
|
Virchow (2016) |
557* |
277 |
*multiple intervention groups added together
Asthma control
For the asthma control outcome measure, we included studies that reported asthma control as well as symptom scores, because a large portion of asthma control is defined by the symptoms patients are experiencing.
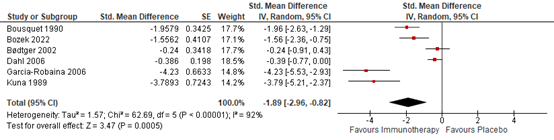
Six studies reported symptom score data that allowed for pooling (Figure 2). A pooled standardized mean difference of -1.89 (95% CI; -2.96 to -0.82) was found. This shows a very large effect size indicating that immunotherapy was effective in improving asthma control in these patients.
Figure 2. Forest plot of the outcome asthma control
Virchow (2016) reported the number of patients that showed an improvement of >0.5 in ACQ separately for each intervention group, but because this literature analysis is just about the effect of SCIT/SLIT and not its dose-response relationship, these two groups were considered as a singular intervention group. Thereby, 453 (81.3%) patients in the intervention groups showed an improvement in ACQ, and 218 (77.9%) patients in the placebo group showed an improvement in ACQ. A pooled relative risk of 1.03 (95% CI; 0.96 to 1.11) was calculated based on the data presented in the article, which means that no clinically relevant difference was found.
Medication use
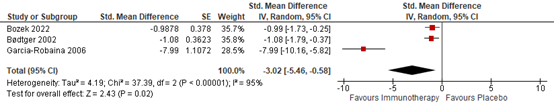
Three studies reported data on medication use that allowed for pooling (Figure 3). Dhami (2017) reported in the meta-analysis only the standardized mean differences of Bødtger (2002) and Garcia-Robaina (2006).
Bozek (2022) reported a total medication score, whereby the intervention had a mean score of 1.07 (SD 0.56) and the placebo group had a mean score of 2.89 (SD 2.56), which resulted in a standardized mean difference noted in Figure 3.
Figure 3. Forest plot of the outcome medication use
Devillier (2016) reported the change in budesonide dose-equivalent compared to baseline of -218.5µg for the intervention group and a reduction of -126.2µg for the placebo group.
Mosbech (2014) reported the mean inhaled corticosteroid reduction compared to baseline for each group of the intervention in the form of a boxplot. The data was extracted using the WebPlotDigitizer tool. The groups consisted of patients taking one, three, and six tablets of the SLIT intervention and this resulted in a change of ICS use compared to placebo of -43µg (95% CI; -99µg to 13µg), -5µg (95% CI; -60µg to 50µg), and -81µg (95% CI; -136 to -27µg), respectively.
Exacerbations
There is a difference in the definitions used in the articles reporting exacerbations. Devillier (2016) defined an exacerbation as: “the presence of symptoms requiring a short course of oral corticosteroid (prednisolone). Asthma exacerbations were further classified as being associated (or not) with an infection requiring the concomitant intake of antibiotics. A transient worsening of asthma not requiring oral corticosteroids was not classified as an SAE.” Virchow (2016) reported moderate and severe exacerbations using the ATS/ARS recommendations. Mosbech (2014) defined an exacerbation as one of the following criteria: need for oral corticosteroid treatment because of asthma, unscheduled visits to the trial site because of asthma, or hospitalization because of asthma worsening.
Devillier (2016) reported an incidence of exacerbations of 3.7% in the intervention group and 4.3% in the placebo group during the twelve-month follow-up. The number of events was calculated using these percentages, resulting in 12 events in 322 patients in the intervention group and 7 events in the 162 patients of the placebo group, with a relative risk of 0.86 (95% CI; 0.35 to 2.15). Additionally, Devillier (2016) reported the number of exacerbations standardized over a year, which was 0.06 (95% CI; 0.02 to 0.11) for the intervention group and 0.04 (95% CI; 0.01 to 0.08) for the control group. The mean difference is -0.02 (95% CI; -0.08 to 0.04), meaning there is no clinically relevant difference.
Virchow (2016) reported the number of exacerbations for each group. In the group that received six tablets per day, 62 (26%) patients experienced an exacerbation. In the group that received twelve tablets per day, 59 (24%) patients experienced an exacerbation. In the placebo group, 83 (32%) patients experienced an exacerbation. Hazard ratios on the time until the first moderate or severe exacerbation between the intervention groups and the placebo group were reported for these groups. Six tablets a day versus placebo showed a hazard ratio (HR) of 0.72 (955 CI; 0.52 to 0.99) and twelve tablets a day versus placebo showed a HR of 0.69 (95% CI; 0.50 to 0.96). This means that the rate of suffering from an exacerbation is 28% and 31% lower in the groups receiving six to twelve tablets a day compared to the control group, respectively.
Mosbech (2014) reported no significant differences between the groups but did not present any data to support this conclusion.
Level of evidence of the literature
The level of evidence regarding the outcome measure asthma control was downgraded by two levels because of study limitations (risk of bias due to incomplete reporting and influence by the sponsor, -2); and conflicting results (inconsistency, -1) to Very Low GRADE.
The level of evidence regarding the outcome measure medication use was downgraded by two levels because of study limitations (risk of bias due to incomplete, -1); and low number of included patients (imprecision) to Low GRADE.
The level of evidence regarding the outcome measure exacerbations was downgraded by three levels because of study limitations (risk of bias due to incomplete reporting and influence by the sponsor, -1); conflicting results (inconsistency, -1); and low number of included patients (imprecision, -1) to Very Low GRADE.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness and safety of allergen immunotherapy (SCIT/SLIT) compared to placebo in patients with non-severe asthma?
| P: | Patients with non-severe asthma |
| I: |
Allergen immunotherapy (subcutaneous immunotherapy (SCIT) or sublingual immunotherapy (SLIT) |
| C: | Placebo |
| O: |
Asthma control, exacerbations, medication use |
Relevant outcome measures
The guideline development group considered asthma control and exacerbations as a crucial outcome measure for decision making; and medication use as an important outcome measure for decision making.
The working group defined the outcome measure asthma exacerbations as follows: number of patients with ≥1 exacerbation during the study period; number of exacerbations per 52 weeks; amount of emergency department visits; amount of severe exacerbations with need of hospitalization per year; amount of exacerbations with need of treatment with oral corticosteroids.
The working group defined the outcome medication use as follows: dose inhaled corticosteroids (at last visit); number of high-dose therapies of prednisolone per year.
The working group defined the outcome control as follows: Asthma Control Questionnaire (ACQ) score.
The working group defined a reduction in annual exacerbation rate or in the risk of having a severe asthma-related event ranging from 20–40% for a given asthma treatment regimen and/or intervention as a MCID for exacerbations, based on Bonini 2020).
For the other dichotomic outcome measures, the working group used the GRADE default limits as limits for clinical decision making, which are defined as a risk ratio (RR) of >1.25 and <0.8 as clinically relevant.
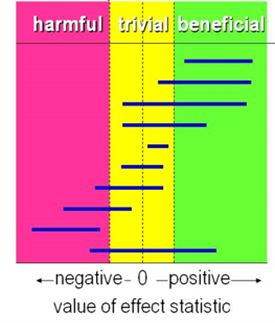
For the continuous outcome measures, the working group defined a difference of 0.5 standard deviation (SD) as clinically relevant. When standardized mean difference (SMD) was used, 0.2 represented a small effect size, 0.5 a medium effect size and 0.8 a large effect size, based on Cohen (1988). Since the objective was to determine whether SLIT or SCIT was more effective than placebo, the results were compared only against the threshold of beneficial effect (figure 1).
Figure 1. Visual representation of the values of clinical decision making for any beneficial effect
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 6th of April, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 600 hits. Studies were selected based on the following criteria: systematic reviews and randomized controlled trials. 27 studies were initially selected based on title and abstract screening. After reading the full text, 22 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Boldovjáková D, Cordoni S, Fraser CJ, Love AB, Patrick L, Ramsay GJ, Ferguson ASJ, Gomati A, Ram B. Sublingual immunotherapy vs placebo in the management of grass pollen-induced allergic rhinitis in adults: A systematic review and meta-analysis. Clin Otolaryngol. 2021 Jan;46(1):52-59. doi: 10.1111/coa.13651. Epub 2020 Oct 9. PMID: 32979035.
- Bonini M, Di Paolo M, Bagnasco D, Baiardini I, Braido F, Caminati M, Carpagnano E, Contoli M, Corsico A, Del Giacco S, Heffler E, Lombardi C, Menichini I, Milanese M, Scichilone N, Senna G, Canonica GW. Minimal clinically important difference for asthma endpoints: an expert consensus report. Eur Respir Rev. 2020 Jun 3;29(156):190137. doi: 10.1183/16000617.0137-2019. PMID: 32499305; PMCID: PMC9488652.
- Bozek A, Galuszka B, Gawlik R, Misiolek M, Scierski W, Grzanka A, Canonica GW. Allergen immunotherapy against house dust mites in patients with local allergic rhinitis and asthma. J Asthma. 2022 Sep;59(9):1850-1858. doi: 10.1080/02770903.2021.1971701. Epub 2021 Sep 6. PMID: 34429002.
- Cohen J. Statistical Power Analysis for the Behavioral Sciences. 2nd ed. New York: Routledge; 1988. 567 p.
- Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Jutel M, Muraro A, Roberts G, Akdis CA, Bonini M, Cavkaytar O, Flood B, Gajdanowicz P, Izuhara K, Kalayci Ö, Mosges R, Palomares O, Pfaar O, Smolinska S, Sokolowska M, Asaria M, Netuveli G, Zaman H, Akhlaq A, Sheikh A. Allergen immunotherapy for allergic asthma: A systematic review and meta-analysis. Allergy. 2017 Dec;72(12):1825-1848. doi: 10.1111/all.13208. Epub 2017 Jul 6. PMID: 28543086.
- Devillier P, Fadel R, de Beaumont O. House dust mite sublingual immunotherapy is safe in patients with mild-to-moderate, persistent asthma: a clinical trial. Allergy. 2016 Feb;71(2):249-57. doi: 10.1111/all.12791. Epub 2015 Nov 6. PMID: 26465232.
- Meadows A, Kaambwa B, Novielli N, Huissoon A, Fry-Smith A, Meads C, Barton P, Dretzke J. A systematic review and economic evaluation of subcutaneous and sublingual allergen immunotherapy in adults and children with seasonal allergic rhinitis. Health Technol Assess. 2013 Jul;17(27):vi, xi-xiv, 1-322. doi: 10.3310/hta17270. PMID: 23827204; PMCID: PMC4780904.
- Mosbech H, Deckelmann R, de Blay F, Pastorello EA, Trebas-Pietras E, Andres LP, Malcus I, Ljørring C, Canonica GW. Standardized quality (SQ) house dust mite sublingual immunotherapy tablet (ALK) reduces inhaled corticosteroid use while maintaining asthma control: a randomized, double-blind, placebo-controlled trial. J Allergy Clin Immunol. 2014 Sep;134(3):568-575.e7. doi: 10.1016/j.jaci.2014.03.019. Epub 2014 May 3. PMID: 24797423.
- Radulovic S, Calderon MA, Wilson D, Durham S. Sublingual immunotherapy for allergic rhinitis. Cochrane Database Syst Rev. 2010 Dec 8;2010(12):CD002893. doi: 10.1002/14651858.CD002893.pub2. PMID: 21154351; PMCID: PMC7001038.
- Rohatgi A. WebPlotDigitizer. https://automeris.io/WebPlotDigitizer version 4.6 September, 2022.
- Tie K, Miller C, Zanation AM, Ebert CS Jr. Subcutaneous Versus Sublingual Immunotherapy for Adults with Allergic Rhinitis: A Systematic Review with Meta-Analyses. Laryngoscope. 2022 Mar;132(3):499-508. doi: 10.1002/lary.29586. Epub 2021 Apr 30. PMID: 33929726.
- Virchow JC, Backer V, Kuna P, Prieto L, Nolte H, Villesen HH, Ljørring C, Riis B, de Blay F. Efficacy of a House Dust Mite Sublingual Allergen Immunotherapy Tablet in Adults With Allergic Asthma: A Randomized Clinical Trial. JAMA. 2016 Apr 26;315(16):1715-25. doi: 10.1001/jama.2016.3964. PMID: 27115376.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Dhami, 2017 |
SR and meta-analysis of RCTs
Literature search up to 31 October 2015
A: Bødtger, 2002 B: Bousquet, 1990 C: Garcia-Robaina, 2006 D: Kuna, 1989 E: Dahl, 2006
Study design: A: Double-blind RCT B: Double-blind RCT C: Double-blind RCT D: Double-blind RCT E: Double-blind RCT
Setting and Country:
A: Denmark B: France C: Spain D: Poland E: Denmark and Sweden
Source of funding and conflicts of interest: Not reported
|
Inclusion criteria SR: Patient characteristics Studies conducted on patients of any age with a physician confirmed diagnosis of asthma, plus evidence of clinically relevant allergic sensitization as assessed by an objective biomarker (e.g. skin prick test or specific IgE), in combination with a history of asthma symptoms due to allergen exposure Interventions of interest AIT for different allergens (eg pollens, house dust mites (HDM), animal dander, cockroach and moulds), administered through either subcutaneous (SCIT) or sublingual (SLIT) routes. Comparator Placebo or any active comparator. Study designs Effectiveness: Double-blind randomized controlled trials (RCTs). Originally, we planned to include data from any RCT, irrespective of whether there was blinding. This was changed due to the large volume of RCT studies. This decision was made prior to any analyses being undertaken. Cost-effectiveness: Health economic analysis. Safety: Double-blind RCTs and large case series (≥300 patients). Outcomes Primary outcomes: Effectiveness, both short-term (ie during treatment) and long-term (ie at least a year after discontinuation of AIT), as assessed by symptom and/or medication scores. Secondary outcomes: Asthma control; asthma-specific quality of life (QoL); exacerbations; lung function; response to environmental exposure chamber or bronchial allergen challenge; health economic analysis from the perspective of the health system/payer; and safety as assessed by local and systemic reactions.
Exclusion criteria SR: Reviews, discussion papers, nonresearch letters and editorials, animal studies and studies not employing double-blind RCT designs.
98 studies included
Important patient characteristics at baseline:
N, mean age A: 35 patients, median age 27 yrs B: 57 patients, median age 24.8 yrs C: 64 patients, mean age 23.65 yrs D: 24 patients, mean age 27.2 yrs E: 114 patients, mean age 36.5 SLIT; 34.1 placebo
Sex: A: 14M/21F B: NR C: 27M/37F D: 17M/7F E: 77M/37F
Groups comparable at baseline? NR |
Describe intervention:
A: Birch pollen extract B: Mixed grass extract C: D pteronyssinus and D farinae extracts (50:50) D: Grass pollen extract E: Timothy grass (Phleum pratense) GRAZAX tablet 75,000 SQ-T once daily
|
Describe control:
A: placebo with histamine B: placebo with histamine C: placebo (NR) D: placebo saline E: placebo
|
End-point of follow-up:
A: 1 year B: 1 year C: 54 weeks D: 1 year E: 19.5 weeks
For how many participants were no complete outcome data available? (intervention/control) A: Intervention: 0 Control: 1 B: Intervention: 0 Control: 0 C: Intervention: 5 Control: 5 D: Intervention: NR Control: NR E: Intervention: NR Control: NR
|
Symptom Score SMD (95% CI) A: -0.24 (-0.91 to 0.42) B: -1.73 (-2.49 to -0.98) C: -4.23 (-5.53 to -2.94) D: -0.25 (-0.65 to 0.13) E: -0.95 (-3.28 to -0.62) Pooled effect: -1.95 (-3.28 to -0.62)
Medication use SMD (95% CI) A: -1.08 (-1.79 to -0.37) B: NR C: -7.99 (-10.16 to – 5.82) D: NR E mean(sd) I: 0.71 (1.28) C: 0.66 (1.08)
Asthma exacerbations A: NR B: NR C: NR D: NR E: NR
|
Risk of bias (high, some concerns or low): Tool used by authors:
A: Low B: Unclear C: Unclear D: Unclear E: Unclear
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Bozek, 2022 |
Type of study: Double-blind placebo-controlled RCT
Setting and country: Hospital, Poland
Funding and conflicts of interest: Funding not reported.
|
Inclusion criteria: >18 years old; well-documented symptoms of mild, moderate, or severe persistent rhinitis according to the Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines clinical mild or moderate asthmatic perennial symptoms with controlled asthma diagnosis based on GINA (Global Initiative for Asthma) guidelines that require inhaled corticosteroids; FEV1 > 75% at baseline; a positive NPT for D. pteronyssinus and D. farinae; negative SPT results for common inhalant allergens, including D. pteronyssinus, D. farinae, grass pollen, hazel, birch, alder, Alternaria, Cladosporium, mugwort, dog and cat dander; negative serum total and allergen-specific IgE results against the mentioned allergens; low level of total serum IgE (<100 IU/L); and negative medical history of atopic diseases.
Exclusion criteria: clinical exacerbation of asthma, uncontrolled asthma, or respiratory infections within 4 weeks prior to the study initiation; nasal polyposis (which is contraindicated for nasal provocation) or other serious diseases or chronic unstable disease; and nose deformity, allergy to other inhalant allergens, or AR. All patients with any of the following characteristics were also excluded: nonallergic rhinitis (especially senile or vasomotor rhinitis, which were excluded after 6 months of clinical observation and result of NPT) and severe nonstable diseases.
N total at baseline: Intervention: 16 Placebo: 14
Important prognostic factors2: Age ± SD: Intervention: 33.7 (3.87) Placebo: 35.9 (4.15)
Sex: Intervention: 44% M / 56% F Placebo: 50% M / 50% F
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Commercially available allergen extracts of D. pteronyssinus and D. farinae (50/50%) in SQ-HDM SLIT tablets (ALK-Abello, Horshol, Denmark) was used. The dosing regimen was based on a procedure according to the provider’s recommendations. Briefly, the first tablet was self-administered by the patient in the center in the presence of a doctor and with 1 h of further observation, and the subsequent tablets were self-administered once per day at home. The tablets were taken in the morning before eating and drinking and held under the tongue until they dissolved.
|
Describe control (treatment/procedure/test):
Identical protocol to the intervention but with a placebo treatment |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 1 (6%) Reasons: non-compliance
Control: 1 (6%) Reasons: non-compliance
Incomplete outcome data: NA
|
Total Asthma Symptom Score (mean ± SD) SLIT: 0.28 (0.27) Placebo: 1.29 (0.88)
Total Medication Score (mean ± SD) SLIT: 1.07 (0.56) Placebo: 2.89 (2.56) P<0.05
N.B. These results are according to the intention-to-treat protocol |
|
|
Devillier, 2016 |
Type of study: Double-blind placebo-controlled RCT
Setting and country: Hospital, China
Funding and conflicts of interest: Philippe Devillier has received consulting fees, honoraria for lectures and/or research funding from Schering-Plough-MSD, Sanofi-Aventis, GlaxoSmithKline, Chiesi, AstraZeneca, ALK and Stallergenes. Riad Fadel and Olivier de Beaumont are employees of Stallergenes. The study was funded by Stallergenes. |
Inclusion criteria: The study population consisted of adult patients (aged 16–50) having suffered from mild or moderate, persistent, HDM-induced asthma for at least previous 12 months. Asthma was diagnosed with a bronchial reversibility test ( ≥ 12% after inhalation of b2-agonist) or a positive methacholine challenge within the previous year or at screening. Sixty percent of the patients were being treated with inhaled corticosteroids (ICSs) at V1, and the remainder were started on budesonide (from 200 lg to 1000 lg/day) at that time. Sensitization to Dermatophagoides pteronyssinus (D. pt) and Dermatophagoides ides farinae (D. far) allergens was confirmed by skin prick tests (wheal diameter: ≥ 4 mm) and specific serum IgE (≥ 0.70 kU/l).
Exclusion criteria: Previous AIT, severe asthma, cosensitization to confounding aero-allergens and a smoking history of more than 10 pack-years.
N total at baseline: Intervention: 322 Control: 162
Important prognostic factors2: Age ± SD: Intervention: 31.2 (9.0) Placebo: 31.3 (8.2)
Sex: Intervention: 46.8% M / 53.2% F Placebo: 41.4% M / 58.6% F
Groups comparable at baseline? Yes
|
The aqueous STALORALâ SLIT solution (Stallergenes, Antony, France) contained equal proportions of D. pt. and D. far extracts. The daily 300 index of reactivity (IR) maintenance dose corresponds to approximately 28 lg Der p 1 and 50 lg Der f 1.
The study consisted of a screening phase, a 12-week base- line phase and a 12-month treatment phase. In compliance with international guidelines on the minimum clinically effective dose of ICS, a budesonide dose step-down was initiated at V3 and again at V4 if the patient had WCA (as defined in GINA) in the 4 weeks preceding the visit, an Asthma Control Questionnaire (ACQ) score at 1.50 (13) and a FEV1 ≥ 80% of the predicted value. At V5, patients were randomized 2 : 1 to active treatment or placebo. After 24 weeks of treatment, a second, 16-week budesonide step-down phase was initiated to identify a possible steroid-sparing effect of AIT. Patients filled out a daily record card. |
Identical to the intervention but with a placebo treatment |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 14 (4%) Reasons: Withdrawn due to adverse events (n = 8) Withdrew consent (n = 6)
Placebo: 4 (3%) Reasons: Withdrawn due to adverse events (n = 1) Withdrew consent (n = 3)
Incomplete outcome data: NA
|
Exacerbations Incidence Intervention: 3.7% Placebo: 4.3%
Standardised mean (95% CI) Intervention: 0.06 (0.02 to 0.11) Placebo: 0.04 (0.01 to 0.08)
Medication use Reduction in budesonide dose equivalent compared to baseline Intervention: -218.5µg Placebo: -126.2µg P<0.004
N.B. in moderate asthma; no difference found in mild asthma and no data reported.
|
|
|
Mosbech, 2014 |
Type of study: Double-blind placebo-controlled RCT
Setting and country: Denmark, Germany, Italy, Spain, United Kingdom, Sweden, France, and Poland.
Funding and conflicts of interest: Sponsored by ALK-Abelló, Hørsholm, Denmark, who assumes overall responsibility for the trial and has been involved in both trial design and conduct. Disclosure of potential conflict of interest: H. Mosbech has received consultancy fees for help in preparation of protocol, has received support for travel to European congresses and international allergologic and pulmonologic congresses, is an advisory board member, and has received lecture fees for postgraduate educational activities on allergologic topics from ALK-Abello. F. de Blay has received research support, consultancy fees, travel support, and participation fees from ALK-Abello; is a board member for and has received consultancy fees from Novartis, Boehringer, Stallergenes, and Meda Pharma; has received research support from AstraZeneca; and has received lecture fees from Novartis, Stallergenes, Meda Pharma, GlaxoSmithKline, and MSD. L. Prieto Andres is a board member for GlaxoSmith- Kline, Novartis, and Stallergenes and has received lecture fees from GlaxoSmithKline and Novartis. C. Ljørring is employed by and has stock/stock options in ALK-Abello. G. W. Canonica has received research support from ALK-Abello, Almirall, Allergy Therapeutics, Allergopharma, Anallergo, HAL, Lofarma, and Stallergenes. The rest of the authors declare that they have no relevant conflicts of interest |
Inclusion criteria: Male or female subjects aged 14 years or greater; a clinical history of HDM-induced mild-to-moderate persistent asthma (steps 2 and 3 in GINA 2002 Guideline) of at least 1 year’s duration before trial entry; use of an appropriate amount of ICS (in accordance with the GINA 2002 Guideline) for the control of the mild-to-moderate persistent asthma symptoms for a period of 6 months within the past year; controlled asthma at randomization and an ICS dose of 100 to 800 mg/d; a clinical history consistent with mild-to-severe (according to the Allergic Rhinitis and its Impact on Asthma guideline) HDM-induced allergic rhinitis for at least 1 year; positive diagnostic test results to HDM (ie, skin prick tests with a wheal size ≥3 mm to D. farinae, D. pteronyssinus, or both [Soluprick SQ; ALK] and specific IgE test results against D farinae extract, D pteronyssinus extract, or both ≥CAP class 2 [performed by ACM-Pivotal, United Kingdom]); and a documented history of reversible airway obstruction.
Exclusion criteria: FEV1 less than 70% of predicted value with appropriate medication; a clinical history of allergy with symptoms to a perennial allergen or a seasonal allergen causing symptoms in the pretreatment ICS adjustment and/or stable periods; a clinical history of severe asthma within the last 2 years before enrollment; AIT with HDM allergen within the previous 5 years before randomization; concurrent or previous (within the last 6 months before randomization) AIT with other allergens than HDM; and history of anaphylactic shock or angioedema.
N total at baseline: 1: 146 3: 159 6: 156 Placebo: 143
Important prognostic factors2: Age (95% CI) 1: 32.2 (18.1 to 53.7) 3: 32.2 (16.0 to 55.1) 6: 32.2 (17.1 to 57.0) Placebo: 31.8 (17.3 to 52.0) (data extracted from boxplot using WebPlotDigitizer)
Sex: 50% M/ 50% F
Groups comparable at baseline? Yes |
Subjects were randomized (1:1:1:1) to double-blinded treatment with 1, 3, or 6 SQ-HDM or placebo as 1 daily tablet administered sublingually. Subjects received intervention treatment for approximately 12 months.
The tablets (active and placebo) were manufactured and provided by the sponsor and were oral lyophilisates containing standardized extracts of D. pteronyssinus and D. farinae in a 1:1 ratio or a placebo that was similar in appearance, smell, and taste. Three active strengths were investigated: 1, 3, and 6 SQ-HDM. In previous publications (abstracts and phase I publication9), the units were designated in development units. One development unit corresponds to 1 SQ-HDM. The sponsor provided ICS and rescue medication to relieve asthma and rhinoconjunctivitis symptoms. |
See intervention |
Length of follow-up: 52 weeks
Loss-to-follow-up: 1: 14 (10%) Withdrawal of consent 3 (2%) Pregnancy 1 (<1%) Lost to follow-up 2 (1%) Noncompliance 3 (2%) AE 2 (1%) Other 3 (2%)
3: 25 (16%) Withdrawal of consent 6 (4%) Pregnancy 2 (1%) Lost to follow-up 4 (3%) Noncompliance 3 (2%) AE 8 (5%) Other 2 (1%)
6: 16 (10%) Withdrawal of consent 3 (2%) Lost to follow-up 3 (2%) Noncompliance 5 (3%) AE 4 (3%) Other 1 (<1%)
Control: 17 (12%) Withdrawal of consent 3 (2%) Pregnancy 2 (1%) Lost to follow-up 5 (3%) Noncompliance 3 (2%) AE 1 (<1%) Other 3 (2%)
Incomplete outcome data: NA
|
ICS reduction: Mean (95% CI) compared to placebo 1: -43µg (-99µg to 13µg) 3: -5µg (-60µg to 50µg) 6: -81µg (-136 to -27µg) (data extracted from boxplot using WebPlotDigitizer)
Asthma control (ACQ) No usable data was reported
Exacerbations No data were reported other that there were no significant differences between groups
|
Sponsored by industry
|
|
Virchow, 2016 |
Type of study: Double-blind placebo-controlled RCT
Setting and country: 109 sites in 13 European countries
Funding and conflicts of interest: This trial was sponsored by ALK, Denmark. All authors have completed and submitted the ICMJE Form for Disclosure of Potential Conflicts of Interest. Dr Virchow reports receiving grant funding from Deutsche Forschungsgemeinschaft, Land Mecklenburg-Vorpommern, GlaxoSmithKline, Merck Sharp & Dohme; honoraria from Allergopharma, ALK, Chiesi, AstraZeneca, Avontec, Bayer, Bencard, Berlin-Chemie, Bionorica, Boehringer Ingelheim, Essex/Schering-Plough, GlaxoSmithKline, Janssen-Cilag, Kyorin, Leti, Meda, Merck/Merck Sharp & Dohme, Mundipharma, Novartis, Nycomed/Altana, Pfizer, Revotar, Sandoz-Hexal, Stallergenes Greer, Takeda, Teva, UCB/Schwarz Pharma, Zydus/Cadila; and serving on advisory boards for ALK, Asche Chiesi, Avontec, Berlin-Chemie, Boehringer Ingelheim, Essex/ Schering-Plough, GlaxoSmithKline, Janssen-Cilag, Merck Sharp & Dohme/Merck, Mundipharma, Novartis, Revotar, Sandoz-Hexal, UCB/Schwarz- Pharma, Takeda. Dr Backer reports receiving grant funding from Pfizer, Novartis, Merck Sharp & Dohme/Merck, Teva, Norpharma, FAPS, Lundbeck foundation, Danish Lung Association, and the Asthma and Allergy Association; honoraria from ALK, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Janssen, Meda, Merck/Merck Sharp & Dohme, Mundipharma, Novartis, Nycomed, Sandoz, Takeda, Teva; and serving on advisory boards for ALK, AstraZeneca, GlaxoSmithKline, Janssen, Merck Sharp & Dohme/Merck, Mundipharma, Novartis, Sandoz, RSPR Pharma, Takeda. Dr Kuna reports receiving honoraria from Adamed, Allergopharma, Almirall, AstraZeneca, Boehringer Ingelheim, Celon Pharma, Chiesi, FAES, GlaxoSmithKline, Hal, Meda, Merck Sharp & Dohme, Novartis, Pfizer, Polfarmex, Polpharma, Stallergenes Greer, Teva, Lekam, Bayer. Dr Prieto reports receiving grants and personal fees from Novartis, ALK, Stallergenes Greer, GlaxoSmithKline. Dr Blay reports receiving grant funding from Anergis, AstraZeneca, ALK, Amgen, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Novartis, Mundipharma, Roche, and Stallergenes Greer, and personal fees from Anergis, AstraZeneca, ALK, GlaxoSmithKline, Novartis, Mundipharma, Stallergenes Greer. |
Inclusion and exclusion criteria: Eligible patients were adults with a positive result for the HDM specific serum immunoglobulin E (IgE) and skin prick test; a clinical history of more than 1 year of allergic asthma and allergic rhinitis with HDM being considered clinically as a major trigger, not well controlled by ICS equivalent to budesonide, 400-1200 μg) at inclusion; and a forced expiratory volume in the first second of expiration (FEV1) at randomization of 70% or more of predicted value. The Asthma Control Questionnaire (ACQ) score required for randomization had to be from 1 through 1.5 (score range, 0-6; values below 1 = controlled asthma, values above 1.5 = uncontrolled asthma). Hospitalization due to an asthma exacerbation within 3 months prior to randomization was an exclusion criterion. Participants could have multiple sensitizations but were not allowed to have a relevant clinical history of perennial allergic asthma or rhinitis caused by other allergens.
N total at baseline: 6: 275 12: 282 Placebo: 277
Important prognostic factors2: Age ± SD: 6: 33.6 (11.3) 12: 33.7 (11.6) Placebo: 33.0 (12.2)
Sex: 6: 48% M/52% F 12: 52% M/ 48% F Placebo: 55% M/45% F
Groups comparable at baseline? Yes |
The HDM SLIT tablet contains extract from 2 species of cultivated HDM (Dermatophagoides pteronyssinus and Dermatophagoides farinae), produced in a standardized process with a 1:1:1:1 ratio of the major allergens (Group 1 allergens of D. farinae and D. pteronyssinus and Group 2 allergens of D. farinae and D. pteronyssinus), and formulated as a rapidly dissolving oral lyophilisate for sublingual administration (ALK). The biological activity of the HDM SLIT tablet is related to the activity of the allergens and is expressed in the unit SQ-HDM. The placebo and active products were similar in appearance, smell, and taste. One tablet per day was to be placed under the tongue, preferably in the morning. Eating and drinking was not allowed for 5 minutes. The maximum duration of treatment with the SLIT tablet was 18 months. Period 1 included screening and switching of all participants from their regular ICS asthma controller to budesonide and SABA. Diary recordings of the last 2 weeks of period 1 served as participant's individual baseline. From randomization and throughout period 2, the participants received their assigned intervention in addition to ICS and SABA. The duration of the period varied from 7 to 12 months depending on the time of inclusion because period 2 had a fixed stop date in October. During the last approximately 4 weeks of period 2, the participant started filling in the electronic diary and recorded asthma symptoms, medication use, and lung function twice daily. Efficacy was primarily assessed during the ICS reduction and withdrawal period (period 3) that began in October 2012 and covered the last 6 months of the treatment period. Daily ICS use was reduced to 50% for 3 months and subsequently withdrawn completely for participants who did not experience an asthma exacerbation. The primary end point, time to first moderate or severe asthma exacerbation (defined below), was measured from the start of period 3 until the time of the first asthma exacerbation.
|
See intervention
|
Length of follow-up: 6 months
Loss-to-follow-up: 6: 38 Discontinuations during period 2b (14%) 9 Adverse events 1 Lack of efficacy 3 Lost to follow-up 5 Nonadherent to protocol 1 Pregnancy 14 Withdrawal of consent 5 Other
12: 21 Adverse events 1 Lack of efficacy 1 Lost to follow-up 1 Nonadherent to protocol 1 Pregnancy 7 Withdrawal of consent 2 Other
Placebo: 3 Adverse events 1 Lack of efficacy 2 Lost to follow-up 1 Nonadherent to protocol 4 Pregnancy 8 Withdrawal of consent 1 Other
Incomplete outcome data: NA
|
Time to first moderate or severe exacerbation compared to placebo HR (95% CI) 0.70 (0.50 to 0.97)
Asthma control compared to placebo OR (95% CI) 1.18 (0.82 to 1.69)
|
Sponsored by industry |
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders]
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Ankermann, T., & Brehler, R. (2023). Allergic asthma: An indication for allergen immunotherapy. Allergologie select, 7, 33–38. https://doi.org/10.5414/ALX02332E |
Wrong study design: description of systematic reviews without methods |
|
Asamoah, F., Kakourou, A., Dhami, S., Lau, S., Agache, I., Muraro, A., Roberts, G., Akdis, C., Bonini, M., Cavkaytar, O., Flood, B., Izuhara, K., Jutel, M., Kalayci, Ö., Pfaar, O., & Sheikh, A. (2017). Allergen immunotherapy for allergic asthma: a systematic overview of systematic reviews. Clinical and translational allergy, 7, 25. https://doi.org/10.1186/s13601-017-0160-0 |
Quality not well enough and no meta-analysis performed |
|
Blanco, C., Bazire, R., Argiz, L., & Hernández-Peña, J. (2018). Sublingual allergen immunotherapy for respiratory allergy: a systematic review. Drugs in context, 7, 212552. https://doi.org/10.7573/dic.212552 |
Few studies with (allergic) asthma and those that were relevant, were included elsewhere |
|
Caimmi, D., & Demoly, P. (2022). A review of allergen immunotherapy in asthma. Allergy and asthma proceedings, 43(4), 310–313. https://doi.org/10.2500/aap.2022.43.210113 |
Wrong study design: narrative review |
|
Calderón, M. A., & Bacharier, L. B. (2021). Controversies in Allergy: A Pro/Con Review of Sublingual Allergen Immunotherapy and Allergic Asthma. The journal of allergy and clinical immunology. In practice, 9(5), 1818–1825. https://doi.org/10.1016/j.jaip.2021.02.029 |
Wrong study design: clinical review |
|
de Blay, F., Kuna, P., Prieto, L., Ginko, T., Seitzberg, D., Riis, B., & Canonica, G. W. (2014). SQ HDM SLIT-tablet (ALK) in treatment of asthma--post hoc results from a randomised trial. Respiratory medicine, 108(10), 1430–1437. https://doi.org/10.1016/j.rmed.2014.07.017 |
Subgroup of a larger trial (Mosbech 2014) |
|
Dominguez-Ortega, J., Delgado, J., Blanco, C., Prieto, L., Arroabarren, E., Cimarra, M., Henriquez-Santana, A., Iglesias-Souto, J., Vega-Chicote, J. M., & Tabar, A. I. (2017). Specific allergen immunotherapy for the treatment of allergic asthma: a review of current evidence. Journal of investigational allergology & clinical immunology, 27(Suppl. 1), 1–35. https://doi.org/10.18176/jiaci.0149 |
Quality not well enough to include the review, no meta-analysis performed |
|
Elliott, J., Kelly, S. E., Johnston, A., Skidmore, B., Gomes, T., & Wells, G. A. (2017). Allergen immunotherapy for the treatment of allergic rhinitis and/or asthma: an umbrella review. CMAJ open, 5(2), E373–E385. https://doi.org/10.9778/cmajo.20160066 |
Quality not well enough to include the review of reviews |
|
Clinical outcome of allergen-specific subcutaneous immunotherapy vaccines in respiratory allergic diseases: 2-year study at mansoura university, Egypt |
No FT available |
|
Role of sublingual immunotherapy in the treatment of asthma: An updated systematic review |
No individual study data; only combined data |
|
Lin, S. Y., Azar, A., Suarez-Cuervo, C., Diette, G. B., Brigham, E., Rice, J., Ramanathan, M., Jr, & Robinson, K. A. (2018). Role of sublingual immunotherapy in the treatment of asthma: An updated systematic review. International forum of allergy & rhinology, 8(9), 982–992. https://doi.org/10.1002/alr.22152 |
More recent systematic review available |
|
Mosbech, H., Canonica, G. W., Backer, V., de Blay, F., Klimek, L., Broge, L., & Ljørring, C. (2015). SQ house dust mite sublingually administered immunotherapy tablet (ALK) improves allergic rhinitis in patients with house dust mite allergic asthma and rhinitis symptoms. Annals of allergy, asthma & immunology : official publication of the American College of Allergy, Asthma, & Immunology, 114(2), 134–140. https://doi.org/10.1016/j.anai.2014.11.015 |
No relevant outcomes measures |
|
Mösges, R., Valero Santiago, A., Allekotte, S., Jahed, N., Astvatsatourov, A., Sager, A., & Sánchez-López, J. (2019). Subcutaneous immunotherapy with depigmented-polymerized allergen extracts: a systematic review and meta-analysis. Clinical and translational allergy, 9, 29. https://doi.org/10.1186/s13601-019-0268-5 |
Doubt about intervention. No subgroup analysis performed based on age, one study published in 2012 and one in 2013 |
|
Fortescue, R., Kew, K. M., & Leung, M. S. T. (2020). Sublingual immunotherapy for asthma. The Cochrane database of systematic reviews, 9(9), CD011293. https://doi.org/10.1002/14651858.CD011293.pub3 |
Only performed subgroup analysis for age for adverse events |
|
Tao, L., Shi, B., Shi, G., & Wan, H. (2014). Efficacy of sublingual immunotherapy for allergic asthma: retrospective meta-analysis of randomized, double-blind and placebo-controlled trials. The clinical respiratory journal, 8(2), 192–205. https://doi.org/10.1111/crj.12058 |
Wrong design: retrospective cohort |
|
Virchow J. C. (2019). Allergen immunotherapy (AIT) in asthma. Seminars in immunology, 46, 101334. https://doi.org/10.1016/j.smim.2019.101334 |
Wrong design: not systematic review |
|
Vogelberg, C., Klimek, L., Brüggenjürgen, B., & Jutel, M. (2022). Real-world evidence for the long-term effect of allergen immunotherapy: Current status on database-derived European studies. Allergy, 77(12), 3584–3592. https://doi.org/10.1111/all.15506 |
Patients without asthma were also included (wrong P), comparison is not clear (wrong C), some studies research allergen immunotherapy in general (wrong I) |
|
Wongsa, C., Phinyo, P., Sompornrattanaphan, M., Krikeerati, T., Lumkul, L., & Thongngarm, T. (2022). Efficacy and Safety of House Dust Mite Sublingual Immunotherapy Tablet in Allergic Asthma: A Systematic Review of Randomized Controlled Trials. The journal of allergy and clinical immunology. In practice, 10(5), 1342–1355.e24. https://doi.org/10.1016/j.jaip.2022.01.046 |
Review also includes two RCTs with allergic rhinitis without asthma and also includes RCTs which use no intervention as comparison |
|
Xu, K., Deng, Z., Li, D., Yuan, H., Liu, C., Chen, Z., & Zhu, L. (2018). Efficacy of add-on sublingual immunotherapy for adults with asthma: A meta-analysis and systematic review. Annals of allergy, asthma & immunology : official publication of the American College of Allergy, Asthma, & Immunology, 121(2), 186–194. https://doi.org/10.1016/j.anai.2018.05.019 |
No different studies were included that already weren't included in Dhami (2017) |
|
Eltoum, T and Fadelelmoula, Y. Efficacy of immunotherapy in adults with bronchial asthma: A mini-systematic review of randomised clinical trials The African journal of respiratory medicine, Vol.13(1), pp.4-7. |
No clear description of comparisons made. |
|
Zhang, W., Lin, C., Sampath, V., & Nadeau, K. (2018). Impact of allergen immunotherapy in allergic asthma. Immunotherapy, 10(7), 579–593. https://doi.org/10.2217/imt-2017-0138 |
No methods section: no systematic search performed |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-11-2025
Beoordeeld op geldigheid : 12-09-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met niet-acute astma in de tweedelijn.
Werkgroep
- Dr. B. (Bas) Langeveld, longarts, werkzaam in het Deventer ziekenhuis te Deventer, NVALT (voorzitter)
- Dr. A. (Astrid) Aardenburg – van Huisstede, longarts, werkzaam in Noordwest Ziekenhuisgroep
- Dr. M (Marijke) Amelink, longarts, werkzaam in het Spaarne Gasthuis te Haarlem, NVALT
- Drs. L.M. (Leonie) Imming, longarts, werkzaam in Medisch Spectrum Twente te Enschede, NVALT
- Dr. B. (Bart) Hilvering, longarts, werkzaam in het Amsterdam UMC te Amsterdam, NVALT
- Dr. J.N.G. (Hanneke) Oude Elberink, allergoloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NIV/NVvAKI
- Dr. M.E. (Marjolein) Cornet, KNO-arts, werkzaam in het Alrijne ziekenhuis te Leiden, NVKNO
- Prof. dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- Drs. M.H.A. (Mariëtte) Scholma-Bronsema, verpleegkundige specialist Astma/COPD/OSA, werkzaam in het Wilhelmina Ziekenhuis te Assen, V&VN
- Drs. Y. (Yvonne) Kappe, senior beleidsadviseur, Longfonds & VND
- Drs. E.M. (Esther) van der Roest, ervaringsdeskundige, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
Klankbordgroep
- Wendy Bokxem, Verpleegkundig specialist longgeneeskunde i.o, werkzaam in Ziekenhuisgroep Twente te Hengelo, V&VN
Met ondersteuning van
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.N. (Nynke) Kampstra, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. B. (Bas) Langeveld, (voorzitter) |
Longarts, Deventer ziekenhuis |
Incidenteel deelname adviesraad industrie (AstraZeneca, Novartis, GSK) over biologicals (betreft ernstig astma, dit valt buiten scope van de richtlijn) |
Deelname Studies: AstraZeneca: ANDHI, tot 2019 GSK: NIMBLE, start 2e kwartaal 2022 (PI) Studies betreffen middelen voor de behandeling van ernstig astma, dit valt buiten de inhoud van deze richtlijn. Opbrengst komt ten goede van de onderzoeksafdeling longziekten van het Deventer ziekenhuis |
Geen restricties (ernstig astma valt buiten deze richtlijn). Deelname adviesraad wordt neergelegd gedurende richltijnontwikkeling. |
|
Dr. A. (Astrid) Aardenburg – van Huisstede |
Longarts, Noordwest Ziekenhuisgroep |
Bijscholing huisartsen CASPIR (betaald) Principal Investigator diverse onderzoeken opgezet door farmacie (betaald) |
Voor alle genoemde studies lokale projectleider: * UMCG - High-flow therapie bij COPD * Astra Zeneca - Oberon studie (COPD) * Franciscus Gasthuis - Tricolon studie (COPD) * Rapsodie database ernstig astma - Geen projectleider |
Geen restricties |
|
Dr. M (Marijke) Amelink |
Longarts, Spaarne ziekenhuis |
Research waarbij unrestricted grant van teva (onbetaald voor mij) mbt ernstig astma. - spreker caspir cursus (betaald via caspir) - verschillende keren een adviesraad gedaan voor pharmacie (eenmalige vergoeding voor astra Z, GSK, Sanofi) - mede voorzitter noord NL symposium met Els Weersink (sponsor chiesi, onbetaald). Staat los van astma. Ik heb geen aandelen, opties of financiële belangen bij een bedrijf. Geen lopend betaald adviseurschap. |
1 unrestricted grand mbt ernstig astma |
Geen restricties |
|
Drs. L.M. (Leonie) Imming |
Longarts, MST |
Geen |
GSK: NIMBLE, start 2e kwartaal 2022. Studie betreft middelen voor de behandeling van ernstig astma, dit valt buiten de inhoud van deze richtlijn. |
Geen restricties |
|
Dr. B. (Bart) Hilvering |
Longarts, Amsterdam UMC |
Incidenteel advisory boards en voordrachten over ernstig astma door GSK, AstraZeneca, Sanofi, dit valt buiten de scope van de richtlijn |
Lokale PI voor de AIRLEAF en CLAIRLEAF studie, geïnitieerd door Boehringer Ingelheim, medicatie voor bronchiectasieen, dit valt buiten de scope van de richtlijn |
Geen restricties |
|
Dr. J.N.G. (Hanneke) Oude Elberink |
Internist-allergoloog, UMCG |
Geen |
Geen |
Geen restricties |
|
Dr. M.E. (Marjolein) Cornet |
KNO-arts, Alrijne ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Prof. dr. J.W.M. (Jean) Muris |
Geen |
Geen |
Geen |
Geen restricties |
|
M.H.A. (Mariëtte) Scholma-Bronsema |
Verpleegkundig specialist longziekten Wilhelmina Ziekenhuis Assen |
Vrijwilliger longfonds voorzitter kwaliteitsteam Assen van de Huisartsen Zorg Drenthe. Lid van transmurale zorg aanpak astma-COPD (landelijke commissie). |
Geen |
Geen restricties |
|
Drs. Y. (Yvonne) Kappe |
Projectleider Longfonds en astmaVereniging Nederland en Davos
|
Geen |
Geen |
Geen restricties |
|
Drs. E.M. (Esther) van der Roest |
ErvaringsdeskundigeastmaVereniging Nederland en Davos |
Geen |
Geen |
Geen restricties |
|
S.T.M. (Saskia) van Dorst |
Ervaringsdeskundige Longfonds |
Geen |
Geen |
Geen restricties |
Klankbordgroep
|
Klankbordgroep lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. W. (Wendy) Bokxem |
Verpleegkundig specialist longgeneeskunde, ZGT Hengelo |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van astmaVereniging Nederland en Davos en Longfonds in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kopje waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patientenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz. Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
| Module |
Uitkomst raming |
Toelichting |
|
Allergeen immunotherapie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met niet-acute astma. Tevens zijn er (aanvullende) knelpunten aangedragen door de Nederlandse Associatie Physician Assistants, Longfonds en Astma Vereniging Nederland en Davos, NVALT-sectie astma & allergie, COPD & Astma Huisartsen Advies Groep en de Nederlandse Vereniging van Ziekenhuizen via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVALT tweedelijns astmazorg |
|
|
Uitgangsvraag: UV3 kinderen, UV6 volwassenen: What is the effectiveness and safety of allergen immunotherapy (SCIT/SLIT) compared to usual care in patients with non-severe asthma? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 6-4-2023 |
|
Periode: 2012- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: Asthma AND allergen immunotherapy Alle sleutelartikelen worden gevonden |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 6-4-2023 met relevante zoektermen gezocht vanaf 2012 naar systematische reviews en RCTS over allergeen immunotherapie bij patiënten met astma. De literatuurzoekactie leverde 600 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
289 |
176 |
316 |
|
RCTs |
248 |
190 |
284 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
600 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#14 |
#4 AND #13 sleutelartikelen gevonden |
3 |
|
#13 |
#11 OR #12 |
537 |
|
#12 |
#8 AND #10 NOT #11 RCT |
248 |
|
#11 |
#8 AND #9 SR |
289 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2034822 |
|
#9 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#8 |
#7 AND [2013-2023]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2331 |
|
#7 |
#5 AND #6 |
9035 |
|
#6 |
'desensitization'/exp OR 'allergen immunotherapy':ti,ab,kw OR 'antianaphylaxis':ti,ab,kw OR 'desensibilization':ti,ab,kw OR 'desensitisation':ti,ab,kw OR 'desensitization':ti,ab,kw OR 'hyposensibilization':ti,ab,kw OR 'hyposensitisation':ti,ab,kw OR 'hyposensitization':ti,ab,kw OR 'subcutaneous immunotherapy'/exp OR 'scit':ti,ab,kw OR 'subcutaneous immunotherapy':ti,ab,kw OR 'sublingual immunotherapy'/exp OR 'slit':ti,ab,kw OR 'sublingual immunotherapy':ti,ab,kw |
76375 |
|
#5 |
'asthma'/exp OR 'bronchus hyperreactivity'/exp OR 'airway obstruction'/exp OR (((airway OR airflow OR repirator*) NEAR/2 (obstruct* OR occlusion* OR closure)):ti,ab,kw) OR ((bronch* NEAR/2 (hyperreactiv* OR 'hyper reactiv*' OR hyperrespons* OR 'hyper respons*')):ti,ab,kw) OR asthma*:ti,ab,kw OR breathles*:ti,ab,kw OR 'wheezing'/exp OR 'sibilant respiration':ti,ab,kw OR 'sibilant rhonchi':ti,ab,kw OR wheez*:ti,ab,kw OR panting:ti,ab,kw OR gasping:ti,ab,kw |
427664 |
|
#4 |
#1 OR #2 OR #3 sleutelartikelen |
3 |
|
#3 |
'allergen-specific immunotherapy in the treatment of pediatric asthma' |
1 |
|
#2 |
'allergen immunotherapy for asthma prevention' |
1 |
|
#1 |
'allergen immunotherapy for allergic asthma: a systematic review and meta-analysis' |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
9 |
(5 and 7) not 8 RCT |
190 |
|
8 |
5 and 6 SR |
176 |
|
7 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1601407 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
659916 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1550 |
|
4 |
limit 3 to yr="2012 -Current" |
1727 |
|
3 |
1 and 2 |
4649 |
|
2 |
exp Desensitization, Immunologic/ or allergen immunotherapy.ti,ab,kf. or antianaphylaxis.ti,ab,kf. or desensibilization.ti,ab,kf. or desensitisation.ti,ab,kf. or desensitization.ti,ab,kf. or hyposensibilization.ti,ab,kf. or hyposensitisation.ti,ab,kf. or hyposensitization.ti,ab,kf. or scit.ti,ab,kf. or subcutaneous immunotherapy.ti,ab,kf. or slit.ti,ab,kf. or sublingual immunotherapy.ti,ab,kf. |
56694 |
|
1 |
exp Asthma/ or Bronchial Hyperreactivity/ or Airway Obstruction/ or ((airway or airflow or repirator*) adj2 (obstruct* or occlusion* or closure)).ti,ab,kf. or (bronch* adj2 (hyperreactiv* or hyper reactiv* or hyperrespons* or hyper respons*)).ti,ab,kf. or asthma*.ti,ab,kf. or wheez*.ti,ab,kf. or breathles*.ti,ab,kf. |
245207 |