Mammacarcinoom na Hodgkinlymfoom
Uitgangsvraag
Hoe hoog is het risico op mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom, en wat zijn de risicofactoren hiervoor?
Zijn er adequate methoden om mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom vroeg op te sporen?
Zijn er specifieke methoden nodig om mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom te behandelen?
Aanbeveling
Borstzelfonderzoek
Borstzelfonderzoek leidt niet tot vroegere detectie van mammacarcinoom of tot minder sterfte hier aan, maar wel worden veel tumoren gedetecteerd na het vinden van een palpabele afwijking door de vrouw zelf. Vrouwen kunnen dan ook zelf beslissen of zij borstzelfonderzoek willen doen of niet. Bespreek dit tijdens het eerste bezoek op de polikliniek. Wanneer de vrouw kiest voor borstzelfonderzoek: uitleg geven volgens de folder “borstzelfonderzoek” van de Borstkankervereniging Nederland.
Borstkankersscreening voor vrouwen behandeld met radiogherapie op de borst voor de leeftijd van 40 jaar
Tabel 1. Richtlijn voor borstkankerscreening voor vrouwen behandeld met radiotherapie op de borst voor de leeftijd van 40 jaar
Start screening 8 jaar na behandeling, maar niet voor de leeftijd van 25 jaar
|
Leeftijd bij screening |
Onderzoek |
|
25-30 jaar |
Jaarlijks klinisch borstonderzoek en MRI |
|
30-60 jaar |
Jaarlijks klinisch borstonderzoek, mammografie en MRI via de polikliniek |
|
60-70 jaar |
1 keer per 2 jaar klinisch borstonderzoek en mammografie via de polikliniek |
|
70-75 jaar |
1 keer per 2 jaar mammografie via het bevolkingsonderzoek |
|
Na preventieve operatie |
Geen indicatie voor screening |
Familieanamnese
Vraag naar het voorkomen van borst- en eierstokkanker bij eerste- en tweedegraads verwanten, zoals beschreven in de NABON-richtlijn Mammacarcinoom.138
Chirurgie
Bij het behandelen van mammacarcinoom na eerdere radiotherapie heeft mastectomie de voorkeur boven lumpectomie met radiotherapie. Bij vrouwen die radiotherapie op de borst hebben gehad voor hun 20e kan een preventieve mastectomie overwogen worden, evenals een contralaterale mastectomie indien mammacarcinoom wordt vastgesteld en de prognose goed is.
Chemotherapie
Bij het behandelen van mammacarcinoom na hodgkinlymfoom dient rekening gehouden te worden met de eerdere behandeling met anthracyclines in verband met het verhoogde risico op cardiomyopathie.
Overige adviezen
De werkgroep adviseert dat vrouwen met mammacarcinoom na hodgkinlymfoom na het afronden van de standaard behandeling en controles voor mammacarcinoom weer gecontroleerd worden op mammacarcinoom volgens de BETER-richtlijnen. Daarnaast dient aandacht te worden besteed aan de familieanamnese (zie NABON-richtlijn Mammacarcinoom).138 Voor het gebruik van hormonale substitutie wordt verwezen naar de BETER-richtlijn Fertiliteit en osteoporose.
Overwegingen
Het risico op mammacarcinoom bij vrouwelijke overlevers van hodgkinlymfoom die voor hun 20e behandeld zijn met radiotherapie waarbij een deel van het borstweefsel in het bestralingsgebied heeft gelegen is vergelijkbaar met dat van BRCA-mutatiedraagsters. In de NABON-richtlijn Mammacarcinoom (2012) wordt aan vrouwen die voor hun 40e bestraald zijn op de thorax of oksel hetzelfde screeningsprogramma geadviseerd als voor vrouwen met een BRCA-mutatie; dit advies geldt vanaf 8 jaar na de radiotherapie.138 Ook internationaal wordt een dergelijke screening geadviseerd.29,53,95,100 Voor vrouwen die zijn bestraald voor hun 40e wordt in de NABON-richtlijn verwezen naar de LATER-richtlijnen voor overlevers van kinderkanker.137
Het screeningsadvies bestaat uit een combinatie van klinisch borstonderzoek, mammografie en MRI. Voor details van de screening wordt verwezen naar tabel 1. De werkgroep is van mening dat alle onderzoeken bij voorkeur uitgevoerd dienen te worden door een specialist met ervaring op dit gebied, bijvoorbeeld op de mammapoli of de BETER-polikliniek.
Vanwege het hoge percentage foutpositieve en foutnegatieve uitslagen is echografie niet geschikt als primaire screeningsmethode, maar wel als aanvulling op andere technieken. Wel kan echografie worden overwogen als screeningsmethode indien er contra-indicaties zijn voor MRI.13
Tabel 1. Richtlijn voor borstkankerscreening voor vrouwen behandeld met radiotherapie op de borst voor de leeftijd van 40 jaar
Start screening 8 jaar na behandeling, maar niet voor de leeftijd van 25 jaar
|
Leeftijd bij screening |
Onderzoek |
|
25-30 jaar |
Jaarlijks klinisch borstonderzoek en MRI |
|
30-60 jaar |
Jaarlijks klinisch borstonderzoek, mammografie en MRI via de polikliniek |
|
60-70 jaar |
1 keer per 2 jaar klinisch borstonderzoek en mammografie via de polikliniek |
|
70-75 jaar |
1 keer per 2 jaar mammografie via het bevolkingsonderzoek |
|
Na preventieve operatie |
Geen indicatie voor screening |
De werkgroep sluit zich aan bij het standpunt van het KWF, dat iedere vrouw zelf de keuze moet maken of zij wel of geen borstzelfonderzoek wil doen. Wanneer zij dit wel wil, kunnen uitleg en ondersteuning geboden met behulp van de folder “Borstzelfonderzoek” van de Borstkankervereniging Nederland.
De werkgroep wil echter een nuancering aanbrengen bij de adviezen in de NABON- en LATER-richtlijnen, omdat het risico op mammacarcinoom sterk afhankelijk is van de leeftijd waarop de behandeling werd gegeven. Een Nederlandse studie laat zien dat vrouwen met hodgkinlymfoom die werden bestraald voor hun 21e een 18 maal zo hoog risico op mammacarcinoom hadden ten opzichte van gezonde leeftijdsgenoten; voor vrouwen bestraald tussen 21-30 jaar was dit risico 7 maal verhoogd; voor vrouwen bestraald tussen 31-40 jaar was dit risico 3 maal verhoogd; en voor vrouwen bestraald boven de 40 jaar was het niet significant verhoogd.20 Internationale studies laten vergelijkbare resultaten zien.33,46,52,73,89,108,110,111 Om deze reden worden verschillende adviezen gegeven bij patiënten die voor hun 20e bestraald zijn, tussen hun 20e en 40e, of na hun 40e. In deze laatste groep wordt in de NABON-richtlijn geen extra screening op mammacarcinoom aanbevolen naast deelname aan het bevolkingsonderzoek.
Verschillen met de NABON-richtlijn c.q. LATER-richtlijn:
Voor de vrouwen met een zeer sterk verhoogd risico (bestraling voor hun 20e):
- Klinisch borstonderzoek: eindleeftijd 70 jaar i.p.v. 60 jaar
- Mammografie: tussen de leeftijd van 60-70 jaar iedere twee jaar mammografie via de poli i.p.v. het bevolkingsonderzoek
- MRI: geen verschil
Voor de vrouwen met een sterk verhoogd risico (bestraling tussen 20-40 jaar):
- Klinisch borstonderzoek: startleeftijd vanaf 8 jaar na de behandeling, ten vroegste vanaf 28 jaar i.p.v. 35 jaar; eindleeftijd 70 jaar i.p.v. 60 jaar
- Mammografie: tussen de leeftijd van 60-70 jaar iedere twee jaar mammografie via de poli i.p.v. het bevolkingsonderzoek
- MRI: startleeftijd vanaf 8 jaar na de behandeling, ten vroegste vanaf 28 jaar i.p.v. 35 jaar
Onderbouwing
Conclusies / Summary of Findings
-
Niveau 1: Het is aangetoond dat het risico op mammacarcinoom verhoogd is bij vrouwelijke overlevers van hodgkinlymfoom die voor de leeftijd van 40 jaar zijn behandeld met radiotherapie waarbij het borstweefsel in het bestralingsveld lag, al dan niet in combinatie met alkylerende chemotherapie.[A1 Henderson 201048, A1 Ibrahim 201255]
-
Niveau 1: Het is aangetoond dat de overleving van mammacarcinoom bij vrouwelijke overlevers van hodgkinlymfoom beter is bij een lager stadium van het mammacarcinoom.[A1 Henderson 201048]
-
Niveau 2: Het is aannemelijk dat er bij vrouwen die behandeld zijn met mantelveldbestraling vanwege hodgkinlymfoom meer mammacarcinomen worden gedetecteerd door screening met mammografie in combinatie met MRI, dan door screening met één van deze methoden alleen.[A2 Ng 201390, B Sung 2011105]
-
Gebrek aan bewijs: Er is gebrek aan bewijs dat screening op mammacarcinoom bij vrouwelijke overlevers van hodgkinlymfoom leidt tot een lagere sterfte.
Samenvatting literatuur
Hoe hoog is het risico op mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom, en wat zijn de risicofactoren hiervoor?
Het risico op mammacarcinoom na hodgkinlymfoom is aanzienlijk verhoogd, met een standardized incidence ratio van 1,3-17,9 en een absoluut excess risico van 1,1-57,0 per 10.000 patiënten per jaar.20,32,33,40,52,70,82,87,89,91,108 Zoals te zien is in figuur 1, varieert de cumulatieve incidentie van 4,5% na 20 jaar follow-up tot meer dan 30% na 40 jaar follow-up.20,111 Het risico op mammacarcinoom na behandeling voor hodgkinlymfoom neemt toe vanaf 8 jaar na de behandeling, en blijft daarna verhoogd tot ten minste 25 jaar na behandeling waarbij ook de AER blijft stijgen ten opzichte van een stijgende incidentie in de algemene bevolking bij een toenemende leeftijd.29,48,55,73,111
De mediane leeftijd bij diagnose van het mammacarcinoom na hodgkinlymfoom (40-48 jaar) is lager dan in de algemene bevolking (60 jaar).3,26,29,48,69,122,127,128 Synchrone of metachrone bilaterale mammacarcinomen komen voor bij 6-39% van de vrouwen.3,26,35,48,122,127,128 De meeste mammatumoren zijn invasieve ductaalcarcinomen (55-85%) of ductaal carcinoma in situ (DCIS) (14-45%).3,26,29,31,35,48,53,69,122,128 Ook blijkt dat het genexpressieprofiel van radiatie-geïnduceerde mammacarcinomen na hodgkinlymfoom anders is dan dat van sporadische mammacarcinomen.19
Uit een Amerikaanse studie onder 253 hodgkinlymfoom-overlevers met mammacarcinoom en 741 gematchte controlepatiënten met sporadisch mammacarcinoom bleek dat de overall survival slechter was onder de vrouwen die hodgkinlymfoom hadden gehad (hazard ratio 1,9), terwijl de borstkankervrije overleving en de borstkankerspecifieke overleving vergelijkbaar waren in beide groepen.35 Een andere grote Amerikaanse studie onder 298 hodgkinlymfoom-overlevers met mammacarcinoom en 405.223 gematchte controlepatiënten met sporadisch mammacarcinoom was de 15-jaarsoverleving significant slechter na hodgkinlymfoom (48% versus 69% voor lokaal mammacarcinoom; 33% versus 43% voor regionaal of distaal gemetastaseerd mammacarcinoom).84 Dit kwam vooral door een hogere sterfte aan andere tumoren en hart- en vaatziekten. Ook de borstkankerspecifieke overleving van gelokaliseerde mammacarcinomen was slechter na hodgkinlymfoom (82% versus 88%); dit gold niet voor gemetastaseerde mammacarcinomen. Kleinere studies lieten echter zien dat de prognose van mammacarcinoom na hodgkinlymfoom vergelijkbaar is met de prognose van mammacarcinoom bij vrouwen die niet voor hodgkinlymfoom behandeld zijn.3,128 Net als in de algemene bevolking is de overleving afhankelijk van het stadium waarin het mammacarcinoom wordt vastgesteld.48 Wel is het zo dat vrouwen met een lymfklierpositief mammacarcinoom na hodgkinlymfoom minder vaak behandeld worden met adjuvante radiotherapie en anthracyclinebevattende chemotherapie.3,99
Figuur 1. Cumulatieve incidentie van mammacarcinoom na hodgkinlymfoom
In deze Nederlandse cohortstudie werd het risico op mammacarcinoom onderzocht onder 1.122 vrouwelijke vijfjaarsoverlevers van hodgkinlymfoom, behandeld met radiotherapie waarbij een deel van het borstweefsel in het bestralingsveld had gelegen voor de leeftijd van 51 jaar.20 De mediane follow-upduur van de studie was 17,8 jaar. Van deze vrouwen ontwikkelden 120 een mammacarcinoom.
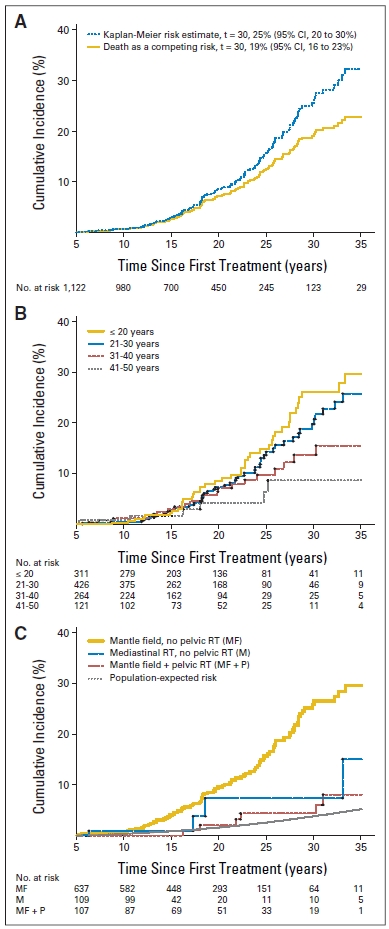
(A) Cumulatieve risico’s en incidentie van mammacarcinoom (invasief mammacarcinoom [IBC] en ductaal carcinoma in situ [DCIS]).
(B) Cumulatieve incidentie van mammacarcinoom (IBC en DCIS) naar leeftijd bij eerste behandeling.
(C) Cumulatieve incidentie van IBC naar bestralingsvelden en verwacht bevolkingsrisico.
Factoren die het risico op mammacarcinoom beïnvloeden, zijn:
- Radiotherapie: Radiotherapie op de borst (o.a. bij mantelveldbestraling) verhoogt het risico op mammacarcinoom.48,55 De meeste mammacarcinomen (89%) bevinden zich in het bestraalde gebied.87 Uit een meta-analyse met 15 gerandomiseerde trials en 3343 hodgkinlymfoom-overlevers blijkt dat het risico op mammacarcinoom significant hoger is (odds ratio 3.25) na “extended field” radiotherapie dan na “involved field” radiotherapie.41 Ook is het risico op mammacarcinoom hoger bij mantelveldbestraling dan bij radiotherapie op alleen het mediastinum.20 Bij het verminderen van het volume van het bestraalde borstweefsel neemt ook het risico op mammacarcinoom af.20,60 Het risico op mammacarcinoom neemt toe bij toenemende stralingsdoses, voornamelijk wanneer er radiotherapie op de borst gegeven wordt zonder chemotherapie.51,74,117 Radiotherapie op de ovaria met ten minste 5 Gy verlaagt het risico op mammacarcinoom, vermoedelijk door inductie van premature menopauze.55,74,117
- Chemotherapie: Het risico op mammacarcinoom na chemotherapie alleen is niet verhoogd.55,110,117 Gonadotoxische alkylerende cytostatica verlagen mogelijk het door radiotherapie verhoogde risico op mammacarcinoom bij behandeling voor de leeftijd van 30 jaar, als gevolg van een premature menopauze.20,48
- Gecombineerde behandeling: Vrouwen die zijn behandeld met supradiafragmatische radiotherapie in combinatie met alkylerende cytostatica of radiotherapie op het bekken hebben een lager risico op mammacarcinoom dan na supradiafragmatische radiotherapie alleen; dit geldt alleen voor vrouwen die tussen de leeftijd van 20 en 40 jaar behandeld zijn.73,111 Deze reductie van het risico komt door chemotherapie-geïnduceerde premature menopauze.
- Splenectomie: Twee studies laten zien dat het risico op mammacarcinoom hoger is na splenectomie, vooral bij hodgkinlymfoom-overlevers van 30 jaar en ouder ten tijde van het hodgkinlymfoom.25,122 Andere studies laten dit echter niet zien.3,126
- Leeftijd bij behandeling: In een Nederlandse studie onder 1122 vrouwelijke vijfjaarsoverlevers van hodgkinlymfoom was de SIR 17,9 bij bestraling voor de leeftijd van 21 jaar; 7,0 bij leeftijd 21-30 jaar; en 3,2 bij leeftijd 31-40 jaar.20 Het relatieve risico op mammacarcinoom was niet significant verhoogd bij vrouwen die boven de leeftijd van 40 jaar hodgkinlymfoom kregen. Voor een vrouw die op de borst is bestraald voor haar 21e betekent dit dat zij een risico van 26% heeft om voor haar 51e borstkanker te krijgen. Internationale studies laten vergelijkbare resultaten zien.33,46,52,73,89,108,110,111,117,118
- Familieanamnese: Net als in de algemene bevolking is het risico op mammacarcinoom bij overlevers van hodgkinlymfoom verhoogd bij een positieve familieanamnese voor mamma- en/of ovariumcarcinoom bij eerste- en/of tweedegraads familieleden.51 Er bleek echter geen verschil te zijn in het risico op mammacarcinoom tussen vrouwen met en zonder een positieve familieanamnese wanneer zij behandeld zijn met radiotherapie.
- Overige risicofactoren: Van een aantal factoren is bekend dat zij in de algemene bevolking het risico op mammacarcinoom verhogen. In twee studies is gekeken naar het effect van deze risicofactoren op het risico op mammacarcinoom bij hodgkinlymfoom-overlevers.20,51 Hieruit bleek dat de volgende factoren geen effect hadden op het risico op mammacarcinoom: roken, body mass index (BMI) ten tijde van het hodgkinlymfoom, het aantal zwangerschappen en de leeftijd daarbij, en het gebruik van orale anticonceptiva. Het effect van hormonale substitutietherapie, lichamelijke inspanning en alcoholgebruik is niet onderzocht bij hodgkinlymfoom-overlevers. De werkgroep ziet echter geen redenen om aan te nemen dat het effect anders zou zijn dan in de algemene bevolking.
Zijn er adequate methoden om mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom vroeg op te sporen?
Er zijn verschillende methoden om mammacarcinoom op te sporen: borstzelfonderzoek, klinisch borstonderzoek (palpatie door een zorgverlener), mammografie, echografie, en magnetic resonance imaging (MRI). Na hodgkinlymfoom wordt 27-90% van de mammacarcinomen opgespoord met mammografie, 70-80% met MRI, 25-63% met borstzelfonderzoek, en 7-58% met palpatie door een zorgverlener.3,29,31,66,69,105,122,127
Borstzelfonderzoek
Borstzelfonderzoek leidt in de algemene bevolking niet tot vroegere detectie van mammacarcinoom, of tot minder sterfte hier aan.36,88,125 Anderzijds worden veel mammacarcinomen nog steeds gedetecteerd na het vinden van een palpabele afwijking door de vrouw zelf.6 Borstzelfonderzoek heeft een lage specificiteit voor mammacarcinoom, vooral bij jonge vrouwen, omdat de kans op benigne aandoeningen veel groter is dan het risico op mammacarcinoom.115 Vrouwen die aan periodiek borstzelfonderzoek doen hebben een grotere kans om een borstoperatie te ondergaan voor goedaardige afwijkingen.36,88,125
Klinisch borstonderzoek
In verschillende grote studies in de algemene bevolking zijn de sensitiviteit en de positief voorspellende waarde van klinisch borstonderzoek door een zorgverlener (meestal een arts of verpleegkundige) gering.7,35,38,61,85,88,125 Bij screening van vrouwen met een hoog familiair risico op borstkanker (met of zonder BRCA-mutaties) met klinisch borstonderzoek in combinatie met mammografie en/of MRI worden eveneens zeer weinig extra carcinomen gevonden door klinisch borstonderzoek.80,96,123 Wel is de positief voorspellende waarde van klinisch borstonderzoek bij vrouwen met een hoog risico (10,3%) iets gunstiger dan die van de mammografie (8,5%) en MRI (7,7%).96 Ook is de tevredenheid groter bij vrouwen die naast mammografie ook met klinisch borstonderzoek gescreend worden.45
Mammografie
De meeste mammacarcinomen na hodgkinlymfoom (70-100%) zijn zichtbaar op een mammografie.29,31,66,69,90,105 In de meeste gevallen (62-72%) is er sprake van microcalcificaties, die ook goed zichtbaar zijn bij jonge vrouwen met een hoge borstdensiteit.29,66,69,95,114 Bij vrouwen jonger dan 50 jaar met een indicatie voor screening met mammografie wordt geadviseerd om de mammografie jaarlijks te maken, omdat de groeisnelheid van een deel van de carcinomen sterk verhoogd is en daarmee ook het risico op intervalcarcinomen.112
Echografie
In de algemene bevolking en bij vrouwen met een bewezen of vermoedelijke BRCA-mutatie heeft echografie geen toegevoegde waarde bij screening met mammografie in combinatie met MRI.12,65 Bij vrouwen met een verhoogd risico op mammacarcinoom (bijvoorbeeld door eerdere blootstelling van een deel van het borstweefsel aan bestraling of familiaire belasting) werden iets meer mammacarcinomen opgespoord wanneer echografie toegevoegd wordt aan de screeningsmammografie (3,7 carcinomen per 1000 vrouwen); het aantal foutpositieve en foutnegatieve bevindingen neemt echter aanzienlijk toe.13 3D-echo is een veelbelovend alternatief maar momenteel is er nog te weinig over bekend om de waarde van deze methode bij screening op mammacarcinoom na hodgkinlymfoom te kunnen bepalen.
MRI
In een recente prospectieve studie onder 134 vrouwelijke overlevers van hodgkinlymfoom, voor hun 36e behandeld met radiotherapie op de borst (mediane leeftijd ten tijde van behandeling: 23 jaar) en nu tenminste 8 jaar na behandeling (mediaan 17,5 jaar), werd de effectiviteit van mammografie versus MRI onderzocht.90 Screening bestond uit een jaarlijkse mammografie en MRI gedurende 3 jaar. In totaal werden er 18 mammacarcinomen gevonden. De sensitiviteit van mammografie was 68%, van MRI 67%, en van beide screeningsmodaliteiten samen 94%, met een specificiteit van respectievelijk 93%, 94% en 90%. In een retrospectieve studie werden bij screening 10 mammacarcinomen gedetecteerd bij 9 van 78 vrouwen die waren behandeld met mantelveldbestraling voor hodgkinlymfoom (3 ductaalcarcinomen, 1 lobulair carcinoom en 6 DCIS in een periode van 10 jaar).105 Van deze tumoren werden er 4 alleen met MRI gevonden, 3 alleen met mammografie, en 3 met mammografie in combinatie met MRI. Door het toevoegen van MRI aan mammografie werden in deze studie 4,4% meer mammacarcinomen opgespoord. Ook bij vrouwen met een verhoogd risico op mammacarcinoom (bijvoorbeeld vanwege eerdere blootstelling van een deel van het borstweefsel aan bestraling of familiaire belasting) werden meer mammacarcinomen opgespoord wanneer MRI toegevoegd werd aan screening met mammografie en echografie (14,7 carcinomen per 1000 vrouwen).13 Het is echter niet duidelijk of de resultaten van screeningsstudies in vrouwen met een verhoogd familiair risico op borstkanker wel extrapoleerbaar zijn naar vrouwen die zijn behandeld met radiotherapie op de borst in de voorgeschiedenis.
Vanwege de waarschijnlijk hogere groeisnelheid van mammacarcinomen en daarmee het risico op intervalcarcinomen bij vrouwen met een verhoogd risico wordt geadviseerd om MRI-scans in deze hoogrisicogroepen jaarlijks te maken.100
Prognose na screening
Er zijn geen gerandomiseerde studies die aantonen dat screening op mammacarcinoom bij vrouwen die zijn behandeld voor hodgkinlymfoom leidt tot een lagere sterfte. Voor prognostische factoren als de gradering, oestrogeen/progestageenreceptor en tumortype worden er in de algemene bevolking geen significante verschillen gezien tussen mammacarcinomen die met MRI gedetecteerd worden in vergelijking met anders gedetecteerde carcinomen.64 Mammacarcinomen die zijn gevonden met screening zijn significant vaker lymfkliernegatief.53,64 Ten opzichte van mammografie is MRI significant meer sensitief voor T1-tumoren, N0-tumoren, niet-ductale tumoren en oestrogeenreceptorpositieve tumoren.13,64,105 Over de grootte van de invasieve tumor bij screening met MRI in vergelijking met screening zonder MRI laten studies wisselende resultaten zien.24,64
Kosteneffectiviteit
Er zijn geen studies waarin de kosteneffectiviteit van screening op mammacarcinoom bij vrouwelijke overlevers van hodgkinlymfoom is onderzocht. Wel is bij BRCA-mutatiedraagsters gebleken dat screening met MRI en mammografie meer kosteneffectief is dan screening met mammografie alleen.44,93,113
Zijn er specifieke methoden nodig om mammacarcinoom bij 5-jaarsoverlevers van hodgkinlymfoom te behandelen?
Radiotherapie
Algemeen geldt dat bij vrouwelijke hodgkinlymfoom-overlevers die mammacarcinoom krijgen na radiotherapie op de borstregio, een mastectomie de voorkeur heeft boven lumpectomie met radiotherapie, omdat het nieuwe bestralingsveld het vroegere geheel of gedeeltelijk zal overlappen. In welke mate dit een verhoogd risico op late complicaties na hernieuwde radiotherapie oplevert is afhankelijk van talrijke factoren zodat individualisatie aangewezen is. Aangezien er geen absolute contra-indicaties bestaan voor het toepassen van radiotherapie bij de behandeling van een secundair mammacarcinoom na hodgkinlymfoom mag eerdere radiotherapie dan ook niet als (enige) argument gebruikt worden om deze behandeling niet te adviseren indien geïndiceerd op basis van patiënt- en tumorgerelateerde kenmerken.127,133
Chirurgie
In de groep met een zeer sterk verhoogd risico op mammacarcinoom (bij bestraling op de borst onder de leeftijd van 20 jaar) kan overwogen worden om een preventieve mastectomie te bespreken. Bij het vaststellen van een mammacarcinoom kan bij deze zeer-hoogrisicogroep een preventieve contralaterale mastectomie overwogen worden vanwege het hoge risico (10-39%) op synchrone of metachrone bilaterale maligniteiten.3,26,122,127,128
Chemotherapie
Bij het behandelen van een mammacarcinoom met anthracyclinebevattende chemotherapie dient rekening gehouden te worden met de cumulatieve dosering vanwege het verhoogde risico op cardiomyopathie (zie BETER-richtlijn Cardiovasculaire schade na hodgkinlymfoom).
Zoeken en selecteren
Na analyse van de knelpunten door de werkgroepen zijn de uitgangsvragen voor de wetenschappelijke onderbouwing opgesteld. Hierbij werd gebruik gemaakt van de PICO-systematiek (PICO = patient problem or population, intervention, comparison (C), outcome(s)).1 Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de wetenschappelijke vraagstelling met PICO:
P: 5-jaarsoverlevers van hodgkinlymfoom
O1: Risico op mammacarcinoom ≥5 jaar na diagnose van hodgkinlymfoom: relatief risico (RR), standardized incidence ratio (SIR), cumulative (actuarial estimated) risk, absolute excess risk (AER)
O2: Risicofactoren voor mammacarcinoom ≥5 jaar na diagnose van hodgkinlymfoom
Studiedesign: cohort studies, case-control studies
Referenties
- 1 - Aberle D, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395-409.
- 2 - Abrahamsen J, et al. Second malignancies after treatment of Hodgkins disease: the influence of treatment, follow-up time, and age. J Clin Oncol 1993;11:255-61.
- 3 - Alm El-Din M, et al. Clinical outcome of breast cancer occurring after treatment for Hodgkin's lymphoma: case-control analysis. Rad Oncol 2009;4:19.
- 4 - Amini R, et al. Patients suffering from both Hodgkins disease and non-Hodgkins lymphoma: a clinico-pathological and immuno-histochemical population-based study of 32 patients. Int J Cancer 1997;71:510-6.
- 5 - André M, et al. Treatment-related deaths and second cancer risk after autologous stem cell transplantation for Hodgkins disease. Blood 1998;92:1933-40.
- 6 - Barlow W, et al. Performance of diagnostic mammography for women with signs or symptoms of breast cancer. J Natl Cancer Inst 2002;94:1151-9.
- 7 - Barton M, et al. The rational clinical examination. Does the patient have breast cancer? The screening clinical breast examination: should it be done? How? JAMA 1999;282:1270-80.
- 8 - Bassal M, et al. Risk of selected subsequent carcinomas in survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Clin Oncol 2006;24:476-83.
- 9 - Bauer K, et al. Comparison of chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for patients with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database Syst Rev 2011;8:CD007941.
- 10 - Van den Belt-Dusebout A, et al. Roles of radiation dose and chemotherapy in the etiology of stomach cancer as a second malignancy. Int J Rad Oncol Biol Phys 2009;75:1420-9.
- 11 - Bennett M, et al. Non-Hodgkins lymphoma arising in patients treated for Hodgkins disease in the BNLI: a 20-year experience. Ann Oncol 1991;2S2:83-92.
- 12 - Berg W, et al. Tailored supplemental screening for breast cancer: what now and what next? AJR Am J Roentgenol 2009;192:390-9.
- 13 - Berg W, et al. Detection of breast cancer with addition of annual screening ultrasound or a single screening MRI to mammography in women with elevated breast cancer risk. JAMA 2012;307:1394-1404.
- 14 - Bhatia S, et al. High risk of subsequent neoplasms continues with extended follow-up of childhood Hodgkins disease: report from the Late Effects Study Group. J Clin Oncol 2003:21:4386-94.
- 15 - Bhatti P, et al. Risk of second primary thyroid cancer after radiotherapy for a childhood cancer in a large cohort study: an update from the Childhood Cancer Survivor Study. Radiat Res 2010;174:741-52.
- 16 - Birdwell S, et al. Gastrointestinal cancer after treatment of Hodgkins disease. Int J Radiat Oncol Biol Phys 1997;37:67-73.
- 17 - Boivin J, et al. Incidence of second cancers in patients treated for Hodgkins disease. J Natl Cancer Inst 1995;87:732-41.
- 18 - Boukheris H, et al. Risk of radiation-related salivary gland carcinomas among Hodgkin lymphoma survivors: a population-based analysis. Cancer 2008;113:31539.
- 19 - Broeks A, et al. Radiation-associated breast tumors display a distinct gene expression profile. Int J Radiat Oncol Biol Phys 2010;76:540-7.
- 20 - De Bruin M, et al. Breast cancer risk in female survivors of Hodgkins lymphoma; lower risk after smaller radiation volumes. J Clin Oncol 2009;27:4239-46.
- 21 - De Bruin M, et al. Malignant mesothelioma after radiation treatment for Hodgkin lymphoma. Blood 2009;113:3679-81.
- 22 - Brusamolino E, et al. The risk of acute leukemia in patients treated for Hodgkins disease is significantly higher after combined modality programs than after chemotherapy alone and is correlated with the extent of radiotherapy and type and duration of chemotherapy: a case-control study. Haematol 1998;83:812-23.
- 23 - Chang C, et al. The value of positron emission tomography in early detection of lung cancer in high-risk population: a systematic review. Clin Respir J 2013;7:1-6.
- 24 - Chéreau E, et al. Characteristics, treatment, and outcome of breast cancers diagnosed in BRCA1 and BRCA2 gene mutation carriers in intensive screening programs including magnetic resonance imaging. Clin Breast Cancer 2010;10:113-8.
- 25 - Chung C, et al. Increased risk of breast cancer in splenectomized patients undergoing radiation therapy for Hodgkins disease. Int J Rad Oncol Biol Phys 1997;37:4059.
- 26 - Cutuli B, et al. Breast cancer in patients treated for Hodgkin's disease: clinical and pathological analysis of 76 cases in 63 patients. Eur J Cancer 1997;33:2315-20.
- 27 - Daniels L, et al. Long-term risk of secondary skin cancers after radiation therapy for Hodgkin lymphoma. Submitted 2013.
- 28 - Das P, et al. Clinical course of thoracic cancers in Hodgkins disease survivors. Ann Oncol 2005;16:7937.
- 29 - Dershaw D, et al. Breast carcinoma in women previously treated for Hodgkin disease: mammographic evaluation. Radiol 1992;184:421-3.
- 30 - Dietrich P, et al. Second primary cancers in patients continuously disease-free from Hodgkins disease: A protective role for the spleen? Blood 1994;84:120915.
- 31 - Diller L, et al. Breast cancer screening in women previously treated for Hodgkins disease: a prospective cohort study. J Clin Oncol 2002;20:2085-91.
- 32 - Dong C, et al. Second primary neoplasms among 53 159 haematolymphoproliferative malignancy patients in Sweden, 19581996: a search for common mechanisms. Br J Cancer 2001;85:9971005.
- 33 - Dores G, et al. Second malignant neoplasms among long-term survivors of Hodgkins disease: a population-based evaluation over 25 years. J Clin Oncol 2002;20:3484-94.
- 34 - Eden K, et al. Screening high-risk populations for thyroid cancer. Med Pediatr Oncol 2001;36:583-91.
- 35 - Elkin E, et al. Characteristics and outcomes of breast cancer in women with and without a history of radiation for Hodgkins lymphoma: a multi-institutional, matched cohort study. J Clin Oncol 2011;29:2466-73.
- 36 - Elmore J, et al. Screening for breast cancer. JAMA 2005;293:1245-56.
- 37 - Engert A, et al. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin's lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol 2009;27:4548-54.
- 38 - Feigin K, et al. Clinical breast examination in a comprehensive breast cancer screening program: contribution and cost. Radiol 2006;240:650-5.
- 39 - Forrest D, et al. High-dose therapy and autologous hematopoietic stem-cell transplantation does not increase the risk of second neoplasms for patients with Hodgkins lymphoma: a comparison of conventional therapy alone versus conventional therapy followed by autologous hematopoietic stem-cell transplantation. J Clin Oncol. 2005;23:7994-8002.
- 40 - Foss Abrahamsen A, et al. Long-term risk of second malignancy after treatment of Hodgkins disease: the influence of treatment, age and follow-up time. Ann Oncol 2002;13:1786-91.
- 41 - Franklin J, et al. Second malignancy risk associated with treatment of Hodgkins lymphoma: meta-analysis of the randomised trials. Ann Oncol 2006;17:174960.
- 42 - Gemsenjager E, et al. Lymph node surgery in papillary thyroid carcinoma. J Am Coll Surg 2003;197:182-90.
- 43 - Gilbert E, et al. Lung cancer after treatment for Hodgkins disease: focus on radiation effects. Radiat Res 2003;159:161-73.
- 44 - Griebsch I, et al. Cost-effectiveness of screening with contrast enhanced magnetic resonance imaging vs X-ray mammography of women at a high familial risk of breast cancer. Br J Cancer 2006;95:80110.
- 45 - Han M, et al. Satisfaction in the national cancer screening program for breast cancer with and without clinical breast examination. Asian Pacific J Cancer Prev 2012;13:63-7.
- 46 - Hancock S, et al. Breast cancer after treatment of Hodgkins disease. J Natl Cancer Inst 1993;85:25-31.
- 47 - Harrison C, et al. High-dose BEAM chemotherapy with autologous haemopoietic stem cell transplantation for Hodgkins disease is unlikely to be associated with a major increased risk of secondary MDS/AML. Br J Cancer 1999;81:476-83.
- 48 - Henderson T, et al. Surveillance for breast cancer in women treated with chest radiation for a childhood, adolescent or young adult cancer: a report from the Children's Oncology Group. Ann Intern Med 2010;152:444W154.
- 49 - Henry-Amar M. Second cancer after the treatment for Hodgkins disease: a report from the International Database on Hodgkins disease. Ann Oncol 1992;3S4:117-28.
- 50 - Hewitson P, et al. Screening for colorectal cancer using the faecal occult blood test, Hemoccult. Cochr Datab Syst Rev 2007;1:CD001216.
- 51 - Hill DA, et al. Breast cancer risk following radiotherapy for Hodgkin lymphoma: modification by other factors. Blood 2005;106:3358-65.
- 52 - Hodgson D, et al. Long-term solid cancer risk among 5-year survivors of Hodgkins lymphoma. J Clin Oncol 2007;25:1489-97.
- 53 - Howell S, et al. The UK national breast cancer screening programme for survivors of Hodgkin lymphoma detects breast cancer at an early stage. Br J Cancer 2009;101:5828.
- 54 - Humphrey L, et al. Lung cancer screening with sputum cytologic examination, chest radiography, and computed tomography: an update for the U.S. Preventive Services Task Force. Ann Intern Med 2004;140:740-53.
- 55 - Ibrahim E, et al. Risk of second breast cancer in female Hodgkins lymphoma survivors: a meta-analysis. BMC Cancer 2012;12:197.
- 56 - Ibrahim E, et al. Increased risk of second lung cancer in Hodgkins lymphoma survivors: a meta-analysis. Lung 2013;191:117-34.
- 57 - Josting A, et al. Secondary myeloid leukemia and myelodysplastic syndromes in patients treated for Hodgkins disease: a report from the German Hodgkins Lymphoma Study Group. J Clin Oncol 2003;21:3440-6.
- 58 - Kaldor J, et al. Leukemia following Hodgkins disease. N Engl J Med 1990;322:7-13.
- 59 - Khoo V, et al. Thyroid dysfunction after mantle irradiation of Hodgkins disease patients. Australas Radiol 1998;42:52-7.
- 60 - Koh E, et al. A comparison of mantle versus involved-field radiotherapy for Hodgkins lymphoma: reduction in normal tissue dose and second cancer risk. Radiat Oncol 2007;2:13.
- 61 - Kösters J, et al. Regular self-examination or clinical examination for early detection of breast cancer. Cochr Syst Rev 2003;2:CD003373.
- 62 - Kouvaraki M, et al. Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer. Surgery 2003;134:946-54.
- 63 - Kovalchik S, et al. Absolute risk prediction of second primary thyroid cancer among 5-year survivors of childhood cancer. J Clin Oncol 2013;31:119-27.
- 64 - Kriege M, et al. Tumor characteristics and detection method in the MRISC screening program for the early detection of hereditary breast cancer. Breast Cancer Res Treat 2007;102:357-63.
- 65 - Kuhl C, et al. Mammography, breast ultrasound, and magnetic resonance imaging for surveillance of women at high familial risk for breast cancer. J Clin Oncol 2005;23:8469-76.
- 66 - Kwong A, et al. Mammographic screening in women at increased risk of breast cancer after treatment of Hodgkin's disease. Breast J 2008;14:3948.
- 67 - Landier W, et al. Yield of screening for long-term complications using the Childrens Oncology Group long-term follow-up guidelines. J Clin Oncol 2012;30::4401-8.
- 68 - Laurie S, et al. The clinical course of nonsmall cell lung carcinoma in survivors of Hodgkin disease. Cancer 2002;95:11926.
- 69 - Lee L, et al. Screening mammography for young women treated with supradiaphragmatic radiation for Hodgkin's lymphoma. Ann Oncol 2008;19:627.
- 70 - Van Leeuwen F, et al. Second cancer risk following Hodgkin's disease: a 20-year follow-up study. J Clin Oncol 1994;12:312-25.
- 71 - Van Leeuwen F, et al. Leukemia risk following Hodgkins disease: relation to cumulative dose of alkylating agents, treatment with teniposide combinations, number of episodes of chemotherapy, and bone marrow damage. J Clin Oncol 1994;12:1063-73.
- 72 - Van Leeuwen F, et al. Roles of radiotherapy and smoking in lung cancer following Hodgkins disease. J Natl Cancer Inst 1995;87:1530-7.
- 73 - Van Leeuwen F, et al. Long-term risk of second malignancy in survivors of Hodgkins disease treated during adolescence or young adulthood. J Clin Oncol 2000;18:487-97.
- 74 - Van Leeuwen F, et al. Roles of radiation dose, chemotherapy, and hormonal factors in breast cancer following Hodgkins disease. J Natl Cancer Inst 2003;95:971-80.
- 75 - Lerch H, et al. Survival of differentiated thyroid carcinoma studied in 500 patients. J Clin Oncol 1997;15:2067-75.
- 76 - Levine E, et al. Leukemias and myelodysplastic syndromes secondary to drug, radiation, and environmental exposure. Semin Oncol 1992;19:47-84.
- 77 - Mackenzie E, et al. Thyroid nodules and thyroid cancer. MJA 2004;180:242-7.
- 78 - Manser R, et al. Screening for lung cancer. Cochrane Database Syst Rev. 2004;1;CD001991.
- 79 - Mauch P, et al. Second malignancies after treatment for laparotomy staged IA-IIIB Hodgkins disease: long-term analysis of risk factors and outcome. Blood 1996;87:3625-32.
- 80 - Maurice A, et al. Surveillance of women at increased risk of breast cancer using mammography and clinical breast examination: further evidence of benefit. Int J Cancer 2011;131:417-25.
- 81 - Maurizi Enrici E, et al. Acute nonlymphocytic leukemia: onset after treatment for Hodgkins disease. Ann Hematol 1997;74:103-10.
- 82 - Metayer C, et al. Second cancers among long-term survivors of Hodgkins disease diagnosed in childhood and adolescence. J Clin Oncol 2000;18:2435-43.
- 83 - Metzger M, et al. Natural history of thyroid nodules in survivors of pediatric Hodgkin lymphoma. Pediatr Blood Cancer 2006;46:314-9.
- 84 - Milano M, et al. Long-term survival among patients with Hodgkins lymphoma who developed breast cancer: a population-based study. J Clin Oncol 2010;28:5088-96.
- 85 - Miller A, et al. Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. JNCI 2000;92:1490-9.
- 86 - Minamimoto R, et al. The current status of an FDG-PET cancer screening program in Japan, based on a 4-year (20062009) nationwide survey. Ann Nucl Med 2013;27:46-57.
- 87 - Munker R, et al. Second malignancies after Hodgkin's disease: the Munich experience. Ann Hematol 1999;78:544-54.
- 88 - Nelson H, et al. Screening for breast cancer: systematic evidence review update for the US Preventive Services Task Force. Rockville (MD): Agency for Healthcare Research and Quality (US); 2009 Nov. Report No.: 10-05142-EF-1.
- 89 - Ng A, et al. Second malignancy after Hodgkin disease treated with radiation therapy with or without chemotherapy: long-term risks and risk factors. Blood 2002;100:1989-96.
- 90 - Ng A, et al. Prospective study of the efficacy of breast magnetic resonance imaging and mammographic screening in Hodgkin lymphoma survivors. J Clin Oncol 2013;31:2282-8.
- 91 - Omer B, et al. Patterns of subsequent malignancies after Hodgkin lymphoma in children and adults. Br J Haemat 2012;158:61525.
- 92 - Pedersen-Bjergaard J, et al. High risk of therapy-related leukemia after BEAM chemotherapy and autologous stem cell transplantation for previously treated lymphomas is mainly related to primary chemotherapy and not to the BEAM-transplantation procedure. Leukemia 1997;11:1654-60.
- 93 - Plevritis S, et al. Cost-effectiveness of screening BRCA1/2 mutation carriers with breast magnetic resonance imaging. JAMA 2006;295:237484.
- 94 - Prosper F, et al. Incidence of non-Hodgkins lymphoma in patients treated for Hodgkins disease. Leuk Lymphoma 1994;12:457-62.
- 95 - Ralleigh G, et al. Breast cancer risk and possible screening strategies for young women following supradiaphragmatic irradiation for Hodgkins disease. Clin Radiol 2004;59:647-50.
- 96 - Rijnsburger A, et al. BRCA1-associated breast cancers present differently from BRCA2-associated and familial cases: long-term follow-up of the Dutch MRISC Screening Study. J Clin Oncol 2010;28:5265-73.
- 97 - Ron E, et al. Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies. Radiat Res 1995;141:259-77.
- 98 - Rueffer U, et al. Non-Hodgkins lymphoma after primary Hodgkins disease in the German Hodgkins Lymphoma Study Group: incidence, treatment and prognosis. J Clin Oncol 2001;19:2026-32.
- 99 - Sanna G, et al. Breast cancer in Hodgkin's disease and non-Hodgkin's lymphoma survivors. Ann Oncol 2007;18:28892.
- 100 - Saslow D, et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin 2007;57:75-89.
- 101 - Scholz M, et al. Impact of first- and second-line treatment for Hodgkin's lymphoma on the incidence of AML/MDS and NHL-experience of the German Hodgkin's Lymphoma Study Group analyzed by a parametric model of carcinogenesis. Ann Oncol 2011;22:681-8.
- 102 - Sigurdson A, et al. Primary thyroid cancer after a first tumour in childhood (the Childhood Cancer Survivor Study): a nested case-control study. Lancet 2005;365:2014-23.
- 103 - Sklar C, et al. Abnormalities of the thyroid in survivors of Hodgkins disease: data from the Childhood Cancer Survivor Study. J Clin Endocrinol Metab 2000;85:3227-32.
- 104 - Stein R, et al. Bone marrow involvement in non-Hodgkin's lymphoma: implications for staging and therapy. Cancer 1976;37:629-36.
- 105 - Sung J, et al. Screening breast MR Imaging in women with a history of chest irradiation. Radiol 2011;259:65-71.
- 106 - Swerdlow A, et al. Risk of second primary cancer after Hodgkins disease in patients in the British National Lymphoma Investigation: relationships to host factors, histology and stage of Hodgkins disease, and splenectomy. Br J Cancer 1993;68:1006-11.
- 107 - Swerdlow A, et al. Second malignancy in patients with Hodgkins disease treated at the Royal Marsden Hospital. Br J Cancer 1997;75:116-23.
- 108 - Swerdlow A, et al. Risk of second malignancy after Hodgkins disease in a collaborative British cohort: the relation to age at treatment. J Clin Oncol 2000;18:498-509.
- 109 - Swerdlow A, et al. Lung cancer after Hodgkins disease: a nested case-control study of the relation to treatment. J Clin Oncol 2001;19:1610-8.
- 110 - Swerdlow A, et al. Second cancer risk after chemotherapy for Hodgkins lymphoma: a collaborative British cohort study. J Clin Oncol 2011;29:4096-104.
- 111 - Swerdlow A, et al. Breast cancer risk after supradiaphragmatic radiotherapy for Hodgkins lymphoma in England and Wales: a national cohort study. J Clin Oncol 2012;30:2745-52.
- 112 - Tabar L, et al. Screening for breast cancer in women aged under 50: mode of detection, incidence, fatality, and histology. J Med Screen 1995;2:94-8.
- 113 - Taneja C, et al. Cost effectiveness of breast cancer screening with contrast-enhanced MRI in high-risk women. J Am Coll Radiol 2009;6:1719.
- 114 - Tardivon A, et al. Breast carcinoma in women previously treated for Hodgkins disease: clinical and mammographic findings. Eur Radiol 1999;9:1666-71.
- 115 - Thomas D, et al. Randomized trial of breast self-examination in Shanghai: final results. J Natl Cancer Inst 2002;94:1445-57.
- 116 - Travis L, et al. Lung cancer following chemotherapy and radiotherapy for Hodgkins disease. J Natl Cancer Inst 2002;94:18292.
- 117 - Travis L, et al. Breast cancer following radiotherapy and chemotherapy among young women with Hodgkins disease. JAMA 2003;290:465-75.
- 118 - Travis L, et al. Cumulative absolute breast cancer risk for young women treated for Hodgkin lymphoma. J Natl Cancer Inst 2005;97:1428 37.
- 119 - Tucker M, et al. Risk of second cancers after treatment for Hodgkins disease. N Engl J Med 1988;318:76-81.
- 120 - Tucker M, et al. Therapeutic radiation at a young age is linked to secondary thyroid cancer. The Late Effects Study Group. Cancer Res 1991;51:2885-8.
- 121 - Veiga L, et al. A pooled analysis of thyroid cancer incidence following radiotherapy for childhood cancer. Radiat Res 2012;178:365-76.
- 122 - Wahner-Roedler D, et al. Risk of breast cancer and breast cancer characteristics in women treated with supradiaphragmatic radiation for Hodgkin lymphoma: Mayo Clinic experience. Mayo Clin Proc 2003;78:708-15.
- 123 - Warner E, et al. Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination. JAMA 2004;292:1317-25.
- 124 - Watt T, et al. Radiation-related risk of basal cell carcinoma: a report from the Childhood Cancer Survivor Study. J Natl Cancer Inst 2012;104:124050.
- 125 - Weiss N. Breast cancer mortality in relation to clinical breast examination and breast self-examination. Breast J 2003;9:S86-9.
- 126 - Wolden S, et al. Second cancers following pediatric Hodgkin's disease. J Clin Oncol 1998;16:536-44.
- 127 - Wolden S, et al. Management of breast cancer after Hodgkins disease. J Clin Oncol 2000;18:765-72.
- 128 - Yahalom J, et al. Breast cancer in patients irradiated for Hodgkin's disease: a clinical and pathologic analysis of 45 events in 37 patients. J Clin Oncol 1992;10:1674-81.
- 129 - Yang S, et al. Screening for oesophageal cancer. Cochr Datab Syst Rev 2012;12:CD007883.
- 130 - Youn P, et al. Long-term survival among Hodgkins lymphoma patients with gastrointestinal cancer: a population-based study. Ann Oncol 2013;24:202-8.
- 131 - Zarate-Osorno A, et al. Non-Hodgkins lymphomas arising in patients treated successfully for Hodgkins disease. A clinical, histologic, and immunophenotypic study of 14 cases. Am J Surg Pathol 1992;16:885-95.
- 132 - D.C. Hodgson & F.E. van Leeuwen. Second Malignancy Risk After Treatment of Hodgkin Lymphoma. In: A. Engert & S.J. Horning. Hematologic Malignancies: Hodgkin Lymphoma. A Comprehensive Update on Diagnostics and Clinics. Springer-Verlag Berlin Heidelberg 2011.
- 133 - F.E. van Leeuwen, A.J. Swerdlow, & L.B. Travis. Second cancers after treatment of Hodgkin Lymphoma. In: R.T. Hoppe et al. Hodgkin Lymphoma. Lippincott Williams & Wilkins Philadelphia 2007.
- 134 - Gezondheidsraad. Bevolkingsonderzoek naar darmkanker. Den Haag: Gezondheidsraad, 2009; publicatienr. 2009/13.
- 135 - Gezondheidsraad. Wet bevolkingsonderzoek: ERGO uitgebreid met lever- en huidonderzoek. Den Haag: Gezondheidsraad, 2011; publicatienr. 2011/30.
- 136 - Nederlandse Kankerregistratie beheerd door IKNL © Najaar 2012, http://www.oncoline.nl.
- 137 - SKION LATER Richtlijn follow-up na kinderkanker meer dan 5 jaar na diagnose. Versie 1 (2009), http://www.skion.nl.
- 138 - NABON Richtlijn Mammacarcinoom. Versie 2.0 (2012), http://www.oncoline.nl.
- 139 - CBO Richtlijn Schildkliercarcinoom. Versie 1.1 (2007), http://www.oncoline.nl.
- 140 - CBO Richtlijn Niet-kleincellig longcarcinoom. Versie 2.0 (2011), http://www.oncoline.nl.
- 141 - CBO Richtlijn Kleincellig longcarcinoom. Versie 1.0 (2011), http://www.oncoline.nl.
- 142 - NCCN Guideline Lung Cancer Screening. Versie 1 (2013), http://www.nccn.org.
- 143 - NVMDL Richtlijn Oesofaguscarcinoom. Versie 3.0 (2010), http://www.oncoline.nl.
- 144 - CBO Richtlijn Maagcarcinoom. Versie 1.0 (2009), http://www.oncoline.nl.
- 145 - CBO Richtlijn Coloncarcinoom. Versie 2.0 (2008), http://www.oncoline.nl.
- 146 - CBO Richtlijn Rectumcarcinoom. Versie 2.1 (2008), http://www.oncoline.nl.
- 147 - CBO Richtlijn Pancreascarcinoom. Versie 2.0 (2011), http://www.oncoline.nl.
- 148 - CBO Richtlijn Erfelijke darmkanker. Versie 1.0 (2008), http://www.oncoline.nl.
- 149 - CBO Richtlijn Melanoom. Versie 2.0 (2012), http://www.oncoline.nl.
- 150 - CBO richtlijn Basaalcelcarcinoom. Versie 1.0 (2009), http://www.oncoline.nl.
- 151 - HOVON Richtlijn Maligne lymfomen. Versie 1.0 (2011), http://www.hovon.nl.
- 152 - CBO Richtlijn Mondholte- en orofarynxcarcinoom. Versie 1.4 (2004), http://www.oncoline.nl.
- 153 - CBO Richtlijn Hypofarynxcarcinoom. Versie 2.0 (2010), http://www.oncoline.nl.
- 154 - CBO Richtlijn Larynxcarcinoom. Versie 3.0 (2010), http://www.oncoline.nl.
- 155 - NVOG Richtlijn Cervixcarcinoom. Versie 3.0 (2012), http://www.oncoline.nl.
- 156 - NVOG Richtlijn Cervicale intra-epitheliale neoplasie. Versie 1.1 (2004), http://www.oncoline.nl.
- 157 - NVOG Richtlijn Endometriumcarcinoom. Versie 3.0 (2011), http://www.oncoline.nl.
- 158 - NVOG Richtlijn Epitheliaal ovariumcarcinoom. Versie 1.0 (2009), http://www.oncoline.nl.
- 159 - VIKC Richtlijn Niercelcarcinoom. Versie 2.0 (2010), http://www.oncoline.nl.
- 160 - NVU Richtlijn Prostaatcarcinoom. Versie 1.0 (2007), http://www.oncoline.nl.
- 161 - NVU Richtlijn Testiscarcinoom. Versie 1.2 (2009), http://www.oncoline.nl.
- 162 - NVU Richtlijn Urotheelcelcarcinoom van de blaas. Versie 1.0 (2009), http://www.oncoline.nl.
- 163 - CBO Richtlijn Beentumoren. Versie 2.0 (2008), http://www.oncoline.nl.
- 164 - CBO Richtlijn Wekedelentumoren. Versie 2.0 (2011), http://www.oncoline.nl.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-12-2016
Beoordeeld op geldigheid : 01-12-2016
Uiterlijk in 2017 bepaalt het bestuur van de Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO) of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVRO is als houder van deze richtlijn(module) de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn werd ontwikkeld in het kader van het BETER-project (Beter na Hodgkin: Evaluatie van de langeTermijnEffecten van chemo- en Radiotherapie). De richtlijnontwikkeling werd gefinancierd met een subsidie van KWF-Alpe d’HuZes (projectnummer NKI 2011-5270).
Doel en doelgroep
Het doel van de BETER-richtlijnen is het ondersteunen van hoogkwalitatieve en uniforme langetermijn-nazorg voor overlevers van hodgkinlymfoom. De richtlijnen gaan over relevante late effecten waarvan bekend is dat zij relatief vaak optreden na behandeling voor hodgkinlymfoom.
Samenstelling werkgroep
Voor elk van de BETER-richtlijnen is in 2011 een multidisciplinaire werkgroep opgericht, bestaande uit leden van het BETER-consortium en waar nodig aangevuld met externe experts. Elke werkgroep had twee voorzitters en werd ondersteund door één van de BETER-projectcoördinatoren voor het uitwerken van de richtlijnen en de wetenschappelijke onderbouwing. Voor de BETER-richtlijn ‘Tweede tumoren na hodgkinlymfoom’ bestond de werkgroep uit:
- Prof. dr. ir. F.E. van Leeuwen, epidemioloog, Antoni van Leeuwenhoek, Amsterdam
- Dr. R.W.M. van der Maazen, radiotherapeut, Radboudumc, Nijmegen
- Dr. P.J. Lugtenburg, internist-hematoloog, Erasmus MC, Rotterdam
- Dr. Ph.M.P. Poortmans, radiotherapeut, Verbeeten Instituut, Tilburg
- Dr. E.J. Petersen, internist-hematoloog, UMC Utrecht, Utrecht
- Dr. M.B. van ’t Veer, internist-hematoloog en coördinator BETER-project, Antoni van Leeuwenhoek, Amsterdam
- Dr. N. Dekker, arts en coördinator BETER-project, Antoni van Leeuwenhoek, Amsterdam
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KiMS), een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Toelichting |
|
Prof. dr. ir. F.E. van Leeuwen |
1) Projectleider BETER 2) Lid stuurgroep HEBON 3) Lid Wetenschappelijke adviesraad Nederlands DES centrum 4) Lid Collaborative Group on Hormonal Factors in Breast Cancer 5) Lid Permanent Health Council Committee on Health effects of Electromagnetic Fields and Radiofrequency radiation 6) Lid adviesraad patiëntenvereniging Hematon 7) Lid Wetenschappelijke Raad Pink Ribbon 8) Lid CBS-commissie provisie doodsoorzaken voor wetenschappelijk onderzoek 9) Lid Wetenschappelijke raad KWF en twee subcommissies 10) Lid stuurgroep LATER 11) Lid stuurgroep BBMRI 12) Lid externe adviesraad US Childhood Cancer Survivor Study 13) Lid Presidium wetenschappelijke raad KWF 14) Lid Scientific committee of the European Code Against Cancer Project, International Agency for Research in Cancer 15) Lid Cancer Survivorship Committee, American Society of Clinical Oncology 16) Voorzitter Commissie Preventie KWF |
1-16: Onbetaald |
|
Dr. R.W.M. van der Maazen |
1) Lid Raad van Advies patiëntenorganisatie Hematon 2) Adviseur patiëntengroep “Late effecten na mantelveldbestraling” |
1-2: Onbetaald |
|
Dr. P.J. Lugtenburg |
1) Voorzitter HOVON lymfoom werkgroep 2) Penningmeester EORTC lymfoom werkgroep |
1-2: Onbetaald |
|
Dr. Ph.M.P. Poortmans |
1) ESTRO president |
1: Onbetaald |
|
Dr. E.J. Petersen |
Geen |
|
|
Dr. M.B. van ’t Veer |
Geen |
|
|
Dr. N. Dekker |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de inbreng van afgevaardigden van patiëntenorganisatie Stichting Hematon tijdens de commentaar- en autorisatiefase van de BETER-richtlijnen.
Methode ontwikkeling
Evidence based
Implementatie
De BETER-richtlijnen worden gratis beschikbaar gesteld via de landelijke richtlijnendatabase van KiMS en IKNL. De huidige versie van de richtlijnen is bedoeld voor zorgverleners. Een versie voor de overlevers van hodgkinlymfoom zelf en een Engelstalige versie voor zorgverleners worden in 2015 ontwikkeld. De implementatie van de richtlijnen zal verder bevorderd worden door het gebruik van een persoonlijk nazorgplan op de BETER-poliklinieken en het aanbieden van een applicatie waarmee zorgverleners kunnen bepalen voor welke nazorg de hodgkinlymfoom-overlevers in aanmerking komen. Daarnaast zullen er publicaties aangeboden worden in Nederlandse en internationale medische tijdschriften, om de kennis van zorgverleners over het BETER-project en deze richtlijnen te vergroten. Ook zullen de richtlijnen worden besproken tijdens vergaderingen en congressen. Het vergroten van deze kennis leidt niet alleen tot een betere toepassing van de richtlijnen op de BETER-poliklinieken, maar ook tot een beter bewustzijn bij zorgverleners over het verwijzen van hun patiënten naar deze nazorgpoliklinieken.
Werkwijze
Voor het ontwikkelen van alle BETER-richtlijnen is gebruik gemaakt van de Richtlijn voor Richtlijnen van de Regieraad Kwaliteit van Zorg 2012.
In 2010-2011 is door de richtlijnwerkgroepen binnen het BETER-consortium een samenvatting gemaakt met de belangrijkste aanbevelingen voor alle BETER-richtlijnen. In 2012-2014 is de wetenschappelijke onderbouwing uitgewerkt door de projectcoördinatoren en voorzitters van de werkgroepen. De verschillende versies van deze richtlijnen zijn per e-mail rondgestuurd en in landelijke vergaderingen van het BETER-consortium besproken. De richtlijnen zijn in 2013-2014 geaccordeerd door het BETER-consortium. De richtlijnen zijn in 2014 overgenomen door de Nederlandse Vereniging voor Radiotherapie en Oncologie en in 2014-2015 ter accordering naar de betreffende wetenschappelijke en beroepsverenigingen gestuurd.
Zoekverantwoording
Voor de beantwoording van de uitgangsvraag hebben wij gezocht naar systematische reviews, boeken over de late effecten van hodgkinlymfoom, en naar Nederlandse en internationale richtlijnen over de desbetreffende aandoeningen. Daarnaast zijn artikelen gebruikt uit over de desbetreffende aandoeningen die getraceerd zijn via Pubmed tussen januari en mei 2013. Hierbij is literatuur met publicatiedatum vanaf 1990 geïncludeerd, tenzij er te weinig artikelen werden gevonden of juist te veel. De volgende zoektermen werden gebruikt:
- Breast
- Breast self examination
- Clinical breast examination
- Radiotherapy, radiation
- Surgery, mastectomy, lumpectomy
- Chemotherap*, antracyclin*
Alle zoektermen zijn gecombineerd met:
- “cancer” en/of “hodgkin” en/of “lymphoma”
- “radiotherapy”, “chemotherapy”, “splenectomy”
- “screening”
Op basis van de titel, abstract en volledige tekst is beoordeeld of het artikel voldeed aan de gestelde PICO-criteria (zie uitgangsvragen). Indien dit het geval was, is het artikel door één van de projectcoördinatoren (dr. N. Dekker) gescoord. De definitieve conclusies zijn hier op gebaseerd en voorzien van een evidence-niveau (1-3 of gebrek aan bewijs).
Voor het indelen van de methodologische kwaliteit van individuele studies en de niveaus van de conclusies is gebruik gemaakt van de door het CBO ontwikkelde Evidence-based richtlijnontwikkeling-methodiek (EBRO).


