Onderzoek bij herhaalde molazwangerschap
Uitgangsvraag
Is bij een herhaalde molazwangerschap aanvullend genetisch onderzoek geïndiceerd?
Aanbeveling
Na 3 of meer complete molazwangerschappen óf 2 complete molazwangerschappen zónder normale zwangerschap in de voorgeschiedenis, wordt genetisch onderzoek naar genmutaties op NLRP7 en KHDC3L aangeraden.
Counseling van vrouwen met een herhaalde complete molazwangerschap dient te geschieden door een gynaecoloog of klinisch geneticus met voldoende ervaring in deze materie.
Eiceldonatie kan worden overwogen voor vrouwen met homozygote NLRP7 of KHDC3L genmutaties, of vrouwen waarbij deze mutatie niet is aangetoond, maar waarbij er wel sprake is van herhaalde diploïde biparentale molazwangerschappen.
Overwegingen
Bij het besluitvorming over wel of niet screenen op genmutaties bij vrouwen met herhaalde molazwangerschappen dienen de kosten hiervan mede in overweging te worden genomen.
De gepubliceerde zwangerschapskansen bij vrouwen met homozygote genmutaties of bij vrouwen zonder deze genmutaties mét herhaalde diploïde biparentale molazwangerschappen zijn gebaseerd op zeer beperkte aantallen en dienen met voorzichtigheid geïnterpreteerd te worden.
Vanwege de complexiteit van deze materie en de schaarste van gepubliceerde studies heeft de werkgroep contact gezocht met dr. Rosemary Fisher, werkzaam in het Charing Cross Trophoblastic Disease Centre in London. In Charing Cross wordt geadviseerd om onderzoek naar genmutaties in te zetten bij 3 of meer herhaalde diploide, biparentale (complete) molazwangerschappen, waarbij in eerste instantie sequencing gedaan wordt van het NLRP7-gen en bij ontbreken van mutaties ook van KHDC3L. Ter nuancering wordt vermeld (persoonlijke communicatie) dat genetisch onderzoek mogelijk ook geindiceerd zou moeten zijn bij vrouwen met 2 complete molazwangerschappen zonder normale zwangerschap in de voorgeschiedenis. Vanwege de uitgebreide expertise van deze groep heeft de werkgroep besloten om de aanbevelingen van dit lokale protocol over te nemen in deze richtlijn.
De rol van genetische afwijkingen bij vrouwen met herhaalde complete mola is zeer complex en aan nieuwe ontwikkelingen onderhevig. Counselling van deze vrouwen dient daarom te geschieden door gynaecologen of klinisch genetici met deze specifieke expertise.
Onderbouwing
Achtergrond
In de literatuur worden sporadische molazwangerschappen onderscheiden van herhaalde molazwangerschappen (Recurrent Hydatiform Moles, RHM). Men spreekt van RHM wanneer er sprake is van tenminste 2 molazwangerschappen bij dezelfde patiënt. Het gaat hierbij nagenoeg altijd om complete molazwangerschappen.
Behoudens het aantal (complete) molazwangerschappen in 1 patiënt, is er klinisch geen onderscheid mogelijk tussen sporadische en herhaalde molazwangerschappen. Bij DNA analyse ziet men echter wel verschillen: enerzijds in de incidentie van genmutaties en anderzijds in de mate van paternale contributie aan de molazwangerschap: terwijl sporadische molazwangerschappen doorgaans uit diploïde androgene cellen bestaan (diploïd: 2 exemplaren van ieder chromosoom bezittend; androgenetisch: enkel bestaand uit vaderlijk DNA), blijken herhaalde molazwangerschappen vaker te bestaan uit diploïde, biparentale cellen (Biparentaal: bestaand uit zowel moederlijk als vaderlijk DNA).
Conclusies / Summary of Findings
Er lijkt een causaal verband te bestaan tussen homozygote NLRP7 (en in mindere mate met KHDC3L mutaties) en het optreden van herhaalde diploide biparentale molazwangerschappen.
[Dixon 2012; Estrada 2013]
Er lijkt geen duidelijke relatie te zijn tussen NLRP7 of KHDC3L genmutaties en androgenetische molazwangerschappen of (herhaalde) miskraam.
[Manokhina 2013]
Vrouwen met homozygote NLRP7 of KHDC3L genmutaties, of vrouwen waarbij deze mutatie niet is aangetoond, maar waarbij er wel herhaalde diploïde biparentale molazwangerschappen zijn, lijken slechts geringe kans te hebben op een doorgaande zwangerschap bij natuurlijke conceptie.
[Slim 2013]
Samenvatting literatuur
Het percentage herhaalde molazwangerschappen varieert fors naar etniciteit: in Westerse landen lijkt slechts 1-2% van vrouwen met één molazwangerschap hierna een tweede molazwangerschap te ontwikkelen [Bracken 1987, Lurain 1982, Sebire 2003]. In het Midden-Oosten en in Azië worden hogere percentages beschreven tot 2,5-9,4% [Boufettal 2011, Kim 1998, Yapar 1994].
Er zijn meerdere studies gepubliceerd waarin een relatie beschreven wordt tussen herhaalde molazwangerschappen en gendefecten. Het meest beschreven zijn mutaties/defecten in (beide allelen van) het NLRP7 (NOD-like receptor protein-7) gen. Ook andere genmutaties lijken een relatie te hebben met het optreden van herhaalde molazwangerschappen. Met deze uitgangsvraag willen we evalueren of er genoeg bewijs bestaat om (systematisch) genetisch onderzoek te verrichten bij vrouwen met herhaalde molazwangerschappen.
In tegenstelling tot de sporadische complete molazwangerschappen die doorgaans paternaal (androgenetisch) zijn, blijken de herhaalde complete molazwangerschappen doorgaans diploïd en biparentaal.
Herhaalde (biparentale) molazwangerschappen en genmutaties
De meeste studies betreffen case reports over individuen met herhaalde biparentale molazwangerschappen waarin bekende of nieuwe mutaties, veelal op het NLRP7 gen worden beschreven (RHM) [Deveault 2009, Fisher 2004, Hayward 2009, Hemida 2016, Ito 2016, Kou 2008, Landolsi 2011, Muhlstein 2011, Murdoch 2006, Panichkul 2005, Qian 2011, Slim 2009, Ulker 2013, Wang 2009].
Sebire [Sebire 2013] heeft de histopathologische verschillen tussen de sporadische (androgenetische) complete molazwangerschappen en de herhaalde (biparentale) complete molazwangerschappen onderzocht. Er wordt geconcludeerd dat het onderscheid niet kan worden gemaakt op basis van histopathologische kenmerken.
Het overzichtsartikel van Slim [Slim 2013] en van Nguyen [Nguyen 2014] beschrijven o.a. het wetenschappelijke proces dat heeft geleid tot de huidige kennis rond RHM en defecten op het NLRP7 en het KHDC3L gen. Ook wordt in meer detail ingegaan op de kenmerken van deze genen. Slim geeft aan dat patiënten met een homozygote mutatie in het NLRP7 gen waarschijnlijk niet in staat zijn tot een doorgaande zwangerschap bij natuurlijke conceptie. Nguyen geeft een suggestie voor DNA screening die gebruikt zou kunnen worden bij herhaalde molazwangerschappen (zie figuur 1).
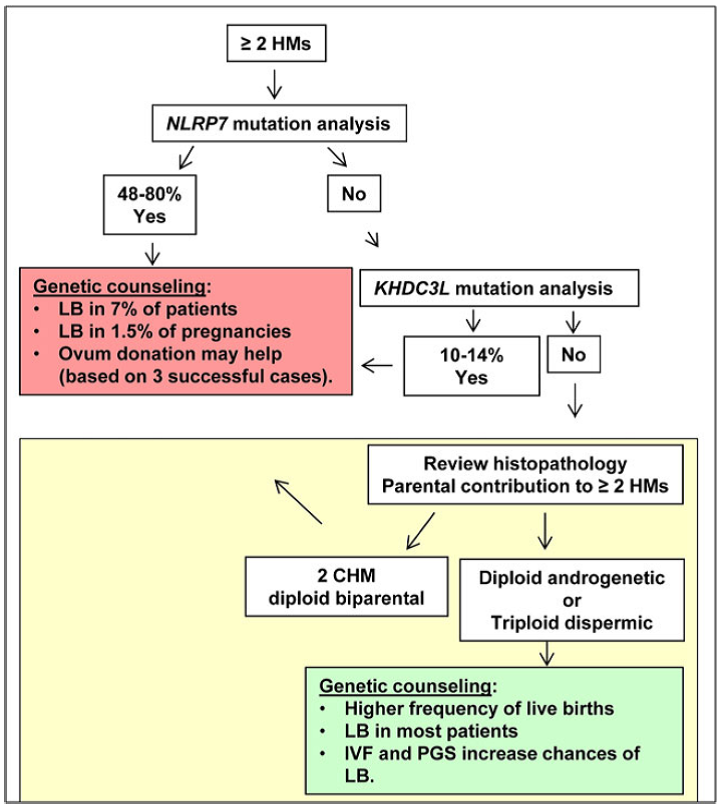
Figuur 1: gesuggereerde screening uit Nguyen [Nguyen 2014].
Estrada onderzocht daarnaast het voorkomen van NLRP7 mutaties bij vrouwen met RHM’s in vergelijking tot een controle groep zonder RHM’s [Estrada 2013]. In deze populatie van 20 vrouwen met RHM’s vonden zij 60% homozygote NLRP7 mutaties en 40% heterozygote NLRP7 mutaties. In de controle groep (n=100) vonden zij geen homozygote mutaties en 5% aanwezigheid van heterozygote mutaties.
Akoury beschrijft 5 casus van levend geboren neonaten bij patiënten met homozygote NLRP7 mutaties. 3 casus betreft eiceldonatie en 2 casus na natuurlijke conceptie [Akoury 2015].
Dixon heeft gekeken naar NLRP7 mutaties bij 4 vrouwen met herhaalde biparentale molazwangerschappen en 9 vrouwen met herhaalde androgenetische molazwangerschappen [Dixon 2012]. In de groep vrouwen met herhaalde biparentale molazwangerschappen werden eveneens geen significante mutaties gevonden in het NLRP7 gen.
Sporadische (androgenetische) molazwangerschappen en genmutaties
Andreasen heeft gekeken naar het voorkomen van genmutaties bij verschillende patiëntengroepen [Andreasen 2013]. Er werden 3 groepen geclassificeerd: groep 1 bestond uit 19 vrouwen met tenminste 1 molazwangerschap en 2 niet-mola miskramen. Groep 2 bestond uit 4 vrouwen met herhaalde androgenetische molazwangerschappen. Groep 3 bestond uit 7 vrouwen met tenminste 1 diploïde androgenetische molazwangerschap en een positieve familie-anamnese van tenminste 1 molazwangerschap. Hoewel er zowel op NLRP7 als op KHDC3L mutaties werden gevonden, leek er in deze studie geen causaal verband te bestaan tussen deze mutaties en de molazwangerschappen of miskramen.
Manokhina heeft gekeken naar de relatie tussen NLRP7 en C6orf221 mutaties en sporadische (androgenetische) molazwangerschappen, partiële molazwangerschappen, polyploïdie, en herhaalde miskramen [Manokhina 2013]. In deze studie kwam geen associatie naar voren tussen deze afwijkende zwangerschappen en mutaties in deze genen.
Referenties
- Akoury E, Gupta N, Bagga R et al. Live births in women with recurrent hydatidiform mole and two NLRP7 mutations. Reprod Biomed Online. 2015;31(1):120-4 #http://www.ncbi.nlm.nih.gov/pubmed/25982095.
- Andreasen L, Christiansen OB, Niemann I et al. NLRP7 or KHDC3L genes and the etiology of molar pregnancies and recurrent miscarriage. Mol Hum Reprod. 2013;19(11):773-81 #http://www.ncbi.nlm.nih.gov/pubmed/23963444.
- Boufettal H, Coullin P, Mahdaoui S et al. [Complete hydatiforme mole in Morocco: epidemiological and clinical study]. Journal de gynecologie, obstetrique et biologie de la reproduction. 2011;40(5):419-29 #http://www.ncbi.nlm.nih.gov/pubmed/21458172.
- Bracken MB. Incidence and aetiology of hydatidiform mole: an epidemiological review. British journal of obstetrics and gynaecology. 1987;94(12):1123-35 #http://www.ncbi.nlm.nih.gov/pubmed/3322372.
- Deveault C, Qian JH, Chebaro W et al. NLRP7 mutations in women with diploid androgenetic and triploid moles: a proposed mechanism for mole formation. Human molecular genetics. 2009;18(5):888-97 #http://www.ncbi.nlm.nih.gov/pubmed/19066229.
- Dixon PH, Trongwongsa P, Abu-Hayyah S et al. Mutations in NLRP7 are associated with diploid biparental hydatidiform moles, but not androgenetic complete moles. Journal of medical genetics. 2012;49(3):206-11 #http://www.ncbi.nlm.nih.gov/pubmed/22315435.
- Estrada H, Buentello B, Zenteno JC et al. The p.L750V mutation in the NLRP7 gene is frequent in Mexican patients with recurrent molar pregnancies and is not associated with recurrent pregnancy loss. Prenatal diagnosis. 2013;33(3):205-8 #http://www.ncbi.nlm.nih.gov/pubmed/23354651.
- Fisher RA, Hodges MD, Newlands ES. Familial recurrent hydatidiform mole: a review. The Journal of reproductive medicine. 2004;49(8):595-601 #http://www.ncbi.nlm.nih.gov/pubmed/15457849.
- Hayward BE, De Vos M, Talati N et al. Genetic and epigenetic analysis of recurrent hydatidiform mole. Human mutation. 2009;30(5):E629-39 #http://www.ncbi.nlm.nih.gov/pubmed/19309689.
- Hemida R, van Doorn H, Fisher R. A Novel Genetic Mutation in a Patient With Recurrent Biparental Complete Hydatidiform Mole: A Brief Report. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2016;26(7):1351-3 #http://www.ncbi.nlm.nih.gov/pubmed/27465884.
- Ito Y, Maehara K, Kaneki E et al. Novel Nonsense Mutation in the NLRP7 Gene Associated with Recurrent Hydatidiform Mole. Gynecologic and obstetric investigation. 2016;81(4):353-8 #http://www.ncbi.nlm.nih.gov/pubmed/26606510.
- Kim JH, Park DC, Bae SN et al. Subsequent reproductive experience after treatment for gestational trophoblastic disease. Gynecologic oncology. 1998;71(1):108-12 #http://www.ncbi.nlm.nih.gov/pubmed/9784329.
- Kou YC, Shao L, Peng HH et al. A recurrent intragenic genomic duplication, other novel mutations in NLRP7 and imprinting defects in recurrent biparental hydatidiform moles. Mol Hum Reprod. 2008;14(1):33-40 #http://www.ncbi.nlm.nih.gov/pubmed/18039680.
- Landolsi H, Rittore C, Philibert L et al. Screening for NLRP7 mutations in familial and sporadic recurrent hydatidiform moles: report of 2 Tunisian families. International journal of gynecological pathology : official journal of the International Society of Gynecological Pathologists. 2011;30(4):348-53 #http://www.ncbi.nlm.nih.gov/pubmed/21623199.
- Lurain JR, Sand PK, Carson SA et al. Pregnancy outcome subsequent to consecutive hydatidiform moles. American journal of obstetrics and gynecology. 1982;142(8):1060-1 #http://www.ncbi.nlm.nih.gov/pubmed/6280501.
- Manokhina I, Hanna CW, Stephenson MD et al. Maternal NLRP7 and C6orf221 variants are not a common risk factor for androgenetic moles, triploidy and recurrent miscarriage. Mol Hum Reprod. 2013;19(8):539-44 #http://www.ncbi.nlm.nih.gov/pubmed/23515668.
- Muhlstein J, Golfier F, Rittore C et al. The spectrum of NLRP7 mutations in French patients with recurrent hydatidiform mole. European journal of obstetrics, gynecology, and reproductive biology. 2011;157(2):197-9 #http://www.ncbi.nlm.nih.gov/pubmed/21439709.
- Murdoch S, Djuric U, Mazhar B et al. Mutations in NALP7 cause recurrent hydatidiform moles and reproductive wastage in humans. Nature genetics. 2006;38(3):300-2 #http://www.ncbi.nlm.nih.gov/pubmed/16462743.
- Nguyen NMP, Slim R. Genetics and Epigenetics of Recurrent Hydatidiform Moles: Basic Science and Genetic Counselling. Current obstetrics and gynecology reports. 2014;3(1):55-64 #https://www.ncbi.nlm.nih.gov/pubmed/?term=Nguyen+NMP%2C+Slim+R.+Genetics+and+Epigenetics+of+Recurrent+Hydatidiform+Moles%3A+Basic+Science+and+Genetic+Counselling.
- Panichkul PC, Al-Hussaini TK, Sierra R et al. Recurrent biparental hydatidiform mole: additional evidence for a 1.1-Mb locus in 19q13.4 and candidate gene analysis. Journal of the Society for Gynecologic Investigation. 2005;12(5):376-83 #http://www.ncbi.nlm.nih.gov/pubmed/15979551.
- Qian J, Cheng Q, Murdoch S et al. The genetics of recurrent hydatidiform moles in China: correlations between NLRP7 mutations, molar genotypes and reproductive outcomes. Mol Hum Reprod. 2011;17(10):612-9 #http://www.ncbi.nlm.nih.gov/pubmed/21507883.
- Sebire NJ, Fisher RA, Foskett M et al. Risk of recurrent hydatidiform mole and subsequent pregnancy outcome following complete or partial hydatidiform molar pregnancy. BJOG : an international journal of obstetrics and gynaecology. 2003;110(1):22-6 #http://www.ncbi.nlm.nih.gov/pubmed/12504931.
- Sebire NJ, Savage PM, Seckl MJ et al. Histopathological features of biparental complete hydatidiform moles in women with NLRP7 mutations. Placenta. 2013;34(1):50-6 #http://www.ncbi.nlm.nih.gov/pubmed/23201303.
- Slim R, Bagga R, Chebaro W et al. A strong founder effect for two NLRP7 mutations in the Indian population: an intriguing observation. Clinical genetics. 2009;76(3):292-5 #http://www.ncbi.nlm.nih.gov/pubmed/19650864.
- Ulker V, Gurkan H, Tozkir H et al. Novel NLRP7 mutations in familial recurrent hydatidiform mole: are NLRP7 mutations a risk for recurrent reproductive wastage? European journal of obstetrics, gynecology, and reproductive biology. 2013;170(1):188-92 #http://www.ncbi.nlm.nih.gov/pubmed/23880596.
- Wang CM, Dixon PH, Decordova S et al. Identification of 13 novel NLRP7 mutations in 20 families with recurrent hydatidiform mole; missense mutations cluster in the leucine-rich region. Journal of medical genetics. 2009;46(8):569-75 #http://www.ncbi.nlm.nih.gov/pubmed/19246479.
- Yapar EG, Ayhan A, Ergeneli MH. Pregnancy outcome after hydatidiform mole, initial and recurrent. The Journal of reproductive medicine. 1994;39(4):297-9 #http://www.ncbi.nlm.nih.gov/pubmed/8040847.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-06-2018
Beoordeeld op geldigheid : 02-02-2018
Deze modules zijn goedgekeurd op 2 februari 2018. IKNL bewaakt samen met betrokken verenigingen de houdbaarheid van deze en andere onderdelen van de richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Conform afspraken binnen de beroepsvereniging zal worden gestreefd naar een herziening na 5 jaar.
Algemene gegevens
Deze richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Een richtlijn is een document met aanbevelingen ter ondersteuning van zorgprofessionals en zorggebruikers, gericht op het verbeteren van de kwaliteit van zorg, berustend op wetenschappelijk onderzoek aangevuld met expertise en ervaringen van zorgprofessionals en zorggebruikers. Deze richtlijn beoogt een leidraad te geven voor het handelen in de dagelijkse praktijk en geeft daartoe aanbevelingen over diagnose, behandeling, begeleiding en follow-up van patiënten met een trofoblasttumor.
Doelpopulatie
De patiëntgroep waarvoor deze richtlijn voornamelijk is bedoeld betreft patiënten van alle leeftijden met een trofoblastziekte.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een trofoblastziekte zoals gynaecologen, medisch oncologen, pathologen, radiologen, radiotherapeuten en (gespecialiseerd) verpleegkundigen. Tevens kan de richtlijn houvast bieden aan patiënten en hun naasten. Deze richtlijn wordt gebruikt voor het maken van patiënten informatiemateriaal op www.kanker.nl en/of een informatiesite van een organisatie die patiënten vertegenwoordigt zoals bijvoorbeeld Stichting Olijf. De richtlijn kan door de doelgroep worden gebruikt voor klinische besluitvorming en afwegen van keuzes voor behandeling.
Deze richtlijn is primair geschreven voor bovengenoemde professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. Zoals in het ‘Patiëntenperspectief’ beschreven is, is het patiëntenperspectief meegenomen bij de revisie van deze richtlijn en werd gepoogd in elk onderdeel het patiëntenperspectief te laten meeklinken, als het al niet expliciet wordt genoemd.
KWF Kankerbestrijding geeft makkelijker leesbare patiëntbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Naar aanleiding van het verschijnen van een geheel of gedeeltelijk gereviseerde richtlijn bepaalt KWF of de bestaande patiëntbrochure wordt herzien.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens wetenschappelijke verenigingen of een patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines. De patiëntenvereniging is eveneens vertegenwoordigd en in het geval er literatuuronderzoek is gedaan volgens de regels van Evidence Based Medicine (EBM), is er een methodoloog of literatuuronderzoeker betrokken.
Werkgroepleden
Prof. dr. R.H.M. Verheijen, gynaecologisch oncoloog, voorzitter
Dr. J.H. Becker, gynaecoloog met aandachtsgebied oncologie
Mw. drs. Y. Eysbouts, promovendus gynaecologische oncologie
Mw. drs. M.M. Frijstein, promovendus gynaecologische oncologie
Prof. dr. H. Hollema, gynaeco-patholoog
Mw. dr. M.J. ten Kate-Booij, gynaecoloog
Mw. dr. C.A.R. Lok, gynaecologisch oncoloog
Prof. dr. L.F.A.G. Massuger, gynaecologisch oncoloog
Dr. W.J. Meijer, gynaecoloog met aandachtsgebied oncologie
Mw. dr. P.B. Ottevanger, internist-oncoloog
Mw. mr. J.G. Posthumus, ervaringsdeskundige
Prof. dr. C.G.J. Sweep, klinisch chemicus-endocrinoloog
Mw. dr. N.E. van Trommel, gynaecologisch oncoloog
Mw. dr. A.M. Westermann, internist-oncoloog
Ondersteuning vanuit IKNL
Mw. N.J. Munneke
Belangenverklaringen
Alle werkgroepleden hebben bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn besproken. Er bleken geen belangenverstrengelingen die het nodig maakten werkgroepleden te vervangen door een ander gemandateerd werkgroeplid. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via info@iknl.nl.
Inbreng patiëntenperspectief
Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van patiënten. Deze input is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande werkwijze is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject heeft de patiëntenvertegenwoordiger, na raadpleging van de achterban, knelpunten aangeleverd.
- De inventarisatie was beschikbaar toen de werkgroep begon met schrijven van overwegingen en aanbevelingen, en is daarin meegenomen.
- De patiëntvertegenwoordiger was betrokken bij een deel van de vergaderingen van de richtlijnwerkgroep. De patiëntvertegenwoordiger heeft de conceptteksten beoordeeld teneinde het patiëntenperspectief in de formulering van de definitieve tekst te optimaliseren.
- De Nederlandse Federatie van Kankerpatiëntenorganisatie (NFK) is geconsulteerd in de externe commentaarronde. Het commentaar is verwerkt in deze richtlijn.
Knelpunten aangeleverd door patiëntenorganisaties:
- Communicatie en informatie over termijn waarop zwangerschap na een trofoblasttumor weer verantwoord is. is hier van cruciaal belang.
- Wat zijn de scenario’s voor diagnostiek en behandeling ?
- Welke keuzemogelijkheden zijn er in het proces en waar is de informatie te vinden om een dergelijke keuze op een goede manier te maken?
- Duidelijkheid is gewenst ten aanzien van de hCG-follow-up. Het digitaal kunnen volgen van het hCG-beloop zou hierbij kunnen helpen om uitslagen tijdig en inzichtelijk te krijgen.
- Eenduidige landelijke informatie voor patiënten op internet en via foldermateriaal.
- Een duidelijk signaal naar behandelend artsen dat inschakeling van werkgroep en de CMR Nijmegen noodzakelijk is.
- De patiënten (kunnen) waarde hechten aan hCG-follow-up, ook waar die medisch niet is geïndiceerd.
- Ondanks de in het algemeen goede prognose van trofoblastziekte, kan door de behandeling de kwaliteit van leven (zeer) negatief beïnvloed worden; dit moet meegewogen worden bij de keuzes die gemaakt (kunnen) worden.
- Patiënten zouden graag nieuwe kennis en ontwikkelingen besproken zien, zoals bijvoorbeeld met betrekking tot de rol van transportgenen op de toxiciteit van chemotherapie met methotrexaat en mogelijk actinomycine D, ook als deze nog onvoldoende is onderbouwd.
- Landelijke (anonieme vastlegging) van alle patiënten ten behoeve van toekomstige onderzoeksdoeleinden.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de oncologische en palliatieve zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL een implementatieplan op.
Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme. Informatie hierover is te vinden op www.iknl.nl/opleidingen.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor de verschillende disciplines en bestaat uit de volgende onderdelen:
Implementatieplan
- de nieuwe richtlijn moet onder de aandacht gebracht worden bij alle stakeholders, c.q. disciplines en partijen die betrokken zijn bij de diagnostiek en behandeling van trofoblastziekten;
- de richtlijn zal online gepubliceerd worden en beschikbaar zijn op Oncoline;
- via de nieuwsbrief van de NVOG zal de nieuwe Richtlijn worden aangekondigd;
- de Werkgroep Trofoblasttumoren (WTT) zal in haar vergaderingen aandacht besteden aan deze richtlijn en hiervan gebruik maken, c.q. hiernaar verwijzen bij de casusbesprekingen;
- de richtlijncommissie is zich ervan bewust dat het digitaal beschikbaar maken van data ( hCG-waarden) in de follow-up van trofoblastziekten op logistieke problemen kan stuiten; desalniettemin zal worden aangedrongen bij de Centrale Mola Registratie (CMR) en het verantwoordelijke laboratorium op snelle en effectieve implementatie van ook dit onderdeel van de Richtlijn.
Evaluatie
De modules in deze richtlijn lenen zich niet voor het opstellen van kwaliteitsindicatoren.
Werkwijze
Als gevolg van beperkt beschikbare middelen en mogelijkheden was het slechts mogelijk 2 van de 15 modules evidence based uit te werken. De overige modules zijn alle consensus based. Door de zeldzaamheid van trofoblast tumoren is het moeilijk, zo niet onmogelijk alle vragen ten aanzien van diagnostiek en behandeling te beantwoorden aan de hand van goede en voldoende onderbouwde studies.
Verantwoording
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg, dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence based richtlijnen voor oncologische en palliatieve richtlijnen tot een van de primaire taken. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen. In beide gevallen werkt IKNL conform de daarvoor geldende (inter-)nationale kwaliteitscriteria.
Juridische betekenis
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken.
Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Zoekverantwoording
Er werd gezocht op PubMed MEDLINE met onderstaande zoekcriteria.
|
Database |
Zoektermen |
Totaal |
|
Medline (PubMed) |
|
|
Op basis van titel en abstract lijken 17 studies relevant voor de uitgangsvraag. Deze studies zijn full-tekst bekeken. Uit de referentielijst van deze studies kwamen nog 5 aanvullende relevante studies. Uiteindelijk zijn er 22 Studies meegenomen in het beantwoorden van deze uitgangsvraag.
