(On)gecementeerde knieprothese (TKP)
Uitgangsvraag
Welk type knieprothese verdient de voorkeur: gecementeerde of ongecementeerde knieprothese?
Aanbeveling
Femurcomponent:
Er bestaat geen voorkeur voor het gebruik van een gecementeerde of ongecementeerde femurcomponent.
Tibiacomponent:
Gebruik bij voorkeur een gecementeerde tibiacomponent.
Overwegingen
De gecementeerde totale knieprothese is in Nederland de meest gebruikte prothese.
Zowel uit de literatuur als uit de ervaringen uit de dagelijkse praktijk blijkt dat gecementeerde fixatie verplaatsing van de tibiale component minimaliseert. De resultaten van de hybride totale knieprothese met een gecementeerde tibiale component en een ongecementeerde femurcomponent zijn vergelijkbaar met die van een volledig gecementeerde totale knieprothese.
Gerandomiseerd onderzoek met (middel)lange follow-up is schaars en van onvoldoende omvang om harde conclusies te kunnen trekken met betrekking tot een eventueel verschil tussen gecementeerde en cementloze fixatie in het risico op revisie. Analyse van nationale registers suggereert een klein en mogelijk klinisch relevant verschil in overleving op middellange termijn in het voordeel van een hybride of volledig gecementeerde fixatie, ten opzichte van een ongecementeerde fixatie. Lange termijn resultaten zijn nog onvoldoende bekend.
Met gecementeerde en ongecementeerde totale knieprotheses worden vergelijkbare klinische resultaten bereikt. Er zijn geen significante verschillen in gewrichtsfunctie, activiteiten van dagelijks leven (ADL), complicaties, en patiënttevredenheid.
De totale kosten lijken in grote lijnen vergelijkbaar tussen cementloze fixatie en fixatie met cement, wanneer de langer operatieduur en de kosten van het cement voor gecementeerde technieken wordt meegerekend.
Alles aanschouwend is op grond van de huidige kennis uit de relevante literatuur en de expert-opinie van de werkgroep geen voorkeur uit te spreken voor het gebruik van een gecementeerde of ongecementeerde femurcomponent, bij het plaatsen van een totale knieprothese. De werkgroep is echter wel van mening dat er een voorkeur bestaat voor het gebruik van een gecementeerd tibiacomponent.
Onderbouwing
Achtergrond
Hoewel bij de meerderheid van de patiënten met een symptomatische gonartrose een gecementeerde TKP zal worden geplaatst, is er al geruime tijd wereldwijd ervaring met de ongecementeerde componenten. Het is voor de patiënt en behandelaar zeer relevant of de resultaten van een ongecementeerde TKP vergelijkbaar zijn met die van de gecementeerde TKP. Mogelijke voordelen van ongecementeerde plaatsing zouden kunnen bestaan uit: tijdswinst, kostenbesparing, minder kans op vetembolische complicaties en minder botverlies bij een eventuele revisie.
Is er vanuit de huidige wetenschappelijke publicaties een advies te formuleren over het wel of niet gebruiken van de ongecementeerde TKP? Zijn de klinische resultaten vergelijkbaar? Zijn de complicatie risico’s vergelijkbaar?
Conclusies / Summary of Findings
|
Laag GRADE |
Een cementloos gefixeerde knieprothese en een gecementeerde knieprothese lijken een vergelijkbaar laag risico op revisie te hebben op de middellange termijn. Gebaseerd op gerandomiseerd onderzoek met een geringe studieomvang.
Bronnen: Bercovy (2012), Pijls (2012), Park (2011) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat een volledig of deels (hybride) gecementeerde knieprothese een licht hogere levensduur heeft dan een ongecementeerde prothese op de middellange termijn. Gebaseerd op niet-gerandomiseerd onderzoek met een grote studieomvang (nationale protheseregisters)
Bronnen: NJR for England and Wales (2012); Australian Orthopaedic Association National Joint Replacement Registry (2012); Danish Joint Registry Report (2010); Swedish Knee Arthroplasty Register. (2012); New Zealand Joint Registry (2012) |
|
Hoog GRADE |
Een cementloos gefixeerde knieprothese en een gecementeerde knieprothese bieden een vergelijkbaar klinisch resultaat, in termen van kniefunctie en activiteiten van dagelijks leven.
Bronnen: Nakama (2012), Bercovy (2012), Pijls (2012), Park (2011), Demey (2011) |
|
Matig GRADE |
Een cementloos gefixeerde knieprothese en een gecementeerde knieprothese bieden een vergelijkbaar klinisch resultaat, in termen van milde (niet zeldzame) bijwerkingen en complicaties, en patiënttevredenheid Lange termijn resultaten zijn nog onvoldoende bekend.
Bronnen: Nakama (2012), Bercovy (2012), Pijls (2012), Park (2011), Demey (2011) |
Samenvatting literatuur
De systematische review van Nakama (2012) is een recent Cochrane review en daarmee van zeer goede kwaliteit (zie tabel quality assessment systematic reviews). Nakama (2012) dekt de literatuur tot oktober 2011 en includeert vijf RCT’s naar de effecten van gecementeerde, ongecementeerde en deels gecementeerde (hybride) knieprotheses. In alle gevallen gaat het om een primaire knieprothese bij patiënten met ernstige gonartrose (trauma en revisies zijn uitgesloten), de groepsgrootte varieert tussen 43 en 120 patiënten (45-150 knieën), met een gemiddelde leeftijd van negenenzestig tot drieënzeventig jaar. De studieduur varieert tussen twee en vijf jaar. Patiënten werden gerandomiseerd naar een gecementeerde of ongecementeerde tibiale component (Carlsson 2005; Ishii 2005; Toksvig-Larsen 1998), naar een gecementeerde of ongecementeerde tibiale èn femorale component (Nilsson 1999), of naar een gecementeerde of ongecementeerde femorale component (Uvehammer 2007). De combinatie van tibiale en femorale fixatie is daarmee niet vergelijkbaar tussen de vijf studies, bijvoorbeeld in Nilsson (1998) werd de fixatie van de tibiale component gerandomiseerd, maar fixatie van de femorale component vond plaats op basis van de voorkeur van de orthopedisch chirurg. In drie van de vijf studies is de ongecementeerde component voorzien van hydroxyappatiet (HA; Carlsson 2005; Nilsson 1999; Uvehammer 2007). De studie van Carlsson (2005) kent drie behandelarmen: gecementeerd, ongecementeerd met HA, en ongecementeerd zonder HA.
Levensduur van de knieprothese
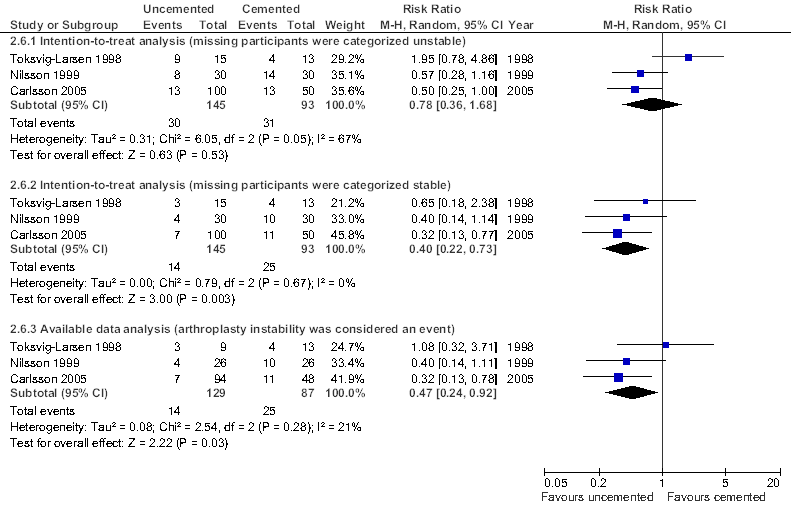
Omdat de geïncludeerde studies een studieduur hebben die varieert tussen twee en vijf jaar, ontbreken middellange en lange termijn resultaten. Nilsson (1999) is de enige studie die een revisie als gevolg van loslating rapporteert: bij één enkele patiënt met een ongecementeerde component voorzien van HA. Het risico op revisie als gevolg van aseptische loslating kan derhalve alleen worden geschat op basis van röntgen stereophotometrische analyse (RSA). Bij meta-analyse bedraagt het gemiddelde verschil in verplaatsing van de tibiale component (maximum total point-motion, MTPM) na een follow-up van twee jaar, tussen gecementeerd en ongecementeerd (met of zonder HA), MD= 0.52 mm ( 95% betrouwbaarheidsinterval, 95%BI= [0,31; 0,74]; 2 RCT’s, n=167) in het voordeel van cementering. Het geschatte risico op aseptische loslating (prothese instabiliteitsclassificatie op basis van RSA met een afkapwaarde voor MTPM van 0,2 mm; Ryd 1995) is echter statistisch significant lager bij cementloze fixatie: relatief risico, RR= 0,47 [0,24; 0,92] (Figuur 1; drie RCT’s, n = 216, analyse beperkt tot de patiënten waarvoor data beschikbaar waren). Bij een intention-to-treat (ITT) analyse waarbij de patiënten die verloren gingen tijdens follow-up zijn gecategoriseerd als instabiel (‘worst case scenario’), is het geschatte risico op aseptische loslating eveneens lager bij cementloze fixatie, maar niet langer statistisch significant: RR= 0,78 [0,36; 1,68] (Figuur 1; drie RCT’s, n = 238).
Figuur 1. Meta-analyse van de vergelijking tussen gecementeerde en ongecementeerde knieprotheses (met of zonder hydroxyappatiet) met betrekking tot het geschatte relatieve risico op aseptische loslating (prothese instabiliteitsclassificatie op basis van RSA).
De systematische zoekactie leverde vier recente onderzoeken op ter aanvulling van de systematisch review (Bercovy 2012; Pijls 2012; Park 2011; Demey 2011), waarvan drie met een middellange follow-up van meer dan vijf jaar (Bercovy 2012; Pijls 2012; Park 2011).
De quasi-gerandomiseerde studie van Bercovy (2012) heeft een gemiddelde lengte van follow-up van 7,6 jaar (range vijf tot elf jaar) en randomiseert patiënten voor een primaire totale knieprothese (291 patiënten, 321 knieën) naar een gecementeerde tibiale component, of een cementloze tibiale component voorzien van HA. De gemiddelde leeftijd van de patiënten bij studie-aanvang bedraagt zeventig jaar. De femorale component was HA-gecoat en werd vrijwel altijd (96%) cementloos gefixeerd. In beide behandelgroepen was één revisie noodzakelijk als gevolg van aseptische loslating van de tibiale component, na vier en zes jaar in respectievelijk de cementloze en gecementeerde groep. Overleving van de (niet gerandomiseerde) femorale component is 100% na negen jaar. Een survival analyse met als eindpunt revisie als gevolg van implantaat falen of aseptische loslating, geeft in beide behandelgroepen een overleving te zien van 100% over de eerste vijf jaar, en 99,1% (95%BI= [97,4; 100,0]) over de eerste tien jaar. Een ITT-analyse waarbij de patiënten die verloren gingen tijdens follow-up (zes patiënten, acht knieën) zijn gecategoriseerd als aseptische loslating met noodzaak tot revisie, geeft na 9,8 jaar een overleving van 96% (95%BI=[92,5; 99,5]) voor de cementloze tibiale component, en een overleving van 96,6% (95%BI=[93,4; 100]) voor de gecementeerde tibiale component; dit verschil is statistisch niet significant (p=0,77). Bij het beoordelen van deze analyses van een zeldzame en lange termijn uitkomstmaat moet de relatief geringe lengte van follow-up en het lage aantal revisies worden meegewogen (imprecisie).
De RCT van Pijls (2012) randomiseert patiënten voor een primaire totale knieprothese (68 knieën in 48 patiënten) naar een gecementeerde tibiale component (n=24), een cementloze tibiale component voorzien van HA (n=24), of een cementloze tibiale component zonder HA (n=20). Patiënten worden gevolgd voor 11 tot 16 jaar, tot overlijden of revisie (gemiddelde lengte van follow-up is negen jaar). Bij de meerderheid van de patiënten (72%) is de indicatie voor de totale knieprothese reumatoïde artritis. De gemiddelde leeftijd van de patiënten bij studie-aanvang bedraagt zesenzestig jaar. De fixatiemethode voor de femorale component wordt niet beschreven. Bij röntgen stereophotometrische analyse (RSA) is de gemiddelde verplaatsing van de tibiale component (maximum total point-motion, MTPM) na een follow-up van tien jaar: 1,66 mm voor de cementloze HA-gecoate, 2,25 mm voor de cementloze niet-gecoate, en 0,79 mm voor de gecementeerde tibiale component (p <0,001; referentie = RSA radiogram na operatie). Gedurende de follow-up migreren de cementloze HA-gecoate en cementloze ongecoate component gemiddeld respectievelijk 0,61 mm (95%BI= [0,42; 0,80]) en 1,0 mm (95%BI= [0,82; 1,18]) meer dan de gecementeerde component (p<0,001). De gemiddelde snelheid van migratie is 0,057mm/jaar voor de cementloze HA-gecoate, 0,067 mm/jaar voor de cementloze niet-gecoate, en 0,043 mm/jaar voor de gecementeerde tibiale component (p <0,003; referentie = RSA radiogram na één jaar; general linear mixed model, gecorrigeerd voor leeftijd, geslacht, diagnose, revisies en bmi). Deze RSA resultaten geven aan dat de tibiale component het minst verplaatst bij een gecementeerde fixatie, in overeenstemming met de meta-analyse van Nakama (2012), en dat bij een cementloze fixatie de verplaatsing van de tibiale component kan worden verminderd door toepassing van een HA coating. Pijls (2012) bevat geen gegevens met betrekking tot het geschatte risico op aseptische loslating op basis van RSA (Ryd 1995). In totaal worden zeven revisies uitgevoerd: drie revisies ten gevolge van aseptische loslating van de tibiale component (twee cementloos ongecoat, één gecementeerd), drie ten gevolge van septische loslating van de tibiale component (twee cementloos ongecoat, één gecementeerd), en één revisie ten gevolge van instabiliteit van de tibiale component (cementloos HA-gecoat). Vanwege de geringe studieomvang en het lage aantal revisies is een zinvolle vergelijking van de overleving van gecementeerde en ongecementeerde protheses niet mogelijk.
De RCT van Park (2011) randomiseert de linkerknie van patiënten die in aanmerking komen voor een primaire bilaterale totale knieprothese (52 patiënten) naar een gecementeerde tibiale plus femorale component (n=52), of een cementloze tibiale plus femorale component voorzien van fiber-metal coating (n=52). De contralaterale knie ontvangt de alternatieve behandeling (n=52). De gemiddelde lengte van follow-up is 13,6 jaar (range, 13 tot 14 jaar). De gemiddelde leeftijd van de patiënten bij studie-aanvang bedraagt 58,4 jaar (range, 51 tot 67 jaar). In de cementloze behandelgroep was één revisie noodzakelijk als gevolg van aseptische loslating van de tibiale component één jaar na de operatie. In beide behandelgroepen is de overleving van de femorale component na veertien jaar 100% (95%BI= [93; 100]). Een survival analyse met als eindpunt revisie of loslating van de tibiale component geeft een overleving te zien van 100% (95%BI= [93; 100]) na veertien jaar in de gecementeerde groep, en 98% (95%BI= [91; 100]) in de cementloze groep. Bij het beoordelen van deze analyses moet het lage aantal revisies worden meegewogen (imprecisie).
De RCT van Demey (2011) randomiseert patiënten voor een primaire totale knieprothese (130 patiënten) naar een gecementeerde femorale component (n=65), of een cementloze femorale component voorzien van HA (n=65). De gemiddelde leeftijd van de patiënten bij studie-aanvang bedraagt tweeënzeventig jaar. De tibiale component werd gefixeerd met cement. Patiënten worden gevolgd voor tenminste twee jaar (gemiddelde lengte van follow-up, 32 tot 33 maanden). Aan deze kortdurende studie kunnen geen gegevens worden ontleend met betrekking tot de levensduur van de protheses, er worden geen revisies uitgevoerd. Bij één patiënt in de gecementeerde groep is sprake van septische loslating zeventien maanden na de operatie.
In de verschillende nationale implantatenregisters wordt een onderscheid gemaakt tussen gecementeerde en ongecementeerde totale knieprothesen. In de registers van de UK , Australië, Denemarken, Zweden en Nieuw-Zeeland wordt een lager revisiepercentage gemeld voor gecementeerde prothesen ten opzichte van een ongecementeerde prothesen. In het UK register (NJR, 2012) wordt een cumulatief revisiepercentage na acht jaar follow-up gerapporteerd, voor gecementeerd 2,82% (95%BI=[2,71; 2,94]) en voor ongecementeerd 3,69% (95%BI=[3,29; 4,14]). Het verschil in revisiepercentage van 0,9% in het voordeel van cementering is statistisch significant maar waarschijnlijk niet klinisch relevant. Er wordt geen verschil waargenomen in revisiepercentage tussen volledig gecementeerde fixatie en hybride fixatie waarbij alleen de tibiacomponent wordt gecementeerd (respectievelijk, 2,82% [2,71; 2,94] en 2.95% [2,43; 3,59]).
In het Australische register (AOANJRR, 2012) bedraagt het cumulatief revisiepercentage over 11 jaar follow-up, voor gecementeerd 6,1% (95%BI= [5,7; 6,4]), voor ongecementeerd 6,6% (95%BI=[6,1; 7,2]), en voor hybride fixatie 5,3% (95%BI=[5,0; 5,7]). Het verschil in revisiepercentage van 0,5% tussen gecementeerd en ongecementeerd (HR=1,05; p=0,045), in het voordeel van gecementeerd, is klinisch niet relevant. Een groter verschil in revisiepercentage wordt waargenomen tussen hybride fixatie (alleen cementering van de tibiacomponent) en een volledig ongecementeerde fixatie, 1,8% in voordeel van hybride fixatie; statistisch significant en klinisch relevant. In geen van bovenstaande analyses wordt gecorrigeerd voor potentiële confounders zoals protheseontwerp, patiëntengroepen, reden van revisie, en ervaring van de operateur. In het Deense register (DJRR 2010) hebben ongecementeerde totale knieprothesen een kortere levensduur dan gecementeerde totale knieprothesen, het verschil in revisiepercentage is statistisch significant en klinisch relevant. Het risico op revisie over 13 jaar follow-up is voor een ongecementeerde totale knieprothese 46% hoger dan voor een gecementeerde (HR=1,46; 95%BI=[1,29;1,66]; gecorrigeerd voor geslacht en leeftijd). Er is geen statistisch significant verschil tussen ongecementeerde en hybride fixatie (Hybride versus gecementeerd, HR=0,89; 95%BI=[0,78;1.01]). In het Zweedse register (SKAR 2012) wordt gemeld dat het aantal ongecementeerde totale knieprotheses zo klein is geworden is dat het niet langer mogelijk is om een vergelijking van enige betekenis te maken. Tussen 1985–1994 werden meer ongecementeerde totale knieprotheses geplaatst en is een vergelijking wel mogelijk. Er wordt een statistisch significant hoger revisie risico gerapporteerd bij een ongecementeerde tibiacomponent. Het risico op revisie over 19 jaar follow-up was voor een totale knieprothese met een ongecementeerde tibiacomponent 60% hoger dan bij gebruik van een gecementeerde tibiacomponent (HR=1,6; 95%BI=[1,3;1,9]; gecorrigeerd voor leeftijd, geslacht, jaar van operatie en gebruik van een patellacomponent). In het Nieuw Zeelandse register (NZJR 2012) wordt een statistisch significant hoger revisie percentage gemeld (p<0.05) voor de ongecementeerde totale knieprothese ten opzichte van de gecementeerde en hybride fixatie (aantal revisies per 100 component jaren over tien jaar follow-up, gecementeerd 0,48 [ 0.46; 0.51]; ongecementeerd 0.98 [0.82; 1.16]; hybride 0.52 [0.42;0.63]).
Samenvattend geven bovenstaande studies aan dat een gecementeerde fixatie verplaatsing van de tibiale component minimaliseert. Een analyse van het risico op aseptische loslating op basis van RSA (Nakama 2012; methode gebaseerd op Ryd 1995) suggereert een mogelijk verhoogd risico bij gecementeerde fixatie, zo’n verhoogd risico wordt echter vooralsnog niet ondersteund door praktijkgegevens. Gerandomiseerd onderzoek met (middel)lange follow-up is schaars en van onvoldoende omvang om harde conclusies te kunnen trekken met betrekking tot een eventueel verschil tussen gecementeerde en cementloze fixatie in het risico op revisie. De weinige gegevens die beschikbaar zijn uit gerandomiseerd onderzoek suggereren een vergelijkbare levensduur voor gecementeerde en cementloze TKP componenten. Analyse van nationale registers suggereert een klein en mogelijk klinisch relevant verschil in overleving op middellange termijn in het voordeel van een hybride of volledig gecementeerde fixatie, ten opzichte van een ongecementeerde fixatie.
Klinische resultaten, bijwerkingen, patiënttevredenheid en kosteneffectiviteit
Van de kritische uitkomstmaten worden, naast levensduur van de prothese (RSA; revisies), de klinische resultaten, gewrichtsfunctie, activiteiten van dagelijks leven (ADL), bijwerkingen en complicaties geanalyseerd. Enkele studies rapporteren over de belangrijke uitkomstmaten patiënttevredenheid en kosteneffectiviteit.
Er worden geen klinisch relevante of statistisch significante verschillen gevonden tussen gecementeerde en cementloze totale knieprotheses met betrekking tot de klinische resultaten (pijn [VAS]; samengestelde scores [KSS, HSS, IKS, WOMAC, OKS]), de gewrichtsfunctie (bewegingsbereik, buiging), en activiteiten van dagelijks leven.
Ishii (2005; één van de studies geïncludeerd in Nakama 2012) vindt geen verschil in totaal bloedverlies tussen gecementeerde en cementloze fixatie, terwijl Park (2011), een statistisch significant hoger bloedverlies rapporteert bij cementloze fixatie (1155 ml versus 1011 ml; p=0,006).
Vrijwel alle studies vermelden complicaties (infecties; septische en aseptische loslating; radiolucente lijnen; ligamentaire laxiteit; anterieure kniepijn), maar zonder statistisch significante verschillen tussen de behandelgroepen. Hierbij dient wel rekening te worden gehouden met de beperkte studieduur van het merendeel van de geïncludeerde onderzoeken, en het feit dat de studieomvang (power) is afgestemd op de primaire uitkomstmaten (RSA, kniescores), en onvoldoende is voor een betrouwbare analyse van zeldzame uitkomsten (ernstige complicaties). Bercovy (2012) vindt bij einde van de follow-up (gemiddeld 7,6 jaar) een statistisch significant hoger percentage radiolucente lijnen in zone 1 van de tibiale interface bij de gecementeerde groep (5,5% versus 2%; p<0,01), maar geen statistisch significante verschillen in de zones 2 tot 7. Demey (2011) rapporteert bij tweeënhalf jaar follow-up een hoger percentage radiolucente lijnen in de femorale interface bij de gecementeerde groep (24% versus 2%; p<0,00), statistisch significant in zones 1, 2 en 4. Hierbij moet wel worden opgemerkt dat radiolucente lijnen bij een korte follow-up van enkele jaren, slechts een zwakke predictor is voor het risico op latere revisie als gevolg van aseptische loslating.
Twee studies vermelden patiënttevredenheid. Toksvig-Larsen (1988; één van de studies geïncludeerd in Nakama 2012) beschrijft dat alle patiënten tevreden waren met de ingreep na twee jaar follow-up, zonder verdere kwantificering. Park (2011) meet patiënttevredenheid op een 10-punts VAS aan het einde van de follow-up (gemiddeld 13,6 jaar) en vindt eveneens geen significant verschil tussen de gecementeerde en cementloze groep (8,1 versus 8,3; p=0,73). De patiënten in Park (2011) hebben zowel een gecementeerde als cementloze totale knieprothese, en 84% geeft aan geen voorkeur te hebben voor het type fixatie, 8% heeft een voorkeur voor een gecementeerde fixatie, en 8% prefereert een cementloze fixatie.
Bercovy (2012) is uitgevoerd in Frankrijk en bevat een summiere vergelijking van de kosten. Een cementloze fixatie met HA-gecoate tibiale en femorale componenten was 296 Euro duurder dan een fixatie met cement. Bij een hybride fixatie met een cementloze HA-gecoate tibiale component, en een gecementeerde femorale component, bedroegen de meerkosten 200 Euro ten opzichte van een volledig gecementeerde prothese. Hierbij is geen rekening gehouden met de kosten van het cement, en de extra tijd die nodig is in de operatiekamer bij een hybride of volledige gecementeerde fixatie (respectievelijk vijf en tien minuten extra à raison de 30 tot 42 Euro per minuut).
Samenvattend geven bovenstaande studies aan dat met gecementeerde en ongecementeerde knieprotheses vergelijkbare klinische resultaten worden bereikt, en dat gewrichtsfunctie, activiteiten van dagelijks leven (ADL), bijwerkingen en complicaties, en patiënttevredenheid niet significant verschillen. Rekening houdend met een langere operatietijd bij gecementeerde fixatie, lijken ook de totale kosten in grote lijnen vergelijkbaar tussen cementloze fixatie en fixatie met cement.
Bewijskracht van de literatuur
De literatuurconclusie met betrekking tot de uitkomstmaat levensduur (aseptische loslating; revisie) is gebaseerd op directe gegevens over aseptische loslating en revisie afkomstig uit studies met middellange follow-up en landelijke protheseregisters. De schatting van het risico op aseptische loslating op basis van RSA is niet meegewogen vanwege de zeer lage bewijskracht van deze (indirecte) uitkomstmaat: twee punten aftrek vanwege gebruik van een matig gevalideerde indirecte uitkomstmaat, en een derde punt aftrek vanwege heterogeniteit (verschil in uitkomst tussen de continue uitkomstmaat [MTPM] en dichotome uitkomstmaat [instabiliteitsclassificatie op basis van RSA met afkapwaarde van 0,2 mm]). De bewijskracht voor de uitkomstmaat levensduur (aseptische loslating; revisie), voor zo ver gebaseerd op de drie recente RCT’s met middellange follow-up, is verlaagd met 2 niveaus vanwege ernstige imprecisie (zeer geringe studieomvang; onvoldoende statistische power voor zeldzame uitkomstmaat). De bewijskracht voor de uitkomstmaat levensduur voor zover gebaseerd op landelijke protheseregisters is zeer laag; de registers zijn te beschouwen als cohortstudies (lage bewijskracht) met ernstige beperkingen in de onderzoeksopzet: verlaging van de bewijskracht met 1 niveau, met name door onvoldoende correctie voor confounders, leidt tot een zeer lage bewijskracht. De bewijskracht voor de uitkomstmaat klinisch resultaat, in termen van kniefunctie en activiteiten van dagelijks leven is hoog. De bewijskracht voor klinisch resultaat in termen van milde (niet zeldzame) bijwerkingen en complicaties, en patiënttevredenheid, is verlaagd met één niveau vanwege imprecisie (gering aantal studies en/of geringe studieomvang).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling: wat zijn de gunstige en ongunstige effecten van een gecementeerde versus een ongecementeerde TKP bij patiënten met gonartrose?
Relevante uitkomstmaten
De werkgroep achtte de klinische resultaten (pijn [VAS]; samengestelde scores [KSS, HSS, IKS, WOMAC, OKS, KOOS]), gewrichtsfunctie (bewegingsbereik [ROM; toename ten opzichte van preoperatieve ROM], buigen, strekken, stabiliteit), activiteiten van dagelijks leven (ADL), bijwerkingen en complicaties (revisies; levensduur van de prothese) voor de besluitvorming kritieke uitkomstmaten; en patiënttevredenheid en kosteneffectiviteit voor de besluitvorming belangrijke uitkomstmaten.
De primaire uitkomstmaat is levensduur van de knieprothese, en de belangrijkste oorzaak voor het falen van een knieprothese en noodzaak tot revisie is septische of aseptische loslating. Eventuele verschillen in levensduur tussen een gecementeerde en ongecementeerde prothese worden pas zichtbaar na een voldoende lange follow-up van meer dan vijf jaar. In studies met een kortere follow-up kan de prothese-instabiliteit op basis van röntgen stereofotometrische analyse (RSA) worden gebruikt als een indirecte (surrogaat) uitkomstmaat voor het risico op revisie als gevolg van aseptische loslating (Kärholm 2006; Ryd 1995). In de studie van Ryd (1995) voorspelt een migratie (maximum total point-motion, MTPM) van de tibiale component met >0,2 mm in het tweede jaar van follow-up, het risico op toekomstige aseptische loslating met een voorspellende waarde van 85%. De werkgroep beschouwt prothese-instabiliteit op basis van RSA als een mogelijke (indirecte) uitkomstmaat voor het risico op revisie als gevolg van aseptische loslating.
De werkgroep definieerde een klinisch relevant verschil als een verschil van tenminste: 5o (ROM), 10 punten (KSS; maximum score is 100), 10 punten (HSS; maximum score is 100), 10 punten (WOMAC; maximum score is 100), 1 punt (pijn [VAS]; maximum score is 10; Kelly 2001), 1% (revisie; middellange termijn [5-10 jaar]), en 2% (revisie; lange termijn [> 10 jaar]).
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en Cochrane is met relevante zoektermen gezocht vanaf 2005 naar vergelijkend onderzoek van gecementeerde en ongecementeerde totale knieprotheses bij patiënten met gonartrose. De zoekverantwoording is weergegeven onder het tabblad verantwoording. Studies werden geselecteerd op grond van de volgende selectiecriteria: (systematisch review van) vergelijkend onderzoek, vergelijking van gecementeerd versus ongecementeerde totale knieprothese, volwassen patiënten met een primaire of secundaire artrose van de knie, met klinische resultaten (pijn, samengestelde scores), gewrichtsfunctie, activiteiten van dagelijks leven, bijwerkingen en complicaties (revisies), patiënttevredenheid en kosteneffectiviteit als uitkomstmaten. De initiële literatuurzoekactie was gericht op systematische reviews en leverde 22 treffers op. Op basis van titel en abstract werden in eerste instantie drie studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens twee studies geëxcludeerd (zie exclusietabel), en één studie definitief geselecteerd. De geselecteerde systematische review is een Cochrane review, dekt de literatuur tot oktober 2011, en is in een tweede zoekactie aangevuld met relevante recentere studies. In deze tweede literatuurzoekactie werd gezocht naar RCT’s vanaf 2011 (zie evidence tabellen). De aanvullende zoekactie leverde 133 treffers op. Op basis van titel en abstract werden in eerste instantie 8 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens vier studies geëxcludeerd (zie exclusietabel), en vier studies definitief geselecteerd.
In totaal zijn vijf onderzoeken (één systematische review en vier originele onderzoeken) opgenomen in de literatuuranalyse. Voor uitgebreide studiekarakteristieken en resultaten van de studies geïncludeerd in de systematische review, wordt verwezen naar de bewuste Cochrane review (Nakama 2012). De belangrijkste studiekarakteristieken en resultaten van de aanvullende studies zijn samengevat in de evidencetabel.
Voor de uitkomstmaat levensduur van de prothese (ernstige complicaties, revisies) zijn tevens de landelijke prothese-registers van Zweden, Noorwegen, Denemarken, Groot Brittannië en Australië geraadpleegd.
Referenties
- AOANJRR. Australian Orthopaedic Association National Joint Replacement Registry - Annual Report 2012. Link: www.aoa.org.au 2012 (geraadpleegd op 10 jan 2014).
- DKAR. Danish Knee Arthroplasty Register Annual Report 2010. Link: www.dkar.dk 2012 (geraadpleegd op 10 jan 2014).
- LROI. LROI-Rapportage 2007-2011. Registreren voor een betere zorg. Eerste jaarrapportage uit de Landelijke Registratie Orthopedische Implantaten 2007-2011. Link: www.lroi.nl 2012 (geraadpleegd op 10 jan 2014).
- Namba RS, Inacio MC, Paxton EW, et al. The role of registry data in the evaluation of mobile-bearing total knee arthroplasty. J Bone Joint Surg Am 2011;93(S3):48-50.
- National Joint Registry for England and Wales. 9th Annual Report. www.njrcentre.org.uk 2012 (accessed May, 6, 2013).
- NZJR. The New Zealand Joint Registry - Thirteen year report. Link: www.cdhb.govt.nz/njr 2012 (geraadpleegd op 10 jan 2014).
- Peltola M, Malmivaara A, Paavola M. Learning curve for new technology? a nationwide register-based study of 46,363 total knee arthroplasties. J Bone Joint Surg Am 2013;95:2097-2103. doi: 10.2106/JBJS.L.01296. PubMed PMID: 24306696.
- SKAR. Swedish Arthroplasty Register. Annual report 2012. Link: www.skane.se 2012 (geraadpleegd op 10 jan 2014).
- Van der Voort P, Pijls BG, Nouta KA, et al. A systematic review and meta-regression of mobile-bearing versus fixed-bearing total knee replacement in 41 studies. Bone Joint J 2013;95-B:1209-1216.
- AOANJRR. Australian Orthopaedic Association National Joint Replacement Registry - Annual Report 2012. Link: www.aoa.org.au 2012 (geraadpleegd op 10 jan 2014).
- Bercovy M, Beldame J, Lefebvre B, et al. A prospective clinical and radiological study comparing hydroxyapatite-coated with cemented tibial components in total knee replacement. J Bone Joint Surg Br 2012;94:497-503.
- Carlsson A, Björkman A, Besjakov J, et al. Cemented tibial component fixation performs better than cementless fixation: a randomized radiostereometric study comparing porous-coated, hydroxyapatite-coated and cemented tibial components over 5 years. Acta Orthop 2005;76:362-9.
- Choi WC, Lee S, Seong SC, et al. Comparison between standard and high-flexion posterior-stabilized rotating-platform mobile-bearing total knee arthroplasties: a randomized controlled study. J Bone Joint Surg Am 2010;92:2634-42.
- Demey G, Servien E, Lustig S, et al. Cemented versus uncemented femoral components in total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc 2011;19:1053-9.
- DKAR. Danish Knee Arthroplasty Register Annual Report 2010. Link: www.dkar.dk 2010 (geraadpleegd op 10 jan 2014).
- Ishii Y, Matsuda Y. Perioperative blood loss in cementless or hybrid total knee arthroplasty without patellar resurfacing: a prospective, randomized study. J Arthroplasty 2005;20:972-6.
- Kärrholm J, Gill RH, Valstar ER. The history and future of radiostereometric analysis. Clin Orthop Relat Res 2006;448:10-21.
- Kelly AM. The minimum clinically significant difference in visual analogue scale pain score does not differ with severity of pain. Emerg Med J 2001;18:205-7.
- Nakama GY, Peccin MS, Almeida GJ, et al. Cemented, cementless or hybrid fixation options in total knee arthroplasty for osteoarthritis and other non-traumatic diseases. Cochrane Database Syst Rev 2012;10:CD006193.
- National Joint Registry for England and Wales (2012). 9th Annual Report. http://www.njrcentre.org.uk (accessed May, 6, 2013).
- Nilsson KG, Kärrholm J, Carlsson L, et al. Hydroxyapatite coating versus cemented fixation of the tibial component in total knee arthroplasty: prospective randomized comparison of hydroxyapatite-coated and cemented tibial components with 5-year follow-up using radiostereometry. J Arthroplasty 1999;14:9-20.
- NZJR. The New Zealand Joint Registry - Thirteen year report. Link: www.cdhb.govt.nz/njr 2012 (geraadpleegd op 10 jan 2014).
- Park JW, Kim YH. Simultaneous cemented and cementless total knee replacement in the same patients: a prospective comparison of long-term outcomes using an identical design of NexGen prosthesis. J Bone Joint Surg Br 2011;93:1479-86.
- Pijls BG, Valstar ER, Kaptein BL, et al. The beneficial effect of hydroxyapatite lasts: a randomized radiostereometric trial comparing hydroxyapatite-coated, uncoated, and cemented tibial components for up to 16 years. Acta Orthop 2012;83:135-41.
- Ryd L, Albrektsson BE, Carlsson L, et al. Roentgen stereophotogrammetric analysis as a predictor of mechanical loosening of knee prostheses. J Bone Joint Surg Br 1995;77:377-83.
- SKAR. Swedish Arthroplasty Register. Annual report 2012. Link: http://www.skane.se 2012 (geraadpleegd op 10 jan 2014).
- Toksvig-Larsen S, Ryd L, Lindstrand A. Early inducible displacement of tibial components in total knee prostheses inserted with and without cement: a randomized study with roentgen stereophotogrammetric analysis. J Bone Joint Surg Am 1998;80:83-9.
- Uvehammer J, Kärrholm J, Carlsson L. Cemented versus hydroxyapatite fixation of the femoral component of the Freeman-Samuelson total knee replacement: a radiostereometric analysis. J Bone Joint Surg Br 2007;89:39-44.
Evidence tabellen
Tabel 2 Quality assessment for systematic reviews of RCT’s and observational studies
based on AMSTAR checklist (Shea et al 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the optimum fixation method for TKA, with or without cement?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Nakama, 2012 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCT’s)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studie
Tabel 3 Risk of bias table for intervention studies (randomized controlled trials)
Research question: what is the optimum fixation method for TKA, with or without cement?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Bercovy, 2012 |
Quasi randomized: toss of coin |
Likely* |
Unclear |
Unclear** |
Unclear*** |
Unlikely |
Unlikely |
Unclear |
|
Demey, 2010 |
computer generated random numbers |
Unlikely |
Unlikely
|
Unclear** |
Unclear*** |
Unlikely |
Unlikely |
Unclear |
|
Pijls, 2012 |
computer generated random numbers |
Unlikely |
Unlikely |
Unclear** |
Unclear**** |
Unlikely |
Unlikely |
Unlikely |
|
Park, 2011 |
sealed study number envelope |
Unlikely |
Unclear |
Unclear** |
Unclear*** |
Unlikely |
Unlikely |
Unlikely |
*quasi randomization, not blinded
** Care providers were not blinded to treatment allocation, but risk of bias is not likely
***outcome assessors were not blinded to treatment allocation, but risk of bias is not likely
**** outcome assessors were blinded to treatment allocation with respect to presence or absence of HA-coating but not cement (cement is visible on radiographs), but risk of bias is not likely
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel 4 Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: what is the optimum fixation method for TKA, with or without cement?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Bercovy, 2012 |
Type of study: RCT
Setting: orthopaedic department
Country:
Source of funding: for personal/ professional use from a commercial party related directly or indirectly to the subject of this article. |
Inclusion criteria: with ROCC prosthesis
Exclusion criteria: Severe comorbidities (n = 4), belonging to the Charnley group C7 (n = 22), those housebound (n = 51)
N total at baseline: Intervention HA coated: 157 knees Control cemented: 164 knees
Important prognostic factors2: For example age (range): I: 69.9 (49 to 89) C: 70.9 (45 to 91) p-value: 0.83
Sex: I: 40.94% M C: 32.39% M P-value: 0.075
Mean BMI (range) I: 29.6 (20-45) C:29.1 (20-47.6) P-value: 0.41
Charnley classification (n,%) I: A 59 (39.6); B 90 (60.4) C: A 51 (35.9); B 91 (64.1) p-value: 0.53†
Aetiology (n, %) Osteoarthritis (OA; Osteonecrosis (ON); Rheumatoid arthritis (RA); Post-traumatic osteoarthritis (PA) I: 145 (92.4); 6 (3.8); 3 (3.8); 3 (1.9) C: 153 (93.3); 4 (2.4); 4 (2.4); 3 (1.8) p-value: 0.46
Groups comparable at baseline? yes
|
Tibial Uncemented HA-coated components
The ROCC Knee is a posterior cruciate ligament-sacrificing mobile-bearing rotating-platform TKR.
Femoral components: HA-coated w/o cement (96%),
|
Tibial Cemented HA-coated components
The ROCC Knee is a posterior cruciate ligament-sacrificing mobile-bearing rotating-platform TKR.
Femoral components: HA-coated w/o cement (96%),
The cemented tibial or femoral components were implanted using cement of normal viscosity mixed by hand and spread on the bone and metal surfaces. Compression was maintained until polymerisation.
|
Length of follow-up: Mean 7.6 years (5.2 to 11)
6 weeks, between 4-6 months, 1 year and every 2 years thereafter.
Loss-to-follow-up: Intervention: N knees 5 (3.18%); Reasons (describe): unknown
Control: N knees 3 (1.83%); Reasons (describe): unknown
Incomplete outcome data: Intervention: n=17 Reasons: deceased Latest follow up included in analysis
Control: 19 Reasons: deceased Latest follow up included in analysis
|
Clinical assessment: Knee Society knee score (mean, range) I: 94,6 (48-100) C: 94.3 (58-100) p-value: 0.74
Function scores (KSS), the range of knee flexion (mean, range) I: 95.2 (20-100) C: 94.7 (10-100) p-value: 0.96
Oxford knee score (OKS) I: 14.5 (12-14) C: 14.5 (12-32) p-value: 0.61
Western Ontario and McMaster Universities (WOMAC) osteoarthritis index I: 3.3 (0-36) C: 3.9 (0-69) p-value: 0.63
Mean visual analogue score for pain (range) I: 0.7 (0 to 4) C: 0.7 (0 to 5) p-value: 0.92
Pain (Knee Society score) (n) No pain I: 111 C: 119 Mild pain I: 30 C: 28 Moderate pain I: 10 C: 14 Severe pain I: 1 C: 0 p-value: 0.68
Survival (Kaplan meier) I (follow up 5.46-8.74): 0.991 (0.974 to 1.0) [0.009] C (follow up: 4.78-9.8): 0.991 (0.974 to 1.0) [0.009] P=0.992
Loosening of tibial component: I: 1 C: 1
Radiological assessment included pre- and post-operative frontal, sagittal and skyline views at 30° and long-leg standing films. The implant interface was assessed using the KSS radiological system
Mean active flexion (°) (range) I:128 (90 to 140) C: 126 (85 to 150) p-value: 0.51
Cost: Both components HA-coated: 296 more than both components cemented. HA-coated femoral component + cemented tibial component: extra cost was 200 euros; did not take into account hidden costs as: use of cement, increased time in operating theatre
RLL femoral interface: I: - C: 1 (0,5%)
RLL frontal view (1mm): zone 1 I: 3 (2%) C: 9 (5,5%) P <0.01 zone 2 3 (2%) 4 (2.5%) NS |
These results demonstrate that the HA-coated version of the ROCC TKR performs at least as well as the cemented version. The HA-coated femoral component had a survival rate of 100% at nine years and no interface radiolucencies were observed. There was no statistically significant difference in outcome between the HA-coated and the cemented tibial components in our series. Our overall survival rate of 99.1% at nine years using revision for aseptic loosening as the endpoint and of 96.4% with revision or re-operation for any cause as the end-point is to be compared with the 95.3% survival rate at ten years and the 93% cumulative survival rate at 13 years of previous studies of cemented or porous coated TKA. advantages of the fully HA-coated femoral and tibial components. The clinical and radiological results are at least equal to those of the cemented version. Operating time is less and the bone-implant interfaces are more stable with the passage of time. However, cementless TKR requires good surgical technique in order to secure fixation of the implant. As a consequence of this study, we now routinely use the HA-coated version. |
|
Pijls, 2012 |
Type of study: RCT long term
Setting: Academic hospital (1993-1998) Country: Netherlands
Source of funding: - |
Inclusion criteria: TKR because of osteoarthritis or rheumatoid arthuritis. Exclusion criteria:- N total at baseline: cemented n=24 HA-coated n=24
Important prognostic factors2: Age (sd) Cemented: 69 (8.6) HA: 63 (11) Uncoated: 65 (15)
Sex (%M) Cemented:25 HA: 12.5 Uncoated: 20
Diagnosis: Reumathoid arthritis (RA) ; Osteoarthritis (OA) Sequelae after septic arthritis (SA) Cemented: 15; 9; 0 HA: 17; 6; 1 Uncoated: 17; 3; 0
BMI mean (sd) Cemented: 26 (3.8) HA: 27 (4.9) Uncoated: : 24 (3.3)
Groups comparable at baseline?yes |
Tibial Hydroxyapatite (HA) coating Femoral component: not described
Posterior cruciate retaining TKA (interax; howmedica, Rutherford, NJ)
patellar component: ultra-high molecular weight polyethylene was used in all but one total knee arthroplasty. No patellar component was used in one knee because the remaining patellar bone was too thin.
|
Tibial Cemented or uncoated Femoral component: not described
Posterior cruciate retaining TKA (interax; howmedica, Rutherford, NJ)
patellar component: ultra-high molecular weight polyethylene was used in all but one total knee arthroplasty. No patellar component was used in one knee because the remaining patellar bone was too thin.
Cemented: Palacos bone cement (Schering,Kenilworth, NJ) was used after mechanical pulse-lavage of the cut bone surfaces.
|
Length of follow-up: mean 9.0. y; Followed for 11–16 years, or until death or revision of the tibial component.
Incomplete outcome data: Lost to follow up: Cemented: 1 HA: - Uncoated: - Reasons: moved out of region
Incomplete data: Cemented: 9 HA: 10 Uncoated:9 Reasons: Died
Cemented: 2 HA: 1 Uncoated: 4 Reasons: revised
|
Radiographic marker configuration of the RSA technique was used for measurement of the pose of a rigid body in situations where less than 3 markers could be detected in both images of an RSA radiograph.
Maximum Total point motion (MTPM) (migration of the point of the prosthesis that has moved the most) 1 year MTPM (mm/year) Cemented: 0.043 HA-coated: 0.057 Uncoated: 0.067 p-value: 0.003
partial radiolucent lines of >2mm (10 years postop) Cemented: - HA-coated: 2 Uncoated: 1
Revisions:
Clinical (last follow up) Knee score mean (95%CI) Cemented: 76 (68-84) HA: 6 (81-90) Uncoated: 81 (74-87) p-value: 0.86
knee function score mean(95%CI) Cemented: 29 (14-44) HA: 29 (15-43) Uncoated: 23 (8-38) p-value: 0.43 |
In conclusion: HA reduces migration of uncemented tibial components, which was most pronounced in the first postoperative years. The beneficial effect of HA endures beyond 10 years and there is no evidence for delamination of the HA layer. Since cemented components showed the lowers migration throughout the follow-up and have excellent survival in the registries, cement is a safe choice for fixation of the tibial component. |
|
Park, 2011 |
Type of study: RCT
Setting: joint replacement centre
Country: Korea
Source of funding: unknown |
Inclusion criteria: Patients who underwent sequential simultaneous bilateral TKR (jan 1997-feb 1988) Exclusion criteria:
N total at baseline: Intervention (non-cemented) : 52 patients, 52 knees Control (cemented): 52 patients, 52 knees
Important prognostic factors2:
age ± range: 58.4 (51-67)
Sex: (%M) 22%
Height (mean, range): 155,3 (140-170)
Groups comparable at baseline? Yes (same patient)
|
Tibial and femoral Uncemented NexGen posterior cruciate retaining total knee system
All patellae in both groups were resurfaced using a cemented polyethylene patellar component.
In the cementless fixation, the femoral and tibial components were inserted with a press-fit. |
Tibial and femoral Cement NexGen posterior cruciate retaining total knee system
All patellae in both groups were resurfaced using a cemented polyethylene patellar component.
In the cemented fixation, implants were cemented after pulsed lavage, drying and pressuration of cement. The dedicated cemented femoral component was not available due to inventory problems and the cementless femoral component was used and fixed using cement in the cemented group. |
Length of follow-up: mean: 13.6 years (13-34)
Loss-to-follow-up: Intervention: 2 patients I: 2 knees C: 2 knees Reasons: unknown Incomplete outcome data: None described
|
Outcome measures and effect size:
Active ROM of the knee in the suspine and weight-bearing position was determined using a standard (60cm) goniometer pre-operatively and at each review. Patients were asked to bend their knees as much as they could when lying supine and when bearing weight.
Satisfaction: VAS 0-10
Mean total knee score (points) (range) Knee Society C: 96.2 (82 to 100) I: 97.7 (90 to 100) P-value: 0.350
Mean function score (points) (range) Knee Society C: 85.8 (50 to 100) I: 88.1 (50 to 100) p-value: 0.627
Mean pain score (points) (range) Knee Society C: 45.2 (40- 50) I: 46.1 (40- 50) p-value: 0.812
Pain severity (n, %) None C: 39 (78) I: 38 (76) Mild C: 10 (20) I: 10 (20) Moderate C: 1 (2) I: 1 (2) Severe C: - 1 I: (2)
Walking distance (n, %) Cannot walk C: - I: - < 1 block C: - I: - 1 to 5 blocks C: 3 (6) I: 3 (6) 5 to 10 blocks C: 6 (12) I: 6 (12) Unlimited C: 41 (82) I: 41 (82)
Mean ROM (°) (range) Supine position C:124 (100-140) I: 128 (110-140) p-value: 0.435
Weight-bearing position C: 109 (90-130) I: 113 (100-130) p-value: 0.428
Stairs (n, %) Normal C: 16 (32) I: 16 (32) With support C: 34 (68) I: 34 (68)
Mean WOMAC‡ score (points) (range) C: 34.5 (4-59) I: 35.6 (5-51) p-value: 0.191
radiological results: Mean alignment (°)(range) Pre-operative C: 10.2 (5 to 17) I: 10.0 varus (7 to 15) p-value: 0.644
Post-operative C: 5.8 (3 to 7) I: 5.3 valgus (3 to 7) p-value: 0.150
Radiolucent line (tibial side) (n,%) Zone 1 (< 1 mm) C: 4 (8) I: 5 (10) p-value: -
Radiolucent line (femoral side) C: 2 (4) I: 3 (6) p-value: -
Patellar component angle (°)(SD) Pre-operative C: 11.9 (4.2) I: 11.4 (4.5) p-value: 0.674
Post-operative C: 3.8 (5.6) I: 3.5 (3.2) p-value: 0.964
Kaplan-meier survival: Rate of survival of femoral components 100% (95%CI 0.93-1.0) ) in both groups at 14 years with loosening or revision considered the end point for failure. Survival tibial component: C: 100% (CI 0.93-1.0) I: 98% (0.91-1.0) |
The dedicated cemented femoral component was not available due to inventory problems and the cementless femoral component was used and fixed using cement in the cemented group.
Low weight of patients, good pre-operative range of knee movement and relatively young age of this ethnic group of patients might limit general applicability to other groups of patients
Not clear how patients whether consecutive patients were included, and what exclusion criteria were used (if any) |
|
Demey, 2011 |
Type of study: RCT
Setting: Monocentre Country:France
Source of funding: no external funding |
Inclusion criteria: Planned TKA due to osteoarthritis or chondrocalcinosis age: 50- 90 years.
Exclusion criteria: TKA associated with tibial or femoral osteotomy and previous knee surgery, arthroscopy excepted.
N total at baseline: Intervention: HA-coated: 64 Control: cement 66
Important prognostic factors Age mean (range): I:72.5 (52-85) C: 72 (53-85)
Sex: I: 30.77% M C: 18.46% M
Diagnosis: Osteoarthritis; Chondrocalcinosis I : 64; 1 C: 62; 3
BMI mean (range) I: 28.4 (21-40) C: 29 (20-42)
Knee I: right: 36, left 29 C: right: 33, left 32
preoper- ative IKS scores and flexion: no significant differences
Groups comparable at baseline?yes |
Femoral Uncemented, HA coated Cemented tibial component
semi-constrained posterior stabilized TKA (HLS Noetos (Tornier, St-Ismier, France)) Patellar resurfacing arthroplasty. A cemented, all polyethylene patellar component was used in all cases.
Straight longitudinal midline skin incision and either a medial para-patellar approach (n = 52 for Cement Group and 53 for Hybrid Group) or lateral approach (n = 13 for Cement Group and 12 for Hybrid Group) was used (n.s.).
|
Femoral cemented fixation with hydroxipatite. Cemented tibial component
semi-constrained posterior stabilized TKA (HLS Noetos (Tornier, St-Ismier, France)) Patellar resurfacing arthroplasty. A cemented, all polyethylene patellar component was used in all cases.
A straight longitudinal midline skin incision and either a medial para-patellar approach (n = 52 for Cement Group and 53 for Hybrid Group) or lateral approach (n = 13 for Cement Group and 12 for Hybrid Group) was used (n.s.).
|
Length of follow-up: Mean: 32 months (sd 6) cement group, 33 months (sd 7) HA group.
Loss-to-follow-up: Intervention: 2 (personal reasons) Control: 1 (lost to follow up), 1 (personal reasons) , 1 (excluded due to septic loosening)
Incomplete outcome data: Intervention: 2 (deceased), Control: 2 (deceased),
|
Tourniquet time mean (sd) I: 67 min ± 14 C: 63 min ± 12 (n.s).
postoperative IKS score mean (sd) I: 175.3 (25) C: 175.3 (23) (n.s.)
Femoral Radiolucent lines C: 15 (24%) P<0.001
bone transparencies of femoral epiphysis I: n= 37 (62%) C: n = 13 (21%) P<0.001; appeared during the first year
Complications: I: valcular ischaemia secondary to popliteal thrombosis 21 day postoperatively (n=1), deep infection (n=1) C: ligamentous laxity (n=1), pain due to an intra-articular cement fragment (n=1) |
No clinical difference was observed between cemented and uncemented femoral fixation. However, radiological evaluation found significant differences in bone transparencies and radiolucent lines that may influence clinical results/ survivorship. A longer follow-up period is required to determine the best mode of fixation. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-02-2015
Beoordeeld op geldigheid : 31-08-2021
Uiterlijk in 2019 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging (NOV) of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Orthopaedische Vereniging is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van totale knievervanging. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij voor zover mogelijk de inbreng door patiënten is meegenomen (patiëntenperspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daartoe is een duidelijke indicatiestelling (tweede lijn) noodzakelijk. Doel van de richtlijn is met name ook het verminderen van postoperatieve pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met (indicatie voor) een totale knieprothese: orthopedisch chirurgen en Physician Assistents, assistenten in opleiding tot orthopedisch chirurg, anesthesiologen, fysiotherapeuten, Huisartsen. De richtlijn is tevens van belang voor de patiënt, ter informatie en ten behoeve van shared-decision making.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een totale knieprothese.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn en is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. M.C. de Waal Malefijt, NOV, orthopedisch chirurg in Radboudumc Nijmegen (voorzitter).
- Dr. R.D.A. Gaasbeek, NOV, orthopedisch chirurg in Meander Medisch Centrum in Amersfoort.
- Dr. S. Köeter, NOV, orthopedisch chirurg in Canisius Wilhelmina Ziekenhuis Nijmegen.
- Drs. L.N. Marting, NOV, orthopedisch chirurg in St. Antonius Ziekenhuis Nieuwegein.
- Drs. H. Verburg, NOV, orthopedisch chirurg in Reinier de Graaf Groep Delft.
- Dr. P.J. Hennis, NVA, anesthesioloog in Zuwehofpoort Ziekenhuis Woerden.
- Dr. W. Hullegie, KNGF, fysiotherapeut, lector, THIM Hogeschool voor Fysiotherapie Nieuwegein, FysioGym Twente, Enschede.
- Drs. G. van der Sluis, KNGF, fysiotherapeut in Nij Smellinghe Ziekenhuis Drachten.
- Dr. C.J. Kalisvaart, NVKG, klinisch geriater in Kennemer Gasthuis Haarlem.
- Drs. A. Kyriazopoulos, NVvR, radioloog in de St. Maartenskliniek Nijmegen.
Met ondersteuning van
- Dr. K.N.J. Burger, epidemioloog, adviseur Kennisinstituut van Medisch Specialisten.
- Mw. drs. M. Wessels, informatiespecialist Kennisinstituut van Medisch Specialisten.
- Mw. S.K. Josso, secretariaat, Kennisinstituut van Medisch Specialisten.
- Mw. N.F. Bullock, secretariaat, Kennisinstituut van Medisch Specialisten.
Met dank aan:
- Mw. drs. K.E.M. Harmelink, fysiotherapeut en fysiotherapiewetenschapper FysioGym Twente te Enschede en Fysiotherapiepraktijk Flex-s te Goor, promovendus aan Radboud Universiteit en HAN, Nijmegen.
- De Commissie Orthopedische Implantaten Classificatie (COIC) van de Nederlandse Orthopaedische Vereninging, in het bijzonder R. Brouwer en G. van Hellemondt.
- Auteurs van recente Cochrane reviews naar prothese-ontwerp, in het bijzonder W.C. Verra, W. Jacobs, R.J.K. Khan, en R.G.H.H. Nelissen.
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht hiervan vindt u hieronder:
Tabel 1 Belangenverklaring
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Hennis |
anesthesio-loog, namens de NVA |
geen, geen belangen-verstrengeling op enigerlei terrein |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Gaasbeek |
orthopedisch chirurg, namens NOV |
|
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Koëter |
orthopedisch chirurg, namens NOV |
0 aanstelling UMCN St Radboud ivm onderzoek |
n.v.t. |
n.v.t. |
bestuur Ned. Ver. Arthroscopie |
onderzoek multi centre Trufit kraakbeenplug Smith & Nephew |
n.v.t. |
n.v.t. |
|
Marting |
orthopedisch chirurg, namens NOV |
Bestuurslid Dutch Knee Society (werkgroep NOV) onbezoldigd |
Niets te melden |
Niets te melden |
Niets te melden |
Deelname aan internationale, multicentre studie NRG knieprothese gefinancierd door Stryker |
n.v.t. |
Tot recent consultancy overeenkomst Fa Stryker, inmiddels beëindigd |
|
De Waal Malefijt |
orthopedisch chirurg, namens NOV |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Kyriazo-poulos |
Radioloog, namens NVvR |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Verburg |
orthopedisch chirurg, namens NOV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
participeer in onderzoek naar klinische resultaten van totale knieprothese (Persona) samen met de firma Zimmer |
n.v.t. |
Neen |
|
Kalisvaart |
Klinisch geriater, namens NVKG |
geen |
geen |
Geen |
geen |
Geen |
Geen |
Geen |
|
Hullegie |
fysiotherapeut, namens KNGF |
lector musculo-skeletale revalidatie HAN |
Geen |
Geen |
n.v.t. |
n.v.t. |
n.v.t. |
Geen |
|
Van der Sluis |
fysiotherapeut, namens KNGF |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep. Het verslag (aanverwant ‘Verslag focusbijeenkomst’) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers van de focusgroep. Ook is er in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (aanverwant 'Zoekfilter Patiëntenperspectief’).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De werkgroep heeft tevens overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door het Nederlands Huisartsen Genootschap (NHG), zorgverzekeraars (VGZ, Achmea, CZ), het College voor Zorgverzekeringen (CVZ), de Inspectie voor de Gezondheidszorg (IGZ), vertegenwoordigers van producenten van knieprotheses (Biomet, Smith&Nephew) via een invitational conference. Een verslag hiervan staat online, maar is niet in het menu weergegeven.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effectenwerd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen in Medline (OVID) en in de database van Guideline International Network, en naar systematische reviews in de Cochrane Library. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie GRADE handbook).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004), waarbij de bewoording van de GRADE methode is gebruikt: hoog (EBRO, niveau 1), matig (EBRO, niveau 2), laag (EBRO, niveau 3), zeer laag (EBRO, niveau 4).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg, zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Randvoorwaarden’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (KiMS).
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken, of omdat er al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk (zoals de registratieplicht voor knieprothesen in de LROI).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek is te vinden in de aanverwant Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
|
Database |
Zoektermen |
Aantal hits |
|
Medline (OVID) 2000-okt. 2012 Engels
RCT’s vanaf 2011 tot nov. 2012 |
4 Knee Prosthesis/ or Arthroplasty, Replacement, Knee/ or (Knee* adj3 (arthroplas* or replace* or prosthes*)).ti,ab. or ("total knee" or TKA).ti,ab. (20208) 5 Knee/ or exp Knee Joint/ or knee*.ti. or (((Osteoarthri* or Arthrosis or Arthrit*) adj3 knee*) or gonarthrosis).ti,ab. (67972) 6 "prostheses and implants"/ or joint prosthesis/ or prosthes*.ti. or implant*.ti. or endoprosthes*.ti. (138175) 7 5 and 6 (3514) 8 4 or 7 (21486) 17 Cementation/ (4391) 18 exp Bone Cements/ (16554) 19 (cement* or uncement*).ti,ab. (35273) 20 17 or 18 or 19 (45447) 21 8 and 20 (2180) 22 limit 21 to (yr="2000 -Current" and (dutch or english or french or german)) (1171) 23 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or (systematic* adj review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (117788) 24 22 and 23 (20) – 17 uniek
Aanvullende search RCT’s 4 Knee Prosthesis/ or Arthroplasty, Replacement, Knee/ or (Knee* adj3 (arthroplas* or replace* or prosthes*)).ti,ab. or ("total knee" or TKA).ti,ab. (20526) 5 Knee/ or exp Knee Joint/ or knee*.ti. or (((Osteoarthri* or Arthrosis or Arthrit*) adj3 knee*) or gonarthrosis).ti,ab. (68880) 6 "prostheses and implants"/ or joint prosthesis/ or prosthes*.ti. or implant*.ti. or endoprosthes*.ti. (139343) 7 5 and 6 (3559) 8 4 or 7 (21819) 26 Cementation/ or exp Bone Cements/ or Durapatite/ or (cement* or uncement* or Hydroxyapatite or Durapatite or Ingrowth or hybrid or porous* or coat* or press-fit).ti,ab. (272883) 27 8 and 26 (2616) 28 zoekfilter RCT (Cochrane (1310) 58 limit 57 to (yr="2011 -Current" and (dutch or english or french or german)) (144) – 129 uniek Zoekresultaat kan ook studies bevatten die eerder met het filter voor systematische reviews zijn gevonden. Deze zijn niet geëxcludeerd. |
22 SR vanaf 2009
133 RCT’s vanaf 2011 |
|
Embase (Elsevier) |
knee prosthesis'/exp/mj OR 'knee endoprosthesis'/exp/mj OR 'knee arthroplasty'/exp OR (knee* NEAR/3 (arthroplas* OR replace* OR prosthes*)):ab,ti OR 'total knee':ab,ti OR tka:ab,ti OR ('knee'/exp/mj OR knee*:ti OR ((osteoarthri* OR arthrosis OR arthrit*) NEAR/3 knee*):ab,ti OR gonarthros*:ab,ti AND ('joint prosthesis'/exp/mj OR prosthes*:ti OR implant*:ti OR endoprosthes*:ti)) AND ('bone cement'/exp/mj OR 'cementation'/exp/mj OR cement*:ab,ti OR uncement*:ab,ti) AND ([dutch]/lim OR [english]/lim OR [french]/lim OR [german]/lim) AND [embase]/lim (951) AND ('meta analysis'/exp OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/exp) NOT (animal* NOT human*) – zoekfilter SR – (16) - 5 uniek
Aanvullende search RCT’s Embase ,'knee prosthesis'/exp/mj OR 'knee endoprosthesis'/exp/mj OR 'knee arthroplasty'/exp OR (knee* NEAR/3 (arthroplas* OR replace* OR prosthes*)):ab,ti OR 'total knee':ab,ti OR tka:ab,ti OR ('knee'/exp/mj OR knee*:ti OR ((osteoarthri* OR arthrosis OR arthrit*) NEAR/3 knee*):ab,ti OR gonarthros*:ab,ti AND ('joint prosthesis'/exp/mj OR prosthes*:ti OR implant*:ti OR endoprosthes*:ti)) AND ('bone cement'/exp/mj OR 'cementation'/exp/mj OR 'hydroxyapatite'/exp/mj OR cement*:ab,ti OR uncement*:ab,ti OR hydroxyapatite:ab,ti OR durapatite:ab,ti OR ingrowth:ab,ti OR hybrid:ab,ti OR porous$:ab,ti OR coat$:ab,ti OR 'press fit':ab,ti) AND ([dutch]/lim OR [english]/lim OR [french]/lim OR [german]/lim) Zoekfilter RCT (33), 4 uniek |
