Bloedleegte bij TKP
Uitgangsvraag
Wat is de waarde van bloedleegte bij plaatsing van een totale knieprothese?
Aanbeveling
Plaats een totale knieprothese bij voorkeur zonder bloedleegte.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de voor- en nadelen van het toepassen van bloedleegte gedurende de plaatsing van een totale knieprothese (TKP). De twee cruciale uitkomstmaten zijn complicaties en pijn. Het toepassen van bloedleegte bij plaatsing van een TKP lijkt tot meer complicaties te leiden dan wanneer geen bloedleegte wordt toegepast. Ook wanneer specifiek gekeken wordt naar diepe veneuze trombose en oppervlakkige wondinfecties, lijkt bloedleegte het aantal complicaties te doen toenemen. Er lijkt geen klinisch relevante toename in pijn te zijn bij gebruik van de bloedleegteband, vergeleken met geen bloedleegteband. De geïncludeerde studies kennen een variatie in perioperatieve pijnbestrijding die mogelijk van invloed is op de eventuele pijn na gebruik van de bloedleegteband. Door het uitblijven van klinisch relevante verschillen kon de belangrijke uitkomstmaat patiënttevredenheid geen richting geven aan de beslissing om wel of geen bloedleegte toe te passen. Het is door de zeer lage bewijskracht onduidelijk of quadricepsfunctie beïnvloed wordt door het toepassen van bloedleegte. Het effect van de bloedleegteband op de quadricepskracht op het moment van het starten van de mobilisatie op de dag van de operatie is onbekend. Verschillen in overleving van de prothese op de lange termijn en terugkeer naar werk/sport waren niet beschreven. De totale bewijskracht, de laagste gevonden bewijskracht voor de cruciale uitkomstmaten, is laag. Op basis van de complicaties beschreven in de literatuur is er een voorkeur voor het niet toepassen van bloedleegte bij plaatsing van een TKP. Over het effect van de duur van de bloedleegte is onvoldoende data beschikbaar. Hetzelfde geld voor het aantal mm Hg. Derhalve kunnen we hier geen harde uitspraken over doen.
Meerdere RSA studies hebben verder aangetoond dat er geen verschil is in het inzakken van de prothese in het bot bij het plaatsen van een prothese met of zonder bloedleegte (Ejaz, 2015; Ledin, 2012; Molt, 2013).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een zo hoog mogelijke patiënttevredenheid en langetermijnoverleving van de prothese zijn van groot belang bij het plaatsen van een knieprothese. Hierbij spelen vele factoren een rol. De voorkeur van de patiënt of zijn verzorgers voor de keuze van al dan niet gebruiken van bloedleegte staat hier los van. Wel zou overwogen kunnen worden om bij patiënten met een verhoogd risico op trombo-embolische events laagdrempelig geen bloedleegte te gebruiken.
Kosten (middelenbeslag)
Het al dan niet gebruiken van de bloedleegteband brengt geen extra kosten met zich mee. Uit de literatuur (Cai, 2019) weten we dat de operatie een aantal minuten langer duurt bij het niet gebruiken van de bloedleegteband. Dit is echter verwaarloosbaar kort en zal geen invloed hebben op de kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Het al dan niet toepassen van de bloedleegteband is zeer haalbaar. Bij het niet gebruiken van een bloedleegteband zal per operatie wel meer bloedverlies optreden en ook is beschreven dat het zicht op het operatiegebied verminderd wordt. Dit zal voor sommige behandelaars mogelijk een drempel zijn om geen bloedleegteband toe te passen. Het is derhalve voor iedereen mogelijk, zonder aanvullende interventies bloedleegte al dan niet te gebruiken.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In de literatuur komt vrij consistent het beeld naar voren dat het toepassen van bloedleegte mogelijk leidt tot meer complicaties, meer diep-veneuze trombose en meer wondinfecties. Er werd geen klinisch relevant effect op pijn gevonden. Tevens is er geen verschil in het inzakken van de prothese in het bot bij het al dan niet gebruiken van bloedleegte.
Onderbouwing
Achtergrond
Het gebruik van een bloedleegteband zorgt voor een minder bloederige operatie wat mogelijk kan leiden tot betere visualisatie peroperatief. Het is echter niet duidelijk of het gebruik van de bloedleegteband leidt tot meer complicaties en een toename van postoperatieve pijn.
Conclusies / Summary of Findings
|
Low GRADE |
In patients undergoing total knee arthroplasty, application of a tourniquet throughout the intervention may increase the incidence of complications compared to no tourniquet application.
Bronnen: (Goel, 2019; Jawhar, 2019; Liu, 2019) |
|
Low GRADE |
In patients undergoing total knee arthroplasty, application of a tourniquet throughout the intervention may increase the incidence of deep vein thrombosis compared to no tourniquet application.
Bronnen: (Goel, 2019; Jawhar, 2019; Liu, 2019) |
|
Low GRADE |
In patients undergoing total knee arthroplasty, application of a tourniquet throughout the intervention may increase the incidence of superficial wound infection compared to no tourniquet application.
Bronnen: (Goel, 2019; Jawhar, 2019; Liu, 2019) |
|
Low GRADE |
In patients undergoing total knee arthroplasty, application of a tourniquet throughout the intervention does not seem to increase postoperative pain to a clinically relevant degree compared to no tourniquet application.
Bronnen: (Alexandersson, 2019; Goel, 2019; Jawhar, 2019; McCarthy Deering, 2019) |
|
Very low GRADE |
It is unclear whether application of a tourniquet throughout the intervention affects quadriceps function, compared to no tourniquet application in patients undergoing total knee arthroplasty.
Bronnen: (Alexanderson, 2019) |
|
- GRADE |
The effect of tourniquet application on long-term prosthesis survival was not described in the included studies. |
|
Low GRADE |
In patients undergoing total knee arthroplasty, application of a tourniquet throughout the intervention does not seem to improve patient satisfaction to a clinically relevant degree compared to no tourniquet application.
Bronnen: (Goel, 2019; Jawhar, 2019) |
|
- GRADE |
The effect of tourniquet application on return to work or sports was not described in the included studies. |
Samenvatting literatuur
Description of studies
The systematic review (SR) and meta-analysis by Liu (2019) comprehensively compared tourniquet with no tourniquet, as well as different tourniquet durations during total knee arthroplasty (TKA). RCTs were included if the population consisted of patients experiencing TKA who were demographically alike, a tourniquet of any duration was applied, and the outcomes blood loss, functional recovery and complications were described. Studies were excluded if relevant outcomes were missing or the adapted JADAD score (with a maximum of 7) was less than 5 points. From the SR, 16 studies that compared whole-duration tourniquet with no tourniquet in 1002 patients were included in the present analysis. The risk of bias for the SR was considered low. The included studies had JADAD scores of a minimum of 5 and maximum of 7.
In addition, the SR and meta-analysis by McCarthy Deering (2019) was included, which had pain as the primary outcome. RCTs were included if a study population consisted of patients > 16 years of age were treated with a primary knee arthroplasty under two different tourniquet conditions and some assessment of postoperative pain was performed. In total eight studies (221 patients in the tourniquet group, 219 patients in the no-tourniquet group) were analyzed, three of which were included in the analysis. The risk of bias for the SR was considered low. The median JADAD-score of the included papers was 4 (with a maximum attainable score of 5). Follow-up was several days up to several weeks. Furthermore, 3 recent RCTs were included, 2 of which were updates of previous studies reported in the reviews.
In a randomized, patient- and assessor-blinded controlled trial, performed in Sweden between September 2012 and June 2015, Alexandersson (2019) included 81 patients aged 50 to 80 years with osteoarthritis of the knee who underwent TKA surgery with or without use of a tourniquet. Exclusion criteria were revision surgery, valgus deformity > 30°, one-stage bilateral procedures, rheumatoid arthritis, and BMI > 35. Knee and quadriceps function as well as pain were reported before and up to 3 months after surgery. The study had a high risk of bias due to baseline differences between the groups regarding the use of a walking aid.
Goel (2019) described pain, functional measures and complications in 200 patients undergoing TKA surgery with or without tourniquet application in a prospective, double-blinded RCT. This American trial includedpatients aged 18 to 80 years undergoing TKA surgery. Patients with Inflammatory arthritis, peripheral vascular disease, BMI > 40, comorbidities or revision surgery were excluded. The study had an unclear risk of bias, since selective outcome reporting and analysis according to the intention-to-treat principle could not be established.
Jawhar (2019) performed a monocentric, randomized, controlled trial in Germany that included a total of 99 patients scheduled to undergo primary TKA. Patients were aged 50 to 85, with a Kellgren and Lawrence score of III or IV and a BMI < 45. Patients with infectious, rheumatoid, malignant disease coronary heart disease or a history of DVT or pulmonary embolism were excluded from the study. Patient satisfaction, pain, function and quadriceps strength and patient wellbeing were reported. The study had an unclear risk of bias due to incomplete reporting of blinding procedures and the possibility of selective outcome reporting.
Results
Complications (crucial)
Incidence of complications was summarized in the SR by Liu (2019), and supplemented with two recent RCTs (Goel, 2019; Jawhar, 2019), which replaced an older study with the same population). In 16 RCTs with in total 1300 knees, risk of complication was 12% in the no tourniquet group versus 23% in the tourniquet group, resulting in a risk ratio (RR) of 0.56 in favor of operation without tourniquet, a clinically relevant difference with a 95% confidence interval (CI) from 0.41 to 0.76, as presented in figure 1.
Figure 1 Complications after TKA with versus without tourniquet
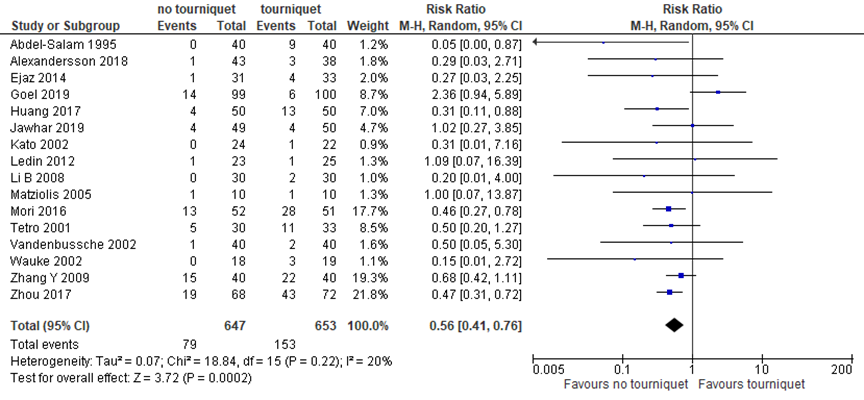
Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Source: Liu, 2019; Goel, 2019; Jawhar, 2019
In addition to all complications, deep venous thrombosis and superficial wound infection were described separately (figure 2). Risk of deep vein thrombosis was 2% without tourniquet versus 5% with a tourniquet, giving a risk ratio of 0.51 (95% CI 0.27 to 1.00) in favor of surgery without a tourniquet, in 10 studies with 982 cases. Risk of superficial wound infection was 2% without a tourniquet versus 4% with a tourniquet, resulting in a RR of 0.49 (95% CI 0.21 to 1.17) in favor of intervention without a tourniquet.
Figure 2 Deep venous thrombosis and wound infection after TKA with versus without tourniquet
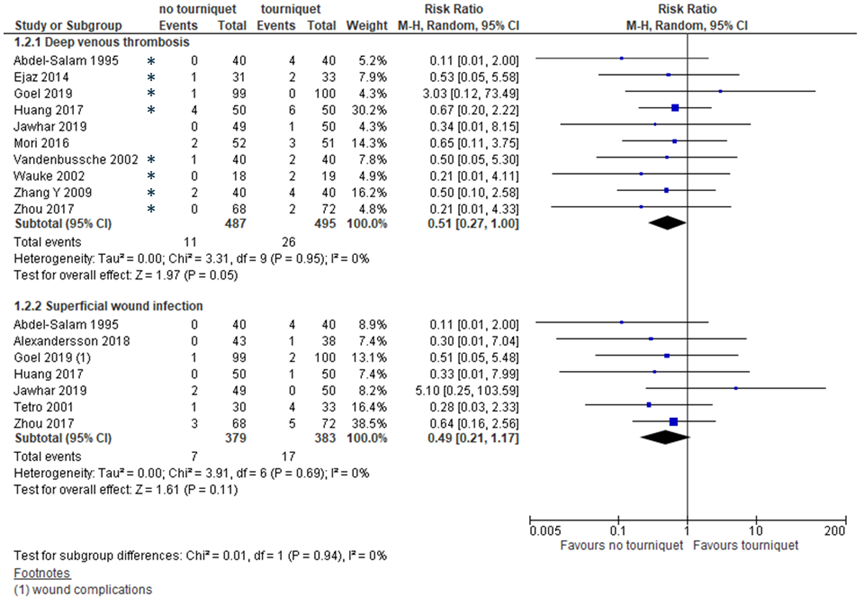
*: chemical thromboprophylaxis was applied; Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Sources: Goel, 2019; Jawhar, 2019; Liu, 2019
Level of evidence of the literature
The level of evidence regarding the outcome complications was based on RCTs and started high. For incidence of all complications, the level of evidence was downgraded by 2 levels to low because of the limited number of events and clinical heterogeneity (both imprecision). For incidence of deep venous thrombosis and incidence of superficial wound infection the level of evidence was downgraded by 2 levels to low because of the limited number of events and overlapping of the confidence interval with the limit of clinical decision making (both imprecision).
Postoperative pain (crucial)
In the review (McCarthy Deering, 2019), postoperative pain as reported by a VAS scale (0 to 10) was reported in 3 studies. In addition, Alexandersson (2019) and Goel (2019) reported postoperative pain on a VAS scale (0 to 100) at 72 hours and 4 to 6 weeks, respectively. Jawhar (2019) reported postoperative pain after 6 weeks using the WOMAC pain components. Taken together, the standardized mean difference (SMD) from 6 studies with 523 patients was -0.36 (95% CI -0.80 to 0.09) in favor of surgery without tourniquet application (figure 3). This difference was not clinically relevant.
Figure 3 Postoperative pain after TKA with versus without tourniquet
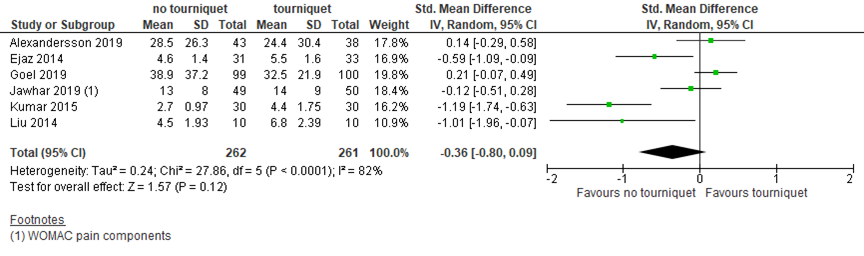
Pain as reported by VAS scale unless stated otherwise. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Sources: Alexandersson, 2019; Goel, 2019; Jawhar, 2019; McCarthy Deering, 2019
Level of evidence of the literature
The level of evidence regarding the outcome pain was based on RCTs and started high, but was downgraded by 2 levels to low because of conflicting results (inconsistency) and the limited number of included patients (imprecision).
Quadriceps function (important)
Alexandersson (2019) reported the straight leg raise (SLR) as a measure for quadriceps function. At 3 days, 13 out of 43 (30%) patients operated on without a tourniquet could perform the SLR, as opposed to 19 out of 38 (50%) patients operated on with a tourniquet. The RR of 0.76 (95% CI 0.45 to 1.30) in favor of tourniquet application was clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome function was based on RCTs and started high, but was downgraded by 3 levels to very low because of study limitations (risk of bias), the limited number of included patients and overlapping of the confidence interval with the limits of clinical decision making (both imprecision).
Prosthesis survival
The included studies did not report long-term follow-up. Jawhar (2019) reported revision after 6 months, which was not considered a relevant time point for determining survival.
Level of evidence of the literature
The level of evidence for prosthesis survival could not be determined due to lack of data on long-term survival.
Patient satisfaction
Two studies reported patient satisfaction. On a VAS scale from 0 to 100, Goel (2019) reported 89±17.4 in the tourniquet group, versus 86.5±20.1 in the no tourniquet group, 6 to 8 months after surgery. Jawhar (2019) measured patient satisfaction by Mancuso scale, in which 17 is the highest score and 85 the lowest. Patients operated with a tourniquet reported a score of 34±9 6 months after surgery, whereas patients operated without a tourniquet reported a score of 36±16. Taken together, this results in a SMD of 0.14 (95% CI -0.09 to 0.37), which is not clinically relevant.
Figure 4 Patient satisfaction 6 to 8 months after TKA with versus without tourniquet
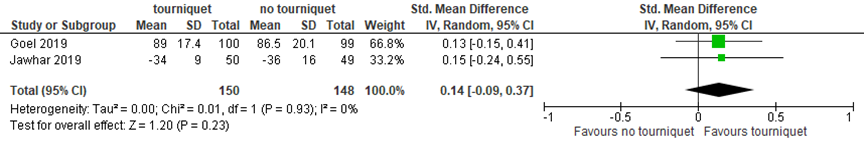
Patient satisfaction on VAS (0 to 100) scale (Goel, 2019) or Mancuso (17 to 85) scale (Jawhar, 2019). Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Sources: Goel, 2019; Jawhar, 2019
Level of evidence of the literature
The level of evidence regarding the outcome patiënt satisfaction was based on RCTs and started high, but was downgraded by 2 levels to low because of the limited number of included patients and overlapping of the confidence interval with the line of no effect (both imprecision).
Return to work/sports
Return to work and sports was not described in the included studies.
Level of evidence of the literature
The level of evidence for return to work and sports could not be determined due to lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of tourniquet application versus no tourniquet application during total knee arthroplasty?
P: patients undergoing total knee arthroplasty;
I: tourniquet;
C: no tourniquet;
O: postoperative pain, complications (thrombosis, wound healing), quadriceps function, prosthesis survival, patient satisfaction and return to work/sports.
Relevant outcomes
The guideline development group considered complications (thrombosis, wound healing) and postoperative pain as critical outcomes for decision making; and quadriceps function, prosthesis survival, patient satisfaction and return to work/sports as important outcomes for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. As minimal clinically (patient) important differences, the working group used the GRADE standard limit of 25% for risk ratios, 10% for VAS scales and 0.5 for standardized mean differences (pain and satisfaction).
Search and select (Methods)
The databases (Medline (via OVID) and Embase (via Embase.com)) were searched with relevant search terms up to February 10, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 251 hits. Based on title and abstract screening 24 studies were initially selected. After reading the full text, 19 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Two systematic reviews and three RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Alexandersson M, Wang EY, Eriksson S. A small difference in recovery between total knee arthroplasty with and without tourniquet use the first 3 months after surgery: a randomized controlled study. Knee Surg Sports Traumatol Arthrosc. 2019 Apr;27(4):1035-1042. doi: 10.1007/s00167-018-5196-8. Epub 2018 Oct 17. PubMed PMID: 30328495; PubMed Central PMCID: PMC6435610.
- Cai DF, Fan QH, Zhong HH, Peng S, Song H. The effects of tourniquet use on blood loss in primary total knee arthroplasty for patients with osteoarthritis: a meta-analysis. J Orthop Surg Res. 2019 Nov 8;14(1):348. doi: 10.1186/s13018-019-1422-4. Review. PubMed PMID: 31703706; PubMed Central PMCID: PMC6839231.
- Ejaz A, Laursen AC, Jakobsen T, Rasmussen S, Nielsen PT, Laursen MB. Absence of a Tourniquet Does Not Affect Fixation of Cemented TKA: A Randomized RSA Study of 70 Patients. J Arthroplasty. 2015;30(12):2128-2132. doi:10.1016/j.arth.2015.05.058
- Goel R, Rondon AJ, Sydnor K, Blevins K, O'Malley M, Purtill JJ, Austin MS. Tourniquet Use Does Not Affect Functional Outcomes or Pain After Total Knee Arthroplasty: A Prospective, Double-Blinded, Randomized Controlled Trial. J Bone Joint Surg Am. 2019 Oct 16;101(20):1821-1828. doi: 10.2106/JBJS.19.00146. PubMed PMID: 31626006.
- Jawhar A, Skeirek D, Stetzelberger V, Kollowa K, Obertacke U. No effect of tourniquet in primary total knee arthroplasty on muscle strength, functional outcome, patient satisfaction and health status: a randomized clinical trial. Knee Surg Sports Traumatol Arthrosc. 2019 Aug 1. doi: 10.1007/s00167-019-05646-5. (Epub ahead of print) PubMed PMID: 31372679.
- Liu Y, Si H, Zeng Y, Li M, Xie H, Shen B. More pain and slower functional recovery when a tourniquet is used during total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. 2019 Jul 8. doi: 10.1007/s00167-019-05617-w. (Epub ahead of print) Review. PubMed PMID: 31289914.
- Ledin H, Aspenberg P, Good L. Tourniquet use in total knee replacement does not improve fixation, but appears to reduce final range of motion. Acta Orthop. 2012;83(5):499-503. doi:10.3109/17453674.2012.727078
- McCarthy Deering E, Hu SY, Abdulkarim A. Does Tourniquet Use in TKA Increase Postoperative Pain? A Systematic Review and Meta-analysis. Clin Orthop Relat Res. 2019 Mar;477(3):547-558. doi: 10.1097/CORR.0000000000000572. PubMed PMID: 30461513; PubMed Central PMCID: PMC6382207.
- Molt M, Harsten A, Toksvig-Larsen S. The effect of tourniquet use on fixation quality in cemented total knee arthroplasty a prospective randomized clinical controlled RSA trial. Knee. 2014;21(2):396-401. doi:10.1016/j.knee.2013.10.008
- Pijls BG, Dekkers OM, Middeldorp S, Valstar ER, van der Heide HJ, Van der Linden-Van der Zwaag HM, Nelissen RG. AQUILA: assessment of quality in lower limb arthroplasty. An expert Delphi consensus for total knee and total hip arthroplasty. BMC Musculoskelet Disord. 2011 Jul 22;12:173. doi: 10.1186/1471-2474-12-173. PubMed PMID: 21781327; PubMed Central PMCID: PMC3155910.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effectiveness of tourniquet application during total knee arthroplasty?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Liu, 2019 |
SR and meta-analysis of RCTs
Literature search up to March, 2019
A: Abdel-Salam, 1995 B: Alexandersson, 2018 C: Ejaz, 2014 D: Huang, 2017 E: Jawhar, 2018 F: Kato, 2002 G: Ledin, 2012 H: Li B, 2008 I: Matziolis, 2005 J: Mori, 2016 K: Tetro, 2001 L: Vandenbussche, 2002 M: Wauke, 2002 N: Zhang Y, 2009 O: Zhou, 2017 P: Bao, 2011
Study design: RCT
Setting and Country: Department of Orthopedics, West China Hospital, Republic of China. Individual studies not specified.
Source of funding and conflicts of interest: This research did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors. The authors declare no conflict of interest. |
Inclusion criteria SR: Studies were included according to the PICOS criteria: (1) Population: patients experiencing TKA who were demographically alike; (2) Intervention and Control: four kinds of tourniquet use during TKA (NT, WDT, SDT, and MDT); (3) Outcomes: blood loss, functional recovery and complications; and (4) Study design: randomized controlled trial (RCT).
Exclusion criteria SR: Studies were excluded if: (1) relevant outcomes were missing or (2) the JADAD score was less than 5 points.
46 studies included, 17 of which relevant for the current analysis
N (cases), mean age, % female (no tourniquet/tourninquet) A: 40/40, 74/72y, 63/58% B: 43/38, 70/68y, 49/53% C: 31/33, 68/68y, 45/45% D: 50/50, 35/66y, 68/64% E: 43/43, 71/70y, 63/63% F: 24/22, 63/65y, 96/91% G: 23/25, 71/70y, 61/60% H: 30/30, 70/71y, 67/70% I: 10/10, 77/72y, 70/80% J: 52/51, 75/73y, 83/88% K: 30/33, 70/70y, 63/55% L: 40/40, 69/73y, 60/78% M: 18/19, 61/63, n.r. N: 40/40, 73/72, 68/63% O: 68/72, 69/67, 90/82% P: 26/26, 73/73y, 54/58%
Groups were comparable at baseline. |
Intervention:
Tourniquet (whole surgery duration)
|
Control:
No tourniquet
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? Withdrawal and dropout described in study (SR does not report the numbers): A: no B: yes C: yes D: yes E: yes F: no G: yes H: no I: no J: yes K: no L: no M: yes N: no O: yes P: no
|
Complications: all Incidence no tourniquet (NT) versus tourniquet (T), RR (95% confidence interval): A: NT 0/40; T 9/40 0.05 (0.00, 0.87) B: NT 1/43; T 3/38 0.29 (0.03, 2.71) C: NT 1/31; T 4/33 0.27 (0.03, 2.25) D: NT 4/50; T 13/50 0.31 (0.11, 0.88) E: NT 1/43; T 2/43 0.50 (0.05, 5.31) F: NT 0/24; T 1/22 0.31 (0.01, 7.16) G: NT 1/23; 1/25 1.09 (0.07, 16.39) H: NT 0/30; T 2/30 0.20 (0.01, 4.00) I: NT 1/10; T 1/10 1.00 (0.07, 13.87) J: NT 13/52; T 28/51 0.46 (0.27, 0.78) K: NT 5/30; T 11/33 0.50 (0.20, 1.27) L: NT 1/40; T 2/40 0.50 (0.05, 5.30) M: NT 0/18; T 3/19 0.15 (0.01, 2.72) N: NT 19/98; T 22/40 0.68 (0.42, 1.11) O: NT 19/68; T 43/72 0.47 (0.31, 0.72) Pooled effect (random effects model): 0.49 (0.38, 0.62) favoring no tourniquet Heterogeneity (I2): 0%
Complications: deep vein thrombosis Incidence no tourniquet (NT) versus tourniquet (T), RR (95% confidence interval): A: NT 0/40; T 4/40 0.11 (0.01, 2.00) C: NT 1/31; T 2/33 0.53 (0.05, 5.58) D: NT 4/50; T 6/50 0.67 (0.20, 2.22) E: NT 0/43; T 1/43 0.33 (0.01, 7.96) J: NT 2/52; T 3/51 0.65 (0.11, 3.75) L: NT 1/40; T 2/40 0.50 (0.05, 5.30) M: NT 0/18; T 2/19 0.21 (0.01, 4.11) N: NT 2/40; T 4/40 0.50 (0.10, 2.58) O: NT 0/68; T 2/72 0.21 (0.01, 4.33) Pooled effect (random effects model): 0.47 (0.24, 0.93) favoring no tourniquet Heterogeneity (I2): 0%
Complications: superficial wound infection Incidence no tourniquet (NT) versus tourniquet (T), RR (95% confidence interval) A: NT 0/40; T 4/40 0.11 (0.01, 2.00) B: NT 0/43; T 1/38 0.30 (0.01, 7.04) D: NT 0/50; T 1/50 0.33 (0.01, 7.99) E: NT 0/43; 1/43 0.33 (0.01, 7.96) K: NT 1/30; T 4/33 0.28 (0.03, 2.33) O: NT 3/68; T 5/72 0.64 (0.16, 2.56) Pooled effect (random effects model): 0.38 (0.15, 0.96) favoring no tourniquet Heterogeneity (I2): 0%
Range of motion* after 4 days In degrees, mean±SD (N) no tourniquet (NT) versus tourniquet (T): D: NT 107.9±7 (50); T 105.1±7 (50) G: NT 70.2±13.3 (23); T 61.7±17 (25) O: NT 99.8±13.7 (68); T 93.95±11.15 (72) P: NT 57.8±9.5 (26); T 50.3±8.9 (26) Pooled effect (random effects model) mean difference (95% confidence interval): 5.04 (2.48, 7.60) favoring tourniquet. Heterogeneity (I2): 27%
Range of motion* after 8 weeks In degrees, mean±SD (N) no tourniquet (NT) versus tourniquet (T): C: NT 100±7.2 (26); T 93±8.2 (33) G: NT 106.4±11.3 (23); T 94.9±15.1 (24) P: NT 98.3±7.2 (26); T 90.8±6.4 (26) Pooled effect (random effects model) mean difference (95% confidence interval): 7.71 (5.22, 10.21) favoring tourniquet. Heterogeneity (I2): 0%
*range of motion was not considered a relevant outcome by the working group. |
Authors’ conclusions: Not using a tourniquet or only using it during the cementation of implants was preferable based on the faster functional recovery, lower rate of DVTs and complications compared with using a tourniquet throughout the TKA procedure. |
|
McCarthy Deering, 2019 |
SR and meta-analysis of RCTs
Literature search up to February 2015
A: Ejaz, 2014 B: Kumar, 2015 C: Liu, 2014
Study design: RCT
Setting and Country: SR: Royal College of Surgeons, Dublin, Ireland. A: Denmark, single blinded, setting not reported B: India, blinding not reported, setting not reported C: Australia, single blinded, setting not reported
Source of funding and conflicts of interest: Funding not specified. Each author certifies that neither he or she, nor any member of his or her immediate family, has funding or commercial associations (consultancies, stock ownership, equity interest, patent/licensing arrangements, etc) that might pose a conflict of interest in connection with the submitted article. |
Inclusion criteria SR: (1) RCT; (2) study population of any nationality and language with mixed gender > 16 years of age treated with a primary knee arthroplasty under two different tourniquet controls (nontourniquet use being one possibility); and (3) some assessment of postoperative pain.
Exclusion criteria SR: Studies with nonrandomized trials, incomparable groups, or observational data.
14 studies included, 3 of which were relevant for this analysis
N at baseline A: 70 patients B: 60 patients C: 20 patients
Age, sex ratio (tourniquet/no tourniquet): A: not reported, 18:15/17:14 B: 58/58, 9:21/9:21 C: 67/70, 7:3/9:1
Groups were comparable at baseline. |
Intervention:
Tourniquet inflated for the entirety of the surgery |
Control:
Not given a tourniquet during the procedure |
End-point of follow-up: For the outcome pain: A: 3 days B: 6 weeks C: 5 days
For how many participants were no complete outcome data available? Accountability of patients was mentioned in the RCTs, but numbers were not reported in the SR |
Pain VAS mean±SD (N), no tourniquet (NT) versus tourniquet (T):
A: NT 4.6±1.4 (31); T 5.5±1.6 (33) B: NT 2.7±0.97 (30); T 4.4±1.75 (30) C: NT 4.5±193 (10); T 6.8±2.39 (10)
Pooled effect (random effects model) mean difference (95% confidence interval): -1.42 (-2.12, -0.72) favoring no tourniquet. Heterogeneity (I2): 39% |
Authors’ conclusions: We found no clinically important differences in pain or ROM between patients treated with and without tourniquets during TKA and no differences between the groups in terms of LOS. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
Research question: What is the effectiveness of tourniquet application during total knee arthroplasty?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Alexandersson, 2019
(ISRCTN 85166072) |
Type of study: RCT
Setting and country: single center, Uppsala, Sweden
Funding and conflicts of interest: This study was not externally funded.
All authors declare that they have no conflict of interest. |
Inclusion criteria: Patients aged 50–80 years undergoing TKA for the treatment of primary osteoarthritis
Exclusion criteria: Revision surgery, valgus deformity > 30°, one-stage bilateral procedures, rheumatoid arthritis, and BMI > 35.
N total at baseline: Intervention: 44 Control: 44
Important prognostic factors2: Mean age ± SD: I: 68.0 ± 7.4 C: 69.7 ± 6.4
Sex: I: 47% M C: 51% M
Diabetes I: 8% C: 7%
BMI (kg/m2) I: 28.6 ± 3.4 C: 27.9 ± 3.5
Use of a walking aid I: 3/38 (8%) C: 12/43 (28%) P=0.024 |
Tourniquet (T) during TKA:
Surgery with a tourniquet (34 in., single bladder, dual port, Zimmer) around the thigh that applied a pressure of 300 mmHg.
|
No tourniquet (NT)
|
Length of follow-up: 3 months
Loss-to-follow-up: Intervention: 1/38 (3%) Control: 3/43 (7%)
Discontinued intervention Intervention: 1/38 (3%) Control: 3/43 (7%)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Complications (thrombosis, wound healing) Reported in Alexandersson (2018)
Postoperative pain VAS 24h, mean (95% CI) T: 27.9 (17.3–38.4) NT: 44.4 (35.8–53.0) Mean difference 16.50 (3.28, 29.72), P=0.005
VAS 72h, mean (95% CI) T: 24.4 (14.4–34.2) n=38 NT: 28.5 (20.4–36.6) n=43 Mean difference 4.10 (-8.37, 16.57), not significant
Function Able to perform straight leg raise at day 3 T: 19/38 (50%) NT: 13/43 (30%) RR 0.60 (0.35 - 1.05), not significant
Able to perform straight leg raise at 3 months (not considered a relevant time point) T: 37/37 (100%) NT: 35/40 (88%) RR 0.88 (0.77 - 1.00), not significant
Range of motion (flexion)* Day 3 T: 69.9 (66.1–73.7) NT: 73.1 (69.9–76.2) Mean difference 3.2 (− 1.0 to 7.4)
3 months T: 107.1 (102.2-112.0) NT: 109.4 (105.3–113.5) Mean difference 2.3 (− 3.0 to 7.5), not significant
*ROM not considered relevant for function by working group.
Prosthesis survival Not reported
Patient satisfaction Not reported
Return to work/sports Not reported |
Follow-up study to Alexandersson, 2018
After randomization but before the group allocation was revealed, the surgeon could exclude a patient in the operating room for medical reasons, primarily impaired blood circulation (as determined by the surgeon). This criterion was predetermined but is missing from the original ISRCTN registration.
Authors’ conclusions: No clear benefit for either procedure was observed, as the more pain exhibited by the non-tourniquet group was only evident for a short period and the improved mobility in this group was not at a clinically relevant level.
Note: there were differences at baseline between the groups regarding the use of a walking aid: 12/43 (28%) in the non-tourniquet group versus 3/38 (8%) in the tourniquet group (P=0.024). |
|
Goel, 2019 |
Type of study: RCT
Setting and country: Single center study at Philadelphia, USA
Funding and conflicts of interest: The authors indicated that no external funding was received for any aspect of this work. The authors declare no conflict of interest. |
Inclusion criteria: All primary total knee arthroplasties performed by surgeons included in this study.
Exclusion criteria: Age < 18 or >80; Revision surgery; BMI > 40; Vascular calcifications or a diagnosis of Peripheral vascular disease; baseline lower extremity strength less than 5/5. Additional criteria in supplemental data.
N total at baseline: Intervention: 100 Control: 100
Important prognostic factors2: Mean age ± SD: I: 66.0 ± 7.0 C: 65.5 ± 7.8
Sex: I: 50 % M C: 48% M
BMI (kg/m2) I: 30.9 ± 4.6 C: 31.3 ± 4.5 |
Tourniquet (T):
The tourniquet was inflated at the start of the procedure and deflated after application of sterile dressings. Either the DePuy Synthes P.F.C. SIGMA or the Zimmer Biomet Persona implant system was used. The tourniquet system used was the Stryker Color Cuff Dual Port inflated to either 300 or 225mmHg depending on surgeon preference.
|
No tourniquet (NT) during TKA
|
Length of follow-up: 6 weeks and 8 months
Loss-to-follow-up: 6 weeks T: 7/100 (7%) NT: 3/99 (3%)
8 months T: 16/100 (16%) NT: 17/99 (17%)
Incomplete outcome data: Not reported
|
Complications (thrombosis, wound healing) Thigh pain, burning, or numbness NT: 17/99 T: 13/100
DVT NT: 1/99 (1%) T: 0/100 (0%)
Wound complications NT: 1/99 (1%) T: 2/100 (2%)
Other NT: 12/99 (12%) T: 4/100 (4%) Not significant
Postoperative pain (VAS) 4-6 weeks, mean ± SD NT: 38.9 ± 37.2 T: 32.5 ± 21.9 Not significant
6-8 months, mean ± SD NT: 18.5 ± 2.35 T: 16.6 ± 19.6 Not significant
Function ROM (flexion)* 4-6 weeks, mean ± SD NT: 101.8 ± 11.5 T: 102.5 ± 14.8 Not significant
6-8 months, mean ± SD NT: 111.2 ± 10.7 T: 111.5 ± 10.2 Not significant
*ROM not considered relevant for function by working group.
Prosthesis survival Not reported
Patient satisfaction (VAS) 4-6 weeks, mean ± SD NT: 83.5 ± 19.2 T: 84.3 ± 19.2 Not significant
6-8 months, mean ± SD NT: 86.5 ± 20.1 T: 89.0 ± 17.4 Not significant
Return to work/sports Not reported |
Authors’ conclusions: Tourniquet use during TKA significantly decreases blood loss and does not adversely affect early postoperative Outcomes. |
|
Jawhar, 2019
(NCT 02475603) |
Type of study: RCT
Setting and country: Single center, Heidelberg, Germany
Funding and conflicts of interest: Funding source was not reported. The authors declare that there were no conflicts of interest. |
Inclusion criteria: Age 50-85 years; Osteoarthritis Kellgren and Lawrence score III or IV; Physical status ASA score I, II, III; Written consent; Implant design (PFC sigma, DePuy); Total knee arthroplasty.
Exclusion criteria: BMI > 45 kg/m2 Rheumatoid disease; Infectious disease; Coronary heart disease; Neurological dysfunction; History of DVT or pulmonary embolism.
N total at baseline: Intervention: 50 Control: 49
Important prognostic factors2: Mean age ± SD: I: 69.3 ± 7.4 C: 68.3 ± 7.8
Sex: I: 34 % M C: 38% M
BMI (kg/m2) I: 31.9 ± 6 C: 31.4 ± 5.5 |
Tourniqet (T):
After introduction of the anaesthesia a pneumatic tourniquet (balbina™, Ulrich medical, Ulm, Germany) was placed on the proximal thigh and inflated only in the tourniquet group to 360 mmHg, immediately prior to skin incision. The tourniquet was released on completion of wound closure and after application of an elastic–compressive bandage.
|
No tourniquet (NT)
|
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 5/50 (10%) Control: 2/49 (4%) Due to patients personal decision
Incomplete outcome data: Not reported
|
Complications (thrombosis, wound healing) T: 4/50 (8%) NT: 4/49 (8%)
DVT T: 1/50 NT: 0/49
Delayed wound healing T: 0/50 NT: 2/49
Postoperative pain (6 weeks) WOMAC pain score, 0 (best)–36 (worst) T: 14 ± 9 NT: 13 ± 8
Quadriceps function Reported quadriceps outcomes (e.g. peak force) not relevant for patients.
Prosthesis survival* Revisions (underpowered) T: 3/50 (1 due to surgical site infection, 2 due to haematoma) NT: 2/49 (1 due to surgical site infection, 2 due to delayed wound healing)
*follow-up too short to determine survival.
Patient satisfaction Mancuso score (total satisfaction value ranges from 17 (highest) to 85 (lowest)) At 6 months T: 34 ± 9 NT: 36 ± 16
Return to work/sports Not reported |
Authors’ conclusions: The application of the tourniquet did not affect the isokinetic muscle strength, the functional outcome, the patient satisfaction and the health status following primary TKA. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Liu, 2019 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
No |
Unclear |
|
McCarthy Deering, 2019 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the effectiveness of tourniquet application during total knee arthroplasty?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Alexandersson, 2019 |
An independent statistician used a computerized random number generator in R to create a random number table for group allocation prior to the study’s start. |
Unlikely.
Group allocation was provided immediately prior to surgery to surgeon and operating team. |
Unlikely.
The participants were not informed of their group allocation and were not aware of our hypothesis. To help preserve blinding, the participants listened to music through headphones during surgery, and a curtain was used to prevent the participants from receiving visual cues. |
Unlikely.
Tourniquet use was not noted in the participants’ medical records |
Unlikely.
By self-report, it was determined that the blinding of the physiotherapists who collected the data was preserved for all but 2 patients. |
Unlikely |
Unlikely |
Unlikely |
|
Goel, 2019 |
A random number generator implemented by the research staff determined group allocation, independent of surgeon. |
Unlikely.
The envelope with the cohort assignment was opened by a member of the research staff just prior to the incision. |
Unlikely.
All members of the perioperative team were instructed to not reveal the group assignment to the patient following the surgery |
Unlikely.
Group assignment was blinded to the floor staff, physical therapy staff, and any of the other physician extenders involved in patient care. |
Unlikely.
Group assignment was also blinded to the research staff performing the assessments. |
Unclear |
Unlikely |
Unclear |
|
Jawhar, 2019 |
The patients were randomly by a management nurse using a computer generated list |
Unlikely |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alcelik, 2012 |
SR, overlap with more recent SRs |
|
Alexandersson, 2018 |
RCT already included in SR |
|
Jawhar, 2018 |
RCT already included in SR |
|
Jawhar, 2019 |
Population overlap with Jawhar (2018) already described in SRs |
|
Dennis, 2015 |
Tourniquet was not used for the whole duration |
|
Dong, 2019 |
Control group not in accordance with PICO |
|
Jiang, 2015 |
SR, overlap with more recent SRs |
|
Li, 2013 |
SR, overlap with more recent SRs |
|
Liu, 2017 |
RCT already included in SR |
|
Nicolaiciuc, 2019 |
Retrospective study |
|
Papalia, 2014 |
No meta-analysis of the data |
|
Ries, 2019 |
Commentary, no data |
|
Smith, 2010 |
SR, overlap with more recent SRs |
|
Sukur, 2016 |
Tourniquet was not used for the whole duration |
|
Tarwala, 2019 |
No data, opinion |
|
Tai, 2010 |
SR, overlap with more recent SRs |
|
Yi, 2014 |
SR, overlap with more recent SRs |
|
Zhang, 2014 |
SR, overlap with more recent SRs |
|
Zhou, 2017 |
RCT already included in SR |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-09-2021
Beoordeeld op geldigheid : 31-08-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van primaire totale knievervanging. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep, waarbij de inbreng door patiënten is meegenomen (patiëntenperspectief). Het doel is een hogere kwaliteit en meer uniformiteit in behandelingsstrategie, en het verminderen van praktijkvariatie. Daartoe is een duidelijke indicatiestelling (tweede lijn) noodzakelijk. Doel van de richtlijn is met name ook het verminderen van postoperatieve pijn en verbeteren van de gewrichtsfunctie door optimalisatie van de zorg en het creëren van reële verwachtingen van de patiënt. Het identificeren van kennislacunes zal richting kunnen geven aan nieuw wetenschappelijk onderzoek en nieuwe ontwikkelingen. Tot slot is naar aanleiding van de noodzaak tot beheersing van de verdere groei van kosten in de gezondheidzorg aandacht besteed aan kosten en kosteneffectiviteit.
Doelgroep
Deze richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met (indicatie voor) een TKP. De richtlijn is tevens van belang voor de patiënt, ter informatie en ten behoeve van shared-decision making.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg rondom de totale knieprothese (TKP).
Werkgroep
- Drs. H. (Hennie) Verburg, orthopedisch chirurg in Reinier Haga Orthopedisch Centrum (voorzitter), NOV
- Dr. ing. S.A.W. (Sebastiaan) van de Groes, orthopedisch chirurg in Radboudumc, NOV
- Drs. D. (Daniël) Hoornenborg, orthopedisch chirurg bij XpertOrthopedie, NOV
- Dr. D.A. (Derk) van Kampen, orthopedisch chirurg in Dijklander Ziekenhuis, NOV
- Dr. G. (Geert) van der Sluis, fysiotherapeut / programmaleider onderzoek en innovatie bij ziekenhuis Nij Smellinghe in Drachten, KNGF
- N. (Nique) Lopuhaä, beleidsmedewerker Patiëntbelangen, ReumaNederland
- mr. J.M. (Jacqueline) Otker, patiëntpartner Nationale Vereniging ReumaZorg Nederland.
Met ondersteuning van
- Dr. M.S. (Matthijs) Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. (Stefanie) Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Verburg (voorzitter) |
Orthopedisch Chirurg, Renier HAGA Groep |
Voorzitter bestuur Werkgroep Knie van de NOV |
Geen |
Geen actie |
|
Hoornenborg |
Orthopedisch chirurg XpertOrthopedie |
Ik geef 1 keer per jaar een AIOS cursus knie voor Arthrex (dat gaat over kruisband-operaties, ik heb met Arthrex geen relatie voor knieprotheses). Hiervoor word ik betaald volgens de richtlijnen. |
geen |
Geen actie |
|
Lopuhaä |
Beleidsmedewerker Patiëntenbelangen ReumaNederland |
geen |
geen |
Geen actie |
|
Otker |
Ervaringsdeskundige Longfonds, Nationale Vereniging ReumaZorg Nederland en Patientenfederatie Nederland (allen onbetaald); Cliëntenraad Ciro Horn (revalidatie centra chronische longziekten) |
Geen |
Geen |
Geen actie |
|
Van de Groes |
Orthopedisch chirurg in Radboudumc |
Lid commissie wetenschap en innovatie NOV (onbetaald). Lid accreditatie commissie NOV (onbetaald), Lid raad wetenschap en innovatie FMS (onbetaald), Maatschapslid universitair orthopedisch expertise centrum Nijmegen (betaald). |
geen |
Geen actie |
|
Van der Sluis |
Programmaleider onderzoek en innovatie bij ziekenhuis Nij Smellinghe |
beroepsinhoudelijk lid regionaal tuchtcollege te Zwolle (vacatievergoeding) |
Geen |
Geen actie |
|
Van Kampen |
Orthopedisch chirurg, Dijklander ziekenhuis |
Consultant voor Exactech: +/- 2 keer per jaar geef ik een cursus over deze schouder prothese. (equinoxe). Hiervoor word ik betaald volgens de richtlijnen. |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties uit te nodigen voor de Invitational conference. Het verslag hiervan (zie die bijlagen) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen. Daarnaast werd het patiëntenperspectief vertegenwoordigd door afvaardiging van ReumaNederland en Nationale Vereniging ReumaZorg Nederland in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de relevante patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een TKP. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NOV, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
