Medicatie bij chronische tinnitus
Uitgangsvraag
Welke medicatie is geïndiceerd bij patiënten met chronische tinnitus?
Deelvragen
- Wat is de effectiviteit van Gingko biloba bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van Lidocaine (Xylocaine en Tocainide) bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van steroïden (systemisch en intratympanaal) bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine) bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van antidepressiva bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van voedingssupplementen (omega 3, zink) bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van anti- oxidanten bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van NMDA-R bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van antagonist nortryptyline bij patiënten met chronische tinnitus?
Aanbeveling
Schrijf geen medicamenten voor tegen chronische tinnitus. Comorbiditeit dient, eventueel medicamenteus, behandeld te worden.
Overwegingen
De werkgroep wil door deze uitgebreide literatuursearch ondubbelzinnig de effectiviteit van medicamenten bij chronische tinnitus aantonen. Dit ten einde een goed en duidelijk antwoord te kunnen geven op de veelgestelde vragen hierover door patiënten die zoekende zijn naar een, liefst ad hoc, oplossing voor hun klacht.
Er is geen specifiek medicijn bewezen effectief tegen chronische tinnitus beschikbaar. Wel kunnen medicijnen tegen specifieke comorbiditeit behandeld worden met medicamenten, zoals bijvoorbeeld antidepressiva bij depressiviteit.
Onderbouwing
Achtergrond
In de huidige KNO-praktijk is veel onduidelijk over de medicamenteuze therapie van chronische tinnitus. In het buitenland, als ook in het ‘alternatieve’ circuit worden diverse medicamenteuze therapieën ingezet. Het is onduidelijk wat de effectiviteit van medicamenteuze behandeling bij patiënten met chronische tinnitus is.
Om antwoord te geven op deze vraag hebben we in eerste instantie gebruik gemaakt van de Duitse richtlijn Chronische Tinnitus (AWMF, 2015). Bij nader inzien heeft de werkgroep toch besloten een eigen uitgebreide literatuursearch hieraan te wijten om meer duidelijkheid te verschaffen over de effectiviteit van medicamenteuze therapieën van patiënten met chronische tinnitus.
Conclusies / Summary of Findings
1. Antidepressiva
|
Laag GRADE |
Ernst van de tinnitus
Er lijkt geen effect van behandeling met antidepressiva in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Baldo, 2012 |
|
Laag GRADE |
Kwaliteit van leven
Er lijkt geen effect van behandeling met antidepressiva in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Baldo, 2012 |
|
- GRADE |
Bijwerkingen
Er zijn geen vergelijkende studies gevonden die de bijwerkingen van antidepressiva systematisch hebben onderzocht bij patiënten met tinnitus. |
2. Gingko biloba
|
Zeer laag GRADE |
Ernst van de tinnitus
Er is geen effect van behandeling met gingko biloba in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Hilton, 2013 |
|
- GRADE |
Kwaliteit van leven
Er zijn geen vergelijkende studies gevonden die het effect van behandeling met gingko biloba hebben onderzocht bij patiënten met tinnitus. |
|
- GRADE |
Bijwerkingen
Er zijn geen vergelijkende studies gevonden die de bijwerkingen van gingko biloba systematisch hebben onderzocht bij patiënten met tinnitus. |
3. Steroïden (systemisch en intratympanaal)
|
Laag GRADE |
Ernst van de tinnitus
Er is geen effect van behandeling met steroïden in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Lavigne, 2015 |
|
- GRADE |
Kwaliteit van leven
Er zijn geen vergelijkende studies gevonden die het effect van steroïden op de kwaliteit van leven beschrijven bij patiënten met tinnitus. |
|
- GRADE |
Bijwerkingen
Er zijn geen vergelijkende studies gevonden die de bijwerkingen beschrijven van steroïden bij patiënten met tinnitus. |
4. Glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine)
|
Laag GRADE |
Ernst van de tinnitus
Er is geen effect van behandeling met glutamaat antagonisten in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Hoekstra, 2011; Ciodaro, 2015; Gerami, 2012 |
|
Laag GRADE |
Kwaliteit van leven
Er is geen effect van behandeling met glutamaat antagonisten in vergelijking met de controlegroep (placebo) op de kwaliteit van leven van patiënten met tinnitus.
Bronnen: Hoekstra, 2011 |
|
- GRADE |
Bijwerkingen
Er zijn geen vergelijkende studies gevonden die de bijwerkingen beschrijven van glutamaat antagonisten bij patiënten met tinnitus. |
5. Voedingssupplementen (omega 3, zink)
|
Zeer laag GRADE |
Ernst van de tinnitus
Er is geen effect van behandeling met zink in vergelijking met de controlegroep (placebo) op de ernst van de tinnitus.
Bronnen: Arda, 2002; Coelho, 2013 |
|
- GRADE |
Kwaliteit van leven
Er zijn geen vergelijkende studies gevonden die de kwaliteit van leven beschrijven van zink bij patiënten met chronische tinnitus. |
|
- GRADE |
Bijwerkingen
Er zijn geen vergelijkende studies gevonden die de bijwerkingen van zink systematisch hebben onderzocht bij patiënten met chronische tinnitus. |
Samenvatting literatuur
1. Antidepressiva
Beschrijving studies
Er werd één systematische review geïncludeerd waarin het effect van antidepressiva is onderzocht (Baldo, 2012). In deze review worden zes RCT’s beschreven waarvan er één het effect van paroxetine beschrijft (Robinson, 2005), vier beschrijven het effect van tricyclische antidepressiva (Sullivan, 1993; Mihail, 1988; Podoshin, 1995; Bayar, 2001) en één beschrijft het effect van trazodone op tinnitus (Dib, 2007).
Voor de behandeling van tinnitus met antidepressiva worden met name tricyclische antidepressiva gebruikt. Recent worden ook selectieve serotonine heropname inhibitors (SSRIs) voorgeschreven. Heel sporadisch worden andere antidepressiva gebruikt zoals trazadone (Baldo, 2012).
In de studie van Robinson (2005) kregen 120 volwassen patiënten 10 mg paroxetine per dag gedurende 100 dagen en werd dit vergeleken met placebo. In de studie van Sullivan (1993) ontvingen 117 patiënten nortriptyline of placebo gedurende 6 weken. In de studie van Mihail (1988) kregen 26 patiënten per dag 150 mg trimipramine of placebo. De behandeling duurde 6 weken, gevolgd door 4 weken rustperiode en nogmaals 6 weken behandeling. In de studie van Podoshin (1995) kregen 83 patiënten amitryptyline (10 mg 3 keer per dag) en 40 patiënten kregen placebo. In de studie van Bayar (2001) kregen 20 patiënten 50mg- 100 mg amitryptiline per dag gedurende 6 weken.
Resultaten
Ernst van de tinnitus
Ernst van tinnitus is in alle zes de geïncludeerde studies gemeten. De studies verschilden in de manier waarop dit werd gemeten: aan de hand van de THQ, aan de hand van losse vragen zoals: ‘has your tinnitus improved’, het aantal Hz, dB, vermindering van subjectieve tinnitus etc. Deze uitkomstmaten in het artikel van Baldo (2012) worden geschaard onder de uitkomstcategorie ‘tinnitus disability’. De term ‘tinnitus disability’ lijkt op het eerste oog te gaan over kwaliteit van leven, maar bij een inspectie van de gebruikte vragen(lijsten) past dit inhoudelijk beter onder de uitkomstmaat ‘ernst van de tinnitus’.
In geen van de studies werd een significant effect gevonden van de behandeling met antidepressiva op de ernst van de tinnitus. Het artikel van Baldo (2012) rapporteert niet voor alle geïncludeerde studies de exacte getallen. De uitkomsten van de studie van Dib (2007) werden in de review van Baldo als volgt weergegeven:
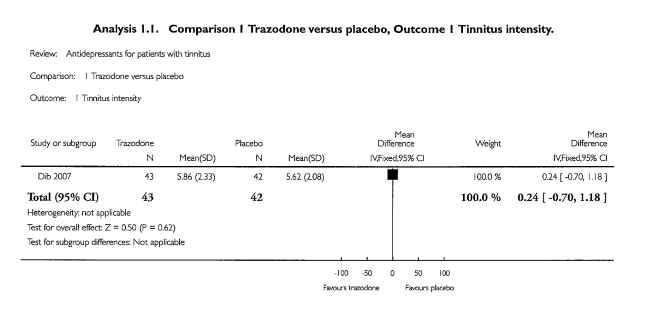
Kwaliteit van leven
Kwaliteit van leven was alleen een uitkomstmaat in de studie van Dib (2007) waarin het effect van trazodone is onderzocht. Kwaliteit van leven is in deze studie onderzocht aan de hand van vragen over slaap en irritatie. Uit de resultaten blijkt dat er geen significant verschil was in gerapporteerde kwaliteit van leven tussen de trazodone groep en de placebo groep. Het niveau van discomfort daalt in de placebo groep meer dan in de trazodone groep: het gemiddelde in de trazodone groep zakte van 6.56 naar 5.91 en in de placebo groep van 6.02 naar 5.10.
Bijwerkingen
De uitkomstmaat ‘bijwerkingen’ was geen onderzochte uitkomstmaat. De studie van Dib (2007) beschrijft wel gerapporteerde bijwerkingen en geeft aan dat bijwerkingen mild waren. De meest voorkomende bijwerking was vermoeidheid. 16,3% van de trazodonegroep rapporteerden bijwerkingen en dit was 7,1% in de placebogroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten ernst van de tinnitus en kwaliteit van leven is met twee niveaus verlaagd gezien het gering aantal patiënten (imprecisie) en vanwege extrapoleerbaarheid (bias ten gevolge van indirectheid: studiepopulaties en medicatie verschillen per studie). Bijwerkingen is niet systematisch onderzocht als uitkomstmaat en daarom is het niet mogelijk om bijwerkingen van antidepressiva te graderen.
2. Gingko biloba
Beschrijving studies
Er werd één review geselecteerd (Hilton, 2013) waarin het effect van Gingko Biloba is onderzocht en één RCT (Morgenstern, 2002). In de review van Hilton (2013) worden vier RCT’s beschreven die de effecten van een behandeling met Gingko biloba bij patiënten met tinnitus onderzochten: (1) Drew, 2001; (2) Morgenstern, 1997; (3) Napryeyenko, 2009; (4) Rejali, 2004.
Tinnitus vraagt vaak om een langdurige behandeling, en een behandeling die goed getolereerd wordt door patiënten is daarom van belang. Phytopharmalogische medicatie die gebaseerd is op extracten die geïsoleerd zijn uit de bladeren van de Gingko biloba plant worden in dit verband al jarenlang met succes gebruikt. Er bestaan weinig RCT’s die de effecten van Gingko biloba extracten in patiënten met Tinnitus onderzoeken (Morgenstern, 2002).
In de review van Hilton (2013) zijn vier RCT’s beschreven(1) Drew, 2001; (2) Morgenstern, 1997; (3) Napryeyenko, 2009; (4) Rejali, 2004. De review was een update van een review die oorspronkelijk in 2004 is geschreven. In 2007 en 2009 heeft er een update van de review plaatsgevonden. In totaal zijn er 1543 patiënten onderzocht. In de RCT van Drew (2001) kregen patiënten 12 weken dagelijks 150 mg LI1370 en werd dit vergeleken met een placebo. In de RCT van Morgenstern (1997) kregen patiënten 12 weken dagelijks 120mg EGb761 en werd dit vergeleken met een placebo. In de RTC van Napryeyenko (2009) kregen patiënten 22 weken dagelijks 240 mg EGb761 of placebo. De patiënten in deze studie waren patiënten met dementie. In de RCT van Rejali (2004) kregen patiënten drie maanden lang 120mg Gingko biloba of placebo.
De studie van Morgenstern (2002) was een double blind, randomized, placebo-controlled studie naar de effecten van Gingko Biloba special extract EGb 761. In totaal zijn er 60 patiënten onderzocht, de follow up was 12 weken. De gemiddelde leeftijd in de interventiegroep was 45 jaar en de gemiddelde leeftijd in de controle groep was 47 jaar. In de interventiegroep was 61.3% man en in de controle groep 51.7%.
Resultaten
Ernst van de tinnitus
De ernst van de tinnitus is in de review van Hilton (2013) gemeten aan de hand van verschillende uitkomstmaten. Een verbetering van zelf gerapporteerde tinnitus was gevonden in 13,6% van de gingko biloba groep en 12.4% in te interventiegroep (niet significant, p waarden niet gegeven) (Drew, 2001). In Morgenstern (1997) was de primaire uitkomstmaat Tinnitus loudness gemeten in dB. De Ginko Biloba groep liet een kleine, niet significante, verbetering zien van 42.3dB (36.6 tot 48.1) naar 39.0dB (31.9 tot 51.2). In Rejali (2004) is gekeken naar scores op de THI en was het verschil -4.7 in de gingko biloba groep en -2.2 in de controlegroep (p=0.51). In de RCT van Napryeyenko (2009) werd gekeken naar veranderingen in ernst van de Tinnitus. In de interventiegroep nam dit af met -0.7±1.4 intervention en in de controle groep met 0.0±0.8 (p<0.01). Het ging in deze studie om een specifieke patiëntengroep namelijk mensen met dementie
In de RCT van Morgenstern (2002) werd ernst van de tinnitus gemeten aan de hand van verschil in tinnitus volume (dB). Na 12 weken was dit in de gingko biloba groep afgenomen met -3.5 en in de controlegroep met -1.9 (p=0.039).
Kwaliteit van leven
Kwaliteit van leven was een onderzochte uitkomstmaat in de review van Von Boeticher (2012). Deze review is geëxcludeerd vanwege een onduidelijke search, de resultaten zoals beschreven in de tekst en in de tabellen komen niet overeen, er is geen duidelijke beschrijving van uitkomstmaten en beperkte studie informatie. In de overige geïncludeerde studies was kwaliteit van leven geen onderzochte uitkomstmaat.
Bijwerkingen
Bijwerkingen van gingko biloba zijn beschreven in twee RCTs: Rejali (2004) en Morgenstern (2002). In de studie van Rejali (2004) zijn 66 patiënten meegenomen. De proportie patiënten met diarree in de 12 weken behandeling was 3% in de interventiegroep en 6% in de controlegroep. De proportie patiënten met hoofdpijn in de 12 weken behandeling was 3% in de interventiegroep en 3% in de controlegroep. Absolute aantallen zijn niet gerapporteerd en de significantie is niet geanalyseerd. In de studie van Morgenstern (2002) zijn 60 patiënten meegenomen. Tijdens de in-patiënt behandeling hebben 9 patiënten adverse events gerapporteerd, deze liepen uiteen van rillingen tot misselijkheid. Alle gerapporteerde bijwerkingen waren mild. Tijdens de out-patiënt fase zijn er in de interventiegroep 2 adverse events gerapporteerd (ijzertekort en common cold) en in de controlegroep zijn er 5 adverse events gerapporteerd maar deze zijn niet gespecificeerd. Bijwerkingen was echter geen systematisch onderzochte uitkomstmaat in deze studies en daarom is het niet mogelijk om hier iets over te concluderen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten ernst van de tinnitus en kwaliteit van leven is met drie niveaus verlaagd gezien het gering aantal studies (imprecisie, 1 niveau verlaagd) en incomplete rapportage van resultaten (serieuze beperkingen in de studie opzet, 2 niveaus verlaagd) (Hilton, 2013 en Morgenstern, 2002). Bijwerkingen is niet systematisch onderzocht als uitkomstmaat en daarom is het niet mogelijk om bijwerkingen van gingko biloba te graderen.
3. Steroïden (systemisch en intratympanaal)
Beschrijving studies
Er werd één systematische review geïncludeerd (Lavigne, 2015), waarin het effect van steroïden is onderzocht. In deze review worden vijf RCT’s beschreven: (1) Choi (2013); (2) Shim (2011); (3) Topak (2009); (4) She (2010); (5) Araujo (2005).
Het voordeel van het lokaal toedienen van steroïden is dat het medicijn in hoge dosering het weefsel kan binnendringen terwijl tegelijkertijd systemische toediening voorkomen kan worden (Lavigne, 2015). De fysiologische eigenschappen van het middenoor (o.a. de semipermeabiliteit van het ronde venstermembraan) maken het mogelijk een vele malen hogere concentratie steroïden in de perilymfe te bereiken dan met systemische toediening. De binnenoorfysiologie wordt door de steroïden dusdanig gemoduleerd dat aandoeningen met een inflammatoir karakter goed lijken te reageren. (Lavigne, 2015).
In de review van Lavigne (2014) is gezocht tot december 2014. In deze review zijn vijf RCT’s beschreven (1) Choi (2013); (2) Shim (2011); (3) Topak (2009); (4) She (2010); (5) Araujo (2005).
In totaal zijn in deze studies 340 patiënten onderzocht op het effect van steroïden op tinnitus. De interventies waren verschillend in elke RCT: (1) dexamethasone 5 mg, intratympanic steroïdinjecties; (2) dexamethasone 5 mg, alazopram; (3) methylprednisolone 62.5 mg, methylprednisolone; (4) methylprednisolone 0.25mg; (5|) dexamethasone 4mg intratympanic steroïdinjecties. Er is geen informatie beschikbaar over leeftijd en geslacht van de patiënten.
Resultaten
Ernst van de tinnitus
Ernst van de tinnitus is in deze studies op een aantal manieren gemeten: met de Tinnitus Handicap Inventory (THI), ‘cure rate’, ‘control rate’ en de Tinnitus Visual Analaog scale Improvement (TVASI). Drie studies vergeleken intratympatic steroids injections met placebo en vonden geen effect op verbetering van ernst van de tinnitus. Eén studie vergeleek intratympatic dexamethasone, intratympatic prednisolone en orale carbamazepine en vond geen effect. Slechts één studie vond een statistisch significant effect van intratympatic steroids injections op de ernst van de tinnitus (25.8% vs 9.8% in de controle groep).
Kwaliteit van leven
De uitkomstmaat ‘kwaliteit van leven’ was geen onderzochte uitkomstmaat.
Bijwerkingen
De uitkomstmaat ‘bijwerkingen’ was geen onderzochte uitkomstmaat.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernst van de tinnitus is met 2 niveaus verlaagd. 1 niveau vanwege extrapoleerbaarheid (bias ten gevolge van indirectheid: studiepopulaties en manier van toedienen medicatie verschillen per studie) en 1 niveau vanwege het geringe aantal patiënten (imprecisie). Hierdoor zijn de studies moeilijk met elkaar te vergelijken. De kwaliteit van de individuele studies is niet te beoordelen op basis van het review van Lavigne (2015).
4. Glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine)
Beschrijving studies
Er werd één systematische review geselecteerd (Hoekstra, 2011) en twee RCT’s (Ciodaro, 2015; Gerami, 2012) geïncludeerd, waarin het effect van glutamaat antagonisten is onderzocht bij patiënten met tinnitus.
Gabapentin is een anticonsulvant medicatie die oorspronkelijk is ontwikkeld en goedgekeurd als een adjunctive therapy voor de behandeling voor partiële convulsies. Het is een structurele analoog van GABA en wordt ook gebruikt om neuro pathische pijn en migraine te behandelen (Ciodaro, 2015).
In de review van Hoekstra zijn zeven RCT’s beschreven: (1) Bakshae (2007); (2) Donaldson (1981); (3) Hulshof (1985); (4) Hulshof (1986); (5) Piccirillo (2007); (6) Simpson (1999); (7) Witsell (2006) die het effect van gabapentine hebben onderzocht bij in totaal 453 patiënten. Twee van deze RCT’s gingen over een ander type glutamaat antagonist dan is gespecificeerd in de uitgangsvraag (De studie van Hulshof uit 1986 had als interventie 10mg flunarizine, en de studie van Simpson uit 1999 had als interventie 100mg lamotrigine). Deze twee studies zijn dan ook niet meegenomen in onderstaande uitwerking en in de evidence tabel. In totaal zijn er dus 370 patiënten meegenomen uit de review van Hoekstra (2011). Van deze overgebleven vijf studies hebben er 3 gekeken naar het effect van gabapentine (Bakshae, 2007; Piccirillo, 2007 en Witsell, 2006) en 2 studies naar het effect van carbamazepine (Donaldson, 1981 en Hulshof, 1995).
In de RCT van Ciodaro (2015) zijn 72 patiënten met tinnitus geïncludeerd en is het effect van gabapentine in vergelijking tot gabapentine in combinatie met lidocaïne injecties. De patiënten werden in drie groepen van 24 personen gedeeld. De eerste groep patiënten kreeg gabapentine in combinatie met zoutinjecties, de tweede groep gabapentine in combinatie met lidocaïne injecties en de controlegroep ontving placebo. De gemiddelde leeftijd in de drie groepen lag tussen de 40.25- 42.71 jaar (SD tussen de 9.07 en 9.55). Het percentage man tussen de 50% en 54%.
In de RCT van Gerami (2012) zijn 57 patiënten met tinnitus geïncludeerd en is het effect van carbamazepine onderzocht. De gemiddelde leeftijd in de totale groep was 51.9yrs ± 10.2 en 56% van de patiënt was man.
Resultaten
Ernst van de tinnitus
Alle studies uit de review van Hoekstra (2011) keken naar het zelf-gerapporteerde effect van behandeling met anticonvulsants op de ernst van de tinnitus. Geen van de studies lieten een (statistisch significant) positief effect zien. In de RCT van Ciodaro is ernst van tinnitus ook gemeten aan de hand van de THI. Na zes maanden werden er significante verschillen in THI scores tussen de interventie en controlegroep gerapporteerd, dit effect was sterker wanneer de gabapentine werd gegeven in combinatie met lidocaïne (6 maanden: groep 1 Gabapentine 37.92±20.65, groep Gabapentine met Lidocaine 26.83±24.95, groep placebo 42.75±11.92, p0.02). In de RCT van Gerami (2012) is de ernst van de tinnitus gemeten aan de hand van Vas scores en de Tinnitus Severity Inventory. Uit deze studie bleek carbamazepine de VAS scores te verlagen (gemiddelde afname in de carbamazepine groep was 1.7 eenheden (95% CI: 0.44-2.17) evenals de scores op de TSI (afname gerapporteerd door 94,5%, 82,4% en 75% van de patiënten, in respectievelijk groep 1,2 en 3), maar deze afname bleek niet significant te verschillen met de afname in de placebogroep.
Kwaliteit van leven
Geen van de studies in de review van Hoekstra (2011) lieten een positief effect zien van anticonvulsants op verbeteringen van de kwaliteit van leven bij patiënten met tinnitus. Slechts drie studies, welke allemaal keken naar het effect van gabapentin, hebben het effect hiervan op de kwaliteit van leven gemeten aan de hand van gevalideerde vragenlijsten. Één studie vond een negatief effect, één studie een niet-significant positief effect en één studie vond geen verschil.
Bijwerkingen
In de review van Hoekstra (2011) worden er in alle studies bijwerkingen gerapporteerd. Het meest gerapporteerd werden misselijkheid en duizeligheid. Daarnaast werden ook: hoofdpijn, vermoeidheid, overgeven, gewichtstoename, slaapstoornissen, diarree, mondzweren en verminderd libido genoemd. In de studie van Backshae (2007) rapporteerden 3% van de patiënten in de interventiegroep bijwerkingen, in de studie van Donaldson (1981) 18 % van de interventiegroep, bij Hulshoff (1986) 63% van de interventiegroep, bij Piccirillo (2007) rapporteerden 7% bijwerkingen (niet gespecificeerd uit welke groep) en bij Witsell (2006) rapporteerde 2% van de interventiegroep bijwerkingen. In de RCT van Ciodaro rapporteren zes patiënten misselijkheid in de groep waarin gabapentine in combinatie met lidocaïne wordt gegeven. In de RCT van Gerami ervaren twee patiënten in de carbamazepine groep huidallergie. Bijwerkingen was echter geen systematisch onderzochte uitkomstmaat in deze studies en daarom is het niet mogelijk om hier iets over te concluderen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘ernst van de tinnitus’ is met twee niveaus verlaagd, gezien het geringe aantal studies (imprecisie) en de verschillen in interventie (carbamazepine en gabapentine, op verschillende manieren toegediend, indirectheid). De bewijskracht voor de uitkomstmaat ‘kwaliteit van leven’ is met twee niveaus verlaagd om dezelfde redenen als het verlagen van de bewijskracht van de uitkomstmaat ‘ernst van de tinnitus’.
5. Voedingssupplementen (omega 3, zink)
Beschrijving studies
Twee RCT’s zijn geselecteerd (Arda, 2003 & Coelho, 2013) die het effect van het voedingssupplement zink onderzochten bij patiënten met tinnitus. Er zijn geen studies gevonden die het effect van omega 3 in patiënten met tinnitus hebben onderzocht.
Zink is een sporenelement en speelt een belangrijke rol in het metabolisme. Zink is een essentieel element voor het functioneren van het menselijk immuunsysteem. Een zinktekort kan de cognitieve ontwikkeling negatief beïnvloeden. Zink lijkt tevens essentieel voor neurogenesis, neuronale migratie en synaptogenesis. Een tekort lijkt een invloed te hebben op neurotransmissie en neuropsychologisch gedrag. Zink is ook aanwezig in de synapsen van het auditief systeem (Arda, 2003).
In de studie van Arda (2003) werden patiënten in de interventie groep ingedeeld in twee groepen. De eerste groep bevatte 10 patiënten met zinklevels van 70u.g/dl of minder en de andere groep 20 patiënten met zinklevels van hoger dan 70u.g/dl. Patiënten in beide groepen werden 2 maanden dagelijks behandeld met 50mg zink. De placebogroep bestond uit 20 personen. De gemiddelde leeftijd in de interventiegroep was 51,2 en de gemiddelde leeftijd in de controlegroep was 55 jaar. De follow-up was 2 maanden.
In de studie van Coelho (2013) werden 58 patiënten geïncludeerd in de interventiegroep en 58 in de controlegroep. De gemiddelde leeftijd in de interventiegroep was 67,5 jaar en de gemiddelde leeftijd in de controlegroep was 67,7. De patiënten in de interventiegroep ontvingen 4 maanden lang 220mg zink per dag en de controlegroep een placebo. Daarna volgde een ‘washout’ periode van één maand en wisselden de interventie en controle groepen (cross-over). Vervolgens volgde een nieuwe periode van 4 maanden. De follow-up periode was 9 maanden.
Resultaten
Ernst van de tinnitus
In de studie van Arda (2003) werd de ernst van de tinnitus gemeten aan de hand van afname in de frequentie in kHz. In deze studie nam de frequentie gemeten in kHz af in de interventiegroep van 5.31 ± 2.95kHz naar 5.02 ± 2.39 kHz (niet significant). In de controle groep nam de frequentie kHz af van 5.81± 3.02 naar 5.81 ± 2.98 (niet significant) De Tinnitus loudness gemeten in dB nam in de interventie groep af van 52.57 ± 23.41 naar 49.91± 21.97 (niet significant) en in de controlegroep van 61.35 ± 26.63 naar 59.61 ± 24.96 (niet significant). De subjectieve tinnitus score nam in de interventiegroep significant af van 5.25 ± 1.09 naar 2.82 ± 1.81 (p.0.001). In de controlegroep nam de subjectieve tinnitus score af van 5.15 ± 0.90 naar 4.23 ± 2.69 (p.0.07).
In de studie van Coelho (2013) werd de ernst van tinnitus gemeten aan de hand van scores op de Tinnitus Handicap Questionnaire, Annoyance rating scores en loudness rating scores. De onderstaande tabel geeft de uitkomsten aan. De scores zijn in onderstaande tabel terug te vinden.
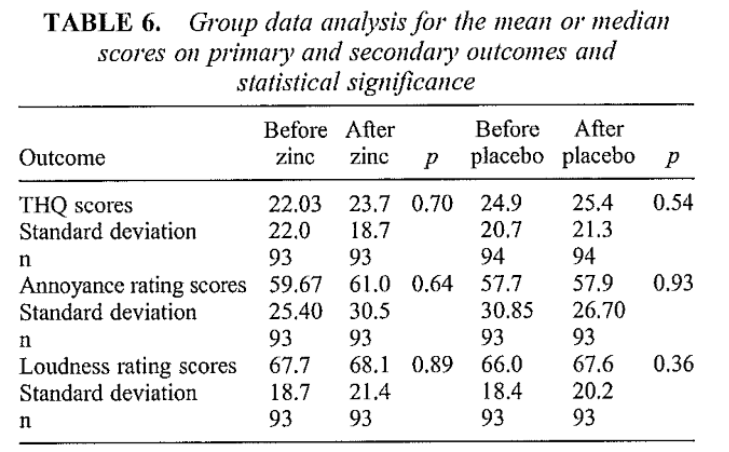
Kwaliteit van leven
De uitkomstmaat ‘kwaliteit van leven’ was geen onderzochte uitkomstmaat.
Bijwerkingen
In de studie van Arda (2003) worden er door twee patiënten in de interventiegroep milde bijwerkingen gerapporteerd. Het gaat om milde buikklachten. In de controlegroep werden geen bijwerkingen gerapporteerd. Bijwerkingen was echter geen systematisch onderzochte uitkomstmaat in deze studie en daarom is het niet mogelijk om hier iets over te concluderen. In de studie van Coelho (2013) was bijwerkingen geen onderzochte uitkomstmaat.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernst van tinnitus is met 3 niveaus verlaagd, omdat er slechts twee studies het effect van een behandeling met zink bij patiënten met tinnitus hebben onderzocht (imprecisie) en omdat in één van de studies (Coelho, 2013) de patiëntengroep 60 jaar en ouder was (indirectheid).
Gezien het feit dat er slechts één studie bijwerkingen heeft gerapporteerd (Arda, 2003) en er in deze studie een gering aantal patiënten in de interventiegroep zat (n=28), is het niet mogelijk om een gradering te geven voor de bijwerkingen van de behandeling met zink bij patiënten met tinnitus.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
- Wat is de effectiviteit van Gingko biloba op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van Lidocaine (Xylocaine en Tocainide) op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van steroïden (systemisch en intratympanaal) op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine) op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van antidepressiva op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van voedingssupplementen (omega 3, zink) op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van anti- oxidanten op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van NMDA-R op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
- Wat is de effectiviteit van antagonist nortryptyline op de ernst van de tinnitus, kwaliteit van leven en bijwerkingen in vergelijking met placebo bij patiënten met chronische tinnitus?
In de databases Medline (OVID), Embase en Cochrane is vanaf 1990 t/m december 2015 met relevante zoektermen gezocht naar verschillende soorten medicatie bij volwassen patiënten met tinnitus. De zoekverantwoording is weergegeven aan het einde van de module. De literatuurzoekactie leverde 252 treffers op. Er is besloten om te kijken naar studies met de hoogste kwaliteit, namelijk systematic reviews van RCT’s en RCT’s. Studies die voldeden aan de volgende selectiecriteria zijn opgenomen in de samenvatting van de literatuur: systematische review van vergelijkend onderzoek en RCT’s; vergelijking van Ginkgo biloba, Lidocaine (Xylocaine en Tocainide), steroïden (systemisch en intratympanaal), glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine), antidepressiva, voedingssupplementen (omega 3, zink), anti-oxidanten, NMDA –R en antagonist nortryptyline met placebo bij patiënten met tinnitus en met minimaal één van de volgende uitkomstmaten: ernst van de tinnitus (vermindering van symptomen), tinnitus specifieke kwaliteit van leven en bijwerkingen.
Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens vier systematische reviews van RCT’s definitief geselecteerd (Baldo, 2012, Hilton, 2013, Hoekstra, 2011 en Lavigne et al. 2015) en vijf RCT’s (Arda et al. 2003, Ciodaro et al. 2015, Coelho et al. 2013, Gerami et al. 2012, Morgenstern and Biermann, 2002). De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn weergegeven aan het einde van deze module.
Er zijn geen vergelijkende studies gevonden die het effect van Lidocaine (Xylocaine en Tocainide), Anti-oxidanten, NMDA-R en Antagonist nortryptyline op de ernst van tinnitus, kwaliteit van leven en bijwerkingen hebben onderzocht. Hieronder zal een samenvatting gegeven worden van de literatuur over de effecten van (1) Antidepressiva (2) Gingko Biloba, (3) Steroïden (systemisch en intratympanaal), (4) Glutamaat antagonisten (Carbamazepine, natriumvalproaat, Gabapentine) en (5) Voedingssupplementen (omega 3, zink).
Referenties
- Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Leitlinie der Chronischer Tinnitus. S3-Leitlinie 017/064. 02/2015.
- Anders M, Dvorakova J, Rathova L, et al. Efficacy of repetitive transcranial magnetic stimulation for the treatment of refractory chronic tinnitus: a randomized, placebo controlled study. Neuroendocrinology Letters 2010;31(2):23849.
- Arda H, Tuncel U, Akdigan O, et al. The Role of Zinc in the Treatment of Tinnitus. Otology & Neurology 2003;24:86-89.
- Baldo P, Doree C, Molin P, et al. Antidepressants for patients with tinnitus (review). Cochrane Databadse of Systematic Reviews 2012, issue 9. Art. No.: CD003853.
- Ciodaro F, Manella V, Cammaroto G, et al. Oral gabapentin and intradermal injection of lidocaine: is there any role in the treatment of moderate/severe tinnitus? Eur Arch Otorhinolaryngol 2015;272:2825-2830.
- Coelho C, Witt S, Ji H, et al. Zinc to Treat Tinnitus in the Elderly: A Randomized Placebo Controlled Crossover Trial. Otology & Neurology 2013;34:1146-1154.
- Gerami H, Saberi A, Nemati S, et al. Effects of oxcarbazepine versus carbamazepine on tinnitus: A randomized double-blind placebo-controlled clinical trial. Iranian Journal of Neurology 2012;11(3):106-110.
- Hilton M, Zimmerman E, Hunt W. Ginkgo biloba for tinnitus (review). Cochrane Database of Systematic Reviews 2013; Issue 3. Art.No:CD003852.
- Hoekstra C, Rynja S, Van Zanten G, Rovers M. Anticonvulsants for tinnitus (review). Cochrane Database of Systematic Reviews 2011; Issue 7. Art.No:CD007960.
- Lavigne P, Lavigne F, Saliba I. Intratympatic corticosteroids injections: a systematic review of literature. Eur Arch Otorhinolaryngol 2015. DOI 10.1007/s00405-015-3689-3.
- Morgenstern C, Biermann E. The efficacy of Ginkgo special extract EGb 761 in patients with tinnitus. International Journal of Clinical Pharmacology and Therapeutics. 2002;40(5):188-197.
Evidence tabellen
Exclusietabel
|
REVIEW |
|
|
Antidepressiva |
|
|
Jufas, 2015 |
Medicatie niet in lijst inclusiecriteria, gaat om GABA-agonisten. |
|
Robinson et al. 2007 |
Geen systematische review of RCT. |
|
Corticosteroïden |
|
|
De Souza Chelminski Barreto et al. 2012 |
Geen placebocontrole |
|
Barreto et al. 2012 |
Geen placebocontrole |
|
Gabapentine |
|
|
Aazh, 2011 |
Zit in review Hoekstra, 2011 |
|
Gingko biloba |
|
|
Von Boetticher et al. 2011 |
Geen duidelijke search, resultaten & tabel komen niet overeen, geen duidelijke beschrijving uitkomstmaten, beperkte studie informatie. |
|
Rejali et al. 2004 |
Zit in review Hilton et.al 2013. |
|
Verschillende |
|
|
Dobie, 1999 |
Worden geen specificaties gegeven over de studies, patiënten karakteristieken etc. Alleen een summiere beschrijving. |
|
RCT |
|
|
Antidepressiva |
|
|
Holgers et al. 2011 |
Onacceptabel hoge drop-out, beschrijft dezelfde groep als Zoger et al. 2006b. |
|
Sullivan et al. 1993 |
Zin in review Baldo et al. 2012. |
|
Zöger et al. 2006a |
Onacceptabel hoge drop-out. |
|
Zoger et al. 2006b |
Onacceptabel hoge drop-out. |
|
Corticosteroïden |
|
|
Choi et al. 2013 |
Zit in review Lavigne et al. 2015 |
|
Silverstein et al. 1998 |
Gaat om patiënten met Meniers disease waarbij tinnitus een symptoom is van MD en niet de hoofddiagnose zelf. |
|
Topak et al. 2009 |
Zit in review Lavigne et al 2015. |
|
Gingko biloba |
|
|
Drew et al. 2001 |
Zit in review Hilton et al. 2013 |
|
Glutamaat antagonisten |
|
|
Sharma et al. 2012 |
Niet duidelijk hoeveel patiënten er in de controle en interventie groep zitten, exacte data niet te extraheren |
|
Piccirillo et al. 2007 |
Zit in review Aazh, 2011 |
|
Lamotrigine |
|
|
Simpson et al. 1999 |
Medicatie niet in lijst inclusiecriteria |
|
Lidocaïne |
|
|
Murai et al. 1992 |
Geen RCT of systematische review |
|
Rudack et al. 1997 |
Geen RCT of systematische review |
|
Memantine |
|
|
Figueiredo et al. 2008 |
Medicatie niet in lijst inclusiecriteria |
|
Sulpride |
|
|
Lopez Gonzalez et al. 2007 |
Medicatie niet in lijst inclusiecriteria |
|
Meerdere medicaties |
|
|
Savage, 2014 |
Zeer summiere beschrijving van de studies. Exacte gegevens niet te extraheren. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Arda, 2003 |
Type of study: Randomized, prospective, placebo-controlled
Setting: Patients with tinnitus admitted to ear, nose, and throat clinic
Country: Turkey
Source of funding: Unknown |
Inclusion criteria: Patients with tinnitus with no known pathologic conditions of the ear, nose and throat.
Exclusion criteria: Acoustic trauma, vascular diseases, took ototoxic drugs, undergone surgical procedures
N total at baseline: Intervention:30 Control:20
Important prognostic factors2: For example age ± SD: I:51.2 yrs C: 55 yrs
Sex: I: 42.9% Male C: 30.8% Male
Groups comparable at baseline? Yes. |
Describe intervention (treatment/procedure/test):
The patients in the intervention group were divided into two groups: 10 patients with a zinc level of 70u.g/dl or less and 18 patients with a zinc level greater than 70 u.g/dl. 2 months of treatment: 50mg daily in the intervention group.
|
Describe control (treatment/procedure/test):
Placebo. |
Length of follow-up: 2 months.
Loss-to-follow-up: Intervention: N 2 patients (30-2) Reasons (describe): non compliant taking pills
Control: N 7 patients (20-7) Reasons (describe): non compliant taking pills.
Incomplete outcome data: Intervention: N 0 Reasons (describe)
Control: N 0 Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Tinnitus severity:
I: decrease 5.31 ± 2.95kHz to 5.02 ± 2.39 kHz (not significant). C: decrease 5.81± 3.02 to 5.81 ± 2.98 (not significant) Loudness dB: I: decrease 2.57 ± 23.41 to 49.91± 21.97 (not significant) C: decrease 61.35 ± 26.63 to 59.61 ± 24.96 (not significant) Subjective Tinnitus: I: decrease 5.25 ± 1.09 to 2.82 ± 1.81 p.0.001 C: decrease 5.15 ± 0.90 to 4.23 ± 2.69 p.0.07 Quality of life: Not measured Side-effects: I: Mild gastric disturbance in 2 patients C: no side effects |
Conclusion: Clinical and subjective improvement can be achieved by oral zinc medication (effects not statistically significant). |
|
Ciodaro, 2015 |
Type of study: prospective randomised double-blind
Setting: patients suffering from moderate/severe tinnitus at the department of Otorhinolaryngology and Audiology of “G.Martino”University Hospitals of Messina
Country: Italy
Source of funding: unknown |
Inclusion criteria: patients suffering from moderate/severe unilateral non-pulsatile subjective tinnitus
Exclusion criteria: Presence of organic mental dysfunction, decompensated systemic or psychiatric disease or middle ear pathologies.
N total at baseline: Intervention : 72 (three groups of 24) Control: 24
Important prognostic factors2: age ± SD: I: Group I: 40.25 ± 9.55 Group II: 42.71 ± 9.07 C: 41.08 ± 9.32
Sex: I: Group I: 54% M Group II: 58% M C: 50% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Group I and Group II received gradually titrated dosage of gabapentin (first day 300mg 3 times a day, second day 600mg 3 times a day, from 3rd day to the 6th week 900mg 3 times a day).
Group II underwent local injection, with lidocaine 40mg in 1mL of saline, in the external auditory canal, administered at four locations: superior, posterior, inferior and anterior. Conducted at 1st, 7th, 21th and 35th days.
|
Describe control (treatment/procedure/test):
Group III Placebo tablets 3 times a week for 6 weeks. |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N 0%
Control: N 0%
Incomplete outcome data: Intervention: N 0%
Control: N 0%
|
Outcome measures and effect size (include 95%CI and p-value if available):
Tinnitus severity: The impact of tinnitus was quantified through the use of the Tinnitus Handicap Inventory.
Pre treatment: group 1 57.00±12.62, group 2 56.00±11.43, group 3 53.25±12.69, p0.96 8th day: group 1 55.33±12.42, group 2 47.75±13.83, group 3 45.33±15.04 p0.04 22nd day: group 1 46.25±16.69, group 2 37.17±20.97, group 3 47.17±13.85, p0.09 36th day: group 1 38.33±24.45, group 2 28.92±25.13, group 3 44.67±13.59, p0.03 3 months: group 1 38.17±20.57, group 2 27.00±24.34, group 3 43.17±11.82, p0.02 6 months: group 1 37.92±20.65, group 2 26.83±24.95, group 3 42.75±11.92, p0.02 Quality of life: Not measured Side-effects: Six patients in Group II and 9 patients in Group I developed nausea as a side-effect of Gabapentin.
|
Conclusion: The use of gabapentin associated to lidocaine seems to be superior to placebo and gabapentin in relieving tinnitus. |
|
Coelho, 2013 |
Type of study: Randomized, prospective double-blind placebo-controlled (crossover)
Setting: Tinnitus subjects older than 60, who are more likely to have a zinc deficiency, Tertiary referral centre
Country: U.S.
Source of funding: unknown |
Inclusion criteria: 60 yr or older, tinnitus duration for 6 months or more, normal copper levels, generally good health.
Exclusion criteria: Have a treatable otologic disorder, involved in litigation, presenting or suspected of having a serious psychiatric problem, involved in other treatments for tinnitus, taking drugs that might interact with zinc levels above normal and cognitive impairment.
N total at baseline: Intervention: 58 Control:58
Important prognostic factors2: For example age ± SD: I: 67.5 ± 5.4 C:67.7 ± 5.8
Sex: I: 58.6 % M C: 65.5% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Zinc sulfate 220mg capsules administered once a day for 4 months followed by a washout period of 30 days. After the washout period, subjects who received zinc were reassigned to the placebo for 4 months.
|
Describe control (treatment/procedure/test):
Placebo capsules administered once a day for 4 months, followed by a washout period for 30 days. After the washout period, subjects who received placebo were reassigned to the zinc for 4 months. |
Length of follow-up: 9 months
Loss-to-follow-up: Intervention: N= 13, 24 % Reasons (describe) Low copper serum Scheduling conflicts Tinnitus getting worse Treatment not helpful Other health problems Indigestion No longer interested Stopped taking pills
Control: N=14, 24% Reasons (describe) Low copper serum Scheduling conflicts Death in family Severe constipation Metallic taste No longer interested Treatment is not helping. No final visit.
Incomplete outcome data: Intervention: N 0 (0%)
Control: N 0(0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Tinnitus severity: THQ: I: 23.7 p0.70 C: 25.4 p0.54 Annoyance rating I: 61.0 p0.64 C: 57.9 p0.93 Loudness rating I: 68.1 p0.89 C: 67.6 p0.36 Quality of life: Not reported Side-effects: Not reported
|
Conclusion:
No significant differences on any of the tests between zinc and placebo conditions. Zinc is not an effective treatment for tinnitus in this subgroup of patients. |
|
Gerami, 2012 |
Type of study: Randomized double-blind clinical trial.
Setting: patients with chronic non-pulsatile tinnitus who visited a university hospital in Guilan.
Country: Iran
Source of funding: Unknown |
Inclusion criteria: Patients with persistent non-pulsatile tinnitus lasting for at least 6 months.
Exclusion criteria: any positive history of thyroid disorders, acute and chronic otitis media, and exposure to excessive or loud noise.
N total at baseline: Intervention group 1: 19 Intervention group 2: 19 Control: 19
Important prognostic factors2: For example age ± SD: Total group: 51.9yrs ± 10.2 I:unknown C:unknown
Sex: I: 56% M total group C: % M
Groups comparable at baseline? Not mentioned but analyses were adjusted for age, sex, tinnitus quality and severity
|
Describe intervention (treatment/procedure/test):
Group 1: course of carbamazepine 300 mg/day for one week, followed by 600 mg/day till 12th week.
Group 2: 450mg/day oxcarbazepine for one week, followed by 900 mg/day till 12th week.
|
Describe control (treatment/procedure/test):
Control: placebo, same shape tablets and were given in the same manner. |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention: N= 4 (%) Reasons: skin allergic reactions, refused completion of treatment course
Control: N = 2 (%) Reasons: refused completion of treatment course.
Incomplete outcome data: Intervention: N= 0 (0%)
Control: N= 0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Tinnitus severity: VAS score: At the end of the treatment and based on VAS, carbamazepine, oxcarbazepine and placebo decreased tinnitus severity in 62.5%, 61.5%, and 38.5% of the cases, respectively. However, compared to the state before treatment, only carbamazepine significantly affected on tinnitus severity at the 8th and 12th weeks of trial (P = 0.006), in contrary to oxcarbazepine and placebo. The mean of decrement with carbamazepine according to VAS score was 1.7 units (95% CI: 0.44-2.17) TSI: TSI, decrement of tinnitus severity in mentioned groups was 94.5%, 82.4%, and 75% of subjects, respectively. reduced tinnitus severity after 8th and 12th weeks of the trial (P < 0.0001 and P = 0.008 respectively). This effect was not significant in the placebo group at the end of 8th week (P = 0.157), but it was statistically significant at the 12th week (P = 0.033) Quality of life: Not measured Side-effects: Skin allergic reactions in 2 persons, one from the carbamazepine group and one from the oxcarbazepine group).
|
Conclusion: According to both scales (i.e. VAS and TSI), there was not any significant statistical differences between carbamazepine, oxcarbazepine and placebo, in reducing tinnitus severity. It was noticed that the effects of both drugs on reducing tinnitus severity were mainly seen in the first 8 weeks of treatment, in contrary to placebo that its effect was steady before and after the 8th week.
Carbamazepine and oxcarbazepine are not more effective than placebo in decreasing tinnitus severity. |
|
Morgenstern, 2002 |
Type of study:
Double bind, randomized, placebo controlled, monocentric
Setting: patients age >18 with chronic tinnitus aurium
Ear/nose/throat out-patient unit in St. Georg General Hospital Hamburg
Country: Germany
Source of funding: Not stated. |
Inclusion criteria: Patients included into the trial had to be at least I 8 years old and were required to declare their informed consent to participate in writing. To assess the patients' eligibility for the trial, pure tones with frequencies of 0.125, 0.25,0.5, 1.0, 1.5, 2.0,3.0, 4.0,6.0, and 8.0 kHz were applied to both ears. Normal hearing capacity was defined as a hearing loss of no more than 10 dB compared to the age norm. Eligible patients had to demonstrate normal hearing capacity over at least 3 adjacent frequencies in the audiogram and had to be suffering from chronic tinnitus for at least 2 months. The protocol required that tinnitus was to be reproducible, could be defined tonally and could be rnasked by means of noise applied to the patient's ear.
Exclusion criteria: presence of objectively audible noises or middle ear diseases, reproducibility of the otoacoustic evoked emissions in the initial examination < 850/o, absence of stapedius reflex, latency between the brain stem potentials .I I V of both ears > 0.5 ms. Furthermore, severe organic diseases, decompensated coronary insufficiency, heart attack within the past 4 weeks, alcohol or rnedicament abuse, pregnancy or participation in another trial within the past 4 weeks were criteria for study exclusion.
N total at baseline: Intervention: 31 Control:29
Important prognostic factors2: For example age ± SD: I: median age 45 yrs C: median age 47 yrs
Sex: I: 61.3% M C: 51.7% M
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
The study started with a lO-day open in-patient phase during which all study participants received daily infusions of Ginkgo extract.
This initiation phase was followed by 12 weeks of double-blind out-patient treatment with either Ginkgo extract or placebo, both of which were administered orally.
Following a screening examination to determine the patients' eligibility for trial participation, further visits were held at days l, 5 and 10 of the in-patient phase as well as after 4, 8 and 12 weeks of out-patiert treatment.
During hospitalization, all patients received I infusion/day with Ginkgo special extract EGb 761 (batch number: 5242) over 30 - 60 minutes (1 dry vial in 500 ml isotonic saline). The dry vials contained 200 mg of dry extract from Ginkgo biloba leaves (drug extract ratio 50 : 1), standardized to 48 mg Ginkgo flavone glycosides and 12 mg terpene lactones (ginkgolides, bilobalide); 26 mg disodium hydrogen phosphate: 12 H2O in 3 ml solution served as the solvent.
In the randomized, double-b1ind outpatient phase, the patients received 2 x I from-coated tablet/day of either EGb 761 (batch number: 5558) or placebo (batch numbber: 5558 P) over a period of l2 weeks.
Each EGb 761 tablet contained 80 mg of dry extract from Ginkgo biloba leaves (drug-extract ratio 50 : 1) standardized to 19.2 mg Ginkgo flavone glycosides and 4.8 mg terpene lactones. Accordingly, the total daily dose of EGb 761 during the out-patient phase was 160 mg. |
Describe control (treatment/procedure/test):
placebo |
Length of follow-up: 12 weeks
Loss-to-follow-up:
After two weeks
Intervention: N 23 (79%) Reasons: adverse event, withdrawal of consent, lack of efficacy, lost to follow up, lack of efficacy, major protocol violations in study completers.
Control: N 19 (61%) Reasons: Adverse event, lost to follow-up, withdrawal of consent, disappearance of symptoms, major protocol violations in study completers.
Incomplete outcome data: Intervention: N 0 (0%)
Control: N 0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Tinnitus severity: Differences in tinnitus volume (dB) After 4 weeks, I: -5.8±13.0, C: 0.0± 17.7, p0.034 After 8 weeks, I: -3.0±17.6, C:-1.3±16.2, p0.018 After 12 weeks, I:-3.5±17.8, C:-1.9±17.3, p0.039 Quality of life: Not measured Side-effects: During initial in-patient treatment: Adverse 10 events reported by 9 patients: chills, phlebitis, vertigo, nausea. All events during inpatient treatment were mild or moderate in intensity and subsided without sequels.
During out-patient phase: I: 2 adverse events were reported: iron deficiency and common cold in patients treated with EGb 761 C: 3 patients reported 5 adverse events (not specified) |
Conclusion: A combination of infusion therapy followed by oral administration of Ginkgo special extract EGb 761 appears to be effective and safe in alleviating the symptoms associated with tinnitus aurium.
Small sample sizes |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study
|
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Baldo, 2012
[individual study characteristics deduced from [Baldo, 2012]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs]
Literature search up to January 2012
A: Bayar, 2001 B: Dib, 2007 C: Mihail, 1988 D: Podoshin, 1995 E:Robinson, 2005 F:Sullivan, 1993
Study design: RCT
Setting and Country: not specified
Source of funding: Not specified
|
Inclusion criteria SR: Patients diagnosed with tinnitus without underlying pathological conditions.
Exclusion criteria SR: additional underlying pathological conditions.
6 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex.
N, mean age A: 37 patients B: 85 patients, between 45 and 80 yrs. C: 26 pts D: 225 pts E: 120 pts F: 117 pts
Sex: A:unknown B: unknown C: unknown D: unknown
Groups comparable at baseline? The six included studies were extremely varied in design.
|
Describe intervention:
A: amitriptyline at scalar doses (50mg to 100 mg; at night) B: trazodone, 50mg daily C: trimipramine, 150 mg daily D: amitryiptyline, 10 mg 3 times a day E:paroxetine, 10 mg daily increased to maximum 50 mg F:nortriptyline
|
Describe control:
A: placebo B: placebo C: placebo D: placebo E: placebo F: placebo |
End-point of follow-up:
A: treatment 6 weeks B: treatment 60 days C: treatment 6 weeks- 4 weeks rest- 6 weeks treatment D: treatment 10 weeks E: treatment 100 days F: treatment 6 weeks
For how many participants were no complete outcome data available? (intervention/control) A: unknown B: unknown C: unknown D: unknown E: 26 pts dropped out F: 25 pts dropped out
|
Tinnitus Severity Defined as tinnitus severity and disability, improvement in tinnitus perception, loudness or intensity.
A: no differences found B: placebo group showed modest improvement in tinnitus intensity (ns). C: statistically significant improvement (4300 Hz vs 4800 Hz in treatment group and 5800 vs 6000 Hz in placebo group) D:no differences found E: no evidence to recommend paroxetine as routine treatment. THQ subscale 2. (F(1.76) – 8.36, P=0.05. F:significant treatment effect in the treatment group 5dB quieter than placebo group but when broken down by depression status tinnitus loudness only decreased in the depression-NOS group.
Quality of life:
A: not measured B: improvement discomfort scale treatment group: 9,9%, placebo group 15,3% (ns) C: no differences found D: no differences found E: not measured F:not measured
Side effects:
A: not measured B:mild effects 16,3% trazadone group, 7,1% placebo group. C: not measured D: not measured E: not measured F: not measured
|
Facultative:
|
|
Hilton, 2013
[individual study characteristics deduced from [Hilton, 2013]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs]
Literature search up to March 2012
A: Drew, 2001 B: Morgenstern, 1997 C: Napryeyenko, 2009 D: Rejali, 2004
Study design: RCT
Setting and Country: not specified
Source of funding: Not specified
|
Inclusion criteria SR: adults (18 yrs and over) complaining of tinnitus
Exclusion criteria SR: tinnitus associated with a conductive hearing loss, intracranial vascular malformation or palatal myoclonus
4 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex.
N, mean age A: 978 patients B: 99 pts, age >18yrs C: 66 pts, age >18yrs D: 400 pts, age >50yrs
Sex: A:676 Male, 302 female B: unknown C: 34 men, 26 women D: unknown
Groups comparable at baseline?
|
Describe intervention:
A: 150 mg LI 1370mg daily B: two week placebo, followed by 120mg EGb761 C: 120 mg Ginkgo biloba D: 240 mg Ginkgo biloba
|
Describe control:
A: placebo B: placebo C: placebo D: placebo
|
End-point of follow-up:
A: treatment 12 weeks; questionnaire 14 weeks B: treatment 14 weeks C: treatment 12 weeks D: 22 weeks
For how many participants were no complete outcome data available? (intervention/control) A: unknown B: 26/99 C: 6/66 D: unknown
|
Tinnitus Severity Defined as patients subjective assessment of tinnitus
Effect measure: RR, RD, mean difference [95% CI]: A: improvement 13.6% intervention vs 12.4% placebo (NS) B: 42.3dB (36.6-48.1) intervention to 39.0dB (31.9 to 51.2) placebo C: change in tinnitus score -0.7±1.4 intervention vs 0.0±0.8 (p<0.01) D: THI -4.7 intervention vs -2.2 placebo (CI -10.5, 5.1; p=0.51) GHSI 1.94 intervention vs 2.52 placebo (CI -4.8, 3.6; p=0.78) Subjective improvement 8.3% intervention vs 13% placebo
Defined as change in psychoacoustic parameters A: not significant B: not reported C:not reported D:not reported
Quality of life:
Not measured
Side effects: Defined as side effects and adverse effects of treatment
Effect measure: proportion (intervention vs placebo): A: 10.6 vs 9.5% B: not reported C: 5 vs 8% D: 3 vs 6% for diarrhoea and 3% both for headache
|
Facultative:
The limited evidence from the included studies does not demonstrate that Ginkgo biloba is effective for tinnitus when tinnitus is the primary complaint.
Not all patients reported tinnitus as one of their symptoms at the outset of the trials (possibly at the interim). High risk of selective reporting in study B.
Significant results are questioned for the clinical significance.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroup analysis) |
|
Hoekstra, 2011
[individual study characteristics deduced from Hoekstra, 2011]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs]
Literature search up to 26 May 2010
A: Backshae, 2007 B: Donaldson, 1981 C: Hulshof, 1985 D: Piccirillo, 2007 E: Witsell, 2006
Study design:
A: Prospective, double-blind, placebo-controlled, cross-over trial B: Placebo-controlled, randomised, cross-over trial C: Double-blind, placebo-controlled, randomised trial Hulshof, 1985 D: Double-blind, placebo-controlled, randomised trial E:Double-blind, placebo-controlled, randomised clinical trial.
Setting and Country: Not specified
Source of funding: Unknown |
Inclusion criteria SR: anticonsulvant vs placebo in patients with chronic tinnitus
Exclusion criteria SR: patients with somatosounds and patients with auditory hallicunations
5 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 30 patients, 36-81 yrs B: 124, age unknown C: 48 patients, age unknown D: 115 patients, 18-65 years E: 79 patients, 18-70years
Sex: A: unknown B: unknown C: unknown D: unknown E: unknown
Groups comparable at baseline? A: unknown B: unknown C: unknown D: unknown E: unknown
|
Describe intervention:
A: 900mg gabapentin/daily B: 100mg carbamazepine/twice a day C: 150mg carbamazepine/three times a day D: 3600mg gabapentin per day in 3 doses (or highest possible dose reached) (titration: week 1, 900mg/day; week 2, 1800 mg/day; week 3, 2700 mg/day; week 4, 3600 mg/day) E: 1800mg gabapentin per day in 3 doses.
|
Describe control:
A: placebo/daily B: placebo tablets C: placebo capsules D: placebo capsules E: placebo capsules
|
End-point of follow-up:
A: 4 weeks B: 2 times 2 months C: 30 days D: 4 weeks titration period and 4 week fixed dose period E: 2 week escalating-dose period (week 1, 300mg/day; week 2, 900 mg/day, 2 week fixed-dose period, 2 week descending-dose period (week 5, 900 mg/day; week 6, 300 mg/day)
For how many participants were no complete outcome data available? (intervention/control)
A: 42 patients were noncompliant with the study instructions and one failed to complete the study due to side effects. Not adequately described; 59% drop-out is implied (not included in the analysis). B: 21% drop-out, 18% intervention, 3% placebo. C: 42% drop-out in the intervention group. D: 16% drop-out in gabapentin group and 14% in placebo group E:30% drop-out, selective loss to follow up.
|
Tinnitus severity: Measured as improvement in self-assessment of tinnitus severity A: no effect of gabapentin on self-assessment score (RD 5%, 95% CI -40% to 30%) B: non-significant positive effect in 45% in carbamazepine group of 45% compared to 21% in the placebo group on a self-assessment score (RD 10%, 95% CI -8% to 27%). C:a non-significant negative effect: in 8% as compared to 13% in the placebo group on self-assessment score (RD -4%, 95% CI -21% to 13%) D: non-significant improvement in 19% in the gabapentin group compared to 9% in the placebo group (RD 10%, 95% CI -2% to 22%) on a self assessment score. E: significant effect for gabapentin using a self-assessment score: 38% of patients in the gabapentin group reported a positive effect compared to 7% of placebo group (RD 30%, 95% CI 14% to 48%)
Quality of life: Measured as improvement in tinnitus-specific health-related quality of life A: Increase in Tinnitus Questionnaire score of 18.4 points (SMD 0.82, 95%CI 0.07 to 1.58) B: not measured C: not measured D:positive, non-significant effect for gabapentin with a difference compared to placebo of 2.4 point on the Tinnitus Handicap Inventory (SMD -0.11, 95% CI -0.48 to 0.25) E: no differences on the THI compared to placebo, exact numbers could not be extracted.
Side-effects: A: 3% experienced dizziness B: adverse events: types not described. 18% withdrew because of side effects from carbamazepine and 3% withdrew because of side effects from the placebo. C: 63% of carbamazepine group experienced side effects (8 dizziness, 8 nausea, 4 headache, 2 tiredness, 2 vomiting) 4% of placebo patients experienced side effects (1 headache). D: Adverse events: 7% withdrew because of side effects (3 nausea, 2 weight gain, 2 sleep disturbance, 2 dizziness, 1 seizure). It was not mentioned if the side effects occurred in the gabapentin group or the placebo group. E: adverse events: 2% of patients in the gabapentin group experienced side effects (1 mouth sores and decreased libido).
|
|
|
Lavigne, 2015,
[individual study characteristics deduced from [Lavigne, 2015]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCT]
Literature search up to December 2014
A: Choi, 2013 B: Shim, 2011 C: Topak, 2009 D: She, 2010 E: Araujo, 2005
Study design: RCT
Setting and Country: not specified
Source of funding: Not mentioned
|
Inclusion criteria SR: locally delivered steroids for treatment of inner ear pathologies suspected to have an inflammatory or autoimmune physiopathology.
Exclusion criteria SR: other languages than English and French
5 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 30 patients, ? yrs B: 132 patients, ? yrs C: 59 patients, ? yrs D: 84 patients, ? yrs E: 35 patients, ? yrs
Sex: A: not mentioned B: not mentioned C: not mentioned D: not mentioned E: not mentioned
Groups comparable at baseline?
A: unknown B: unknown C: unknown D: unknown E: unknown F: unknown |
Describe intervention:
A:dexamethasone 5 mg, intratympanic steroid injection B: dexamethasone 5 mg, alazopram C: methylprednisolone 62.5 mg, methylpredinisolone D: methylpredinisolone 0.25mg E: dexamethasone 4mg intratympanic steroid injection
|
Describe control:
A: placebo B: alazopram+ intratympanic steroid injection, alazopram + intratympanic steroid injection + prostaglandin C: placebo D: dexamethasone 5mg, carbamazepine 300mg E: placebo
|
End-point of follow-up:
A: no follow up B: no follow up C: no follow up D: no follow up E: no follow up
For how many participants were no complete outcome data available? (intervention/control) A: unknown B: unknown C: unknown D: unknown E: unknown
|
Tinnitus severity: Defined as tinnitus control
Effect measure: RR, RD, mean difference [95% CI]: A: THI: no effect B: Control rate: no effect. C: SATLSI: no effect D: statistically significant improvement of tinnitus E: TVASI: no effect
Quality of life: Not measured Side-effects: Not measured
|
Facultative:
|
Table of quality assessment for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Arda, 2003 |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Ciodaro, 2015 |
Sequentially randomized according to a computer generated random code |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Coelho, 2013 |
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Likely Note: I: 13 of 58 lost to follow up C: 14 of 58 lost to follow up |
Unlikely |
|
Gerami, 2012 |
Random blocks |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
unlikely |
|
Morgenstern, 2002 |
Unclear |
Unlikely |
Unclear |
Unclear |
Unclear |
Unlikely |
Likely Note: I: 19 of 31 lost to follow up C:23 of 29 lost to follow up |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Baldo, 2012 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
No |
|
Hilton, 2013 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
no |
|
Hoekstra, 2011 |
yes |
yes |
yes |
yes |
Not applicable |
yes |
yes |
no |
no |
|
Lavigne, 2015 |
yes |
yes |
no |
yes |
Not applicable |
no |
yes |
no |
no |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-11-2017
Een aantal modules dienen binnen de tijdstermijn van 5 jaar herzien te worden. De NVKNO is daarom voornemens een deel van de werkgroep in stand te houden. Een nader uitgewerkt onderhoudsplan is tijdens de commentaarronde ter consultatie voorgelegd aan de NVKNO commissie richtlijnen.
De NVKNO is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het verkrijgen van meer uniformiteit met betrekking tot de diagnostiek, behandeling en begeleiding van tinnituspatiënten door KNO-artsen. Hiermee kan zowel overdiagnostiek als onderdiagnostiek worden vermeden en worden kosten gereduceerd. Verder kan een richtlijn het aantal second opinions doen afnemen en een handvat bieden ten aanzien van het doorverwijzen van de patiënt naar een audiologisch centrum, een ander (medisch) specialisme of terugverwijzing naar de huisarts.
Doelgroep
De richtlijn is primair gericht op KNO-artsen. Daarnaast is het belangrijk dat ook ketenpartners zoals Audiologische Centra, huisartsen en psychologen/psychiaters kennisnemen van de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met tinnitus (zie hieronder). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- drs. J. Joustra, KNO-arts in ruste (voorzitter)
- dr. J. Buwalda, KNO–arts, Deventer Ziekenhuis, Deventer
- dr. R. Cima, psycholoog, Maastricht University en Adelante Zorggroep, Hoensbroek
- dr. R.H. Free, KNO–arts, UMCG, Groningen
- dr. R. Hofman, KNO –arts, UMCG, Groningen
- dr. E. de Kleine, klinisch fysicus –audioloog, UMCG, Groningen
- prof. dr. R.J. Stokroos, KNO–arts, MUMC, Maastricht
- dr. J. van Tongeren, KNO–arts, MUMC, Maastricht
Met ondersteuning van:
- drs. D. Leereveld, junior adviseur Kennisinstituut van Medisch Specialisten
- drs. M. Wessels, literatuurspecialist Kennisinstituut van Medisch Specialisten
Met dank aan:
- drs. J. Beelen, patiëntvertegenwoordiger mede namens de commissie Tinnitus en Hyperacusis, Stichting Hoormij /Nederlandse Vereniging voor Slechthorenden (NVVS), Houten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie -management |
Extern gefinancierd onderzoek |
Kennis -valorisatie |
Overige belangen |
|
drs. J.. Joustra (voorzitter) |
Keel-,Neus- en Oorarts, in ruste |
-Bestuurslid Nederlands Tinnitus Platform (NTP) onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
dr. J. Buwalda |
KNO-arts |
Lid commissie kwaliteitsvisitatie (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
dr. R. Cima |
Onderzoekscoördinator Audiologie en Tinnitus (.02 fte) |
Geen nevenwerkzaamheden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
dr. R.H. Free |
KNO-arts -otoloog |
- secretaris NVWPO (Nederlands Vlaamse Werkgroep Pediatrische Otorhynologie |
Geen |
Geen |
Zie nevenfuncties (Geen rechtstreekse relatie) |
Geen (op termijn MEDEL gesponsord onderzoek niet gestuurd door industrie) |
Betrokken KNO-arts bij tinnitus team UMCG + docent Tinnituscursus Groningen |
Geen |
|
dr. R. Hofman |
KNO-arts-otoloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Betrokken KNO-arts bij tinnitusteam UMCG + docent Tinnituscursus Groningen |
Geen |
|
dr. E. de Kleine |
Klinisch fysicus audioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Betrokken audioloog bij tinnitusteam UMCG + docent Tinnituscursus Groningen |
Geen |
|
prof. dr. R.J. Stokroos |
Hoogleraar Otologie, Neurotologie, KNO arts 100% |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
dr. J. van Tongeren |
KNO-arts |
Geen |
Geen |
Geen |
Commissie lid Medische Technische Werkgroep Stichting Eardrop |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging Stichting Hoormij /Nederlandse Vereniging voor Slechthorenden (NVVS) te laten meelezen met relevante hoofdstukken. De conceptrichtlijn is tevens voor commentaar voorgelegd aan bovenstaande patiëntenvereniging. Ook is er een oriënterende literatuursearch verricht in Medline (OVID) van 2011 t/m januari 2014 naar het patiëntenperspectief. Onder het kopje zoekverantwoording is deze zoekactie te vinden. Hieruit zijn geen relevante artikelen naar voren gekomen. De patiëntenvoorkeuren worden, waar mogelijk, meegenomen onder het kopje ‘Overwegingen’.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden onder 'aanverwant'.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Voor de beoordeling van de kwaliteit van richtlijnen is dit rapport gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org), dat een internationaal breed geaccepteerd instrument is, en op richtlijnen voor richtlijn (www.zorginstituutnederland.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Ook is het concept raamwerk met de knelpunten naar Zorgverzekeraars Nederland verstuurd, maar hier waren geen aanvullingen op.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (zie http://www.guidelinedevelopment.org/handbook/).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
De conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het best beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuur
Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, ..., GRADE Working Group. Grading quality of evidence and strength of recommendations. BMJ 2004; 328 (7454):1490.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
