Blootstelling van derden bij therapie met 223Ra
Uitgangsvraag
Zijn maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 223Ra-dichloride redelijkerwijs noodzakelijk?
Indien de uitgangsvraag positief wordt beantwoord:
Welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 223Ra-dichloride zijn redelijkerwijs noodzakelijk?
Aanbeveling
Uitgaande van het generieke, conservatieve model en een generiek scenario worden de blootstellingskaders zoals beschreven in de algemene inleiding op de richtlijn niet overschreden. Desondanks kan vanuit ALARA principe worden aanbevolen leefregels aan te houden. Op basis van bovenstaande overwegingen worden de volgende aanbevelingen gedaan:
In geval van het generieke scenario en het generieke biokinetisch model zijn maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling aanbevolen. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Geef de patiënt en indien van toepassing de verzorger mondelinge en schriftelijke instructies met betrekking tot stralingshygiëne ter beperking van blootstelling van derden. Daarin moet tenminste terugkomen dat gedurende drie dagen na toediening
- De patiënt alert dient te zijn op (toilet)hygiëne:
- indien mogelijk een eigen toilet reserveren
- zittend gebruikmaken van het toilet
- tweemaal doorspoelen na gebruik van het toilet
- handen wassen na gebruik van het toilet
- eventuele besmetting met lichaamsvloeistoffen en/of uitscheiding zelf opruimen
- Medebewoners en gasten alert dienen te zijn op (toilet)hygiëne:
- handen wassen na gebruik van het toilet
- wegwerphandschoenen gebruiken bij schoonmaken van het toilet
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen drie dagen na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 45 dagen na een gift is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Overwegingen
Biokinetisch model
De toegediende activiteit wordt voornamelijk via fecaliën geklaard. De retentie in het lichaam varieert sterk tussen patiënten, blijkend uit de grote gerapporteerde spreiding (2,6 – 11,4 dagen) in effectieve halveringstijd. Daarbij dient opgemerkt te worden dat een effectieve halveringstijd van 11,4 dagen inhoudt dat er geen activiteit uit het lichaam wordt geklaard. De activiteit in het bloed wordt snel opgenomen of geklaard. De literatuur beschrijft dat activiteit die niet wordt opgenomen in het bot snel wordt opgenomen in de darmen. Alle geïncludeerde literatuur heeft betrekking op kleine cohorten waardoor de bewijskracht lager is.
Daar de toegediende activiteit door het hele lichaam verspreidt, wordt de ioniserende straling deels afgeschermd en vindt build-up plaats. Op basis van de geometrische progressiebenadering [Shultis, 2000] voor het berekenen van de build-up, conversiecoëfficienten voor verschillende fotonenergieën en het vervalschema is de transmissie en build-up ftli berekend, waarbij ook remstraling is geïncludeerd. In de berekening is aangenomen dat de patiënt een diameter van 30 centimeter heeft.
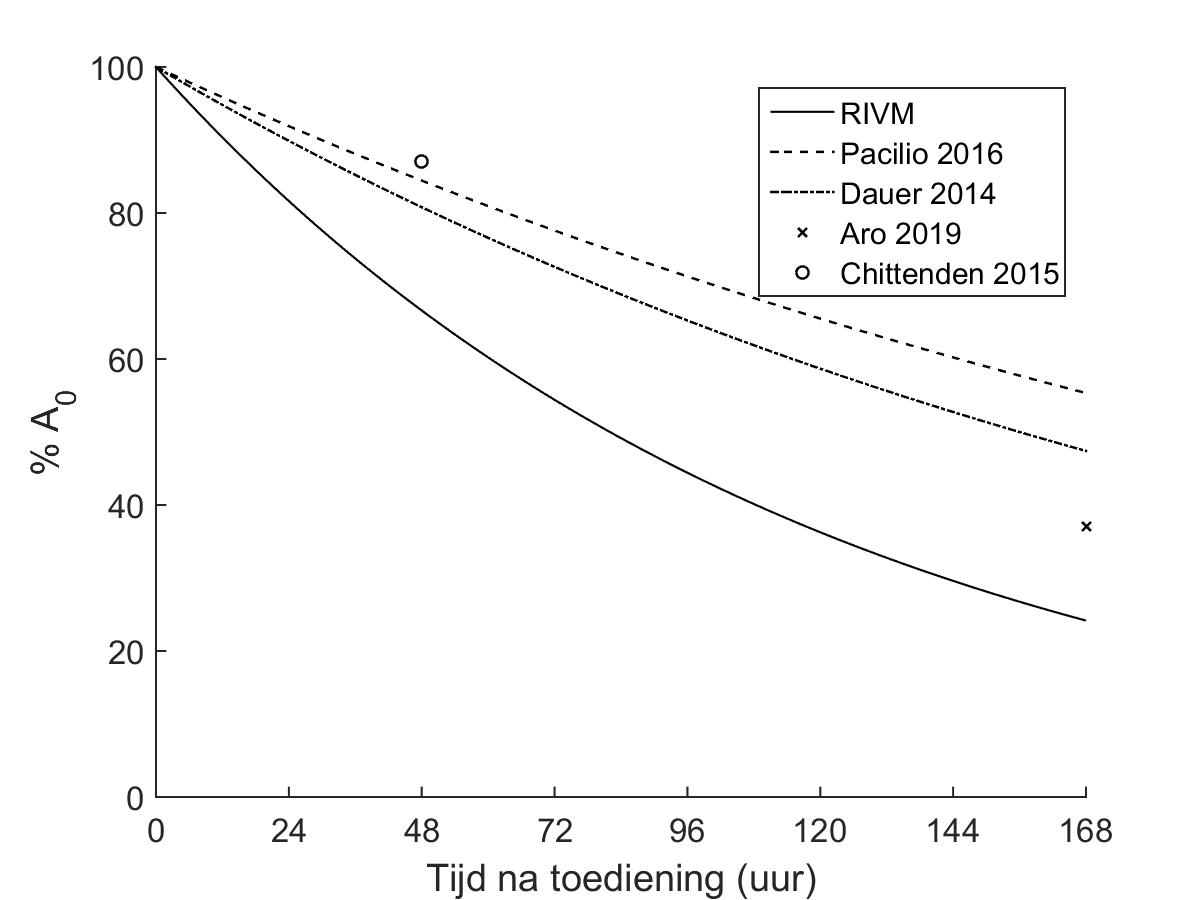
De effectieve halveringstijd in het RIVM-model van 82 uur is korter dan gerapporteerd in literatuur, waarmee de berekende externe blootstelling voor derden lager zal uitvallen dan wanneer berekend op basis van gerapporteerde effectieve halveringstijd in literatuurstudies. Vanwege de grote spreiding in biokinetiek tussen patiënten is op basis van de hoogste gerapporteerde effectieve halveringstijd van 11,4 dagen ingeschat hoe groot de blootstelling voor derden is. Op basis van die overweging worden de in Tabel 3 beschreven parameters aanbevolen voor het biokinetisch model.
Tabel 2: eigenschappen van 223Ra (dosisequivalenttempoconstanten inclusief bijdrage dochters)
|
hfoton(10) (µSv·h-1·GBq-1 op 1 m) [Otto, 2016] |
59 |
|
hfoton(0.07) (mSv·h-1·GBq-1 op 10 cm) [Otto, 2016] |
6,7 |
|
hhuidbesmetting(0.07) (mSv·h-1·kBq-1·cm2) [Petoussi, 1993] |
3,76 |
|
DCCingestie (Sv·Bq-1) [ICRP 119, 2012] |
1,0·10-7 |
|
T1/2,fys (h) [ICRP 119, 2012] |
274,4 |
|
Vrijstellingswaarde activiteitsconcentratie (kBq·kg-1) [Bbs, 2018] |
1·102 |
|
Vrijstellingswaarde activiteit (Bq) [Bbs, 2018] |
1·105 |
Tabel 3: gehanteerde parameters voor berekening van de potentiële blootstelling.
|
Therapie |
T1/2,biol (h) |
ftli |
|
223Ra-dichloride |
∞ |
0,96 |
Figuur 1: biokinetisch model voor therapie met 223Ra-dichloride, op basis van excretie en fysisch verval (Tabel 3) ten behoeve van het bepalen van de externe blootstelling.
Externe blootstelling
Aangezien de verhouding tussen de dosisequivalenttempoconstante voor de huid h(0.07) en voor het lichaam h(10) kleiner is dan de verhouding tussen de dosisbeperking voor de huid en het lichaam wordt de effectieve dosis als beperkende factor beschouwd.
De blootstellingscenario’s in het RIVM-rapport [Kloosterman, 2020] zijn gehanteerd als uitgangspunt bij het bepalen van de externe blootstelling. Omdat therapie met 223Ra bestaat uit meerdere giften wordt de cumulatieve dosis bij 6 giften aan de dosisbeperkingen getoetst. Bij de behandeling bestaande uit 6 giften van 3,75 MBq 223Ra, gebaseerd op een toediening van 55 kBq per kilogram lichaamsgewicht bij een patiënt van 70 kg, bedraagt de conservatief berekende externe blootstelling minder dan 0,5 mSv voor verzorgers, kinderen of leden van de bevolking (Appendix G) gedurende de eerste 21 dagen na toediening, zonder leefregels. Deze inschatting is in overeenstemming met de literatuur op dit onderwerp.
Besmetting en ingestie
De kortste halveringstijd die in de literatuur wordt gepresenteerd komt overeen met een biologische halveringstijd van 81 uur, wat overeenkomt met 700 kBq 223Ra in de ontlasting in de eerste 24 uur na toediening van 3,75 MBq. Ingestie van 10 kBq leidt tot een volgdosis van 1,0 mSv voor een volwassene. De werkgroep acht de kans op ingestie van 1% van de dagelijkse excretie klein, waardoor wordt overschrijding van dosisbeperkingen ten gevolge van ingestie niet waarschijnlijk geacht. Een huidbesmetting met 1% van de excretie op 1 cm2 leidt tot een dosistempo van 26 mSv·h-1. Derhalve acht de werkgroep het onwaarschijnlijk dat huiddosisbeperkingen worden overschreden. Omdat slechts een kleine fractie van de activiteit renaal geklaard wordt, is het onnodig de eerste mictie na toediening op de therapie-afdeling te laten plaatsvinden.
Op basis van het biokinetisch model kan gesteld worden dat 72 uur na toediening geen noemenswaardige biologische klaring meer plaatsvindt.
Overlijden
Bij gebrek aan wet- en regelgeving op stralingshygiënisch vlak met betrekking tot het omgaan met patiënten die overlijden na radionuclidentherapie wordt teruggevallen op de vrijstellings- en vrijgavewaarden zoals vastgelegd in het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018]. Bij toediening van 55 kBq 223Ra per kg lichaamsgewicht wordt de vrijstellingswaarde voor activiteitsconcentratie bij toediening niet overschreden. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingsgrens voor activiteitsconcentratie wordt bereikt na 45 dagen voor een patiënt van 70 kg. Bij overlijden binnen deze periode gelden mogelijk beperkingen met betrekking tot lijkbezorging en is maatwerk met betrekking tot stralingshygiënische aspecten benodigd.
Onderbouwing
Achtergrond
In deze module wordt behandeld:
- 223Ra-dichloride
223Ra-dichloride wordt toegediend aan patiënten ter behandeling en pijnpalliatie van skeletmetastasen ten gevolge van castratie resistent prostaatcarcinoom. Het 223Ra neemt de plaats in van calcium in botaanbouw en wordt zodoende ingebouwd in de afzetting van hydroxyapatiet ter plaatse van nieuwe botaanmaak. Verhoogde botaanmaak wordt juist gezien in sclerotische botmetastasen en dus zal daar een hoge concentratie van het radiofarmacon stapelen [Esser, 2016].
Na toediening van 223Ra kan een patiënt mogelijk derden blootstellen aan ioniserende straling. Deze module beschrijft de aard en omvang van die potentiële blootstelling, die aansluitend is aan de kaders die in de algemene inleiding van de richtlijn zijn beschreven. Op basis hiervan is gedefinieerd welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 223Ra redelijkerwijs noodzakelijk zijn.
Samenvatting literatuur
11 studies werden gevonden naar blootstelling van derden ten gevolge van therapie met 223Ra-dichloride. Wegens het ontbreken van vergelijkende of prognostische studies naar de gevolgen van de mate van blootstelling met 223Ra-dichloride en bijbehorende maatregelen is de literatuur beschrijvend weergegeven. Er is om diezelfde reden een aangepaste beoordeling van de bewijskracht uitgevoerd (zie Verantwoording).
Biokinetisch model
Er werden uit de gevonden literatuur 6 artikelen geselecteerd ten aanzien van het biokinetisch model van 223Ra-dichloride. Daarnaast werd informatie over het biokinetisch model gebruikt uit een artikel dat werd gevonden bij de literatuur search “scenario’s” ([Aro, 2019]).
Bij de studie van Pratt et al. werd bij 6 patiënten die 100 kBq 223Ra per kg lichaamsgewicht kregen toegediend ter behandeling van castratierefractair prostaatcarcinoom de excretie van 223Ra-dichloride gedurende 48 uur na toediening bepaald middels telmetingen van de excreta (urine, feces). Tevens werd de retentie bepaald middels whole body patiënt telmetingen gedurende de eerste 48 uur en op 3, 4, 7 en 42 dagen na toediening. Gedurende de eerste 8 uur werd een cumulatieve maximum excretie van 2,6% gemeten, welke vervolgens toenam tot 39,0% na 48 uur. Het merendeel van de excretie werd gevonden in de feces, een klein deel in de urine. Zes weken na toediening werd een whole body retentie gerapporteerd die tussen patiënten varieert binnen 11% en 60% [Pratt, 2018].
Bij de studie van Großer et al. werd bij 6 opeenvolgende toedieningen van 223Ra-dichloride de excretie bij dialyse van 223Ra in het dialysaat gemeten met een NaI-scintillatie teller. De geïncludeerde patiënt was gediagnostiseerd met castratierefractair prostaatcarcinoom en kreeg een dosis van 55 kBq per kg lichaamsgewicht toegediend. De mediaan van de gerapporteerde totale hoeveelheid activiteit in het dialysaat is 46,1 kBq 24 uur na toediening en 11,2 kBq 96 uur na toediening. Omgerekend naar percentage van de totale toegediende activiteit is de hoeveelheid activiteit in het dialysaat respectievelijk ongeveer 1% en 0,25% [Grosser, 2017].
Bij de studie van Chittenden et al. werd de farmacokinetiek en biodistributie van 223Ra-dichloride van een cohort van 6 patiënten gemeten met een scintillatietelmetingen. Alle patiënten hadden bewezen castratierefractair prostaatcarcinoom. Bij elk van hen waren botmetastasen aangetoond middels botscintigrafie. Met een tussenperiode van 6 weken werd tweemaal 100 kBq 223Ra per kg lichaamsgewicht intraveneus toegediend. Er werd een snelle klaring van activiteit in het bloed gerapporteerd, gemiddeld 1,1% resterend in het bloed na 24 uur. De gerapporteerde opname in het bot is 61% ± 10% op de eerste scan 4 uur na injectie. Er werd gerapporteerd dat het merendeel van de excretie via feces plaatsvindt (cumulatief 13% ± 11% na 48 uur) [Chittenden, 2015].
Bij de studie van Pacilio et al. werd bij 9 patiënten onder andere de biodistributie van 223Ra-dichloride bepaald met behulp van metingen met een dubbelkops gammacamera. In de studie werden louter Kaukasische patiënten geïncludeerd. Elk van hen had botmetastasen ten gevolge van castratierefractair prostaatcarcinoom. Met tussenpozen van 4 weken werden 6 toedieningen met 50 kBq 223Ra per kg lichaamsgewicht gegeven. Er werd een gemiddelde effectieve halveringstijd gerapporteerd van 8,2 (5,5 – 11,4) dagen [Pacilio, 2016].
Bij de studie van Dauer et al. werden bij 10 patiënten met castratierefractair prostaatcarcinoom en bewezen botmetastasen verschillende stralingsveiligheidsaspecten rondom 223Ra-dichloride therapie onderzocht. Drie doseringen (50, 100 en 200 kBq 223Ra per kg lichaamsgewicht) werden toegepast. Er werd gerapporteerd dat excretie van 223Ra-dichloride met name via de feces plaatsvindt en dat de effectieve whole body halveringstijd tussen de 2,6 en 11,4 dagen ligt, met een gemiddelde van 6,5 ± 3,1 dag [Dauer, 2014].
Bij de studie van Carrasquillo et al. werd de farmacokinetiek en biodistributie van 223Ra-dichloride voor een cohort van 10 patiënten met castratierefractair prostaatcarcinoom en bewezen botmestastasen onderzocht met behulp van blood sampling en whole body telmetingen. De patiënten werden verdeeld over cohorten die 50, 100 of 200 kBq 223Ra per kg lichaamsgewicht kregen toegediend. Er werd een snelle klaring uit het bloed gerapporteerd (0,5% resterend na 24 uur). Er werd gerapporteerd dat excretie voornamelijk via de feces plaatsvindt en slechts in beperkte mate via de urine [Carrasquillo, 2013].
Bij de studie van Aro et al. werd de biodistributie van 223Ra-dichloride gerapporteerd. Er werd een snelle klaring uit het bloed gerapporteerd (80% klaring 15 minuten na toediening) en 4 uur na toediening is er nog 4% in het bloed aanwezig, 61% opgenomen in het bot en de overige 35% in de darmen. Na 48 uur is 2% via de urine uitgescheiden en 13% via de feces. Er werd een totale excretie van 63% gerapporteerd 7 dagen na toediening [Aro, 2019].
Voor behandeling met 223Ra-dichloride wordt in het RIVM-rapport een model gehanteerd met een effectieve halveringstijd van 82 uur, op basis van productinformatie van de producent van 223Ra-dichloride [Kloosterman, 2020].
Er bestaat een brede spreiding in effectieve halveringstijd (2,6 – 11,4 dagen) en derhalve dient de biokinetiek in de individuele patiënt bekend te zijn om een onderbouwde uitspraak over de blootstelling van derden te doen. Initiële klaring van activiteit vanuit het bloed verloopt snel. Excretie vindt voornamelijk via fecaliën plaats.
Scenario’s
Er werden uit de gevonden literatuur 2 artikelen geselecteerd ten aanzien van relevante blootstellingsscenario’s van 223Ra-dichloride.
Bij de studie van Aro et al. werden verschillende aspecten rondom stralingsveiligheid onderzocht waaronder blootstellingsscenario’s van derden.
- Er wordt een typisch dosistempo vlak na toediening gerapporteerd van 0,02 µSv·h-1 op 1 meter afstand van de patiënt. Er werd gerapporteerd dat de maximale dosis die een huisgenoot die thuis in hetzelfde bed als de patiënt slaapt kan oplopen tot 100 µSv per toediening, voor een totaal van 600 µSv na 6 toedieningen.
- Er werd gerapporteerd dat het externe dosistempo ten gevolge van uitscheiding van 223Ra-dichloride in feces en urine verwaarloosbaar is en dat significante inwendige besmetting via uitscheiding van 223Ra-dichloride niet voorkomt wanneer de basis hygiëneregels worden gehanteerd.
- Het scenario dat de patiënt een bloeding krijgt: gezien de snelle klaring van 223Ra-dichloride wordt het bloed na 24 uur als niet-radioactief beschouwd. Als de bloeding zeer snel na injectie plaatsvindt kan een besmetting met dit bloed mogelijk de besmettingsnormen overschrijden [Aro, 2019].
Bij de studie van Ooe et al. werd de aanwezigheid van activiteit in de lucht die patiënten uitademen na toediening van 3,4 ± 0,8 MBq 223Ra-dichloride onderzocht, en werd beschreven of dit gevolgen kon hebben voor blootstelling van mensen in de nabijheid. De uitgeademde lucht werd opgevangen in een breath collection bag en geanalyseerd met een HPGe-detector. Er werd gevonden dat de fractie activiteit in de uitgeademde lucht relatief klein is en als gevolg de dosis voor mensen in de nabijheid ook erg klein (voor verzorgers werd deze gerapporteerd als totaal 3,5 µSv per toediening) [Ooe, 2019].
Het externe dosistempo vlak na toediening ligt laag, waardoor de externe blootstelling van derden ook laag uitvalt. Ook blootstelling via inwendige besmetting is beperkt, mits basis hygiëneregels worden nageleefd.
Maatregelen
Er werden uit de gevonden literatuur 3 artikelen geselecteerd ten aanzien van maatregelen bij blootstelling van derden aan 223Ra-dichloride.
Bij de studie van Lassmann et al. werd gerapporteerd dat de potentiële dosis van derden na toediening van 223Ra-dichloride ten gevolge van externe blootstelling en excretie cumulatief ruim onder de 1 mSv ligt. De patiënt moet wel leefregels mee naar huis krijgen waarin de basis hygiëneregels worden benadrukt [Lassmann, 2018].
Bij de studie van Aro et al. werden verschillende aspecten rondom stralingsveiligheid onderzocht waaronder maatregelen voor blootstelling van derden. Voor de thuissituatie werd gerapporteerd dat het houden van enige afstand en hanteren van basis hygiëneregels de dosis fors beperken (<<100 µSv totaal per toediening) [Aro, 2019].
Bij de studie van Sánchez-Jiménez et al. werd de aanwezigheid van contaminaties met langlevende nucliden in 223Ra-dichloride onderzocht, waaronder 227Ac. Er werd gerapporteerd dat de aanwezigheid van langlevende nucliden verwaarloosbaar is en geen aanvullende maatregelen ten aanzien van stralingshygiëne vereist [Sánchez-Jiménez, 2017].
Zwangerschap en borstvoeding worden in de Procedure Guidelines van de NVNG aangemerkt als contra-indicaties voor deze therapie [Procedure Guidelines NVNG, 2017].
De maatregelen die in de literatuur worden besproken beperken zich tot basis hygiëneregels waarmee de externe blootstelling van derden ruim onder de 0,1 mSv per toediening blijft.
Fysische eigenschappen
223Ra vervalt via een vervalreeks en onder uitzending van α-deeltjes, β--deeltjes- en gammastraling naar de stabiele isotoop 207Pb [ICRP 107, 2008] en heeft een fysische halveringstijd van 11,43 dagen [ICRP 119, 2012]. De dosisequivalenttempoconstante voor huidbesmetting (hhuidbesmetting(0.07)) is ontleend aan Petoussi [Petoussi, 1993]. De dosisequivalenttempoconstanten voor fotonbijdrage lichaam (h(10)) en huid (h(0.07)) zijn ontleend aan Otto [Otto, 2016]. Deze bedragen voor de gehele vervalreeks respectievelijk 3,76 mSv·h-1·kBq-1·cm2, 59 µSv·h-1·GBq-1 op 1 meter en 6,7 mSv·h-1·GBq-1 op 10 cm.
De dosisconversiecoëfficiënt voor ingestie van 223Ra bedraagt 1,0·10-7 Sv·Bq-1 voor een volwassen lid van de bevolking [ICRP 119, 2012].
De vrijstellingswaarden voor activiteitsconcentratie en totale activiteit bedragen 0,1 MBq·kg-1 en 0,1 MBq, respectievelijk [Bbs, 2018].
Zoeken en selecteren
Voor het beantwoorden van deze uitgangsvraag heeft de werkgroep gebruik gemaakt van het RIVM-rapport Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. Dosisberekeningen als basisinformatie voor de herziening van maatregelen en leefregels [Kloosterman, 2020].
Daarnaast is er oriënterend literatuuronderzoek verricht in Pubmed, waarbij op 22 mei 2020 is gezocht middels 3 zoekopdrachten gericht op biologische modellen, scenario’s en maatregelen met relevante zoektermen in combinatie met 223Ra-dichloride. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
De literatuurzoekacties leverden respectievelijk 76, 72 en 72 resultaten op. Studies zijn geselecteerd op grond van de volgende selectiecriteria:
- betrekking op het juiste radiofarmacon
- betrekking op mensen
- betrekking op het hele lichaam
- betrekking op blootstelling van derden
- betrekking op beperkende maatregelen
- in een bekende taal
In eerste instantie zijn voor biologische modellen, scenario’s en maatregelen bij 223Ra-dichloride 11, 4 en 7 studies voorgeselecteerd op basis van titel en abstract. Na raadpleging van de volledige tekst zijn hiervan 5, 2 en 4 studies geëxcludeerd (zie exclusietabel) en 6, 2 en 3 artikelen definitief geselecteerd (zie verdeling in Tabel 1).
Tabel 1: verdeling van artikelen per radiofarmacon
|
|
223Ra-dichloride |
|
Biologische modellen |
6 |
|
Scenario’s |
2 |
|
Maatregelen |
3 |
Referenties
- Aro, 2019 Aro JL, Dinning SI, Leung EY, Zuckier LS. Safe Use of Radium-223 Dichloride (223RaCl2) Across a Wide Range of Clinical Scenarios, Incorporating a 10-year Single-Institution Radiation Safety Experience. J Med Imaging Radiat Sci. 2019 Dec;50(4S1):S36-S40. https://doi.org/10.1016/j.jmir.2019.06.043 Epub 2019 Aug 2. PMID: 31383575.
- Carrasquillo, 2013 Carrasquillo JA, O'Donoghue JA, Pandit-Taskar N, Humm JL, Rathkopf DE, Slovin SF, Williamson MJ, Lacuna K, Aksnes AK, Larson SM, Scher HI, Morris MJ. Phase I pharmacokinetic and biodistribution study with escalating doses of ²²³Ra-dichloride in men with castration-resistant metastatic prostate cancer. Eur J Nucl Med Mol Imaging. 2013 Sep;40(9):1384-93. https://doi.org/10.1007/s00259-013-2427-6. Epub 2013 May 8. PMID: 23653243; PMCID: PMC5468165.
- Chittenden, 2015 Chittenden SJ, Hindorf C, Parker CC, Lewington VJ, Pratt BE, Johnson B, Flux GD. A Phase 1, Open-Label Study of the Biodistribution, Pharmacokinetics, and Dosimetry of 223Ra-Dichloride in Patients with Hormone-Refractory Prostate Cancer and Skeletal Metastases. J Nucl Med. 2015 Sep;56(9):1304-9. https://doi.org/10.2967/jnumed.115.157123. Epub 2015 Jul 16. PMID: 26182965.
- Dauer, 2014 Dauer LT, Williamson MJ, Humm J, O'Donoghue J, Ghani R, Awadallah R, Carrasquillo J, Pandit-Taskar N, Aksnes AK, Biggin C, Reinton V, Morris M, St Germain J. Radiation safety considerations for the use of ²²³RaCl₂ DE in men with castration-resistant prostate cancer. Health Phys. 2014 Apr;106(4):494-504. https://doi.org/10.1097/HP.0b013e3182a82b37 PMID: 24562070; PMCID: PMC4981573.
- Esser, 2016 Esser JP, et al ed., (2016). 89Sr Chloride. In: Procedure Guidelines Nuclear Medicine. Neer: 404-6
- Großer, 2017 Großer OS, Wissel H, Wallbaum T, Genseke P, Kupitz D, Ricke J, Ruf J, Amthauer H. Extraction of 223Radium by haemodialysis after treatment of metastatic castration-resistant prostate cancer. Nuklearmedizin. 2017 Jun 13;56(3):69-72. https://doi.org/10.3413/Nukmed-0874-16-12. Epub 2017 Apr 6. PMID: 28383088.
- ICRP 107, 2008 Eckerman K, Endo A. ICRP Publication 107. Nuclear decay data for dosimetric calculations. Ann ICRP. 2008;38(3):7-96. https://doi.org/10.1016/j.icrp.2008.10.004
- ICRP 119, 2012 ICRP Publication 119. Compendium of Dose Coefficients based on ICRP Publication 60. Ann ICRP 2012;41 suppl 1:1-130. https://doi.org/10.1016/j.icrp.2012.06.038
- Kloosterman, 2020 Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- Lassmann, 2018 Lassmann M, Eberlein U. Targeted alpha-particle therapy: imaging, dosimetry, and radiation protection. Ann ICRP. 2018 Oct;47(3-4):187-195. https://doi.org/10.1177/0146645318756253. Epub 2018 Apr 17. PMID: 29664326.
- Ooe, 2019 Ooe K, Watabe T, Kamiya T, Yoshimura T, Hosono M, Shinohara A, Hatazawa J. Quantitative measurement of 219Rn radioactivity in exhaled breath from patients with bone metastasis of castration-resistant prostate cancer treated with 223RaCl2. EJNMMI Phys. 2019 Jul 26;6(1):13. https://doi.org/10.1186/s40658-019-0249-8. PMID: 31350633; PMCID: PMC6660527.
- Otto, 2016 Otto T. Personal dose-equivalent conversion coefficients for 1252 radionuclides. Radiation Protection Dosimetry. 2016 Oct; 168(1):1-70
- Pacilio, 2016 Pacilio M, Ventroni G, De Vincentis G, Cassano B, Pellegrini R, Di Castro E, Frantellizzi V, Follacchio GA, Garkavaya T, Lorenzon L, Ialongo P, Pani R, Mango L. Dosimetry of bone metastases in targeted radionuclide therapy with alpha- emitting (223)Ra-dichloride. Eur J Nucl Med Mol Imaging. 2016 Jan;43(1):21-33. https://doi.org/10.1007/s00259-015-3150-2. Epub 2015 Aug 13. PMID: 26266887.
- Petoussi, 1993 Petoussi N, Zankl M, Ferhenbacher G, Drexler G. Dose distributions in the ICRU sphere for monoenergetic photons and electrons and for ca. 800 radionuclides. GSF – bericht 7/93. 1993
- Pratt, 2018 Pratt BE, Hindorf C, Chittenden SJ, Parker CC, Flux GD. Excretion and whole-body retention of radium-223 dichloride administered for the treatment of bone metastases from castration resistant prostate cancer. Nucl Med Commun. 2018 Feb;39(2):125-130. https://doi.org/10.1097/MNM.0000000000000783 PMID: 29189490.
- Procedure Guidelines NVNG, 2017 Procedure Guidelines Nuclear Medicine. NVNG. Kloosterhof, 2017. ISBN: 978-90-78876-09-0
- Sánchez-Jiménez, 2017 Sánchez-Jiménez J, López-Montes A, Núñez-Martínez L, Villa-Abaunza A, Fraile LM, Sánchez-Tembleque V, Udías JM. 223Ra-dichloride spectrometric characterization: Searching for the presence of long-lived isotopes with radiological protection implications. Phys Med. 2017 Mar;35:97-101. https://doi.org/10.1016/j.ejmp.2017.02.006. Epub 2017 Feb 16. PMID: 28216330.
- Scholl, 2019 Scholl C, Bundschuh RA, Hirzebruch S, Glanert T, Wei X, Kürpig S, Rödel R, Essler M, Thomas L, Ahmadzadehfar H. Radionuclide intake risks in the clinical administration of 223RaCl2. J Radiol Prot. 2019 Jun;39(2):387-398. https://doi.org/10.1088/1361-6498/ab044d. Epub 2019 Feb 4. PMID: 30716726.
- Shultis, 2000 Shultis JK, Faw RE. Radiation Shielding. American Nuclear Society 2000.
- Siegersma, 2019 Siegersma D, et al. Potentiële stralingsbelasting na het overlijden van patiënten behandeld met radioactieve stoffen. RIVM Briefrapport 2019-0165.
Evidence tabellen
|
Biological models |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Pratt, 2018 |
Observat |
Same cohort as [Chittenden, 2015] |
Spectroscopy with high sensitivity WB counter. |
2 intravenous injections of 223Ra-dichloride 6 wk apart with an activity of 100kBq/kg whole body weight. Urine and fecal collection 48h |
6 |
B2 |
|
Grosser, 2017 |
Observat |
One patient with metastatic castration-refractory prostate cancer, with chronic renal dysfunction |
Dialysate sample measurements with scintillation detector. |
55 kBq/kg bodyweight 223Ra injected. |
1 |
B2 |
|
Chittenden, 2015 |
Observat |
Patients >57 years old with bone metastases due to castration-refractory prostate cancer |
Activity measurement in blood, urine and fecal collection |
2 intravenous injections of 223Ra-dichloride 6 wk apart with an activity of 100kBq/kg whole body weight. Blood samples until 144h after administration, urine and fecal collection 48h |
6 |
B2 |
|
Pacilio, 2016 |
Observat |
Caucasian patients with bone metastases from castration-resistant prostate cancer. |
Gamma camera measurements |
6 administrations of 50 kBq 223Ra per kg bodyweight, 4 weeks apart |
9 |
B2 |
|
Dauer, 2014 |
Observat |
Castration-resistant prostate cancer; same cohort as [Carasquillo, 2013] |
Effective half-lives based on measured dose rate readings |
223Ra administration: 3 pt with 50 kBq/kg; 3 with 100 kBq/kg; 4 with 200 kBq/kg. |
10 |
B2 |
|
Carasquillo, 2013 |
Observat |
Patients with metastatic castration-resistant prostate cancer aged 57.9 – 80.9 |
Blood samples and WB imaging. |
223Ra administration: 3 pt with 50 kBq/kg; 3 with 100 kBq/kg; 4 with 200 kBq/kg. |
10 |
B2 |
|
Aro, 2019 |
Observat |
- |
- |
- |
- |
- |
|
Scenarios |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Aro, 2019 |
Observat |
- |
- |
- |
- |
- |
|
Ooe, 2019 |
Observat |
Patients with metastatic castration-resistant prostate cancer 71.3 ± 5.4 years old |
Breath samples using breath collection bag measured with HPGe detector |
3.4 ± 0.8 MBq 223Ra administered |
6 |
B2 |
|
Counter measures |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Lassmann, 2018 |
Observat |
- |
- |
- |
- |
- |
|
Aro, 2019 |
Observat |
- |
- |
- |
- |
- |
|
Sánchez-Jiménez, 2017 |
Observat |
- |
- |
- |
- |
- |
Exclusietabel
Biological models
|
|
|
Reason for exclusion |
|
1 |
Flux, 2017 |
Focus purely on dosimetry and no additional information about biodistribution, clearance and retention of 223-Ra. |
|
2 |
Umeda, 2018 |
Focus only on uptake and no additional information about biodistribution, clearance and retention of 223-Ra. |
|
3 |
Saurat, 2018 |
Reviews three different measurement methods used after inhalation contamination events with the unsealed radiofarmaceutical. As this contains no information about the biokinetics and exposure of third persons after injection the article is excluded. |
|
4 |
Taprogge, 2019 |
Study refers to and uses a dataset (Chittenden et al) and provides no new dataset. The Chittenden study had already been selected for the biokinetics chapter and as the Taprogge et al study contains no additional information it is excluded.
|
|
5 |
Pacilio, 2016 |
Focuses purely on dosimetry and no additional information about biodistribution, clearance and retention of 223-Ra. |
Scenarios
|
|
|
Reason for exclusion |
|
6 |
Du, 2017 |
Focuses on practical recommendations for the administering of Ra-223 patiënts and not on scenario’s that lead to exposure of the surroundings of the patient |
|
7 |
Stabin, 2015 |
Focuses on three contamination events of the radiofarmaceutical before the activity has been administered and the resulting dose that medical workers can potentially receive due to these contamination events. As these scenarios are not relevant for the exposure of third parties after administration the article is excluded. |
Counter measures
|
|
|
Reason for exclusion |
|
8 |
Stabin, 2015 |
Focuses on three contamination events of the radiofarmaceutical before the activity has been administered and the resulting dose that medical workers can potentially receive due to these contamination events. As these scenarios are not relevant for the exposure of third parties after administration the article is excluded. |
|
9 |
Saurat, 2018 |
Reviews three different measurement methods used after inhalation contamination events with the unsealed radiofarmaceutical. As this contains no information about the biokinetics and exposure of third persons after injection the article is excluded. |
|
10 |
El Mantani Ordoulidis, 2018 |
Focuses only on syringes before injection and contains no information about exposure of third parties by patients after injections |
|
11 |
Scholl, 2019 |
Focuses on exposure of medical staff and not third parties |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-07-2021
Beoordeeld op geldigheid : 20-04-2021
Deze module is opgesteld door de werkgroep herziening aanbevelingen ‘het werken met therapeutische doses radionucliden’, bestaande uit afgevaardigden vanuit de NVNG, NVKF, NVS en ANVS. Er is nauw contact onderhouden met het RIVM, dat gelijktijdig het rapport [Kloosterman, 2020] schreef.
De werkgroep beveelt aan in 2026 de inhoud van deze module te beoordelen, en te overwegen of revisie of herziening gewenst is.
Doel en doelgroep
Doel
In 2005 werden de Aanbevelingen ‘Het werken met therapeutische doses radionucliden’ gepubliceerd. Deze aanbevelingen waren bedoeld als leidraad voor degenen die in de medische praktijk betrokken waren bij het werken met therapeutische doses radionucliden (met name bij 131I-therapieën). Het vormde onder andere de basis voor de normen voor ontslag van de patiënt en de leefregels die na ontslag aan de patiënt werden meegegeven met als doel de blootstelling van verzorgers en andere personen in de naaste omgeving van ontslagen patiënten zoveel als redelijkerwijs mogelijk te beperken. Heden ten dage is niet alleen het aantal behandelingen met radioactieve stoffen toegenomen maar worden naast 131I diverse andere radionucliden, zoals bijvoorbeeld 177Lu, veelvuldig voor therapie ingezet. Om ook voor de nieuwe therapieën goed onderbouwde ontslagnormen en leefregels te kunnen opstellen, heeft een werkgroep bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG), de Nederlandse Vereniging voor Klinische Fysica (NVKF) en Nederlandse Vereniging voor Stralingshygiëne (NVS) in nauwe samenwerking met vertegenwoordigers van de Autoriteit Nucleaire Veiligheid en Stralingsbescherming (ANVS) de aanbevelingen herzien.
Doelgroep
De richtlijn is bedoeld voor (medisch) specialisten uit de radiofarmacie, klinische fysica, nucleaire geneeskunde en radiochemie. Daarnaast is de richtlijn ook relevant voor verwijzers, i.e. internisten, oncologen, urologen, longartsen. Gegeven de expliciete positie van de ‘Aanbevelingen’ in de Kernenergiewet vergunning is deze richtlijn ook relevant voor de overheid en stralingsbeschermingsdeskundigen in medische centra.
Samenstelling werkgroep
Richtlijnwerkgroep
- ir. S. Rijnsdorp (voorzitter) NVKF
- Dr. D. Dieckens NVNG
- Dr. B. Godthelp ANVS
- Dr. T. van der Goot NVKF
- Ing. D.W. Rook NVS
- Drs. N.C .Veltman NVNG
Belangenverklaringen
Er zijn geen conflicterende belangen gemeld. De volledig ingevulde belangenverklaringen zijn op te vragen bij het secretriaat van de Nederlandse vereniging nucleaire geneeskunde.
Inbreng patiëntenperspectief
Gezien de zeer specialistische en technische aard van de uitgangsvragen is het perspectief van de patiënt op de aanbevelingen niet van toepassing.
Methode ontwikkeling
Evidence based
Werkwijze
Bronnen
Voor medici die deze richtlijn lezen is het goed om stil te staan bij de verschillen tussen het domein waar deze richtlijn betrekking op heeft, blootstelling aan ioniserende straling van personen in de omgeving van de patiënt buiten het ziekenhuis, ten opzichte van het gebruikelijke klinisch domein van een medisch specialistische richtlijn. Dit verschil betekent dat de literatuur en de kennis die over stralingsblootstellingen en eventuele maatregelen te vinden is verschillen kent ten opzichte van de klinisch wetenschappelijke literatuur. Waar de klinisch wetenschappelijke literatuur vooral leunt op klinische trials gericht op de vergelijking tussen interventie en reguliere zorg is die opzet niet haalbaar in het domein van de stralingsblootstellingen op grond van medisch ethische bezwaren bij een dergelijke onderzoeksopzet met blootstelling aan ioniserende straling als interventie en het meten van de schadelijke effecten daarvan als uitkomstmaat. Voor klinische studies met patiënten waarbij de stralingsblootstelling een therapeutisch effect beoogt zijn wel klinische trials beschikbaar, maar daarmee begeeft de studie zich weer in het klinisch domein en bovendien gelden ook dan aanvullende aanbevelingen ten aanzien van de stralingsblootstelling van vrijwilligers ten opzichte van reguliere klinische therapeutische verrichtingen [Radiation Protection 97, 1998]. Deze richtlijn richt zich niet op aanbevelingen ten aanzien van de klinische toepassing van therapeutische radiofarmaca. Om die reden zal niet gezocht worden naar fase 3 klinische trials als meest richting gevende referentie, aangezien die alleen bestaan voor studies naar de therapeutische effectiviteit. Dat aspect van stralingsblootstellingen wordt gedekt door de betreffende klinische richtlijnen rondom een ziektebeeld waar het gebruik van therapeutische radiofarmaca hun toepassing hebben. Deze richtlijn richt zich op de veiligheid van de toepassing van radiofarmaca voor verzorgers en leden van de bevolking. Voor de omgeving dient de patiënt beschouwd te worden als een stralingsbron met een continu veranderende activiteit door fysisch verval, het biologisch gedrag van het radiofarmacon in de patiënt en uitscheiding. De relevante literatuur om die informatie beschikbaar te krijgen gaat over biodistributie, farmacokinetiek en farmacodynamiek. Dit betreft de fase 1 en 2 studies voor een radiofarmacon. Aangezien het biologisch gedrag gerelateerd is aan de chemische eigenschappen van een stof geldt dat dit biologisch gedrag niet specifiek voor radioactieve isotopen geldt, maar ook voor de stabiele natuurlijke isotopen van een zelfde stof. Een deel van de vereiste informatie bevindt zich dus buiten het klinisch domein. Vanwege bovenstaande is de gebruikelijke classificatietabel voor het graderen van de bewijskracht van gevonden literatuur uit de EBRO of GRADE methodologie niet toepasbaar. Wel is een alternatieve weging van bronnen gebruikt zoals hierna beschreven om in de geest van EBRO te blijven werken.
In belangrijke mate is de informatie waarmee bepaald kan worden wat de blootstelling van de omgeving is, gebaseerd op fysische eigenschappen van ioniserende straling, radioactieve stoffen en afscherming. Voor de afscherming die wordt veroorzaakt door het lichaam van de patiënt is in de berekeningen gekozen om als benadering van de werkelijkheid het menselijk lichaam opgebouwd te zien uit een laag water. De bedoelde grootheden zijn grotendeels bekende waarden waarvoor het toepassen van een graderingsschaal niet zinvol is. De beschrijving van de toegepaste zoektermen en de documentatie over inclusie en exclusie van literatuur inclusief het onderliggend argument zijn wel uitgevoerd.
De literatuursearches zijn uitgevoerd in Pubmed omdat via deze database, zowel geneeskundige literatuur als ook de fysische, biologische en biofysische literatuur beschikbaar is. Daarnaast is rekening gehouden met de kaders en normen van de wetgeving, meer specifiek de Kernenergiewet [KEW, 1963] en het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018]. Dit besluit is een uitwerking van de Europese Richtlijn 2013/59/Euratom van 5 december 2013 [Euratom, 2013]. In deze Europese Richtlijn staat de volgende overweging:
“(27) De besmetting van het milieu kan een bedreiging voor de menselijke gezondheid vormen. In de secundaire wetgeving van de Gemeenschap is die besmetting tot nog toe alleen beschouwd als blootstellingsroute voor de leden van de bevolking die rechtstreeks getroffen zijn door de lozing van radioactieve afvalstoffen in het milieu. Aangezien de staat waarin het milieu zich bevindt de menselijke gezondheid op de lange termijn kan beïnvloeden, is beleid vereist dat het milieu beschermt tegen de schadelijke gevolgen van ioniserende straling. Ten behoeve van de bescherming van de menselijke gezondheid op de lange termijn dient rekening te worden gehouden met milieucriteria die zijn gebaseerd op internationaal erkende wetenschappelijke gegevens (zoals gepubliceerd door de EC, de ICRP, de Wetenschappelijke Commissie van de Verenigde Naties inzake de gevolgen van atoomstraling, de Internationale Organisatie voor Atoomenergie (IAEA)).”
Ten aanzien van de blootstelling van het milieu waarnaar gerefereerd wordt zijn er in deze richtlijn geen specifieke berekeningen en aanbevelingen gedaan ten aanzien van het beschermen van het milieu voor blootstelling aan ioniserende straling. De reden daartoe is dat met het naleven van leefregels ter reductie van de blootstelling van derden vanzelf aan de huidige normering voor het milieu wordt voldaan. Als er naar bijvoorbeeld één behandeling met 177Lu-PSMA wordt gekeken, wordt er bij lozing van 100% van de toegediende activiteit niet meer dan 0,05 Reing geloosd door de patiënt thuis. Dit betekent dat dit zonder vergunning geloosd mag worden. Trends zullen wel in de gaten gehouden moeten worden, maar op dit moment is er geen toegevoegde waarde voor aparte aanbevelingen ten aanzien van het milieu.
In de overige paragrafen van de Europese Richtlijn worden de specifieke publicaties van bovenstaande organisaties, bron van de bedoelde “internationaal erkende wetenschappelijke gegevens”, meerdere malen aangehaald. De richtlijnwerkgroep heeft daarom deze passage geïnterpreteerd als generieke verwijzing naar de huidige (en mogelijk toekomstige) publicaties door genoemde organisaties die betrekking hebben op stralingsblootstelling van leden van de bevolking. Daarmee geeft de Europese Raad dus aan dat regelgeving binnen de lidstaten gebaseerd dient te zijn op de wetenschappelijke gegevens die geleverd worden via deze organisaties, waarbij 2013/59/Euratom zelf deze gegevens al (grotendeels) samengebracht heeft in een format voor implementatie tot wetgeving binnen de EU lidstaten. De relatie tussen Euratom en het IAEA is dat de aanbevelingen (Safety Standards) van het IAEA als basis gelden voor mogelijke wetgeving en daarom zullen worden geïmplementeerd via Euratom richtlijnen. IAEA baseert haar Safety Standards weer primair op de ICRP publicaties.
Om deze redenen zijn de dosisnormen, voor zover vermeld in deze publicaties, overgenomen in volgorde van meest directe relatie met geldende Nederlandse wetgeving: 1) KEW en Besluit basisveiligheidsnormen stralingsbescherming 2) Euratom 3) IAEA, en 4) ICRP. Voor de fysische en biologische eigenschappen zijn zoekopdrachten in Pubmed uitgevoerd. Vooral voor het vinden van gegevens over biologisch gedrag en maatregelen ter bescherming tegen straling zijn deze zoekopdrachten relevant, aangezien die maar beperkt of niet beschreven zijn in bovenstaande publicaties. Ook zijn er zoekopdrachten uitgevoerd voor de wel beschreven eigenschappen, maar dan beperkt tot de periode na de zoekdatum van de betreffende publicaties om te verifiëren dat er niet al nieuwe inzichten zijn ontstaan.
Bij het beoordelen van de kwaliteit van de literatuur die is gevonden middels zoekopdrachten in Pubmed, is onderscheid gemaakt tussen hoge kwaliteit en lage kwaliteit van het uitgevoerde onderzoek. Kenmerken die iets classificeren als hoge of lage kwaliteit zijn terug te zien in Tabel 1, waarbij voldoen aan ≥ 2 kenmerken beschouwd wordt als hoge kwaliteit.
Tabel 1: beoordelingscriteria voor de kwaliteit van gevonden literatuur
|
Kenmerk |
Hoge kwaliteit |
Lage kwaliteit |
|
onderwerp |
mensen |
dieren |
|
opzet |
experimenteel |
observationeel |
|
methode |
reproduceerbaar |
niet reproduceerbaar |
Omdat wet- en regelgeving vóór eigen wetenschappelijk inzicht van de professional in de stralingsbescherming gaat, is onderstaande volgordelijkheid aangehouden op basis van autoriteit van de gevonden gegevens met van boven naar beneden hogere waarde naar mindere waarde. De gradering van de gebruikte bronnen en daarmee de bewijskracht is conform Tabel 2. Hierbij geldt niet zozeer wetenschappelijke maar meer juridische bewijskracht.
Tabel 2: gradatie in kwaliteit van geïncludeerde bronnen
|
Bbs/KEW |
A1 |
|
Richtlijn 2013/59/Euratom |
A2 |
|
IAEA |
A3 |
|
ICRP |
A4 |
|
Pubmed hoge kwaliteit |
B1 |
|
Pubmed lage kwaliteit |
B2 |
Vragen voor zoekopdrachten
De aanbevelingen in deze richtlijn dienen gebaseerd te zijn op het mortaliteitsrisico en/of morbiditeitsrisico per toepassing van een radiofarmacon per scenario voor leden van de bevolking (anderen dan de patiënt zelf en de betrokken zorgprofessionals). Deze getallen zijn bekend voor de stralingsblootstelling uitgedrukt in Sv [ICRP 103, 2007]. Extra aandacht verdient de beoordeling van deze waarden tussen verschillende leeftijdsgroepen. Voor het bepalen van de blootstelling zijn gegevens nodig over:
A. de samenstelling van een radiofarmacon, inclusief contaminatie met moeder/dochter/zuster-isotopen
B. de hoeveelheid activiteit in de patiënt in de loop van de tijd I) voor de activiteit in de loop van de tijd hebben we het biologisch model van een radiofarmacon in de patiënt nodig (inclusief de contaminatie isotopen). II) de fysische halveringstijden
C. de afscherming van de straling door het lichaam van de patiënt
D. de afstanden tot de activiteit
E. tijdstip van blootstelling t.o.v. tijdstip van toediening en blootstellingsduur
F. omgevingsdosisequivalenttempoconstanten per radionuclide.
G. dosisconversieconstanten voor ingestie per radionuclide
Voor onderdelen D en E dienen de relevante scenario’s (zie hieronder) bekend te zijn.
De literatuurstudie beoogt bovenstaande gegevens boven tafel te krijgen. Gedeeltelijk is dat opzoeken van bekende fysische eigenschappen (fysische halveringstijden, massieke verzwakkingscoëfficiënten van water, omgevingsdosisequivalenttempoconstanten), te halen uit het scenario (tijdstip van blootstelling t.o.v. tijdstip van toediening, blootstellingsduur, afstanden tot de activiteit) en literatuurzoekopdrachten in de eerder beschreven bronnen (biologische modellen). De scenario’s zijn ontleend aan de RIVM-publicatie ‘Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden’ [Kloosterman, 2020], waarbij deze scenario’s zijn gebaseerd op SCP-studie ‘Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven’ [Roeters, 2018].
Ook de inventarisatie van maatregelen waarmee de blootstelling kan worden verlaagd, is iets wat gebaat kan zijn bij een literatuurzoekopdracht. Deze maatregelen zijn niet radiofarmaconspecifiek. Aspecten die daarin dienen te worden meegenomen zijn maatregelen die zich richten op:
- klaring via verschillende uitscheidingsroutes
- inname via ingestie/inhalatie door derden
- afscherming voor gamma-/beta-/alfa-straling
- afstand tot de patiënt
De vragen voor de literatuurzoekopdrachten zullen per radiofarmacon worden uitgevoerd en zijn gericht op onderstaande 3 onderdelen:
- biologische model
- scenario’s
- stralingsbeschermingsmaatregelen
Berekeningen
Voor de te verrichten berekeningen conform de rekenmethode [Kloosterman, 2020] zijn fysische en dosimetrische parameters nodig die in de meeste gevallen tabulair gepubliceerd zijn. Primaire bron hierbij zijn de IAEA- en ICRP-publicaties. Bij het zoeken naar de vereiste waarden voor de benodigde rekenvariabelen bleek dat deze niet altijd terug te vinden waren voor alle in deze richtlijn behandelde radiofarmaca. Om die reden zijn ook andere bronnen gebruikt om de dataset compleet te krijgen. Hetzelfde gold voor de afschermingseigenschappen voor het materiaal water voor de verschillende fotonenergieën. Deze bronnen werden verkregen doordat ze al bekend waren bij een of meer van de leden van de werkgroep, op basis van opzoeken van de data safety sheets van radiofarmaca door fabrikanten en door generieke online searches middels Google.
Reeds bekend bij de leden of gevonden via bovenstaande methode zijn de volgende bronnen:
- Atomic and Nuclear Data from the French Laboratoire National Henri Becquerel (http://www.lnhb.fr/nuclear-data/nuclear-data-table)
- The RadPro Calculator (http://www.radprocalculator.com/Gamma.aspx)
- National Institute of Standards and Technology U.S. Department of Commerce (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
- Radiological Protection Ordinance of 22 june 1994 from the Swiss Federal Council (https://www.admin.ch/opc/en/classified-compilation/19940157/201401010000/814.501.pdf)
- Dose distributions in the ICRU sphere for monoenergetic photons and electrons and for ca. 800 radionuclide. Petoussi N, Zankl M, Fehrenbacher G, Drexler G. Institut für Strahlenschutz. GSF-Bericht 7/93 (https://push-zb.helmholtz-muenchen.de/deliver.php?id=10991)
- Personal Dose-equivalent conversion coefficients for 1252 radionuclides. T. Otto. Radiation Protection Dosimetry. 2016, vol 168, No 1: p1-70.
- Radiation Shielding. Shultis JK, Faw RE. Amer Nuclear Society. 2000
- X-Ray Mass Attenuation Coefficients for Water (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
Ten aanzien van de berekeningen die zijn toegepast zij verwezen naar de Rekentool waar zowel de gebruikte bronnen als de rekenformules zijn gegeven. Ook de rekenkundige definitie van de transmissie van gammastraling door het lichaam van de patiënt (ftli) die in de Tabel met gehanteerde parameters voor de berekeningen wordt gegeven bij iedere module wordt daar toegelicht.
Maatregelen
Na het in kaart brengen van bovenstaande gegevens is de volgende stap het beoordelen welke factoren de meeste invloed hebben op reductie van de stralingsblootstelling. Hiertoe zijn berekeningen uitgevoerd, opgebouwd middels een blootstellingscenario gebaseerd op de SCP-tijdsbestedingsscenario’s [Roeters, 2018]. Deze werkwijze is ook toegepast in het rekenmodel dat is ontwikkeld door het RIVM voor het rapport ‘Nucleair-geneeskundige therapieën: potentiële blootstellingen voor derden’ [Kloosterman, 2020]. De principes van dit RIVM-rekenmodel zijn overgenomen in de Rekentool die is ontwikkeld voor deze richtlijn. Rechtstreeks overnemen van het rekenmodel van het RIVM bleek niet mogelijk doordat daarin de transmissiefactor is ontleend
aan het programma Nucleonica waarover de richtlijnwerkgroep niet de beschikbaarheid had en dat ook gezien moet worden als ‘blackbox’. Dit tast de reproduceerbaarheid en mogelijkheid tot updaten van waarden op basis van nieuwe literatuur aan. In de Rekentool bij deze Richtlijn is daarom een berekende transmissiefactor gehanteerd. Door de scenario-gebaseerde berekeningen wordt inzichtelijk welke handelingen binnen dat scenario verantwoordelijk zijn voor het belangrijkste deel van de totale blootstelling. Hierdoor is optimale selectie van maatregelen ter reductie van de blootstelling mogelijk. In de aanbevelingen die zijn geformuleerd zijn de meest relevante en generieke maatregelen benoemd. Daarnaast is de Rekentool die is ontwikkeld voor deze berekeningen eveneens beschikbaar gesteld. Met deze rekenbladen kunnen in de dagelijkse praktijk meer specifieke scenario’s worden uitgewerkt evenals het effect van meer specifieke maatregelen. Op deze wijze kan er in de nucleair geneeskundige praktijk meer ‘Patient Tailored Medicine’ bedreven worden zonder dat dit leidt tot grotere gezondheidsrisico’s ten gevolge van stralingsblootstelling voor verzorgers en leden van de bevolking.
Rekenbladen
Ter ondersteuning van het gebruik van de rekenbladen is voorwaardelijke opmaak gebruikt die een signaalfunctie heeft ten aanzien van de mate van blootstelling totaal of voor een specifiek scenario. Hierbij is een kleurgradient gecreëerd die loopt van een gekozen minimale grenswaarde in de kleur geel naar een gekozen maximale grenswaarde in rood. Deze grenswaarden zijn deels gebaseerd op de in de inleiding genoemde normen voor blootstellingen [Radiation Protection 97, 1998]. Voor de goede orde zij vermeld dat de kleurencodes geen dwingend karakter hebben en alleen fungeren als signalering. Wel geldt dat de kleur rood bij de totale dosis aangeeft dat de normen voor blootstelling worden overschreden. De overige gekozen grenswaarden zijn, met uitzondering van de waarden voor een ‘Derde’, afgeleide waarden waarbij voor > 10% van de norm voor totale blootstelling is gekozen voor de kleur geel in Tabel 3. Voor een ‘Derde’ is 10% van de norm voor de totale dosis gelijk aan 0,03 mSv. Dat is dermate laag voor een totale blootstelling dat het weinig toevoegt om op die waarde een signalering te geven. Daarom is er door de richtlijnwerkgroep gekozen om die waarde op minimaal 0,1 mSv te laten. Voor de afzonderlijke handelingen in Tabel 4 is voor de kleur rood gekozen bij een waarde > 10% van de norm voor de totale blootstelling. De kleur geel geldt dan voor waarden > 1% van de norm voor de totale blootstelling. Uitzondering hierbij zijn de signaleringswaarden voor een ‘Derde’ aangezien dat gaat om anderen dan ‘familie en vrienden’ en er dus in de regel altijd slechts sprake is van een blootstelling via slechts 1 handeling. Daarom is de grenswaarde voor een handeling hetzelfde als voor de totale dosis aangezien de laatste op de eerste gebaseerd is.
Tabel 3: gekozen grenswaarden voor totale blootstelling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,1 mSv |
|
|
≥ 1 mSv |
≥ 3 mSv |
≥ 15 mSv |
≥ 0,3 mSv |
|
Tabel 4: gekozen grenswaarden voor blootstelling per afzonderlijke handeling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,01 mSv |
≥ 0,03 mSv |
≥ 0,15 mSv |
≥ 0,1 mSv |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,3 mSv |
|
Radiation Protection 97 geeft geen grenswaarden voor de huiddosis. Om die toch vast te stellen is gekeken naar de relatie tussen de vastgestelde dosislimieten in het Bbs tussen leden van de bevolking en blootgestelde medewerkers. Daarbij gaat de dosislimiet voor de blootgestelde medewerker voor de totale dosis van 1 mSv naar 20 mSv ten opzichte van een lid van de bevolking (verhouding 1:20) en voor de huiddosis gaat deze van 50 mSv naar 500 mSv (verhouding 1:10), zie Bbs artikel 7.34.2 vs. 9.1.1 [Bbs, 2018]. Daarmee kan worden vastgesteld dat de correctiefactor van de dosislimiet voor de huiddosis gelijk is aan de helft van de correctiefactor voor de totale dosis. Voor de correctie van de dosislimiet voor de totale dosis bij een derde na een behandeling (0,3 mSv in plaats van 1 mSv) is de onderliggende ratio de herhaalkans per jaar op een blootstelling van een derde aan een patiënt die is behandeld met een radiofarmacon. Die herhaalkans is voor zowel de totale dosis als de huiddosis gelijk. Daarom is de correctiefactor (0,3) daarvoor aan elkaar gelijkgesteld. Daarmee worden de gehanteerde grenswaarden voor de huiddosis zoals gegeven in Tabel 5.
Tabel 5: gekozen grenswaarden voor huiddosis
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 5 mSv |
≥ 7,5 mSv |
≥ 37,5 mSv |
≥ 1,5 mSv |
|
|
≥ 50 mSv |
≥ 75 mSv |
≥ 375 mSv |
≥ 15 mSv |
|
Deze kleurgradient heeft een signaalfunctie om aan te geven waar de meeste winst te halen is ten aanzien van het reduceren van blootstelling en via de kleurovergangen ook de oplopende wenselijkheid om in ieder geval te beoordelen of er maatregelen mogelijk zijn om de blootstelling te reduceren. Daarbij dient wel in alle gevallen de afweging gemaakt te worden of de winst voor leden van de bevolking opweegt tegen de overlast voor de patiënt. Ook hierbij geldt het principe van redelijkheid en de graduele aanpak zoals verwoord in Euratom 2013/59 [Euratom, 2013].
Literatuur
- [Bbs, 2018] Besluit basisveiligheidsnormen stralingsbescherming. nr. IENM/BSK-2017/135624; Staatsblad nr. 404, 2017
- [Euratom, 2013] Euratom/2013/59 van de Raad 2013. (2013 5 december).
- [ICRP 103, 2007] Annex A of ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP publication 103. Ann. ICRP 37 (2-4). 2007
- [KEW, 1963] Kernenergiewet 1963. (1963 21 februari).
- [Kloosterman, 2020] Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- [NCS, 2016] Human Exposure to Ionising Radiation for Clinical and Research Purposes NCS 26, mei 2016
- [RP 97, 1998] European Commission, Directorate-General Environment, Nuclear Safety and Civil Protection. Radiation Protection following Iodine-131 therapy (exposures due to out-patients or discharged in-patients). 1998
- [Roeters, 2018] Roeters, A., Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven. SCP, 2018
Zoekverantwoording
De in PubMed gehanteerde zoekopdrachten zijn:
(ra-223 OR 223-ra OR 223ra OR radium-223 OR 223-ra) AND (biologic* OR excretion* OR retention*)
(ra-223 OR 223-ra OR 223ra OR radium-223 OR 223-ra) AND (scenario* OR pathway*)
(ra-223 OR 223-ra OR 223ra OR radium-223 OR 223-ra) AND (measures* OR restrict* OR expos* OR instruct*)
