Blootstelling van derden bij therapie met 131I
Uitgangsvraag
Zijn maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 131I redelijkerwijs noodzakelijk?
Indien de uitgangsvraag positief wordt beantwoord:
Welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 131I zijn redelijkerwijs noodzakelijk?
Aanbeveling
Uitgaande van het generieke, conservatieve model en een generiek scenario worden de normen voor blootstelling zoals beschreven in de algemene inleiding op de richtlijn niet overschreden. Desondanks kan vanuit ALARA principe worden aanbevolen om de dag van toediening en daaropvolgende nacht leefregels aan te houden, gezien de snelle klaring van het deel van de activiteit dat niet wordt opgenomen in de schildklier. Op basis van bovenstaande overwegingen worden de volgende aanbevelingen gedaan:
Aanbevelingen benigne schildklieraandoeningen
In geval van het generieke scenario en het generieke biokinetisch model zijn maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling aanbevolen. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Geef de patiënt en indien van toepassing de verzorger mondelinge en schriftelijke instructies met betrekking tot stralingshygiëne ter beperking van blootstelling van derden. Daarin moet tenminste terugkomen dat gedurende 3 dagen na toediening
- De patiënt alert dient te zijn op (toilet)hygiëne:
- indien mogelijk een eigen toilet reserveren
- zittend gebruikmaken van het toilet
- tweemaal doorspoelen na gebruik van het toilet
- handen wassen na gebruik van het toilet
- eventuele besmetting met lichaamsvloeistoffen en/of uitscheiding zelf opruimen
- Medebewoners en gasten alert dienen te zijn op (toilet)hygiëne:
- handen wassen na gebruik van het toilet
- wegwerphandschoenen gebruiken bij schoonmaken van het toilet
Daarin moet tenminste terugkomen dat gedurende 1 week na toediening
- De patiënt afstand dient te bewaren tot huisgenoten:
- gescheiden slapen
- afstand bewaren tijdens sociale activiteiten
- De patiënt situaties dient te vermijden waarbij gedurende meer dan 1 uur eenzelfde persoon zich op minder dan 1 meter afstand bevindt, waaronder:
- bezoeken van voorstellingen, sportwedstrijden, horecagelegenheden en dergelijke
- gebruiken van het openbaar vervoer of taxi en dergelijke
- (kantoor)werk en klassikale scholing
Laat de eerste urinelozing met activiteit bij voorkeur plaatsvinden op de afdeling nucleaire geneeskunde. Vraag de patiënt de blaas te ledigen voor toediening.
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen drie dagen na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 45 dagen na therapie is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Aanbevelingen maligne schildklieraandoeningen
Uitgaande van het generieke, conservatieve model en een generiek scenario worden de normen voor blootstelling zoals beschreven in de algemene inleiding op de richtlijn overschreden. Derhalve dienen maatregelen ter beperking van de blootstelling van derden te worden genomen. Gezien de variatie tussen patiënten wordt aanbevolen om de individuele biokinetiek te bepalen en op basis van leefomstandigheden van de patiënt in te schatten tot welk moment maatregelen benodigd zijn. Op basis van bovenstaande overwegingen worden de volgende aanbevelingen gedaan:
In geval van het generieke scenario en het generieke biokinetisch model zijn maatregelen en/of leefregels ten behoeve van het beperken van externe of inwendige blootstelling vereist. Onderbouw in afwijkende situaties op basis van berekening met de daarvoor bestemde rekentool welke maatregelen en/of leefregels benodigd zijn om te borgen dat dosisbeperkingen niet worden overschreden.
Voor patiënten die behandeld worden met 131I voor maligne schildklieraandoeningen dient een opnameperiode van tenminste 24 uur te worden gehanteerd. Indien op basis van het gemeten externe dosistempo, de persoonlijke leefomstandigheden van de patiënt en berekeningen met de rekentool kan worden aangetoond dat de potentiële blootstelling van derden binnen de dosisbeperkingen blijft, kan ontslag eerder plaatsvinden.
Geef de patiënt en indien van toepassing de verzorger mondelinge en schriftelijke instructies met betrekking tot stralingshygiëne ter beperking van blootstelling van derden. Daarin moet tenminste terugkomen dat gedurende een week na toediening
- De patiënt alert dient te zijn op (toilet)hygiëne:
- indien mogelijk een eigen toilet reserveren
- zittend gebruikmaken van het toilet
- tweemaal doorspoelen na gebruik van het toilet
- handen wassen na gebruik van het toilet
- eventuele besmetting met lichaamsvloeistoffen en/of uitscheiding zelf opruimen
- Medebewoners en gasten alert dienen te zijn op (toilet)hygiëne:
- handen wassen na gebruik van het toilet
- wegwerphandschoenen gebruiken bij schoonmaken van het toilet
Daarin moet tenminste terugkomen dat gedurende een week na toediening
- De patiënt afstand dient te bewaren tot huisgenoten:
- gescheiden slapen
- afstand bewaren tijdens sociale activiteiten
- De patiënt situaties dient te vermijden waarbij gedurende meer dan 1 uur eenzelfde persoon zich op minder dan 1 meter afstand bevindt, waaronder:
- bezoeken van voorstellingen, sportwedstrijden, horecagelegenheden en dergelijke
- gebruiken van het openbaar vervoer of taxi en dergelijke
- (kantoor)werk en klassikale scholing
Overweeg of het nodig is een vliegbrief mee te geven. De noodzaak hiervan hangt af van patiëntspecifieke gegevens zoals de activiteit, het toegediende radiofarmacon en het moment van reizen.
Om te bepalen of een vliegbrief noodzakelijk is kan gebruik gemaakt worden van de rekentool van de Nederlandse Commissie voor Stralingsdosimetrie (NCS):
Zwangerschap is een contra-indicatie voor deze therapie. Borstvoeding dient te worden gestaakt.
Geef de patiënt de instructie dat bij bezoek aan een zorgverlener binnen een week na toediening moet worden aangegeven dat de patiënt therapie met radiofarmaca heeft ondergaan en dat de zorgverlener voor verdere informatie contact kan opnemen met de behandelend arts.
Bij overlijden binnen 58 dagen na therapie is maatwerk met betrekking tot stralingshygiënische aspecten benodigd. Wijs de patiënt en indien van toepassing de verzorger dienen erop dat mogelijk beperkingen met betrekking tot lijkbezorging zullen gelden.
Overwegingen
Biokinetisch model benigne schildklieraandoeningen
Literatuuronderzoek naar de biodistributie van 131I bij behandeling van benigne schildklieraandoeningen wijst uit dat de uptake en effectieve halveringstijd in de schildklier sterk varieert tussen patiënten. Derhalve doet een generiek model over het algemeen geen recht aan de individuele situatie. De meeste literatuur beschrijft de uptake in de schildklier en de effectieve halveringstijd van deze fractie, aangezien deze informatie relevant is voor de uitkomst van de therapie, maar laat klaring uit het lichaam buiten beschouwing.
Twee artikelen beschrijven de biokinetiek voor het hele lichaam. Het tweecompartimentenmodel van Hänscheid et al. [Hänscheid, 2011] komt goed overeen met het model dat door het RIVM wordt gehanteerd. Ook de bevinding van Liu [Liu, 2015] dat de effectieve halveringstijd voor 131I niet opgenomen in de schildklier 5,1 uur bedraagt is in lijn met het model dat door het RIVM wordt gehanteerd, zie Figuur 1. Daarbij dient aangetekend te worden dat zowel het model van Hänscheid als dat van Liu is opgesteld op basis van metingen na toediening van een tracerdosis. Kobe et al. beschrijven verschillen tussen de effectieve halveringstijd bij een tracer- en therapeutische dosis van om en nabij een dag [Kobe, 2009]. Op basis van die bevinding kan worden gesteld dat metingen op basis van een therapeutische dosis een betere inschatting van de biokinetiek geven.
Overige literatuur beschrijft in het algemeen de uptake van 131I, vaak 24 uur na toediening, en de effectieve halveringstijd van 131I in de schildklier. Daar in deze studies geen uitspraken worden gedaan over de effectieve halveringstijd van de fractie toegediend 131I die niet wordt opgenomen in de schildklier zijn deze niet direct te vertalen naar een volledig biokinetisch model. Uit de literatuur blijkt een sterke variatie in zowel uptake als effectieve halveringstijd van 131I in de schildklier.
Op basis van de maximale schildklieruptake en de effectieve halveringstijd in de schildklier en de rest van het lichaam kan een inschatting van het verloop van het dosistempo worden gemaakt. Indien die gegevens niet beschikbaar zijn, is in het kader van stralingsbescherming voor derden een realistische maar conservatieve inschatting van schildklieruptake en effectieve halveringstijd in de schildklier aanbevolen.
Daar de activiteit accumuleert in de schildklier en de schildklier oppervlakkig gelegen is, wordt aangenomen dat er geen afscherming of build-up plaatsvindt en wordt ftli op 1 gesteld.
Tabel 2: eigenschappen van 131I
|
hfoton(10) (µSv·h-1·GBq-1 op 1 m) [Otto, 2016] |
67 |
|
hfoton(0.07) (mSv·h-1·GBq-1 op 10 cm) [Otto, 2016] |
3,4 |
|
hhuidbesmetting(0.07) (mSv·h-1·kBq-1cm2) [Petoussi, 1993] |
1,39 |
|
DCCingestie (Sv·Bq-1) [ICRP 119, 2012] |
2,2·10-8 |
|
T1/2,fys (h) [ICRP 119, 2012] |
193 |
|
Vrijstellingswaarde activiteitsconcentratie (kBq·kg-1) [Bbs, 2018] |
1·102 |
|
Vrijstellingswaarde activiteit (Bq) [Bbs, 2018] |
1·106 |
Tabel 3: gehanteerde parameters voor berekening van de potentiële blootstelling bij behandeling van benigne schildklieraandoeningen met 131I
|
Therapie |
T1/2,biol (uur) |
Interval (h na toediening) |
T1/2,biol (uur) |
Interval (h na toediening) |
ftli |
|
131I benigne |
16,1
|
0 - 17,1 |
315 |
> 17,1 |
1 |
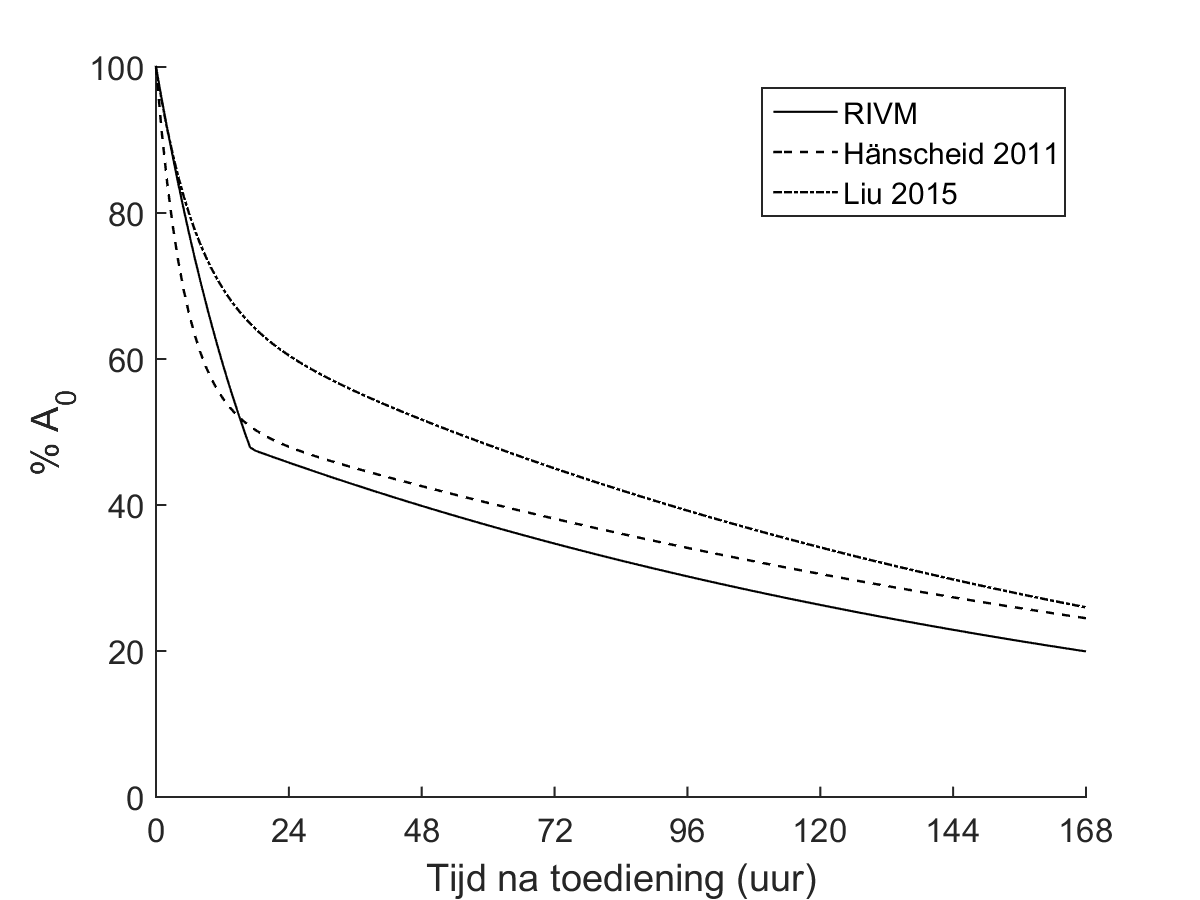
Figuur 1: biokinetisch model voor therapie met 131I (natriumjodide) voor benigne schildklieraandoeningen, op basis van biologisch en fysisch verval (Tabel 3) ten behoeve van het bepalen van de externe blootstelling.
Biokinetisch model maligne schildklieraandoeningen
Literatuuronderzoek naar de biodistributie van 131I bij behandeling van maligne schildklieraandoeningen wijst uit dat de biokinetiek sterk varieert. Derhalve doet een generiek model over het algemeen geen recht aan de individuele situatie. De meeste literatuur beschrijft de halveringstijd van 131I in het gehele lichaam van de patiënt. Over het algemeen wordt een gemiddelde halveringstijd van minder dan 20 uur gerapporteerd, waarbij de gerapporteerde spreiding aanzienlijk is. Het RIVM-model [Kloosterman, 2020] veronderstelt dat vanaf 120 uur na toediening geen biologische klaring meer plaatsvindt vanwege het ontbreken van experimentele waarden en is derhalve een conservatief model. In Figuur 2 wordt gevisualiseerd dat het RIVM-model aan de bovenzijde ligt van het spectrum dat in de literatuur wordt beschreven.
Daar de toegediende activiteit door het hele lichaam verspreidt, wordt de ioniserende straling deels afgeschermd en vindt build-up plaats. Op basis van de geometrische progressiebenadering formule [Shultis, 2000] voor het berekenen van de build-up, conversiecoëfficienten voor verschillende fotonenergieën en het vervalschema is de transmissie en build-up ftli berekend. In de berekening is aangenomen dat de patiënt een diameter van 30 centimeter heeft.
Tabel 4: eigenschappen van 131I
|
hfoton(10) (µSv·h-1·GBq-1 op 1 m) [Otto, 2016] |
67 |
|
hfoton(0.07) (mSv·h-1·GBq-1 op 10 cm) [Otto, 2016] |
3,4 |
|
hhuidbesmetting(0.07) (mSv·h-1·kBq-1cm2) [Petoussi, 1993] |
1,39 |
|
DCCingestie (Sv·Bq-1) [ICRP 119, 2012] |
2,2·10-8 |
|
T1/2,fys (h) [ICRP 119, 2012] |
193 |
|
Vrijstellingswaarde activiteitsconcentratie (kBq·kg-1) [Bbs, 2018] |
1·102 |
|
Vrijstellingswaarde activiteit (Bq) [Bbs, 2018] |
1·106 |
Tabel 5: gehanteerde parameters voor berekening van de potentiële blootstelling bij behandeling van maligne schildklieraandoeningen met 131I
|
Therapie |
T1/2,biol (h) |
Interval (h na toediening) |
T1/2,biol |
Interval (h na toediening) |
ftli |
|
131I maligne |
22,3 |
0 - 120 |
∞ |
> 120 |
1,01 |
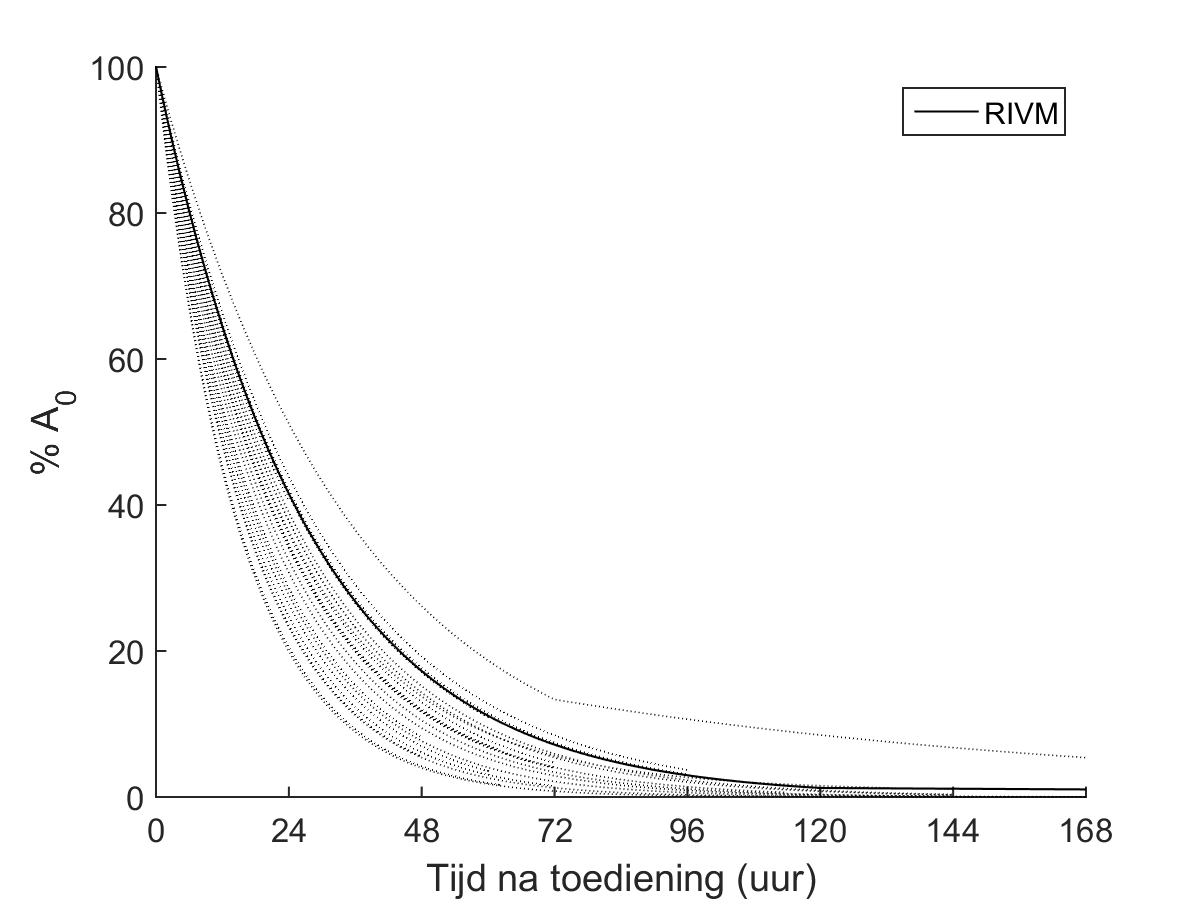
Figuur 2: biokinetisch model voor therapie met 131I (natriumjodide) voor maligne schildklieraandoeningen, op basis van biologisch en fysisch verval (Tabel 5) ten behoeve van het bepalen van de externe blootstelling.
Externe blootstelling benigne schildklieraandoeningen
Aangezien de verhouding tussen de dosisequivalenttempoconstante voor de huid h(0.07) en voor het lichaam h(10) kleiner is dan de verhouding tussen de dosisbeperking voor de huid en het lichaam wordt de effectieve dosis als beperkende factor beschouwd.
De blootstellingscenario’s in het RIVM-rapport [Kloosterman, 2020] zijn gehanteerd als uitgangspunt bij het bepalen van de externe blootstelling. Bij toediening van 1 GBq 131I bedraagt de conservatief berekende externe blootstelling in de ordegrootte van meerdere mSv voor verzorgers, kinderen of derden (Appendix B1) gedurende de eerste 21 dagen na ontslag en ontslag 2 uur na toediening wanneer geen leefregels in acht worden genomen. Op basis van het generieke rekenmodel kan worden gesteld dat bij toediening van 1,0 GBq 131I de dosisbeperkingen van kinderen, verzorgers en derden niet wordt overschreden indien gedurende een week na ontslag leefregels zoals gescheiden slapen en het houden van afstand tijdens gezamenlijke activiteiten in acht worden genomen (Appendix B2).
Externe blootstelling maligne schildklieraandoeningen
Aangezien de verhouding tussen de dosisequivalenttempoconstante voor de huid h(0.07) en voor het lichaam h(10) kleiner is dan de verhouding tussen de dosisbeperking voor de huid en het lichaam wordt de effectieve dosis als beperkende factor beschouwd.
De blootstellingscenario’s in het RIVM-rapport [Kloosterman, 2020] zijn gehanteerd als uitgangspunt bij het bepalen van de externe blootstelling. Bij toediening van 7,4 GBq 131I bedraagt de conservatief berekende externe blootstelling in de ordegrootte van meerdere mSv voor verzorgers, kinderen of derden (Appendix B3) gedurende de eerste 21 dagen na ontslag en ontslag 2 uur na toediening wanneer geen leefregels in acht worden genomen. Op basis van het generieke rekenmodel kan worden gesteld dat bij toediening van 7,4 GBq 131I de dosisbeperkingen van kinderen, verzorgers en derden niet wordt overschreden indien gedurende een week na ontslag en ontslag 24 uur na toediening leefregels zoals gescheiden slapen en het houden van afstand tijdens gezamenlijke activiteiten in acht worden genomen (Appendix B4).
Besmetting en ingestie benigne schildklieraandoeningen
Vanwege de renale klaring kan huidbesmetting met een druppel urine voorkomen; bijvoorbeeld wanneer een druppel urine is gemorst op de toiletbril, of via de patiënt op een oppervlakte terecht is gekomen. Om de ordegrootte van de huiddosis te schatten, wordt de activiteit in een druppel geschat:
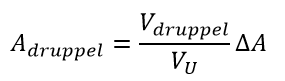
met Adruppel de activiteit in een druppel, Vdruppel het volume van een druppel, VU urineproductie in een tijdsinterval en ΔA de activiteit die biologisch wordt geklaard in dat tijdsinterval. Bij een druppel van 50 µl, 1000 ml urineproductie in 24 uur en een maximale biologische klaring van 50% in de eerste 24 uur na toediening (Figuur 1) bedraagt de activiteit in een druppel 25 kBq bij een toegediende activiteit van 1 GBq. Bij de dosisequivalenttempoconstante voor huidbesmetting van 1,39 mSv·cm2·h-1·kBq-1 levert een huidbesmetting van 1 cm2 met 10% van de activiteit in de druppel urine persisterend op de huid een huiddosis van 3,5 mSv·h-1.
Indien de huidbesmetting onopgemerkt blijft, kan deze leiden tot ingestie. Ingestie van 10% van de activiteit in de hierboven beschreven druppel leidt tot een effectieve volgdosis van 55 µSv voor volwassenen.
Omdat de activiteit via de urine geklaard wordt, bestaat er een reële kans op een huidbesmetting. Gezien de huiddosis van 3,5 mSv·h-1 zijn toilethygiënische maatregelen ter voorkoming van huidbesmettingen en reductie van de duur van de huidbesmetting essentieel. Op basis van de literatuur kan gesteld worden dat de biologische klaring met name gedurende de eerste 24 uur na toediening plaatsvindt. Om die reden kan gesteld worden dat de eerste mictie na toediening bij voorkeur op de afdeling nucleaire geneeskunde moet plaatsvindt, en dat de patiënt kort voor de toediening de blaas moet hebben geledigd. Omdat de potentiële blootstelling voor kinderen, verzorgers en derden ten gevolge van een besmetting snel afneemt met de tijd na toediening weegt de risicoreductie van een opname niet op tegen het ongemak voor de patiënt en extra voorzieningen die het ziekenhuis daarvoor moet treffen.
Door goede (toilet)hygiëne in acht te nemen kan de kans op het voorkomen van bovenstaande blootstellingen sterk worden verkleind en de mate van blootstelling worden beperkt. In de langzame fase van het generieke biokinetisch model wordt per etmaal ongeveer 5% van de aanwezige activiteit biologisch geklaard, waardoor de blootstelling dusdanig laag is dat dosisbeperkende maatregelen niet noodzakelijk worden geacht. Vanwege de snelle afname van de biologische klaring zijn beperkende maatregelen alleen in de eerste dagen na toediening relevant.
Op basis van het biokinetisch model kan gesteld worden dat 72 uur na toediening geen noemenswaardige biologische klaring meer plaatsvindt.
Ook borstvoeding is een blootstellingsscenario dat tot inwendige besmetting kan leiden [Dydek, 1988]. Gezien de dosisconversiecoëfficiënt voor ingestie van 4,8·10-7 Sv·Bq-1 voor baby’s kan door het geven van borstvoeding een volgdosis in de ordegrootte van 1 mSv worden ontvangen na behandeling met 131I. Vanwege deze bevinding zal borstvoeding gestaakt moeten worden. Deze notie is in lijn met de contra-indicaties in de Procedure Guidelines van de NVNG. Ook zwangerschap wordt in de Procedure Guidelines van de NVNG als absolute contra-indicatie vermeld [Procedure Guidelines NVNG, 2017].
Literatuur die externe blootstelling van verzorgers en familieleden beschrijft [Kochovska, 2017; Yoshimura, 2013; Pant, 2006; Mathieu, 1999], toont aan dat die in bijna alle gevallen lager dan 1 mSv is. In geval van een blootstelling hoger dan 1 mSv wordt in verschillende studies het niet opvolgen van leefregels en instructies met betrekking tot stralingshygiëne als oorzaak gegeven. Ook wanneer stralingsbeschermingsmaatregelen niet strikt worden opgevolgd blijft de dosis beperkt tot enkele mSv. De enige gevonden studie die dosis ten gevolge van inwendige besmetting beschrijft, geeft aan dat de dosis voor kinderen mogelijk boven de 1 mSv ligt [Barrington, 2008]. Op basis van de studie van Sudbrock et al. [Sudbrock, 2017] kan worden aangenomen dat de effectieve dosis ten gevolge van ingeademde lucht in verhouding met effectieve dosis ten gevolge van externe blootstelling geen wezenlijke bijdrage levert aan de blootstelling voor derden. Derhalve wordt dit blootstellingspad niet meegenomen in de bepaling van de blootstelling.
Omdat de beschrijving van de leefregels en instructies in het algemeen niet gegeven wordt en omdat ontslagcriteria verschillen tussen studies is het niet mogelijk om een perfecte set leefregels uit de literatuur te destilleren. Voorts zijn leefomstandigheden van de patiënten vaak niet beschreven.
Op basis van het generieke rekenmodel kan worden gesteld dat bij toediening van 1 GBq 131I de blootstelling van kinderen, verzorgers en derden niet wordt overschreden indien gedurende een week na ontslag leefregels zoals gescheiden slapen en het houden van afstand tijdens gezamenlijke activiteiten in acht worden genomen (zie Appendix B).
Afstemming van maatregelen en leefregels op de individuele patiënt biedt voor zowel de patiënt als de zorginstelling waar de behandeling plaatsvindt voordelen. Onnodige opname en restricties voor de patiënt worden voorkomen, terwijl wordt geborgd dat de blootstelling van derden binnen de in de algemene inleiding beschreven kaders valt.
Besmetting en ingestie maligne schildklieraandoeningen
Vanwege de renale klaring kan huidbesmetting met een druppel urine voorkomen; bijvoorbeeld wanneer een druppel urine is gemorst op de toiletbril, of via de patiënt op een oppervlakte terecht is gekomen. Om de ordegrootte van de huiddosis te schatten, wordt de activiteit in een druppel geschat:
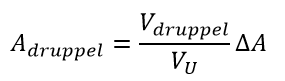
met Adruppel de activiteit in een druppel, Vdruppel het volume van een druppel, VU urineproductie in een tijdsinterval en ΔA de activiteit die biologisch wordt geklaard in dat tijdsinterval. Bij een druppel van 50 µl, 1000 ml urineproductie in 24 uur en een maximale biologische klaring van 80% in de eerste 24 uur na toediening (Figuur 2) bedraagt de activiteit in een druppel 296 kBq bij een toegediende activiteit van 7,4 GBq. Bij de dosisequivalenttempoconstante voor huidbesmetting van 1,39 mSv·cm2·h-1·kBq-1 levert een huidbesmetting van 1 cm2 met 10% van de activiteit in de druppel urine persisterend op de huid een huiddosis van 41,1 mSv·h-1.
Indien de huidbesmetting onopgemerkt blijft, kan deze leiden tot ingestie. Ingestie van 10% van de activiteit in de hierboven beschreven druppel leidt tot een effectieve volgdosis van 651 µSv voor volwassenen.
Gezien de huiddosis van 41,1 mSv·h-1 en de ingestiedosis van 651 µSv zijn toilethygiënische maatregelen ter voorkoming van huidbesmettingen en reductie van de duur van de huidbesmetting essentieel. Vanwege de snelle afname van de biologische klaring zijn beperkende maatregelen alleen in de eerste dagen na toediening relevant. Op basis van het biokinetisch model kan gesteld worden dat 168 uur na toediening geen noemenswaardige biologische klaring meer plaatsvindt.
Ook borstvoeding is een blootstellingsscenario dat tot inwendige besmetting kan leiden [Robinson, 1994]. Gezien de dosisconversiecoëfficiënt voor ingestie van 4,8·10-7 Sv·Bq-1 voor baby’s kan door het geven van borstvoeding een volgdosis in de ordegrootte van 1 mSv worden ontvangen na behandeling met 131I. Vanwege deze bevinding zal borstvoeding gestaakt moeten worden. Deze notie is in lijn met de contra-indicaties in de Procedure Guidelines van de NVNG. Ook zwangerschap wordt in de Procedure Guidelines Nuclear Medicine als absolute contra-indicatie vermeld [Procedure Guidelines NVNG, 2017].
Verschillende beschrijvingen in de literatuur tonen dat de blootstelling voor verzorgers en derden in het merendeel van de gevallen binnen de gestelde normen voor blootstelling blijft. In geval van overschrijding van dosisbeperkingen wordt in verschillende studies het niet opvolgen van leefregels en instructies met betrekking tot stralingshygiëne als oorzaak gegeven. Omdat de beschrijving van de leefregels en instructies in het algemeen niet gegeven wordt en omdat ontslagcriteria verschillen tussen studies is het niet mogelijk om een perfecte set leefregels uit de literatuur te destilleren. Voorts zijn leefomstandigheden van de patiënten vaak niet beschreven.
Vanwege het hoge externe dosistempo kort na toediening en de snelle biologische klaring en daarmee samenhangend een hoog huiddosistempo bij huidbesmetting en hoge effectieve volgdosis bij inwendige besmetting wordt een opname van 24 uur op een daarvoor ingerichte therapie-afdeling aanbevolen.
Afstemming van maatregelen en leefregels op de individuele patiënt biedt voor zowel de patiënt als de zorginstelling waar de behandeling plaatsvindt voordelen. Onnodige opname en restricties voor de patiënt worden voorkomen, terwijl wordt geborgd dat de blootstelling van derden binnen de in de algemene inleiding beschreven normen voor blootstelling valt.
Overlijden
Bij gebrek aan wet- en regelgeving op stralingshygiënisch vlak met betrekking tot het omgaan met patiënten die overlijden na radionuclidentherapie wordt teruggevallen op de vrijstellings- en vrijgavewaarden zoals vastgelegd in het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018]. Bij toediening van 1,0 GBq 131I ten behoeve van behandeling van benigne schildklieraandoeningen wordt de vrijstellingswaarde voor activiteitsconcentratie 31 dagen na toediening bereikt voor een patiënt van 70 kg conform het biokinetisch model. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingswaarde voor totale activiteit na 45 dagen als eerste wordt bereikt.
Bij toediening van 7,4 GBq ten behoeve van behandeling van maligne schildklieraandoeningen wordt de vrijstellingswaarde voor activiteitsconcentratie 35 dagen na toediening bereikt voor een patiënt van 70 kg conform het biokinetisch model. In geval van crematie wordt conservatief aangenomen dat alle activiteit in 2,5 kg as achterblijft [Siegersma, 2019], waardoor de vrijstellingswaarde voor totale activiteit na 58 dagen als eerste wordt bereikt.
Bij overlijden binnen deze periodes gelden mogelijk beperkingen met betrekking tot lijkbezorging en is maatwerk met betrekking tot stralingshygiënische aspecten benodigd.
Onderbouwing
Achtergrond
In deze module wordt behandeld:
- 131I-natriumjodide
Bij verschillende schildklieraandoeningen wordt therapie met 131I voorgeschreven. Hierbij wordt gebruik gemaakt van het feit dat in het lichaam jodium opgenomen wordt in de schildklier waar organificatie plaatsvindt via inbouw in schildklierhormoon. Dit schildklierhormoon bindt aan thyroxine-binding globuline (TBG) en blijft vervolgens opgeslagen in follikels in de schildklier. Elders in het lichaam komt deze organificatie niet voor. Daarnaast bestaat er langdurige retentie van TBG in de schildklier. Bij therapie met 131I wordt van dit verschil gebruik gemaakt [Esser, 2016].
In deze aanbevelingen wordt onderscheid gemaakt tussen 131I-therapie ten behoeve van behandeling van:
- Primaire hyperthyreoïdie en euthyreoot-(multi)nodulair-struma;
- Gedifferentieerd schildkliercarcinoom
Beide indicaties zullen in deze module worden behandeld. Vanwege verschillen op biokinetisch vlak en in gemiddelde toegediende activiteit is dit onderscheid gemaakt.
Na toediening van 131I kunnen personen die zich bevinden in de nabijheid van een patiënt die hiermee is behandeld worden blootgesteld aan ioniserende straling. Deze module beschrijft de aard en omvang van die potentiële blootstelling. Op basis hiervan is met inachtneming van de kaders die in de algemene inleiding van de richtlijn zijn beschreven gedefinieerd welke maatregelen ter beperking van de blootstelling van derden na behandeling van een patiënt met 131I redelijkerwijs noodzakelijk zijn.
Samenvatting literatuur
Ter beantwoording van de uitgangsvraag en de aanvullende vragen zijn 83 artikelen geselecteerd. Wegens het ontbreken van vergelijkende of prognostische studies naar de gevolgen van de mate van blootstelling met 131I en bijbehorende maatregelen is de literatuur beschrijvend weergegeven. Er is om diezelfde reden een aangepaste beoordeling van de bewijskracht uitgevoerd (zie Verantwoording).
Biokinetisch model benigne schildklieraandoeningen
Literatuuronderzoek naar de biodistributie van 131I bij behandeling van benigne schildklieraandoeningen wijst uit dat de uptake en effectieve halveringstijd in de schildklier sterk varieert tussen patiënten. Vanwege de variatie in biokinetiek tussen patiënten is het waardevol om op patiëntniveau de effectieve halveringstijd en het externe dosistempo te bepalen.
Zhang et al. geven op basis van retrospectief onderzoek naar 256 patiënten met Graves’ ziekte een effectieve halveringstijd van gemiddeld 5,80 (1,9 – 7,9) dagen. De data zijn verkregen na orale toediening van een tracerdosis. [Zhang, 2017].
Fürstner et al. bepaalden met een uptake counter een gemiddelde effectieve halveringstijd van 131I dat is opgenomen in de schildklier van 5,6 dagen. De halveringstijd werd bepaald bij 12 patiënten, waarvan 7 met de ziekte van Graves, 3 met toxisch multinodulair struma en 2 met toxisch adenoom [Fürstner, 2017].
Hartmann et al. vonden voor behandeling van ziekte van Graves, multinodulair struma, autonome schildkliernodules en euthyreoot struma een effectieve halveringstijd van gemiddeld 5,4; 6,6; 5,5 en 6,9 dagen gevonden op basis van gegevens van 286, 751, 421 en 40 patiënten respectievelijk. De uptake na 24 uur bedroeg 53,0 ± 13,5%; 35,5 ± 13,1%; 28,1 ± 10,9% en 33,2 ± 9,8%, respectievelijk. Toegediende activiteit bedroeg 898,7; 956,5; 874,8 en 1193,7 MBq gemiddeld. Metingen zijn met een probe uitgevoerd [Hartmann, 2017].
Voor een groep van 72 patiënten met de ziekte van Graves werd op basis van een whole-body telling na toediening van een tracerdosis van 0,37 MBq een effectieve halveringstijd van 121 uur bij 75% van de patiënten voor 131I opgenomen in de schildklier gemeten bij een gemiddelde uptake van 68%, en een effectieve halveringstijd van gemiddeld 5,1 uur in de rest van het lichaam. De gemiddelde uptake in de schildklier na 4 uur en 24 uur bedroeg 55% en 63%, respectievelijk. De spreiding tussen patiënten bedraagt 15%-86% en 18%-89%, respectievelijk [Liu, 2015].
Krohn et al. vergeleken de halveringstijd die werd bepaald op basis van pretherapeutische en posttherapeutische metingen. Voor therapie werd op basis van metingen op 24, 48 of 144 uur na toediening van een dosis van 3-5 MBq 131I de halveringstijd bepaald op basis van metingen met een probe. Post-therapie werd in intervallen van 12 uur na toediening de activiteit in de schildklier gemeten met dezelfde probe. Voor autonome schildkliernoduli werd een effectieve halveringstijd van 4,8 dagen (1,2 – 8,02) gemeten; voor autonoom multinodulair struma een effectieve halveringstijd van 5,9 dagen (0,9 – 8,02) en voor de ziekte van Graves van 6.0 dagen (0,9 – 8,02). [Krohn, 2015].
Schiavo et al. rapporteren op basis van externe uptakemetingen na toediening van een tracerdosis van 370 kBq 131I bij 93 patiënten met multinodulair toxisch struma een mediane uptake van 175 uur (84 – 511 uur). De mediane maximale uptake in de schildklier bedroeg 37% (9,4 – 68%) bij succesvolle therapie en 51,2% (15,6 – 67,1%) bij onsuccesvolle therapie [Schiavo, 2015].
Willegaignon et al. bepaalden na toediening van een tracerdosis van 370 kBq 131I bij 196 patiënten met de ziekte van Graves de uptake. De gemiddelde uptake bedroeg na 6 uur 59% (± 23%) en na 24 uur 67% (± 18%). [Willegaignon, 2013a]
Op basis van een prospectieve studie bij 50 patiënten met de ziekte van Graves doen Willegaignon et al. een uitspraak over uptake. Bij alle patiënten werd 2, 6, 24, 48, 96 en 220 uur na toediening van een tracerdosis van 370 kBq 131I de uptake gemeten. Op basis van sets van 2, 3 en 4 metingen werd de effectieve halveringstijd bepaald. De uptake na 2, 6, 24, 48, 96 en 220 uur bedroeg (gemiddeld ± SD) 41 ± 21%; 62 ± 22%; 65 ± 15%; 57 ± 13%, 46 ± 10% en 28 ± 6%. Gemiddelde effectieve halveringstijden varieerden tussen de 5,74 ± 1,89 dagen (op basis van de metingen 24 en 48 uur na toediening) en 6,95 ± 0,81 dagen (op basis van de metingen 24, 48, 96 en 220 uur na toediening [Willegaignon, 2013b].
Schiavo et al. bepaalden de effectieve halveringstijd bij 75 patiënten met een overactieve schildklier. 4, 24 en 96-120 uur na toediening van een tracerdosis van 370 tot 600 kBq 131I werd met een probe de uptake in de schildklier bepaald. Een effectieve halveringstijd korter dan 50 uur werd waargenomen bij 1 patiënt; tussen de 50 en 100 uur bij 4 patiënten; tussen de 100 en 150 uur bij 22 patiënten; tussen de 150 en 200 uur bij 36 patiënten en langer dan 200 uur bij 12 patiënten [Schiavo, 2013].
Zheng et al. hebben bij 766 patiënten met de ziekte van Graves voorafgaand aan therapie op basis van toediening van een tracerdosis van 74 kBq 131I de uptake en effectieve halveringstijd in de schildklier bepaald. Metingen werden 6, 24, 48 en 72 uur na toediening uitgevoerd. Resultaten werden uitgesplitst in man/vrouw en anti-thyroid microsoom antilichaam (TMAb) negatief of positief. Bij samenvoegen van die resultaten is de bepaalde effectieve halveringstijd 5,94 dagen en de maximale uptake 68,6% [Zheng, 2011].
Rogowski et al. bestudeerden het effect van toediening van 127I na toediening van 131I. De patiëntenpopulatie bestond uit 55 patiënten (22 met ziekte van Graves en 33 met toxisch nodulair struma) verdeeld over 2 groepen. Patiënten in groep A kregen 2 dagen na toediening van de therapeutische dosis 131I driemaal daags gedurende 3 dagen 127I toegediend. Op basis van uptakemetingen 24 en 48 uur na toediening van 2 MBq 131I werd de effectieve halveringstijd bepaald. 120 en 144 uur na toediening van de therapeutische dosis (425,2 ± 195,1 MBq in groep A; 525,7 ± 168,1 MBq in groep B) werd de effectieve halveringstijd bij therapie bepaald. De uptake na 24 uur bedroeg 51,9 ± 13,2% in groep A en 53,2 ± 10,2% in groep B. Na 48 uur bedroeg de uptake 39,8 ± 11,6% in groep A en 43,9 ± 9,3% in groep B. Therapeutische halveringstijd in groep A bedroeg 5,4 ± 0,64 dagen [Rogowski, 2011].
Eschner et al. bepaalden voor 12 patiënten met benigne aandoeningen op basis van metingen met een probe op de schildklier en whole-body telling een gemiddelde effectieve halveringstijd die constant blijft tot twee maanden na toediening [Eschner, 2011].
Hänscheid et al. beschrijven op basis van uptakemetingen 2, 6, 24, 48 en 96 of 120 uur na toediening van 1 MBq 131I een biokinetisch model met 2 compartimenten. 73 patiënten met de ziekte van Graves, toxisch nodulair struma of niet-toxisch struma werden geïncludeerd. Het model beschrijft de activiteit in het bloed en in de schildklier. Geobserveerde transfer rates bedroegen 0,102 per uur voor kt (transfer van vanuit bloed naar schildklier), 0,091 per uur voor kr (renale klaring uit het bloed) en 0,00101 per uur voor kh (hormonale excretie). Fysisch verval wordt beschreven met kp = 0,0036 per uur. De activiteit op het tijdstip t na toediening wordt beschreven volgens
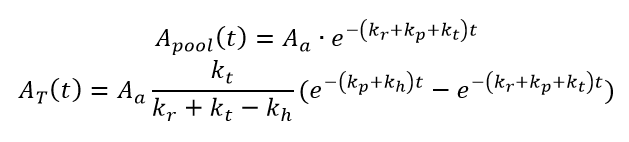
met Aa de toegediende activiteit, Apool de activiteit in het bloed en AT de activiteit in de schildklier [Hänscheid, 2011].
Hautzel et al. vergelijken 2 groepen patiënten die 131I therapie ondergaan voor ziekte van Graves’. 125 patiënten kregen prednisonol toegediend; 190 niet. 24 uur na toediening van 131I en vervolgens dagelijks werd de uptake bepaald. Er werd geen significant verschil in uptake tussen de twee groepen geconstateerd. Gemiddelde uptake bedroeg 72,1 ± 19,2%. De gemiddelde effectieve halveringstijd bedroeg 5,48 ± 1,54 dagen in pred- patiënten en 5,01 ± 1,44 dagen in pred+ patiënten [Hautzel, 2010].
Araujo et al. voerden metingen uit bij 8 patiënten met de ziekte van Graves. De gemiddelde effectieve halveringstijd, gebaseerd op meerdere metingen tussen de 14 en 30 uur na toediening, bedroeg 4,7 dagen. De gemiddelde uptake na 2 uur bedroeg 31,6% [Araujo, 2009].
Kobe et al. voerden retrospectief onderzoek uit naar de effectieve halveringstijd en uptake van 131I in de schildklier. Uptakemetingen na toediening van een tracerdosis en metingen tijdens de therapie werden gebruikt. De studie omvat 363 patiënten met ziekte van Graves, 50 patiënten met nontoxisch struma, 639 patiënten met toxisch struma en 365 patiënten met toxisch uninodulair struma. De halveringstijd bij therapie werd bepaald op basis van tenminste 5 uptake metingen. Uptakemetingen werden op 4.5 meter van de patiënt uitgevoerd met een probe. De maximale uptake is gedefinieerd als de hoogste uptake gemeten gedurende de eerste 24 uur na toediening. De halveringstijden na toediening van de tracerdosis (therapiedosis) bedroegen 5,5 ± 1,5 (5,4 ± 1,6) dagen, 7,4 ± 0,9 (6,4 ± 1,1) dagen, 7,3 ± 1,0 (6,6 ± 1,2) dagen en 6,5 ± 1,4 (5,7 ± 1,5) dagen respectievelijk. Het gemiddelde verschil in effectieve halveringstijd tussen de test- en therapeutische dosis bedroeg 1,0 ± 0,7 dagen, 1,2 ± 0,9 dagen, 1,1 ± 1,0 dagen en 1,3 ± 1,1 dagen respectievelijk. Maximale uptake na toediening van de tracerdosis (therapiedosis) bedroeg 63 ± 17 (64 ± 18)%, 38 ± 15 (42 ± 13)%, 37 ± 15 (38 ± 15)% en 31 ± 12 (13 ± 23)%, respectievelijk. Het gemiddelde verschil in maximale uptake tussen test- en therapeutische dosis bedroeg 7,4 ± 9,7%, 7,7 ± 9,7%, 6,1 ± 7,6% en 6,0 ± 20%, respectievelijk [Kobe, 2009].
Muhammad et al. beschrijven uptake 24 en 48 uur na toediening bij 59 patiënten met diffuse struma of nodulaire struma. Op basis van deze metingen is de effectieve halveringstijd bepaald. Metingen zijn uitgevoerd met een nek-probe. De gemiddelde uptake na 24 uur bedroeg 63 ± 13% voor diffuse struma en 53,5 ± 17,7% voor nodulaire struma. Na 48 uur waren die waarden gedaald tot 58,5 ± 15,9% en 52 ± 18,8% respectievelijk. De effectieve halveringstijd bedroeg 5,7 ± 2,5 (1,2 – 7,5) en 5,5 ± 2,3 (1,8 – 7,5) dagen, respectievelijk [Muhammad, 2008].
Dunkelmann et al. bestudeerden het effect van stoppen van antithyroide medicatie bij therapie bij patiënten met de ziekte van Graves. Bij 316 patiënten werden gedurende 2 dagen na toediening 10 uptakemetingen gedaan om een model met twee compartimenten op te kunnen stellen. De effectieve halveringstijd na toediening van een therapeutische dosis (testdosis) bedroeg 5,1 ± 1,3 (5,8 ± 1,2) dagen in de groep die nooit thiamazol kreeg. Maximale uptake, gecorrigeerd voor fysisch verval, in deze groep bedroeg 44,9 ± 15,7 (47,8 ± 16,5) [Dunkelmann, 2007].
Nielsen et al. voerden een dubbelblind placebogecontroleerd onderzoek naar het effect van rhTSH uit. 57 patiënten werden geïncludeerd en verdeeld over twee groepen. Op basis van uptakemetingen 24 en 96 uur na toediening werd de effectieve halveringstijd bepaald. De uptake 24 en 96 uur na toediening van de tracerdosis bedroeg 34,0 ± 5,5% en 32,3 ± 5,6% in het rhTSH+ cohort en 31,6 ± 11,0% en 31,0 ± 12,0% in het placebo-cohort. Na toediening van de therapeutische dosis bedroegen die waarden 47,0 ± 13,0% en 46,0 ± 13,0% in het rhTSH+ cohort en 28,7 ± 9,3% en 27,4 ± 8,3% in het placebo-cohort. De verschillen in uptake bij therapie waren significant. De effectieve halveringstijd bij therapie bedroeg 6,8 ± 1,4 dagen in het rhTSH+ cohort en 6,9 ± 1,8 dagen in de controlegroep [Nielsen, 2006].
Dunkelmann et al. onderzochten de invloed van lithium op de biokinetiek van 131I bij behandeling van patiënten met de ziekte van Graves. Zowel diagnostisch als therapeutisch werd de kinetiek gemonitord middels tenminste 10 uptakemetingen in de eerste 48 uur na toediening. 227 patiënten met normale kinetiek dienden als controlegroep (G1); 40 patiënten die in de diagnostische test een effectieve halveringstijd korter dan 3.5 dagen lieten zien werden verdeeld over de Li- en Li+ groepen (G2 en G3). De effectieve halveringstijd bij diagnostiek bedroeg 5,4 ± 1,5 dagen, 2,9 ± 0,37 dagen en 2,2 ± 0,57 dagen voor G1, G2 en G3 respectievelijk. Bij therapie bedroeg die 4,9 ± 1,4 dagen, 3,2 ± 0,94 dagen en 3,60 ± 1,3 dagen respectievelijk. De maximale uptake bij diagnostiek bedroeg 57,8 ± 17,2%, 60,8 ± 18,0% en 65,6 ± 15,3%, respectievelijk. Bij therapie bedroeg die 54,3 ± 16,1%, 55,9 ± 17.7% en 57,7 ± 14,2%, respectievelijk [Dunkelmann, 2006].
Eschmann et al. bestudeerden het effect van het stopzetten van antithyroid medicatie bij patiënten met ziekte van Graves. Door middel van probemetingen werd de uptake tijdens de therapie bij 141 patiënten bepaald. Op basis van deze metingen werd de effectieve halveringstijd van 131I in de schildklier bepaald. De effectieve halveringstijd was langer in de groep waar de medicatie werd gestopt (5,39 ± 1,1 vs. 5,03 ± 1,3 dagen). De uptake bij de testdosis en therapeutische dosis bedroeg 56,25 ± 16,72% en 51,14 ± 15,66% voor de groep waar medicatie werd voortgezet en 56,98 ± 19,45 en 55,51 ± 18,24% voor de groep waar medicatie werd gestopt [Eschmann, 2006].
Walter et al. onderzochten het effect van carbimazol op de uptake van 131I. De gemiddelde uptake na 24 uur bedroeg 15,2 ± 4,5 % in de studiegroep versus 42,4 ± 15,8 % in de controlegroep. De halveringstijd in de schildklier bedroeg 4,4 ± 1,6 dagen in de studiegroep en 5,3 ± 1,1 dagen in de controlegroep [Walter, 2005].
Jönsson et al. analyseerden retrospectief 515 patiënten die werden behandel voor hyperthyroïdie. Uptakemetingen werden 24, 48 en 3 tot 8 dagen na toediening van een testdosis uitgevoerd en gecorrigeerd voor fysisch verval. Op basis van de uptakemetingen werd een effectieve halveringstijd van 4,9 ± 0,1 (1,7 – 7,5) dagen voor ziekte van Graves; 5,9 ± 0,1 (3,1 – 7,5) dagen voor multinodulair struma en 5,9 ± 0,1 (2,4 – 8) dagen voor toxisch adenoom bepaald [Jönsson, 2003].
Sabri et al. includeerden 171 patiënten die 131I therapie voor behandeling van de ziekte van Graves of toxisch diffuus/nodulair struma ondergingen en vanwege een te lage geabsorbeerde dosis een tweede therapeutische dosis 131I kregen toegediend. Op basis van metingen die tweemaal daags werden uitgevoerd werd de effectieve halveringstijd en de uptake bepaald. De 131I uptake bedroeg 34,7 ± 15,4% na de eerste toediening en 23,7 ± 12,3% na de tweede toediening. De effectieve halveringstijd bedroeg 4,9 ± 1,3 dagen na de eerste toediening en 5,0 ± 1,7 dagen na de tweede toediening [Sabri, 2000].
Catargi et al. beschrijven jodiumkinetiek in een cohort van 100 patiënten. Zij kregen elk een diagnostische dosis van 1 MBq 131I toegediend. Op basis van metingen 3, 6, 24 en 48 uur na toediening werd de effectieve halveringstijd en de maximale uptake bepaald. Na toediening van de therapeutische dosis 131I werd gedurende 5 dagen met een scintillatieteller de kinetiek bepaald. Resultaten worden op basis van uitkomst van de therapie weergegeven. De 26 euthyreote patiënten toonden een uptake van 48,5 ± 8,7% en effectieve halveringstijd van 4,7 ± 1,0 dagen; de 33 hypothyreote patiënten 55,7 ± 11,5% en 4,7 ± 1,1 dagen en de 36 hypothyreote patiënten 54,5 ± 9,3% en 5,1 ± 1,1 dagen [Catargi, 1999].
Sabri et al. onderzochten 207 patiënten die therapie met 131I ondergingen voor behandeling van de ziekte van Graves. Zij kregen een testdosis van 2 MBq 131I toegediend waarna de maximum uptake en effectieve halveringstijd werden bepaald. Na toediening van de therapeutische dosis werden deze paramaters bepaald op basis van een of twee metingen per dag. De 101 non-thyrostatische patiënten toonden een uptake van 57,5 ± 15,1 % en effectieve halveringstijd van 5,8 ± 1,3 dagen. In de groep thyrostatische patiënten bedroegen die parameters 51,7 ± 15,7% en 5,2 ± 1,1 dagen [Sabri, 1999].
Mathieu et al. onderzochten de stralingsrisico’s voor familieleden van patiënten die werden behandeld met 131I. 18 patiënten die werden behandeld voor hyperthyreoïdie werden geïncludeerd. Met een gammacamera werden acquisities verkregen op 1, 5, 8, 12, 14, 19 en 21 dagen na toediening. De effectieve halveringstijd van 131I bedroeg 6,2 ± 1,2 dagen [Mathieu, 1999].
Retrospectieve analyse van 460 patiënten die werden behandeld voor hyperthyroïdie door Aktay et al. geven inzicht in de uptake in de schildklier. 4 tot 6 en 20 tot 25 uur na toediening van een dosis van 111 tot 333 kBq 131I werd de uptake bepaald met een uptake probe. Vroege uptake bedroeg 50 ± 24% in de groep waar therapie succesvol bleek en 66 ± 26% in patiënten waar therapie niet succesvol was. De late uptake bedroeg 69 ± 16% en 71 ± 17% in die groepen, respectievelijk [Aktay, 1996].
Berg et al. rapporteren de effectieve halveringstijd van 131I bij behandeling van de ziekte van Graves en toxisch nodulair struma. De gemiddelde effectieve halveringstijd bij de ziekte van Graves bedraagt 5,0 ± 1,3 dagen; bij toxisch nodulair struma is dat 6,0 ± 1,2 dagen. De metingen zijn 24, 48 en 4 of 6 dagen na toediening uitgevoerd [Berg, 1996].
Tsuruta et al. hebben onderzoek gedaan naar de outcome van 131I therapie bij patiënten met de ziekte van Graves. De 131I uptake en effectieve halveringstijd voor 13 patiënten staan gerapporteerd. De gemiddelde uptake na 24 uur bedraagt 71,8 ± 9,8 %. De gemiddelde effectieve halveringstijd bedraagt 6,7 ± 1,0 dagen [Tsuruta, 1993].
Voor 77 patiënten met thyreotoxicose is de retentie van 131I in de schildklier gemeten voor een periode tot 50 dagen na toediening. Daaruit is een gemiddelde effectieve halveringstijd van 6,35 dagen bepaald, gemeten vanaf 1 dag na toediening. Na de eerste dag na toediening bedroeg de gemiddelde activiteit in de schildklier 56,1% van de toegediende dosis [Hilditch, 1991].
In een studie waarin 24 patiënten met de ziekte van Graves werden geïncludeerd werd op basis van metingen van activiteit in de schildklier op 5, 15 en 22 dagen na toediening van 131I een gemiddelde biologische halveringstijd van 41,7 en 62,1 dagen bepaald voor 131I in de schildklier, afhankelijk van het therapieprotocol [Connell, 1987].
O’Connor et al. onderzochten de kinetiek van radioactief jodium in hyperthyroïdie. 31 patiënten (17 met ziekte van Graves’, 12 met multinodulaire struma en 2 met enkelvoudige noduli) werden geïncludeerd. Een tracerdosis van 185 – 592 kBq werd toegediend. Uptake van de tracerdosis werd 24 uur na toediening bepaald met een scintillatieteller. De effectieve halveringstijd in de schildklier werd bepaald op basis van een aantal metingen met een externe probe of met thermoluminescentieschijven. De tracer en therapie-uptake bedraagt 67,1 ± 14,8% en 64,4 ± 15,3%, respectievelijk. De effectieve halveringstijden bedragen 6,3 ± 1,0 dagen en 6,2 ± 0,9 dagen, respectievelijk [O’Connor, 1979].
In het RIVM-rapport [Kloosterman, 2020] wordt voor behandeling met 131I bij benigne schildklieraandoeningen een effectieve halveringstijd T1/2,eff van 14,9 uur gehanteerd gedurende de eerste 17,1 uur na toediening. Na die periode wordt een T1/2,eff van 119 uur gehanteerd. Deze waarden zijn gebaseerd op 3 publicaties [ATA, 2011; Berg, 1996; Steward, 2017]. In het rapport wordt niet aangegeven op grond waarvan deze publicaties zijn geselecteerd.
Biokinetisch model maligne schildklieraandoeningen
Literatuuronderzoek naar de biodistributie van 131I bij behandeling van maligne schildklieraandoeningen wijst uit dat de uptake en effectieve halveringstijd sterk varieert tussen patiënten. Vanwege de variatie in biokinetiek tussen patiënten is het waardevol om op patiëntniveau relevante parameters te bepalen.
Mínguez et al. hebben bij 50 patiënten die werden behandeld voor papillair schildkliercarcinoom de effectieve halveringstijd in de schildklier bepaald. Patiënten kregen 1,11 of 3,7 GBq 131I toegediend voor respectievelijk laag- en hoog-risico carcinomen. De effectieve halveringstijd werd bepaald op basis van twee SPECT/CT-acquisities op de tweede en zevende dag na toediening. De mediane effectieve halveringstijd bedroeg in de eerste groep 93 uur en in de tweede groep 40 uur. De Q1- en Q3- waarden lagen op 78 en 117 uur in de eerste groep en 29 en 58 uur in de tweede groep [Mínguez, 2019].
Freesmeyer et al. beschrijven op basis van onderzoek bij 48 patiënten een sterke correlatie tussen de effectieve halveringstijd gemeten met een gammacamera en een probe; correlatie tussen deze twee methoden en metingen aan bloed zijn minder sterk. De gemiddelde toegediende hoeveelheid 131I bedroeg 409,6 MBq. Op basis van metingen op 3 tijdstippen tot 42 uur na toediening werd een gemiddelde effectieve halveringstijd van 13,2 uur gevonden. Op basis van metingen op 4 tijdstippen tot 114 uur na toediening werd een gemiddelde halveringstijd van 15,6 uur gevonden [Freesmeyer, 2019].
Bacher et al. hebben bij 366 patiënten op basis van metingen met een scintillatiecamera op 4,5 meter van de patiënt een effectieve halveringstijd van gemiddeld 18,8 uur gevonden. Metingen werden direct na toediening en vervolgens iedere 12 uur uitgevoerd. De effectieve halveringstijd is berekend op basis van ten minste 5 datapunten [Bacher, 2019].
Ruhlmann et al. geven op basis van metingen van de activiteit in het bloed van 14 patiënten die tussen de 2 en 72 uur na toediening van 1,1 tot 16 GBq 131I een gemiddelde effectieve halveringstijd van 15,5 uur [Ruhlmann, 2018].
Willegaignon et al. hebben met een probe en gammacamera metingen uitgevoerd op 4, 24, 48, 72 en 96 uur na toediening van een tracerdosis van gemiddeld 87 MBq bij 14 patiënten met gemetastaseerd schildkliercarcinoom. De halveringstijd bepaald met een probe bedroeg 19,2 ± 8,57 uur en met een gammacamera bedroeg 20,2 ± 12,6 uur [Willegaignon, 2016a].
Okkalides et al. hebben na toediening van gemiddeld 7,93 GBq bij 375 patiënten met gedifferentieerd schildkliercarcinoom op basis van dosismetingen een effectieve halveringstijd van 14,1 ± 5,7 (5,1 – 43,87) uur gevonden. De metingen zijn uitgevoerd met een detector boven het bed van de patiënt. Door de afstand tussen de detector en patiënt zijn afwijkingen in de meetresultaten door verschillen in positionering beperkt [Okkalides, 2016].
Willegaignon et al. beschrijven een effectieve halveringstijd van 13,3 ± 3,38 uur op basis van blootstellingsmetingen na toediening van gemiddeld 8 GBq 131I bij 11 patiënten. De metingen zijn uitgevoerd met een Geiger-Mullerteller op 2 meter afstand van de patiënt. De eerste meting vond plaats 1 uur na toediening, voorafgaand aan de eerste blaasleging na toediening. Tenminste 3 metingen in de 48 uur na toediening zijn verkregen. Vergelijking met de gemiddelde effectieve halveringstijd verkregen op basis van toediening van een tracerdosis laat geen significante verschillen zien (P = 0,906). [Willegaignon, 2016b].
Grenfell et al. vinden bij vergelijking van de gemiddelde effectieve halveringstijd voor patiënten die rhTSH kregen (n = 19) en die thyroxine werden onthouden (n = 31) geen statistisch significante verschillen. De gemiddelde effectieve halveringstijden bedragen 11,5 ± 5,28 uur en 13,3 ± 6,29 uur respectievelijk. Deze halveringstijden zijn bepaald op basis van meting van het externe dosistempo op het moment van toediening van de activiteit en vervolgens elke ochtend en avond tot het ontslagmoment bij een dosistempo van 25 µSv/uur [Grenfell, 2015].
Ravichandran et al. hebben met metingen van het blootstellingstempo op een afstand van 1 meter van de patiënt de gemiddelde effectieve halveringstijd bepaald voor patiënten waarbij thyroxine werd gestopt en 22 patiënten die rhTSH kregen toegediend. De metingen vonden direct na toediening en vervolgens elke 24 uur tot 3 dagen na toediening plaats; patiënten waarbij een dosistempo onder de 10 µSv/uur werd gemeten werden ontslagen. De toegediende activiteit varieerde van 2,6 tot 7,9 GBq. Zij geven een halveringstijd van 11,9 en 16,3 uur voor 20 rhTSH en 78 stop-thyroxine patiënten [Ravichandran, 2014].
Liu et al. hebben dosismetingen uitgevoerd bij 77 patiënten die werden behandeld voor gedifferentieerd schildkliercarcinoom. Met een ionisatiekamer geplaatst op 0,3 en 1 meter van het middel van de patiënt op 1 meter boven de vloer werd op 30 minuten (voor de eerste mictie), 12, 24, 48, 72 en 144 uur na toediening het dosistempo bepaald. Uptake werd in beeld gebracht met een gammacamera. Bij patiënten die 131I kregen toegediend voor ablatie van de overblijfselen van de schildklier werd 2% van de toegediende activiteit geconcentreerd in de schildklier, met een effectieve halveringstijd van 120 uur. De effectieve halveringstijd in de rest van het lichaam bedroeg 16 uur. Voor patiënten die follow-up behandeling kregen vanwege metastasen bedroeg de effectieve halveringstijd 15 uur [Liu, 2014].
Bij patiënten met schildkliercarcinoom werd na toediening van 3,7 (48 patiënten), 5,55 (18 patiënten) of 7,4 (17 patiënten) GBq op basis van gemeten activiteit in urine tot 120 uur na toediening een gemiddelde effectieve halveringstijd vastgesteld van 18,4 uur in de eerste fase tot 24 uur na toediening en 64 uur in de tweede fase, tussen 48 en 120 uur [Demir, 2013].
Gültekin et al. hebben gekeken naar het effect van de inname van water, het douchen, defecatie en mictie op de effectieve halveringstijd. De effectieve halveringstijd bij 51 patiënten die 3,7 of 5,5 GBq 131I toegediend kregen werd bepaald op basis van metingen op 4 posities om het lichaam van de patiënt, op 1 meter afstand. De auteurs geven aan dat mictie sterk samenhangt met de effectieve halveringstijd. Voor de groep die in de periode 2 tot 4 uur na toediening gemiddeld 550 ml innam en 410 ml uitscheidde werd een gemiddelde effectieve halveringstijd van 4,16 uur bepaald, terwijl deze 8,14 uur bedroeg voor de groep die gemiddeld 200 ml innam en 120 ml uitscheidde [Gültekin, 2013].
Metingen bij 10 vrouwelijke patiënten die met 2,64 tot 4,05 GBq 131I behandeld werden voor schildkliercarcinoom kwamen uit op een gemiddelde biologische halveringstijd 0,81 dagen in de eerste 6 dagen na toediening en van 15,7 dagen (op basis van whole-body metingen) en 15,0 dagen (op basis van metingen met een probe) vanaf de tweede week na toediening [Nascimento, 2010].
Taïeb et al. hebben de effectieve halveringstijd voor het gehele lichaam bepaald bij 79 patiënten die ablatie van de overblijfselen van de schildklier ondergingen. De effectieve halveringstijd in de hypothyreoïdiegroep (40 patiënten) bedroeg 17,1 ± 2,83 uur, in de rhTSH groep (39 patiënten) 14,76 ± 2,1 uur. Dosistempometingen 2 en 6 dagen na toediening en de aanname van een mono-exponentieel verband werden gebruikt voor de bepaling [Taïeb, 2010].
Bepaling van de effectieve halveringstijd bij 254 patiënten met schildkliercarcinoom middels tenminste 7 whole-body metingen in de eerste 62 uur na toediening per patiënt resulteerden in waarden van 15,7 en 10,5 uur voor twee verschillende subgroepen. Metingen van de renaal geklaarde activiteit kwamen uit op 16,0 respectievelijk 10,6 uur voor deze subgroepen [Remy, 2008].
Willegaignon et al. presenteert een gemiddelde effectieve halveringstijd van 11,4 uur na dagelijkse metingen bij 90 patiënten met gedifferentieerd schildkliercarcinoom die gemiddeld 8,2 GBq 131I kregen toegediend [Willegaignon, 2006].
Voor 191 patiënten met gedifferentieerd schildkliercarcinoom werd op basis van metingen van 2 uur tot 72 uur na toediening een effectieve halveringstijd van 0,38 tot 0,87 dagen (op basis van meting na 24 uur) en van 0,44 tot 1,22 dagen (op basis van meting na 72 uur) vastgesteld [Papadimitriou, 2006].
Voor 265 patiënten behandeld voor schildkliercarcinoom met 2,6 tot 9,3 GBq werd een biologische halveringstijd van gemiddeld 0,7 dagen bepaald op basis van metingen gedurende de opname van de patiënt [Pacilio, 2005].
Menzel et al. hebben 265 patiënten die therapie met 131I ondergingen retrospectief bekeken. De gemiddelde effectieve halveringstijd bedroeg 0,43 ± 0,11 dagen voor patiënten die rhTSH kregen toegediend. Voor patiënten die thyroxine werden onthouden bedroeg de gemiddelde effectieve halveringstijd 0,54 ± 0,11 dagen [Menzel, 2013].
Nadig et al. bepaalden bij 50 patiënten de effectieve halveringstijd van 131I en de maximale uptake na 24 uur. Alle geïncludeerde patiënten hadden een vorm van chirurgie ondergaan. Metingen werden uitgevoerd met een NaI scintillatieprobe met collimator op 24, 48, 72 en 96 na toediening van de tracerdosis. Uiteindelijk waren data van 39 patiënten beschikbaar voor analyse. De gemiddelde effectieve halveringstijd in de schildklieroverblijfselen bedroeg 4,5 ± 0,9 (1.98 – 6.10) dagen. De 24-uurs uptake in de schildklier bedroeg gemiddeld 8,8 ± 6,1 (1,1 – 21,2)% [Nadig, 2008].
In een studie naar de blootstelling van de blaas werd op basis van urinemonsters gedurende een week na toediening van 3,7 tot 7,4 GBq bij 29 patiënten met schildkliercarcinoom een effectieve halveringstijd van 24,8 uur in de eerste 3 dagen na toediening en 73,3 uur in de 4 daaropvolgende dagen berekend [Sabbir Ahmed, 2003].
Venencia et al. gaven 14 patiënten die 1,11 tot 8,18 GBq 131I kregen toegediend een dosismeter die links op de thorax werd gedragen. Gedurende een gemiddelde periode van 2,5 dagen werden dosismetingen uitgevoerd, op basis waarvan een effectieve halveringstijd is bepaald. De gemiddelde halveringstijd op basis van de data in het artikel bedraagt 0,52 dagen [Venencia, 2002].
North et al. bepaalden in een studie waarin 238 patiënten met schildkliercarcinoom waren geïncludeerd een effectieve halveringstijd op basis van metingen na toediening, na de eerste nacht en na de tweede nacht. Gerapporteerde waarden variëren tussen de 17,1 en 19,0 uur gemiddeld, afhankelijk van de subgroep en berekening [North, 2001].
Tatiana et al. beschreven de effectieve halveringstijd op basis van uptakemetingen na toediening van een tracerdosis van maximaal 74 MBq en 2,2 – 3,7 GBq. 30 patiënten met papillair of folliculair schildkliercarcinoom werden geïncludeerd. De uptake in de schildklier bedroeg 4,0 ± 2,6% bij de testdosis en 6,0 ± 2,6 % bij de behandeling. De effectieve halveringstijd in de schildklier bedroeg 3,1 ± 1,4 dagen bij de testdosis en 1,3 ± 0,8 dagen bij de behandeling [Tatiana, 2000].
Mathieu et al. onderzochten de stralingsrisico’s voor familieleden van patiënten die werden behandeld met 131I. 22 patiënten die werden behandeld voor schildkliercarcinoom werden geïncludeerd. Met een gammacamera werden acquisities verkregen op 4, 6, 9, 12, 14 en 16 dagen na toediening. De effectieve halveringstijd vanaf 2 dagen na toediening bedroeg 2,2 ± 0,8 dagen [Mathieu, 1999].
Huic et al. bepaalden de retentie van 131I door middel van metingen met een whole-body teller. 24 patiënten met schildkliercarcinoom werden geïncludeerd. De metingen werden 2, 24, 48 en 72 na toediening van een diagnostische dosis uitgevoerd, en vervolgens nog 72 uur na toediening van de therapeutische dosis. De effectieve halveringstijd na toediening van de diagnostische dosis bedraagt 40,3 uur; na toediening van de therapeutische dosis is dat 20,2 uur [Huic, 1996].
Voor behandeling van maligne schildklieraandoeningen wordt in het RIVM-rapport [Kloosterman, 2020] een model gehanteerd op basis van een overzichtsartikel van Kamil et al. uit 2006, waarin 5 artikelen worden aangehaald die de biokinetiek van 131I beschrijven. In het artikel wordt niet beschreven op basis waarvan deze 5 artikelen zijn geselecteerd. In het RIVM-rapport wordt niet beschreven waarom het artikel van Kamil et al. is geselecteerd. Op basis van het overzichtsartikel wordt de biologische halveringstijd in de eerste 120 uur na toediening op 21,0 uur geschat. Voor de fase na 120 uur wordt op basis van het ontbreken van experimentele waarden in het artikel gesteld dat de effectieve halveringstijd gelijk is aan de fysische halveringstijd.
Scenario’s
Door uitademing komt een deel van de toegediende activiteit 131I in de lucht terecht, waaraan derden door inademing kunnen worden blootgesteld. In de literatuur worden voor volwassenen effectieve doses van 97 µSv (schildkliercarcinoom) en 31 µSv (ziekte van Graves) genoemd in de tijdsperiode van 8 tot 16 uur na toediening. Voor kinderen bedragen de effectieve doses in die periode 180 µSv en 57 µSv, respectievelijk [Sudbrock, 2017].
Bij operatie van een patiënt 6 dagen na toediening van 3,0 GBq 131I voor behandeling van schildkliercarcinoom bedroeg de blootstelling van de chirurg 20 µSv na een twee uur durende procedure. Het dosistempo post-mortem op 2 meter van de schildklier bedroeg 2 µSv per uur [Griffiths, 2000].
In een studie uit 1997 wordt gerapporteerd dat 1,1% van de activiteit aan 131I die werd toegediend in een ziekenhuis werd teruggevonden in de gemeentelijke waterafvoerbehandeling [Martin, 1997].
Prichard et al. maken melding van detectie van 131I in afvalwater in de nabijheid van een groot medisch complex. Er is echter geen relatie met de hoeveelheid toegediende activiteit te bepalen doordat deze onbekend is [Prichard, 1981].
Maatregelen
Mattar et al. bepaalden na toediening van 3,7 – 7,4 GBq 131I de besmetting. De hoogst gevonden besmettingen bedroegen 11 Bq cm-2 in kleding, 6,6 Bq cm-2 op het toilet en 2,9 Bq cm-2 op bed [Mattar, 2019].
Voor patiënten die werden behandeld voor schildkliercarcinoom met een dosis hoger dan 1,1 GBq 131I is de blootstelling van 29 verzorgers vastgesteld met thermoluminescentiedosimeters. Patiënten werden ontslagen na 1 dag als zij maximaal 3,7 GBq toegediend hadden gekregen en na 2 dagen als zij tussen de 3,7 en 7,4 GBq toegediend hadden gekregen. De blootstelling is gemeten gedurende gemiddeld 24 dagen. De verzorgers hadden instructies met betrekking tot stralingsbeschermingsmaatregelen ontvangen. De gemiddelde dosis bedroeg 0,12 mSv, het maximum 0,38 mSv [Zehtabian, 2017].
Bij metingen met een persoonsdosimeter aan de riem bij 13 verzorgers die elk één patiënt verzorgden gedurende 3 dagen dat de patiënten opgenomen waren in het ziekenhuis werd een externe dosis van gemiddeld 0,37 mSv vastgesteld. Het maximum bedroeg 0,70 mSv. De patiënten hadden elk tussen de 3,7 en 7,4 GBq 131I toegediend gekregen ter behandeling van schildkliercarcinoom. Metingen aan de activiteit in omgevingslucht leiden tot een schatting van een gemiddelde effectieve dosis ten gevolge van inhalatie van 0,04 mSv [Poon, 2016].
Verzorgers van 20 patiënten die 131I therapie ondergingen ter behandeling van schildkliercarcinoom met 5,6 tot 7,4 GBq ontvingen gemiddeld 0,14 mSv en 0,65 mSv gedurende 3 dagen na toediening, gemeten met een persoonsdosimeter. De maximale dosis bedroeg 1,9 mSv [Tonnonchiang, 2016].
Voor 60 familieleden van patiënten behandeld met 131I na een opname van 3 dagen werd de blootstelling gemeten met thermoluminscentiedosimeters. 30 patiënten ondergingen therapie voor hyperthyreoïdie (toegediende activiteit tussen 0,2 en 1,3 GBq), 30 patiënten voor schildkliercarcinoom (toegediende activiteit tussen de 3,7 en 5,6 GBq, patiënten ontslagen bij een dosistempo van 8 µSv·h-1 op 2 meter afstand). Voor de verzorgers van patiënten behandeld voor hyperthyreoïdie bedroeg de gemiddelde effectieve dosis 0,87 mSv, het maximum bedroeg 6,79 mSv ten gevolge van het niet opvolgen van maatregelen om de blootstelling te beperken. Voor de verzorgers van patiënten behandeld voor schildkliercarcinoom bedroeg de gemiddelde effectieve dosis 0,21 mSv, met een maximum van 0,51 mSv [Kochovska, 2017].
Na toediening van 3,0 of 5,5 GBq voor behandeling van schildkliercarcinoom bij kinderen is de blootstelling van verzorgers bepaald. Verzorgers kregen mondeling en schriftelijk uitleg van stralingshygiënische maatregelen. Dosis werd gemeten met een persoonsdosimeter gedurende verblijf van de patiënt in het ziekenhuis. De gemiddelde effectieve dosis bedroeg 0,037 mSv en het maximum 0,274 mSv [Gains, 2015].
Nantajit et al. hebben bij de verzorgers van 10 patiënten die behandeld werden voor schildkliercarcinoom (5,42 GBq 131I gemiddeld) met elektronische persoonsdosimeters de blootstelling bepaald gedurende de eerste 7 dagen na toediening. Patiënten en verzorgers kregen stralingshygiënemaatregelen mee. De gemiddelde dosis gedurende de eerste 7 dagen na toediening bedroeg 0,138 mSv (0,021 – 0,672 mSv). Interne blootstelling, gemeten met een schildklieruptakesysteem, was verwaarloosbaar [Nantajit, 2015].
Ramírez-Garzón et al. vergeleken blootstelling van verzorgers van patiënten die 48-72 uur werden opgenomen en werden ontslagen wanneer het dosistempo op 1 meter afstand was gedaald tot onder de 50 µSv/uur (groep 1) en verzorgers van patiënten die poliklinisch behandeld werden (groep 2) met een TLD. De toegediende dosis bedroeg 3,7, 5,55, 7,4 of 11,1 GBq 131I. Patiënten en verzorgers kregen stralingshygiënemaatregelen mee. Alle verzorgers ontvingen een dosis lager dan 5 mSv [Ramírez-Garzón, 2014].
Lee et al. onderzochten de blootstelling van verzorgers van 33 klinische (3,7 – 7,4 GBq) en 31 poliklinische (1,11 GBq) patiënten die met 131I werden behandeld. De stralingsdosis werd gemeten met thermoluminescentiedosimeters. Patiënten en verzorgers kregen instructies mee. Alle verzorgers sliepen in een andere ruimte dan de patiënt. Voor verzorgers van poliklinische patiënten bedroeg de dosis 0,61 ± 0,56 mSv. Voor verzorgers van klinische patiënten (opname 2 of 3 dagen) bedroeg de dosis 0,16 ± 0,34 mSv [Lee, 2015].
Yoshimura et al. voerden metingen uit bij huisgenoten van patiënten die poliklinische therapie met 1110 MBq 131I ondergingen. De gemiddelde effectieve dosis bedroeg 0,05 ± 0,08 mSv gedurende de eerste 7 dagen na toediening, op basis van metingen met elektronische persoonsdosimeters. Daaruit wordt geconcludeerd dat bij inachtneming van de mitigerende maatregelen de dosis voor derden onder de 5,0 mSv per therapie zal blijven [Yoshimura, 2013].
Kusakabe et al. bepaalden het dosistempo op 1 meter afstand van de patiënt na poliklinische toediening van 1,11 GBq 131I om te ableren. Ook werd de dosis van verzorgers bepaald met persoonsdosimeters. 37 patiënten derden geïncludeerd; zij moesten onder andere de mogelijkheid hebben om in een andere ruimte dan de verzorgers te slapen. Het dosistempo op 1 meter van de patiënt 1 uur na toediening bedroeg 63,8 µSv·h-1 (29 – 115 µSv·h-1). De gemiddelde dosis voor verzorgers gedurende 7 dagen na toediening bedroeg 0,11 ± 0,08 mSv; 3 verzorgers ontvingen een dosis hoger dan 0,2 mSv [Kusakabe, 2012].
Remy et al. beschrijven de gemeten stralingsblootstelling van 67 familieleden van 56 patiënten die werden behandeld met 131I voor schildklierkanker. De toegediende dosis bedroeg 3,7 GBq en de patiënten verbleven na toediening 3 dagen in isolatie. Patiënten en familieleden ontvingen instructies. Dosis werd gemeten met een persoonsdosimeter. De gemiddelde residuele activiteit bij ontslag bedroeg 188 MBq. Gedurende 7 dagen ontvingen familieleden gemiddeld 0,0515 ± 0,0697 mSv. Familieleden spendeerden gemiddeld 47,2 ± 34,5 uur in nabijheid van de patiënt [Remy, 2012].
Gabriel et al. onderzochten naast de blootstelling van 48 gezinsleden van patiënten die 131I therapie ondergingen voor de behandeling van schildkliercarcinoom ook de mate waarin zij zich aan de stralingshygiënemaatregelen hielden. De gemiddelde dosis gedurende de eerste 3 dagen na ontslag van de patiënt bedroeg 0,102 mSv (<0,050 – 1,000 mSv). Uit enquêtes bleek dat 35,4% van de gezinsleden zich strikt aan de maatregelen hield; desalniettemin waren er slechts 4 gevallen waarin de dosis voor gezinsleden de 0,3 mSv overschreden [Gabriel, 2011].
Willegaignon et al. beschrijven de blootstelling van verzorgers van 100 patiënten die op poliklinische basis worden behandeld voor gedifferentieerd schildkliercarcinoom. De toegediende dosis bedraagt 3,9 of 7,8 GBq 131I. De maximale gemeten oppervlaktebesmetting gemeten op de derde dag na toediening bedroeg 899,3 Bq/cm2. De hoogste besmettingsniveaus werden gemeten in de slaapkamer (kussensloop) en op het toilet. De hoogst gemeten externe blootstelling voor een verzorger bedroeg 1,6 mSv; 87 van de 90 verzorgers ontvingen een dosis lager dan 1,0 mSv [Willegaignon, 2011].
Willegaignon et al. rapporteren de blootstelling van verzorgers van 20 patiënten die poliklinisch behandeld werden voor schildkliercarcinoom met 3,7 of 5,55 GBq 131I. Van alle patiënten werd ingeschat dat zij zich aan de beperkende maatregelen zouden houden. De hoogst gemeten dosis bedroeg 2,8 mSv in de eerste 7 dagen na toediening [Willegaignon, 2009].
Barrington et al. hebben metingen verricht om de interne dosis van familieleden van poliklinisch behandelde patiënten met hyperthyroïdie te bepalen. De mediane toegediende dosis bedroeg 576 MBq 131I. De interne blootstelling werd bepaald op basis van meting van 131I in de schildklier van familieleden met een uptakemeter. Deelnemers aan het onderzoek kregen advies om besmetting en blootstelling zoveel mogelijk te beperken. Bij 17 van de 53 deelnemende volwassenen en 26 van de 92 deelnemende kinderen werd activiteit gedetecteerd in de schildklier. De maximale dosis ten gevolge van besmetting bedroeg 0,4 mSv voor volwassenen en 1,7 mSv voor kinderen [Barrington, 2008].
Marriott et al. beschrijven de blootstelling van verzorgers van poliklinisch behandelde patiënten met gedifferentieerd schildkliercarcinoom. Verzorgers ontvingen een elektronische persoonsdosimeter om blootstelling te bepalen. Deelnemers aan het onderzoek werden geacht zich aan de beperkende maatregelen te houden. De toegediende activiteit 131I bedroeg 3,7 GBq in 25/27 gevallen, eenmaal 5,6 GBq en eenmaal 7,4 GBq. De gemiddelde blootstelling Hp(10) bedroeg 0,098 ± 0,064 mSv gedurende de eerste 7 dagen na toediening [Marriott, 2007].
Pant et al. includeerden zowel familieleden van patiënten die voor hyperthyroïdie als schildkliercarcinoom werden behandeld met 131I. 45 familieleden van patiënten met thyrotoxicose werden verdeeld over 2 groepen die identieke stralingsveiligheidsinstructies ontvingen, behalve dat familieleden in de tweede groep gedurende 3 dagen na toediening in een eigen bed moesten slapen. Gemiddelde blootstelling in de eerste groep bedroeg 1,1 mSv (0,4 – 2,4 mSv); in de tweede groep 0,6 mSv (0 – 1,9 mSv). Voor 297 familieleden van patiënten die werden behandeld voor schildkliercarcinoom met een dosis tot 7,4 GBq bedroeg de maximale blootstelling 8,5 mSv. Blootstelling werd bepaald met thermoluminescentiedosimeters [Pant, 2006].
Grigsby et al. onderzochten de stralingsblootstelling bij gezinsleden van 30 patiënten die werden behandeld met 131I voor schildkliercarcinoom. De toegediende activiteit bedroeg 2,8 tot 5,6 GBq. Gedurende 10 dagen na toediening werd de blootstelling gemonitord met optisch gestimuleerde luminescentiedosimeters. 65 gezinsleden in de leeftijd van < 1 tot 78 jaar participeerden. De gemiddelde gemeten dosis bedroeg 0,24 mSv (0,01 – 1,09 mSv) [Grigsby, 2000].
Mathieu et al. bepaalden de blootstelling bij 73 familieleden (35 partners en 38 kinderen) van 22 patiënten die behandeld werden voor schildkliercarcinoom met 3,7 – 7,4 GBq 131I en 18 patiënten die behandeld werden voor hyperthyroïdie (200 – 600 MBq 131I). De patiënten met schildkliercarcinoom werden de eerste twee dagen na toediening opgenomen zodat het dosistempo op 1 meter van de patiënt bij ontslag lager dan 20 µSv·h-1 lag; de hyperthyroïdiepatiënten werden poliklinisch behandeld. Blootstelling werd bepaald met thermoluminescentiedosimeters gedurende 2 tot 3 weken. Patiënten en familieleden kregen leefregels mee. Hoogste doses werden gemeten in families waar de stralingshygiëneadviezen niet werden opgevolgd, resulterend in een dosis > 5 mSv voor een partner en > 3 mSv voor twee kinderen van een patiënt behandeld met 600 MBq 131I. Alle familieleden van patiënten die werden behandeld voor schildkliercarcinoom ontvingen een dosis lager dan 0,53 mSv in een periode van 2 weken na ontslag [Mathieu, 1999].
Op basis van een case-report wordt gesteld dat borstvoeding na behandeling van een schildkliercarcinoom met 4000 MBq 131I tenminste tot 50 dagen na toediening dient te worden onderbroken om de effectieve dosis voor de baby lager dan 1 mSv te houden [Robinson, 1994]
Ook bij behandeling van de ziekte van Graves met 355 MBq kan borstvoeding leiden tot een onaanvaardbaar hoge dosis voor de baby, blijkens een case-report [Dydek, 1988].
Jacobson et al. volgden 17 familieleden van 7 patiënten gedurende ongeveer 2 maanden met thermoluminescentiedosimeters op de pols. De hoogste gemeten dosis bedroeg 22 mSv [Jacobson, 1978].
Zwangerschap en borstvoeding worden in de Procedure Guidelines van de NVNG aangemerkt als contra-indicaties voor deze therapie [Procedure Guidelines NVNG, 2017].
Fysische eigenschappen
131I vervalt onder uitzending van β--deeltje en gammastraling naar de stabiele isotoop 131Xe en heeft een fysische halveringstijd van 8,04 dagen [ICRP 119, 2012]. De dosisequivalenttempoconstante voor huidbesmetting (hhuidbesmetting(0.07)) is ontleend aan Petoussi [Petoussi, 1993]. De dosisequivalenttempoconstanten voor fotonbijdrage lichaam (h(10)) en huid (h(0.07)) zijn ontleend aan Otto [Otto, 2016]. Deze bedragen respectievelijk 1,39 mSv·h-1·kBq-1 cm-2, 67 µSv·h-1·GBq-1 op 1 meter en 3,4 mSv·h-1·GBq-1 op 10 cm
De dosisconversiecoëfficiënt voor ingestie van 131I bedraagt 2,2·10-8 Sv·Bq-1 voor een volwassen lid van de bevolking [ICRP 119, 2012].
De vrijstellingswaarden voor activiteitsconcentratie en totale activiteit bedragen 0,1 MBq·kg-1 en 1 MBq, respectievelijk [Bbs, 2018].
Zoeken en selecteren
Voor het beantwoorden van deze uitgangsvraag heeft de werkgroep gebruik gemaakt van het RIVM-rapport Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. Dosisberekeningen als basisinformatie voor de herziening van maatregelen en leefregels [Kloosterman, 2020].
Daarnaast is er oriënterend literatuuronderzoek verricht in Pubmed, waarbij op 31 mei 2020 is gezocht middels een zoekopdracht gericht op biologische modellen, en op 31 januari 2020 is gezocht middels 2 zoekopdrachten gericht op scenario’s en maatregelen met relevante zoektermen in combinatie met 131I. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
De literatuurzoekacties leverden respectievelijk 473, 33 en 135 resultaten op. Studies zijn geselecteerd op grond van voldoen aan alle van de volgende selectiecriteria:
- betrekking op het juiste radiofarmacon
- betrekking op de juiste therapie
- betrekking op mensen
- betrekking op blootstelling van derden
- betrekking op beperkende maatregelen
- in een bekende taal
In eerste instantie zijn voor biologische modellen, scenario’s en maatregelen bij 131I 87, 4 en 21 studies voorgeselecteerd op basis van titel en abstract. Na raadpleging van de volledige tekst zijn hiervan 29 studies geëxcludeerd (zie exclusietabel) en 83 artikelen definitief geselecteerd (zie verdeling in Tabel 1).
Tabel 1: verdeling van artikelen per radiofarmacon
|
|
131I |
|
Biologische modellen |
58 |
|
Scenario’s |
4 |
|
Maatregelen |
21 |
Op basis van expert opinion zijn nog twee aanvullende artikelen geïncludeerd.
Referenties
- Aktay, 1996 Aktay R, Rezai K, Seabold JE, Bar RS, Kirchner PT. Four- to Twenty-four-Hour Uptake Ratio: An Index of Rapid Iodine-1311 Turnover in Hyperthyroidism. J Nucl Med 1996; 37:1815-1819.
- Araujo, 2009 Araujo F, Rebelo AM, Pereira AC, et al. Optimization of 131I doses fort he treatment of hyperthyroidism. Cell. Mol. Biol. 2009. 55(3), 1-6. 10.1170/T866
- ATA, 2011 The American Thyroid Association Taskforceon Radioiodine Safety. Radiation Safety in the Treatment of Patients with Thyroid Diseases by Radioiodine 131I: Practice Recommendations of the American Thyroid Association. Thyroid 2011 Apr;21(4):335-46. https://doi.org/10.1089/thy.2010.0403
- Bacher, 2019 Bacher R, Hohberg M, Dietlein M, et al. Thyroid Uptake and Effective Half-Life of Radioiodine in Thyroid Cancer Patients at Radioiodine Therapy and Follow-Up Whole-Body Scintigraphy Either in Hypothyroidism or Under rhTSH. J Nucl Med 2019; 60:631-637. https://doi.org/10.2967/jnumed.118.217638
- Barrington, 2008 Barrington SF, Anderson P, Kettle AG, et al. Measurement of the internal dose to families of outpatients treated with 1131I for hyperthyroidism. Eur J Nucl Med Mol Imaging (2008) 35:2097-2104. https://doi.org/10.1007/s00259-008-0892-0
- Berg, 1996 Iodine-131 Treatment of Hyperthyroidism: Significance of Effective Half-life Measurements. Berg GE, Michanek AM, Holmberg EC, Fink M. J Nucl Med 1996; 37:228-232.
- Catargi, 1999 Catargi B, Leprat F, Guyot M, Valli N, Ducassou D, Tabarin A. Optimized radioiodine therapy of Graves’ disease: analysis of the delivered dose and of other possible factors affecting outcome. Eur J Endocrinol 1999 141:117-121.
- Demir, 2013 Demir M, Parlak Y, Cavdar I, et al. The evaluation of urine activity and external dose rate from patients receiving radioiodine therapy for thyroid cancer. Rad Prot Dosim (2013) 1-5. https://doi.org/10.1093/rpd/nct036
- Dunkelmann, 2006 Dunkelmann S, Künstner H, Nabavi E, Eberlein U, Groth P, Schümichen C. Lithium as an adjunct to radioiodine therapy in Graves’ disease for prolonging the intrathyoridal effective half-life or radioiodine. Nuklearmedizin 2006; 45:123-8.
- Dunkelmann, 2007 Dunkelmann S, Kuenstner H, Nabavi E, Rohde B, Groth P, Schuemichen C. Change in the intrathyroidal kinetics of radioiodine under continued and discontinued antithyroid medication in Graves’ disease. Eur J Nucl Med Mol Imaging (2007) 34:228-236. https://doi.org/10.1007/s00259-006-0234-z.
- Dydek, 1988 Dydek GJ, Blue PW. Human Breast Milk Excretion of Iodine-131 Following Diagnostic and Therapeutic Administration to a Lactating Patient with Graves’ Disease. J Nucl Med 1988; 29:407-410.
- Eschmann, 2006 Eschmann SM, Thelen MH, Dittman H, Bares R. Influence of Short-Term Interruption of Antithyroid Drugs on the Outcome of Radioiodine Therapy of Graves’ Disease: Results of a Prospective Study. Exp Clin Endocrinol Diabetes 2006; 114: 222-226. https://doi.org/10.1055/s-2006-924238
- Eschner, 2011 Eschner W, Kobe C, Schicha H. Follow-up on thyroidal uptake after radioiodine therapy – how robust is the peri-therapeutic dosimetry? Z. Med. Phys 2011 21 258-265. https://doi.org/10.1016/j.zemedi.2011.04.006
- Esser, 2016 Esser JP, et al ed., 131I therapy in Primary Hyperthyroidism and Non-toxic (Multi)Nodular Goitre. In: Procedure Guidelines Nuclear Medicine. Neer: 372-83
- Freesmeyer, 2019 Freesmeyer M, Gühne F, Kühnel C, Opfermann T, Winkens T, Werner A. Determination of effective half-life of 131I in patients with differentiated thyroid carcinoma: comparison of cystatin C and creatinine-based estimation of renal function. Endocrine (2019) 63:554-562. https://doi.org/10.1007/s12020-018-1800-4
- Fürstner, 2017 Fürstner M, Hentschel M, Spanjol P-M, et al. Technical Note: Determination of individual thyroid clearance effective half-life with a common handheld electronic dosimeter.
- Gabriel, 2011 Gabriel S, Farman-Ara B, Bourrelly M, et al. Radiation Doses to Cohabitants of Patients Undergoing Radioiodine Ablation for Thyroid Cancer: Poor Compliance With Radiation Protection Guidelines but Low Radiation Exposure. Nucl Med Commmun. 2011;32(9):823-833. http://doi.org/10.1097/MNM.0b013e32834f1c2
- Gains, 2015 Gains JE, Walker C, Sullivan TM, et al. Radiation Exposure to Comforters and Carers During Paediatric Molecular Radiotherapy. Pediatr Blood Cancer 2015;62:235-239. https://doi.org/10.1002/pbc.25250
- Grenfell, 2015 Grenfell S, Roos D, Rijken J, Higgs B, Kirkwood I. Comparison of effective I-131 half-life between thyroid hormone withdrawal and recombinant human thyroid-stimulating hormone for thyroid cancer: A retrospective study. Journal of Medical imaging and Radiation Oncology 2014. https://doi.org/10.1111/1754-9485.12238.
- Grigsby, 2000 Grigsby PW, Siegel BA, Baker S, Eichling JO. Radiation Exposure From Outpatient Radioactive Iodine (131I) Therapy for Thyroid Carcinoma. JAMA 2000;283:2272-2274.
- Gültekin, 2013 Gültekin SS, Sahmaran T. The efficacy of patient-dependent practices on exposure rate in patients undergoing Iodine-131 ablation. Health Phys 2013 104(5) 454-458. https://doi.org/10.1097/HP.0b013e318283f853.
- Hanscheid, 2011 Hänscheid H, Laßmann M, Reiners C. Dosimetry prior to I-131-therapy of benign thyroid disease. Z. Med. Phys. 2011 21 250-257. https://doi.org/10.1016/j.zemedi.2011.01.006
- Hartmann, 2017 Hartmann T, Vach W,Frings L, Mix M, Meyer PR, Ruf J. Radioiodine therapy of benign thyroid-disorders. Assessment of the effective half-lives and determination of influence factors within a Southwestern German cohort. Nuklearmedizin 2017; 56: 171-176. https://doi.org/10.3413/Nukmed-0875-17-01
- Hautzel, 2010. Hautzel H, Pisar E, Yazdan-Doust N, Schott M, Beu M, Müller H-W. Qualitative and Quantitative Impact of Protective Glucocorticoid Therapy on the Effective 131I Half-Life in Radioiodine Therapy for Graves Disease. J Nucl Med 2010; 51:1917-1922. https://doi.org/10.2967/jnumed.110.080473
- Huic, 1996 Huic D, Medvedec M, Dodig D, et al. Radioiodine uptake in thyroid cancer patients after diagnostic application of low-dose 131I. Nucl Med Commun 1996, 17:839-842.
- ICRP 119, 2012 ICRP Publication 119. Compendium of Dose Coefficients based on ICRP Publication 60. Ann ICRP 2012;41 suppl 1:1-130. https://doi.org/10.1016/j.icrp.2012.06.038
- Jacobson, 1978 Jacobson AP, Plato PA, Toeroek D. Contamination of the Home Environment by Patients Treated with Iodine-131: Initial Results. Am J Public Health 68:225-230, 1978
- Jönsson, 2003 Jönsson H, Mattsson S. Single Uptake Measurement for Absorbed Dose Planning for Radioiodine Treatment of Hyperthyroidism. Cancer Biotherapy & Radiopharmaceuticals. 2003 18(3)
- Kloosterman, 2020 Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- Kobe, 2009 Kobe C, Eschner W, Wild M, et al. Radioiodine therapy of benign thyroid disorders: what are the effective thyroidal half-life and uptake of 131I? Nucl med commun 2010, 31:201-205. https://doi.org/10.1097/MNM.0b013e328333d303
- Krohn, 2015 Krohn T, Behrendt FF, Heinzel A, Müller B, Mottaghy FM, Verburg FA. Pretherapeutic dosimetry before 131I therapy of benign thyroid disease. Nuklearmedizin 2015; 54: 131-136. http://dx.doi.org/10.3413/Nukmed-0692-14-08
- Kusakabe, 2012 Kusakabe K, Yokoyama K, Ito K, et al. Thyroid remnant ablation using 1,110 MBq of I-131 after total thyroidectomy: regulatory considerations on release of patients after unsealed radioiodine therapy. Ann Nucl Med 2012, 26:370-378. https://doi.org/10.1007/s12149-012-0590-7
- Lee, 2015 Lee HK, Hong SJ, Jeong KH, et al. An engagement factor for caregiver radiation dose assessment with radioiodine treatment. Rad Prot Dosim 2015 163(4), 499-508. https://doi.org/rpd/ncu231
- Liu, 2014 Liu B, Peng W, Huang R, Tian R, Zeng Y, Kuang A. Thyroid Cancer: Radiation Safety Precautions in 131I Therapy Based on Actual Biokinetic Measurements. Radiology 2014; 273(1).
- Liu, 2015. Liu B, Tian R, Peng W, He Y, Huang R, Kuang A. Radiation Safety Precautions in 131I Therapy of Graves’ Disease Based on Actual Biokinetic Measurements. J Clin Endocrinol Metab. 2015. 100(8):2934-2941. https://doi.org/10.1210/jc.2015-1682.
- Marriott, 2007 Marriott CJ, Webber CE, Gulenchyn KY. Radiation exposure for ‘caregivers’ during high-dose outpatient radioiodine therapy. Rad Prot Dosim 2007; 123(1), 62-67. https://doi.org/10.1093/rpd/ncl084
- Martin, 1997 Martin JE, Fenner FD. Radioactivity in Municipal Sewage and Sludge. Public Health Rep. 1997 Jul-Aug;112(4):308-316
- Mathieu, 1999 Mathieu I, Caussin J, Smeester P, Wambersie A, Beckers C. Recommended restrioctions after 131I therapy: measured doses in family members. Health Phys. 1999 76(2):129-136
- Mattar, 2019 Mattar E, Salih MA, Alsafi K, Suliman II. Radiation protection in the release of patients receiving 131I treatment. Rad Prot Dosim 2019;187(4):499-508. https://doi.org/10.1093/rpd/ncz190
- Menzel, 2003 Menzel C, Kranert WT, Döbert N, et al. rhTSH Stimulation Before Radioiodine Therapy in Thyroid Cancer Reduces the Effective Half-Life of 131I. J Nucl Med 2003; 44:1065-1068.
- Mínguez, 2019 Mínguez P, Rodeño E, Genollá J, Domínguez M, Expósito A, Sjögreen Gleisner K. Analysis of activity uptake, effective half-life and time-integrated activity for low- and high-risk papillary thyroid cancer patients treated with 1.11 GBq and 3.7 GBq of 131I-NaI respectively. Physica Medica 2019 (65) 143-149. https://doi.org/10.1016/j.ejmp.2019.08.017
- Muhammad, 2008 Muhammad W, Faaruq S, Hussain A, Kakakhail MB, Fatmi S, Matiullah. Quantitative analysis of the factors responsible for over or under dos of 131I therapy patients of hyperthyroidism. Radiat Prot Dosim 200. 128(1), 90-97. https://doi.org/10.1093/rpd/ncm243
- Nadig, 2008. Nadig MR, Pant GS, Bal C. Usefulness of 99mTc-pertechnetate single-photon emission computed tomography in remnant mass estimation of postsurgical patients of differentiated thyroid cancer during internal dosimetry. Nucl Med Commun 2008, 29:809-814.
- Nantajit, 2015 Nantajit D, Saengsuda S, NaNakorn P, Saengsuda Y. High-Dose Radioiodine Outpatient Treatment: An Initial Experience in Thailand. Asia Oceania J Nucl Med Biol. 2015; 3(1):66-71.
- Nascimento, 2010. Nascimento AC, Lipsztein JL, Corbo R, Rebelo AM. 131I biokinetics and cytogenetic dose estimates in ablation treatment of thyroid carcinoma. Health Phys. 2010. 99(4):457-463. https://doi.org/10.1093/HP.0b013e3181c8f9ea
- Nielsen, 2006 Nielsen VE, Bonnema SJ, Boel-Jorgensen, H, Grupe, P, Hegedus, L. Stimulation With 0.3-mg Recombinant Human Thyrotropin Prior to Iodine 131 Therapy to Improve the Size Reduction of Benign Nontoxic Nodular Goiter. Arch Intern Med. 2006;166:1476-1482.
- North, 2001 North DL, Shearer DR, Hennessey JV, Donovan GL. Effective half-life of 131I in thyroid cancer patients. Health Phys. 81(3):325-329; 2001.
- O’Connor, 1979 O’Connor MK, Cullen MJ, Malone JF. The value of a tracer dosie in predicting the kinetics of therapeutic doses of 131I in thyrotoxicosis. British J of Radiol. 1979, 52. 719-726.
- Okkalides, 2016 Okkalides D. The Result of Multiple I-131 Treatments on the Effective Half-Life of Retained Radioactivity in Patients Ablated for Differentiated Thyroid Cancer: Possible Evidence for Thyroid Remnant Function Impairment. Cancer biotherapy and radiopharmaceuticals 2016 31(2). https://doi.org/10.1089/cbr.2015.1959
- Pacilio, 2005 Pacilio M, Bianciardi L, Panichelli V, Argirò G, Cipriani C. Management of 131I therapy for thyroid cancer: cumulative dose from in-patients, discharge planning and personnel requirements. Nucl Med Commun 2005, 25:623-631.
- Pant, 2006 Pant GS, Sharma SK, Bal CS, Kumar R, Rath GK. Radiation dose to family members of hyperthyroidism and thyroid cancer patients treated with 131I. Rad Prot Dosim (2006) 118(1):22-27. https://doi.org/10.1093/rpd/nci337
- Papadimitriou, 2006 Papadimitriou D, Kottou S, Oros L, et al. Differentiated thyroid cancer: comparison of therapeutic iodine 131 biological elimination after discontinuation of levothyroxine versus administration of recombinant human thyrotropin. Ann Nucl Med 2006 20(1):63-67
- Poon, 2016 Poon-iad N, Chaudakshetrin P, Sritongkul N, Tuntawiroon M. Total Effective Dose Equivalent to Caregivers from Hospitalized Patients Treated with High Dose Radioiodine for Thyroid Carcinoma. J Med Assoc Thai 2016; 99(2):225-30.
- Procedure Guidelines NVNG, 2017 Procedure Guidelines Nuclear Medicine. NVNG. Kloosterhof, 2017. ISBN: 978-90-78876-09-0
- Ramírez-Garzón, 2014 Ramírez-Garzón YT, Ávila O, Medina LA, et al. Measurement of radiation exposure in relatives of thyroid cancer patients treated with 131I. Health Phys. 107(5):410-416;2011.
- Ravichandran, 2014 Ravichandran R, Al Saadi A, Al Balushi N. Radioactive Body Burden Measurements in 131Iodine Therapy for Differentiated Thyroid Cancer: Effect of Recombinant Thyroid Stimulating Hormone in Whole Body 131Iodine Clearance. World J of Nucl Med 2014 13(1).
- Remy, 2008 Remy H, Borget I, Leboulleux S, et al. ‑131‑I Effective Half-life and Dosimetry in Thyroid Cancer Patients. J Nucl Med 2008; 48: 1445-1450. https://doi.org/10.2967/jnumed.108.052464
- Remy, 2012 Rémy H, Coulot J, Borget I, et al. Thyroid Cancer Patients Treated with 131I: Radiation Dose to Relatives After Discharge from the Hospital. Thyroid 2012; 22(1). https://doi.org/10.1089/thy.2010.0406
- Robinson, 1994 Robinson PS, Barker P, Campbell A, Henson P, Surveyor I, Young PR. Iodine-131 in Breast Milk Following Therapy for Thyroid Carcinoma. J Nucl Med 1994; 35:1797-1801.
- Rogowski, 2011. Rogowski F, Abdelrazek S, Szumowski P, Zonenberg A, Parfienczyk A, Sawicka A. The influence of non-radioactive iodine (127I) on the outcome of radioiodine (131I) therapy in patients with Graves’ disease and toxic nodular goitre. Nuclear Med Rev 2011; 14, 1:9-15.
- RP 97, 1998 European Commission, Directorate-General Environment, Nuclear Safety and Civil Protection. Radiation Protection following Iodine-131 therapy (exposures due to out-patients or discharged in-patients). 1998
- Ruhlmann, 2018 Ruhlmann M, Sonnenschein W, Nagarajah J, Binse I, Herrmann K, Jentzen W. Pretherapeutic 124I dosimetry reliably predicts intratherapeutic blood kinetics of 131I in patients with differentiated thyroid carcinoma receiving high therapeutic activities. Nucl Med Commun. 2018.
- Sabbir Ahmed, 2003 Sabbir Ahmed AS, Demir M, Yasar D, Uslu I. Quantification of absorbed doses to urine bladder depending on drinking water during radioiodine therapy to thyroid cancer patients: a clinical study using MIRDOSE3. Nucl Med Commun 2003, 24:749-754.
- Sabri, 1999 Sabri O, Zimny M, Schulz G, et al. Success Rate of Radioiodine Therapy in Graves’ Disease: The Influence of Thyrostatic Medication. J Clin Endocrinol Metab. 1999 84: 1229-1233.
- Sabri, 2000 Sabri O, Zimny M, Schreckenberger M, Meyer-Oelmann A, Reinartz P, Buell U. Does thyroid stunning exist? A model with benign thyroid disease. Eur J Nucl Med 2000. 27:1591-1597. https://doi.org/10.1007/s002590000348
- Schiavo, 2013 Schiavo M, Bagnara MC, Pomposelli E, et al. Radioiodine therapy of hyperfunctioning thyroid nodules: usefulness of an implemented dose calculation algorithm allowing reduction of radioiodine amount. Q J Nucl Med Mol Imaging 2013;57:301-7.
- Schiavo, 2015. Schiavo M, Bagnara MC, Camerieri L, et al. Clinical efficacy of radioiodine therapy in multinodular toxic goiter, applying an implemented dose calculation algorithm. Endocrine 2014. https://doi.org/10.1007/s12020-014-0398-4.
- Shultis, 2000 Shultis JK, Faw RE. Radiation Shielding. American Nuclear Society 2000.
- Siegersma, 2019 Siegersma D, et al. Potentiële stralingsbelasting na het overlijden van patiënten behandeld met radioactieve stoffen. RIVM Briefrapport 2019-0165.
- Steward, 2017 Steward P. An Excel-Based System to Manage Radiation Safety for the Family of Patients Undergoind 131I Therapy. Jun;45(2):102-110. https://doi.org/10.2967/jnmt.116.185322
- Taïeb, 2010 Taïeb D, Sebag F, Farman-Ara T, et al. Iodine Biokinetics and Radioiodine Exposure after Recombinant Human Thyrotropin-Assisted Remnant Ablation in Comparison with Thyroid Hormone Withdrawal. J Clin Endocrinol Metab 93:3283-3290, 2010.
- Tatiana, 2000 Tatiana HD. Quantitative evidence of thyroid stunning in 131I cancer treatment. Nucl Med Review 2000 3(1):47-51.
- Tonnonchiang, 2016 Tonnonchiang S, Sritongkul N, Chaudakshetrin P, Tuntawiroon M. Radiation Exposure to Relatives of Patients Treated with Iodine-131 for Thyroid Cancer at Siriraj Hospital. J Med Assoc Thai 2016; 99(2):220-4
- Tsuruta, 1993 Tsuruta M, Nagayama Y, Yokoyama N, Izumi M, Nagataki S. Long-term follow-up studies on Iodine-131 treatment of hyperthyroid Graves’ disease based on the measurement of thyroid volume by ultrasonography. Ann Nucl Med 1993 7(3); 193-197
- Venencia, 2002 Venencia CD, Germanier AG, Bustos SR, Giovannini AA, Wyse EP. Hospital Discharge of Patients with Thyroid Carcinoma Treated with 131I. J Nucl Med 2002; 43:61-65.
- Walter, 2005 Walter MA, Christ-Crain M, Müller B, Müller-Brand J. Radioiodine uptake and thyroid hormone levels on or off simultaneous carbimazole medication. Nuklearmedizin 2005; 44
- Willegaignon, 2006 Willegaignon J, Malvestiti LF, Guimaraes MI, et al. 131I effective half-life (Teff) for patients with thyroid cancer. Health Phys. 91(2):119-122; 2006
- Willegaignon, 2009 Willegaignon de Amorim de Carvalho J, Sapienza M, Ono C, et al. Could the treatment of differentiated thyroid carcinoma with 3.7 and 5.55 GBq of (131I)NaI, on an outpatient basis, be safe? Nucl Med Commun 2009 30:533-541. https://doi.org/10.1097/MNM.0b013e32832b79bc
- Willegaignon, 2011 Willegaignon J, Sapienza M, Ono C, et al. Outpatient Radioiodine Therapy for Thyroid Cancer Clin Nucl Med 2011;36: 440-445.
- Willegaignon, 2013a Willegaignon J, Sapienza MT, Buchpiguel CA. Radioiodine Therapy for Graves Disease. Clin Nucl Med 2013;38:231-236.
- Willegaignon, 2013b Willegaignon J, Sapienza MT, Coura Filho GB, Traino AC, Buchpiquel CA. Determining thyroid 131I effective half-life for the treatment planning of Graves’ disease. Med Phys 40 (2013). https://doi.org/10.1118/1.4788660.
- Willegaignon, 2016a. Willegaignon J, Pelissoni RA, Lima BC, et al. Estimating 131I biokinetics and radiation doses to the red marrow and whole body in thyroid cancer patients: probe detection versus image quantification. Radiol Bras. 2016 Mai/Jun;49(3):150-157
- Willegaignon, 2016b Willegaignon J, Pelissoni RA, Lima BC, Sapienza MT, Cour-Filho GB, Buchpiguel CA. Prediction of iodine-131 biokinetics and radiation doses from therapy on the basis of tracer studies: an important question for therapy planning in nuclear medicine. Nucl med commun 2016, 37:473-479.
- Yoshimura, 2013 Yoshimura M, Tsutsui H, Ikeda N, Koizumi K. Thyroid remnant ablation with 1110MBq of 131I in outpatients: measurement of effective dose to household members and establishment of safety precautions. W J Nucl Med Mol Imaging. 2013 Mar;57(1):101-108.
- Zehtabian, 2017 Zehtabian M, Dehghan N, Ghazanfarkhani MD, Haghighatafshar M, Sina S. Measurement of the dose tot he family members taking care of thyroid cancer patients undergoing I-131 therapy in nuclear medicine using TLD-100. Radiat Prot Dosim 2017;174(4): 541-544. https://doi.org/10.1093/rpd/ncw242
- Zhang, 2017 Zhang R, Zhang G, Wang R, Tan J, He Y, Meng Z. Prediction of thyroidal 131I effective half-life in patients with Graves’ disease. Oncotarget, 2017; 8(46); pp80934-80940.
- Zheng, 2011 Zheng W, Jian T, Guizhi Z, Zhaowei M, Renfei W. Analysis of 131I therapy and correlation factors of Graves’ disease patients: a 4-year retrospective study. Nucl Med Commun 2012, 33:97-101.
Evidence tabellen
|
Biological models |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of patients |
Quality |
|
Minguez, 2019 |
Observat |
Papillary thyroid cancer |
Adequate method to establish biological half-life |
131I administration (1.11 or 3.7 GBq) after total thyroidectomy and rhTSH stimulation. Estimation of effective half-life with SPECT/CT |
50 |
B2 |
|
Freesmeyer, 2019 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish biological half-life |
Measurement at three or four time points; blood sampling, whole-body and probe measurements; 410 MBq average. |
48 |
B2 |
|
Bacher, 2019 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish biological half-life |
Measurements directly after administration and then every 12 h using a scintillation counter at 4.5 m from patient. |
366 |
B2 |
|
Ruhlmann, 2018 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish biological half-life |
Data of five blood samples from each patient from 2 until 72 hours post administration. Patients received 1.1 to 16 GBq 131I |
14 |
B2 |
|
Zhang, 2017 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Radioiodine uptake was measured based on tracer dose of 74 kBq. |
256 |
B2 |
|
Fürstner, 2017 |
Observat |
Graves’ disease, toxic adenoma, toxic multinodular goiter |
Measurement of thyroid clearance effective half-life with collar dose meter, comparison with uptake counter. |
7 patients with Graves’ disease, 2 with toxic adenoma and 3 with toxic multinodular goiter. |
12 |
B2 |
|
Hartmann, 2017 |
Observat |
Graves’Disease, multinodular goiter, autonome thyroid nodules en euthyreote goiter. |
Adequate method to establish half-life |
1498 patients with inpatient stay of at least 72 hours and at least 6 probe measurements |
1498 |
B2 |
|
Willegaignon, 2016a |
Observat |
Metastatic thyroid cancer |
Adequate method to establish half-life |
Whole-body scans and probe measurements at 4-96 post administration of a tracer dose (mean activity 87 MBq) 131I. |
14 |
B2 |
|
Okkalides, 2016 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Measurements with a ceiling-mounted detector. Several measurements per patient, but not at fixed times. Mean activity administered 7.93 GBq. |
375 |
B2 |
|
Willegaignon, 2016b |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Measurements of exposure rates following administration of therapeutic activity with a GM detector 2.0 m in front of the patiënt, 1 to 48 hours after administrations. At least 3 time points. |
11 |
B2 |
|
Krohn, 2015 |
Observat |
Benign thyroid disease |
Adequate method to establish half-life |
Retrospective study comparing pretherapeutic measurements performed 24/48/144 hours after administration and post-therapy measurements performed in 12h intervals until discharge |
1538 |
B2 |
|
Liu, 2015 |
Observat |
Graves’ disease |
Adequate method to establish half-life |
Mean activity 310 MBq (range 1185-925 MBq), measurement after 4 and 24 hours. |
72 |
B2 |
|
Grenfell, 2015 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Comparison of effective half-life in rhTSH patients and thryoxine withdrawal patients. Measurements of dose rate at 1 m from the patient right after administration and then every morning and evening until dismissal of the patient |
50 |
B2 |
|
Schiavo, 2015 |
Observat |
Multinodular toxic goiter |
Adequate method to establish half-life |
Estimation of half-life by external dose measurements at 4, 24, 96-120 h after administration of 370 kBq 131I. |
93 |
B2 |
|
Ravichandran, 2014 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Comparison of effective half-life in rhTSH patients and thryoxine withdrawal patients. Half-life is calculated using exposure rate measurements at 1 m from the patient immediately after administration and at 24 hour intervals the next 3 days. |
103 |
B2 |
|
Liu, 2014 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Patients undergoing 131I remnant ablation and treatment for metastases during follow-up. Dose measurements at 0.3 and 1 m from the trunk, 1 m above the floor with an ionization chamber. At least six measurements, at 30 minutes and 12, 24, 48, 72, 144 hours after administration. |
77 |
B2 |
|
Schiavo, 2013 |
Observat |
Hyperthyroïdism |
Adequate method to establish half life |
Before treatment I-131 uptake was evaluated with direct external measurements after 4, 24 and 96-120 h after administration of 370-600 kBq I-131. |
75 |
B2 |
|
Demir, 2013 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
3.70, 5.55 or 7.40 GBq administered. Measurement at 6, 12, 24 hours and 2, 3, 4 and 5 days after administration |
83 |
B2 |
|
Gültekin, 2013 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish half-life |
Measurement of total body exposure rate at four positions (A,P,L,R) at 1 meter from the patient after administration of a fixed dose of 3.7 or 5.5 GBq were used to calculate effective half-life. |
51 |
B2 |
|
Willegaignon, 2013a |
Observat |
Graves’disease |
Based on a 0.37 MBq tracer dose, assumption that biokinetics during therapy are identical. |
Measurement of uptake, 2, 6 and 24 hours after administration of 370 kBq I-131. |
196 |
B2 |
|
Willegaignon, 2013b |
Observat |
Graves’disease |
Based on a 0.37 MBq tracer dose, assumption that biokinetics during therapy are identical. |
Thyroidal uptake was measured at various timepoints after administration of I-131. Effective half-life was calculated based on 2, 3 and 4 time points. |
50 |
B2 |
|
Rogowski, 2011 |
Observat |
Graves’ disease, toxic nodular goiter |
No description on measurement of uptake |
Two groups of 41 and 14 patients were compared, one group received I-127 to study the effect on effective half-life |
65 |
B2 |
|
Eschner, 2011 |
Observat |
Graves’ disease, toxic adenoma, toxic goitre, non-toxic goitre |
Adequate method to establish biological half-life |
Measurement at discharge and late measurements (13-154 days post administration) |
12 |
B2 |
|
Hanscheid, 2011 |
Observat |
Graves’ disease, toxic nodular goiter, non-toxic goiter. |
Adequate method to establish biological half-life |
Uptake measurements 2, 6, 24, 48 and 96 or 120 hours after administration of 1 MBq I-131 were used to describe a 2-compartmental model. |
73 |
B2 |
|
Zheng, 2011 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Uptake of I-131 in the thyroid was measured at 6, 24, 48 and 72 hours after administration of a 74 kBq I-131 tracer dose. |
766 |
B2 |
|
Hautzel, 2010 |
Observat |
Graves’ disease |
Uptake measurements |
Groups with or without prednisolone. 24-hour uptake and subsequent daily 131-I measurements with a survey meter. |
315 |
B2 |
|
Nascimento, 2010 |
Observat |
Thyroid carcinoma, female |
Adequate method to establish biological half-life |
Measurement from first hour following administration until detection limits were reached |
10 |
B2 |
|
Taïeb, 2010 |
Observat |
Thyroid remnant ablation |
Adequate method to establish biological half-life |
Patients in hypothyroid or rhTSH arm. WB scan at 48 and 144 h after therapy, dose rates were assessed at 24, 48 and 144h. Urinary samples were obtained during the first 48 h. |
79 |
B2 |
|
Araujo, 2009 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Measurements between 14 and 30 hours post-administration were used to determine effective half-life |
8 |
B2 |
|
Kobe, 2009 |
Observat |
Graves’ disease, nontoxic goitre, toxic goitre, toxic uninodular adenoma. |
Adequate method to establish biological half-life |
Estimation of effective half-life and uptake of 131I by uptake measurements after 24 h and 5 days after pretherapeutic dose and measurements during therapy. |
1417 |
B2 |
|
Remy, 2008 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
1.11 or 3.70 GBq administered. At least 7 measurements per patient; at 0.5, 2, 14, 26, 38, 50 and 62 hours after administration |
254 |
B2 |
|
Nadig, 2008 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish biological half-life |
Effective half life and 24h uptake were calculated by repeated neck count measurements. All patients had undergone different types of surgery (total/near-total/copmlete thyroidectomy; subtotal throidectomy and hemithyroidectomy. |
39 |
B2 |
|
Muhammad, 2008 |
Observat |
Diffuse goiter, nodular goiter |
Adequate method to establish biological half-life |
Uptake test with probe. From uptake levels at 24 and 48 h, the effective half-life and estimated zer-time uptake were determined. |
59 |
B2 |
|
Dunkelmann, 2007 |
Observat |
Graves’ disease. |
Adequate method to establish biological half-life |
Uptake measurements in thyroid during test and therapy, studying the effects of (dis)continuation of antithyroid medication. |
316 |
B2 |
|
Nielsen, 2006 |
Observat |
Nontoxisch nodulair goiter |
Adequate method to establish biological half-life |
Effect of rhTSH on therapy with 131I. Double-blind, placebo-controlled trial. Effective half-life was calculated from 24 and 96-hour thyroid uptake measurements. |
57 |
B2 |
|
Dunkelmann, 2006 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
The effect of lithium on intrathyroidal kinetics was studied. Diagnostic and therapeutic radioiodine kinetics were monitored by at least 10 uptake measurements within 48 hours. |
267 |
B2 |
|
Eschmann, 2006 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
In this prospective study, the influence of interruption of antithyroid drugs was studied. Intratherapeutic radioiodine uptake was derived from daily probemeasurements at 1 meter from the cervical region of the patient. Based on this data effective half-life was calculated. |
141 |
B2 |
|
Willegaignon, 2006 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
8.2 Gbq administered on average, measurements from 1 h after administration until discharge. |
90 |
B2 |
|
Papadimitriou, 2006 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
3 different groups, measurements up to 72 h post-administration |
191 |
B2 |
|
Pacilio, 2005 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
Administration activity ranged from 2590 to 9250 MBq. Measurements studied during hospitalization of 2-4 days. |
265 |
B2 |
|
Walter, 2005 |
Observat |
Toxisch nodulair goiter and Graves’ disease |
Adequate method to establish biological half-life |
Effect of carbimazole medication was studies. RAI uptake was assessed at 2, 4, 24 and 48 hours after administration. |
12 |
B2 |
|
Menzel, 2003 |
Observat |
Differentiated thyroid cancer |
Adequate method to establish biological half-life |
Measurement of remaining activity within the whole body measured daily for at least 2 and up to 6 days. Probe was placed at 3.5 m from patient. A biexponential fit was made. |
265 |
B2 |
|
Sabbir Ahmed, 2003 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
Measurements of urine samples up to 1 week after administration. |
29 |
B2 |
|
Jönsson, 2003 |
Observat |
Hyperthyroidism |
Adequate method to establish biological half-life |
Retrospective analysis. Uptake measurements were made using a NaI-detector at 24, 48 and 3 to 8 days after intake of test activity. |
515 |
B2 |
|
Venencia, 2002 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
Measurement of dose with personal dosimeter placed on left pectoral muscle for a mean of 2.5 days of measurements |
14 |
B2 |
|
North, 2001 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
Measurement after administration, 1st night and 2nd night (when applicable) |
238 |
B2 |
|
Sabri, 2000 |
Observat |
Graves’ disease or diffuse/toxic nodular goitre |
Adequate method to establish biological half-life |
Patients who received two-step I-131 therapy as the absorbed dose from first application was below target dose. Antithyroid medication was discontinued. Uptake measurements were performed twice a day. |
171 |
B2 |
|
Tatiana, 2000 |
Observat |
Papillary and follicular thyroid cancer |
Adequate method to establish biological half-life |
Calculation of effective half-life based on uptake measurements after administration of a test dose. No details on measurement method. |
30 |
B2 |
|
Catargi, 1999 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Patients withoud antithyroid therapy and no excessive 24h iodine excretion. Effective half-life and maximum uptake were determined after application of 1 MBq I-131. Kinetics were measured after 3, 6, 24 and 48 h. At therapy, iodine kinetics were measured during 5 days with a scintillation counter. |
100 |
B2 |
|
Mathieu, 1999 |
Observat |
Thyroid cancer, hyperthyroidism. |
Adequate method to establish biological half-life |
Effective half=life of I-131 was measured with a gamma camera at 4, 6, 9, 12, 14 and 16 days after treatment for thyroid cancer. For hyperthyroidism, measurements were performed at 1, 5, 8, 12, 14, 19 and 21 days post-administration. |
40 |
B2 |
|
Sabri, 1999 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Iodine uptake and effective half-life were determined with a test dose of 2 MBq I-131. After administration of therapeutic dose measurements were performed once or twice daily. |
207 |
B2 |
|
Aktay, 1996 |
Observat |
Hyperthyroidism |
Adequate method to establish biological half-life |
Retrospective analysis. All medications that could interfere were stopped 4 to 6 days before treatment. Uptake measurements were obtained 4-6 and 20-25 h after administration of 3 – 9 µCi I-131. |
460 |
B2 |
|
Huic, 1996 |
Observat |
Thyroid cancer |
Adequate method to establish biological half-life |
Retention in thyroid was determined with a whole-body counter from profile scans 2, 24, 48 and 72 hours after administration of diagnostic dose. 72 hours after administration of therapeutic dose, whole-body scanning was performed once more. |
24 |
B2 |
|
Berg, 1996 |
Observat |
Graves’ disease and toxic nodular goiter |
Adequate method to establish biological half-life |
Repeated uptake measurements at 24 and 48 h and 4 or 6 days to define effective half-life. |
555 |
B2 |
|
Tsuruta, 1993 |
Observat |
Graves’ disease |
Adequate method to establish biological half-life |
Study of outcome of treatment. I-131 uptake and half life were determined and reported per patient |
13 |
B2 |
|
Hilditch, 1991 |
Observat |
Thyrotoxicosis |
Adequate method to establish biological half-life |
Measurement up to 50 days post-administration. |
77 |
B2 |
|
Connell, 1987 |
Observat |
Graves’ |
Adequate method to establish biological half-life |
2 treatment protocols, mesaurements up to 22 days post-administration. |
24 |
B2 |
|
O’Connor, 1979 |
Observat |
Thyrotoxicosis |
Adequate method to establish biological half-life |
Uptake of tracer doses (5 – 16 µCi) was measured 24 hours post-administration with a scintillation counter. Effective half-life was estimated by measureing thyroidal radioiodine content several times per week with a probe or thermoluminescent disks. |
31 |
B2 |
|
Scenarios/pathways |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of people |
Quality |
|
Sudbrock, 2017 |
Observat |
Adenoma, Graves’disease, carcinoma |
Adequate measurements |
Average administration of 1.38 GBq (adenoma)/1.05 GBq (Graves’)/3.1GBq (carcinoma). |
47 (26 adenoma, 13 Graves’, 8 carcionoma) |
B2 |
|
Griffiths, 2000 |
Observat |
Thyroid cancer |
Staff at ICU not familiar with ionising radiation |
Patient treated with 3011 MBq. |
1 |
B2 |
|
Martin, 1997 |
Observat |
? |
|
Radioactivity in sewage, measured following radioiodine treatments of patients (14.8 GBq in total) |
2 |
B2 |
|
Prichard, 1981 |
Observat |
? |
Amount of I-131 administered in hospital not known |
Radioactivity in sewage |
- |
B2 |
|
Exposure public |
||||||
|
|
Type |
Selection bias |
Measurement bias |
Confounding bias |
Nr of people |
Quality |
|
Mattar, 2019 |
Observat |
Hyperthyroidic, thyroid cancer |
Caregivers and patients received radiation protection instructions |
3.7 – 7.4 GBq administrated, contamination was measured |
|
B2 |
|
Zehtabian, 2017 |
Observat |
Thyroid cancer |
Caregivers and patients received radiation protection instructions. |
TLD-100 measurement for 24 days. Patients receiving 3.70 GBq were released after 1 day, up to 7.4 released after 2 days. |
29 caregivers |
B2 |
|
Poon, 2016 |
Observat |
Thyroid cancer |
Caregivers received radiation protection instructions. |
Patients released when remaining activity < 1.11 GBq. EPD clipped to belt. |
13 caregivers |
B2 |
|
Tonnonchiang, 2016 |
Observat |
Thyroid cancer |
Caregivers received radiation protection instructions |
Hospitalized patiënts with 5.55 – 7.40 GBq administered. Measurements with EPD during 3 days. |
20 caregivers |
B2 |
|
Kochovska, 2016 |
Observat |
Hyperthyroidism, thyroid cancer |
Caregivers received radiation protection instructions |
Discharge for thyroid cancer patients when doserate is < 8 µSv/h at 2 m. Administered dose for hyperthyroid patients up to 1295 MBq. Measurements for 1 week. |
60 family members |
B2 |
|
Gains, 2015 |
Observat |
Thyroid cancers |
Comforters and carers received verba land written explanation of risks and reductional measures. |
Children with thyroid cancer received 3.0 or 5.5 GBq. |
41 patients |
B2 |
|
Nantajit, 2015 |
Observat |
Radioiodine treatment on outpatient basis |
Caregivers and patients received radiation protection instructions |
Administration of 3.70 – 5.55 GBq. Measurement with personal dosimeter on torso. |
10 caregivers |
B2 |
|
Ramirez-Garzon, 2014 |
Observat |
Thyroid cancer |
Caregivers and patients received radiation protection instructions |
Release when doserate < 50 µSv/h at 1m. Administered dose >3.70 GBq. Measurement with TLD-badges. |
40 caregivers |
B2 |
|
Lee, 2015 |
Observat |
Inpatients (> 3700 MBq) and outpatients (1110 MBq) |
Caregivers and patients received radiation protection instructions |
Measurement with TLD-badges for 7 days on average. |
31 caregivers (outpatients); 33 caregivers (inpatients) |
B2 |
|
Yoshimura, 2013 |
Observat |
Remnant ablation |
Patients and household members received safety precautions |
Effective dose measured using personal dosimeter. |
|
B2 |
|
Kusakabe, 2012 |
Observat |
Differentiated thyroid cancer |
Caregivers and patients received radiation protection instructions |
Dose rate measurements with survey meter at 1 m from patient; dose level for caregiver measured with personal dosimeter. |
37 |
B2 |
|
Remy, 2012 |
Observat |
Thyroid cancer |
Caregivers and patients received radiation protection instructions |
Administered dose was 3.7 GBq I-131. Patients remained in radiation protection ward for 3 days. Radiation dose was monitored using a personal dosimeter. |
67 |
B2 |
|
Gabriel, 2011 |
Observat |
Thyroid cancer |
Safety guidelines were explained. |
Dose measurement with optically stimulated lumenescence-based personal dosimeter during 3 days after discharge. |
48 |
B2 |
|
Willegaignon, 2011 |
Observat |
Thyroid cancer |
Caregivers and patients received radiation protection instructions |
Administered dose 3.9 to 7.8 GBq, on outpatient basis. Measurements with chest dosimeter. |
90 caregivers |
B2 |
|
Willegaignon, 2009 |
Observat |
Differentiated thyroid carcinoma |
Caregivers and patients received radiation protection instructions |
Administered dose 3.7 or 5.55 GBq on outpatient basis. Measurements with a TLD. |
26 caregivers |
B2 |
|
Barrington, 2008 |
Observat |
Hyperthyroidism |
Caregivers and patients received radiation protection instructions |
Measurement of internal activity. |
145 family members |
B2 |
|
Marriott, 2007 |
Observat |
Differentiated thyroid carcinoma |
Caregivers and patients received radiation protection instructions |
Administration of 3.7 GBq on outpatient basis. Measurement on hourly basis for 1 week using personal dosemeter. |
27 caregivers |
B2 |
|
Pant, 2006 |
Observat |
Hyperthyroidism, thyroid cancer |
Caregivers and patients received radiation protection instructions |
For Graves’ disease 185-500 MBq administered; for DTC 0.925 – 7.4 GBq. Measurement with personal dosimeter. |
45 caregivers for thyrotoxicosis patients; 297 caregivers for thyroid cancer patients |
B2 |
|
Grigsby, 2000 |
Observat |
Thyroid cancer |
Caregivers and patients received radiation protection instructions |
Administered doses from 2.8 to 5.6 GBq. Exposure was monitored for 10 days after administration. Measurement with optically stimulated luminescence dosimeters. |
65 household members |
B2 |
|
Mathieu, 1999 |
Observat |
Thyroid cancer, hyperthyroidism |
Caregivers and patients received radiation protection instructions |
Measurement with TLD on chest for 15 to 21 days after administration. Administration of 3.7 – 7.4 GBq, hospitalization for 2 days for thyroid cancer. Administration of 200-600 MBq for hyperthyroid patients on outpatient basis. |
73 family members |
B2 |
|
Jacobson, 1978 |
Observat |
? |
? |
Measurement with TLD wristbands |
17 family members |
B2 |
Exclusietabel
|
|
|
Reason for exclusion |
|
1 |
Yang, 2018 |
No description of how half-life was established |
|
2 |
van Gils, 2017 |
Feasibility study with low power (n = 2 patients) |
|
3 |
Mínguez, 2016 |
Only mentions effective half-life for remnants, uptake is unknown. |
|
4 |
Krohn, 2014 |
No measurements during the first hours after administration and assumption of a fixed half-life based on ICRP publication |
|
5 |
Rani, 2014 |
Only describes half-life for lesions |
|
6 |
Vogel, 2013 |
Full text n/a |
|
7 |
Lee, 2013 |
Only describes half-life for salivary glands |
|
8 |
Mínguez, 2013 |
Only describes half-life for thyroid remnants; uptake unknown |
|
9 |
Szumowski, 2012 |
Only half-life for thyroid remnants, no exact quantification |
|
10 |
Carvalho, 2012 |
No quantitative description of half-life |
|
11 |
Kahraman, 2012 |
No determination of half-life |
|
12 |
Merrill, 2011 |
No determination of half-life |
|
13 |
Wang, 2010 |
Results are not quantitatively described |
|
14 |
van Isselt, 2010 |
No quantitative determination of half-life |
|
15 |
Biondi, 2009 |
Half-life not determined. |
|
16 |
Willegaignon, 2006 |
Cohort is similar to (and possibly overlaps with) the population included in another article by the same author in the same year. |
|
17 |
Hoyes, 2004 |
Half-life not determined |
|
18 |
Moka, 2002 |
Half-life not determined |
|
19 |
Siddiqi, 2001 |
Half-life not determined |
|
20 |
Reynolds, 1997 |
Tumor specific half-life, not WB or exactly described |
|
21 |
Zanzonico, 1997 |
Half-life not determined |
|
22 |
Samuel, 1994 |
Uptake and effective half-life in thyroid remnants, but not combined in a useful way |
|
23 |
Matsushita, 1994 |
Full text not available. |
|
24 |
Wasserman, 1993 |
Biokinetics not determined. |
|
25 |
Heinemann, 1983 |
Full text not available |
|
26 |
Gimlette, 1981 |
Full text not available |
|
27 |
Smith, 1977 |
No quantitative data that can be used |
|
28 |
Malone, 1975 |
Feasibility study with low power (n = 2 patients) |
|
29 |
Livadas, 1975 |
Full text not available |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-07-2021
Beoordeeld op geldigheid : 20-04-2021
Deze module is opgesteld door de werkgroep herziening aanbevelingen ‘het werken met therapeutische doses radionucliden’, bestaande uit afgevaardigden vanuit de NVNG, NVKF, NVS en ANVS. Er is nauw contact onderhouden met het RIVM, dat gelijktijdig het rapport [Kloosterman, 2020] schreef.
De werkgroep beveelt aan in 2026 de inhoud van deze module te beoordelen, en te overwegen of revisie of herziening gewenst is.
Doel en doelgroep
Doel
In 2005 werden de Aanbevelingen ‘Het werken met therapeutische doses radionucliden’ gepubliceerd. Deze aanbevelingen waren bedoeld als leidraad voor degenen die in de medische praktijk betrokken waren bij het werken met therapeutische doses radionucliden (met name bij 131I-therapieën). Het vormde onder andere de basis voor de normen voor ontslag van de patiënt en de leefregels die na ontslag aan de patiënt werden meegegeven met als doel de blootstelling van verzorgers en andere personen in de naaste omgeving van ontslagen patiënten zoveel als redelijkerwijs mogelijk te beperken. Heden ten dage is niet alleen het aantal behandelingen met radioactieve stoffen toegenomen maar worden naast 131I diverse andere radionucliden, zoals bijvoorbeeld 177Lu, veelvuldig voor therapie ingezet. Om ook voor de nieuwe therapieën goed onderbouwde ontslagnormen en leefregels te kunnen opstellen, heeft een werkgroep bestaande uit vertegenwoordigers van de Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG), de Nederlandse Vereniging voor Klinische Fysica (NVKF) en Nederlandse Vereniging voor Stralingshygiëne (NVS) in nauwe samenwerking met vertegenwoordigers van de Autoriteit Nucleaire Veiligheid en Stralingsbescherming (ANVS) de aanbevelingen herzien.
Doelgroep
De richtlijn is bedoeld voor (medisch) specialisten uit de radiofarmacie, klinische fysica, nucleaire geneeskunde en radiochemie. Daarnaast is de richtlijn ook relevant voor verwijzers, i.e. internisten, oncologen, urologen, longartsen. Gegeven de expliciete positie van de ‘Aanbevelingen’ in de Kernenergiewet vergunning is deze richtlijn ook relevant voor de overheid en stralingsbeschermingsdeskundigen in medische centra.
Samenstelling werkgroep
Richtlijnwerkgroep
- ir. S. Rijnsdorp (voorzitter) NVKF
- Dr. D. Dieckens NVNG
- Dr. B. Godthelp ANVS
- Dr. T. van der Goot NVKF
- Ing. D.W. Rook NVS
- Drs. N.C .Veltman NVNG
Belangenverklaringen
Er zijn geen conflicterende belangen gemeld. De volledig ingevulde belangenverklaringen zijn op te vragen bij het secretriaat van de Nederlandse vereniging nucleaire geneeskunde.
Inbreng patiëntenperspectief
Gezien de zeer specialistische en technische aard van de uitgangsvragen is het perspectief van de patiënt op de aanbevelingen niet van toepassing.
Methode ontwikkeling
Evidence based
Werkwijze
Bronnen
Voor medici die deze richtlijn lezen is het goed om stil te staan bij de verschillen tussen het domein waar deze richtlijn betrekking op heeft, blootstelling aan ioniserende straling van personen in de omgeving van de patiënt buiten het ziekenhuis, ten opzichte van het gebruikelijke klinisch domein van een medisch specialistische richtlijn. Dit verschil betekent dat de literatuur en de kennis die over stralingsblootstellingen en eventuele maatregelen te vinden is verschillen kent ten opzichte van de klinisch wetenschappelijke literatuur. Waar de klinisch wetenschappelijke literatuur vooral leunt op klinische trials gericht op de vergelijking tussen interventie en reguliere zorg is die opzet niet haalbaar in het domein van de stralingsblootstellingen op grond van medisch ethische bezwaren bij een dergelijke onderzoeksopzet met blootstelling aan ioniserende straling als interventie en het meten van de schadelijke effecten daarvan als uitkomstmaat. Voor klinische studies met patiënten waarbij de stralingsblootstelling een therapeutisch effect beoogt zijn wel klinische trials beschikbaar, maar daarmee begeeft de studie zich weer in het klinisch domein en bovendien gelden ook dan aanvullende aanbevelingen ten aanzien van de stralingsblootstelling van vrijwilligers ten opzichte van reguliere klinische therapeutische verrichtingen [Radiation Protection 97, 1998]. Deze richtlijn richt zich niet op aanbevelingen ten aanzien van de klinische toepassing van therapeutische radiofarmaca. Om die reden zal niet gezocht worden naar fase 3 klinische trials als meest richting gevende referentie, aangezien die alleen bestaan voor studies naar de therapeutische effectiviteit. Dat aspect van stralingsblootstellingen wordt gedekt door de betreffende klinische richtlijnen rondom een ziektebeeld waar het gebruik van therapeutische radiofarmaca hun toepassing hebben. Deze richtlijn richt zich op de veiligheid van de toepassing van radiofarmaca voor verzorgers en leden van de bevolking. Voor de omgeving dient de patiënt beschouwd te worden als een stralingsbron met een continu veranderende activiteit door fysisch verval, het biologisch gedrag van het radiofarmacon in de patiënt en uitscheiding. De relevante literatuur om die informatie beschikbaar te krijgen gaat over biodistributie, farmacokinetiek en farmacodynamiek. Dit betreft de fase 1 en 2 studies voor een radiofarmacon. Aangezien het biologisch gedrag gerelateerd is aan de chemische eigenschappen van een stof geldt dat dit biologisch gedrag niet specifiek voor radioactieve isotopen geldt, maar ook voor de stabiele natuurlijke isotopen van een zelfde stof. Een deel van de vereiste informatie bevindt zich dus buiten het klinisch domein. Vanwege bovenstaande is de gebruikelijke classificatietabel voor het graderen van de bewijskracht van gevonden literatuur uit de EBRO of GRADE methodologie niet toepasbaar. Wel is een alternatieve weging van bronnen gebruikt zoals hierna beschreven om in de geest van EBRO te blijven werken.
In belangrijke mate is de informatie waarmee bepaald kan worden wat de blootstelling van de omgeving is, gebaseerd op fysische eigenschappen van ioniserende straling, radioactieve stoffen en afscherming. Voor de afscherming die wordt veroorzaakt door het lichaam van de patiënt is in de berekeningen gekozen om als benadering van de werkelijkheid het menselijk lichaam opgebouwd te zien uit een laag water. De bedoelde grootheden zijn grotendeels bekende waarden waarvoor het toepassen van een graderingsschaal niet zinvol is. De beschrijving van de toegepaste zoektermen en de documentatie over inclusie en exclusie van literatuur inclusief het onderliggend argument zijn wel uitgevoerd.
De literatuursearches zijn uitgevoerd in Pubmed omdat via deze database, zowel geneeskundige literatuur als ook de fysische, biologische en biofysische literatuur beschikbaar is. Daarnaast is rekening gehouden met de kaders en normen van de wetgeving, meer specifiek de Kernenergiewet [KEW, 1963] en het Besluit basisveiligheidsnormen stralingsbescherming [Bbs, 2018]. Dit besluit is een uitwerking van de Europese Richtlijn 2013/59/Euratom van 5 december 2013 [Euratom, 2013]. In deze Europese Richtlijn staat de volgende overweging:
“(27) De besmetting van het milieu kan een bedreiging voor de menselijke gezondheid vormen. In de secundaire wetgeving van de Gemeenschap is die besmetting tot nog toe alleen beschouwd als blootstellingsroute voor de leden van de bevolking die rechtstreeks getroffen zijn door de lozing van radioactieve afvalstoffen in het milieu. Aangezien de staat waarin het milieu zich bevindt de menselijke gezondheid op de lange termijn kan beïnvloeden, is beleid vereist dat het milieu beschermt tegen de schadelijke gevolgen van ioniserende straling. Ten behoeve van de bescherming van de menselijke gezondheid op de lange termijn dient rekening te worden gehouden met milieucriteria die zijn gebaseerd op internationaal erkende wetenschappelijke gegevens (zoals gepubliceerd door de EC, de ICRP, de Wetenschappelijke Commissie van de Verenigde Naties inzake de gevolgen van atoomstraling, de Internationale Organisatie voor Atoomenergie (IAEA)).”
Ten aanzien van de blootstelling van het milieu waarnaar gerefereerd wordt zijn er in deze richtlijn geen specifieke berekeningen en aanbevelingen gedaan ten aanzien van het beschermen van het milieu voor blootstelling aan ioniserende straling. De reden daartoe is dat met het naleven van leefregels ter reductie van de blootstelling van derden vanzelf aan de huidige normering voor het milieu wordt voldaan. Als er naar bijvoorbeeld één behandeling met 177Lu-PSMA wordt gekeken, wordt er bij lozing van 100% van de toegediende activiteit niet meer dan 0,05 Reing geloosd door de patiënt thuis. Dit betekent dat dit zonder vergunning geloosd mag worden. Trends zullen wel in de gaten gehouden moeten worden, maar op dit moment is er geen toegevoegde waarde voor aparte aanbevelingen ten aanzien van het milieu.
In de overige paragrafen van de Europese Richtlijn worden de specifieke publicaties van bovenstaande organisaties, bron van de bedoelde “internationaal erkende wetenschappelijke gegevens”, meerdere malen aangehaald. De richtlijnwerkgroep heeft daarom deze passage geïnterpreteerd als generieke verwijzing naar de huidige (en mogelijk toekomstige) publicaties door genoemde organisaties die betrekking hebben op stralingsblootstelling van leden van de bevolking. Daarmee geeft de Europese Raad dus aan dat regelgeving binnen de lidstaten gebaseerd dient te zijn op de wetenschappelijke gegevens die geleverd worden via deze organisaties, waarbij 2013/59/Euratom zelf deze gegevens al (grotendeels) samengebracht heeft in een format voor implementatie tot wetgeving binnen de EU lidstaten. De relatie tussen Euratom en het IAEA is dat de aanbevelingen (Safety Standards) van het IAEA als basis gelden voor mogelijke wetgeving en daarom zullen worden geïmplementeerd via Euratom richtlijnen. IAEA baseert haar Safety Standards weer primair op de ICRP publicaties.
Om deze redenen zijn de dosisnormen, voor zover vermeld in deze publicaties, overgenomen in volgorde van meest directe relatie met geldende Nederlandse wetgeving: 1) KEW en Besluit basisveiligheidsnormen stralingsbescherming 2) Euratom 3) IAEA, en 4) ICRP. Voor de fysische en biologische eigenschappen zijn zoekopdrachten in Pubmed uitgevoerd. Vooral voor het vinden van gegevens over biologisch gedrag en maatregelen ter bescherming tegen straling zijn deze zoekopdrachten relevant, aangezien die maar beperkt of niet beschreven zijn in bovenstaande publicaties. Ook zijn er zoekopdrachten uitgevoerd voor de wel beschreven eigenschappen, maar dan beperkt tot de periode na de zoekdatum van de betreffende publicaties om te verifiëren dat er niet al nieuwe inzichten zijn ontstaan.
Bij het beoordelen van de kwaliteit van de literatuur die is gevonden middels zoekopdrachten in Pubmed, is onderscheid gemaakt tussen hoge kwaliteit en lage kwaliteit van het uitgevoerde onderzoek. Kenmerken die iets classificeren als hoge of lage kwaliteit zijn terug te zien in Tabel 1, waarbij voldoen aan ≥ 2 kenmerken beschouwd wordt als hoge kwaliteit.
Tabel 1: beoordelingscriteria voor de kwaliteit van gevonden literatuur
|
Kenmerk |
Hoge kwaliteit |
Lage kwaliteit |
|
onderwerp |
mensen |
dieren |
|
opzet |
experimenteel |
observationeel |
|
methode |
reproduceerbaar |
niet reproduceerbaar |
Omdat wet- en regelgeving vóór eigen wetenschappelijk inzicht van de professional in de stralingsbescherming gaat, is onderstaande volgordelijkheid aangehouden op basis van autoriteit van de gevonden gegevens met van boven naar beneden hogere waarde naar mindere waarde. De gradering van de gebruikte bronnen en daarmee de bewijskracht is conform Tabel 2. Hierbij geldt niet zozeer wetenschappelijke maar meer juridische bewijskracht.
Tabel 2: gradatie in kwaliteit van geïncludeerde bronnen
|
Bbs/KEW |
A1 |
|
Richtlijn 2013/59/Euratom |
A2 |
|
IAEA |
A3 |
|
ICRP |
A4 |
|
Pubmed hoge kwaliteit |
B1 |
|
Pubmed lage kwaliteit |
B2 |
Vragen voor zoekopdrachten
De aanbevelingen in deze richtlijn dienen gebaseerd te zijn op het mortaliteitsrisico en/of morbiditeitsrisico per toepassing van een radiofarmacon per scenario voor leden van de bevolking (anderen dan de patiënt zelf en de betrokken zorgprofessionals). Deze getallen zijn bekend voor de stralingsblootstelling uitgedrukt in Sv [ICRP 103, 2007]. Extra aandacht verdient de beoordeling van deze waarden tussen verschillende leeftijdsgroepen. Voor het bepalen van de blootstelling zijn gegevens nodig over:
A. de samenstelling van een radiofarmacon, inclusief contaminatie met moeder/dochter/zuster-isotopen
B. de hoeveelheid activiteit in de patiënt in de loop van de tijd I) voor de activiteit in de loop van de tijd hebben we het biologisch model van een radiofarmacon in de patiënt nodig (inclusief de contaminatie isotopen). II) de fysische halveringstijden
C. de afscherming van de straling door het lichaam van de patiënt
D. de afstanden tot de activiteit
E. tijdstip van blootstelling t.o.v. tijdstip van toediening en blootstellingsduur
F. omgevingsdosisequivalenttempoconstanten per radionuclide.
G. dosisconversieconstanten voor ingestie per radionuclide
Voor onderdelen D en E dienen de relevante scenario’s (zie hieronder) bekend te zijn.
De literatuurstudie beoogt bovenstaande gegevens boven tafel te krijgen. Gedeeltelijk is dat opzoeken van bekende fysische eigenschappen (fysische halveringstijden, massieke verzwakkingscoëfficiënten van water, omgevingsdosisequivalenttempoconstanten), te halen uit het scenario (tijdstip van blootstelling t.o.v. tijdstip van toediening, blootstellingsduur, afstanden tot de activiteit) en literatuurzoekopdrachten in de eerder beschreven bronnen (biologische modellen). De scenario’s zijn ontleend aan de RIVM-publicatie ‘Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden’ [Kloosterman, 2020], waarbij deze scenario’s zijn gebaseerd op SCP-studie ‘Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven’ [Roeters, 2018].
Ook de inventarisatie van maatregelen waarmee de blootstelling kan worden verlaagd, is iets wat gebaat kan zijn bij een literatuurzoekopdracht. Deze maatregelen zijn niet radiofarmaconspecifiek. Aspecten die daarin dienen te worden meegenomen zijn maatregelen die zich richten op:
- klaring via verschillende uitscheidingsroutes
- inname via ingestie/inhalatie door derden
- afscherming voor gamma-/beta-/alfa-straling
- afstand tot de patiënt
De vragen voor de literatuurzoekopdrachten zullen per radiofarmacon worden uitgevoerd en zijn gericht op onderstaande 3 onderdelen:
- biologische model
- scenario’s
- stralingsbeschermingsmaatregelen
Berekeningen
Voor de te verrichten berekeningen conform de rekenmethode [Kloosterman, 2020] zijn fysische en dosimetrische parameters nodig die in de meeste gevallen tabulair gepubliceerd zijn. Primaire bron hierbij zijn de IAEA- en ICRP-publicaties. Bij het zoeken naar de vereiste waarden voor de benodigde rekenvariabelen bleek dat deze niet altijd terug te vinden waren voor alle in deze richtlijn behandelde radiofarmaca. Om die reden zijn ook andere bronnen gebruikt om de dataset compleet te krijgen. Hetzelfde gold voor de afschermingseigenschappen voor het materiaal water voor de verschillende fotonenergieën. Deze bronnen werden verkregen doordat ze al bekend waren bij een of meer van de leden van de werkgroep, op basis van opzoeken van de data safety sheets van radiofarmaca door fabrikanten en door generieke online searches middels Google.
Reeds bekend bij de leden of gevonden via bovenstaande methode zijn de volgende bronnen:
- Atomic and Nuclear Data from the French Laboratoire National Henri Becquerel (http://www.lnhb.fr/nuclear-data/nuclear-data-table)
- The RadPro Calculator (http://www.radprocalculator.com/Gamma.aspx)
- National Institute of Standards and Technology U.S. Department of Commerce (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
- Radiological Protection Ordinance of 22 june 1994 from the Swiss Federal Council (https://www.admin.ch/opc/en/classified-compilation/19940157/201401010000/814.501.pdf)
- Dose distributions in the ICRU sphere for monoenergetic photons and electrons and for ca. 800 radionuclide. Petoussi N, Zankl M, Fehrenbacher G, Drexler G. Institut für Strahlenschutz. GSF-Bericht 7/93 (https://push-zb.helmholtz-muenchen.de/deliver.php?id=10991)
- Personal Dose-equivalent conversion coefficients for 1252 radionuclides. T. Otto. Radiation Protection Dosimetry. 2016, vol 168, No 1: p1-70.
- Radiation Shielding. Shultis JK, Faw RE. Amer Nuclear Society. 2000
- X-Ray Mass Attenuation Coefficients for Water (https://physics.nist.gov/PhysRefData/XrayMassCoef/ComTab/water.html)
Ten aanzien van de berekeningen die zijn toegepast zij verwezen naar de Rekentool waar zowel de gebruikte bronnen als de rekenformules zijn gegeven. Ook de rekenkundige definitie van de transmissie van gammastraling door het lichaam van de patiënt (ftli) die in de Tabel met gehanteerde parameters voor de berekeningen wordt gegeven bij iedere module wordt daar toegelicht.
Maatregelen
Na het in kaart brengen van bovenstaande gegevens is de volgende stap het beoordelen welke factoren de meeste invloed hebben op reductie van de stralingsblootstelling. Hiertoe zijn berekeningen uitgevoerd, opgebouwd middels een blootstellingscenario gebaseerd op de SCP-tijdsbestedingsscenario’s [Roeters, 2018]. Deze werkwijze is ook toegepast in het rekenmodel dat is ontwikkeld door het RIVM voor het rapport ‘Nucleair-geneeskundige therapieën: potentiële blootstellingen voor derden’ [Kloosterman, 2020]. De principes van dit RIVM-rekenmodel zijn overgenomen in de Rekentool die is ontwikkeld voor deze richtlijn. Rechtstreeks overnemen van het rekenmodel van het RIVM bleek niet mogelijk doordat daarin de transmissiefactor is ontleend
aan het programma Nucleonica waarover de richtlijnwerkgroep niet de beschikbaarheid had en dat ook gezien moet worden als ‘blackbox’. Dit tast de reproduceerbaarheid en mogelijkheid tot updaten van waarden op basis van nieuwe literatuur aan. In de Rekentool bij deze Richtlijn is daarom een berekende transmissiefactor gehanteerd. Door de scenario-gebaseerde berekeningen wordt inzichtelijk welke handelingen binnen dat scenario verantwoordelijk zijn voor het belangrijkste deel van de totale blootstelling. Hierdoor is optimale selectie van maatregelen ter reductie van de blootstelling mogelijk. In de aanbevelingen die zijn geformuleerd zijn de meest relevante en generieke maatregelen benoemd. Daarnaast is de Rekentool die is ontwikkeld voor deze berekeningen eveneens beschikbaar gesteld. Met deze rekenbladen kunnen in de dagelijkse praktijk meer specifieke scenario’s worden uitgewerkt evenals het effect van meer specifieke maatregelen. Op deze wijze kan er in de nucleair geneeskundige praktijk meer ‘Patient Tailored Medicine’ bedreven worden zonder dat dit leidt tot grotere gezondheidsrisico’s ten gevolge van stralingsblootstelling voor verzorgers en leden van de bevolking.
Rekenbladen
Ter ondersteuning van het gebruik van de rekenbladen is voorwaardelijke opmaak gebruikt die een signaalfunctie heeft ten aanzien van de mate van blootstelling totaal of voor een specifiek scenario. Hierbij is een kleurgradient gecreëerd die loopt van een gekozen minimale grenswaarde in de kleur geel naar een gekozen maximale grenswaarde in rood. Deze grenswaarden zijn deels gebaseerd op de in de inleiding genoemde normen voor blootstellingen [Radiation Protection 97, 1998]. Voor de goede orde zij vermeld dat de kleurencodes geen dwingend karakter hebben en alleen fungeren als signalering. Wel geldt dat de kleur rood bij de totale dosis aangeeft dat de normen voor blootstelling worden overschreden. De overige gekozen grenswaarden zijn, met uitzondering van de waarden voor een ‘Derde’, afgeleide waarden waarbij voor > 10% van de norm voor totale blootstelling is gekozen voor de kleur geel in Tabel 3. Voor een ‘Derde’ is 10% van de norm voor de totale dosis gelijk aan 0,03 mSv. Dat is dermate laag voor een totale blootstelling dat het weinig toevoegt om op die waarde een signalering te geven. Daarom is er door de richtlijnwerkgroep gekozen om die waarde op minimaal 0,1 mSv te laten. Voor de afzonderlijke handelingen in Tabel 4 is voor de kleur rood gekozen bij een waarde > 10% van de norm voor de totale blootstelling. De kleur geel geldt dan voor waarden > 1% van de norm voor de totale blootstelling. Uitzondering hierbij zijn de signaleringswaarden voor een ‘Derde’ aangezien dat gaat om anderen dan ‘familie en vrienden’ en er dus in de regel altijd slechts sprake is van een blootstelling via slechts 1 handeling. Daarom is de grenswaarde voor een handeling hetzelfde als voor de totale dosis aangezien de laatste op de eerste gebaseerd is.
Tabel 3: gekozen grenswaarden voor totale blootstelling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,1 mSv |
|
|
≥ 1 mSv |
≥ 3 mSv |
≥ 15 mSv |
≥ 0,3 mSv |
|
Tabel 4: gekozen grenswaarden voor blootstelling per afzonderlijke handeling
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 0,01 mSv |
≥ 0,03 mSv |
≥ 0,15 mSv |
≥ 0,1 mSv |
|
|
≥ 0,1 mSv |
≥ 0,3 mSv |
≥ 1,5 mSv |
≥ 0,3 mSv |
|
Radiation Protection 97 geeft geen grenswaarden voor de huiddosis. Om die toch vast te stellen is gekeken naar de relatie tussen de vastgestelde dosislimieten in het Bbs tussen leden van de bevolking en blootgestelde medewerkers. Daarbij gaat de dosislimiet voor de blootgestelde medewerker voor de totale dosis van 1 mSv naar 20 mSv ten opzichte van een lid van de bevolking (verhouding 1:20) en voor de huiddosis gaat deze van 50 mSv naar 500 mSv (verhouding 1:10), zie Bbs artikel 7.34.2 vs. 9.1.1 [Bbs, 2018]. Daarmee kan worden vastgesteld dat de correctiefactor van de dosislimiet voor de huiddosis gelijk is aan de helft van de correctiefactor voor de totale dosis. Voor de correctie van de dosislimiet voor de totale dosis bij een derde na een behandeling (0,3 mSv in plaats van 1 mSv) is de onderliggende ratio de herhaalkans per jaar op een blootstelling van een derde aan een patiënt die is behandeld met een radiofarmacon. Die herhaalkans is voor zowel de totale dosis als de huiddosis gelijk. Daarom is de correctiefactor (0,3) daarvoor aan elkaar gelijkgesteld. Daarmee worden de gehanteerde grenswaarden voor de huiddosis zoals gegeven in Tabel 5.
Tabel 5: gekozen grenswaarden voor huiddosis
|
Kind |
Verzorger < 60 jaar |
Verzorger ≥ 60 jaar |
Derde |
|
|
≥ 5 mSv |
≥ 7,5 mSv |
≥ 37,5 mSv |
≥ 1,5 mSv |
|
|
≥ 50 mSv |
≥ 75 mSv |
≥ 375 mSv |
≥ 15 mSv |
|
Deze kleurgradient heeft een signaalfunctie om aan te geven waar de meeste winst te halen is ten aanzien van het reduceren van blootstelling en via de kleurovergangen ook de oplopende wenselijkheid om in ieder geval te beoordelen of er maatregelen mogelijk zijn om de blootstelling te reduceren. Daarbij dient wel in alle gevallen de afweging gemaakt te worden of de winst voor leden van de bevolking opweegt tegen de overlast voor de patiënt. Ook hierbij geldt het principe van redelijkheid en de graduele aanpak zoals verwoord in Euratom 2013/59 [Euratom, 2013].
Literatuur
- [Bbs, 2018] Besluit basisveiligheidsnormen stralingsbescherming. nr. IENM/BSK-2017/135624; Staatsblad nr. 404, 2017
- [Euratom, 2013] Euratom/2013/59 van de Raad 2013. (2013 5 december).
- [ICRP 103, 2007] Annex A of ICRP, 2007. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP publication 103. Ann. ICRP 37 (2-4). 2007
- [KEW, 1963] Kernenergiewet 1963. (1963 21 februari).
- [Kloosterman, 2020] Kloosterman A, van Dijk A, Boudewijns-Schoonderbeek L, et al. Nucleair-geneeskundige therapieën: potentiële blootstelling voor derden. RIVM-briefrapport 2020-0113.
- [NCS, 2016] Human Exposure to Ionising Radiation for Clinical and Research Purposes NCS 26, mei 2016
- [RP 97, 1998] European Commission, Directorate-General Environment, Nuclear Safety and Civil Protection. Radiation Protection following Iodine-131 therapy (exposures due to out-patients or discharged in-patients). 1998
- [Roeters, 2018] Roeters, A., Alle ballen in de lucht: Tijdsbesteding in Nederland en de samenhang met kwaliteit van leven. SCP, 2018
Zoekverantwoording
De in PubMed gehanteerde zoekopdrachten zijn:
(I-131 OR 131-I OR 131I OR Iodine-131 OR 131-Iodine OR radioiodine) AND (biologic* OR excretion OR retention) AND thyroid* AND (therapy OR treatment) AND (effective half-life OR biological half-life)
(I-131 OR 131-I OR 131I OR Iodine-131 OR 131-Iodine OR radioiodine) AND (therapy OR treatment) AND (scenario* OR pathway*) AND expos*
(I-131 OR 131-I OR 131I OR Iodine-131 OR 131-Iodine OR radioiodine) AND thyroid* AND (therapy OR treatment) AND (measures* OR restrict* OR expos* OR instruct*) AND (family OR caregiver* OR public OR relatives OR ambient)
