18F-FDG-PET/CT bij S. aureus bacteriëmie
Uitgangsvraag
Bij welke patiënten met S. aureus bacteriëmie is een 18F-FDG-PET/CT geïndiceerd?
Aanbeveling
Overweeg een 18F-FDG-PET/CT te verrichten bij patiënten met een S. aureus bacteriëmie en tenminste 1 risicofactor voor strooihaarden, zoals:
- community acquisition;
- aanwezigheid van een permanent vreemd lichaamsmateriaal, zoals kunstklep, cardiac device, vaatprothese of gewrichtsprothese;
- een voorgeschiedenis van endocarditis, een hartklepaandoening of recent intraveneus drugsgebruik;
- een onbekend focus van infectie;
- aanwijzingen voor septische embolie en/of strooihaarden;
- het starten van adequate behandeling >48 uur na afname van de initiële positieve bloedkweek;
- een positieve follow-up bloedkweek >48 uur na start adequate behandeling;
- het persisteren van koorts >72 uur na afname van de initiële positieve bloedkweek;
- een niet verwijderd focus.
Indien u een 18F-FDG-PET/CT verricht, verricht deze dan zo snel mogelijk, maar uiterlijk binnen twee weken na de eerste positieve bloedkweek.
Bespreek de keuze om wel of geen 18F-FDG-PET/CT te laten verrichten met de patiënt (shared decision making).
Overwegingen
Kwaliteit van bewijs
De algehele kwaliteit van bewijs voor het netto-effect van 18F-FDGPET/CT is zeer laag.
Waarden en voorkeuren van patiënten
Op grond van eigen ervaring meent de richtlijncommissie dat patiënten de aanbevelingen zullen onderschrijven gezien een PET-CT weinig belastend is voor patiënten en omdat de testuitslag mede de behandelduur bepaalt. Daarnaast is het belangrijk om strooihaarden tijdig te diagnosticeren, omdat de behandeling hierop aangepast wordt om daarmee de prognose te verbeteren.
Kosten
De kosten zijn onzeker, want variëren wellicht van €7592 - €215.586 voor de reductie van één sterfgeval in 6 maanden.
Professioneel perspectief
Uit observationeel onderzoek is gebleken dat een 18F-FDG-PET/CT de detectie van het infectiefocus en strooihaarden mogelijk kan optimaliseren bij patiënten met een verhoogd risico op een gecompliceerd beloop. Uit de review naar prognostische factoren (zie samenvatting literatuur) blijkt dat de patiënten met de kenmerken genoemd in onderstaande aanbevelingen een verhoogd risico hebben op strooihaarden.
Bij de review over prognostische factoren voor strooihaarden (zie samenvatting literatuur in de module ‘Prognostische factoren S. aureus bacteriëmie’) kwam een huidaandoening of katheterinfectie als porte d’entrée naar voren als mogelijke risicofactor. De commissie is echter van mening dat de aanwezigheid van een huidinfectie of katheterinfectie op zich waarschijnlijk geen risicofactor vormt tenzij er sprake is van een persisterend focus zoals een niet-gedraineerd abces of een niet-verwijderde centrale lijn, maar deze informatie ontbreekt in de betreffende studie. Om deze reden is slechts de aanwezigheid van een huidinfectie of katheterinfectie als porte d’entrée niet aangeduid als risicofactor, maar wel indien er sprake is van een niet-verwijderd focus.
Indien u een 18F-FDG-PET/CT verricht, is het belangrijk dat u deze zo spoedig mogelijk verricht, maar in elk geval binnen twee weken na de eerste positieve bloedkweek, omdat de uitslag van de 18F-FDG-PET/CT mede de behandeling en de behandelduur kan bepalen. Als er strooihaarden worden vastgesteld door middel van 18F-FDG-PET/CT, is dit een reden voor een langere behandelduur dan de minimale behandelduur van 2 weken.
Uitvoering 18F-FDG-PET/CT
Indien er een 18F-FDG-PET/CT verricht wordt bij een patiënt met een S. aureus bacteriëmie dient deze bij voorkeur verricht te worden van kruin tot en met de voeten (“whole body”). Indien er sprake is van verdenking op een endocarditis of mogelijke infectie in de hartregio dient een patiënt voorbereid te worden met een koolhydraatarm dieet gedurende tenminste 24 uur om zo de fysiologische opname in het hart te verminderen.
Balans van gunstige en ongunstige effecten
Voor patiënten en behandelaars is een lagere sterfte en recidiefkans cruciaal. Het onderzoek is in de meeste gevallen weinig belastend voor de patiënt. Dit geldt niet voor IC patienten. Ieder transport met een beademde en/of hemodynamisch instabiele patient brengt immers risico’s met zich mee. Daarnaast wordt ter voorbereiding de voeding bij deze ernstig zieke patient onderbroken wat een verdere katabolie kan induceren. De mogelijke ongunstige effecten zijn de extra kosten die een 18F-FDG-PET/CT met zich meebrengt.
Aanvaardbaarheid
Het willen toepassen van de aanbevelingen zal naar verwachting van de werkgroep aanvaardbaar zijn voor alle stakeholders, omdat het verminderen van de sterfte en recidiverende infectie in ieders belang is. De extra kosten zouden een belemmering kunnen zijn om een 18F-FDG-PET/CT te verrichten.
Haalbaarheid
18F-FDG-PET/CT is in de overgrote meerderheid van de ziekenhuizen beschikbaar. Er zijn nog enkele ziekenhuizen die voor het verrichten van 18F-FDG-PET/CT afhankelijk zijn van naburige
ziekenhuizen. Bij een te zieke patiënt zou dit een belemmering kunnen zijn om een 18F-FDG- PET/CT te verrichten vanwege de risico’s van vervoer. Indien de wachttijd voor een 18F-FDG- PET/CT langer dan 2 weken is, zou dit een belemmering kunnen vormen voor het tijdig verrichten van een 18F-FDG-PET/CT.
Rationale voor de aanbeveling
Bij het opstellen van de aanbevelingen is veel gewicht toegekend aan het feit dat een 18F-FDG- PET/CT door het tijdig opsporen van strooihaarden het risico op overlijden ten gevolge van een
S. aureus bacteriëmie en/of kans op een recidief kan reduceren. De commissie verwacht dat de aanbevelingen aanvaardbaar zijn voor alle stakeholders. De haalbaarheid is afhankelijk van de lokale beschikbaarheid over 18F-FDG-PET/CT en de eventuele wachttijden.
Onderbouwing
Achtergrond
Tijdige opsporing van infectieuze strooihaarden bij patiënten met een bacteriëmie is cruciaal, omdat deze een langdurige behandeling met antibiotica en eventueel chirurgisch ingrijpen vergen. Onvoldoende eradicatie van strooihaarden resulteert bij een deel van de patiënten in recidief infecties na stoppen van de behandeling met antibiotica. Sterftecijfers zijn beduidend hoger bij patiënten met complicaties (infectieuze strooihaarden) of een recidief (Vos et al., 2010).
Diagnose van complicerende infectieuze foci is veelal lastig omdat tot 50% van deze foci geen symptomen en klachten geeft die te lokaliseren zijn (Vos et al., 2010).
Het laatste decennium wordt 18F-FDG PET/CT steeds vaker gebruikt bij het opsporen van infectiehaarden. 18F-FDG PET/CT heeft zijn waarde bewezen bij o.a. patiënten met febris e.c.i. en voor het opsporen van infectiehaarden in weke delen, (vaat)protheses en ander lichaamsvreemd materiaal en het skelet. Enkele studies hebben de waarde van 18F-FDG PET/CT voor de diagnostiek van infectieuze strooihaarden onderzocht en toonden dat een sensitieve beeldvormende techniek als 18F-FDG PET/CT kan helpen bij het opsporen van strooihaarden bij patiënten met een bacteriëmie en hierdoor van invloed is op de behandeling en de behandelduur (Vos et al.; 2010).
Conclusies / Summary of Findings
|
Zeer Laag GRADE |
Sterfte na 3 maanden, recidief infectie na 3 maanden, detectie strooihaarden
Bij patiënten met een S. aureus bacteriëmie zou het gebruik van 18F-FDGPET/CT voor de diagnostiek van infectiehaarden de sterfte en recidief ‘infecties na 3 maanden’ kunnen verminderen, en de detectie van strooihaarden kunnen optimaliseren.
Vos et al. (2010)9 |
|
Zeer Laag GRADE |
Kosten na 6 maanden
Bij patiënten met S. aureus bacteriëmie is het gebruik van een 18F-FDGPET/CT voor de diagnostiek van infectiehaarden mogelijk kostenverantwoord.
Vos et al. (2011) |
Samenvatting literatuur
Studie van Vos (2010)
Dit is een prospectief cohortonderzoek met een historische controlegroep. In de studie-arm werden 115 patiënten met een Grampositieve bacteriëmie geïncludeerd die aan de hieronder beschreven inclusiecriteria voldeden. De historische controlegroep bestond uit 230 patiënten die gematcht waren op bacterietype, porte d’entrée van de infectie, en aan- of afwezigheid van additionele risicofactoren (vertraagde behandeling, persisterende koorts, of beide). Blijvend positieve bloedkweken van langer dan 48 uur na start behandeling was geen risicofactor die onderdeel was van de matching strategie. De reden hiervan was dat bloedkweken niet op een gestandaardiseerde wijze werden afgenomen in de historische controlegroep.
In de studiegroep was 56% man en de gemiddelde leeftijd 59 jaar, in de historische controlegroep was 52% man en de gemiddelde leeftijd 58 jaar. 64 procent van de studiepopulatie heeft S. aureus bacteriëmie, 26% een streptokokkeninfectie, en 10% een enterokokkeninfectie.
Tussen studiegroep en historische controlegroep bestaan verschillen in de prevalentie van enkele additionele risicofactoren:
|
Additional risk factors |
Prevalence |
|
p-value |
|
|
Study group |
Historical control group |
|
|
Treatment delay |
27% |
45% |
0.01 |
|
Persistent fever |
46% |
37% |
0.13 |
|
Portal of entry unknown |
52% |
46% |
0.30 |
|
Central venous catheter not removed within 48 h |
5% |
8% |
0.50 |
|
Persistent positive blood cultures |
16% |
6%* |
0.006 |
*Not routinely obtained in control group
Vos et al. (2010) hanteerden de volgende inclusiecriteria:
- patiënten met een positieve bloedkweek voor S. aureus, Streptococcus species
- (uitgezonderd S. pneumoniae), of een Enterococcus species, en geen neutropenie (aantal neutrofiele granulocyten ≥ 0.5 x 109)
- ouder dan 18 jaar
- met minimaal één van de volgende risicofactoren voor de aanwezigheid van complicerende infectieuze foci:
- infectie die buiten een zorginstelling is ontstaan,
- tekenen van infectie die zich meer dan 48 uur voor het starten van een passende behandeling manifesteerden,
- koorts meer dan 72 uur na het starten van een passende behandeling,
- een positieve bloedkweek meer dan 48 uur na het starten van een passende behandeling.
- Exclusiecriteria waren een infectie met meerdere micro-organismen of zwangerschap.
Vos et al. (2010) hanteerden de volgende definitie voor porte d'entrée:
lokale infectie voorafgaande aan bacteriëmie. Tabel 1 geeft weer bij welke condities van een bekende porte d'entrée kan worden gesproken.
Tabel 1. Condities op grond waarvan porte d'entrée bekend wordt verondersteld
|
Condities |
Wanneer is conditie een porte d'entrée? |
|
Centraal veneuze katheter |
Een ontstoken katheterinsteekplaats of als de kweek van de kathetertip eenzelfde micro-organisme liet zien als de bloedweek bij afwezigheid van bewijs voor een andere infectiebron. |
|
Luchtweg- of urineweginfectie |
Alleen wanneer specifieke symptomen en tekenen aanwezig waren naast een positieve kweek van urine of sputum. |
|
Flebitis |
Bij aanwezigheid van perifere intravasculaire katheters |
|
Cellulitis |
Indien gecategoriseerd als huidinfecties |
In de tabel 2 worden de definities van een aantal begrippen vermeld.
Tabel 2. Definities
|
Term |
Definitie |
|
Nosocomiale infectie |
Bacteriëmie met een bloedkweek die na meer dan 48 uur hospitalisatie positief was en zonder klinische tekenen van een infectie bij opname. Alle andere infecties werden beschouwd als een infectie die buiten een zorginstelling werd verkregen. |
|
Complicerende infectieuze foci |
Infectieuze foci zonder anatomische relatie met de porte d'entrée, of lokale uitbreiding van een infectie. |
|
Endocarditis |
Classificatie conform Duke criteria. |
|
Recidiverende infectie |
Strooihaarden die niet werden gediagnosticeerd tijdens de eerste infectieperiode, of een tweede periode van bacteriëmie met hetzelfde micro-organisme, beide binnen 3 maanden na de eerste positieve bloedkweek. |
|
Genezing |
Symptomen of tekenen van een infectie zijn afwezig 3 maanden na het staken van de behandeling met antibiotica. |
18F-FDGPET/CT werd binnen 2 weken na de eerste positieve bloedkweek verricht. Abnormale 18F-
FDG opname werd bevestigd door middel van radiologisch, microbiologisch of pathologisch onderzoek. De primaire uitkomstmaat was ‘recidief infecties’. Secundaire uitkomstmaten waren sterfte na 3 en 6 maanden follow-up, duur van de behandeling met antibiotica en aantal diagnostische procedures om de 18F-FDG PET/CT resultaten te bevestigen. De uitkomstmaten recidief infecties en mortaliteit komen overeen met de uitkomstmaten die de werkgroep klinisch relevant vindt. Vos et al. (2010) rapporteren het percentage recidiverende infecties wel gescheiden voor S. aureus bacteriëmie, maar de sterftepercentages en percentages strooihaarden niet. Door tussenkomst van een van de betrokken auteurs werden deze alsnog verkregen. Overige details van deze studie staan vermeld in de evidence tabellen.
De kosteneffectiviteitstudie van de Vos et al. (2011) is geheel gebaseerd op Vos et al. (2010) en is samengevat in de evidence tabellen.
Recidiverende infectie na 3 maanden
Er is mogelijk een effect in het voordeel van het gebruik van een 18F-FDGPET/CT, statistisch niet significant: de kans op een recidief was 1/73 (1,4%) bij gebruik van een 18F-FDGPET/CT en 13/146 (8.9%) bij geen gebruik van een 18F-FDGPET. Voor een dergelijke infectieziekte, met bekend hoge mortaliteit zou, indien reëel, een dergelijk verschil klinisch zeer relevant zijn.3 De schatting van het relatieve risico (RR: 0,15) is niet gecorrigeerd voor verstorende variabelen, zoals treatment delay, waarvan in de controlegroep aanzienlijk meer sprake was.4
Figuur 1. Recidief infectie na 3 maanden; 18FDG-PET/CT versus geen 18FDG-PET/CT
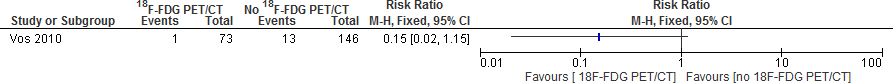
Sterfte na 3 maanden
De resultaten in Vos et al. (2010) zijn niet uitgesplitst naar bacterietype. Uit de alsnog verkregen data blijkt dat gebruik van 18F-FDGPET/CT bij S. aureus bacteriëmie mogelijk de sterfte na 3 maanden vermindert, echter dit is statistisch niet significant (RR: 0,76; 95% BI: 0,46 – 1,26; figuur 2).
De schatting van het relatieve risico (RR: 0,76) is niet gecorrigeerd voor verstorende variabelen, zoals ‘treatment delay’, waarvan in de controlegroep aanzienlijk meer sprake was. Vos et al. rapporteerden niet wat het kwantitatief effect was van correctie voor deze verstorende variabele, maar lieten het bij de constatering (p. 1239) dat “adding treatment delay as a covariate did not influence the outcome on survival (…)”.5 Een vervolgstudie (Berrevoets et al., 2017) heeft laten zien dat gebruik van 18F-FDGPET/CT bij patiënten met S. aureus bacteriëmie én met één of meer risicofactoren voor metastatische infectie geassocieerd is met een significante reductie van de sterfte na 3 maanden. Hierbij dient wel te worden opgemerkt dat de resultaten mogelijk vertekend zijn vanwege ernstig risico op selectiebias. Tevens is het onduidelijk of de auteurs in de analyse voor sterfte voor alle relevante confounders gecorrigeerd hebben.6
Figuur 2. Sterfte na 3 maanden; 18FDG-PET/CT versus geen 18FDG-PET/CT

Strooihaarden
De resultaten in Vos et al. (2010) zijn niet uitgesplitst naar bacterietype. Uit de alsnog verkregen data blijkt dat gebruik van 18F-FDGPET/CT bij S. aureus bacteriëmie het percentage niet ontdekte strooihaarden vermindert met circa 60% (RR: 0,39; 95% BI: 0,25 – 0,61; figuur 3).
Figuur 3. Niet ontdekte strooihaarden; 18FDG-PET/CT versus geen 18FDG-PET/CT
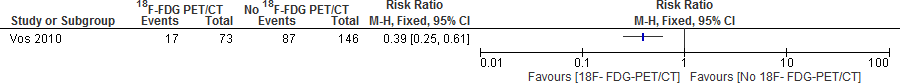
Kosten
Er zijn geen studies waarin alleen voor S. aureus bacteriëmie de kosteneffectiviteit van 18F- FDGPET/CT werd onderzocht. Vos et al. (2011) – een studie waarin drie Gram-positieve bacterietypen werden geïncludeerd (S. aureus, Streptococcus species [uitgezonderd S. pneumoniae], en een Enterococcus species) zoals beschreven in Vos et al. (2010) – rapporteerden een zogeheten incrementele kosteneffectiviteitsratio (IKER). De IKER geeft de additionele kosten voor de introductie van 18F-FDGPET/CT per gewonnen effectmaat (in dit geval sterfte na 6 maanden follow-up) voor de hiervoor genoemde studiegroepen, uitgezonderd alle patiënten met endocarditis. De IKER wordt berekend als (kosten nieuw–kosten oud)/(effect nieuw–effect oud). De puntschatter voor de IKER is volgens Vos et al. (2011) €48.325 (95% BI:
€7592 - €215.586) voor één overleden patiënt minder in een tijdsbestek van 6 maanden.7 De belangrijkste determinant van deze kosten is de kostentoename van de behandeling van strooihaarden tijdens een ziekenhuisopname.
Een vergelijking van de geschatte IKER met wat het Zorginstituut acceptabele meeruitgaven per gewonnen levensjaar (QALY) vindt is niet mogelijk. Ter illustratie:
- €80.000 per QALY is bij een hoge ziektelast het bedrag dat het Zorginstituut acceptabel acht (Zorginstituut Nederland, Kosteneffectiviteit in de praktijk, 2015); in het Verenigd Koninkrijk worden interventies met een kosteneffectiviteitsratio van circa
- £ 55.000 (circa € 79.000) in het verzekerde pakket opgenomen (Raad voor de Volksgezondheid. Zinnige en duurzame zorg, 2006).
- Deze studie werd zodanig ontworpen dat een statistisch significant verschil van 10% in het voorkomen van een recidiverende infectie tussen studiegroep en historische controlegroep zou kunnen worden aangetoond (Vos et al., 2010: 1237). Hieruit kan worden afgeleid dat een verschil van 10% als een klinisch relevant verschil wordt beschouwd.
- Vos et al. (2010) rapporteerden voor de drie Gram-positieve bacterietypen samen ‘treatment delay’ bij 45% in de controlegroep en bij 27% van de patiënten in de groep bij wie 18F-FDGPET/CT onderdeel was van de diagnostische strategie. Het effect van ‘Treatment delay’ op het voorkomen van een recidief infectie wordt door de onderzoekers niet geanalyseerd, wel in verband met sterfte: “Because treatment delay might have been an important confounder—being significantly more prevalent among control patients—it was added as a covariate in the final analysis. But adding treatment delay as a covariate did not influence the outcome on survival at 6 mo of follow-up”.
- Elders in hun artikel schrijven Vos et al. (2010; p. 1237): “Treatment delay was added as a covariate (confounder) in the final analysis but was insignificant in all Cox proportional hazards models; therefore, Kaplan–Meier analyses were performed”. Het is onduidelijk of de auteurs met “insignificant” en “did not influence” (zie voetnoot 3) hetzelfde bedoelen.
- Bij ruim 26% van de patiënten bij wie 18F-FDG PET/CT was geïndiceerd vond dit onderzoek om onbekende redenen niet plaats. Dat kan selectiebias hebben veroorzaakt.
- US dollars zijn omgerekend naar Euro. Volgens Vos et al. (2011) komt anno 2010 1 euro overeen met 1,50 US dollar.
- Vos et al. (2010; p. 1239) schrijven in verband met echocardiografie: “echocardiography was performed significantly more often in the study group, resulting in a more frequent diagnosis of endocarditis. However, when patients with endocarditis alone were excluded, metastatic foci were still found significantly more often in the study group”. Wat het effect van het buiten beschouwing laten van patiënten met endocarditis is op andere uitkomstmaten (sterfte, recidief infectie) wordt niet vermeld.
- Aangevuld met persoonlijke mededelingen van de onderzoekers.
Studie van Kestler et al. (2014)
Deze studie met eveneens een historische controlegroep betreft patiënten met infectieuze endocarditis (n=47). Voor de diagnose van infectieuze endocarditis gebruikten Kestler et al. (2014) de Duke criteria. In tegenstelling tot de studie van Vos et al. (2010) is de controlegroep niet gematcht op bacterietype, porte d’entrée van de infectie, en aan- of afwezigheid van additionele risicofactoren (vertraagde behandeling, persisterende koorts, of beide), maar op aangedane hartklep en etiologie van de infectieuze endocarditis. Exclusiecriteria voor de groep die PET/CT kreeg waren hemodynamische instabiliteit, zwangerschap, chirurgische ingreep ondergaan in de voorafgaande maand, contra-indicatie voor 18F-FDGPET/CT en bekende actieve maligniteit.
De historische controlegroep (n=94) heeft betrekking op patiënten die tussen 2003 en 2012 werden behandeld. In hoeverre het diagnostisch en behandelbeleid in deze periode identiek was aan de periode vanaf 2013 toen men PET/CT ging toepassen, wordt niet beschreven door Kestler
c.s. In de experimentele groep is de Charlson comorbidity index 4,09; in de controlegroep 5,05. De controlegroep heeft meer/ernstiger morbiditeit en daarmee een grotere kans op sterfte. In tegenstelling tot de studie van Vos et al. (2010) hebben Kestler et al. (2014) geen potentiële confounders geïdentificeerd en hiervoor gecorrigeerd bij de berekening van verschillen in sterfte en recidief percentage tussen experimentele en historische controlegroep.
Bij 17 van de 47 patiënten is sprake van een S. aureus bacteriëmie.
De gemiddelde leeftijd in de controlegroep (n=12) is 64,9 jaar (SD: 20,9) en 50% is vrouw. De gemiddelde leeftijd in de experimentele groep (n=5) is 62,4 jaar (SD: 19,7) en 40% is vrouw. Overige studiekarakteristieken staan vermeld in de evidence tabellen.
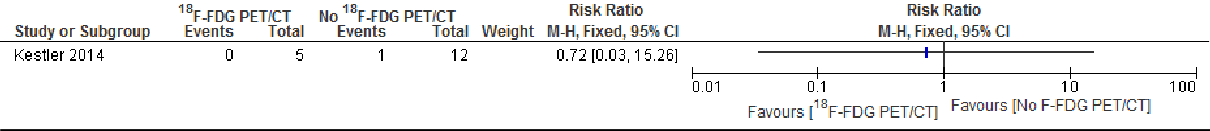
Recidief infectie 30 dagen
Forest plot of comparison: 1 18F-FDG PET/CT versus no 18F-FDG PET/CT, outcome: 1.4 Relapse at 40 days.
Sterfte na 30 dagen
Forest plot of comparison: 1 18F-FDG PET/CT versus no 18F-FDG PET/CT, outcome: 1.5 Mortality at 40 days.

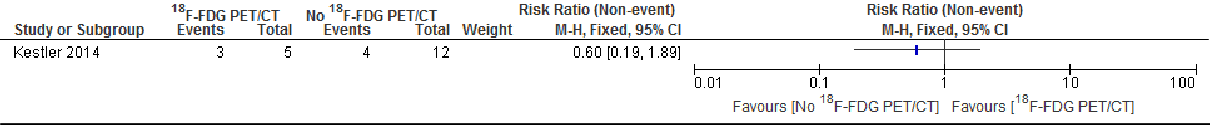
Strooihaarden
Forest plot of comparison: 1 18F-FDG PET/CT versus no 18F-FDG PET/CT, outcome: 1.6 No Metastatic foci detection.
Ter info: de data werden niet gepoold vanwege klinische heterogeniteit.
Kwaliteit van bewijs
Recidiverende infectie, sterfte en strooihaarden
De kwaliteit van bewijs is zeer laag voor de uitkomstmaten recidiverende infectie, sterfte en strooihaarden. Dit wordt uitgebreid toegelicht in de [GRADE evidence profiles]. Kort samengevat: het betrof hier geen gerandomiseerd onderzoek, en er was niet voor elke uitkomstmaat sprake van (transparante) correctie voor verstorende variabelen (vaker echocardiografie in de studiegroep (83%) dan in de controlegroep (29%) en meer ‘treatment delay’ in de historische controlegroep).8 Daarnaast was er sprake van onnauwkeurigheid van de uitkomst vanwege de relatief kleine studieomvang (‘gering aantal events’). Dit kan als volgt worden geïllustreerd. Voor een nauwkeurige schatting van dichotome uitkomsten wordt een aantal ‘events’ van 300 als vuistregel aanbevolen (Guyatt et al., 2011). Voor de uitkomstmaten recidief infectie, sterfte en strooihaarden waren er 14, 48 respectievelijk 104 events (figuren 1, 2 en 3). Het aantal events voor de uitkomstmaten recidief infectie en sterfte is dan ook substantieel minder dan de vereiste 300. Soms volstaat een aantal van 200 wanneer het achtergrondrisico (risico in de controlegroep) rond 60% is. Dit geldt voor het aantal niet ontdekte strooihaarden wanneer geen 18F-FDGPET/CT wordt toegepast.
Kosten
In hoeverre de berekende IKER is te extrapoleren naar patiënten met S. aureus bacteriëmie is onzeker. De kosten voor S. aureus bacteriëmie zullen hoger zijn (dit is immers de grootste groep Grampositieven) maar tegelijk is er meer kostenreductie door 18F-FDGPET/CT omdat daar de meeste recidieven voorkomen worden. Daarnaast kunnen we constateren dat de IKER-schatting in ieder geval tamelijk ongewis is gezien het zeer brede betrouwbaarheidsinterval. Zou bijvoorbeeld de bovengrens van het betrouwbaarheidsinterval (€215.586) de werkelijke IKER zijn, dan is het zeer onwaarschijnlijk dat een aanbeveling ten gunste van toepassen van 18F- FDGPET/CT zou worden geformuleerd. Zou echter de ondergrens van het betrouwbaarheidsinterval (€7592) de werkelijke IKER zijn, dan is een aanbeveling ten gunste van toepassen van 18F-FDGPET/CT waarschijnlijker.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische review uitgevoerd met de volgende PICO-vraagstelling:
- Wat is het effect van een 18F-FDG PET/CT versus geen 18F-FDG PET/CT op de in onderstaande tabel genoemde uitkomstmaten bij (kinderen en) volwassenen met een S. aureus bacteriëmie?
Selectie- en exclusiecriteria:
|
Type studies |
|
|
Type patiënten |
- volwassenen en kinderen met S. aureus bacteriëmie |
|
Type interventies |
|
|
Type (mate van belangrijkheid) uitkomstmaten |
|
|
Type setting |
- ziekenhuis |
|
Exclusiecriteria |
|
**cruciale uitkomstmaten hebben een zeer belangrijke impact op de aanbevelingen; * belangrijke uitkomstmaten hebben een belangrijke impact op de aanbevelingen.
Er werd d.d. 21-07-2016 een literatuursearch verricht met als bronnen Medline en de Cochrane Library (CSDR, DARE en CENTRAL). Er werd gezocht naar Engelstalige en Nederlandstalige studies vanaf publicatiejaar 2000. Zie de zoekverantwoording voor meer details over de zoekstrategie.
Onder de 36 studies die werden gevonden was één niet-gerandomiseerde trial met een historische controlegroep (Vos et al., 2010) die aan de inclusiecriteria voldeed. Eén studie (Kestler et al., 2014) werd aangedragen door de werkgroep. Deze studie, met eveneens een historische controlegroep, betreft patiënten met infectieuze endocarditis (n=47). In 17 gevallen was sprake van een S. aureus bacteriëmie.2
Een studie (Vos et al., 2011) naar de incrementele kosteneffectiviteitsratio (IKER) voor de introductie van 18F-FDGPET/CT bij patiënten met S. aureus bacteriëmie, voldeed niet geheel aan de inclusiecriteria, omdat de onderzoekers de IKER niet afzonderlijk uitgesplitst hebben voor S. aureus bacteriëmie versus andere Grampositieve bacteriëmie.
Tijdens het schrijven van de literatuursamenvatting droeg een werkgroeplid een recent gepubliceerde studie (Berrevoets et al., 2017) aan voor inclusie. Deze studie voldeed echter niet aan de inclusiecriteria: de studie had geen direct-vergelijkende opzet (zie tabel selectie- en exclusiecriteria). Omdat deze studie echter deels als een vervolg op Vos et al. (2010) kan worden gezien, wordt deze aldaar kort aangehaald.
Referenties
- Berrevoets MAH, Kouijzer IJE, Aarntzen EHJG, Janssen MJR, De Geus-Oei LF, Wertheim HFL, Kullberg BJ, Oever JT, Oyen WJG, Bleeker-Rovers CP. 18F-FDG PET/CT Optimizes Treatment in Staphylococcus Aureus Bacteremia and Is Associated with Reduced Mortality. J Nucl Med. 2017 Sep;58(9):1504-1510.
- Guyatt GH, Oxman AD, Kunz R, Brozek J, Alonso-Coello P, Rind D, Devereaux PJ, Montori VM, Freyschuss B, Vist G, Jaeschke R, Williams JW Jr, Murad MH, Sinclair D, Falck-Ytter Y, Meerpohl J, Whittington C, Thorlund K, Andrews J, Schünemann HJ. GRADE guidelines 6. Rating the quality of evidence--imprecision. J Clin Epidemiol. 2011 Dec;64(12):1283-93.
- Kestler M, Muñoz P, Rodríguez-Créixems M, Rotger A, Jimenez-Requena F, Mari A, Orcajo J, Hernández L, Alonso JC, Bouza E; Group for the Management of Infectious Endocarditis (GAME). Role of (18)F-FDG PET in Patients with Infectious Endocarditis. J Nucl Med. 2014 Jul;55(7):1093-8.
- Kouijzer I, Vos F, Bleeker-Rovers C, Oyen WJ. Clinical application of FDG-PET/CT in metastatic infections. Q J Nucl Med Mol Imaging. 2016 Feb 16.
- Raad voor de Volksgezondheid. Zinnige en duurzame zorg. Zoetermeer. 2006.
- Vos FJ, Bleeker-Rovers CP, Kullberg BJ, Adang EM, Oyen WJ. Cost-effectiveness of routine (18)F-FDG PET/CT in high-risk patients with gram-positive bacteremia. J Nucl Med. 2011 Nov; 52(11):1673-8. doi: 10.2967/jnumed.111.089714. Epub 2011 Oct 7.
- Vos FJ, Bleeker-Rovers CP, Sturm PD, Krabbe PF, van Dijk AP, Cuijpers ML, Adang EM, Wanten GJ, Kullberg BJ, Oyen WJ. 18F- FDG PET/CT for detection of metastatic infection in gram-positive bacteremia. J Nucl Med. 2010 Aug;51(8):1234-40. doi: 10.2967/jnumed.109.072371. Epub 2010 Jul 21.
- Zorginstituut Nederland. Kosteneffectiviteit in de praktijk. Diemen, 2015.
Evidence tabellen
Tabel met studiekarakteristieken
|
Study id Setting |
Study design |
Inclusion / exclusion criteria |
Number of patients |
Patient characteristics |
Intervention Comparison |
Outcome measures and results |
Risk of Bias assessment |
|
Vos et al., |
Observational |
All |
Initial: |
E: 56% males; mean age: 59 y, C: 52% males; mean age: 58 y. 64% S Aureus Bacteremia, 26% Streptococcus infection, 10% een Enterococcus infection. Additional Prevalence p- risk value factors Study Historical group control group Treatment 27% 45% 0.01 delay Persistent 46% 37% 0.13 fever Portal of 52% 46% 0.30 entry unknown Central 5% 8% 0.50 venous catheter not removed within 48 h Persistent 16% 6%* 0.006 positive blood cultures |
I: 18F-FDG |
The primary |
Appendix 2. |
|
2010 |
with historical |
nonneutropenic |
Experimental |
PET/CT was |
outcome parameter: |
|
|
|
Radboud |
control group |
(neutrophil |
group (E): |
performed as |
relapse of infection. |
|
|
|
University Nijmegen |
For every prospectively |
count > 0.5 x 109) adult |
N=201 Control |
soon as possible after inclusion. |
Secondary outcome measures: overall |
|
|
|
Medical |
included |
patients (age, |
group (C): |
The maximum |
and |
|
|
|
Centre, a |
patient, 2 |
≥18 y) were |
N=456 |
time between the |
attributablemortality |
|
|
|
950-bed |
control |
eligible when at |
With at least |
first positive |
after 3 and 6 mo, |
|
|
|
university |
patients were |
least 1 of the |
one |
blood culture and |
(duration of |
|
|
|
hospital. |
matched for |
following |
additional |
18F-FDG PET/CT |
antibiotic treatment, |
|
|
|
|
the type of |
known risk |
risk factor: |
was 2 wk. Before |
and number of |
|
|
|
|
microorganism, |
factors for the |
E: N=148 |
18F-FDG |
diagnostic |
|
|
|
|
site of |
presence of |
C: N=366 |
injection, |
procedures |
|
|
|
|
acquisition of |
complicating |
After |
patients fasted, |
performed to |
|
|
|
|
the infection, |
infectious foci |
obtaining |
and glucose or |
confirm 18F-FDG |
|
|
|
|
and the |
was present: |
consent: |
insulin-containing |
PET/CT results). |
|
|
|
|
presence or |
community |
E: N=115 |
intravenous |
Outcome measures |
|
|
|
|
absence of |
acquisition, |
C: N=230 |
infusions were |
pertaining to S |
|
|
|
|
additional risk |
signs of |
(1:2 |
discontinued for |
Aureus Bacteremia: |
|
|
|
|
factors |
infection more |
matching) |
at least 6 h. In all |
Relapse at 3 months: |
|
|
|
|
(treatment |
than 48 h |
|
diabetic patients |
E: 1.4% |
|
|
|
|
delay, |
before |
|
at the time of |
C: 8.9% |
|
|
|
|
persistent |
initiation of |
|
18FFDG injection, |
Mortality at 3 |
|
|
|
|
fever, or both). |
appropriate |
|
glucose was |
months: |
|
|
|
|
Because blood |
treatment, |
|
below 12.0 |
E: 21.9% |
|
|
|
|
cultures had |
fever more |
|
mmol/L. One |
C: 28.8% |
|
|
|
|
not been |
than 72 h after |
|
hour after |
Outcome measures |
|
|
|
|
obtained in a |
initiation of |
|
intravenous |
pertaining to S |
|
|
|
|
standardized |
appropriate |
|
injection of 200– |
Aureus, |
|
|
|
|
way in the |
treatment, and |
|
220 MBq of 18F- |
Streptococcus and |
|
|
|
|
retrospective |
positive blood |
|
FDG (Covidien), a |
Enterococcus |
|
|
|
|
cohort, the |
cultures more |
|
low-dose CT scan, |
Bacteremia. |
|
|
|
|
presence of |
than 48 h after |
|
without contrast |
Number of |
|
|
|
|
persistently |
initiation of |
|
enhancement, of |
metastatic foci |
|
|
|
|
positive blood |
appropriate |
|
the area between |
detected: |
|
|
Study id Setting |
Study design |
Inclusion / exclusion criteria |
Number of patients |
Patient characteristics |
Intervention Comparison |
Outcome measures and results |
Risk of Bias assessment |
|
|
cultures more |
treatment. |
|
|
the proximal |
E: 67.8% |
|
|
than 48 h after |
Patients |
femora and base |
C: 35.7% |
||||
|
the initiation of |
primarily |
of the skull was |
|
||||
|
treatment was |
admitted to the |
acquired for |
|
||||
|
not included as |
intensive care |
anatomic |
|
||||
|
a risk factor in |
unit were |
correlation and |
|
||||
|
the matching |
included only |
attenuation |
|
||||
|
strategy. |
when |
correction of the |
|
||||
|
|
transferred to |
PET data. |
|
||||
|
|
regular patient |
Subsequently, |
|
||||
|
|
wards within 14 |
emission images |
|
||||
|
|
d after the first |
of the same area |
|
||||
|
|
positive blood |
were acquired. |
|
||||
|
|
culture. |
18F-FDG PET/CT |
|
||||
|
|
Exclusion |
images were |
|
||||
|
|
criteria were |
evaluated by |
|
||||
|
|
poly-microbial |
physicians |
|
||||
|
|
infection and |
without |
|
||||
|
|
pregnancy. The |
knowledge of |
|
||||
|
|
records of all |
prior clinical |
|
||||
|
|
patients with |
evaluation and |
|
||||
|
|
positive blood |
imaging results. |
|
||||
|
|
cultures |
Except for 18F- |
|
||||
|
|
growing S. |
FDG PET/CT and |
|
||||
|
|
aureus, |
the diagnostic |
|
||||
|
|
Streptococcus |
procedures |
|
||||
|
|
species |
needed for |
|
||||
|
|
(excluding S. |
confirmation of |
|
||||
|
|
pneumoniae), |
abnormal 18F- |
|
||||
|
|
or |
FDG PET/CT |
|
||||
|
|
Enterococcus |
results, standard |
|
||||
|
|
species were |
diagnostic and |
|
||||
|
|
reviewed for |
therapeutic |
|
||||
|
|
eligibility as |
procedures were |
|
||||
|
|
soon as blood |
followed. |
|
||||
|
|
culture results |
If no complicating |
|
||||
|
|
were available. |
infectious foci |
|
|
Study id Setting |
Study design |
Inclusion / exclusion criteria |
Number of patients |
Patient characteristics |
Intervention Comparison |
Outcome measures and results |
Risk of Bias assessment |
|
|
|
|
|
|
were detected, the standard duration of treatment was 14 d. Treatment was prolonged to 6– 12 wk in patients with complicating infectious foci, depending on the site of infection and clinical response. C: no 18F-FDG PET/CT. standard diagnostic and therapeutic procedures were followed. |
|
|
|
Vos et al., 2011 See above. |
See above + cost data were collected using the principles of a cost- effectiveness analysis |
See above |
See above |
See above |
Direct costs related to the diagnosis and treatment of patients with a complicated bloodstream infection included admission days in the intensive care unit and general ward, all imaging techniques, antibiotic treatment, specialist consultation, and surgical |
Relapse rate, defined as confirmed relapse of infection within 3 mo after completion of antibiotic treatment and mortality at 6 mo of follow-up. Mortality was considered the final outcome (together with costs) and was used in the denominator of the incremental cost- effectiveness ratio (ICER). |
Not assessed. |
|
Study id Setting |
Study design |
Inclusion / exclusion criteria |
Number of patients |
Patient characteristics |
Intervention Comparison |
Outcome measures and results |
Risk of Bias assessment |
|
|
|
|
|
|
interventions. |
|
|
|
Costs of the |
Outcomes |
||||||
|
primary visit to |
pertaining to all |
||||||
|
the emergency |
GRAM-positive |
||||||
|
room |
bacteremia: |
||||||
|
department, |
ICER: $72,487 per |
||||||
|
routine blood |
prevented death |
||||||
|
examinations, |
(95% CI, $11,388– |
||||||
|
blood cultures, |
$323,379) (1 Euro = |
||||||
|
and chest |
1.5 U.S. Dollars) |
||||||
|
radiographs were |
|
||||||
|
not included in |
|
||||||
|
the analysis |
|
||||||
|
because they |
|
||||||
|
belong to regular |
|
||||||
|
care and there |
|
||||||
|
were no |
|
||||||
|
differences on a |
|
||||||
|
per-patient basis |
|
||||||
|
in either study |
|
||||||
|
group. Prices |
|
||||||
|
were determined |
|
||||||
|
for each unit of |
|
||||||
|
health care |
|
||||||
|
consumed. Costs |
|
||||||
|
were adjusted to |
|
||||||
|
the price level of |
|
||||||
|
the first quarter |
|
||||||
|
of 2007 based on |
|
||||||
|
the consumer |
|
||||||
|
price index as |
|
||||||
|
presented by the |
|
||||||
|
Central Bureau of |
|
||||||
|
Statistics. The |
|
||||||
|
incremental costs |
|
||||||
|
of 18F-FDG |
|
||||||
|
PET/CT alone |
|
|
Study id Setting |
Study design |
Inclusion / exclusion criteria |
Number of patients |
Patient characteristics |
Intervention Comparison |
Outcome measures and results |
Risk of Bias assessment |
|
|
|
|
|
|
were estimated by excluding all patients with endocarditis, because echocardiography is the preferred imaging technique to detect endocarditis. |
|
|
GRADE Evidence profiles
18F-FDG PET/CT compared to no 18F-FDG PET/CT for S Aureus Bacteremia
Bibliography: Vos et al. (2010)
|
Outcomes |
№ of participants (studies) Follow-up |
Quality of the evidence (GRADE) |
Relative effect (95% CI) |
Anticipated absolute effects |
|
|
|
Risk with no 18F-FDG PET/CT |
Risk difference with 18F-FDG PET/CT |
|||
|
Relapse at 3 months (Relapse) assessed with: clinical examination and laboratory analysis follow up: mean 3 months |
219 (1 RCT) 1 |
⨁◯◯◯ VERY LOW 2,3,4 |
RR 0.15 (0.02 to 1.10) |
89 per 1.000 |
76 fewer per 1.000 (87 fewer to 9 more) |
|
Mortality at 3 months (mortality 3 mo) follow up: mean 3 months |
219 (1 RCT) 1 |
⨁◯◯◯ VERY LOW 2,3,5 |
RR 0.77 (0.44 to 1.23) |
288 per 1.000 |
66 fewer per 1.000 (161 fewer to |
|
|
|
|
|
|
66 more) |
|
Not-detected metastatic foci (Metastatic foci) follow up: mean 3 months |
219 (1 RCT) 1 |
⨁◯◯◯ VERY LOW 2,3,6 |
RR 0.39 (0.25 to 0.61) |
596 per 1.000 |
363 fewer per 1.000 (447 fewer to |
|
|
|
|
|
|
232 fewer) |
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI).
CI: Confidence interval; RR: Risk ratio
18F-FDG PET/CT compared to no 18F-FDG PET/CT for S Aureus Bacteremia
Bibliography: Vos et al. (2010)
| Outcomes |
№ of participants (studies) Follow-up |
Quality of the evidence (GRADE) |
Relative effect (95% CI) |
Anticipated absolute effects |
|
|
|
Risk with no 18F-FDG PET/CT |
Risk difference with 18F-FDG PET/CT |
|||
GRADE Working Group grades of evidence
High quality: We are very confident that the true effect lies close to that of the estimate of the effect
Moderate quality: We are moderately confident in the effect estimate: The true effect is likely to be close to the estimate of the effect, but there is a possibility that it is substantially different
Low quality: Our confidence in the effect estimate is limited: The true effect may be substantially different from the estimate of the effect
Very low quality: We have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect
- This is not a randomized trial. However, this study with historic control group can be considered as an attempt to emulate (mimic) a hypothetical randomized trial, and therefore starts as initially high quality of evidence.
- One critically important confounding domain to adjust for is the usage of more frequent echocardiography in the study group. It is clear that no adjustment took place with regard to the relapse rate (primary outcome parameter). A critical co-intervention (taking additional blood cultures) was not balanced across intervention and control groups. Downgraded by 2 levels.
- Not applicable.
- Confidence interval (CI) does not cross the clinical decision threshold (100 less per 1,000 assumed) between recommending and not recommending treatment but number of events substantially less than Optimal information size (n=300).
- Confidence interval crosses the clinical decision threshold (20 less per 1000 [appreciabele benefit] or 20 more per 1000 [appreciable harm) between recommending and not recommending treatment.
- Number of events less than Optimal Information Size of ca 200 events given control group event rate of 60%.
Assessment of risk of bias of effect estimates in Vos et al (2010)
Assessment was performed by using the Cochrane Risk of Bias Assessment Tool for Non-Randomised Studies of Interventions (ACROBAT-NRSI)
(Remark: this assessment does not take into account that baseline characteristics pertaining to S Aureus Bacteremia only are not available in this publication. However, this does not have serious impact on the final GRADE assessment. As is shown, the most important criterion bearing on the final GRADE assessment is risk of bias due to unmeasured confounding and imprecision).
Study: Vos et al., 2010 BIAS DUE TO CONFOUNDING
1.1 Is confounding of the effect of intervention unlikely in this study?
Probably not. No information on other potential prognostic factors such as comorbid conditions or disease severity was provided. It should be underlined that it is usually impossible to exclude bias due to residual or unmeasured (and unknown!) confounding of the results in a non-randomized study.
1.2. Were participants analyzed according to their initial intervention group throughout follow up?
Probably yes.
1.4 Did the authors use an appropriate analysis method that adjusted for all the critically important confounding domains?
In the analysis treatment delay was taken into account but no other additional risk factors such as persistent fever (in spite of matching there was an almost 10% difference between the two groups) and positive blood culture.
1.5 Were confounding domains that were adjusted for measured validly and reliably by the variables available in this study?
Unclear. A definition of treatment delay was not provided by the author.
1.6. Did the authors avoid adjusting for post-intervention variables?
Yes.
Assessment Bias due to confounding: moderate risk of bias.
BIAS IN SELECTION OF PARTICIPANTS
2.1. Was selection into the study unrelated to intervention or unrelated to outcome?
Yes.
2.2. Do start of follow-up and start of intervention coincide for most subjects?
Yes.
Assessment of Bias in selection of participants: low risk of bias.
BIAS IN MEASUREMENT OF INTERVENTIONS
3.1 Is intervention status well defined?
Yes.
3.2 Was information on intervention status recorded at the time of intervention?
Yes (i.e. no PET-scans were made in control group).
3.3 Was information on intervention status unaffected by knowledge of the outcome or risk of the outcome?
Yes.
Assessment of Bias in measurement of interventions: low risk of bias.
BIAS DUE TO DEPARTURES FROM INTENDED INTERVENTIONS
4.1. Were the critical co-interventions balanced across intervention groups?
No. In the study group, additional blood cultures were taken at 24, 48, and 72 h after the first positive blood culture and 48 h thereafter when subsequent blood cultures were positive. In the control group blood cultures were not routinely obtained. Echocardiography was much less frequently performed in the control group (29% versus 83%) which probably led to underestimating the occurrence of infectious endocarditis in this group, and influenced treatment decisions.
4.2. Were numbers of switches to other interventions low?
Not applicable.
4.3. Was implementation failure minor?
Yes.
4.4 Were adjustment techniques used that are likely to correct for these issues?
No. Not with respect to relapse rate. With respect to mortality only treatment delay seems to have been taken into account but no p-values were reported.
Assessment of Bias due to departures from intended interventions: serious risk of bias.
BIAS DUE TO MISSING DATA
5.1 Are outcome data reasonably complete?
Yes.
5.2 Was intervention status reasonably complete for those in whom it was sought?
Yes.
5.3 Are data reasonably complete for other variables in the analysis?
Yes.
Assessment of Bias due to missing data: low risk of bias.
BIAS IN MEASUREMENT OF OUTCOMES
6.1 Was the outcome measure objective?
Relapse, duration of antibiotic treatment, number of diagnostic procedures performed to confirm 18F-FDG PET/CT results. Most outcome measures do involve negligible assessor judgment.
6.2 Were outcome assessors unaware of the intervention received by study participants?
No.
6.3 Were the methods of outcome assessment comparable across intervention groups?
Unclear.
6.4 Were any systematic errors in measurement of the outcome unrelated to intervention received?
Probably not.
Assessment of bias due to measurement of outcomes: moderate risk of bias.
BIAS IN SELECTION OF THE REPORTED RESULT
7.1 Is the reported effect estimate unlikely to be selected, on the basis of the results, from multiple outcome measurements within the outcome domain?
No.
7.2 Is the reported effect estimate unlikely to be selected, on the basis of the results, from multiple analyses of the intervention-outcome relationship?
No.
7.3 Is the reported effect estimate unlikely to be selected, on the basis of the results, from different subgroups?
No.
Assessment of bias due to bias in selection of reported result: low risk of bias.
SUMMARY:
Assessment Bias due to confounding: moderate risk of bias.
Assessment of Bias in selection of participants: low risk of bias. Assessment of Bias in measurement of interventions: low risk of bias. Assessment of Bias due to departures from intended interventions: serious risk of bias. Assessment of Bias due to missing data: low risk of bias.
Assessment of bias due to measurement of outcomes: moderate risk of bias.
Assessment of bias due to bias in selection of reported result: low risk of bias.
Assessment of overall risk of bias: serious risk of bias because of important co-interventions. Downgraded by 2 levels.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 27-11-2019
Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een up-to-date multidisciplinaire evidence-based richtlijn voor diagnostiek, behandeling en follow-up van patiënten met een S. aureus bacteriëmie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met S. aureus bacteriëmie, zoals artsen-microbioloog, internisten, cardiologen, kinderartsen, chirurgen, nucleair geneeskundigen, ziekenhuisapothekers en verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met S. aureus bacteriëmie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. K. Verduin (voorzitter), arts-microbioloog, PAMM, Veldhoven; NVMM
- Dr. H. Ammerlaan, internist-infectioloog, Catharina ziekenhuis, Eindhoven; NIV
- Drs. G. Blaauw, arts-microbioloog, Gelre Ziekenhuizen, Apeldoorn; NVMM
- Dr. C.P. Bleeker-Rovers, internist-infectioloog, Radboud universitair medisch centrum, Nijmegen; NIV
- Drs. R.J.H.M. van Drie-Pierik, ziekenhuisapotheker, Medisch Spectrum Twente, Enschede; NVZA
- Dr. M. Ekkelenkamp, arts-microbioloog, Universitair Medisch Centrum, Utrecht; NVMM
- Dr. A.W.J.M. Glaudemans, nucleair geneeskundige, Universitair Medisch Centrum Groningen; NVNG
- Drs. D. van Hout, arts-onderzoeker, Universitair Medisch Centrum Utrecht; NVMM
- Dr. Y.G.T. Loeffen, kinderarts, Wilhelmina Kinderziekenhuis/Universitair Medisch Centrum Utrecht; NVK
- Dr. J.T.M. van der Meer, internist-infectioloog, Academisch Medisch Centrum, Amsterdam; NIV
- Drs. C.S. Rijs-Bol, chirurg-intensivist, Ziekenhuis St Jansdal, Harderwijk; NVVH
- Dr. W. Tanis, cardioloog, HagaZiekenhuis, Den Haag; NVVC
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie- management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Kees Verduin |
Arts-microbioloog; Medisch manager LMI, Amphia ziekenhuis Breda |
Lid SWAB-bestuur, onbetaald; lid sectie bacteriologie en mycologie SKML, onbetaald; lid werkgroep antimicrobial stewardship (SWAB/SKMS): opzetten antimicrobial stewardship in NL en opzetten Stewardship monitor (op uurbasis declaratie en reiskosten) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Gert Blaauw |
Arts-microbioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Miguel Ekkelenkamp |
Arts-microbioloog |
Schrijver, betaald |
Adviescommissie intraveneus fosfomycine, voor Nordic Pharma. |
geen |
geen |
Onderzoek in kader van Innovative Medicines Initiative van de Europese Commissie. Dit wordt mede-gefinancierd door industriële partners (EFPIA). Dit betreft voor het project "COMBACTE": klinisch onderzoek naar antibiotica en antibacteriële monoclonale antistoffen, o.a. met de bedrijven Astra Zeneca, MedImmune, The Medicines Company en DaVolterra. Voor het project "iABC": pre-klinische ontwikkeling van een inhalatie- antibioticum, met de bedrijven Novartis en Basilea. |
geen |
geen |
|
Regine van Drie-Pierik |
Ziekenhuisapotheker, lid A-team |
Lid van de Santeon farma inkoopgroep. De inkoop groep geeft uitvoering aan het vastgestelde beleid door de antibiotica commissie. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Heidi Ammerlaan |
Internist-infectioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Chantal Bleeker- Rovers |
lnternist- infectioloog/acute geneeskunde; |
geen |
geen |
geen |
Lid Raad van Advies Q-uestion, patiëntenvereniging voor mensen met Q-koorts, maar dit heeft geen enkele relatie met S.aureus bacteriëmie. |
geen |
geen |
geen |
|
Jan van der Meer |
Internist-infectioloog |
Lid VIZ bestuur, onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Wilco Tanis |
Cardioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Andor Glaudemans |
Nucleair geneeskundige |
Chair Infection and Inflammation Committee European Association of Nuclear Medicine (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Carianne Rijs-Bol |
Chirurg-intensivist |
nvt |
geen |
geen |
geen |
geen |
geen |
geen |
|
Yvette Loeffen |
Kinderarts |
geen |
Geen |
geen |
geen |
geen |
geen |
geen |
|
Denise van Hout |
Arts-onderzoeker infectieziekten epidemiologie Julius Centrum, UMCU |
geen |
Geen |
geen |
geen |
Deelname onderzoek gefinancierd vanuit de Innovative Medicines Joint Undertaking, grant agreement no. 115523/115620/115737. Deze grants zijn samengesteld uit financiële contributie van de European Union Seventh Framework Program en van EFPIA (AstraZeneca/Medimmune in dit geval). |
Geen |
geen |
Inbreng patiëntenperspectief
Tijdens de voorbereidende fase zijn er knelpunten aangedragen door een vertegenwoordiger van Stichting FCIC, Sepsis en daarna, via een invitational conference. Een [verslag hiervan] kunt u vinden bij de aanverwante producten van deze module. Tijdens de commentaarfase is beroep gedaan op Stichting FCIC, Sepsis en daarna en de Vereniging voor Patiënten met Parenterale Thuisvoeding.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het [implementatieplan] bij de aanverwante producten).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen van het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.kwaliteitskoepel.nl). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.cvz.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de Inspectie Gezondheidszorg en Jeugd (IGJ); het Ministerie van Volksgezondheid, Welzijn en Sport (VWS); Stichting FCIC, Sepsis en daarna; en experts die geen zitting hadden in de werkgroep via een invitational conference. Een [verslag hiervan] kunt u vinden bij de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag de relevante uitkomstmaten voor de patiënt, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht op de website van het RIVM en in de databases van National guideline clearinghouse, Guidelines International Network, WHO, Medline en Embase. Verder is naar systematische reviews gezocht in de databases van Medline, Embase en Cochrane library. Zie de zoekstrategie. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
|
|
Inconsistentie |
|
|
|
Indirect bewijs |
|
|
|
Onnauwkeurigheid |
|
|
|
Publicatiebias |
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
|
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg bacteriemie’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om de toepassing van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Beersen et al. (2007) en De Koning et al. (2007).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de [Kennislacunes].
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Zorginstituut Nederland; Inspectie voor de Gezondheidszorg (IGJ); het Ministerie van Volksgezondheid, Welzijn en Sport (VWS); Zorgverzekeraars Nederland (ZN); Stichting FCIC, Sepsis en daarna; Nederlandse Federatie van Universitair Medische Centra (NFU); Nederlandse Vereniging van Ziekenhuizen (NVZ); Samenwerkende topklinische ziekenhuizen (STZ); Vereniging voor Patiënten met Parenterale Thuisvoeding; Verpleegkundigen & Verzorgenden Nederland V&VN en experts die geen zitting hadden in de werkgroep. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Beersen, A. N., Kallewaard, M., Croonenburg, J.J., Everdingen van, J.J.E. en Barneveld van, T.A., Handleiding indicatoren- ontwikkeling. 2007.
Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008).
GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
De Koning, J., Smulders, A. en Klazinga, N. Appraisal of Indicators through Research and Evaluation (AIRE). 2007.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
Dutch or English |
4 or/1-3 (3)
16 pet.kf. (5744)
22 6 or 7 or 8 (36386) 23 21 and 22 (131)
33 placebo$.tw. (182226) 34 random$.tw. (870365)
37 (clin$ adj25 trial$).tw. (336188)
46 45 not 44 (1656085)
49 or/24-43,47-48 (1878862) 50 49 not 44 (1722829)
|
31 trials and comparative observational studies |
|
|
53 |
or/45,47-48,51-52 (3330704) |
|
|
54 |
53 not 44 (3155728) |
||
|
55 |
23 and 54 (18) |
||
|
56 |
Comparative Study/ (1757533) |
||
|
57 |
23 and 56 (5) |
||
|
58 |
55 or 57 (22) |
||
|
59 |
from 58 keep 1-22 (22) |
||
|
60 |
23 not 44 (106) |
||
|
61 |
limit 60 to yr="2012 -Current" (35) |
||
|
62 |
journal article/ (24895824) |
||
|
63 |
61 and 62 (35) |
||
|
64 |
foci.tw,kf. (48815) |
||
|
65 |
(metastatic adj3 infect*).tw,kf. (582) |
||
|
66 |
(silent adj3 infect*).tw,kf. (424) |
||
|
67 |
64 or 65 or 66 (49767) |
||
|
68 |
61 and 67 (8) |
||
|
Cochrane |
ID |
Search |
5 trials |
|
Library |
#1 |
Bacteremia*:ti,ab |
|
|
(CENTRAL) |
#2 |
MeSH descriptor: [Bacteremia] explode all trees |
|
|
|
#3 |
MeSH descriptor: [Gram-Positive Bacterial Infections] explode all trees |
|
|
|
#4 |
MeSH descriptor: [Tomography, Emission-Computed] explode all trees |
|
|
|
#5 |
tomograph* near/3 emission:ti,ab |
|
|
|
#6 |
pet:ti,ab |
|
|
|
#7 |
MeSH descriptor: [Fluorodeoxyglucose F18] explode all trees |
|
|
|
#8 |
MeSH descriptor: [Radiopharmaceuticals] this term only |
|
|
|
#9 |
Fluorodeoxyglucose near/3 F18:ti,ab |
|
|
|
#10 |
#1 or #2 or #3 |
|
|
|
#11 |
#4 or #5 or #6 or #7 or #8 or #9 |
|
|
|
#12 |
#10 and #11 |
|
|
|
#13 |
fdg near/3 imaging:ti,ab |
|
|
|
#14 |
#11 or #13 |
|
|
|
#15 |
gram-positive near/3 bacter*:ti,ab |
|
|
|
#16 |
gram near/3 positive near/3 bacter*:ti,ab |
|
|
|
#17 |
#10 or #15 or #16 |
|
|
|
#18 |
#14 and #17 |
|
Algemene zoekverantwoording
Medline
Database: MEDLINE <1946 to Present incl: Epub Ahead of Print, In-Process & Other Non-Indexed Citations, and MEDLINE Daily>
Search Strategy:
--------------------------------------------------------------------------------
1 staphylococcus aureus/ or methicillin-resistant staphylococcus aureus/ (60126)
2 (staphylococc* adj3 aureus).tw. (81324)
3 (staphylococc* adj3 aureus).kf. (2922)
4 or/1-3 (97533)=P
5 guideline/ or practice guideline/ (28077)
6 consensus development conference/ (10038)
7 guideline?.ti. (58994)
8 guideline?.kf. (5569)
9 or/5-8 (85993)
10 4 and 9 (284)
11 *staphylococcus aureus/ or *methicillin-resistant staphylococcus aureus/ (37036)
12 (staphylococc* adj3 aureus).ti. (32166)
13 3 or 11 or 12 (45705)
14 9 and 13 (139)= P +bacteriemie
15 (dutch or english or german or french).la. (23555640)= talen
16 14 and 15 (123)
17 16 (123)
18 limit 17 to yr="2005 -Current" (87)
19 bacteremia/ or hemorrhagic septicemia/ (20745)
20 bactere*.tw. (20921)
21 bactere*.kf. (1412)
22 19 or 20 or 21 (33610)
23 18 and 22 (13)
24 sab.tw. (963)
25 sab.kf. (20)
26 19 or 20 or 21 or 24 or 25 (34364)
27 18 and 26 (13)= richtlijnen vanaf 2005
28 "filter systematic reviews".ti. (0)
29 meta analysis.pt. (70838)
30 (meta-anal$ or metaanal$).af. (126011)
31 (quantitativ$ adj10 (review$ or overview$)).tw. (6106)
32 (systematic$ adj10 (review$ or overview$)).tw. (99842)
33 (methodologic$ adj10 (review$ or overview$)).tw. (8239)
34 (quantitativ$ adj10 (review$ or overview$)).kf. (24)
35 (systematic$ adj10 (review$ or overview$)).kf. (5412)
36 (methodologic$ adj10 (review$ or overview$)).kf. (29)
37 medline.tw. and review.pt. (58275)
38 (pooled adj3 analy*).tw. (12141)
39 (pooled adj3 analy*).kf. (103)
40 "cochrane$".fc_jour. (16009)
41 or/29-40 (226059)
42 4 and 15 and 26 and 41 (48)= systrev
Embase search
Database: Embase <1974 to 2016 July 07>
Search Strategy:
--------------------------------------------------------------------------------
1 staphylococcal bacteremia/ (1385)
2 exp Staphylococcus aureus/ (130261)
3 (staphylococc* adj3 aureus).tw. (97561)
4 (staphylococc* adj3 aureus).kw. (12205)
5 bacteremia/ or staphylococcal bacteremia/ (34100)
6 2 or 3 or 4 (150575)
7 bactere*.tw. (25886)
8 bactere*.kw. (3692)
9 5 or 7 or 8 (43651)
10 6 and 9 (7550)
11 practice guideline/ (278974)
12 guideline?.ti. (76104)
13 guideline?.kw. (23330)
14 11 or 12 or 13 (309135)
15 10 and 14 (249)
16 (dutch or english or german or french).la. (27127260)
17 15 and 16 (237)
18 17 (237)
19 limit 18 to yr="2005 -Current" (197)
20 exp *Staphylococcus aureus/ (45047)
21 (staphylococc* adj3 aureus).ti. (36419)
22 4 or 20 or 21 (59914)=P focus
23 19 and 22 (76)
24 limit 23 to (article or "review") (54)= richtlijnen
25 "filter systematic reviews & meta-analyses Embase".ti. (0)
26 meta analysis/ (111545)
27 "systematic review"/ (109864)
28 (meta-analy$ or metaanaly$).tw. (123807)
29 (systematic$ adj4 (review$ or overview$)).tw. (115867)
30 (quantitativ$ adj5 (review? or overview?)).tw. (3372)
31 (methodologic adj5 (overview? or review?)).tw. (310)
32 (review$ adj3 (database? or medline or embase or cinahl)).tw. (16975)
33 (pooled adj3 analy$).tw. (17264)
34 (extensive adj3 review$ adj3 literature).tw. (2666)
35 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1130118)
36 review.pt. (2179885)
37 35 and 36 (102281)
38 (systematic$ adj4 (review$ or overview$)).kw. (13304)
39 (quantitativ$ adj5 (review? or overview?)).kw. (43)
40 (pooled adj3 analy$).kw. (311)
41 or/26-34,37-40 (334603)
42 1 and 16 and 41 (36)
43 10 and 16 and 41 (146)
44 43 (146)
45 limit 44 to yr="2005 -Current" (125)= systrev
Cochrane search
Search Name: coc20160708 s aureus bacteriemie barbara
Last Saved: 08/07/2016 12:30:22.424
Description:
ID Search
#1 MeSH descriptor: [Staphylococcal Infections] explode all trees
#2 bacteri*:ti,ab
#3 Staphylococc* near/3 aureus:ti,ab
#4 MeSH descriptor: [Bacteremia] explode all trees
#5 MeSH descriptor: [Staphylococcus aureus] explode all trees
#6 (#1 or #3 or #5) and (#2 or #4)
WOS
Staphylococcus NEAR/3 aureus NEAR/5 Bacter* in titel
vanaf 2005 en review of guideline* in topic van 2005-2016
