Methicillinegevoelige S. aureus bacteriëmie
Uitgangsvraag
Wat is de behandeling van een methicillinegevoelige S. aureus bacteriëmie?
Aanbeveling
Keuze antibiotica
- Behandel een methicillinegevoelige S. aureus bacteriëmie met monotherapie flucloxacilline.
- Eerste keuze alternatief bij een (relatieve) contra-indicatie voor flucloxacilline is een eerste generatie cefalosporine.
- Voor tweede keuze neem contact op met de betrokken arts-microbioloog/infectioloog.
Dosering
- Volg het lokale formularium.
Duur behandeling + toedieningsweg
- Behandel een ongecompliceerde S. aureus bacteriëmie twee weken intraveneus.
- Behandel een gecompliceerde S. aureus bacteriëmie 4 tot 6 weken intraveneus.
- Overweeg om patienten met een verhoogd risico op een gecompliceerde S. aureus bacteriemie maar negatieve aanvullende diagnostiek 2 weken IV te behandelen (in plaats van 4 tot 6 weken).
Overwegingen
Kwaliteit van bewijs
Met betrekking tot flucloxacilline versus vancomycine; flucloxacilline versus eerste generatie cefalosporine; flucloxacilline + aminoglycoside versus flucoxacilline
De kwaliteit van het bewijs is zeer laag voor zowel de gunstige effecten als voor de bijwerkingen vanwege het observationele karakter van de onderzoeken, beperkingen in onderzoeksopzet en -uitvoering, onvoldoende nauwkeurigheid van de uitkomsten (kleine studies met vaak brede betrouwbaarheidsintervallen) en het de vraag is of de patiëntenpopulaties en interventies in de studies extrapoleerbaar zijn naar de populatie en interventies in de Nederlandse situatie (indirect bewijs).
Met betrekking tot (minimaal) 2 weken intraveneuze antibiotische behandeling versus korter dan 2 weken
Gezien de aanwezigheid van klinische en statistische heterogeniteit werden de data niet gepoold en konden ook geen conclusies worden getrokken. Vandaar dat de kwaliteit van het bewijs ook niet kon worden beoordeeld.
Waarden en voorkeuren
Niet van toepassing, omdat de aanbevelingen niet op het niveau van de individuele patiënt zijn geformuleerd.
Kosten en middelen
Het toepassen van de aanbeveling zal naar verwachting van de richtlijncommissie geen effect op de structurele kosten hebben, omdat de aanbevelingen grotendeels al aansluiten op de bestaande praktijk.
Professioneel perspectief Keuze antibiotica
Het streven van de werkgroep is om op grond van wetenschappelijk bewijs de juiste
antimicrobiële behandeling te kiezen bij een patiënt met een S. aureus bacteriëmie. Volgens de principes van de evidence-based geneeskunde is bewijs van de hoogste kwaliteit afkomstig van goed uitgevoerde randomized controlled trials. Bewijs afkomstig van observationeel onderzoek is in die opvatting per definitie van lage tot zeer lage kwaliteit. Op grond hiervan is de conclusie van het hierboven beschreven literatuuronderzoek dat de kwaliteit van het bewijs laag tot zeer laag is voor een gunstig effect van flucloxacilline versus vancomycine, van flucloxacilline plus een aminoglycoside versus flucloxacilline alleen, of van flucloxacilline versus een 1e generatie cefalosporine. Daaruit zou ten onrechte het beeld kunnen ontstaan dat keuze van antibiotica en duur van de behandeling bij patiënten met een S. aureus bacteriëmie geen invloed hebben op morbiditeit en mortaliteit. Een lage tot zeer lage kwaliteit van het bewijs betekent immers dat elke schatting van een effect onzeker is en dat nader onderzoek mogelijk of zelfs waarschijnlijk zal leiden tot een andere schatting van het effect. Ontbreken van bewijs voor effectiviteit is echter geen bewijs voor het ontbreken van effectiviteit. Door de verschillende verschijningsvormen van S. aureus bacteriëmie verschillen studies vaak in de populaties die onderzocht zijn, in eindpunten, in follow-up duur etc., etc. Bovendien is de onderzoekspopulatie meestal klein en de power van de studie gering. Het gevolg is dat effecten vaak statistisch niet significant zijn, een probleem dat niet opgelost kan worden door studies te poolen omdat ze daarvoor te heterogeen zijn. Het antwoord hierop zal ook in de toekomst niet gegeven worden door randomized controlled trials gezien de problemen die gepaard gaan met onderzoek naar S. aureus bacteriëmie. In dit spanningsveld tussen wetenschappelijk onderzoek en praktijk heeft de werkgroep zich in haar aanbevelingen in hoge mate gebaseerd op klinische ervaring, uitkomsten van in-vivo en in-vitro onderzoek en biologische plausibiliteit. Bijvoorbeeld: studies die behandeling van methicillinegevoelige S. aureus met β-lactam antibiotica vergelijken met vancomycine zijn klein en kunnen niet gepoold worden. De puntschatter van het effect is echter in het merendeel van deze studies in het voordeel van β-lactam antibiotica. Daarbij is het betere effect van behandeling met β-lactam antibiotica t.o.v. behandeling met vancomycine in overeenstemming met de bevindingen bij dierexperimenteel onderzoek. Bovendien laten in- vitro studies zien dat nafcilline en cefazoline lysis van S. aureus stimuleren door verhoging van de activiteit van host-defense peptides zoals cathelicidin LL-37. Dit effect treedt niet op bij gebruik van vancomycine.
Omdat hier in-vitro, in-vivo en klinische data allemaal dezelfde kant op wijzen beveelt de werkgroep aan om een methicillinegevoelige S. aureus te behandelen met flucloxacilline of een 1e generatie cefalosporine.
Dosering
De dosering van antibiotica verschilt bij oncompliceerde en gecompliceerde bacteriemie. Ook bij geinfecteerd kunstmateriaal wordt de dosering aangepast en vaak middelen toegevoegd (rifampicine). De werkgroep verwijst voor de dosering naar het lokale antibioticum formularium en de relevante SWAB-richtlijnen.
Duur behandeling
De behandeling van gecompliceerde bacteriëmie bestaat uit 4 tot 6 weken intraveneus toegediende antibiotica en volgt daarmee de bestaande richtlijnen voor bijvoorbeeld de behandeling van endocarditis of spondylodiscitis. Een behandelduur van minder dan 14 dagen intraveneus toegediende antibiotica bij een ongecompliceerde bacteriëmie is misschien mogelijk maar op dit moment is dat nog niet overtuigend aangetoond. In afwachting van betere data blijft de geadviseerde behandelduur bij een verder ongecompliceerd beloop daarom 14 dagen intraveneus.
Er zijn geen studies waarin patiënten met een S. aureus bacteriëmie worden gerandomiseerd naar 2 of 4 of 6 weken behandeling met antibiotica. In het verleden werden alle patiënten met een S. aureus bacteriëmie langdurig behandeld, omdat het percentage patiënten met een gecompliceerd beloop hoog was. Met de toename van het aantal nosocomiale en healthcare- related S. aureus bacteriëmiën rees de vraag of in ongecompliceerde gevallen niet korter behandeld zou kunnen worden. Retrospectief, observationeel onderzoek suggereerde dat een behandelduur van minder dan 14 dagen intraveneus toegediende antibiotica tot meer recidieven leidt en mogelijk gepaard gaat met een hogere mortaliteit. De auteurs concluderen dat men terughoudend moet zijn met een korte behandelduur voor deze ernstige infecties totdat gerandomiseerd onderzoek uitsluitsel heeft gegeven (Jernigan et al., 1993). Huidige richtlijnen (U.K., USA) voor de behandeling van S. aureus bacteriëmie beschouwen een behandelduur van 14 dagen intraveneus toegediende antibiotica dan ook als de standaardbehandeling voor een ongecompliceerde S. aureus bacteriëmie. De kans op een gecompliceerd beloop bij deze groep patiënten wordt geschat op 2,5% (SABATO studie (PMID 26452342). Sinds oktober 2013 loopt in een aantal Europese landen de SABATO trial waarin patiënten met een ongecompliceerde S. aureus bacteriëmie na een week intraveneuze behandeling worden gerandomiseerd naar voortzetting van de intraveneuze toediening voor nog een week of switch naar orale antibiotica. Deze Europese multicenter trial heeft na vijf jaar nog steeds niet het beoogde aantal van 430 patiënten heeft kunnen includeren. Het feit dat minder dan 5% van de patiënten met een S. aureus bacteriëmie wordt geïncludeerd maakt extrapolatie van de uitkomst naar de dagelijkse praktijk bij voorbaat twijfelachtig. Voor de behandeling van gecompliceerde S. aureus bacteriëmie wordt 4 tot 6 weken intraveneuze behandeling aangehouden onder verwijzing naar de richtlijnen voor behandeling van endocarditis, lever- en miltabcessen, osteomyelitis, spondylodiscitis, meningitis, etc.
Aanvaardbaarheid en haalbaarheid van de aanbeveling(en
Het willen en kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders, omdat dit aansluit bij de huidige praktijk.
Balans van gewenste en ongewenste effecten
Ad keuze antibiotica:
De wenselijke effecten (minder recidieven, kortere ziekenhuisopname en lagere mortaliteit) afwegend tegen de onwenselijke effecten (bijwerkingen medicatie) en kosten valt de balans ten gunste van de behandeling met β-lactam antibiotica.
Ad duur behandeling:
De grote onzekerheid over de effecten van een kortere behandelduur maakt het niet mogelijk een uitspraak te doen over de balans van gunstige en ongunstige effecten.
Rationale van de aanbeveling(en)
Ad keuze antibiotica:
Leidend bij het opstellen van de aanbevelingen was het feit dat de conclusies bijna allemaal in het voordeel van β-lactam antibiotica wijzen. Deze bevindingen zijn ook in lijn met de bevindingen bij dierexperimenteel en in vitro onderzoek.
Ad duur behandeling:
Bij het opstellen van de aanbeveling is geen rekening gehouden met de resultaten van het systematisch review, omdat er geen conclusies konden worden getrokken vanwege de aanwezigheid van klinische en statistische heterogeniteit. Leidend bij het opstellen van de aanbevelingen was de reductie van een gecompliceerd verloop. De aanbevelingen zijn in lijn met de huidige richtlijnen in de UK en USA.
Onderbouwing
Achtergrond
In het algemeen wordt intraveneus toegediende flucloxacilline beschouwd als de optimale behandeling van een methicillinegevoelige S. aureus bacteriëmie. Volgens sommige auteurs is behandeling met een eerste generatie cefalosporine echter net zo goed of beter. Anderen wijzen dit af onder verwijzing naar het zogenaamde inoculum effect waarbij bij infecties met hoge inocula zoals endocarditis, cefalosporines worden gehydrolyseerd door S. aureus β-lactamases. Of het combineren van flucloxacilline met gentamicine beter is dan flucloxacilline alleen is een ander twistpunt. Vancomycine wordt beschouwd als inferieur t.o.v. flucloxacilline voor de behandeling van MSSA- S. aureus bacteriëmie. Over de duur van de behandeling van een ongecompliceerde S. aureus bacteriëmie is men het meestal eens: 14 dagen.
Ter informatie: in het verloop van deze module zal, waar nodig, de term penicillinase-resistente penicilline (PRP) gebruikt worden om de volgende typen antibiotica aan te duiden: flucloxacilline; nafcilline; cloxacilline; en oxacilline.
Conclusies / Summary of Findings
1. Flucloxacilline versus vancomycine
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Recidief S. aureus bacteriëmie Er zijn aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met vancomycine geassocieerd is met meer recidieven in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Chambers et al., 1988; Fortún et al., 2001; Chang et al., 2003; Siegman-Igra et al., 2005 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Mortaliteit Er zijn aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met vancomycine geassocieerd is met meer sterfte in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Gentry et al., 1997; González et al., 1999 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Duur ziekenhuisopname Er zijn aanwijzingen dat behandeling van methicillinegevoelige S. aureus bacteriëmie met vancomycine geassocieerd is met een langere ziekenhuisopname in vergelijking met behandeling met nafcilline.
Bron: Gentry et al., 1997 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Bijwerkingen medicatie Er zijn geen aanwijzingen dat er een verschil is in het optreden van nefrotoxiciteit tussen behandeling van methicillinegevoelige S. aureus bacteriëmie met vancomycine in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Gentry et al. 1997; Fortún et al. 2001 |
2. Flucloxacilline versus cefazoline
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Recidief S. aureus bacteriëmie Er zijn geen aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met cefazoline geassocieerd is met meer recidieven in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Renaud et al., 2011; Li et al., 2014; Bai et al., 2015; McDanel et al., 2017 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Mortaliteit Er zijn geen aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met cefazoline geassocieerd is met meer sterfte in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Lee et al., 2011; Paul et al., 2011; Renaud et al., 2011; Li et al., 2014; Bai et al., 2015; McDanel et al., 2017 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Duur ziekenhuisopname Er zijn geen aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met cefazoline is geassocieerd met een langere ziekenhuisopname in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Renaud et al., 2011; McDanel et al., 2017 |
|
Zeer laag GRADE |
Voor volwassen patiënten met methicillinegevoelige S. aureus bacteriëmie
Bijwerkingen medicatie Er zijn geen aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met cefazoline is geassocieerd met meer bijwerkingen in vergelijking met behandeling met penicillinase-resistente penicillines.
Bron: Lee et al., 2011; Renaud et al., 2011; Li et al., 2014 |
3. Flucloxacilline versus flucloxacilline plus aminoglycoside
|
Zeer laag GRADE |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie
Recidief S. aureus bacteriëmie Er zijn geen aanwijzingen dat behandeling van methicillinegevoelige S. aureus bacteriëmie met penicillinase-resistente penicillines in combinatie met een aminoglycoside leidt tot minder recidieven in vergelijking met behandeling met penicillinase-resistente penicillines alleen.
Bron: Korzeniowski et al., 1982; Ribera et al., 1996 |
|
Zeer laag GRADE |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie
Mortaliteit Er zijn geen aanwijzingen dat behandeling van methicillinegevoelige S. aureus bacteriëmie met penicillinase-resistente penicillines in combinatie met een aminoglycoside leidt tot minder sterfte in vergelijking met behandeling met penicillinase-resistente penicillines alleen.
Bron: Korzeniowski et al., 1982; Ribera et al., 1996; Hughes et al., 2009 |
|
Zeer laag GRADE |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie
Duur ziekenhuisopname Er zijn geen aanwijzingen dat behandeling van methicillinegevoelige S. aureus bacteriëmie met cloxacilline in combinatie met gentamicine geassocieerd is met een verschil in duur van ziekenhuisopname in vergelijking met behandeling met cloxacilline alleen.
Bron: Hughes et al., 2009 |
|
Zeer laag GRADE |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie
Bijwerkingen medicatie Er zijn aanwijzingen dat behandeling van een methicillinegevoelige S. aureus bacteriëmie met penicillinase-resistente penicillines in combinatie met een aminoglycoside geassocieerd is met meer bijwerkingen in vergelijking met behandeling met penicillinase-resistente penicillines alleen.
Bron: Korzeniowski et al., 1982; Ribera et al., 1996 Hughes et al., 2009 |
4. (<2 weken IV antibiotica versus >2 weken IV antibiotica)
|
GRADE niet te beoordelen |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie
Recidief S. aureus bacteriëmie Op basis van bestaand onderzoek kan geen uitspraak gedaan worden over de optimale duur van behandeling van methicillinegevoelige S. aureus bacteriëmie.
Bron: Raad et al., 1992; Khosrovaneh et al., 2005; Thomas et al., 2005; Kreisel et al., 2006; Landman et al., 2011; Chong et al., 2013; Kempley et al., 2015 |
|
GRADE niet te beoordelen |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie Mortaliteit Op basis van bestaand onderzoek kan geen uitspraak gedaan worden over de optimale duur van behandeling van methicillinegevoelige S. aureus bacteriëmie.
Bron: Zeylemaker et al., 2001; Jensen et al., 2002; Fätkenheuer et al., 2004; Chong et al., 2013; Kempley et al. 2015 |
|
- |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie Duur ziekenhuisopname Er werden geen studies geïdentificeerd waarin duur van ziekenhuisopname werd gehanteerd als uitkomstmaat. |
|
- |
Voor patiënten met methicillinegevoelige S. aureus bacteriëmie Bijwerkingen medicatie Er werden geen studies geïdentificeerd waarin bijwerkingen van medicatie werden gehanteerd als uitkomstmaat. |
Samenvatting literatuur
Leeswijzer:
Hieronder worden de vier systematic review gepresenteerd. Op het einde van iedere review staan de conclusies.
1. Flucloxacilline versus vancomycine
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie. Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben tot de huidige PICO vraagstelling.
Beschrijving studies
Drie van de zes geïncludeerde studies betroffen prospectieve observationele cohort studies (González et al., 1999; Chang et al., 2003; Siegman-Igra et al., 2005). Twee studies betroffen interventiestudies, waarvan één wel randomiseerde (Fortún et al., 2001) en de ander niet (Chambers et al., 1988). De studie van Gentry et al. (1997) betrof een retrospectieve cohort studie.
Studiepopulaties (Tabel 2)
De studiepopulaties varieerden sterk tussen de studies. In Tabel 2 hieronder zijn de meest differentiërende in- en exclusiecriteria weergegeven. Drie studies includeerden alleen patiënten met endocarditis (Chambers et al., 1988; Gentry et al., 1997; Fortún et al., 2001), één studie richtte zich op patiënten met bacteriëmische S. aureus pneumonie (González et al., 1999) en twee studies includeerden alle patiënten met een positieve bloedkweek met S. aureus (Chang et al., 2003; Siegman-Igra et al., 2005). Van deze laatste twee studies werden in één studie patiënten met endocarditis geëxcludeerd voor de analyse betreffende de antibiotica (Chang et al., 2003).
Tabel 2 Studiepopulaties
|
|
Inclusiecriteria |
Exclusiecriteria |
|
Chambers 1988 |
|
- Aanwezigheid infectieuze complicatie (zoals osteomyelitis) |
|
Gentry 1997 |
- Mogelijke of bewezen S. aureus endocarditis o.b.v. Duke criteria |
|
|
González 1999 |
- Bacteriëmische S. aureus pneumonie |
|
|
Fortún 2001 |
|
|
|
Chang 2003 |
- S. aureus bacteriëmie |
|
|
Siegman-Igra 2005 |
- S. aureus bacteriëmie |
|
Interventies (Tabel 3)
De onderzochte interventies waren uiteenlopend (zie Tabel 3 hieronder). Dosering en type antibiotica varieerden tussen studies. Daarnaast werd de exacte duur en/of dosering van behandeling in een deel van de studies niet beschreven (Gentry et al., 1997; González et al., 1999; Chang et al., 2003). Verder werd niet altijd beschreven in welke studiegroep een patiënt werd ingedeeld in het geval van switch tussen typen antibiotica tijdens de behandeling (González et al., 1999; Siegman-Igra et al., 2005). Omdat vancomycine is vergeleken met verschillende soorten penicillinase-resistente penicillines (nafcilline en cloxacilline), zal deze laatstgenoemde groep op een aantal plaatsen in de samenvatting overkoepelend benoemd worden als penicillinase-resistente penicillines (PRP).
Tabel 3 Onderzochte interventies
|
|
Interventie |
Controle |
Dosering |
|
S. aureus endocarditis |
|
||
|
Chambers 1988 |
Vancomycine-tobramycine |
Nafcilline-tobramycine |
Bekend* |
|
Gentry 1997 |
Vancomycine-gentamicine |
Nafcilline-gentamicine |
Deels bekend* |
|
Fortún 2001 |
Vancomycine-gentamicine |
Cloxacilline-gentamicine |
Bekend* |
|
Bacteriëmische S. aureus pneumonie |
|
||
|
González 1999 |
Vancomycine |
Cloxacilline |
Onbekend |
|
S. aureus bacteriëmie |
|
||
|
Chang 2003 |
Vancomycine |
Nafcilline |
Onbekend |
|
Siegman-Igra 2005 |
Vancomycine |
Cloxacilline |
Bekend* |
|
*zie de evidence tabellen voor details |
|||
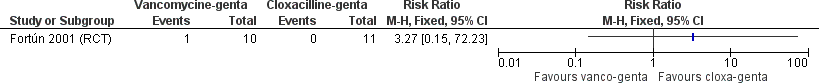
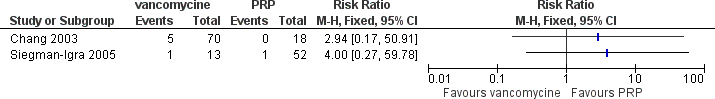
Recidief S. aureus bacteriëmie
In vier studies werd de uitkomstmaat recidief S. aureus bacteriëmie gehanteerd (Chambers et al., 1988; Fortún et al., 2001; Chang et al., 2003; Siegman-Igra et al., 2005). Chambers et al. (1988) definieerde recidief endocarditis niet en hanteerde wisselende follow-up tijden. Fortún (2001) definieerde een recidief bacteriëmie als een positieve bloedkweek met S. aureus na het stoppen van behandeling, met onbekende follow-up duur. Chang et al. (2003) hanteerde een follow-up duur van zes maanden voor patiënten met S. aureus bacteriëmie en een follow-up duur van drie jaar voor S. aureus endocarditis patiënten. De volgende definitie werd gehanteerd voor recidief: terugkeer van S. aureus bacteriëmie na negatieve bloedkweken of klinische verbetering. Hierbij werd pulsed-field gel elektroforese (PFGE) gebruikt om te bevestigen dat het ging om hetzelfde genotype (Chang et al., 2003). Siegman-Igra et al. (2005) definieerde recidief
S. aureus bacteriëmie als een positieve bloedkweek met S. aureus na negatieve bloedkweken of na klinisch herstel met ontslag uit het ziekenhuis, waarbij enkele recidieven alsnog werden geëxcludeerd op basis van kliniek en resistentiepatroon (deze werden beschouwd als re-infectie en niet als recidief). Exacte follow-up duur is onbekend. In alle vier studies was de puntschatter in het voordeel van de β-lactam antibiotica (zie Figuur 1, 2 en 3). Slechts in één studie (Chambers et al., 1988) was het gevonden voordeel echter statistisch significant. Ter informatie: in de vier studies werd niet gecorrigeerd voor confounders. Vanwege de aanwezigheid van klinische en methodologische heterogeniteit werden de data niet gepoold: de studies verschillen sterk in studieopzet, onderzoekspopulatie (zie Tabel 2), onderzochte interventies (zie Tabel 3) en de manier waarop recidief S. aureus bacteriëmie gedefinieerd was.
Figuur 1 Optreden van recidief S. aureus bacteriëmie bij patiënten met S. aureus endocarditis
Figuur 2 Optreden van recidief S. aureus bacteriëmie bij patiënten met S. aureus bacteriëmie
Figuur 3 Optreden van recidief S. aureus endocarditis bij patiënten met S. aureus endocarditis
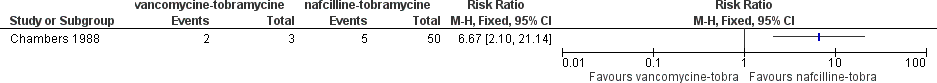
Duur ziekenhuisopname (dagen)
Eén studie onderzocht de gemiddelde duur van ziekenhuisopname (Gentry et al., 1997). Patiënten die behandeld waren met nafcilline en gentamicine hadden gemiddeld een kortere ligduur dan patiënten die werden behandeld met vancomycine en gentamicine. Het verschil was echter niet statistisch significant (zie Figuur 4).
Figuur 4 Duur ziekenhuisopname

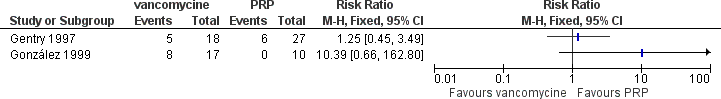
Mortaliteit
Twee studies rapporteerden mortaliteit gestratificeerd voor methicillinegevoelige S. aureus bacteriëmie (Gentry et al., 1997, González et al., 1999). Gentry (1997) hanteerde een follow-up duur van twee maanden. González (1999) volgde patiënten tot genezing of dood, met onduidelijke exacte follow-up duur. Beide studies toonden een niet significant voordeel voor penicillinase-resistente penicillines (PRP), zie Figuur 5. Tevens dient opgemerkt te worden dat er niet werd gecorrigeerd voor belangrijke confounders. Vanwege de aanwezigheid van klinische heterogeniteit werden de resultaten niet gepoold: de studies verschilden sterk in onderzoekspopulatie (endocarditis vs. bacteriëmische pneumonie), onderzochte interventies (zie Tabel 3) en de follow-up duur van de uitkomstmaat.
Figuur 5 Mortaliteit
Bijwerkingen medicatie
Bijwerkingen werden beschreven in twee van de zes studies (Gentry et al., 1997; Fortún et al., 2001). Gentry et al. (1997) beschrijft een stijging van serum creatinine in vijf van de 27 patiënten in de vancomycine groep, tegen vier van de 26 patiënten in de nafcilline groep. Van deze vier patiënten had één er mogelijk nafcilline-geïnduceerde glomerulonefritis en ontstond er bij één patiënt mogelijke nafcilline-geïnduceerde eosinofilie en anemie. Alle patiënten met nefrotoxiciteit waren gelijktijdig ook behandeld met een aminoglycoside. In de studie van Fortún et al. (2001) kwamen bijwerkingen voor bij twee van de tien patiënten in de vancomycine- gentamicine groep (licht verhoogd serum creatinine en huiduitslag), tegen geen patiënten met bijwerkingen in de cloxacilline-gentamicine groep.
Indirect bewijs
Vijf studies werden niet geïncludeerd in de literatuursamenvatting omdat type β-lactam antibiotica niet gespecificeerd werden (Kim et al., 2008) of de resultaten voor verschillende typen β-lactam antibiotica niet gestratificeerd werden gepresenteerd (Johnson et al., 2003; Lodise et al., 2007; Schweizer et al., 2011; Wong et al., 2016). De resultaten van twee van de vijf studies toonden een trend in het voordeel voor de β-lactam groep ten opzichte van vancomycine voor de uitkomstmaat mortaliteit (Kim 2008, Wong 2016). De overige drie studies toonden een voordeel voor penicilline of ceftriaxon en een voordeel voor nafcilline of cefazoline ten opzichte van vancomycine voor de uitkomstmaat mortaliteit (Lodise et al., 2007; Schweizer et al., 2011) en voor de uitkomstmaat recidief (Johnson et al., 2003).
Bewijskracht van de literatuur
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie.
Recidief S. aureus bacteriëmie
Observationeel onderzoek: vanwege het observationele karakter van het onderzoek start de kwaliteit van bewijs voor de uitkomstmaat recidief S. aureus bacteriëmie laag. De kwaliteit wordt verlaagd van laag naar zeer laag om de volgende redenen: er was sprake van onvergelijkbare studiegroepen in prognose en in bijna alle studies was follow-up duur niet gerapporteerd (beperkingen in onderzoeksopzet). Tevens gaat het om studies van geringe omvang met brede betrouwbaarheidsintervallen rondom de effectschatter (imprecisie). Daarnaast is er sprake van indirectheid van het bewijs, omdat in een aantal studies gelijktijdig werd behandeld met een aminoglycoside, er een selecte patiëntenpopulatie werd onderzocht (endocarditis) en we niet weten of de gehanteerde doseringen extrapoleerbaar zijn naar de Nederlandse situatie.
Gerandomiseerd onderzoek: de bewijskracht van de RCT verandert van hoog naar zeer laag omdat het onduidelijk is of de toewijzing van medicatie onvoorspelbaar was (beperkingen in onderzoeksopzet), het gaat om kleine aantallen (imprecisie) en de onderzoekspopulatie (endocarditis patiënten met parenteraal drugsgebruik) niet zonder meer extrapoleerbaar is naar de onderzoekspopulatie waarvoor de richtlijn geschreven wordt (indirectheid).
Duur ziekenhuisopname
De bewijskracht voor de uitkomstmaat duur ziekenhuisopname verandert van laag naar zeer laag, omdat maar één observationele studie van geringe omvang deze uitkomstmaat heeft onderzocht (imprecisie). Tevens was er in deze studie sprake van niet vergelijkbare studiegroepen in prognose (beperkingen in onderzoeksopzet), werden alleen patiënten met endocarditis geïncludeerd en werd er in één studie gelijktijdig behandeld met gentamicine (indirectheid van het bewijs).
Mortaliteit
De bewijskracht voor de uitkomstmaat mortaliteit verandert van laag naar zeer laag: er was sprake van onvergelijkbare studiegroepen in prognose (beperkingen in onderzoeksopzet), kleine aantallen (imprecisie), in één studie was er sprake van gelijktijdige behandeling met gentamicine en er werden specifieke patiëntengroepen geïncludeerd, i.e. met bacteriëmische S. aureus pneumonie of endocarditis (indirectheid van het bewijs).
Bijwerkingen medicatie
De bewijskracht voor de uitkomstmaat bijwerkingen van medicatie is laag tot zeer laag, omdat slechts twee studies van beperkte omvang deze uitkomstmaat hebben onderzocht (imprecisie) en omdat er sprake is van indirect bewijs (beide studies onderzochten alleen endocarditis patiënten en in beide studies was er sprake van gelijktijdige behandeling met gentamicine). Daarnaast werd in beide studies niet gerapporteerd of het optreden van bijwerkingen systematisch werd onderzocht.
2. Flucloxacilline versus cefazoline
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben tot de huidige PICO vraagstelling.
Beschrijving studies
De zes studies betroffen allen retrospectieve cohort studies (Lee et al., 2011; Paul et al., 2011; Renaud et al., 2011; Li et al., 2014; Bai et al., 2015; McDanel et al., 2017).
Studiepopulaties (Tabel 4)
De populaties in de studies waren heterogeen. In de tabel hieronder zijn de meest differentiërende in- en exclusiecriteria weergegeven.
Tabel 4 Studiepopulaties
|
|
Inclusiecriteria |
Exclusiecriteria |
|
Lee 2011 |
- S. aureus bacteriëmie |
- Behandeling met cefazoline terwijl nafcilline leverbaar was |
|
Paul 2011 |
- S. aureus bacteriëmie |
|
|
Renaud 2011 |
|
|
|
Li 2014 |
- Gecompliceerde S. aureus bacteriëmie* |
|
|
Bai 2015 |
- S. aureus bacteriëmie |
- Overlijden <3 dagen na afname bloedkweken |
|
McDanel 2017 |
- S. aureus bacteriëmie |
- Combinatietherapie met cefazoline en nafcilline/oxacilline |
|
*Gecompliceerde SAB werd in deze studie gedefinieerd als aanwezigheid van positieve follow-up bloedkweken binnen 5 dagen na starten therapie, strooihaarden, een geïnfecteerde prothese of endocarditis |
||
Interventies (Tabel 5)
De onderzochte interventies van de studies waren eveneens heterogeen: naast dosering en type antibiotica, varieerde ook de therapieduur. Met name in de studie van Li et al. (2014) werden patiënten over het algemeen langdurig behandeld met antibiotica: mediaan 39 dagen (IQR 28-44 dagen) voor cefazoline en mediaan 31 dagen (IQR 21-42 dagen) voor oxacilline (zie de evidence tabellen voor details). Dosering van de antibiotica werd in een aantal studies niet beschreven (zie Tabel 5). In twee studies werd een deel van de patiënten gelijktijdig behandeld met gentamicine en/of rifampicine (Li et al., 2014; Bai et al., 2015), in de andere studies werd geen informatie gegeven over eventuele combinatietherapie (Lee et al., 2011; Paul et al., 2011; Renaud et al., 2011; McDanel et al., 2017). Omdat cefazoline is vergeleken met verschillende soorten penicillinase-resistente penicillines (nafcilline, oxacilline en cloxacilline), zal deze laatstgenoemde groep op een aantal plaatsen in de samenvatting overkoepelend benoemd worden als penicillinase-resistente penicillines (PRP).
Tabel 5 Onderzochte interventies
|
|
Interventie |
Controle |
Dosering |
|
Patiënten met S. aureus bacteriëmie |
|
||
|
Lee 2011 |
Cefazoline |
Nafcilline |
Onbekend |
|
Paul 2011 |
Cefazoline |
Oxacilline |
Onbekend |
|
Li 2014 |
Cefazoline |
Oxacilline |
Bekend* |
|
Bai 2015 |
Cefazoline |
Cloxacilline |
Bekend* |
|
McDanel 2017 |
Cefazoline |
Nafcilline of Oxacilline |
Onbekend |
|
Hemodialyse patiënten met S. aureus bacteriëmie |
|
||
|
Renaud 2011 |
Cefazoline |
Cloxacilline |
Bekend* |
|
*zie de evidence tabellen voor details |
|||
Resultaten recidief S. aureus bacteriëmie
In vier studies werd de uitkomstmaat recidief S. aureus bacteriëmie gehanteerd, met wisselende definities en follow-up tijden, zie de tabel hieronder (Renaud et al., 2011; Li et al., 2014; Bai et al., 2015; McDanel et al., 2017).
Tabel 6 Definities recidief S. aureus bacteriëmie
|
|
Definitie |
Follow-up duur |
|
Renaud 2011 |
|
30 dagen |
|
Li 2014 |
Onbekend |
90 dagen |
|
Bai 2015 |
|
90 dagen |
|
McDanel 2017 |
|
365 dagen |
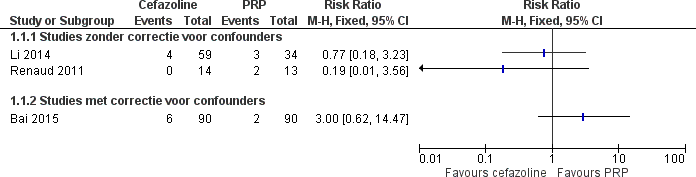
De resultaten van alle vier studies toonden geen statistisch significant verschil aan tussen het gebruik van PRP en cefazoline (zie Figuur 6). Hierbij dient opgemerkt te worden dat er in de studies een verschil bestaat in het wel of niet corrigeren voor confounders (ondanks confounding by indication, de beslissing voor het starten van bepaalde antibiotica was mogelijk afhankelijk van bepaalde patiëntkenmerken). De niet-statisch significante resultaten van de drie studies uit Figuur 6 komen overeen met de resultaten van de studie waarbij behandeling met cefazoline in een multivariabele regressie analyse werd onderzocht: in de studie van McDanel et al. (2017) gaf behandeling met cefazoline een gecorrigeerde OR van 1,13 (95% BHI 0,94-1,36). Vanwege de aanwezigheid van klinische en methodologische heterogeniteit werden de resultaten niet gepoold: de studies verschilden in onderzoekspopulatie, de definities van de uitkomstmaat liepen uiteen en de statistische methode was erg heterogeen.
Figuur 6 Optreden van een recidief S. aureus bacteriëmie
Duur ziekenhuisopname
Twee studies onderzochten duur van ziekenhuisopname (Renaud et al., 2011; McDanel et al., 2017). In de eerste studie was de lengte van ziekenhuisopname korter voor de groep hemodialysepatiënten die was behandeld met cefazoline (gemiddelde ligduur 10 dagen) ten opzichte van de groep hemodialysepatiënten die was behandeld met cloxacilline (gemiddelde ligduur 20 dagen). Hierbij dient opgemerkt te worden dat er geen betrouwbaarheidsintervallen werden beschreven en dat er niet werd gecorrigeerd voor confounders (Renaud et al., 2011). In de tweede studie was de mediane ligduur ook korter voor de patiënten die werden behandeld met cefazoline, namelijk 12 dagen (IQR 8-18) ten opzichte van 13 dagen (IQR 9-22) voor patiënten die werden behandeld met nafcilline of oxacilline (McDanel et al., 2017). Ook in deze studie werd voor deze uitkomstmaat niet gecorrigeerd voor confounders.
Mortaliteit
Zes studies rapporteerden resultaten betreffende het eindpunt mortaliteit, waarbij de follow-up duur verschilde tussen de studies. De studies van Lee et al. (2011) en Renaud et al. (2011) hanteerden een follow-up van respectievelijk 28 en 30 dagen. Twee studies hanteerden een follow-up duur van zowel 30 als 90 dagen (Li et al., 2014; McDanel et al., 2017), de overige twee studies onderzochten alleen mortaliteit op 90 dagen (Paul et al., 2011; Bai et al., 2015). Twee studies lieten alleen absolute, ongecorrigeerde resultaten zien (zie Figuur 7). De vier overige studies corrigeerden wel voor confounders, waarvan één studie het optreden van sterfte per behandelgroep rapporteerde en drie studies het eindpunt onderzochten met behulp van multivariabele regressieanalyse (zie Figuur 7 en Tabel 7). Vanwege de aanwezigheid van klinische heterogeniteit werden de resultaten niet gepoold: de studies verschilden sterk in onderzoekspopulatie, statistische methode en de follow-up duur van de uitkomstmaat.
Vijf van de zes studies toonden geen statistisch significant voordeel van behandeling met cefazoline in het voorkomen van mortaliteit ten opzichte van behandeling met PRP (Renaud et al., 2011; Li et al., 2014; Lee et al., 2011; Paul et al., 2011; Bai et al., 2015). Eén studie toonde wel een statistisch significant voordeel in het voorkomen van 30-dagen en 90-dagen mortaliteit bij behandeling met cefazoline (McDanel et al., 2017).
Figuur 7 Mortaliteit – studies die stratificeren per behandelgroep

Tabel 7 Mortaliteit – studies met een multivariabele analyse
|
|
Paul 2011 (n = 353) |
Bai 2015 (n = 354) |
McDanel 2017 (n = 3167) |
|
30-dagen mortaliteit |
|||
|
Behandeling met cefazoline |
- |
- |
adjusted HR 0,63c (95% BHI 0,51-0,78) |
|
90-dagen mortaliteit |
|||
|
Behandeling met cefazoline |
adjusted OR 0,91a (95% BHI 0,47-1,77) |
adjusted HR 0,6b (95% BHI 0,36-1,01) |
adjusted HR 0,77d (95% BHI 0,66-0,9) |
|
a gecorrigeerd voor: leeftijd, status van ADL afhankelijkheid, nosocomiale S. aureus bacteriëmie, diabetes, maligniteit, hartklep aandoening, ureum level, albumine level en trombocyt level b gecorrigeerd voor: leeftijd, geslacht, afdeling van opname, ‘community-associated’, comorbiditeiten, ziekte-ernst bij presentatie (koorts/shock/nierfalen), vroege infectieuze foci en >2 dagen tot antimicrobiële therapie |
|||
Bijwerkingen medicatie
Bijwerkingen werden beschreven in drie van de zes studies (Lee et al., 2011; Renaud et al., 2011; Li et al., 2014). In de enige studie waarbij dit eindpunt werd gecorrigeerd voor confounders, kwamen bijwerkingen voor in 7 van de 41 patiënten in de nafcilline groep (n=4 geneesmiddelenkoorts, n=2 cytopenie, n=1 flebitis), tegen geen van de 41 patiënten in de cefazoline groep (Lee et al., 2011). In de studie van Li et al. (2014) kwamen ook meer bijwerkingen voor in de oxacilline groep (in 10 van de 34 patiënten, n=6 transaminase stijging, n=1 huiduitslag, n=1 serum creatinine stijging, n=1 leukopenie en één niet beschreven bijwerking) ten opzichte van de cefazoline groep (2 van de 59 patiënten, n=1 huiduitslag en n=1 diarree). Belangrijk om op te merken is dat in deze studie een aantal patiënten combinatietherapie ontving met gentamicine en/of rifampicine, het is niet bekend in hoeverre dit de patiënten met bijwerkingen betrof. De studie naar hemodialyse patiënten rapporteerde gevallen van bijwerkingen in 3 van de 14 patiënten in de cefazoline groep (n=2 Stevens-Johnson syndroom, n=1 ernstige leukopenie), ten opzichte van géén ernstige bijwerkingen in de cloxacilline groep van 13 patiënten (Renaud et al., 2011).
Bewijskracht van de literatuur
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie.
A) Recidief S. aureus bacteriëmie
Vanwege het observationele karakter van het onderzoek start de kwaliteit van bewijs voor de uitkomstmaat recidief S. aureus bacteriëmie laag. De bewijskracht van de vier observationele studies wordt verlaagd van laag naar zeer laag om de volgende redenen: er zijn sterke beperkingen in onderzoeksopzet: twee studies corrigeerden niet voor confounders (ondanks confounding by indication) en één studie gaf geen definitie van de uitkomstmaat. Daarnaast is er sprake van statistische heterogeniteit, gaat het om een aantal studies van geringe omvang (imprecisie) en is er sprake van indirectheid van het bewijs (een aantal patiënten ontving combinatietherapie en in één studie werden alleen hemodialyse patiënten geïncludeerd).
B) Duur ziekenhuisopname
De bewijskracht voor de uitkomstmaat duur van ziekenhuisopname verandert van laag naar zeer laag, omdat er in deze studies sprake was van zeer serieus risico op bias (er werd niet gecorrigeerd voor confounders) en indirectheid van het bewijs (in één studie er werden er alleen hemodialyse patiënten geïncludeerd).
C) Mortaliteit
De bewijskracht voor de uitkomstmaat mortaliteit verandert van laag naar zeer laag, vanwege de volgende redenen: er was in twee studies sprake van onvergelijkbare studiegroepen in prognose (confounding by indication, beperkingen in onderzoeksopzet), de meerderheid van de studiepopulaties bestond uit kleine aantallen (imprecisie), in één studie was er sprake van gelijktijdige behandeling met andere antibiotica, er werd in één studie een specifieke (hemodialyse) patiëntengroep geïncludeerd (indirectheid van het bewijs) en er was sprake van statistische heterogeniteit.
D)Bijwerkingen medicatie
De bewijskracht voor de uitkomstmaat bijwerkingen van medicatie is zeer laag, omdat slechts drie studies van beperkte omvang deze uitkomstmaat hebben onderzocht (imprecisie), omdat er sprake is van indirect bewijs (één studie onderzocht alleen hemodialyse patiënten en in één studie was er sprake van gelijktijdige behandeling met rifampicine danwel gentamicine) en vanwege inconsistentie in resultaten. Daarnaast bestond in twee van deze drie studies een zeer serieus risico op bias vanwege onvergelijkbare studiegroepen in baseline prognose en werd er niet gerapporteerd of het optreden van bijwerkingen systematisch werd onderzocht.
3. Flucloxacilline versus flucloxacilline plus aminoglycoside
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben tot de huidige PICO vraagstelling.
Beschrijving studies
Twee van de drie studies betroffen randomized controlled trials (Korzeniowski et al., 1982; Ribera et al., 1996). De derde studie was een retrospectieve cohortstudie (Hughes et al., 2009).
Studiepopulaties (Tabel 8)
De populaties in de studies betroffen alle patiënten met S. aureus endocarditis, in de tabel hieronder zijn de meest differentiërende in- en exclusiecriteria weergegeven.
Tabel 8 Studiepopulaties
|
|
Inclusiecriteria |
Exclusiecriteria |
|
Randomized controlled trials |
||
|
Korzeniowski 1982 |
- S. aureus endocarditis |
- Kunstkleppen |
|
Ribera 1996 |
|
|
|
Retrospectieve cohortstudie |
||
|
Hughes 2009 |
- S. aureus endocarditis |
- Leeftijd <18 jaar |
Interventies (Tabel 9)
De onderzochte interventies van de studies waren heterogeen: naast dosering en type antibiotica, varieerde ook de therapieduur (zie Tabel 9). Omdat verschillende soorten penicillinase-resistente penicillines (nafcilline en cloxacilline) onderzocht zijn, zullen deze op een aantal plaatsen in de samenvatting overkoepelend benoemd worden als penicillinase-resistente penicillines (PRP).
Tabel 9 Onderzochte interventies
|
|
Interventie |
Controle |
Dosering |
|
Randomized controlled trials |
|
||
|
Korzeniowski 1982 |
6 weken nafcilline IV + 2 weken gentamicine IM of IV |
6 weken nafcilline IV |
Bekend* |
|
Ribera 1996 |
2 weken cloxacilline IV + 7 dagen gentamicine IV |
2 weken cloxacilline IV |
Bekend* |
|
Retrospectieve cohortstudie |
|
||
|
Hughes 2009 |
Cloxacilline IV + gentamicine |
Cloxacilline IV |
Deels bekend* |
|
*zie de evidence tabellen voor details |
|||
Resultaten recidief S. aureus bacteriëmie (tabel 10)
In twee studies werd de uitkomstmaat recidief S. aureus bacteriëmie gehanteerd. In één van die studies werd follow-upduur en definitie niet beschreven, zie de tabel hieronder (Korzeniowski et al., 1982; Ribera et al., 1996).
Tabel 10 Definities recidief S. aureus bacteriëmie
|
|
Definitie |
Follow-up duur |
|
Korzeniowski 1982 |
Onbekend |
Onbekend |
|
Ribera 1996 |
|
6 maanden |
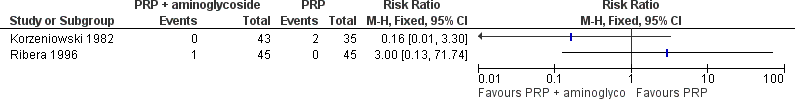
De resultaten van de twee gerandomiseerde studies toonden geen statistisch significant verschil tussen het gebruik van PRP alleen en in combinatietherapie met een aminoglycoside in het voorkomen van een recidief (zie Figuur 8). Hierbij dient opgemerkt te worden dat het gaat om studies van geringe grootte, dat er ondanks randomisatie in één studie baseline verschillen bestonden tussen de behandelgroepen (Korzeniowski et al., 1982) en dat het gaat om brede betrouwbaarheidsintervallen rondom de effectschatter. Vanwege de aanwezigheid van klinische en methodologische heterogeniteit werden de resultaten niet gepoold: de studies verschillen in onderzoekspopulatie, interventie en de definities van de uitkomstmaat liepen uiteen.
Figuur 8 Optreden van een recidief S. aureus bacteriëmie
Duur ziekenhuisopname
Dit eindpunt werd in één studie onderzocht (Hughes et al., 2009). In deze studie was er geen statistisch significant verschil tussen de gemiddelde duur van ziekenhuisopname tussen patiënten die werden behandeld met cloxacilline alleen (21 dagen) in vergelijking met patiënten die werden behandeld met cloxacilline en gentamicine (20 dagen). Hierbij werden geen nauwkeurigheidsmarges gerapporteerd en werd er niet gecorrigeerd voor mogelijke confounders.
Mortaliteit
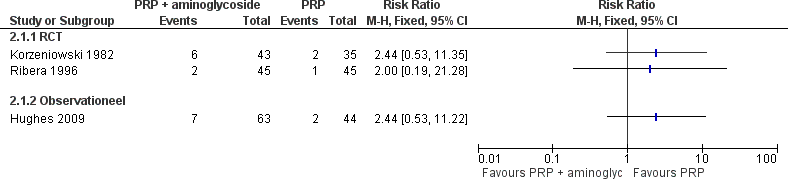
Drie studies rapporteerden resultaten betreffende het eindpunt mortaliteit, waarbij de follow-up duur verschilde tussen de studies. De studies van Hughes et al. (2009) hanteerde als enige studie een vooraf gedefinieerde follow-up duur, van 30 dagen. Ribera et al. (1996) volgde patiënten zes maanden maar rapporteerde alleen sterfte tijdens antimicrobiële behandeling. De exacte lengte van follow-up wordt in de studie van Korzeniowski et al. (1982) niet beschreven. De resultaten van deze drie studies toonden geen statistisch significant voordeel van combinatietherapie van PRP en een aminoglycoside in het voorkomen van sterfte ten opzichte van behandeling met PRP alleen, met mogelijk een trend in het voordeel van PRP zonder aminoglycoside (zie Figuur 9). Hierbij dient opgemerkt te worden dat er in twee studies sprake was van verschillen in baseline prognose tussen groepen en dat hiervoor niet werd gecorrigeerd (Korzeniowski et al., 1982; Hughes et al., 2009). Vanwege de aanwezigheid van klinische heterogeniteit werden de resultaten niet gepoold: de studies verschillen sterk in onderzoekspopulatie, interventie en de follow-up duur van de uitkomstmaat.
Figuur 9 Mortaliteit
Bijwerkingen medicatie
Bijwerkingen werden beschreven in drie studies, waarbij er in geen van de studies werd gerapporteerd of er systematisch naar het optreden van bijwerkingen werd gezocht. Korzeniowski et al. (1982) beschrijft dat er vaker bijwerkingen voorkwamen in de combinatietherapiegroep, namelijk een verdubbeling van het serum creatinine in 11 van de 43 patiënten (26%) in de nafcilline+gentamicine groep, tegen 1 van de 35 patiënten (3%) in de nafcilline monotherapie groep. Daarnaast trad in 4 van de 43 combinatietherapie patiënten (9%) neutropenie (≤1000/µL) op, dit werd niet beschreven in de groep met nafcilline monotherapie. Ook in de retrospectieve studie van Hughes et al. (2009) kwam stijging van het serum creatinine vaker voor in de combinatietherapiegroep: in 18% van de 63 patiënten die werden behandeld met cloxacilline+gentamicine, ten opzichte van 7% van de 44 patiënten met cloxacilline monotherapie (p = 0,1). De studie van Ribera et al. (1996) meldt over bijwerkingen dat in géén van de 90 patiënten in de studie de medicatie werd gestopt vanwege nierinsufficiëntie.
Bewijskracht van de literatuur
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie.
A) Recidief S. aureus bacteriëmie
De bewijskracht van de twee gerandomiseerde studies verandert van hoog naar zeer laag omdat het in één van de studies onduidelijk is of de toewijzing van medicatie onvoorspelbaar was (beperkingen in onderzoeksopzet), het gaat om kleine aantallen (imprecisie) en de onderzoekspopulatie (endocarditis patiënten, deels met parenteraal drugsgebruik) niet zonder meer te generaliseren is naar de onderzoekspopulatie waarvoor de richtlijn geschreven wordt (patiënten met S. aureus bacteriëmie, indirectheid van het bewijs).
B) Duur ziekenhuisopname
De bewijskracht voor de uitkomstmaat duur ziekenhuisopname verandert van laag naar zeer laag, omdat maar één observationele studie van geringe omvang deze uitkomstmaat heeft onderzocht (imprecisie). Tevens was er in deze studie sprake van niet vergelijkbare studiegroepen in prognose (beperkingen in onderzoeksopzet) en werden alleen patiënten met endocarditis geïncludeerd (indirectheid van het bewijs).
C) Mortaliteit
Gerandomiseerd onderzoek: de bewijskracht van de twee gerandomiseerde studies verandert van hoog naar zeer laag omdat het onduidelijk is of de toewijzing van medicatie onvoorspelbaar was in één van de twee studies (beperkingen in onderzoeksopzet), het gaat om kleine aantallen (imprecisie) en de onderzoekspopulatie (endocarditis patiënten, deels met parenteraal drugsgebruik) niet zonder meer te generaliseren is naar de onderzoekspopulatie waarvoor de richtlijn geschreven wordt (indirectheid).
Observationeel onderzoek: vanwege het observationele karakter van het onderzoek start de kwaliteit van bewijs voor de uitkomstmaat mortaliteit laag. De kwaliteit wordt verlaagd van laag naar zeer laag om de volgende redenen: er is sprake van onvergelijkbare studiegroepen in prognose (beperkingen in onderzoeksopzet), het gaat om een studie van geringe omvang (imprecisie) en er is sprake van indirectheid van het bewijs (er werd een selecte patiëntenpopulatie onderzocht, namelijk patiënten met endocarditis).
D) Bijwerkingen medicatie
De bewijskracht voor de uitkomstmaat bijwerkingen van medicatie is zeer laag, omdat drie studies van beperkte omvang deze uitkomstmaat hebben onderzocht (imprecisie), omdat er sprake is van indirect bewijs (er werden alleen endocarditis patiënten onderzocht), omdat er in twee van deze sprake was van onvergelijkbare studiegroepen in baseline prognose en omdat er in de studies niet beschreven is of het optreden van bijwerkingen systematisch werd onderzocht.
4. (<2 weken IV antibiotica versus >2 weken IV antibiotica)
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben tot de huidige PICO vraagstelling.
Beschrijving studies en studiepopulaties (Tabel 11)
De tien studies betroffen zowel retrospectieve als prospectieve cohortstudies. De populaties in de studies waren patiënten met S. aureus bacteriëmie, maar waren verder heterogeen. In de tabel hieronder zijn de meest differentiërende in- en exclusiecriteria weergegeven. In de meeste studies werden zowel patiënten met methicillinegevoelige als methicilline-resistente S. aureus bacteriëmie geïncludeerd. Omdat dit voor een meerderheid van de studies een klein deel van de studiepopulaties betrof, zijn deze studies toch meegenomen in de literatuursamenvatting.
Tabel 11 Studiepopulaties
|
|
Inclusiecriteria |
Exclusiecriteria |
|
|
Prospectieve cohortstudies |
|||
|
Raad 1992 |
Katheter-gerelateerde S. aureus bacteriëmie |
Optreden vroege complicaties (i.e. endocarditis, abces) |
|
|
Jensen 2002 |
S. aureus bacteriëmie Behandeling met dicloxacilline |
|
|
|
Khosrovaneh 2005 |
S. aureus bacteriëmie en weke delen infectie Leeftijd ≥18 jaar |
|
|
|
Thomas 2005 |
Katheter-gerelateerde S. aureus bacteriëmie Leeftijd >16 jaar |
|
|
|
Chong 2013 |
Ongecompliceerde S. aureus bacteriëmiea Leeftijd ≥18 jaar |
Polymicrobiële bacteriëmie |
|
|
Retrospectieve cohortstudies |
|||
|
Zeylemaker 2001 |
Katheter-gerelateerde S. aureus bacteriëmie Leeftijd ≥18 jaar |
Endocarditis bij opname |
|
|
Fätkenheuer 2004 |
S. aureus bacteriëmie |
|
|
|
Kreisel 2006 |
S. aureus bacteriëmie |
Aanwezigheid endocarditis |
|
|
Landman 2011 |
S. aureus bacteriëmie Leeftijd ≥18 jaar |
|
|
|
Kempley 2015 |
S. aureus bacteriëmie Neonaten |
|
|
Interventies (Tabel 12)
De onderzochte interventies van de studies waren heterogeen: zowel type antibiotica als dosering verschilde per studie (voor zover bekend, zie de tabel hieronder). De gebruikte antibiotica per behandelgroep (<2 weken versus ≥2 weken) werd niet in elke studie beschreven.
Tabel 12 Onderzochte interventies
|
|
Interventie |
N |
Controle |
N |
Type AB per groep |
|
Raad 1992 |
<10 dagen IV AB 10-14 dagen IV AB |
18 18 |
>14 dagen IV AB |
10 |
Bekenda |
|
Zeylemaker 2001 |
0 dagen AB 1-7 dagen AB 7-14 dagen AB |
5 4 25 |
>14 dagen AB |
15 |
Onbekend |
|
Jensen 2002 |
<14 dagen dicloxacilline |
74 |
≥14 dagen dicloxacilline |
81 |
Bekenda |
|
Fätkenheuer 2004 |
<14 dagen AB |
87 |
≥14 dagen AB |
73 |
Onbekend |
|
Khosrovaneh 2005 |
Kortdurende behandelingb |
23 |
Langdurige behandelingb |
18 |
Onbekend |
|
Thomas 2005 |
0-7 dagen IV AB 8-14 dagen IV AB |
37 132 |
15-21 dagen IV AB >21 dagen IV AB |
55 30 |
Onbekend |
|
Kreisel 2006 |
≤14 dagen ABc |
231 |
>14 dagen AB |
110 |
Onbekend |
|
Landman 2011 |
<14 dagen AB |
26 |
≥14 dagen AB |
53 |
Onbekend |
|
Chong 2013 |
<14 dagen IV AB |
38 |
≥14 dagen IV AB |
73 |
Bekenda |
|
Kempley 2015 |
0-13 dagen AB |
9 |
14-27 dagen AB ≥28 dagen AB |
51 19 |
Onbekend |
|
d, dagen; AB, antibiotica a zie de evidence tabellen voor details, b onduidelijke definitie, mogelijk ≤14 dagen versus >14 dagen; c gedefinieerd als antibioticum waarvoor het isolaat gevoelig was |
|||||
Resultaten recidief S. aureus bacteriëmie (Tabel 13)
In zeven studies werd de uitkomstmaat recidief S. aureus infectie gehanteerd, zie de tabel hieronder voor definities en follow-up duur.
Tabel 13 Definities recidief S. aureus bacteriëmie
|
|
Definitie |
Follow-up duur |
|
Raad 1992 |
Onbekend |
6 maanden |
|
Khosrovaneh 2005 |
Onbekend |
14-440 dagen |
|
Thomas 2005 |
|
12 weken |
|
Kreisel 2006 |
|
Onbekend |
|
Landman 2011 |
- Positieve kweek met S. aureus |
3 maanden |
|
|
- Na klinische verbetering |
|
|
Chong 2013 |
|
12 weken |
|
Kempley 2015 |
|
1 jaar |
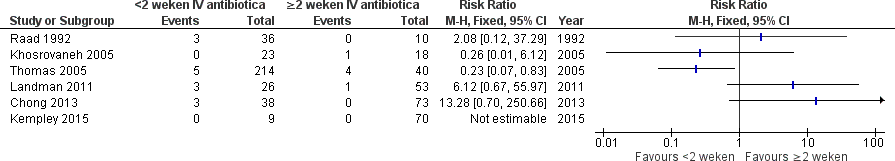
De resultaten van de studies waren wisselend (zie Figuur 10 en Tabel 14). Vier van de zeven studies toonden een trend in het voordeel van minimaal twee weken behandeling met IV antibiotica in het voorkomen van recidief S. aureus bacteriëmie, ten opzichte van korter dan twee weken IV behandeling met antibiotica (Raad et al., 1992; Kreisel et al., 2006; Landman et al., 2011; Chong et al., 2013). Twee van de zeven studies toonden dat er juist meer recidieven optraden bij patiënten die langer dan twee weken met antibiotica werden behandeld (Thomas et al., 2005; Khosrovaneh et al., 2005). In één studie trad in beide groepen geen recidief op (Kempley et al. 2015). Hierbij dient opgemerkt te worden dat het veelal gaat studies van geringe grootte en dat er ondanks baseline verschillen in prognose (confounding by indication), in zes van de zeven studies niet gecorrigeerd werd voor confounders. Eén studie onderzocht het eindpunt recidief in multivariabele analyse (Kreisel et al., 2006). Hierbij was therapieduur niet statistisch significant geassocieerd met het optreden van recidief S. aureus bacteriëmie en wees de puntschatter in een nadelig effect van langdurige behandeling (zie Tabel 14). Daarnaast onderzocht Chong et al. (2013) het effect van duur van behandeling in relatie tot een gecombineerd eindpunt van sterfte en recidief S. aureus bacteriëmie (therapiefalen) in multivariabele analyse. Hierbij was behandelduur niet statistisch significant geassocieerd met therapiefalen, zie Tabel 14 (Chong et al., 2013). Vanwege de aanwezigheid van klinische en methodologische heterogeniteit werden de resultaten betreffende recidief S. aureus bacteriëmie niet gepoold: de studies verschillen in onderzoekspopulatie en interventie, de definities van de uitkomstmaat liepen uiteen en er was sprake van statistische heterogeniteit.
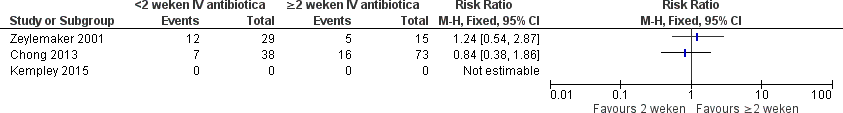
Figuur 10 Optreden van een recidief S. aureus bacteriëmie
Tabel 14 Recidief – studies met een multivariabele analyse
|
|
Kreisel et al., 2006 (n =341) |
Chong et al., 2013 (n =111) |
|
Recidief S. aureus bacteriëmie |
||
|
≤14 dagen effectieve antibiotica |
adjusted ORa 0,58 (95% BHI 0,32-1,05) |
|
|
12-weken therapiefalen (recidief S. aureus bacteriëmie of sterfte) |
||
|
<14 dagen IV antibiotica |
|
adjusted p=0.19b |
|
a gecorrigeerd voor HIV infectie, diabetes en MRSA b gecorrigeerd voor type infectie (i,e, primaire S. aureus bacteriëmie of katheter-gerelateerd), Charlson Comorbidity Score en maligniteit |
||
Duur ziekenhuisopname
Dit eindpunt werd in geen van de studies onderzocht.
Mortaliteit
Vijf studies rapporteerden resultaten betreffende het eindpunt mortaliteit, waarbij de definitie en de follow-up duur verschilden tussen de studies (zie Tabel 15). Daarnaast was de wijze van rapporteren van resultaten erg heterogeen. Eén van de vijf studies toonde in multivariabele analyse een statistisch significant effect van duur van behandeling met antibiotica (dicloxacilline) in het voorkomen van sterfte, maar het is in het artikel onduidelijk in welke richting dit effect wijst, zie Tabel 16 (Jensen et al., 2002). Drie andere studies toonden geen statistisch significante associatie tussen behandelduur en het optreden van sterfte (Zeylemaker et al., 2001; Fätkenheuer et al., 2004; Chong et al., 2013). Eén van deze studies rapporteerde niet het aantal sterfgevallen per behandelgroep (Fätkenheuer et al., 2004), zie Figuur 11 voor de resultaten van de andere twee studies. Hierbij dient opgemerkt te worden dat er in deze analyses sprake was van verschillen in baseline prognose tussen groepen (confounding by indication) en dat hiervoor niet werd gecorrigeerd. In de vijfde studie trad in beide groepen geen sterfte op (Kempley et al. 2015). Daarnaast werd in één studie een gecombineerd eindpunt van sterfte en recidief S. aureus bacteriëmie (therapiefalen) in multivariabele analyse onderzocht. Hierbij was behandelduur niet statistisch significant geassocieerd met therapiefalen, zie tabel 16 (Chong et al., 2013). Vanwege de aanwezigheid van klinische en methodologische heterogeniteit werden de resultaten betreffende mortaliteit niet gepoold: de studies verschilden sterk in onderzoekspopulatie, interventie, statistische methode en de follow-up duur van de uitkomstmaat.
Tabel 15 Definities mortaliteit
|
|
Eindpunt |
Follow-up duur |
|
Zeylemaker 2001 |
Totale mortaliteit |
1 jaar |
|
Jensen 2002 |
S. aureus bacteriëmie-gerelateerde mortaliteit, gedefinieerd als sterfte <5 weken na positieve bloedkweek of in relatie met recidief S. aureus bacteriëmie |
3 maanden |
|
Fätkenheuer 2004 |
Totale mortaliteit |
1 jaar |
|
Chong 2013 |
Totale mortaliteit Therapiefalen (sterfte of recidief S. aureus bacteriëmie) |
12 weken |
|
Kempley 2015 |
Totale mortaliteit |
Onbekend |
Figuur 11 Mortaliteit
Tabel 16 Mortaliteit – studies met een multivariabele analyse
|
|
Jensen 2002 (n = 155) |
Chong 2013 (n =111) |
|
3-maanden S. aureus bacteriëmie-gerelateerde mortaliteit |
||
|
Duur van therapiea |
adjustedb OR 0,84 (95% BHI 0,76-0,94) |
|
|
12-weken therapiefalen (recidief S. aureus bacteriëmie of sterfte) |
||
|
<14 dagen IV antibiotica |
|
adjusted p=0.19c |
|
a onduidelijk op welke categorie (lang of kortdurende behandeling) de gerapporteerde OR van toepassing is b gecorrigeerd voor septische shock, totale dosis dicloxacilline, leeftijd, ‘community-acquisition’, geslacht, tijd tussen |
||
Bijwerkingen medicatie
Dit eindpunt werd in geen van de studies onderzocht.
Bewijskracht van de literatuur
Ter informatie: zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie.
A) Recidief S. aureus bacteriëmie
Vanwege het observationele karakter van het onderzoek start de kwaliteit van bewijs voor de uitkomstmaat recidief S. aureus bacteriëmie laag. De bewijskracht van de zeven studies wordt verlaagd van laag naar zeer laag om de volgende redenen: er zijn sterke beperkingen in onderzoeksopzet: het exacte antibioticagebruik (type antibioticum) werd niet altijd gerapporteerd per behandelgroep, zes studies corrigeerden niet voor confounders (ondanks confounding by indication) en twee studies gaven geen definitie van de uitkomstmaat. Daarnaast is er sprake van statistische heterogeniteit (inconsistentie) en includeerden de studies ook patiënten met methicilline-resistente S. aureus bacteriëmie (of werd dit niet duidelijk beschreven), waardoor de resultaten niet zonder meer te extrapoleren zijn naar de onderzoekspopulatie waarvoor de richtlijn geschreven wordt (methicillinegevoelige S. aureus bacteriëmie, indirectheid van het bewijs). Tevens werd in één studie een zeer selecte patiëntenpopulatie geïncludeerd (patiënten met weke delen infectie). Tot slot waren vijf van de zeven studies van zeer geringe omvang (imprecisie).
B) Duur ziekenhuisopname
Niet te beoordelen, omdat uitkomstmaat niet onderzocht is.
C) Mortaliteit
De kwaliteit van de observationele studies wordt verlaagd van laag naar zeer laag vanwege sterke beperkingen in onderzoeksopzet (in vier van de vijf studies was er sprake van onvergelijkbare studiegroepen in baseline prognose) en het gaat om studies van geringe omvang (imprecisie). Daarnaast includeerden de studies ook patiënten met methicilline-resistente S. aureus bacteriëmie (of werd dit niet duidelijk beschreven), waardoor de resultaten niet zonder meer te extrapoleren zijn naar de onderzoekspopulatie waarvoor de richtlijn geschreven wordt (methicillinegevoelige S. aureus bacteriëmie, indirectheid van het bewijs).
D) Bijwerkingen medicatie
Niet te beoordelen, omdat uitkomstmaat niet onderzocht is.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep vier systematische literatuuranalyses gepland met de volgende PICO-vraagstellingen:
- Wat is het effect van flucloxacilline vergeleken met vancomycine op de uitkomstmaten in onderstaande Tabel 1 bij patiënten met een methicillinegevoelige S. aureus bacteriëmie?
- Wat is het effect van flucloxacilline vergeleken met een eerste generatie cefalosporine op de uitkomstmaten in onderstaande Tabel 1 bij patiënten met een methicillinegevoelige S. aureus bacteriëmie?
- Wat is het effect van flucloxacilline gecombineerd met een aminoglycoside vergeleken met alleen flucoxacilline op de uitkomstmaten in onderstaande Tabel 1 bij patiënten met een methicillinegevoelige S. aureus bacteriëmie?
- Wat is het effect van (minimaal) 2 weken intraveneuze antibiotische behandeling vergeleken met intraveneuze antibiotische behandeling korter dan 2 weken op de uitkomstmaten in onderstaande Tabel 1 bij patiënten met een methicillinegevoelige S. aureus bacteriëmie?
In de databases Medline (OVID), Embase and Cochrane is een overkoepelende, systematische search verricht voor de 4 PICO-vraagstellingen. De zoekverantwoording is weergegeven onder het tabblad verantwoording.
Tabel 1 Selectiecriteria
|
Type studies |
|
|
Type patiënten |
- patiënten met een methicillinegevoelige S. aureus bacteriëmie |
|
Interventie/control |
|
|
Type uitkomstmaten |
Effectiviteit
|
|
Type setting |
- ziekenhuis |
|
Exclusiecriteria |
|
Review 1 (flucloxacilline versus vancomycine):
Na ontdubbeling van de verschillende sets met zoekresultaten per studietype leverde de literatuurzoekactie 549 treffers op. Zie de zoekverantwoording voor de referenties die na het lezen van het volledige artikel werden geëxcludeerd. Studies die voldeden aan de selectiecriteria in Tabel 1 zijn opgenomen in de samenvatting van de literatuur.
Vijf onderzoeken zijn opgenomen in de literatuuranalyse (Chambers et al., 1988; González et al., 1999; Fortún et al., 2001; Chang et al., 2003; Siegman-Igra et al., 2005). Referentie-check leverde nog 1 extra artikel op (Gentry et al., 1997). Zie ook dee evidencetabel hiervan. Daarnaast zijn 5 studies meegenomen als indirect bewijs (Johnson et al., 2003; Kim et al., 2008; Lodise et al., 2007; Schweizer et al., 2011; Wong et al., 2016).
Review 2 (flucloxacilline versus eerste generatie cefalosporine):
Na ontdubbeling van de verschillende sets met zoekresultaten per studietype leverde de literatuurzoekactie 328 treffers op. Zie de zoekverantwoording voor de referenties die na het lezen van het volledige artikel werden geëxcludeerd. Studies die voldeden aan de selectiecriteria in Tabel 1 zijn opgenomen in de samenvatting van de literatuur.
Zes onderzoeken zijn opgenomen in de literatuuranalyse (Lee et al., 2011; Paul et al., 2011; Renaud et al., 2011; Li et al., 2014; Bai et al., 2015; McDanel et al., 2017). Zie ook dee evidencetabel hiervan. Referentie-check van deze zes artikelen leverde geen extra artikelen op.
NB: Er werd uit de zoekresultaten één systematische review geïdentificeerd met een vergelijkbare onderzoeksvraag. Deze werd echter niet geïncludeerd in de literatuursamenvatting omdat de resultaten niet werden gestratificeerd voor eerste en tweede generatie cefalosporines (Vardakas et al., 2014).
Review 3 (flucloxacilline + aminoglycoside versus flucloxacilline)
Na ontdubbeling van de verschillende sets met zoekresultaten per studietype leverde de literatuurzoekactie 268 treffers op. Zie de zoekverantwoording voor de referenties die na het lezen van het volledige artikel werden geëxcludeerd. Studies die voldeden aan de selectiecriteria in Tabel 1 zijn opgenomen in de samenvatting van de literatuur.
Drie onderzoeken zijn opgenomen in de literatuuranalyse (Korzeniowski et al., 1982; Ribera et al., 1996; Hughes et al., 2009). Zie ook dee evidencetabel hiervan. Referentie- check van deze drie studies leverde geen extra artikelen op.
Review 4 (<2 weken IV antibiotica versus >2 weken IV antibiotica)
Na ontdubbeling van de verschillende sets met zoekresultaten per studietype leverde de literatuurzoekactie 322 treffers op. Zie de zoekverantwoording voor de referenties die na het lezen van het volledige artikel werden geëxcludeerd. Studies die voldeden aan de selectiecriteria in Tabel 1 zijn opgenomen in de samenvatting van de literatuur.
Vier onderzoeken zijn opgenomen in de literatuuranalyse (Fätkenheuer et al., 2004; Khosrovaneh et al., 2005; Landman et al., 2011; Kempley et al., 2015). Zie ook dee evidencetabel hiervan. Referentie-check van deze drie studies leverde zes extra artikelen op (Raad et al., 1992; Zeylemaker et al., 2001; Jensen et al., 2002; Thomas et al., 2005; Kreisel et al., 2006; Chong et al., 2013).
Referenties
- Bai AD, Showler A, Burry L, Steinberg M, Ricciuto DR, Fernandes T et al. Comparative effectiveness of cefazolin versus cloxacillin as definitive antibiotic therapy for MSSA bacteraemia: results from a large multicentre cohort study. J Antimicrob Chemother 2015;70(5):1539-46.
- Chambers HF, Miller RT, Newman MD. Right-sided Staphylococcus aureus endocarditis in intravenous drug abusers: two- week combination therapy. Ann Intern Med 1988;109(8):619-24.
- Chang FY, Peacock JE Jr, Musher DM, Triplett P, MacDonald BB, Mylotte JM et al. Staphylococcus aureus bacteremia: recurrence and the impact of antibiotic treatment in a prospective multicenter study. Medicine (Baltimore) 2003;82(5):3339.
- Chong YP, Moon SM, Bang KM, Park HJ, Park SY, Kim MN et al. Treatment duration for uncomplicated Staphylococcus aureus bacteremia to prevent relapse: analysis of a prospective observational cohort study. Antimicrob Agents Chemother 2013;57(3):1150-6.
- Fätkenheuer G, Preuss M, Salzberger B, Schmeisser N, Cornely OA, Wisplinghoff H et al. Long-term outcome and quality of care of patients with Staphylococcus aureus bacteremia. Eur J Clin Microbiol Infect Dis 2004;23(3):157-62.
- Fortún J, Navas E, Martínez-Beltrán J, Pérez-Molina J, Martín-Dávila P, Guerrero A et al. Short-course therapy for right-side endocarditis due to Staphylococcus aureus in drug abusers: cloxacillin versus glycopeptides in combination with gentamicin.Clin Infect Dis 2001;33(1):120-5.
- Gentry CA, Rodvold KA, Novak RM, Hershow RC, Naderer OJ. Retrospective evaluation of therapies for Staphylococcus aureus endocarditis. Pharmacotherapy 1997;17(5):990-7.
- González C, Rubio M, Romero-Vivas J, González M, Picazo JJ. Bacteremic pneumonia due to Staphylococcus aureus: A comparison of disease caused by methicillin-resistant and methicillin-susceptible organisms. Clin Infect Dis 1999;29(5):1171-7.
- Hughes DW, Frei CR, Maxwell PR, Green K, Patterson JE, Crawford GE et al. Continuous versus intermittent infusion of oxacillin for treatment of infective endocarditis caused by methicillin-susceptible Staphylococcus aureus. Antimicrob Agents Chemother 2009;53(5):2014-9.
- Jernigan JA, Farr BM. Short-course therapy of catheter-related Staphylococcus aureus bacteremia: a meta-analysis. Ann Intern Med. 1993 Aug 15;119(4):304-11.
- Kempley S, Kapellou O, McWilliams A, Banerjee J, McCorqodale A, Millar M. Antibiotic treatment duration and prevention of complications in neonatal Staphylococcus aureus bacteraemia. J Hosp Infect 2015;91(2):129-35.
- Khosrovaneh A, Sharma M, Khatib R. Favorable prognosis of Staphylococcus aureus bacteremia originating from soft tissues: a prospective study of fifty cases. Scand J Infect Dis 2005;37(1):6-10.
- Kreisel K, Boyd K, Langenberg P, Roghmann MC. Risk factors for recurrence in patients with Staphylococcus aureus infections complicated by bacteremia. Diagn Microbiol Infect Dis 2006;55(3):179-84.
- Jensen AG, Wachmann CH, Espersen F, Scheibel J, Skinhøj P, Frimodt-Møller N. Treatment and outcome of Staphylococcus aureus bacteremia: a prospective study of 278 cases. Arch Intern Med 2002;162(1):25-32.
- Johnson LB, Almoujahed MO, Ilg K, Maolood L, Khatib R. Staphylococcus aureus bacteremia: compliance with standard treatment, long-term outcome and predictors of relapse. Scand J Infect Dis 2003;35(11-12):782-9.
- Kim SH, Kim KH, Kim HB, Kim NJ, Kim EC, Oh MD et al. Outcome of vancomycin treatment in patients with methicillin- susceptible Staphylococcus aureus bacteremia. Antimicrob Agents Chemother 2008;52(1):192-7.
- Korzeniowski O, Sande MA. Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts: A prospective study. Ann Intern Med 1982;97(4):496-503.
- Landman GW, Bouwhuis JW, Bloembergen P, van der Meer JT, Groeneveld PH. Evaluation of diagnosis and therapy of Staphylococcus aureus bacteraemia: recommended minimum treatment duration of 2 weeks not always met. Ned Tijdschr Geneeskd 2011;155(38):A3376.
- Lee S, Choe PG, Song KH, Park SW, Kim HB, Kim NJ et al. Is cefazolin inferior to nafcillin for treatment of methicillin- susceptible Staphylococcus aureus bacteremia? Antimicrob Agents Chemother 2011;55(11):5122-6.
- Li J, Echevarria KL, Hughes DW, Cadena JA, Bowling JE, Lewis JS. Comparison of cefazolin versus oxacillin for treatment of complicated bacteremia caused by methicillin-susceptible Staphylococcus aureus. Antimicrob Agents Chemother 2014;58(9):5117-24.
- Lodise TP Jr, McKinnon PS, Levine DP, Rybak MK. Impact of empirical-therapy selection on outcome of intravenous drug users with infective endocarditis caused by methicillin-susceptible Staphylococcus aureus. Antimicrob Agents Chemother 2007;51(10):3731-3.
- McDanel JS, Roghmann MC5, Perencevich EN, Ohl ME, Goto M, Livorsi DJ et al. Comparative Effectiveness of Cefazolin Versus Nafcillin or Oxacillin for Treatment of Methicillin-Susceptible Staphylococcus aureus Infections Complicated by Bacteremia: A Nationwide Cohort Study. Clin Infect Dis 2017;65(1):100-6.
- Paul M, Zemer-Wassercug N, Talker O, Lishtzinsky Y, Lev B, Samra Z et al. Are all beta-lactams similarly effective in the treatment of methicillin-sensitive Staphylococcus aureus bacteraemia? Clin Microbiol Infect 2011;17:15816.
- Raad II, Sabbagh MF. Optimal duration of therapy for catheter-related Staphylococcus aureus bacteremia: a study of 55 cases and review. Clin Infect Dis 1992;14(1):75-82.
- Renaud CJ, Lin X, Subramanian S, Fisher DA. High-dose cefazolin on consecutive hemodialysis in anuric patients with Staphylococcal bacteremia. Hemodial Int 2011;15(1):63-8.
- Ribera E, Gómez-Jimenez J, Cortes E, del Valle O, Planes A, Gonzalez-Alujas T et al. Effectiveness of cloxacillin with and without gentamicin in short-term therapy for right-sided Staphylococcus aureus endocarditis. A randomized, controlled trial. Ann Intern Med 1996;125(12):969-74.
- Schweizer ML, Furuno JP, Harris AD, Johnson JK, Shardell MD, McGregor JC et al. Comparative effectiveness of nafcilline or cefazolin versus vancomycin in methicillin-susceptible Staphylococcus aureus bacteremia. BMC Infect Dis 2011;11:279.
- Siegman-Igra Y, Reich P, Orni-Wasserlauf R, Schwartz D, Giladi M. The role of vancomycin in the persistence of recurrence of Staphylococcus aureus bacteraemia. Scand J Infect Dis 2005;37(8):572-8.
- Thomas MG, Morris AJ. Cannula-associated Staphylococcus aureus bacteraemia: outcome in relation to treatment. Intern Med J 2005;35(6):319-30.
- Vardakas KZ, Apiranthiti KN, Falagas ME. Antistaphylococcal penicillins versus cephalosporins for definitive treatment of methicillin-susceptible Staphylococcus aureus bacteraemia: a systematic review and meta-analysis. Int J Antimicrob Agents 2014;44(6):486-92.
- Wong D, Wong T, Romney M, Leung V. Comparative effectiveness of beta-lactam versus vancomycin empiric therapy in patients with methicillin-susceptible Staphylococcus aureus (MSSA) bacteremia. Ann Clin Microbiol Antimicrob 2016;15:27.
- Zeylemaker MM, Jaspers CA, van Kraaij MG, Visser MR, Hoepelman IM. Long-term infectious complications and their relation to treatment duration in catheter-related Staphylococcus aureus bacteremia. Eur J Clin Microbiol Infect Dis 2001;20(6):380-4
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
||||||
|
PICO 1: flucloxacilline versus vancomycine |
|||||||||||||
|
Chambers 1988 |
Type of study: Prospective open study |
Inclusion criteria: Patients with suspected Staphylococcal endocarditis, ≥2 blood cultures with S. aureus, intravenous drug use, suspected infection is reason for hospitalization
Exclusion criteria: Allergy to study drugs, serum creatinine level of ≥ 220 µmol/L, presence of other infectious complications requiring prolonged therapy or surgery for cure, meningitis, MRSA, evidence of mitral or aortic valve infection, pregnancy.
N total at baseline (episodes, not patients): Intervention: 3 Control: 50
Important prognostic factors2: Unknown
Groups not comparable at baseline |
Intervention group: 14 day course of vancomycin- tobramycin |
Control group: 14 day course of nafcillin-tobramycin |
Length of follow-up: 2 months, for some patients follow-up ranged until 37 months. |
Recurrent episode of S. aureus endocarditis (crude)* I: 2/3** C: 6/50 |
|
||||||
|
|
Setting: San Francisco General Hospital Medical Center between August 1983 and September 1987. |
IV vancomycin (30 mg/kg per day in 2-3 divided doses) and IV tobramycin (1 mg/kg every 8h) |
IV nafcillin (1.5 g, every 4h) and IV tobramycin (1 mg/kg every 8h) |
Loss-to-follow-up: Unclear
Incomplete outcome data: Unclear |
*exact definition unclear
**one of two described relapses had persistent fever but negative blood cultures. |
||||||||
|
|
Country: USA |
|
|
|
|
||||||||
|
|
Source of funding: Unknown |
|
|
|
|
||||||||
|
Gentry 1997 |
Type of study: Retrospective cohort study
Setting: University of Illinois Hospital or Westside Veterans Administration Hospital in Chicago Illinois from January 1989 – December 1993.
Country: USA |
Inclusion criteria: Initial blood cultures, valvular tissue specimens or specimens from embolic phenomena showing S. aureus as the only causative pathogen, and definite or possible infective endocarditis based on the Duke criteria
Exclusion criteria: Not completing at least 10 days of primary antibiotic therapy, unless failure or death occurred within those 10 days
N total at baseline (courses, not patients): Intervention: 18 Control: 27
Important prognostic factors2: Sex: |
Intervention group: Vancomycin
Exact duration of vancomycin treatment is unknown
In case of switch from nafcilline to vancomycin, vancomycin was considered primary therapy as long as nafcilline was given for <5 days
Serum vancomycin concentrations were |
Control group: Nafcillin
Exact duration of nafcillin treatment is unknown
In case of switch from vancomycin to nafcillin, nafcillin was considered primary therapy as long as vancomycin was given for <5 days
Daily dosage of nafcilline ranged from 8-12 g/day in all patients. 7% of |
Length of follow-up: 2 months
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Length of hospital stay (crude) I: 39.8 days (± 17.7) C: 31.9 days (± 15.0)
2-month mortality (crude) I: 5/18 (28%) C: 6/27 (22%)
Failure* When adjusting for confounders**, therapy with vancomycin did not remain significantly associated with failure (effect estimate not given)
*defined as lack of microbiologic response, no clinical improvement, deterioration, relapse, or death during therapy or within 2 months after therapy |
|
||||||
|
|
Source of funding: Unknown |
I: 44% M C: 70% M
No of chronic conditions: I: 2.83 (± 1.69) C: 1.41 (± 1.47) p <0.05
IV drug use: I: 39% C: 81% p <0.05
Groups not comparable at baseline |
maintained in the therapeutic range for most patients. (mean peak and trough concentr. were 33.6 and 16.4 µg/ml). 17% of vancomycin patients received rifampin therapy.
Gentamicin was given initially to 84% of all the patients, mean duration of gentamicin therapy in vancomycin group was 13.2 days |
nafcilline-treated patients received rifampin therapy.
Gentamicin was given initially to 84% of all the patients, mean duration of gentamicin therapy in nafcillin group was 9.7 days |
|
**adjusted for: age, IV drug use, number of chronic conditions, duration of fever and vancomycin
Adverse effects (nephrotoxicity) I: 5/18 C: 4/27 |
|
|
|||||
|
González 1999 |
Type of study: Prospective observational cohort study
Setting: Tertiary care center Hospital Universitario San Carlos in Madrid from 1 January 1990 to 31 December 1995
Country: Spain
Source of funding: Unknown |
Inclusion criteria: Patients with bacteremic pneumonia due to S. aureus*
*defined as clinical symptoms and S. aureus in culture of 2 samples of bronchial aspirate from the same patient on consecutive days AND significant S. aureus bacteremia (S. aureus from ≥ 1 blood culture, with sepsis symptoms of unexplained by other causes)
Exclusion criteria: For the analysis of treatment efficacy, patients with inappropriate antibiotic treatment, patients that were not treated over a period of >48, that died as a consequence of underlying disease before the completion of the treatment and the underlying clinical situation did not allow the response to the antibiotic to be evaluated were excluded |
Intervention group: Appropriate vancomycin treatment*
*Defined as vancomycin in therapeutic dosage, active in vitro and recognized clinical efficacy. Exact duration unknown.
** Two patients were initially treated with vancomycin and switched to cloxacillin, are also in this group? |
Control group: Appropriate cloxacillin treatment*
*Defined as in therapeutic dosage, active in vitro and recognized clinical efficacy. Exact duration unknown.
** Four patients were initially treated with cloxacillin and switched to vancomycin, are also in this group? |
Length of follow-up: Until cure or death
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Mortality* (crude) I: 8/17 (47%) C: 0/10 p-value <0.1.
Mortality* Not corrected for confounders, but taking into account interaction between vancomycin, shock and respiratory distress: Odds ratio of death for vancomycin treatment in presence of distress: OR 38.46 (95% CI 3.5 – 422.37).
*time point of assessment unclear |
|
|
|||||
|
|
|
N total at baseline: MSSA bacteremic pneumonia: Intervention: 17 Control: 10 |
|
|
|
|
|
||||||
|
|
|
Important prognostic factors2: Unknown |
|
|
|
|
|
||||||
|
|
|
Groups not comparable at baseline |
|
|
|
|
|
|
|||||
|
Fortún 2001 |
Type of study: Open randomized trial
Setting: Unknown
Country: Spain
Source of funding: Unknown |
Inclusion criteria: Parental drug abuse and fever, isolation of MSSA from ≥2 blood cultures and any of the following: septic pulmonary embolization, tricuspid regurgitation murmur, and echocardiographic evidence of endocarditis.
Exclusion criteria: MRSA, allergy to antibiotics used, extrapulmonary metastatic focus at enrolment or developed within the first 48h of therapy, serum creatinine >220 nmol/L, left side endocarditis, presence of nonbiological valvular prosthesis or long- term catheter, polymicrobial infections, pregnancy, or receipt of effective antimicrobial treatment during the 72h prior to the study period. |
Intervention group: 14 day course of vancomycin- gentamicin
IV vancomycin (500 mg, every 6h) and IV gentamicin (1.5 mg/kg every 8h)
Mean serum vancomcyin peak level was 36 ± 9 |
Control group: 14 day course of cloxacillin-gentamicin
IV cloxacillin (2 g, every 4h) and IV gentamicin (1.5 mg/kg every 8h)
Mean serum cloxacillin peak level was 59 ± 12 |
Length of follow-up: Unclear
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Microbiological relapse (crude)* I: 1/10 (10%) C: 0/11 (0%)
*a positive blood culture result after cessation of treatment.
Adverse effects: 1 patient in vancomycin-group developed a moderate increase in serum creatinine level at the end of therapy that resolved within 1 week after withdrawal of vancomycin and the aminoglycoside, 1 other patient in vancomycin group experienced rash. |
|
|
|||||
|
|
|
N total at baseline: Intervention: 10 Control: 11 |
|
|
|
|
|
||||||
|
|
|
Important prognostic factors2: Sex: I: 90% M C: 100% M |
|
|
|
|
|
||||||
|
|
|
Mean age (range): I: 25 (18-31) C: 28 (23-38) |
|
|
|
|
|
||||||
|
|
|
Groups comparable at baseline |
|
|
|
|
|
||||||
|
Chang 2003 |
Type of study: Prospective observational cohort study
Setting: 6 Tertiary care hospitals from August 1994 to March 1996
Country: |
Inclusion criteria: Patients with S. aureus bacteremia* *exact definition unknown Exclusion criteria: Polymicrobial bacteremia. For the analysis of antibiotic efficacy, patients that did not receive >4 days of therapy and patients with endocarditis were excluded
N total at baseline: |
Intervention group: At least 10 days vancomycine within the first 14 days of therapy
Exact duration and dosing of vancomycin not reported. |
Control group: At least 10 days of nafcillin within the first 14 days of therapy
Exact duration and dosing of nafcillin not reported. |
Length of follow-up: 6 months for patients with SAB, 3 years for patients with endocarditis
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Relapse* (crude) I: 5/70 C: 0/18
Relapse* Multivariable analysis: Including the factors endocarditis and hemodialysis: treatment with vancomycin versus nafcillin was significantly associated with relapse (n=5), OR = 6.5 (95% CI = 1.0-52.8, p- value 0.048). |
|
|
|||||
|
|
United States?
Source of funding: Unknown |
Intervention: 70 Control: 18
Important prognostic factors2: Sex: I: 61% M C: 85% M p = 0.015 |
|
|
|
*relapse is defined as a recurrent episode (return of SAB after documentation of negative blood cultures or clinical improvement) with pulsed-field gel electrophoresis patterns of sequential isolates being indistinguishable |
|
|
|||||
|
|
Community acquisition: I: 31% C: 67% p = 0.001 |
|
|
||||||||||
|
|
Catheter-related infection: I: 48% C: 12% p = 0.0002 |
|
|
||||||||||
|
|
Groups not comparable at baseline |
|
|
||||||||||
|
Siegman- |
Type of study: |
Inclusion criteria: |
Intervention group: |
Control group: |
Length of follow-up: |
SAB relapse** (crude) |
*Note: |
|
|||||
|
Igra 2005 |
Prospective |
Growth of S. aureus from at least 1 blood |
Treatment with IV |
Treatment with IV |
Unknown |
I: 1/13 (8%) |
article |
|
|||||
|
|
observational |
culture specimen, |
vancomycin |
cloxacillin |
|
C: 1/52 (2%) |
describes |
|
|||||
|
|
cohort study |
patients who survived at least 10 d of |
|
|
Loss-to-follow-up: |
|
two study |
|
|||||
|
|
|
appropriate therapy |
Standard of care: |
Standard of care: 2-3gr |
Unknown |
**Defined as the return of SAB after |
periods. |
|
|||||
|
|
Setting: |
|
1gr every 12h, |
every 6h |
|
documentation of negative blood |
Data |
|
|||||
|
|
Tel-Aviv |
Exclusion criteria: |
adjusted to age and |
|
Incomplete outcome data: |
cultures, or after clinical recovery and |
extraction |
|
|||||
|
|
Sourasky |
S. aureus in blood culture that was |
renal function to |
Exact duration of |
Unknown |
hospital discharge, following a course |
was |
|
|||||
|
|
Medical Centre |
considered as contaminant |
achieve peak levels |
cloxacillin treatment |
|
of anti-staphylococcal therapy. 9 |
performed |
|
|||||
|
|
university |
|
of ≥20 mg/l |
unknown. Also |
|
patients were excluded who had a |
only for |
|
|||||
|
|
hospital in Tel- |
N total at baseline (MSSA): |
|
unknown whether |
|
second episode of SAB interpreted as |
study |
|
|||||
|
|
Aviv during 1997-1998* |
Intervention: 13 Control: 52 |
Exact duration of vancomycin |
switching occurred |
|
reinfection. |
period 1997- |
|
|||||
|
|
|
|
treatment unknown. |
|
|
Mortality |
1998, |
|
|||||
|
|
Country: |
Important prognostic factors2 |
Also unknown |
|
|
Data on mortality not stratified for |
since in |
|
|||||
|
|
Israel |
(Including MRSA episodes): |
whether switching |
|
|
MRSA and MSSA |
the second |
|
|||||
|
|
|
Age ± SD: |
occurred |
|
|
|
period |
|
|||||
|
|
Source of |
I: 57 (± 19) |
|
|
|
|
only |
|
|||||
|
|
funding: |
C: 63 (± 20) |
|
|
|
|
patients |
|
|||||
|
|
Unknown |
|
|
|
|
|
with |
|
|||||
|
|
|
Endocarditis, n: |
|
|
|
|
recurrent |
|
|||||
|
|
|
I: 5/55 |
|
|
|
|
or |
|
|||||
|
|
|
C: 2/52 |
|
|
|
|
persistent |
|
|||||
|
|
|
|
|
|
|
|
SAB were |
|
|||||
|
|
|
Underlying conditions: |
|
|
|
|
enrolled in |
|
|||||
|
|
|
No significant differences (details unknown) |
|
|
|
|
the study |
|
|||||
|
|
|
Groups not comparable at baseline |
|
|
|
|
|
||||||
|
PICO 2: flucloxacilline versus eerste generatie cefalosporine |
|||||||||||||
|
Lee, 2011 |
Type of study: |
Inclusion criteria: |
Intervention group: |
Control group: |
Length of follow-up: |
4-week overall mortality |
Authors |
||||||
|
|
Retrospective |
Patients with MSSA positive blood cultures |
Definite therapy |
Definite therapy with |
4 weeks |
Propensity score matched groups * |
name it a |
||||||
|
|
cohort study |
who received cefazolin or nafcillin as |
with cefazolin* |
nafcillin* |
|
I: 4/41 (10%) |
case- |
||||||
|
|
|
definite antibiotics, only first episodes |
|
|
Loss-to-follow-up: |
C: 4/41 (10%) |
control |
||||||
|
|
Setting: |
|
*Exact definition |
*Exact definition |
None? |
p>0.99 |
study but |
||||||
|
|
Tertiary care |
Exclusion criteria: |
unknown |
unknown |
|
|
there is no |
||||||
|
|
hospital in Seoul |
Patients that were not able to be matched |
|
|
Incomplete outcome data: |
SAB-related mortality |
sampling of |
||||||
|
|
from January |
on propensity score, patients that received |
Median duration of |
Median duration of |
None? |
Propensity score matched groups * |
cases and |
||||||
|
|
2004 to June |
cefazolin while nafcillin was available (n=41) |
treatment 17 days |
treatment 15 days |
|
I: 1/41 (2%) |
controls so |
||||||
|
|
2009 |
|
(IQR 10-28) |
(IQR 10-25) |
|
C: 5/41 (12%) |
seems to |
||||||
|
|
|
N total at baseline: |
|
|
|
P=0.22 |
be a |
||||||
|
|
Country: |
Intervention: 49 |
No details provided |
No details provided on |
|
|
‘regular’ |
||||||
|
|
South-Korea |
Control: 84 |
on dose and |
dose and synergistic |
|
(Confounders included in PS: age, |
cohort |
||||||
|
|
|
|
synergistic |
treatment |
|
McCabe classification, high-burden |
study |
||||||
|
|
Source of |
Important prognostic factors: |
treatment |
|
|
disease, site of infection, focus |
|
||||||
|
|
funding: |
Community-acquired, n: |
|
|
|
eradication) |
NB: |
||||||
|
|
None |
I: 19/49 (39%) |
|
|
|
|
Propensity |
||||||
|
|
|
C: 43/84 (51%) |
|
|
|
Adverse drug events |
score |
||||||
|
|
|
|
|
|
|
I: 0/41 |
matching |
||||||
|
|
|
Endocarditis, n: |
|
|
|
C: 7/41 |
creates |
||||||
|
|
|
I: 1/49 (2%) |
|
|
|
p=0.02 |
balanced |
||||||
|
|
|
C: 13/84 (16%) |
|
|
|
Drug-related fever (n=4), cytopenia |
groups in |
||||||
|
|
|
|
|
|
|
(n=2), phlebitis (n=1) |
terms of |
||||||
|
|
|
End-stage renal disease, n: |
|
|
|
|
measured |
||||||
|
|
|
I: 2/49 (4%) |
|
|
|
|
confounder |
||||||
|
|
|
C: 10/84 (12%) |
|
|
|
|
s |
||||||
|
|
|
Groups not comparable at baseline (before |
|
|
|
|
|
||||||
|
|
|
matching on PS) |
|
|
|
|
|
||||||
|
Paul, 2011 |
Type of study: Retrospective cohort study
Setting: Rabin Medical Center, Beilinson Hospital between 1998- 1994 and 1999- 2007
Country: Israel |
Inclusion criteria: Patients with growth of MSSA in at least 2 separate sets of blood cultures or those who fulfilled criteria for SIRS within 48h of a positive blood culture with no other source of infection, patients that were treated with a β-lactam antibiotic started within 48h after collection of positive blood cultures
Exclusion criteria: Polymicrobial bacteremia death before day 7 after blood culture collection
N total at baseline: Intervention: 72 |
Intervention group: Definitive treatment with cefazolin*
* Definitive treatment was defined as treatment that was given on days 3-9 after collection of blood cultures
Median duration of treatment 15 days (IQR 10-25) |
Control group: Definitive treatment with oxacillin*
*Definitive treatment was defined as treatment that was given on days 3-9 after collection of blood cultures
Median duration of treatment 15 days (IQR 10-25) |
Length of follow-up: 90 days
Loss-to-follow-up: None?
Incomplete outcome data: None? |
90-day all-cause mortality Definitive treatment with cefazolin, adjusted* OR 0.91 (95%CI 0.47-1.77)
*adjusted for age, poor functional capacity, hospital-acquired SAB, diabetes, malignancy, valvular heart disease, urea level, albumin level, thrombocyte level
Adverse drug events Not reported |
|
||||||
|
|
Source of funding: None |
Control: 281
Important prognostic factors: Not presented stratified per group, only for overall cohort:
Mean age, in years (±SD): 69 (±16.8)
Community-acquired, n: 66 (12.2%)
Endocarditis, n: 25 (6.5%)
Groups not comparable at baseline (data not presented) |
No details provided on dose, treatment duration and synergistic treatment |
No details provided on dose, treatment duration and synergistic treatment |
|
|
|
|
|||||
|
Renaud, 2011 |
Type of study: Retrospective cohort study with historical controls
Setting: Acute tertiary academic center between June 1 and December 31 2009
Country: Singapore
Source of funding: Unknown |
Inclusion criteria: Hemodialysis patients with confirmed MSSA positive blood cultures that had received 2- 3g of cefazolin on HD and HD vintage >36 months (patients with anuria)
For historical control cohort, HD patients who had received cloxacillin 6 months before the start of the cefazolin protocol were included
Exclusion criteria: Age <21 years old, died within 2 days of hospitalization or had the following: polymicrobial or non-MSSA bacteremia or had received standard 1g cefazolin daily initially
N total at baseline: Intervention: 14 Control: 13
Important prognostic factors: Diabetes mellitus: I: 79% C: 77% NS |
Intervention group: 2-3 gr cefazolin, administered over 5 minutes immediately during the patient’s disconnection from the HD circuit.
Patients were discharged to complete 2 weeks of cefazolin at their HD centers once clinically better, C- reactive protein (CRP) improved, and blood culture was negative
No details provided on synergistic treatment |
Control group: IV cloxacillin 500- 2000mg 4 times a day through a PICC
Patients were switched to oral equivalent upon bacteremia clearance and improvement in CRP
No details provided on synergistic treatment |
Length of follow-up: 30 days
Loss-to-follow-up: None?
Incomplete outcome data: None? |
30-day all-cause mortality (crude) I: 1/14 C: 2/13
Infection recrudescence* (crude) I: 0 C: 2/13 (15%) p=0.14 *Defined as the isolation of MSSA from a repeat blood culture during the follow-up period or readmission after blood culture had become sterile on initial treatment within 30 days
Mean length of stay (crude) I: 10 days C: 20 days P<0.05
Adverse drug events (crude) I: 3 C: 0 n=2 Steven Johnson syndrome, 1 severe leukopenia |
|
|
|||||
|
|
|
Catheter-related infection I: 35.7% C: 38.5% NS |
|
|
|
|
|
||||||
|
|
|
Groups not comparable at baseline (historical controls) |
|
|
|
|
|
|
|||||
|
Li, 2014 |
Type of study: |
Inclusion criteria: |
Intervention group: |
Control group: |
Length of follow-up: |
30-day all-cause mortality (crude) |
No |
|
|||||
|
|
Retrospective |
Patients with ≥1 positive blood culture for |
≥10 days of therapy |
≥10 days of therapy |
90 days |
I: 0 |
definition |
|
|||||
|
|
cohort study |
MSSA (only the first episode) and |
with cefazolin |
with oxacillin |
|
C: 1/34 (3%) |
provided |
|
|||||
|
|
|
complicated bacteremia*, ≥18 years old, |
|
|
Loss-to-follow-up: |
p=0.37 |
for |
|
|||||
|
|
Setting: |
received ≥10 days of therapy with cefazolin |
n=41 of intervention |
n=32 (94%) of control |
None? |
|
recurrence |
|
|||||
|
|
Two tertiary |
or oxacillin |
group received |
group received |
|
90-day all-cause mortality (crude) |
or relapse |
|
|||||
|
|
care hospitals in |
|
6g/day, n=1 8g/day, |
12g/day, mostly with |
Incomplete outcome data: |
I: 0 |
of |
|
|||||
|
|
San Antonio, |
*Complicated bacteremia was defined as ≥1 |
n=2 4g/day |
continuous infusions |
None? |
C: 1/34 (3%) |
infection, |
|
|||||
|
|
Texas between |
positive blood culture and at least one of |
(adjusted for renal |
|
|
p=0.37 |
the |
|
|||||
|
|
January 2008 |
the following: positive follow-up blood |
function), mostly |
Median duration of |
|
|
numbers of |
|
|||||
|
|
and June 2012 |
cultures within 5d of therapy initiation, |
with continuous |
therapy 31 days (IQR |
|
Recurrence of bacteremia* (crude) |
relapse of |
|
|||||
|
|
|
evidence of metastatic spread, infected |
infusions |
21-42) |
|
I: 1/59 (2%) |
infection |
|
|||||
|
|
Country: |
prostheses not removed within 4d and |
N=12 received 2g |
|
|
C: 2/34 (6%) |
used in |
|
|||||
|
|
USA |
presence of endocarditis |
after every |
n=4 (11%) patients |
|
p=0.55 |
literature |
|
|||||
|
|
|
|
hemodialysis |
treated with |
|
|
review |
|
|||||
|
|
Source of |
Exclusion criteria: |
session, n=3 |
synergistic gentamicin, |
|
Relapse of infection* (crude) |
above |
|
|||||
|
|
funding: |
Uncomplicated or polymicrobial bacteremia, |
received 3g |
n=1 with rifampin in |
|
I: 4/59 |
|
|
|||||
|
|
Unknown |
received empirical antibiotics for ≥72h, or |
following dialysis |
addition to gentamicin |
|
C: 3/34 |
|
|
|||||
|
|
|
received other antibiotics active against |
session |
|
|
p=0.1 |
|
|
|||||
|
|
|
MSSA during treatment |
|
|
|
|
|
|
|||||
|
|
|
|
Median duration of |
|
|
*No definition provided |
|
|
|||||
|
|
|
N total at baseline: |
therapy 39 days |
|
|
|
|
|
|||||
|
|
|
Intervention: 59 |
(IQR 28-44) |
|
|
Adverse drug events (crude) |
|
|
|||||
|
|
|
Control: 34 |
|
|
|
I: 2/59 (3%)** |
|
|
|||||
|
|
|
|
n=5 (8%) patients |
|
|
C: 10/34 (30%)*** |
|
|
|||||
|
|
|
Important prognostic factors: |
treated with |
|
|
p<0.001 |
|
|
|||||
|
|
|
Sex: |
synergistic |
|
|
**n=1 rash, n=1 diarrhoea |
|
|
|||||
|
|
|
I: 75% M |
gentamicin, n=3 |
|
|
***n=6 elevated transaminases, n=1 |
|
|
|||||
|
|
|
C: 82% M |
with rifampin in |
|
|
rash, n=1 elevated creatinine, n=1 |
|
|
|||||
|
|
|
p = 0.45 |
addition to |
|
|
leukopenia, n=1 other |
|
|
|||||
|
|
|
|
gentamicin |
|
|
|
|
|
|||||
|
|
|
IV drug use: |
|
|
|
|
|
|
|||||
|
|
|
I: 32% |
|
|
|
|
|
|
|||||
|
|
|
C: 30% |
|
|
|
|
|
|
|||||
|
|
|
p = 0.6 |
|
|
|
|
|
|
|||||
|
|
|
End-stage renal disease: |
|
|
|
|
|
|
|||||
|
|
|
I: 25% |
|
|
|
|
|
|
|||||
|
|
|
C: 0% |
|
|
|
|
|
|
|||||
|
|
|
p <0.001 |
|
|
|
|
|
|
|||||
|
|
|
Osteoarticular source of infection: |
|
|
|
|
|
|
|||||
|
|
|
I: 31% |
|
|
|
|
|
|
|||||
|
|
|
C: 59% |
|
|
|
|
|
|
|||||
|
|
|
p = 0.009 |
|
|
|
|
|
|
|||||
|
|
|
Groups not comparable at baseline |
|
|
|
|
|
|
|||||
|
Bai, 2015 |
Type of study: Retrospective cohort study
Setting: Six acute-care academic and community hospitals in the Greater Toronto Area between 1 April 2007 to 31 March 2010
Country: Canada
Source of funding: Study was carried out as part of routine work, several authors received grants (see Funding section of manuscript) |
Inclusion criteria: Patients with MSSA bacteremia (≥1 positive blood culture) that were treated with cefazolin or cloxacillin as the predominant antibiotic during their antibiotic course (defined as the only antibiotic used for >3d and for the majority (>50%) of the time during the antibiotic course
Exclusion criteria: Age <18 years, if any of the following occurred within 3d of blood culture: death, left against medical advice, deemed palliative
N total at baseline: Intervention: 105 Control: 249
Important prognostic factors: Sex: I: 55% M C: 67% M p = 0.0532
Endocarditis: I: 2% C: 12% p=0.0018
Mechanical ventilation within 7d of blood culture: I: 15% C: 25% p = 0.0497 |
Intervention group: Cefazolin as predominant antibiotic
Median daily dose was 3g (IQR 3-3)
Median duration of therapy 17 days (IQR 13-31), for n=7 obese patients the median dose was 4g (range 3-6g)
n=9 (9%) cefazolin patients received gentamicin as synergistic treatment |
Control group: Cloxacillin as predominant antibiotic
Median daily dose was 12g (IQR 8-18)
Median duration of therapy 19 days (IQR 13-34)
n=18 (7%) cloxacillin patients received gentamicin as synergistic treatment |
Length of follow-up: 90 days
Loss-to-follow-up: Unclear
Incomplete outcome data: Unclear |
90-day all-cause mortality Cox proportional hazards regression model with propensity score adjustment: Cefazolin treatment, HR 0.6 (95% CI 0.36-1.01)
Relapse* In groups matched on propensity score (creates balance between baseline differences) I: 6/90 (7%) C: 2/90 (2%)
*Defined as any positive culture for S. aureus isolated from a suspected infectious focus after discontinuation of antibiotic course within 90days of follow-up, with same susceptibility pattern
Adverse drug events Not reported
Variables included in propensity score: age, sex, admission unit, onset of infection, presence of comorbidities, fever/hypotensive shock/renal insufficiency at onset of presentation, early SAB infectious foci preceding or within 3 days of blood culture and ≥2 days to appropriate antibiotics |
|
|
|||||
|
|
|
Groups not comparable at baseline |
|
|
|
|
|
||||||
|
McDanel, 2017 |
Type of study: Retrospective cohort study
Setting: 119 acute care Veterans Affairs hospitals from |
Inclusion criteria: ≥1 S. aureus positive blood culture susceptible to either methicillin or oxacillin and treatment with cefazolin, nafcillin or oxacillin for definitive therapy of their MSSA infections complicated by bacteremia, only first admissions |
Intervention group: Definitive therapy* with cefazolin
*Defined as starting a definitive antimicrobial or continuing an |
Control group: Definitive therapy* with nafcillin or oxacillin
*Defined as starting a definitive antimicrobial or continuing an |
Length of follow-up: 90 days (365 days for recurrence)
Loss-to-follow-up: Unclear
Incomplete outcome data: |
30-day all-cause mortality Multivariable* cox proportional hazards regression model: Cefazolin treatment, HR 0.63 (95%CI 0.51-0.78)
*Adjustment for modified APACHE III score, Charlson comorbidity index, |
Authors extracted data from electronic health records (e.g. ICD-9 codes) |
|
|||||
|
|
2003 to 2010 |
Exclusion criteria: |
empiric |
empiric antimicrobial |
Unclear |
skin/soft tissue infections, |
|
|
|||||
|
|
Admission to a VA hospital with <25 cases of |
antimicrobial |
between day 4 and 14 |
|
endocarditis, osteomyelitis, ICU |
|
|||||||
|
Country: |
S. aureus bacteremia throughout study |
between day 4 and |
after the first positive |
|
admission, diabetes |
|
|||||||
|
USA |
period, definite treatment with both |
14 after the first |
blood culture was |
|
|
|
|||||||
|
|
cefazolin and nafcillin or cefazolin and |
positive blood |
collected |
|
90-day all-cause mortality |
|
|||||||
|
Source of |
oxacillin, for the recurrence analysis: death |
culture was |
|
|
Multivariable** cox proportional |
|
|||||||
|
funding: |
within 45d from first blood culture |
collected |
n=1581 (79%) of |
|
hazards regression model: |
|
|||||||
|
VA Health |
|
|
control group received |
|
Cefazolin treatment, HR 0.77 (95%CI |
|
|||||||
|
Services |
N total at baseline: |
n=909(78%) of |
empiric vancomycin |
|
0.66-0.9) |
|
|||||||
|
Research and |
Intervention: 1163 |
intervention group |
|
|
|
|
|||||||
|
Development |
Control: 2004 |
received empiric |
No details provided on |
|
**Adjustment for modified APACHE |
|
|||||||
|
(HSR&D) Career |
|
vancomycin |
dose and treatment |
|
III score, Charlson comorbidity index, |
|
|||||||
|
Development |
Important prognostic factors: |
|
duration |
|
skin/soft tissue infections, |
|
|||||||
|
Awards |
Sex: |
No details provided |
|
|
endocarditis, osteomyelitis, ICU |
|
|||||||
|
|
I: 97% M |
on dose and |
|
|
admission, diabetes, hospital-onset |
|
|||||||
|
|
C: 99% M |
treatment duration |
|
|
infection |
|
|||||||
|
|
p = 0.031 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
Recurrence* |
|
|||||||
|
|
Hospital-onset infection: |
|
|
|
Multivariable** logistic regression: |
|
|||||||
|
|
I: 21% |
|
|
|
Cefazolin treatment, OR 1.13 (95% CI |
|
|||||||
|
|
C: 24% |
|
|
|
0.94-1.36) |
|
|||||||
|
|
p = 0.018 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
*Defined as MSSA positive blood |
|
|||||||
|
|
APACHE III score ≥34: |
|
|
|
cultures between 45 and 365 days |
|
|||||||
|
|
I: 56% |
|
|
|
after the first MSSA positive blood |
|
|||||||
|
|
C: 52% |
|
|
|
culture |
|
|||||||
|
|
p = 0.027 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
**Adjusted for modified APACHE III |
|
|||||||
|
|
Dialysis or end-stage renal disease: |
|
|
|
score, Charlson comorbidity index, |
|
|||||||
|
|
I: 15% |
|
|
|
hospital-onset infection |
|
|||||||
|
|
C: 8% |
|
|
|
|
|
|||||||
|
|
p < 0.001 |
|
|
|
Median length of stay (crude) |
|
|||||||
|
|
|
|
|
|
I: 12 days (IQR 8-18) |
|
|||||||
|
|
Diabetes: |
|
|
|
C: 13 days (IQR 9-22) |
|
|||||||
|
|
I: 40% |
|
|
|
P<0.001 |
|
|||||||
|
|
C: 33% |
|
|
|
|
|
|||||||
|
|
p < 0.001 |
|
|
|
Adverse drug events |
|
|||||||
|
|
|
|
|
|
Not reported |
|
|||||||
|
|
Endocarditis: |
|
|
|
|
|
|||||||
|
|
I: 4% |
|
|
|
|
|
|||||||
|
|
C: 7% |
|
|
|
|
|
|||||||
|
|
p=0.002 |
|
|
|
|
|
|||||||
|
|
Groups not comparable at baseline |
|
|
|
|
|
|||||||
|
PICO 3: flucloxacilline versus flucloxacilline + aminoglycoside |
|
||||||||||||
|
Korzeniow |
Type of study: |
Inclusion criteria: |
Intervention group: |
Control group: |
Length of follow-up: |
Death |
|
|
|||||
|
ski 1982 |
Randomized |
Clinical presentation of infective |
Nafcillin for 6 weeks |
Nafcillin for 6 weeks |
Unknown |
I: 6/43 |
|
|
|||||
|
|
controlled trial |
endocarditis, ≥2 positive blood cultures for |
+ gentamicin for 2 |
|
|
C: 2/35 |
|
||||||
|
|
|
S. aureus |
weeks |
Dosage: |
Loss-to-follow-up: |
|
|
||||||
|
|
Setting: |
|
|
9-12gr nafcillin per day |
n=4 in addict group |
Relapse* |
|
||||||
|
|
Hospital setting, |
Exclusion criteria: |
Dosage: |
administered |
|
I: 0/43 |
|
||||||
|
|
further details |
Prosthetic valves, clearly defined non |
9-12gr nafcillin per |
parenterally every 4h |
Incomplete outcome data: |
C: 2/35 |
|
||||||
|
|
unknown |
cardiac primary infections, history of severe |
day administered |
for 6 weeks |
n=4 in addict group |
|
|
||||||
|
|
|
immediate allergic reaction to penicillin or |
parenterally every |
|
|
*No definition provided |
|
||||||
|
|
Country: |
antimicrobial therapy >48h before |
4h for 6 weeks + |
Mean duration of |
|
|
|
||||||
|
|
USA? |
randomization |
gentamicin 3mg/kg |
nafcillin therapy: |
|
Drug-related renal dysfunction |
|
||||||
|
|
|
|
body weight per |
Addicts: 31 days (IQR |
|
I: 11/43 |
|
||||||
|
|
Source of |
N total at baseline: |
day, every 8h IV or |
21-42) |
|
C: 1/35 |
|
||||||
|
|
funding: |
Intervention: 43 |
IM for initial 2 |
Non-addicts: 44 days |
|
|
|
||||||
|
|
Unknown |
Control: 35 |
weeks |
(range 33-79) |
|
Neutropenia ≤1000/µL |
|
||||||
|
|
|
|
|
|
|
I: 4/43 |
|
||||||
|
|
|
N subgroups at baseline: |
Mean duration of |
|
|
C: 0/35 |
|
||||||
|
|
|
Addicts*: |
nafcillin therapy: |
|
|
|
|
||||||
|
|
|
Intervention: 24 |
Addicts: 30 days |
|
|
|
|
||||||
|
|
|
Control: 24 |
(range 8-65) |
|
|
|
|
||||||
|
|
|
|
Non-addicts: 44 |
|
|
|
|
||||||
|
|
|
Nonaddicts: |
days (range 33-79) |
|
|
|
|
||||||
|
|
|
Intervention: 19 |
|
|
|
|
|
||||||
|
|
|
Control: 11 |
Mean duration of |
|
|
|
|
||||||
|
|
|
|
gentamicin therapy: |
|
|
|
|
||||||
|
|
|
*defined as recent history or current |
Addicts: 17.9 days |
|
|
|
|
||||||
|
|
|
evidence of parenteral drug use |
(range 3-31) |
|
|
|
|
||||||
|
|
|
|
Non-addicts: 14 |
|
|
|
|
||||||
|
|
|
Important prognostic factors: |
(range 3-24) |
|
|
|
|
||||||
|
|
|
Age, in years (of men): |
|
|
|
|
|
||||||
|
|
|
Addicts: |
|
|
|
|
|
||||||
|
|
|
I: 30.6 (range 20-42) |
|
|
|
|
|
||||||
|
|
|
C: 30.1 (range 21-47) |
|
|
|
|
|
||||||
|
|
|
Nonaddicts: |
|
|
|
|
|
||||||
|
|
|
I: 60 (range 25-74) |
|
|
|
|
|
||||||
|
|
|
C: 38 (range 17-67) |
|
|
|
|
|
||||||
|
|
|
Valvular heart disease, n: |
|
|
|
|
|
||||||
|
|
|
Addicts: |
|
|
|
|
|
||||||
|
|
|
I: 13/24 |
|
|
|
|
|
||||||
|
|
|
C: 12/24 |
|
|
|
|
|
||||||
|
|
|
Nonaddicts: |
|
|
|
|
|
||||||
|
|
|
I: 8/19 |
|
|
|
|
|
||||||
|
|
|
C: 3/11 |
|
|
|
|
|
||||||
|
|
|
(Sub)Groups not comparable at baseline |
|
|
|
|
|
||||||
|
Ribera, 1996 |
Type of study: Randomized |
Inclusion criteria: Tricuspid endocarditis caused by S. aureus, |
Intervention group: Cloxacillin plus |
Control group: Cloxacillin alone |
Length of follow-up: 6 months |
Intention to treat: Death during treatment |
ITT data used for |
|
|||||
|
|
controlled trial |
IV drug use |
gentamicin |
|
|
I: 2/45 |
literature |
|
|||||
|
|
|
|
Dosage: |
Loss-to-follow-up: |
C: 1/45 |
review |
|
||||||
|
Setting: |
Exclusion criteria: |
Dosage: |
2 gr cloxacillin IV every |
Unknown |
|
|
|
||||||
|
An academic |
Allergy to study medication, MRSA, |
2 gr cloxacillin IV |
4h for 14 days |
|
Relapse* |
|
|
||||||
|
tertiary care |
confirmed or suspected left-sided |
every 4h for 14 days |
|
Incomplete outcome data: |
I: 1/45 |
|
|
||||||
|
hospital |
endocarditis by clinical examination or |
+ gentamicin IV 1 |
|
Unknown |
C: 0/45 |
|
|
||||||
|
between Marc h |
echocardiography, vegetation on pulmonic |
mg/kg body weight |
|
|
|
|
|
||||||
|
1998 and |
valves, systemic complications requiring |
every 8h for 7 days |
|
|
*defined as positive blood culture for |
|
|
||||||
|
February 1993 |
prolonged therapy (i.e. osteomyelitis), |
|
|
|
S. aureus with same phage group as |
|
|
||||||
|
|
antibiotic therapy >48h before |
|
|
|
original isolate |
|
|
||||||
|
Country: |
hospitalization |
|
|
|
|
|
|
||||||
|
Spain |
|
|
|
|
Discontinuation due to renal |
|
|
||||||
|
|
N total at baseline (intention to treat): |
|
|
|
insufficiency |
|
|
||||||
|
Source of |
Intervention: 45 |
|
|
|
I: 0/45 |
|
|
||||||
|
funding: |
Control: 45 |
|
|
|
C: 0/45 |
|
|
||||||
|
Unknown |
|
|
|
|
|
|
|
||||||
|
|
N total at baseline (per-protocol): |
|
|
|
Per-protocol analysis: |
|
|
||||||
|
|
Intervention: 36 |
|
|
|
Death during treatment |
|
|
||||||
|
|
Control: 38 |
|
|
|
I: 2/36 |
|
|
||||||
|
|
|
|
|
|
C: 1/38 |
|
|
||||||
|
|
Important prognostic factors: |
|
|
|
p>0.2 |
|
|
||||||
|
|
Age, y (±SD): |
|
|
|
|
|
|
||||||
|
|
I: 27.1 (±3.4) |
|
|
|
Relapse* |
|
|
||||||
|
|
C: 26.5 (±4) |
|
|
|
I: 1/36 |
|
|
||||||
|
|
|
|
|
|
C: 0/38 |
|
|
||||||
|
|
Male: |
|
|
|
|
|
|
||||||
|
|
I: 26/36 (72%) |
|
|
|
*defined as positive blood culture for |
|
|
||||||
|
|
C: 30/38 (79%) |
|
|
|
S. aureus with same phage group as |
|
|
||||||
|
|
|
|
|
|
original isolate |
|
|
||||||
|
|
Definitive endocarditis: |
|
|
|
|
|
|
||||||
|
|
I: 20/36 (56%) |
|
|
|
|
|
|
||||||
|
|
C: 19/38 (50%) |
|
|
|
|
|
|
||||||
|
|
Comparable groups at baseline |
|
|
|
|
|
|
||||||
|
Hughes, 2009 |
Type of study: Retrospective cohort study
Setting: University hospital in San Antonio from 1 January 2000 and 31 December 2007
Country: |
Inclusion criteria: ≥18 years, absolute neutrophil counts ≥1,000 cells/mm3, meeting modified Duke’s criteria for IE and bacteremia with MSSA, receival of oxacillin for treatment
Exclusion criteria: IE due to an unidentifiable/other organism than MSSA, IE treatment with drug other than oxacillin, incomplete medical records or incomplete follow-up (i.e. transfer to other hospital, switch from continuous to intermittent infusion or vice versa |
Intervention group: IV cloxacillin* with synergistic gentamicin use
Exact definition of ‘gentamicin use’ and dose of gentamicin unknown
*Either2 gr intermittent oxacillin IV over 30 |
Control group: IV cloxacillin* without synergistic gentamicin use
*Either2 gr intermittent oxacillin IV over 30 min every 4h, or 12gr continuous IV over 24h once daily |
Length of follow-up: 30 days
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
30-day mortality (crude) I: 7/63 (11%) C: 2/44 (5%) p=0.2
Length of hospital stay (crude)* I: 20 days C: 21 days p=0.8
*This was only reported for patients that did not die in-hospital |
Primary aim of study was to compare intermitte nt and continuous infusion of cloxacillin, the gentamicin analysis |
|
|||||
|
|
USA
Source of funding: None |
N total at baseline: Intervention: 63 Control: 44
Important prognostic factors: Not presented stratified per subgroup, for overall cohort:
Male, n: 77 (72%)
IV drug use, n: 86 (80%)
Unknown whether groups are comparable at baseline (probably not) |
min every 4h, or 12gr continuous IV over 24h once daily
Median duration of gentamicin therapy 4 days (range 1-14) |
|
|
Acute kidney injury (crude) I: 18% C: 7% p=0.1 |
was a subgroup analysis |
|
|||||
|
PICO 4: <2 weken versus ≥2 weken |
|
||||||||||||
|
Raad, 1992 |
Type of study: Retrospective + prospective cohort study
Setting: Two hospitals between 1984 and 1989
Country: USA
Source of funding: Unknown |
Inclusion criteria: Vascular catheter in place, S. aureus isolated from ≥1 blood culture, bloodstream infection clinically manifested by ≥1 of the following: fever, chills, or leucocytosis, no other source of bacteremia except catheter, S. aureus antibiogram from catheter tip/pus insertion site the same as S. aureus from blood
Exclusion criteria: Loss to follow-up within 3 months, burn victims, patients that developed early complications (i.e. endocarditis, abscess)
N total at baseline: <10 days: 18 10-14 days: 18 >14 days: 10 |
Intervention group:
Antibiotic type: Group 1: Vancomycin n=6, β- lactam n=8, β- lactam+ aminoglycoside n=4
Group 2: Vancomycin n=8, β- lactam n=7, β- lactam+ aminoglycoside n=3 |
Control group: >14 days of IV antibiotic duration
Antibiotic type: Vancomycin n=3, β- lactam n=4, β-lactam+ aminoglycoside n=3
‘Dosing regimen of all groups was comparable’ |
Length of follow-up: 6 months
Loss-to-follow-up: None (were excluded)
Incomplete outcome data: None |
Late infectious complications* (crude) <10 days: 3/18 10-14days: 0/18 ≥14 days: 0/10
<14 days: 3/36 ≥14 days: 0/10
*defined as relapsing septicaemia, further definition not given |
|
|
|||||
|
|
|
Important prognostic factors: Mean age, in years: <10 days: 39.5 10-14 days: 35.7 >14 days: 40.8 |
‘Dosing regimen of all groups was comparable’ |
|
|
|
|
||||||
|
|
|
Immunocompromised, n: <10 days: 2 10-14 days: 7 >14 days: 4 |
|
|
|
|
|
||||||
|
|
|
Unclear whether subgroups were comparable at baseline (probably not) |
|
|
|
|
|
|
|||||
|
Zeylemake r, 2001 |
Type of study: Retrospective cohort
Setting: University hospital between 1994 and 1996
Country: The Netherlands
Source of funding: Unknown |
Inclusion criteria: positive blood culture and catheter segment positive for S. aureus, adults (>18 years)
Exclusion criteria: clinical evidence of an infection elsewhere, clinical evidence of endocarditis at time of admission, incomplete data
N total at baseline: 0 days: 5 1-7 days: 4 7-14 days: 25 >14 days: 15
Important prognostic factors: Median age, in years (range): 0 days: 69 (62-90) 1-7 days: 41 (24-57) 7-14 days: 46 (21-85) >14 days: 57 (20-78) |
Intervention group:
Exact antibiotic type, dosage, proportion combination therapy and switch from IV to oral therapy of this subgroup unknown |
Control group: Antibiotic treatment >14 days antibiotic treatment
Exact antibiotic type, dosage, proportion combination therapy and switch from IV to oral therapy of this subgroup unknown |
Length of follow-up: 1 year
Loss-to-follow-up: None
Incomplete outcome data: None |
All-cause mortality (crude) 0 days: 2/5 (40%) 1-7 days: 2/4 (50%) 7-14 days: 10/25 (40%) >14 days: 5/15 (33%)
1-14 days: 12/29 (41%) >14 days: 5/15 (33%) |
|
|
|||||
|
|
|
No of underlying diseases per patient: 0 days: 1.2 1-7 days: 1.3 7-14 days: 1.5 >14 days: 1.4 |
|
|
|
|
|
||||||
|
|
|
Renal failure, n: O days: 1 (20%) 1-7 days: 1 (25%) 7-14 days: 9 (36%) >14 days: 8 (53%) |
|
|
|
|
|
||||||
|
|
|
Immunosuppression, n: O days: 1 (20%) 1-7 days: 2 (50%) 7-14 days: 6 (24%) >14 days: 6 (40%) |
|
|
|
|
|
||||||
|
|
|
Subgroups not comparable at baseline |
|
|
|
|
|
||||||
|
Jensen, 2002 |
Type of study: Prospective cohort |
Inclusion criteria: positive blood culture with S. aureus, treatment with dicloxacillin sodium |
Intervention group: <14 days dicloxacillin sodium |
Control group: ≥14 days dicloxacillin sodium |
Length of follow-up: 3 months |
3-month SAB-related mortality** (crude) I: 17/74 (23%) |
|
|
|||||
|
|
|
|
|
|
Loss-to-follow-up: |
C: 3/81 (4%) |
|
|
|||||
|
Setting: |
Exclusion criteria: positive blood cultures |
Exact dosage, |
Exact dosage, |
None |
p = 0.001 |
|
|||||||
|
4 community |
that were considered contamination, |
proportion |
proportion |
|
|
|
|||||||
|
hospitals in |
patients who died <3 days after positive |
combination |
combination therapy |
Incomplete outcome data: |
3-month SAB-related mortality** |
|
|||||||
|
Copenhagen County from |
blood culture, survival without treatment |
therapy and switch from IV to oral |
and switch from IV to oral therapy of this |
None |
Multivariable logistic regression: Duration of treatment ≥14 daysa, |
|
|||||||
|
May 1994 |
N total at baseline: |
therapy of this |
subgroup unknown |
|
adjusted* OR 0.84 (95% CI 0.76-0.94) |
|
|||||||
|
through April |
Intervention: 74 |
subgroup unknown |
|
|
|
|
|||||||
|
1996 |
Control: 81 |
|
|
|
aauthors write about a protective |
|
|||||||
|
|
|
|
|
|
effect of longer treatment in abstract, |
|
|||||||
|
Country: |
Important prognostic factors: |
|
|
|
so assume the adjusted OR accounts |
|
|||||||
|
Denmark |
Not presented stratified per group, only for |
|
|
|
for longer treatment and not for |
|
|||||||
|
|
overall cohort: |
|
|
|
treatment <14d (unclear in article) |
|
|||||||
|
Source of |
|
|
|
|
|
|
|||||||
|
funding: |
Median age, in years (range): 64 (0-94) |
|
|
|
*adjusted for focus removal, focus not |
|
|||||||
|
Research |
Diabetes type II, n: 23 (8%) |
|
|
|
eradicated, septic shock, total daily |
|
|||||||
|
fellowship from |
Hospital-acquired SAB, n: 147 (53%) |
|
|
|
dose dicloxacillin <4g, age ≥60, |
|
|||||||
|
Danish Research |
IV catheter as primary focus, n: 68 (24%) |
|
|
|
community-acquired, male, time from |
|
|||||||
|
Council, |
Endocarditis, n: 22 (8%) |
|
|
|
onset symptoms to positive culture |
|
|||||||
|
Copenhagen |
MRSA, n: 3 (1%) |
|
|
|
>3d, malignancy, secondary focus |
|
|||||||
|
|
Unclear whether subgroups were |
|
|
|
**defined as death <5wks after |
|
|||||||
|
|
comparable at baseline (probably not) |
|
|
|
positive blood culture or in connection |
|
|||||||
|
|
|
|
|
|
with recurrence of SAB |
|
|||||||
|
Fätkenheu er 2004 |
Type of study: Retrospective cohort study |
Inclusion criteria: Positive blood culture for S. aureus |
Intervention group: Antibiotic treatment <14 days |
Control group: Antibiotic treatment ≥ 14 days |
Length of follow-up: 1 year |
1-year mortality (crude) Antibiotic treatment >14 days, p >0.05* |
|
|
|||||
|
|
Setting: University clinic of Cologne between 1 January 1997 and 31 December 2000 |
Exclusion criteria: Missing data on antibiotics, death while receiving antibiotic treatment, referral to other hospital or discharge with ongoing antibiotic treatment
N total at baseline: 160 Intervention: 87 Control: 73 |
Type of antibiotics, switching and dosage of this particular group unknown |
Type of antibiotics, switching and dosage of this particular group unknown |
Loss-to-follow-up: n=11 (4.8%)
Incomplete outcome data: n=11 of overall cohort (4.8%) |
* No further details provided NB: number of patients in fig. 3 regarding survival curve and log-rank test are different from numbers in text? |
|
||||||
|
|
Country: Germany
Source of funding: Unknown |
Important prognostic factors: Not presented stratified per group, only for overall cohort:
Mean age, in years (±SD): 56.1 (±17.9) Cardiac disease, n: 70 (31%) Nosocomial acquisition, n: 177 (77%) Venous catheter as source, n: 80 (35%) MRSA, n: 13 (5.7%) Time to antibiotic therapy >48h from onset |
|
|
|
|
|
||||||
|
|
|
of SAB, n: 26 (12.3%)
Unclear whether groups were comparable at baseline (probably not) |
|
|
|
|
|
|
|||||
|
Khosrovan eh, 2005 |
Type of study: Prospective cohort study |
Inclusion criteria: Adult (≥18 years) inpatients with ≥1 positive blood culture for S. aureus and with soft tissue infection* |
Intervention group: Short course therapy*
*No definition provided
Type of antibiotics, switching and dosage of this particular group unknown (i.e. entire cohort was treated with among others IV vancomycin or beta-lactams, change to oral antibiotic and switching of antibiotic also occurred) |
Control group: Long course therapy*
*No definition provided
Type of antibiotics, switching and dosage of this particular group unknown (i.e. entire cohort was treated with among others IV vancomycin or beta- lactams, change to oral antibiotic and switching of antibiotic also occurred) |
Length of follow-up: 14-440 days (for n=25 survivors) |
Relapse* (crude) I: 0 C: 1/18 |
|
|
|||||
|
|
Setting: Teaching hospital in Detroit area from 1 January 2002 to 30 June 2003 |
*soft-tissue associated bacteremia was defined as: ≥1 positive blood cultures, systemic manifestations of infection, presence of focal signs or symptoms of soft tissue inflammation/necrosis and no other sources of bacteremia |
Loss-to-follow-up: n=5 (10%)
Incomplete outcome data: n=5 (10%) |
*no definition provided |
|
||||||||
|
|
Country: USA |
Exclusion criteria: ≤4 days of therapy |
|
|
|
||||||||
|
|
Source of funding: Medical Education Funds, St. John Hospital |
N total at baseline: Intervention: 23 Control: 18
Important prognostic factors: Not presented stratified per subgroup, only for overall cohort: |
|
|
|
||||||||
|
|
|
Median age, in years (range): 60 (21-103) Male: 56% Congestive heart failure: 60% Diabetes: 40% Oxacillin resistance: 52% |
|
|
|
||||||||
|
|
|
Unclear whether subgroups were comparable at baseline (probably not) |
|
|
|
||||||||
|
Thomas, 2005 |
Type of study: Prospective cohort
Setting: Six hospitals from July 1996 to December 1999
Country: New Zealand |
Inclusion criteria: adult patients (>16 years) with intravascular cannula-associated SAB* (CASAB)
*defined as S. aureus isolated from blood culture(s) and an intravascular cannula in situ, or had a cannula removed no more than 72h before positive blood culture, and who had no other source for their SAB
Exclusion criteria: death within 30 days of CASAB episode?, complicating focus of |
Intervention group: Intravenous antibiotic treatment ≤14 days
Exact antibiotic type, dosage, proportion combination therapy of this subgroup unknown |
Control group: Intravenous antibiotic treatment ≥15 days
Exact antibiotic type, dosage, proportion combination therapy of this subgroup unknown
(in overall cohort, ‘vancomycin, beta- |
Length of follow-up: 12 weeks
Loss-to-follow-up: 16/254 (6%)?
Incomplete outcome data: None |
Relapse* (crude) ≤14 days: 5/214 (2%) ≥15 days: 4/40 (10%) p = 0.037
*defined as relapse of deep-seated infection caused by the same strain of S. aureus (determined by PFGE) after apparently successful completion of initial treatment, excluding recurrent episodes of CASAB |
|
|
|||||
|
|
Source of funding: Financial support by Auckland Infectious Disease Education and Research Trust |
infection during initial treatment which resulted in prolongation of treatment
N total at baseline (episodes): 0-7 days: 37 8-14 days: 132 15-21 days: 55 >21 days: 30
Important prognostic factors: Not presented stratified per group, only for overall cohort: |
(in overall cohort, ‘vancomycin, beta- lactam, and other agents’ were used) |
lactam, and other agents’ were used) |
|
|
|
|
|||||
|
|
Median age, in years (range): 52 (17-93) |
|
|
|
|||||||||
|
|
Renal impairment, n: 118 (43%) Steroid treatment, n: 49 (18%) MRSA, n: 16 (5%) Endocarditis, n: 10 (3%) |
|
|
|
|||||||||
|
|
Subgroups not comparable at baseline (authors state that cancer diagnosis and bacteremia from peripheral venous cannula were sign. associated with shorter duration of treatment, but no details provided) |
|
|
|
|||||||||
|
Kreisel, 2006 |
Type of study: Retrospective cohort study
Setting: Veteran Health Care Center (VAMHCS) from 1995 to 2004 in Maryland
Country: USA
Source of funding: VA Research and Development Merit Award |
Inclusion criteria: ≥1 documented blood culture with S. aureus, survival of initial treatment course for that infection, patient at VAMHCS from 1995 to 2004
Exclusion criteria: S. aureus infection without bacteremia, not the first S. aureus infection
N total at baseline: Intervention: 231 Control: 110
Important prognostic factors: Not presented stratified per group, only for overall cohort:
Mean age, in years (±SD): 62.52 (±13.95) Male, n: 393 (>99%) MRSA, n: 171 (43%) Endocarditis, n: 56 (14%) |
Intervention group: Duration of effective antibiotic therapy* ≤14 days
*defined as an antibiotic to which the patient’s isolate was susceptible
Type of antibiotics, switching and dosage of this particular group unknown (i.e. entire cohort was treated with among others vancomycin or beta- lactams) |
Control group: Duration of effective antibiotic therapy* >14 days
*defined as an antibiotic to which the patient’s isolate was susceptible
Type of antibiotics, switching and dosage of this particular group unknown (i.e. entire cohort was treated with among others vancomycin or beta- lactams) |
Length of follow-up: Unclear
Loss-to-follow-up: None?
Incomplete outcome data: None |
Recurrence* Shorter duration of effective antibiotic therapy ≤14 days, adjusted** OR 0.58 (0.32-1.05)
**adjusted for HIV infection, diabetes and infection due to MRSA
*Recurrence was defined as a positive culture with the same susceptibility to methicillin from a normally sterile site after clearance of the initial infection
NB. Patients with endocarditis were excluded from regression |
|
|
|||||
|
|
|
Central-line associated source, n: 88 (49%) Ineffective empiric therapy, n: 94 (24%)
Unclear whether groups were comparable at baseline (probably not) |
|
|
|
|
|
|
|||||
|
Landman, 2011 |
Type of study: Retrospective cohort study |
Inclusion criteria: First isolation of S. aureus from >1 blood culture bottle, age ≥18 years |
Intervention group: <14 days of antibiotic treatment |
Control group: ≥14 days of antibiotic treatment |
Length of follow-up: 3 months |
Relapse* (crude) I: 3/26 (12%) C: 1/53 (2%) |
|
|
|||||
|
|
Setting: Hospital between November 2008 and October 2009
Country: The Netherlands
Source of funding: None |
Exclusion criteria: Death within 2 weeks
N total at baseline: Intervention: 26 Control: 53
Important prognostic factors: Not presented stratified per treatment duration subgroup, only for overall cohort:
Median age, in years (range): 72 (33-94) Male, n: 63 (68%) Diabetes, n: 16 (17%) Presence foreign body material, n: 26 (28%) Endocarditis, n: 7
Unclear whether subgroups were comparable at baseline (probably not) |
Median duration of treatment: 7 (range 2-12)
n=2 (8%) only treated with oral antibiotics, n=5 treated with clindamycin, n=1 treated with ciprofloxacin
Other details on types of antibiotics, switching and dosage of this particular subgroup unknown |
Median duration of treatment unknown
Type of antibiotics, switching and dosage of this particular subgroup unknown |
Loss-to-follow-up: None
Incomplete outcome data: None |
*defined as new positive culture for S. aureus after clinical improvement |
|
||||||
|
Chong, 2013 |
Type of study: Prospective cohort study
Setting: Hospital between August 2008 and September 2010
Country: Republic of Korea
Source of funding: Future-Based Technology Development Program (grant no. 2011- 0029936 and 2011-0029937) |
Inclusion criteria: Adult patients with uncomplicated S. aureus bacteremia*
*Defined as: 1. negative follow-up blood culture 2-4 days after bacteremia, 2. defervescence < 72h of therapy, and 3. no evidence of metastatic infection among patients with catheter-related bloodstream infection or with primary bacteremia without evidence of endocarditis on TTE or TEE
Exclusion criteria: Polymicrobial bacteremia, death before positive blood culture results were reported, clinically insignificant SAB, not admitted to hospital
N total at baseline: Intervention: 38 Control: 73
Important prognostic factors: Median age, in years (IQR): I: 63 (51-73) C: 59 (49-67)
Peripheral catheter-related infection, n: I: 17 (44.7%) C: 14 (19.2%) p<0.01
MRSA, n: I: 18 (47%) C: 35 (48%)
Subgroups not comparable at baseline |
Intervention group: <14 days of IV antibiotic duration
Antibiotic type: MSSA: Cefazolin n= 11 Nafcillin n=9 Vancomycin n=0
MRSA: Linezolid n=2 Teicoplanin n=0 Vancomycin n=16
Combination therapy: 1 (2.6%)
n=5 patients received oral antibiotics after parental antibiotics
All patients received standard doses |
Control group: ≥14 days of IV antibiotic duration
Antibiotic type: MSSA: Cefazolin n= 17 Nafcillin n=18 Vancomycin n=3
MRSA: Linezolid n=2 Teicoplanin n=4 Vancomycin n=29
Combination therapy: 4 (5.5%)
n=1 patients received oral antibiotics after parental antibiotics
All patients received standard doses |
Length of follow-up: 12 weeks
Loss-to-follow-up: None?
Incomplete outcome data: None? |
12-week relapse* (crude) I: 3/38 (7.9%) C: 0 p=0.04
*defined as recurrent S. aureus infection with same antibiogram and PFGE pattern after apparently successful completion of antistaphylococcal therapy for uncomplicated SAB
12-week all-cause mortality (crude) I: 7/38 (18.4%) C: 16/73 (21.9%) p = 0.67
Treatment failure*, Multivariable logistic regression: Duration of treatment, p =0.19
Adjusted for type of infection, Charlson comorbidity score and malignancy
*defined as any of the following: 1 relapse of S. aureus bacteremia or deep-seated infection or 2. death due to any cause after completion of antistaphylococcal therapy |
|
|
|||||
|
Kempley, 2015 |
Type of study: Retrospective cohort study
Setting: Two tertiary neonatal units between 2001 and 2010
Country: United Kingdom
Source of funding: None |
Inclusion criteria: Isolation of S. aureus from a blood culture, taken from a peripheral vein
Exclusion criteria: Death while still receiving therapy or discharge to other unit
N total at baseline: Duration 0-13 days: 9 Duration 14-27 days: 51 Duration ≥28 days: 19
Important prognostic factors: Not presented stratified per subgroup, only for overall cohort: Gestational age at birth, in weeks (range): 27 (23-41)
Median birth weight, in grams (range): 846 (434-3840)
Postnatal age, in days (range): 16 (0-116)
Central line when S. aureus isolated, n: 52 (58%)
MRSA,n: 6 (7%)
Unclear whether subgroups were comparable at baseline (probably not) |
Intervention group: <14 days of antibiotic duration
Type of antibiotics, switching and dosage of this particular subgroup unknown (i.e. entire cohort was treated with among others IV vancomycin or beta-lactams, change to oral antibiotic and switching of antibiotic also occurred) |
Control group:
Type of antibiotics, switching and dosage of this particular subgroup unknown (i.e. entire cohort was treated with among others IV vancomycin or beta-lactams, change to oral antibiotic and switching of antibiotic also occurred) |
Length of follow-up: Unclear
Loss-to-follow-up: n=2?
Incomplete outcome data: n=2? |
Mortality (crude) I: 0 C: 0
Recurrent S. aureus bacteraemia* (crude) I: 0 C: 0
*defined as any clinical illness with isolation of S. aureus in blood after stopping appropriate antibiotic therapy, recorded in the hospital or laboratory record during the first year of life |
|
|
|||||
Risk of bias assessment for observational intervention studies (per PICO op jaar van publicatie)
|
Study reference |
Bias due to a non- representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
PICO 1: flucloxacilline versus vancomycine |
||||
|
Chambers 1988 |
Unlikely |
Likely
Length of follow-up seems to differ between treatment groups. |
Likely
Definition of relapse is unclear |
Likely
No adequate adjustment for confounders |
|
Gentry 1997 |
Unlikely |
Unclear
The loss to follow-up was not reported. |
Unlikely
Hard outcome (death) |
Likely
No adequate adjustment for confounders |
|
González 1999 |
Unlikely |
Unclear
The loss to follow-up was not reported. |
Unlikely
Hard outcome (death) |
Likely
No adequate adjustment for confounders |
|
Chang 2003 |
Unlikely |
Unclear
The loss to follow-up was not reported. |
Unlikely
Semi-hard outcome (relapse) |
Likely
No adequate adjustment for confounders |
|
Siegman-Igra 2005 |
Unlikely |
Unclear
The loss to follow-up was not reported. |
Unlikely
Semi-hard outcome (relapse) |
Likely
No adequate adjustment for confounders |
|
PICO 2: flucloxacilline versus eerste generatie cefalosporine |
||||
|
Lee, 2011 |
Unlikely |
Unclear
The loss to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Unlikely
(Although there is always residual confounding) |
|
Paul, 2011 |
Unlikely |
Unclear |
Unlikely |
Unclear |
|
|
|
The loss to follow-up was not reported |
Hard outcome (mortality) |
Baseline characteristics not reported for different groups |
|
Renaud, 2011 |
Likely
Sampling of historic controls |
Unclear
The loss to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Likely
No adjustment for confounders |
|
Li, 2014 |
Unlikely |
Unclear
The loss to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Likely
No adequate adjustment for confounders |
|
Bai, 2015 |
Unlikely |
Unclear
The loss-to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Unlikely
(Although there is always residual confounding) |
|
McDanel, 2017 |
Unlikely |
Unclear
The loss-to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Unlikely
(Although there is always residual confounding) |
|
PICO 3: flucloxacilline versus flucloxacilline + aminoglycoside |
||||
|
Hughes, 2009 |
Likely
Limited representability: 80% IV drug users |
Unclear
The loss to follow-up was not reported |
Unlikely
Hard outcome (mortality), might be different for other outcomes |
Likely
No adjustment for confounders |
|
PICO 4: <2 weken versus ≥2 weken |
||||
|
Fätkenheuer 2004 |
Unlikely |
Unlikely
Loss to follow-up 4.8% |
Unlikely
Hard outcome (mortality) |
Likely
No adjustment for confounders |
|
Kreisel, 2006 |
Unlikely |
Unclear
Unclear whether there were differences in follow-up time between patients |
Unlikely
Well-defined outcome (recurrence) |
Likely
Inadequate adjustment for important confounders |
|
Khosrovaneh, 2005 |
Unlikely |
Likely
Loss to follow-up 10% |
Likely
Outcome (relapse) not defined |
Likely
No adjustment for confounders |
|
Landman, 2011 |
Unlikely |
Unlikely |
Unlikely
Well-defined outcome (recurrence) |
Likely
No adjustment for confounders |
|
Kempley, 2015 |
Unlikely |
Unclear
Unclear whether there were differences in follow-up time between patients |
Unlikely
Hard outcome (mortality) and well- defined outcome (recurrence) |
Not applicable
No events |
|
Raad, 1992 |
Unlikely |
Unclear
Subjects that were loss to follow-up were excluded |
Unclear
Unclear definition of outcome |
Likely
No adjustment for confounders |
|
Chong, 2013 |
Unlikely |
Unlikely |
Unlikely
Hard outcome (mortality) and well- defined outcome (recurrence) |
Likely
Adjustment for few confounder in multivariable regression |
|
Jensen, 2002 |
Unlikely |
Unlikely |
Unlikely
Well-defined outcome (recurrence) |
Unclear
Unclear multivariable regression analysis |
|
Zeylemaker, 2001 |
Unlikely |
Unclear
Subjects that were loss to follow-up were excluded |
Unlikely
Hard outcome (mortality) |
Likely
No adjustment for confounders |
|
Thomas, 2005 |
Unlikely |
Unclear
Unclear whether there were differences in follow-up time between patients |
Unlikely
Well-defined outcome (recurrence) |
Likely
No adjustment for confounders |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Risk of bias assessment for randomised intervention studies (per PICO op jaar van publicatie)
|
Study |
Method of |
Bias due to |
Bias due to |
Bias due to inadequate |
Bias due to inadequate |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/ unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclea r) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclea r) |
|
reference |
randomisatio n1 |
inadequate concealment of allocation?2 |
inadequate blinding of participants to |
blinding of care providers to treatment allocation?3 |
blinding of outcome assessors to treatment allocation?3 |
|||
|
|
|
|
treatment allocation?3 |
|
(unlikely/likely/unclear) |
|||
|
|
|
(unlikely/likely/un |
(unlikely/likely/un |
|
|
|||
|
|
|
clear) |
clear) |
(unlikely/likely/unclear) |
|
|||
|
PICO 1: flucloxacilline versus vancomycine |
||||||||
|
Fortún 2001 |
Not described |
Unclear |
Unlikely |
Unclear |
Unlikely |
Unlikely |
Unclear |
Likely |
|
|
|
Randomisation process is not described |
Detection bias unlikely |
Unclear whether treatment allocation could have influenced clinical care process |
Semi-hard outcome (relapse) |
Well-predefined outcome |
The loss to follow-up was not reported |
3 randomized patients were not evaluated for efficacy |
|
PICO 3: flucloxacilline versus flucloxacilline + aminoglycoside |
||||||||
|
Korzeniows ki 1982 |
Assignment according to table of random numbers |
Likely
Incomparable groups at baseline |
Unlikely |
Unclear
Unclear whether treatment allocation could have influenced clinical care process |
Unlikely
Hard outcome (mortality and relapse) |
Unlikely
All outcomes reported |
Unclear
Seems to be no selective follow-up |
Unlikely
All randomized patients are reported |
|
Ribera 1996 |
Assignment according to sealed envelopes (blocks of 10) |
Unlikely |
Unlikely |
Unclear
Unclear whether treatment allocation could have influenced clinical care process |
Unlikely
Hard outcome (mortality and relapse) |
Unlikely
All outcomes reported |
Unclear
Loss to follow-up not described |
Unlikely
Both ITT and per- protocol analysis are reported |
- Randomisation: generation of allocation sequences have to be unpredictable.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non- surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias).
- Results of all predefined outcome measures should be reported
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-12-2019
Beoordeeld op geldigheid : 27-11-2019
Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een up-to-date multidisciplinaire evidence-based richtlijn voor diagnostiek, behandeling en follow-up van patiënten met een S. aureus bacteriëmie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met S. aureus bacteriëmie, zoals artsen-microbioloog, internisten, cardiologen, kinderartsen, chirurgen, nucleair geneeskundigen, ziekenhuisapothekers en verpleegkundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met S. aureus bacteriëmie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. K. Verduin (voorzitter), arts-microbioloog, PAMM, Veldhoven; NVMM
- Dr. H. Ammerlaan, internist-infectioloog, Catharina ziekenhuis, Eindhoven; NIV
- Drs. G. Blaauw, arts-microbioloog, Gelre Ziekenhuizen, Apeldoorn; NVMM
- Dr. C.P. Bleeker-Rovers, internist-infectioloog, Radboud universitair medisch centrum, Nijmegen; NIV
- Drs. R.J.H.M. van Drie-Pierik, ziekenhuisapotheker, Medisch Spectrum Twente, Enschede; NVZA
- Dr. M. Ekkelenkamp, arts-microbioloog, Universitair Medisch Centrum, Utrecht; NVMM
- Dr. A.W.J.M. Glaudemans, nucleair geneeskundige, Universitair Medisch Centrum Groningen; NVNG
- Drs. D. van Hout, arts-onderzoeker, Universitair Medisch Centrum Utrecht; NVMM
- Dr. Y.G.T. Loeffen, kinderarts, Wilhelmina Kinderziekenhuis/Universitair Medisch Centrum Utrecht; NVK
- Dr. J.T.M. van der Meer, internist-infectioloog, Academisch Medisch Centrum, Amsterdam; NIV
- Drs. C.S. Rijs-Bol, chirurg-intensivist, Ziekenhuis St Jansdal, Harderwijk; NVVH
- Dr. W. Tanis, cardioloog, HagaZiekenhuis, Den Haag; NVVC
Met ondersteuning van:
- Mw. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie- management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Kees Verduin |
Arts-microbioloog; Medisch manager LMI, Amphia ziekenhuis Breda |
Lid SWAB-bestuur, onbetaald; lid sectie bacteriologie en mycologie SKML, onbetaald; lid werkgroep antimicrobial stewardship (SWAB/SKMS): opzetten antimicrobial stewardship in NL en opzetten Stewardship monitor (op uurbasis declaratie en reiskosten) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Gert Blaauw |
Arts-microbioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Miguel Ekkelenkamp |
Arts-microbioloog |
Schrijver, betaald |
Adviescommissie intraveneus fosfomycine, voor Nordic Pharma. |
geen |
geen |
Onderzoek in kader van Innovative Medicines Initiative van de Europese Commissie. Dit wordt mede-gefinancierd door industriële partners (EFPIA). Dit betreft voor het project "COMBACTE": klinisch onderzoek naar antibiotica en antibacteriële monoclonale antistoffen, o.a. met de bedrijven Astra Zeneca, MedImmune, The Medicines Company en DaVolterra. Voor het project "iABC": pre-klinische ontwikkeling van een inhalatie- antibioticum, met de bedrijven Novartis en Basilea. |
geen |
geen |
|
Regine van Drie-Pierik |
Ziekenhuisapotheker, lid A-team |
Lid van de Santeon farma inkoopgroep. De inkoop groep geeft uitvoering aan het vastgestelde beleid door de antibiotica commissie. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Heidi Ammerlaan |
Internist-infectioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Chantal Bleeker- Rovers |
lnternist- infectioloog/acute geneeskunde; |
geen |
geen |
geen |
Lid Raad van Advies Q-uestion, patiëntenvereniging voor mensen met Q-koorts, maar dit heeft geen enkele relatie met S.aureus bacteriëmie. |
geen |
geen |
geen |
|
Jan van der Meer |
Internist-infectioloog |
Lid VIZ bestuur, onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Wilco Tanis |
Cardioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Andor Glaudemans |
Nucleair geneeskundige |
Chair Infection and Inflammation Committee European Association of Nuclear Medicine (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Carianne Rijs-Bol |
Chirurg-intensivist |
nvt |
geen |
geen |
geen |
geen |
geen |
geen |
|
Yvette Loeffen |
Kinderarts |
geen |
Geen |
geen |
geen |
geen |
geen |
geen |
|
Denise van Hout |
Arts-onderzoeker infectieziekten epidemiologie Julius Centrum, UMCU |
geen |
Geen |
geen |
geen |
Deelname onderzoek gefinancierd vanuit de Innovative Medicines Joint Undertaking, grant agreement no. 115523/115620/115737. Deze grants zijn samengesteld uit financiële contributie van de European Union Seventh Framework Program en van EFPIA (AstraZeneca/Medimmune in dit geval). |
Geen |
geen |
Inbreng patiëntenperspectief
Tijdens de voorbereidende fase zijn er knelpunten aangedragen door een vertegenwoordiger van Stichting FCIC, Sepsis en daarna, via een invitational conference. Een [verslag hiervan] kunt u vinden bij de aanverwante producten van deze module. Tijdens de commentaarfase is beroep gedaan op Stichting FCIC, Sepsis en daarna en de Vereniging voor Patiënten met Parenterale Thuisvoeding.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het [implementatieplan] bij de aanverwante producten).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen van het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit (www.kwaliteitskoepel.nl). Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.cvz.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de Inspectie Gezondheidszorg en Jeugd (IGJ); het Ministerie van Volksgezondheid, Welzijn en Sport (VWS); Stichting FCIC, Sepsis en daarna; en experts die geen zitting hadden in de werkgroep via een invitational conference. Een [verslag hiervan] kunt u vinden bij de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag de relevante uitkomstmaten voor de patiënt, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht op de website van het RIVM en in de databases van National guideline clearinghouse, Guidelines International Network, WHO, Medline en Embase. Verder is naar systematische reviews gezocht in de databases van Medline, Embase en Cochrane library. Zie de zoekstrategie. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
|
|
Inconsistentie |
|
|
|
Indirect bewijs |
|
|
|
Onnauwkeurigheid |
|
|
|
Publicatiebias |
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
|
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg bacteriemie’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om de toepassing van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Beersen et al. (2007) en De Koning et al. (2007).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de [Kennislacunes].
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Zorginstituut Nederland; Inspectie voor de Gezondheidszorg (IGJ); het Ministerie van Volksgezondheid, Welzijn en Sport (VWS); Zorgverzekeraars Nederland (ZN); Stichting FCIC, Sepsis en daarna; Nederlandse Federatie van Universitair Medische Centra (NFU); Nederlandse Vereniging van Ziekenhuizen (NVZ); Samenwerkende topklinische ziekenhuizen (STZ); Vereniging voor Patiënten met Parenterale Thuisvoeding; Verpleegkundigen & Verzorgenden Nederland V&VN en experts die geen zitting hadden in de werkgroep. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
Beersen, A. N., Kallewaard, M., Croonenburg, J.J., Everdingen van, J.J.E. en Barneveld van, T.A., Handleiding indicatoren- ontwikkeling. 2007.
Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008).
GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
De Koning, J., Smulders, A. en Klazinga, N. Appraisal of Indicators through Research and Evaluation (AIRE). 2007.
Zoekverantwoording
Eerste 3 PICO’s (welk antibioticum?)
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) <1946 to 2016 July> |
5 2 or 3 or 4 (3)
15 5 or 11 or 13 or 14 (8)
25 22 or 23 or 24 (260144)
35 or/31-34 (12851)
|
287 |
|
|
47 |
(pooled adj3 analy*).kf. (105) |
|
|
48 |
"cochrane$".fc_jour. (16069) |
||
|
49 |
or/37-48 (227207) |
||
|
50 |
"sensitief filter voor RCT's van Cochrane".ti. (0) |
||
|
51 |
randomized controlled trial.pt. (425167) |
||
|
52 |
controlled clinical trial.pt. (91285) |
||
|
53 |
(randomized or randomised).ab. (437555) |
||
|
54 |
placebo.ab. (176639) |
||
|
55 |
drug therapy.fs. (1887319) |
||
|
56 |
randomly.ab. (259968) |
||
|
57 |
trial.ab. (378286) |
||
|
58 |
groups.ab. (1618174) |
||
|
59 |
or/51-58 (3866603) |
||
|
60 |
59 not (exp animals/ not humans/) (3336316) |
||
|
61 |
"filter observational studies Medline".ti. (0) |
||
|
62 |
epidemiologic studies/ (7209) |
||
|
63 |
exp case-control studies/ (801549) |
||
|
64 |
exp cohort studies/ (1571170) |
||
|
65 |
cross-sectional studies/ (222396) |
||
|
66 |
(case adj3 control).af. (260045) |
||
|
67 |
(cohort adj5 (study or studies or analy$)).af. (301189) |
||
|
68 |
(follow-up adj5 (study or studies)).af. (593556) |
||
|
69 |
(longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (1729184) |
||
|
70 |
(observational adj5 (study or studies)).af. (100081) |
||
|
71 |
or/62-70 (2440600) |
||
|
72 |
"filter obs Medline".ti. (0) |
||
|
73 |
Comparative Study/ (1757759) |
||
|
74 |
20 and 21 and 30 and 35 (183) |
||
|
75 |
74 and 49 (1) |
||
|
76 |
74 and (49 or 60) (121)=vr1 systrev rct |
||
|
77 |
(74 and 71) not (49 or 60) (13) vr1 observat comp |
||
|
78 |
(74 and 73) not (49 or 60 or 71) (9) |
||
|
79 |
20 and 21 and 25 and 30 (1650) |
||
|
80 |
*Vancomycin/ (6411) |
||
|
81 |
*Vancomycin/tu (1461) |
||
|
82 |
79 and 81 (202) |
||
|
83 |
82 and (49 or 60 or 71 or 73) (193) |
||
|
84 |
83 not (74 or 76 or 77 or 78) (176) vr1 vanco therapeutic use |
||
|
85 |
Daptomycin/ (1541) |
||
|
86 |
(daptomycin or d?ptomyc*).tw. (2286) |
||
|
87 |
(daptomycin or d?ptomyc*).kf. (192) |
||
|
88 |
(daptomycin or d?ptomyc*).rn. (1541) |
||
|
89 |
or/85-88 (2452) |
||
|
90 |
Linezolid/ (2293) |
||
|
91 |
(zyvox or linezolid?).tw. (4293) |
||
|
92 |
(zyvox or linezolid?).kf. (227) |
||
|
93 |
(zyvox or linezolid?).rn. (2293) |
||
|
94 |
cubicin*.tw. (68) |
||
|
95 |
cubicin*.rn. (0) |
||
|
96 |
or/90-95 (4587) |
||
|
97 |
89 or 96 (6231) |
||
|
98 |
20 and 21 and 30 and 97 (451) |
||
|
99 |
98 and 49 (21) vr 2 systrev |
||
|
100 |
98 and 25 (397) |
||
|
101 |
(98 and 60) not 49 (291) vr2 rct |
||
|
102 |
100 and 101 (269) |
||
|
103 |
101 not 102 (22) |
||
|
104 |
(100 and (71 or 73)) not (49 or 60) (25) vr2 observat comp |
||
|
|
105 aminoglycosides/ or gentamicins/ (25794) |
|
|
|
106 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).tw. (35504) |
|||
|
107 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).kf. (657) |
|||
|
108 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).rn. (25806) |
|||
|
109 or/105-108 (44431) |
|||
|
110 20 and 21 and 35 and 109 (136) |
|||
|
111 exp *staphylococcal infections/dt (5924) |
|||
|
112 20 and 21 and (35 or 111) and 109 (190) |
|||
|
113 112 and (49 or 60) (128) vr3 systrev rct |
|||
|
114 (112 and (71 or 73)) not (49 or 60) (20) vr3 observat comp |
|||
|
115 cephalosporins/ or cefazolin/ (19726) |
|||
|
116 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).tw. |
|||
|
(22603) |
|||
|
117 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).kf. |
|||
|
(389) |
|||
|
118 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).rn. |
|||
|
(20034) |
|||
|
119 or/115-118 (32903) |
|||
|
120 20 and 21 and 35 and 119 (208) |
|||
|
121 20 and 21 and 119 (1295) |
|||
|
122 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).ti. |
|||
|
(6647) |
|||
|
123 20 and 21 and (122 or 117 or 115) and 49 (5) vr4 systrev |
|||
|
124 120 and (49 or 60) (141) |
|||
|
125 124 and 25 (86) vr 4 rct |
|||
|
126 (120 and 25 and (71 or 73)) not (49 or 60) (15) vr4 observat comp |
|||
|
Embase <1974 to 2016 July> |
5 2 or 3 or 4 (2)
15 5 or 11 or 13 or 14 (6)
27 24 or 25 or 26 (75058) |
227 |
|
|
|
28 flucloxacillin/ (7211) |
|
|
|
29 (Flucloxacillin or floxacillin or oxacillin or nafcillin or cloxacillin or fluorochloroxacillin).tw. |
|||
|
(7992) |
|||
|
30 (Flucloxacillin or floxacillin or oxacillin or nafcillin or cloxacillin or fluorochloroxacillin).kw. |
|||
|
(404) |
|||
|
31 (cloxacillin or cefazolin).tw. (6413) |
|||
|
32 (cloxacillin or cefazolin).kw. (384) |
|||
|
33 28 or 29 or 30 or 31 or 32 (18506) |
|||
|
34 (dutch or german or french or english).la. (27194985) |
|||
|
35 "filter systematic reviews & meta-analyses Embase".ti. (0) |
|||
|
36 meta analysis/ (112252) |
|||
|
37 "systematic review"/ (110679) |
|||
|
38 (meta-analy$ or metaanaly$).tw. (124789) |
|||
|
39 (systematic$ adj4 (review$ or overview$)).tw. (116873) |
|||
|
40 (quantitativ$ adj5 (review? or overview?)).tw. (3395) |
|||
|
41 (methodologic adj5 (overview? or review?)).tw. (312) |
|||
|
42 (review$ adj3 (database? or medline or embase or cinahl)).tw. (17086) |
|||
|
43 (pooled adj3 analy$).tw. (17405) |
|||
|
44 (extensive adj3 review$ adj3 literature).tw. (2674) |
|||
|
45 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1133498) |
|||
|
46 review.pt. (2185723) |
|||
|
47 45 and 46 (102819) |
|||
|
48 (systematic$ adj4 (review$ or overview$)).kw. (13439) |
|||
|
49 (quantitativ$ adj5 (review? or overview?)).kw. (43) |
|||
|
50 (pooled adj3 analy$).kw. (314) |
|||
|
51 or/36-44,47-50 (336627) |
|||
|
52 "filter rct embase".ti. (0) |
|||
|
53 controlled clinical trial/ or randomized controlled trial/ (554967) |
|||
|
54 randomization/ (71217) |
|||
|
55 Major Clinical Study/ (2515652) |
|||
|
56 random$.tw. (1107264) |
|||
|
57 Double Blind Procedure/ (132538) |
|||
|
58 or/53-57 (3561173) |
|||
|
59 "einde filter rct embase".ti. (0) |
|||
|
60 daptomycin/ (6389) |
|||
|
61 (daptomycin or d?ptomyc*).tw. (3126) |
|||
|
62 (daptomycin or d?ptomyc*).kw. (739) |
|||
|
63 linezolid/ (14669) |
|||
|
64 (zyvox or linezolid?).tw. (6443) |
|||
|
65 (zyvox or linezolid?).kw. (1239) |
|||
|
66 60 or 61 or 62 or 63 or 64 or 65 (18263) |
|||
|
67 cubicin*.tw. (438) |
|||
|
68 "filter observationele studies embase".ti. (0) |
|||
|
69 Clinical study/ (123639) |
|||
|
70 Case control study/ (108040) |
|||
|
71 Family study/ (11542) |
|||
|
72 Longitudinal study/ (89927) |
|||
|
73 Retrospective study/ (478512) |
|||
|
74 Prospective study/ (343345) |
|||
|
75 Randomized controlled trials/ (103534) |
|||
|
76 74 not 75 (340363) |
|||
|
77 Cohort analysis/ (251247) |
|||
|
78 (Cohort adj (study or studies)).tw. (166042) |
|||
|
79 (Case control adj (study or studies)).tw. (95877) |
|||
|
80 (follow up adj (study or studies)).tw. (52840) |
|||
|
81 (observational adj (study or studies)).tw. (93855) |
|||
|
82 (epidemiologic$ adj (study or studies)).tw. (87000) |
|||
|
83 (cross sectional adj (study or studies)).tw. (122470) |
|||
|
|
84 or/69-74,76-83 (1609392)
91 23 and 34 and 90 (11501) 92 91 and 27 and 33 (407)
98 97 and 90 (28) vr1 focus vanco drug comparison 99 66 or 67 (18264) 100 90 and 27 and 99 and (51 or 58) (1478)
106 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).tw. (45307) 107 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).kw. (4608) 108 103 or 104 or 106 or 107 (83789) 109 23 and 34 and 33 and 108 (327)
116 or/112-115 (191951) 117 23 and 34 and 90 and 33 and 116 (363)
systrev alle vragen |
|
|
|
Cochrane |
ID Search #1 MeSH descriptor: [Bacteremia] explode all trees #2 bacter?emi*:ti,ab #3 staphylococ*:ti,ab #4 MeSH descriptor: [Staphylococcal Infections] explode all trees #5 #1 or #2 #6 #3 or #4 #7 #5 and #6 #8 MeSH descriptor: [Vancomycin] explode all trees #9 Vancomycin*:ti,ab #10 #8 or #9 #11 MeSH descriptor: [Floxacillin] explode all trees #12 (Flucloxacillin or floxacillin or cefazolin or oxacillin or nafcillin or cloxacillin or fluorochloroxacillin):ti,ab #13 #5 and #10 and (#11 or #12) #14 (#5 or #6) and #10 and (#11 or #12) #15 MeSH descriptor: [Daptomycin] explode all trees #16 (daptomycin or deptomyc*):ti,ab |
35 |
|
|
|
#17 MeSH descriptor: [Linezolid] explode all trees #18 (zyvox or linezolid* or cubicin*):ti,ab #19 #15 or #16 or #17 or #18 #20 (#5 or #6) and #10 and #19 #21 MeSH descriptor: [Aminoglycosides] this term only #22 MeSH descriptor: [Gentamicins] explode all trees #23 (aminoglycoside* or gentamycin* or gentamicin* or garamycin* or myticin or genticin*):ti,ab #24 #21 or #22 or #23 #25 (#5 or #6) and (#11 or #12) and #24 #26 MeSH descriptor: [Cephalosporins] this term only #27 MeSH descriptor: [Cefazolin] explode all trees #28 (cephalospor* or cephazoli* or cefazoli* or cefamedin* or ancef or gramaxin or kefzol or totacef):ti,ab #29 (#5 or #6) and (#11 or #12) and (#26 or #27 or #28) |
|
|
PICO 4 (duur behandeling)
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) <1946 to 2017 June> |
33 ad.fs. (1289992) 34 or/2-9 (273447)
38 34 and 37 (60687)
44 36 or 39 (441332) 45 38 and 43 and 44 (4530) 46 (schedul* or week? or month? or course* or episode?).ti. (177827) 47 42 or 46 (180431) 48 45 and 47 (168) |
111 |
|
|
49 time/ or time factors/ (1128884) |
|
|
50 (during or duration or lasting or tim* or week? or month?).tw. (7110709) |
||
|
51 (during or duration or lasting or tim* or week? or month?).kf. (32755) |
||
|
52 49 or 50 or 51 (7631172) |
||
|
53 38 and 52 and 44 (7107) |
||
|
54 "filter systematic reviews".ti. (0) |
||
|
55 meta analysis.pt. (81223) |
||
|
56 (meta-anal$ or metaanal$).af. (144262) |
||
|
57 (quantitativ$ adj10 (review$ or overview$)).tw. (6872) |
||
|
58 (systematic$ adj10 (review$ or overview$)).tw. (119515) |
||
|
59 (methodologic$ adj10 (review$ or overview$)).tw. (9147) |
||
|
60 (quantitativ$ adj10 (review$ or overview$)).kf. (32) |
||
|
61 (systematic$ adj10 (review$ or overview$)).kf. (8256) |
||
|
62 (methodologic$ adj10 (review$ or overview$)).kf. (36) |
||
|
63 medline.tw. and review.pt. (64575) |
||
|
64 (pooled adj3 analy*).tw. (14102) |
||
|
65 (pooled adj3 analy*).kf. (129) |
||
|
66 "cochrane$".fc_jour. (13476) |
||
|
67 or/55-66 (258473) SR |
||
|
68 53 and 67 (103) |
||
|
69 from 68 keep 19 (1) |
||
|
70 from 68 keep 30 (1) |
||
|
71 from 68 keep 64 (1) |
||
|
72 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or |
||
|
week? or month?).tw. (7118875) |
||
|
73 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or |
||
|
week? or month?).kf. (32770) |
||
|
74 49 or 72 or 73 (7638433) |
||
|
75 tu.fs. (2052632) |
||
|
76 exp Anti-Bacterial Agents/tu (228516) |
||
|
77 32 or 75 or 76 (2117280) |
||
|
78 staphylococcus/ or exp staphylococcus aureus/ (88474) |
||
|
79 34 or 78 (287841) |
||
|
80 74 and 77 and 79 (24477) |
||
|
81 67 and 80 (382) |
||
|
82 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or |
||
|
week? or month?).ti. (944937) |
||
|
83 49 or 73 or 82 (1956624) |
||
|
84 81 and 83 (51) |
||
|
85 Comparative Study/ (1814105) |
||
|
86 81 and 85 (34) |
||
|
87 uncomplicat*.tw. (31913) |
||
|
88 80 and 87 (340) |
||
|
89 uncomplicat*.kf. (92) |
||
|
90 87 or 89 (31931) |
||
|
91 79 and 90 (1263) |
||
|
92 83 and 91 (107) |
||
|
93 74 and 77 and 91 (340) |
||
|
94 67 and 93 (17) |
||
|
95 (dutch or german or french or english).la. (24872662) |
||
|
96 exp treatment outcome/ (848390) |
||
|
97 mo.fs. (505546) |
||
|
98 ae.fs. (1575938) |
||
|
99 exp Mortality/ (337980) |
||
|
100 (mortality or (adverse adj effect*)).tw. (738602) |
||
|
101 outcom*.tw. (1326565) |
||
|
102 or/96-101 (3904212) |
||
|
103 92 and 95 and 102 (52) |
||
|
|
104 from 103 keep 1-52 (52) |
|
|
105 ((optimal or short* or extend* or month* or week? or day?) adj10 course?).tw. (65275) |
||
|
106 74 or 105 (7649412) |
||
|
107 77 and 79 and 106 (24764) |
||
|
108 95 and 102 and 107 (11323) talen + outcome +antibiotica |
||
|
109 67 and 108 (303) talen + outcome +antibiotic + SR |
||
|
110 90 and 109 (13) |
||
|
111 37 and 109 (209) |
||
|
112 44 and 111 (55) talen + outcome +antibiotic + SR + intravenous behandeling |
||
|
113 "sensitief filter voor RCT's van Cochrane".ti. (0) |
||
|
114 randomized controlled trial.pt. (465276) |
||
|
115 controlled clinical trial.pt. (94192) |
||
|
116 (randomized or randomised).ab. (485776) |
||
|
117 placebo.ab. (190128) |
||
|
118 drug therapy.fs. (2003737) |
||
|
119 randomly.ab. (282522) |
||
|
120 trial.ab. (426679) |
||
|
121 groups.ab. (1739635) |
||
|
122 or/114-121 (4140529) |
||
|
123 122 not (exp animals/ not humans/) (3582112) |
||
|
124 79 and 77 and 74 and 44 and 67 (70) |
||
|
125 79 and 77 and 74 and 44 and 67 and 95 (69) |
||
|
126 79 and 77 and 74 and 44 and 67 and 95 and 102 (54) |
||
|
127 adolescent, hospitalized/ or child, hospitalized/ or inpatients/ (23842) |
||
|
128 hospital*.tw,kf. (1078650) |
||
|
129 127 or 128 (1087891) |
||
|
130 (79 and 77 and 74 and 44 and 123 and 95 and 102) not 67 (1607) |
||
|
131 130 and 102 and 129 (593) |
||
|
132 32 and 78 (11534) |
||
|
133 83 and 131 (91) |
||
|
134 90 and 131 (17) |
||
|
135 (complex* or sever* or complicat*).tw,kf. (4310769) |
||
|
136 131 not 135 (303) |
||
|
137 ((optimal or short* or extend* or month* or week? or day?) adj10 course?).kf. (133) |
||
|
138 74 or 105 or 137 (7649438) |
||
|
139 79 and 77 and 138 and 44 and 123 and 95 and 102 (1665) |
||
|
140 exp *Anti-Bacterial Agents/tu (103483) |
||
|
141 *bacterial infections/dt or *gram-positive bacterial infections/dt or exp *staphylococcal |
||
|
infections/dt (19732) |
||
|
142 *Bacteremia/dt or (*bacterial infections/dt or *gram-positive bacterial infections/dt or exp |
||
|
*staphylococcal infections/dt) or *Vancomycin/ad or *Floxacillin/ad or (*aminoglycosides/ad or |
||
|
*gentamicins/ad) or (*cephalosporins/ad or *cefazolin/ad) or exp *Anti-Bacterial Agents/ad |
||
|
(51877) |
||
|
143 140 or 141 or 142 (143576) |
||
|
144 139 and 143 (1016) |
||
|
145 inpatient?.tw,kf. (86473) |
||
|
146 129 or 145 (1124071) |
||
|
147 144 and 146 (430) |
||
|
148 105 or 137 (65343) |
||
|
149 147 and 148 (49) |
||
|
150 79 and 77 and 138 and 44 and 123 and 95 and 102 and 148 (135)= P + behandeling + duur |
||
|
+ IV + rct + talen + outcome + optimale duur |
||
|
151 150 (135) |
||
|
152 limit 151 to yr="2000 -Current" (94) |
||
|
153 150 and 143 (99) |
||
|
154 79 and 77 and 138 and 44 and 123 and 95 and 102 and 90 (32))= P + behandeling + duur + |
||
|
IV + rct + talen + outcome + optimale duur + uncomplicated)= 32 rcts end |
||
|
155 (treatment adj2 durat*).tw,kf. (20770) |
||
|
|
156 (antibiotic adj3 duration).tw,kf. (1959) 157 155 or 156 (22468) 158 79 and 143 and 157 (684) 159 44 and 158 (170) 160 159 and 67 (8) systrev 161 (159 and 123) not 67 (146) 162 exp Probability/ (1181296) 163 low.tw,kf. (1978383) 164 low risk.tw,kf. (49236) 165 162 and 163 (163599) 166 87 or 89 or 164 or 165 (225444) 167 161 and 166 (9) 168 166 or 102 (4025026) 169 161 and 168 and 95 (94) rcts 172 79 and 77 and 138 and 44 and 67 and 95 and 102 and 90 (0) geen systrev van combi set 154! |
|
|
Extra search Medline (OVID) <1946 to 2017 June> |
6 2 or 3 (20934) 7 staphyloc*.tw,kf. (131835) 8 staphyloc*.af. (169505) 9 5 and 6 and 8 (19) 10 (antibiotic adj2 duration).tw,kf. (1522) 11 1 or 10 (22099) 12 4 and 6 and 8 and 11 (23) med20170605 spec duur behandeling |
|
|
Embase <1974 to 2017 July> |
5 2 or 3 or 4 (3)
15 5 or 11 or 13 or 14 (7)
|
130 |
|
|
26 vancomycin*.kw. (4346) |
|
|
27 24 or 25 or 26 (80275) |
||
|
28 flucloxacillin/ (7497) |
||
|
29 (Flucloxacillin or floxacillin or oxacillin or nafcillin or cloxacillin or fluorochloroxacillin).tw. |
||
|
(8352) |
||
|
30 (Flucloxacillin or floxacillin or oxacillin or nafcillin or cloxacillin or fluorochloroxacillin).kw. |
||
|
(446) |
||
|
31 (cloxacillin or cefazolin).tw. (6765) |
||
|
32 (cloxacillin or cefazolin).kw. (428) |
||
|
33 28 or 29 or 30 or 31 or 32 (19331) |
||
|
34 (dutch or german or french or english).la. (27744465) |
||
|
35 "filter systematic reviews & meta-analyses Embase".ti. (0) |
||
|
36 meta analysis/ (127551) |
||
|
37 "systematic review"/ (139292) |
||
|
38 (meta-analy$ or metaanaly$).tw. (146046) |
||
|
39 (systematic$ adj4 (review$ or overview$)).tw. (139918) |
||
|
40 (quantitativ$ adj5 (review? or overview?)).tw. (3792) |
||
|
41 (methodologic adj5 (overview? or review?)).tw. (324) |
||
|
42 (review$ adj3 (database? or medline or embase or cinahl)).tw. (19450) |
||
|
43 (pooled adj3 analy$).tw. (20132) |
||
|
44 (extensive adj3 review$ adj3 literature).tw. (2908) |
||
|
45 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1197928) |
||
|
46 review.pt. (2260332) |
||
|
47 45 and 46 (112602) |
||
|
48 (systematic$ adj4 (review$ or overview$)).kw. (16769) |
||
|
49 (quantitativ$ adj5 (review? or overview?)).kw. (48) |
||
|
50 (pooled adj3 analy$).kw. (354) |
||
|
51 or/36-44,47-50 (381666) |
||
|
52 "filter rct embase".ti. (0) |
||
|
53 controlled clinical trial/ or randomized controlled trial/ (614277) |
||
|
54 randomization/ (73821) |
||
|
55 Major Clinical Study/ (2805078) |
||
|
56 random$.tw. (1197477) |
||
|
57 Double Blind Procedure/ (139116) |
||
|
58 or/53-57 (3917744)=rct |
||
|
59 "einde filter rct embase".ti. (0) |
||
|
60 daptomycin/ (7101) |
||
|
61 (daptomycin or d?ptomyc*).tw. (3427) |
||
|
62 (daptomycin or d?ptomyc*).kw. (829) |
||
|
63 linezolid/ (16206) |
||
|
64 (zyvox or linezolid?).tw. (7055) |
||
|
65 (zyvox or linezolid?).kw. (1349) |
||
|
66 60 or 61 or 62 or 63 or 64 or 65 (20166) |
||
|
67 cubicin*.tw. (456) |
||
|
68 "filter observationele studies embase".ti. (0) |
||
|
69 Clinical study/ (150688) |
||
|
70 Case control study/ (113669) |
||
|
71 Family study/ (22543) |
||
|
72 Longitudinal study/ (100319) |
||
|
73 Retrospective study/ (541041) |
||
|
74 Prospective study/ (381008) |
||
|
75 Randomized controlled trials/ (126527) |
||
|
76 74 not 75 (377309) |
||
|
77 Cohort analysis/ (296967) |
||
|
78 (Cohort adj (study or studies)).tw. (193008) |
||
|
79 (Case control adj (study or studies)).tw. (105041) |
||
|
80 (follow up adj (study or studies)).tw. (55095) |
||
|
81 (observational adj (study or studies)).tw. (108957) |
||
|
|
82 (epidemiologic$ adj (study or studies)).tw. (91785) |
|
|
83 (cross sectional adj (study or studies)).tw. (142055) |
||
|
84 or/69-74,76-83 (1816712) |
||
|
85 "filter observationele studies embase".ti. (0) |
||
|
86 exp comparative study/ (1199979) |
||
|
87 staphylococ*.af. (229928) |
||
|
88 (gram?postive or (gram adj1 positive)).af. (69092) |
||
|
89 exp Staphylococcus infection/ (41975) |
||
|
90 87 or 88 or 89 (276103) |
||
|
91 23 and 34 and 90 (12196) |
||
|
92 91 and 27 and 33 (440) |
||
|
93 92 and (51 or 58) (145) |
||
|
94 (92 and (84 or 86)) not (51 or 58) (44) |
||
|
95 vancomycin/cm, dt [Drug Comparison, Drug Therapy] (36544) |
||
|
96 *vancomycin/cm, dt (6501) |
||
|
97 23 and 34 and 96 and 51 (31) |
||
|
98 97 and 90 (26) |
||
|
99 66 or 67 (20167) |
||
|
100 90 and 27 and 99 and (51 or 58) (1687) |
||
|
101 90 and 27 and 99 and 96 and (51 or 58) (234) |
||
|
102 (90 and 27 and 99 and 96 and (84 or 86)) not (51 or 58) (67) |
||
|
103 aminoglycoside antibiotic agent/ or aminoglycoside/ (31075) |
||
|
104 gentamicin/cm, dt [Drug Comparison, Drug Therapy] (30487) |
||
|
105 cm.fs. (530146) |
||
|
106 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).tw. (47317) |
||
|
107 (aminoglycoside? or gentam?cin? or garamycin? or myticin or genticin?).kw. (4923) |
||
|
108 103 or 104 or 106 or 107 (87175) |
||
|
109 23 and 34 and 33 and 108 (339) |
||
|
110 109 and (51 or 58) (92) |
||
|
111 (109 and (84 or 86)) not (51 or 58) (32) |
||
|
112 exp cephalosporin derivative/ (197938) |
||
|
113 exp cefazolin/ (23729) |
||
|
114 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).tw. |
||
|
(31665) |
||
|
115 (cephalospor* or ce??azoli* or cefamedin? or ancef or gramaxin or kefzol or totacef).kw. |
||
|
(2472) |
||
|
116 or/112-115 (201851) |
||
|
117 23 and 34 and 90 and 33 and 116 (392) |
||
|
118 117 and (51 or 58) (130) |
||
|
119 (117 and (84 or 86)) not (51 or 58) (46) |
||
|
120 23 and 34 and 90 and (27 or 33 or 99 or 108 or 116) and 105 and 51 (72) |
||
|
121 90 or 18 (276103) |
||
|
122 exp antibiotic agent/iv [Intravenous Drug Administration] (67178) |
||
|
123 (intraven* or parenteral).tw,kw. (471708) |
||
|
124 exp antibiotic agent/ (1156403) |
||
|
125 123 and 124 (51692) |
||
|
126 122 or 125 (107013) |
||
|
127 121 and 34 and 126 (15337) |
||
|
128 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or |
||
|
week? or month?).tw. (8894258) |
||
|
129 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or |
||
|
week? or month?).kw. (95296) |
||
|
130 time/ or time factor/ (400449) |
||
|
131 128 or 129 or 130 (9104743) |
||
|
132 127 and 131 and 51 (141) |
||
|
133 (antimicrob* or antibioti*).tw. (475229) |
||
|
134 (antimicrob* or antibioti*).kw. (71430) |
||
|
135 133 or 134 (486502) |
||
|
|
136 123 and 135 (31807) 137 126 or 136 (114308) 138 uncomplicat*.tw,kw. (40849) 139 126 and 131 and 137 and 138 (503) 140 139 and 51 (23) 141 18 or 87 or 89 (231620) 142 140 and 141 (6) 143 27 or 33 or 108 or 116 (297344) 144 123 and 143 (21643) 145 126 or 144 (107513) 146 131 and 141 and 145 (6026) 147 146 and 34 (5658) 148 138 and 147 (94) 149 51 and 147 (119)
154 149 and 153 (64) SR uncomplicated duur behandeling 155 34 and 58 and 131 and 141 and 145 (1549) 156 155 not 51 (1503) 157 156 and 153 (737) 158 (during or duration? or (prolong* adj5 course?) or (longer adj5 cours*) or lasting or tim* or week? or month?).ti. (1070436) 159 129 or 158 (1124965) 160 157 and 159 (46) 161 major clinical study/ (2805078) 162 157 and 161 (644) 163 exp hospital/ (948316) 164 from 154 keep 1-64 (64) 165 exp hospital patient/ (128680) 166 hospital*.tw. (1503805) 167 hospital*.kw. (40777) 168 163 or 165 or 166 or 167 (1970380) 169 162 and 168 (359) 170 treatment duration/ (170996) 171 169 and 170 (89) 172 147 and 58 (1549)
177 172 and 153 and 176 (32) 178 172 and 176 (55) 179 178 not 51 (53) rct |
|
|
Extra search Embase <1974 to 2017 July> |
5 exp Staphylococcus infection/dm (390) 6 4 and 5 (18) 7 day?.tw,kw. (2320126) 8 4 and 7 (129) 9 (antibiotic adj2 duration).tw,kw. (2103) 10 7 or 9 (2321028) 11 4 and 10 (138)
|
|
|
|
19 11 and 18 (22) emb20170605 spec duur behandeling SA |
|
|
Cochrane |
ID Search Hits |
81 |
|
|
#1 MeSH descriptor: [Bacteremia] explode all trees 854 |
|
|
|
#2 bacter?emi*:ti,ab 408 |
|
|
|
#3 staphylococ*:ti,ab,kw 4366 |
|
|
|
#4 MeSH descriptor: [Staphylococcal Infections] explode all trees 1147 |
|
|
|
#5 #1 or #2 1163 |
|
|
|
#6 #3 or #4 4408 |
|
|
|
#7 #5 and #6 210 |
|
|
|
#8 MeSH descriptor: [Vancomycin] explode all trees 544 |
|
|
|
#9 Vancomycin*:ti,ab 1093 |
|
|
|
#10 #8 or #9 1149 |
|
|
|
#11 MeSH descriptor: [Floxacillin] explode all trees 70 |
|
|
|
#12 (Flucloxacillin or floxacillin or cefazolin or oxacillin or nafcillin or cloxacillin or |
|
|
|
fluorochloroxacillin):ti,ab 911 |
|
|
|
#13 #5 and #10 and (#11 or #12) 3 |
|
|
|
#14 (#5 or #6) and #10 and (#11 or #12) 43 |
|
|
|
#15 MeSH descriptor: [Daptomycin] explode all trees 53 |
|
|
|
#16 (daptomycin or deptomyc*):ti,ab 96 |
|
|
|
#17 MeSH descriptor: [Linezolid] explode all trees 108 |
|
|
|
#18 (zyvox or linezolid* or cubicin*):ti,ab 292 |
|
|
|
#19 #15 or #16 or #17 or #18 370 |
|
|
|
#20 (#5 or #6) and #10 and #19 153 |
|
|
|
#21 MeSH descriptor: [Aminoglycosides] this term only 233 |
|
|
|
#22 MeSH descriptor: [Gentamicins] explode all trees 1105 |
|
|
|
#23 (aminoglycoside* or gentamycin* or gentamicin* or garamycin* or myticin or |
|
|
|
genticin*):ti,ab 2010 |
|
|
|
#24 #21 or #22 or #23 2337 |
|
|
|
#25 (#5 or #6) and (#11 or #12) and #24 27 |
|
|
|
#26 MeSH descriptor: [Cephalosporins] this term only 1337 |
|
|
|
#27 MeSH descriptor: [Cefazolin] explode all trees 406 |
|
|
|
#28 (cephalospor* or cephazoli* or cefazoli* or cefamedin* or ancef or gramaxin or kefzol |
|
|
|
or totacef):ti,ab 1627 |
|
|
|
#29 (#5 or #6) and (#11 or #12) and (#26 or #27 or #28) 109 |
|
|
|
#30 (#3 or #4) and (#11 or #12 or #26 or #27 or #28) 499 |
|
|
|
#31 MeSH descriptor: [Anti-Bacterial Agents] explode all trees 10749 |
|
|
|
#32 (#3 or #4) and (#31 or #11 or #12 or #26 or #27 or #28) 1231 |
|
|
|
#33 MeSH descriptor: [Time] explode all trees 63895 |
|
|
|
#34 (during or duration* or (prolong* near/5 course*) or (longer near/5 cours*) or lasting |
|
|
|
or tim* or week or weeks or perio*):ti,ab,kw 577606 |
|
|
|
#35 #33 or #34 578558 |
|
|
|
#36 #32 and #35 695 |
|
|
|
#37 hospital*:ti,ab,kw 106195 |
|
|
|
#38 uncomplicat*:ti,ab,kw 4672 |
|
|
|
#39 #36 and (#37 or #38) 196 |
|
|
|
#40 (intraven* or parenteral):ti,ab,kw 78621 |
|
|
|
#41 MeSH descriptor: [Administration, Intravenous] explode all trees 17374 |
|
|
|
#42 #39 and (#40 or #41) 77 |
|
Exclusie na het lezen van het volledige artikel (per PICO op volgorde van jaar van publicatie)
|
Referentie |
Redenen van exclusie |
|
||
|
PICO 1: flucloxacilline versus vancomycine |
|
|||
|
Craven et al. J Infect Dis 1983 |
Andere onderzoeksvraag: vergelijking oxacilline- en aminoglycoside- gevoelige episodes versus oxacilline-resistente en aminoglycoside- resistente episodes |
|
||
|
Auwera et al. Antimicrob Agents Chemother 1985 |
Andere onderzoeksvraag: studie naar het toevoegen van rifampicine aan oxacilline of vancomycine |
|
||
|
Johnson et al. Scand J Infect Dis 2003 (via refcheck) |
Andere onderzoeksvraag: vancomycine versus β-lactam antibiotica (nafcilline/cefazoline), resultaten niet gestratificeerd gepresenteerd voor typen antibiotica (wel meegenomen als indirect bewijs) |
|
||
|
Schrenzel et al. Clin Infect Dis 2004 |
Andere onderzoeksvraag: vergelijking orale versus IV antibiotica |
|
||
|
Lodise et al. Antimicrob Ag Chemother 2007 (via refcheck) |
Andere onderzoeksvraag: vergelijking empirisch vancomycine met empirische behandeling met β-lactam antibiotica, geen gestratificeerde resultaten voor behandeling met penicilline en ceftriaxon (wel meegenomen als indirect bewijs) |
|
||
|
Kim et al. Antimicrob Ag Chemother 2008 |
Andere onderzoeksvraag: vancomycine versus β-lactam antibiotica. Niet gespecificeerd welke antibiotica de β-lactam groep exact kreeg (wel meegenomen als indirect bewijs) |
|
||
|
Lalani et al. J Antimicrob Chemother 2008 |
Andere onderzoeksvraag: daptomycine versus vancomycine |
|
||
|
Schweizer et al. BMC Infect Dis 2011 |
Andere onderzoeksvraag: vancomycine versus nafcilline/cefazoline. Geen gestratificeerde resultaten voor nafcilline en cefazoline (wel meegenomen als indirect bewijs) |
|
||
|
Thwaites et al. Lancet Infect Dis 2011 |
Review maar voldoet niet aan voorwaarden voor systematisch review (geïncludeerde studies zijn niet beoordeeld op kwaliteit) |
|
||
|
Han et al. Antimicrob Ag Chemother 2012 |
Geen vergelijkend onderzoek tussen flucloxacilline en vancomycine: studie naar de associatie tussen verminderde gevoeligheid voor vancomycine en mortaliteit |
|
||
|
Holmes et al. Clin Microbiol Infect 2013 |
Andere onderzoeksvraag: studie naar de associatie tussen verhoogde MIC voor vancomycine en mortaliteit |
|
||
|
Lopez-Cortes et al. Clin Infect Dis 2013 |
Andere onderzoeksvraag: vergelijking pre-interventie en post-interventie periode |
|
||
|
Blumenthal et al. Clin Infect Dis 2015 |
Geen vergelijkend onderzoek tussen flucloxacilline en vancomycine: ontwikkeling van een statistisch model |
|
||
|
Marti-Carjaval et al. Cochrane 2016 |
Cochrane review. Eén PICO komt overeen met onze onderzoeksvraag, waarbij 1 origineel artikel werd gevonden. Dit artikel werd ook in onze search gevonden en geïncludeerd (Fortún 2001) |
|
||
|
Wong et al. Ann Clin Microb 2016 – april 2016 |
Andere onderzoeksvraag: vancomycine versus β-lactam antibiotica, resultaten niet gestratificeerd gepresenteerd. Lijkt qua content zeer op artikel hieronder. Geen respons van auteur op verzoek voor opheldering over wat de verschillen zijn in onderzoeksvraag en data-analyse (wel meegenomen als indirect bewijs, keuze voor dit artikel omdat het als eerst gepubliceerd is) |
|||
|
Wong et al. BMC Infect Dis 2016 – mei 2016 |
Andere onderzoeksvraag: vancomycine versus β-lactam antibiotica, resultaten niet gestratificeerd gepresenteerd. Lijkt qua content zeer op artikel hierboven. Exclusie vanwege ‘duplicaat’ enerzijds en andere onderzoeksvraag anderzijds |
|||
|
|
PICO 2: flucloxacilline versus eerste generatie cefalosporine |
|||
|
Reinarz et al. J Infect Dis 1973 |
Andere onderzoeksvraag: studie naar de antimicrobiële en klinische respons cefazoline behandeling in twee patiënten met bacteriëmie en zeven patiënten met endocarditis (geen vergelijkend onderzoek) |
|||
|
Schweizer et al. BMC Infect Dis 2011 (via refcheck) |
Andere onderzoeksvraag: vergelijking tussen behandeling met nafcilline of cefazoline versus behandeling met vancomycine. Resultaten niet gestratificeerd gepresenteerd voor behandeling met nafcilline versus behandeling met cefazoline |
|||
|
Livorsi et al. Antimicrob Agents Chemother 2012 (via refcheck) |
Geen vergelijkend onderzoek tussen flucloxacilline en eerste generatie cefalosporines: studie naar de prevalentie van genetische karakteristieken en een mogelijk inoculum effect |
|||
|
Vardakas et al. Int J Antimicrob Agents 2014 |
Systematische review met vergelijkbare onderzoeksvraag, maar de resultaten werden niet gestratificeerd voor de verschillende typen cefalosporines |
|||
|
|
PICO 3: flucloxacilline versus flucloxacilline + aminoglycoside |
|||
|
Paladino et al. Am J Med 1991 |
Andere onderzoeksvraag: studie naar intraveneuze ciprofloxacine versus orale ciprofloxacine na 72 uur behandeling. Geen vergelijkend onderzoek tussen flucloxacilline en flucloxacilline en aminoglycoside |
|||
|
Chang et al. J Microbiol Immunol Infect 2000 |
Review maar voldoet niet aan voorwaarden voor systematisch review (narrative review) |
|||
|
Capitano et al. Paediatr Drugs 2001 |
Review maar voldoet niet aan voorwaarden voor systematisch review (narrative review) |
|||
|
Bayer et al. Clin Infect Dis 2009 |
Geen vergelijkend onderzoek (editorial) |
|||
|
Cosgrove et al. Clin Infect Dis 2009 |
Post-hoc analyse van RCT data (Fowler et al., 2006) naar het optreden van nefrotoxiciteit bij gentamicine combinatietherapie; resultaten niet gestratificeerd voor 1) smalspectrum penicillines met gentamicine versus behandeling met alleen smalspectrum penicillines en 2) methicillinegevoelige S. aureus bacteriëmie |
|||
|
Thwaites et al. PLoS ONE 2010 |
Andere onderzoeksvraag: studie naar variatie in richtlijnen en variatie in behandeling van SAB in verschillende landen, geen vergelijkend onderzoek tussen flucloxacilline en flucloxacilline en aminoglycoside |
|||
|
Lemonovich et al. Infection 2011 |
Resultaten niet gestratificeerd voor 1) aminoglycoside combinatietherapie met smalspectrum penicillines versus behandeling met alleen smalspectrum penicillines en 2) methicillinegevoelige S. aureus bacteriëmie |
|||
|
Thwaites et al. Lancet Infect Dis 2011 |
Review maar voldoet niet aan voorwaarden voor systematisch review (geïncludeerde studies zijn niet beoordeeld op kwaliteit) |
|||
|
|
PICO 4: <2 weken versus ≥2 weken |
|||
|
Chambers et al. Ann Intern Med 1988 |
Andere onderzoeksvraag: vergelijking nafcilline en tobramycine versus vancomycine en tobramycine |
|||
|
Jernigan et al. Ann Intern Med 1993 |
Systematische review, maar vergelijkt geen uitkomsten tussen korte en langere therapieduur (meer een assessment van risico op bias van de studies) |
|||
|
DiNubile et al. Ann Intern Med 1994 |
Review, maar voldoet niet aan voorwaarden voor systematisch review (narrative review) |
|||
|
Heldman et al. Am J Med 1996 |
Andere onderzoeksvraag: vergelijking orale antibiotica versus intraveneuze antibiotica |
|||
|
Rosen et al. Ann Intern Med 1999 |
Andere onderzoeksvraag: studie naar de kosteneffectiviteit van TEE bij patiënten met S. aureus bacteriëmie |
|||
|
Verhagen et al. Scand J Infect Dis 2003 |
Ontbreken van controlegroep: duur van antimicrobiële therapie alleen verzameld voor patiënten die overleden of een recidief hadden |
|||
|
Wintenberger et al. Med Mal Infect 2017 |
Geen vergelijkend onderzoek (aanbevelingen over antimicrobiële therapieduur van verschillende infecties met deels literatuurstudie, maar voldoet niet aan voorwaarden voor systematische review) |
|||
Algemene zoekverantwoording
Medline
Database: MEDLINE <1946 to Present incl: Epub Ahead of Print, In-Process & Other Non-Indexed Citations, and MEDLINE Daily>
Search Strategy:
--------------------------------------------------------------------------------
1 staphylococcus aureus/ or methicillin-resistant staphylococcus aureus/ (60126)
2 (staphylococc* adj3 aureus).tw. (81324)
3 (staphylococc* adj3 aureus).kf. (2922)
4 or/1-3 (97533)=P
5 guideline/ or practice guideline/ (28077)
6 consensus development conference/ (10038)
7 guideline?.ti. (58994)
8 guideline?.kf. (5569)
9 or/5-8 (85993)
10 4 and 9 (284)
11 *staphylococcus aureus/ or *methicillin-resistant staphylococcus aureus/ (37036)
12 (staphylococc* adj3 aureus).ti. (32166)
13 3 or 11 or 12 (45705)
14 9 and 13 (139)= P +bacteriemie
15 (dutch or english or german or french).la. (23555640)= talen
16 14 and 15 (123)
17 16 (123)
18 limit 17 to yr="2005 -Current" (87)
19 bacteremia/ or hemorrhagic septicemia/ (20745)
20 bactere*.tw. (20921)
21 bactere*.kf. (1412)
22 19 or 20 or 21 (33610)
23 18 and 22 (13)
24 sab.tw. (963)
25 sab.kf. (20)
26 19 or 20 or 21 or 24 or 25 (34364)
27 18 and 26 (13)= richtlijnen vanaf 2005
28 "filter systematic reviews".ti. (0)
29 meta analysis.pt. (70838)
30 (meta-anal$ or metaanal$).af. (126011)
31 (quantitativ$ adj10 (review$ or overview$)).tw. (6106)
32 (systematic$ adj10 (review$ or overview$)).tw. (99842)
33 (methodologic$ adj10 (review$ or overview$)).tw. (8239)
34 (quantitativ$ adj10 (review$ or overview$)).kf. (24)
35 (systematic$ adj10 (review$ or overview$)).kf. (5412)
36 (methodologic$ adj10 (review$ or overview$)).kf. (29)
37 medline.tw. and review.pt. (58275)
38 (pooled adj3 analy*).tw. (12141)
39 (pooled adj3 analy*).kf. (103)
40 "cochrane$".fc_jour. (16009)
41 or/29-40 (226059)
42 4 and 15 and 26 and 41 (48)= systrev
Embase search
Database: Embase <1974 to 2016 July 07>
Search Strategy:
--------------------------------------------------------------------------------
1 staphylococcal bacteremia/ (1385)
2 exp Staphylococcus aureus/ (130261)
3 (staphylococc* adj3 aureus).tw. (97561)
4 (staphylococc* adj3 aureus).kw. (12205)
5 bacteremia/ or staphylococcal bacteremia/ (34100)
6 2 or 3 or 4 (150575)
7 bactere*.tw. (25886)
8 bactere*.kw. (3692)
9 5 or 7 or 8 (43651)
10 6 and 9 (7550)
11 practice guideline/ (278974)
12 guideline?.ti. (76104)
13 guideline?.kw. (23330)
14 11 or 12 or 13 (309135)
15 10 and 14 (249)
16 (dutch or english or german or french).la. (27127260)
17 15 and 16 (237)
18 17 (237)
19 limit 18 to yr="2005 -Current" (197)
20 exp *Staphylococcus aureus/ (45047)
21 (staphylococc* adj3 aureus).ti. (36419)
22 4 or 20 or 21 (59914)=P focus
23 19 and 22 (76)
24 limit 23 to (article or "review") (54)= richtlijnen
25 "filter systematic reviews & meta-analyses Embase".ti. (0)
26 meta analysis/ (111545)
27 "systematic review"/ (109864)
28 (meta-analy$ or metaanaly$).tw. (123807)
29 (systematic$ adj4 (review$ or overview$)).tw. (115867)
30 (quantitativ$ adj5 (review? or overview?)).tw. (3372)
31 (methodologic adj5 (overview? or review?)).tw. (310)
32 (review$ adj3 (database? or medline or embase or cinahl)).tw. (16975)
33 (pooled adj3 analy$).tw. (17264)
34 (extensive adj3 review$ adj3 literature).tw. (2666)
35 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1130118)
36 review.pt. (2179885)
37 35 and 36 (102281)
38 (systematic$ adj4 (review$ or overview$)).kw. (13304)
39 (quantitativ$ adj5 (review? or overview?)).kw. (43)
40 (pooled adj3 analy$).kw. (311)
41 or/26-34,37-40 (334603)
42 1 and 16 and 41 (36)
43 10 and 16 and 41 (146)
44 43 (146)
45 limit 44 to yr="2005 -Current" (125)= systrev
Cochrane search
Search Name: coc20160708 s aureus bacteriemie barbara
Last Saved: 08/07/2016 12:30:22.424
Description:
ID Search
#1 MeSH descriptor: [Staphylococcal Infections] explode all trees
#2 bacteri*:ti,ab
#3 Staphylococc* near/3 aureus:ti,ab
#4 MeSH descriptor: [Bacteremia] explode all trees
#5 MeSH descriptor: [Staphylococcus aureus] explode all trees
#6 (#1 or #3 or #5) and (#2 or #4)
WOS
Staphylococcus NEAR/3 aureus NEAR/5 Bacter* in titel
vanaf 2005 en review of guideline* in topic van 2005-2016

