SSRI en lactatie
Uitgangsvraag
Uitgangsvragen:
- In hoeverre worden SSRI’s uitgescheiden in de borstvoeding (per middel, dosering en tijdstip)?
- Wat zijn de vroege neonatale effecten (van SSRI-bevattende borstvoeding op het kind)?
- Wat zijn de lange termijn effecten van SSRI-bevattende borstvoeding op het kind?
- Is er een verschil in associatie tussen gebruik van verschillende SSRI’s tijdens de lactatie en effecten op het kind?
- Welke SSRI‘s hebben de voorkeur voor gebruik tijdens de lactatieperiode?
Aanbeveling
Bij het voorschrijven of continueren van een SSRI tijdens de lactatieperiode dienen onderstaande gegevens met de patiënt en haar partner besproken te worden:
- Er is zeer weinig onderzoek verricht naar directe effecten op de pasgeborene.
- Tot op heden zijn geen ernstige negatieve effecten aangetoond.
- Effecten op lange termijn zijn onvoldoende onderzocht.
Er is te weinig onderzoek beschikbaar naar de directe effecten op het kind om een uitspraak te doen naar een voorkeur voor een SSRI tijdens de lactatie.
Op basis van gemeten serumconcentraties van het kind en het metabolisme van de middelen is de werkgroep van mening datfFluoxetine en citalopram geen voorkeur verdienen om mee te beginnen tijdens de lactatie.
Wanneer behandeling met fluoxetine of citalopram reeds tijdens of voor de zwangerschap gestart is en effectief is, kan deze gecontinueerd worden, omdat tot op heden geen ernstige negatieve effecten bij de pasgeborene gevonden zijn.
- Paroxetine en sertraline tijdens de lactatie de voorkeur verdienen
- Er onvoldoende gegevens zijn om escitalopram en fluvoxamine tijdens de lactatie aan te bevelen of te ontraden.
Ziekte van het kind, prematuriteit, laag geboortegewicht en welke SSRI en in welke dosering dienen bij deze beslissing meegewogen te worden.
Overwegingen
SSRI’s worden in borstvoeding uitgescheiden, maar voor de meeste SSRI’s is de borstvoeding/maternale plasma ratio <1, met uitzondering van de SSRI’s sertraline, citalopram en fluvoxamine. Deze SSRI’s zijn het meest lipofiel. Vanwege de lipofiliteit van SSRI’s bevat achtermelk ook hogere concentraties aan SSRI’s dan voormelk. De borstvoeding/maternale plasma ratio zegt helaas weinig over de hoeveelheid die het kind daadwerkelijk binnen krijgt.
Plasmaconcentraties van SSRI’s, gemeten in borstgevoede kinderen van wie de moeder een SSRI gebruikt zijn onmeetbaar tot laag. Voor sertraline, paroxetine en fluvoxamine werden onmeetbare waarden gevonden; het aantal onderzochte kinderen bij fluvoxamine was echter zeer klein (n =12).
Bij maternaal fluoxetine- en citalopramgebruik werden de hoogste relatieve kinddoses gevonden, respectievelijk 2,2-12% en 3-10%. (Een dosis van <10% van de maternale dosis/kg lichaamsgewicht wordt algemeen als te verwaarlozen beschouwd). De aktieve metaboliet van fluoxetine is norfluoxetine. Norfluoxetine heeft een lange halfwaardetijd (4-16 dagen), waardoor accumulatie bij het geven van borstvoeding kan ontstaan. In de studies waarbij hoge SSRI-concentraties gevonden werden hadden de meeste kinderen een leeftijd van 2-4 maanden en dus een nog niet volledig rijpe lever. Het vermogen om deze medicatie te metaboliseren neemt vanaf de leeftijd van drie maanden geleidelijk toe. Voor prematuur geboren kinderen en à terme geboren kinderen van een tot twee weken oud zal het vermogen om SSRI’s te metaboliseren minder zijn ten opzichte van oudere à terme geboren kinderen.
Er zijn slechts weinig studies verricht naar de directe effecten van SSRI-bevattende borstvoeding op de pasgeborene en het aantal onderzochte kinderen in deze studies was klein. In de drie studies die in totaal slechts 53 patiënten bevatten werden geen nadelige effecten gevonden. Er is wel een aantal casereports verschenen die nadelige effecten van SSRI’s in borstgevoede kinderen meldden. De meeste effecten werden bij gebruik van fluoxetine en citalopram gezien: kolieken, voedingsproblemen, slaapproblemen, veel huilen en prikkelbaarheid. Er zijn geen gegevens bekend over de lange termijn effecten (leeftijd kind >2 jaar) van SSRI-bevattende borstvoeding op motorische ontwikkeling, cognitie, gedrag en sociaal emotionele ontwikkeling van het kind.
Vanwege hun onmeetbare tot zeer lage concentraties in het serum van de pasgeborene zijn sertraline en paroxetine middel van eerste keus bij behandeling van postpartum depressie waarbij de moeder borstvoeding wil geven. Over fluvoxamine zijn onvoldoende gegevens bekend. Fluoxetine en citalopram worden vanwege hun hoge relatieve kinddosis ontraden. Echter wanneer behandeling met fluoxetine of citalopram reeds tijdens de zwangerschap gestart is en effectief is, kan deze gecontinueerd worden, omdat tot op heden geen ernstige negatieve effecten bij de pasgeborene gevonden zijn (ondanks de lange halfwaarde tijd van (nor) fluoxetine).
Een aantal auteurs adviseert bij gebruik van SSRI’s tijdens de lactatie verdere controle van de pasgeborene op negatieve effecten, vooral bij prematuur geboren kinderen, zieke kinderen en pasgeborenen met een laag geboortegewicht (Gentile S, 2007; di Scalea TL, 2009).
Om de blootstelling van de pasgeborene aan SSRI’s zo laag mogelijk te houden adviseert een aantal auteurs om net voor inname van de medicatie te voeden en voeden ten tijde van de maternale piekconcentratie te vermijden,. De piek van de concentraties in de moedermelk loopt echter achter op de piek in het plasma en of deze maatregelen ook klinisch relevant zijn is niet onderzocht.
Onderbouwing
Achtergrond
Er bestaat onduidelijkheid over het te voeren beleid inzake borstvoeding bij vrouwen die een SSRI (gaan) gebruiken. Het gaat hierbij om de afweging van de positieve effecten van het geven van borstvoeding voor de pasgeborene en de moeder en de mogelijk schadelijke effecten van SSRI-bevattende borstvoeding voor de pasgeborene. Van belang is om te weten of de verschillende SSRI’s daadwerkelijk in borstvoeding uitgescheiden worden (en in welke mate) en of deze invloed hebben op het kind op korte of lange termijn. In dit hoofdstuk wordt behandeld of vrouwen met SSRI-gebruik in de lactatieperiode borstvoeding veilig kunnen geven (en welk type SSRI dan de voorkeur verdiend) of dat flesvoeding de voorkeur heeft.
Het risico op exacerbatie van de psychiatrische ziekte bij de moeder in geval van wel of geen SSRI-behandeling wordt in dit hoofdstuk besproken bij de overwegingen maar is geen onderwerp van deze richtlijn.
Conclusies / Summary of Findings
Conclusies uit de literatuur
Uitgangsvragen 1 en 4:
|
Kwaliteit van bewijs: ZEER LAAG |
Bij maternaal fluoxetine- en citalopramgebruik werden de hoogste relatieve kinddoses gevonden, respectievelijk 2,2-12% en 3-10%. |
|
Kwaliteit van bewijs: ZEER LAAG |
Plasmaconcentraties van SSRI’s gemeten in borstgevoede kinderen van wie de moeder een SSRI gebruikt zijn onmeetbaar tot laag (<5 ng/ml). Alleen voor fluoxetine was de plasmaconcentratie hoger (tot 100 ng/ml). |
Uitgangsvraag 2:
|
Kwaliteit van bewijs: ZEER LAAG |
Er is weinig informatie beschikbaar over de vroege neonatale effecten van blootstelling aan SSRI’s door borstvoeding. Er werden geen nadelige vroege neonatale effecten gerapporteerd. |
Uitgangsvraag 3:
|
Geen bewijs |
Er zijn geen gegevens bekend over de lange termijn effecten (leeftijd kind >2 jaar) van SSRI-bevattende borstvoeding op motorische ontwikkeling, cognitie, gedrag en sociaal emotionele ontwikkeling van het kind. |
Samenvatting literatuur
Uitgangsvraag 1
In hoeverre worden SSRI’s uitgescheiden in de borstvoeding (per middel , dosering en tijdstip)?
De mate van uitscheiding van SSRI’s is per middel verschillend. Bij borstvoedende moeders die paroxetine en sertraline gebruiken worden over het algemeen onmeetbare concentraties van het middel in het bloed van het kind gevonden; bij fluoxetine- en citalopramgebruik kunnen relatief hoge plasmaconcentraties bij het kind gemeten worden (tot respectievelijk 8% en 10% van de maternale concentratie). (Weissman, 2004; Gentile, 2007). Bij gebruik van fluoxetine en citalopram tijdens borstvoeding werden ook de hoogste relatieve kinddoses gevonden, respectievelijk 2,2-12% en 3-10% (Berle, 2011; Kristensen, 1999; Taddio, 1996; Yoshida, 1998). Voor fluvoxamine, paroxetine en sertraline werden lage relatieve kinddoses gevonden (alle <3%, Berle, 2011). De relatieve kinddosis is de dosis van het geneesmiddel van het kind per kg lichaamsgewicht uitgedrukt als percentage van de maternale dosis per kg lichaamsgewicht. Bij een percentage <10% wordt de blootstelling aan het geneesmiddel over het algemeen als te verwaarlozen beschouwd.
Figuur 8.1
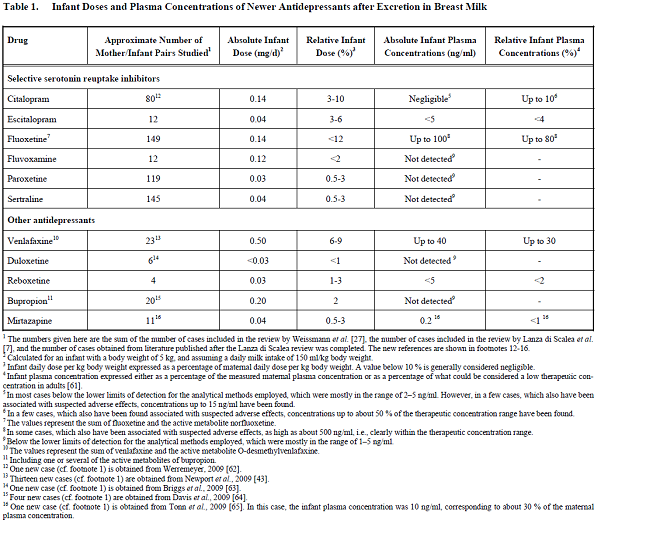
Bron:(Berle JO, 2011).
Uitgangsvraag 2
Wat zijn de vroege neonatale effecten van SSRI-bevattende borstvoeding op het kind?
In totaal werden drie studies geïncludeerd. In een prospectief cohortonderzoek vergeleek men de ongunstige effecten op kinderen van moeders die citalopram gebruikten tijdens de lactatie (n=31) met vrouwen die depressief waren maar geen medicatie gebruikten (n=12) en vrouwen die niet depressief waren en geen medicatie gebruikten (n=31) (Lee A, 2004). Men vond geen verschil in ongunstige effecten (adverse events gedefinieerd als any clinical events in the infants for which they may or may not have sought medical attention) tussen kinderen met SSRI-blootstelling door borstvoeding en kinderen zonder SSRI-blootstelling door borstvoeding (beide groepen). Ook (Heikkinen T, 2002) onderzocht citalopramgebruik tijdens de lactatie in een prospectief cohortonderzoek (n=11) en vond geen verschil in ontwikkeling van het kind (onderzoek door een kinderarts) in het eerste jaar. Met een soortgelijke opzet onderzocht (Heikkinen T, 2003) ook het effect van fluoxetineblootstelling door borstvoeding op de ontwikkeling van het kind op de leeftijd van twee weken, twee maanden, zes maanden en een jaar (onderzoek door kinderarts en fysiotherapeut). Tussen de twee groepen werden geen significante verschillen gevonden in ontwikkeling, waarbij opgemerkt moet worden dat de uitkomstmaat geclassificeerd werd als ‘normaal’ en ‘abnormaal’.
Uitgangsvraag 3
Wat zijn de lange termijn effecten van SSRI-bevattende borstvoeding op het kind?
Er zijn onvoldoende gegevens beschikbaar over de lange termijn effecten (leeftijd kind >2 jaar) van SSRI-bevattende borstvoeding op het kind. In de eerder vermelde studies van Heikkinen werd de neurologische ontwikkeling van de kinderen op éénjarige leeftijd onderzocht (n=11). Hierbij werden geen verschillen vastgesteld (Heikkinen T, 2002; Heikkinen T, 2003).
Uitgangsvraag 4
Is er een verschil in associatie tussen gebruik van verschillende SSRI’s tijdens de lactatie en effecten op het kind?
Voor het antwoord op deze vraag wordt verwezen naar uitgangsvraag 1.
Uitgangsvraag 5
Welke SSRI‘s hebben de voorkeur voor gebruik tijdens de lactatieperiode?
Voor het antwoord op deze uitgangsvraag wordt verwezen naar hoofdstuk 8.
GRADE tabel 1: In hoeverre worden SSRI’s uitgescheiden in de borstvoeding (per middel , dosering en tijdstip)?
|
Beoordeling van Kwaliteit |
Kwaliteit |
||||||
|
Aantal studies |
Studie ontwerp |
Studie beperkingen |
Inconsistentie |
Indirectheid |
Imprecisie |
Andere opmerkingen |
|
|
Concentratie SSRI’s in borstvoeding |
|||||||
|
- |
Observationele studies1 |
- |
- |
- |
- |
- |
- |
|
Directe effecten van SSRI bevattende borstvoeding op het kind |
|||||||
|
3 |
Observationele studies |
Ernstige studie beperkingen2 |
Geen ernstige inconsistentie |
Geen ernstige indirectheid |
Ernstige imprecisie3 |
Geen |
ZEER LAAG |
|
Late effecten van SSRI bevattende borstvoeding op het kind (motorische ontwikkeling, cognitie, gedrag en sociaal emotionele ontwikkeling) |
|||||||
|
0 |
Geen bewijs |
- |
- |
- |
- |
- |
- |
1 Niet geschikt om in te vullen in GRADE tabel. Systematic reviews gebruikt die de gegevens voornamelijk baseren op casereports, wat neer komt op maximaal laag, maar waarschijnlijk zeer lage kwaliteit van bewijs (Berle JO, 2011; Gentile S, 2007; Kristensen JH, 1999; Taddio A, 1996; Weissman AM, 2004; Yoshida K, 1998)
2 Niet gerapporteerd of de beoordelaar van de uitkomstmaat geblindeerd was in 2 studies. Populatie niet duidelijk omschreven in 2 studies. 2 studies onduidelijk hoe het onderzoek gefinancierd werd. In 1 studie middelengebruik niet gerapporteerd.
3 (Heikkinen T, 2002; Heikkinen T, 2003; Lee A, 2004). Totaal 53 patiënten onderzocht. Alleen de SSRI’s fluoxetine en citalopram werden voor deze uitkomstmaat onderzocht.
Zoeken en selecteren
Tijdens het selectieproces van de literatuur blijkt dat de beschikbare kennis voornamelijk gebaseerd is op casereports en caseseries. Deze worden vervolgens in diverse (vooral beschrijvende) reviews weergegeven. De werkgroep heeft voor dit hoofdstuk dan ook besloten de criteria voor selectie van literatuur waar nodig iets te versoepelen en niet alleen RCT’s en cohortstudies mee te nemen maar ook systematische reviews van caseseries.
In totaal werden er van de 232 gevonden artikelen zes geselecteerd voor inclusie (zie bijlage 4 voor de zoekverantwoording en bijlage 6 voor de evidence tabel 6.6).
Referenties
- Berle JO, Spigset O. (2011). Antidepressant use during breastfeeding. Current Women's Health Reviews, 7, 28-34.
- Epperson CN, Jatlow PI, Czarkowski K, Anderson GM. (2003). Maternal fluoxetine treatment in the postpartum period: effects on platelet serotonin and plasma drug levels in breastfeeding mother-infant pairs. Pediatrics, 112, e425-x.
- Gentile S (2007). Use of contemporary antidepressants during breastfeeding: a proposal for a specific safety index. . Drug Saf, 30, 107-121.
- Gentile S, Rossi A, Bellantuono C. (2007). SSRIs during breastfeeding: spotlight on milk-to-plasma ratio. Arch Womens Ment Health, 10, 39-51.
- Heikkinen T, Ekblad U, Palo P, Laine K. (2003). Pharmacokinetics of fluoxetine and norfluoxetine in pregnancy and lactation. Clin Pharmacol Ther, 73, 330-7.
- Heikkinen T, Ekblad U, Kero P, Ekblad S, Laine K. (2002). Citalopram in pregnancy and lactation. Clin Pharmacol Ther, 72, 184-91.
- Kristensen JH, Ilett KF, Hackett LP, Yapp P, Paech M, Begg EJ. (1999). Distribution and excretion of fluoxetine and norfluoxetine in human milk. Br J Clin Pharmacol., 48, 521-7.
- Lee A, Woo J, Ito S. (2004). Frequency of infant adverse events that are associated with citalopram use during breast-feeding. Am J Obstet Gynecol, 190, 218-21.
- Oberlander TF, Grunau RE, Fitzgerald C, Papsdorf M, Rurak D, Riggs W. (2005). Pain reactivity in 2-month-old infants after prenatal and postnatal serotonin reuptake inhibitor medication exposure. Pediatrics, 115, 411-25.
- di Scalea TL, Wisner KL. (2009). Pharmacotherapy of postpartum depression. Expert Opin Pharmacother, 10, 2593-607.
- Taddio A, Ito S, Koren G. (1996). Excretion of fluoxetine and its metabolite, norfluoxetine, in human breast milk. J Clin Pharmacol, 36, 42-7.
- Weissman AM, Levy BT, Hartz AJ, Bentler S, Donohue M, Ellingrod VL, Wisner KL. (2004). Pooled analysis of antidepressant levels in lactating mothers, breast milk, and nursing infants. Am J Psychiatry, 161, 1066-78.
- Yoshida K, Smith B, Craggs M, Kumar RC. (1998). Fluoxetine in breast-milk and developmental outcome of breast-fed infants. Br J Psychiatry, 172, 175-.
Evidence tabellen
6.6 Lactatie en SSRI-gebruik
|
Reference |
Study type |
Characteristics |
Intervention (I) |
Controls (C)
|
Outcome measures and follow-up time |
Results |
Quality assesment study |
|
Epperson, 2003
|
Non-comparative observational study
N=11 |
Inclusion: women referred by their primary care provider to the Yale Behavioral Gynecology Program for evaluation and consultation regarding the treatment of postpartum depression and/or the use of antidepressants during lactation. Women were counseled regarding the possible risks and benefits of using fluoxetine and other antidepressants while breastfeeding; nonpharmacologic treatments were also discussed.
Measurements: 1) 5-HT levels before the mother’s initiation of fluoxetine treatment. Mothers then began fluoxetine (initial dose: 20 mg/d) and continued to breastfeed their infants according to their preferred schedule. 2) Postexposure blood sampling occurred 4 to 12 weeks after the initiation of fluoxetine treatment and no sooner than 10 days after a change in fluoxetine dose. |
Women who started using fluoxetine in the lactation period. (mother-infant pairs)
N=11
Five mothers were taking 20 mg of fluox- etine daily, 4 were taking 30 mg daily, and 2 were taking 40 mg daily. Mean infant age at the start of the study was 16.8 (SD: 8.8) weeks.
Six infants were breastfed exclusively; the remaining were breastfed between 3 and 8 times daily and were given supplemental feedings. |
- |
Maternal and infant transporter blockade was assessed by measurement of platelet 5-HT before and after 4 to 12 weeks of maternal fluoxetine (20–40 mg/d) treatment for postpartum depression. Whole-blood 5-HT levels and plasma fluoxetine and norfluoxetine levels were determined by high-performance liquid chromatography. |
Mean ma- ternal postexposure 5-HT levels of 22.9 ng/mL (SD: 12.5) were markedly lower than mean preexposure (baseline) levels of 156.6 ng/mL (SD: 71.4). In contrast, the mean infant pre- and postexposure 5-HT concentrations of 217.1 (SD: 66.5) and 229.9 (SD: 83.5) ng/mL, respectively, were similar. However, the 1 infant with measurable plasma fluoxetine had a substantial decline in 5-HT to 40% of baseline. In samples obtained from the same infant 4 months later, plasma drug levels were undetectable (<1 ng/mL) and the platelet serotonin levels were no longer reduced (12% increase from baseline). |
Clearly defined groups: No
Selection bias: possibly
Adequate exposure assessment method: yes
Method of assessing the outcome appropriately: ?
Impactassessor blinded: No
Follow-up: different for all included women, since the start of therapy differs.
Selective loss to follow up: Unclear
Identification confounders and correction in analysis: Not reported
Funding: Funded by pharmaceutical company (Eli Lilly)
Very small sample! |
|
Gentile, 2007
Arch Womens Ment health |
|
Inclusion: Medline, Toxnet, Embase, Current Contents, and PsycInfo indexed articles from 1980 to September 2006.
All studies reporting the Milk-to-plasma (M/P) ratio in mothers taking SSRIs while breastfeeding or studies which such an information could be calculated from data reported in the article. |
|
|
Milk-to-plasma (M/P) ratio |
Higher M/P ratios were rarely associated with a clinically significant impact on the babies during the early phases of breastfeeding. |
|
|
Heikkinen, 2002 |
Prospective cohort study
N=21 |
Inclusion: pregnant women using citalopram (cases) or who were not taking any medication (matched controls).
Assessment: - Pregnancy: 3 checks (physical and US examinations and bloodsamples) -Delivery: Standardized investigation -Early puerperium. Standardized investigation -Follow-up until 1 year: standardized (breastmilk, plasma and examination) |
Pregnant women taking citalopram N=11
Indication for citalopram: depression (n=6), or panic disorder (n=5)
Dose: 20-40 mg a day
No significant difference between groups in characteristics except 2 patients in the citalopram group had a habit of light alcohol use during pregnancy |
Pregnant women who were not taking any medication N=10
Control group was prospectively matched for confounding obstetric characteristics (age, gravidity, parity, and time and mode of delivery) at time of delivery.
1 of 11 controls dropped out due to protocol violation |
Primary: plasma and breast milk concentrations of citalopram and metabolites
Secondary outcomes: Neonatal outcomes: -birth weight, -Apgar score, -umbilical artery pH, -body temperature and -physical examination
|
The mean didesmethylcitalopram-desmethylcitalopram metabolic ratio was significantly higher during pregnancy (54%, P < .001) than at 2 months after delivery, indicating induction of cytochrome P450 (CYP) 2D6 during pregnancy.
At delivery, the trough plasma citalopram, desmethylcitalopram, and didesmethylcitalopram concentrations in the infants were 64%, 66%, and 68% of the maternal concentrations, respectively.
The citalopram and metabolite concentrations in the milk were 2- to 3-fold higher compared with maternal plasma concentrations, but the infant citalopram and metabolite plasma concentrations were very low or undetectable. The delivery outcome and the neurodevelopment of all infants up to the age of 1 year were normal.
|
Clearly defined groups: No, recruitment procedure unclear.
Selection bias: Possible.Unclear how many women were initially approached
Adequate exposure assessment method: yes
Method of assessing the outcome appropriately: unclear
Impactassessor blinded: Not described
Follow-up: yes
Selective loss to follow-up: unlikely (one drop out in control group)
Identification confounders and correction in analysis: yes
Financiering: Not mentioned!
Other: -small sample size -secondary outcome measurement
|
|
Heikkinen, 2003
|
Prospective cohort study
N=21 |
Inclusioncriteria unclear. |
N=11
fluoxetine dose from 20 mg to 40 mg once daily
Already used fluoxetine before conception n=6
Started taking fluoxetine later during pregnancy N=5
Four of the women with a PD occasionally took a benzodiazepine. (0.5- to 2-mg dose of alprazolam or 1- to 2-mg dose of lorazepam) during pregnancy). |
N=10
Breastfeeding women without psychotropic medication who were prospectively matched for confounding obstetric characteristics (age, gravidity, parity, gestational weeks, and mode of delivery) at the time of delivery |
maternal and infant plasma and breast milk concentrations
norfluoxetine/fluoxetine metabolic ratios
mean (_SD) child/mother plasma concentration ratios and milk/plasma (M/P) ratios |
Relatively low trough fluoxetinenorfluoxetine concentrations during pregnancy (range, 317-850 nmol/L) were measured. The mean norfluoxetine/fluoxetine metabolic ratio was 2.4-fold higher during late pregnancy than at 2 months after delivery (P _ .0072). At delivery, the infant plasma fluoxetine and norfluoxetine concentrations were 65% and 72%, respectively, of those found in mothers. The mean estimated infant exposures from breast milk to fluoxetine-norfluoxetine were 2.4% and 3.8% of the maternal weight-adjusted daily dose at age 2 weeks and age 2 months, respectively.
Outcomes:
|
Clearly defined groups: No
Selection bias: Possibly
Adequate exposure assessment method: Yes
Method of assessing the outcome appropriately: Outcome is concentration of the drug in the breastmilk, not a clinically relevant outcome.
Impactassessor blinded: not reported
Selective loss to follow up:
Identification confounders and correction in analysis: Smoking and Alcohol use were registered.
Funding: not reported
Other: 5% comedication but occasionally |
|
Lee, 2004 |
Prospective cohort study
N=74 |
Inclusion: Cases: mothers contacting the Motherisk program between January 1999 and May 2001 regarding the safety of citalopram during breast-feeding were followed up. Those women who were undergoing citalopram therapy while breastfeeding were placed in group 1. Controls: Those women who opted not to use the drug (regardless of whether they decided on a different form of pharmacologic treatment for their depression) were placed in group 2 (diseasematched control subjects).
A healthy control group of women, who contacted the program regarding nonteratogenic exposures and short-term exposures that were known to be compatible with breast-feeding, were enrolled in group 3. These were matched to their group 1 counterparts by maternal age and parity.
Comparability: Characteristics were comparable in all three groups (no significant difference in maternal age, parity, ecucation level, marital status, income, gestational age, birthweight, age at follow-up, breastfeeding duration and the age the formula was introduced) |
group 1: women who were depressed and were undergoing citalopram therapy,
N=31
Avarage dose: 25.3±11.4 mg per day
Mean duration of infant exposure to citalopram through the breast milk: 4.8±3.9 months. |
group 2: women who were depressed but were not undergoing citalopram therapy (but 7 of 12 women were receiving a different SSRI (paroxetine n=3, sertraline n=2, fluvoxamine n=1 and fluoxetine n=1)
N=12
group 3: healthy women who were matched to group 1 by maternal age and parity.
N=31 |
adverse events, defined as “any clinical events in the infants for which they may or may not have sought medical attention”.
Telephone interviews using standardized questionnaires.
Confirmation by direct contact with the physicians’ offices. |
No statistically significant difference in the rate of adverse events in the three Groups: - group 1: 3/31 events - group 2: 0/12 events - group 3: 1/31 events
Group 1: one case each of: - colic - decreased feeding, and - irritability/restlessness The symptoms were considered nonspecific and insignificant by the physicians and medical intervention was not required.
In the case of irritability and restlessness, the symptoms were noted after the mother commenced citalopram therapy at 2 months after delivery. Although the physical examination was unremarkable and no medical intervention was needed, breast-feeding was discontinued 2 weeks after the start of therapy, and the symptoms in the infant subsided.
Group 3: One mother described ‘gassiness’ |
Clearly defined groups: yes
Selection bias: selected population (women who called for information), but not likely to cause bias.
Adequate exposure assessment method: Telephone interview
Method of assessing the outcome appropriately: women were asked to report events. Possible bias
Impactassessor blinded: No (mother)
Follow-up: adequate (although by phone)
Selective loss to follow up: Unlikely
Identification confounders and correction in analysis: No, smoking/alcohol/drug use were not reported.
Funding: No conflict of interest
Other: small study population, power? |
|
Oberlander, 2005 |
Prospective cohort study
|
Inclusion: Mothers and their infants in the control group were eligible if: - no psychotropic or antidepressant medication use during the pregnancy - the pregnancy was term(37–42 wks) - no history of maternal mental illness.
The original criteria for inclusion in the newborn pain study was: - a birth weight ≥2500 g and/or - ≥37 weeks’ gestational age at birth - absence of other prenatal psychotropic drug exposure - congenital heart defects, and/or - central nervous system lesions.
Clonazepam (CL) exposure was included in the analysis as a covariate (based on earlier outcomes when no significant difference in behavior was found) |
(1) infants with prenatal SSRI exposure alone Total n = 11; - fluoxetine, n= 2 - paroxetine, n =9
(2) infants with prenatal and postnatal SSRI (via breast milk) exposure Total n= 30; - fluoxetine, n= 6 - paroxetine, n= 20 - sertraline, n =4
|
(3) control infants (n =22; nonexposed) |
1. Biobehavioral responses to acute procedural pain at 2 months of age
(-> Comparing Facial action (Neonatal Facial Coding System) and cardiac autonomic reactivity derived from the respiratory activity and heart rate variability (HRV) responses to a painful event (heel-lance))
2. Measures of maternal mood and drug levels were also obtained, and BSID-II were administered at ages 2 and 8 months.
At the 2-month study, maternal mood was assessed by using the Hamilton Rating Scale for Depression |
Facial action increased in all groups immediately after the lance but was significantly lower in the pSE group during the lance period. HR among infants in the pSE and ppSE groups was significantly lower during recovery. Using measures of HRV and the transfer relationship between heart rate and respiration, exposed infants had a greater return of parasympathetic cardiac modulation in the recovery period, whereas a sustained sympathetic response continued in control infants. Although postnatal exposure via breast milk was extremely low when infant drug levels could be detected in ppSE infants, changes in HR and HRV from lance to recovery were greater compared among infants with levels too low to be quantified. Neither maternal mood nor the presence of clonazepam influenced pain responses. |
Clearly defined groups: Yes
Selection bias: No
Adequate exposure assessment method: Yes
Method of assessing the outcome appropriately: Not described.
Impactassessor blinded: Not mentioned
Follow-up: Adequate
Selective loss to follow up: Unlikely
Identification confounders and correction in analysis: No
Funding: No conflict of interest |
|
Weissman, 2004 |
Systematic review |
Electronic searches of MEDLINE, PreMEDLINE, Current Contents, Biological Abstracts, and PsycINFO from 1966 through July 2002 followed by bibliographic searches |
|
|
Infants with recent prenatal exposure and symptomatic infants included in case reports were analyzed separately. Infant plasma levels were standardized against the average maternal level for each drug. The average infant-maternal plasma ratio was calculated for each drug, and correlations of infant plasma level to maternal dose, maternal plasma level, and breast milk level were calculated.
|
Paroxetine and sertraline usually produce undetectable infant levels. Of drugs currently used, fluoxetine produces the highest proportion (22%) of infant levels that are elevated above 10% of the average maternal level. Based on smaller numbers, the data on citalopram indicate that it produces elevated levels in 17% of infants. The milk-to-plasma ratios for 11 antidepressants had a statistically significant negative association with the percentage of the drug bound to protein. |
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-12-2012
Beoordeeld op geldigheid : 01-10-2012
Binnen 5 jaar bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie in samenspraak met de NVVP en de NVK of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Gezien de opzet van de richtlijn, kan bij bekend worden van relevant onderzoek, waarbij (een deel van) de richtlijn zou moeten worden aangepast, dit tussentijds per uitgangsvraag plaatsvinden.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd door de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS)
Doel en doelgroep
Het doel van deze richtlijn is de onduidelijkheid en onzekerheid over het al dan niet continueren of aanpassen van de dosis van (specifieke) SSRI’s tijdens zwangerschap en/of lactatie te verminderen door het geven van informatie en aanbevelingen voor het gebruik van SSRI’s in deze periode en voor het beleid met betrekking tot de pasgeborene. Tevens wordt door het ontwikkelen van deze richtlijn multidisciplinaire samenwerking gestimuleerd, zodat zwangere vrouwen met psychische problemen en medicijngebruik gezamenlijk geëvalueerd en behandeld worden.
In principe geldt de richtlijn voor alle vrouwen met kinderwens, zwangere vrouwen en/of vrouwen die borstvoeding (willen) geven, bij wie er een indicatie bestaat voor behandeling met SSRI's of bij wie er reeds sprake is van SSRI-gebruik ongeacht de indicatie voor het SSRI-gebruik. Dit betekent expliciet dat de ernst of de aard van het onderliggende psychiatrische lijden hierbij niet in aanmerking wordt genomen.
De richtlijn kan worden gebruikt door alle zorgverleners die betrokken zijn bij de zorg voor vrouwen die SSRI’s gebruiken tijdens zwangerschap en/of lactatie maar is primair geschreven voor leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen: de Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging voor Psychiatrie.
Samenstelling werkgroep
- Dhr. dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter)
- Dhr. drs. A.J. Schneider, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam
- Mw. dr. I.L. van Kamp, gynaecoloog-perinatoloog, Leids Universitair Medisch Centrum, Leiden
- Mw. dr. M.P. Lambregtse-van den Berg, (kinder- en jeugd)psychiater, Erasmus MC, Rotterdam
- Mw. dr. I.M. van Vliet, psychiater, Leids Universitair Medisch Centrum, Leiden
- Mw dr. C.N. van der Veere, kinderarts, Wilhelmina Ziekenhuis, Assen
- Mw. dr. J.U.M. Termote, kinderarts-neonatoloog, Wilhelmina Kinderziekenhuis / Universitair Medisch Centrum Utrecht, Utrecht
- Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
- Mw. drs. M.M.J. Wiegerinck, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
- Mw. drs. C.A.L. van Rijn, richtlijnondersteuner Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Met dank aan:
Mw. Prof. L.T.W. de Jong-van den Berg, Mw. dr. F.F.T. Ververs, Mw. drs. A.G.B. te Winkel, Mw. dr. G.C.M.L. Page-Christiaens, Mw. drs. M.E. van Hoorn, dr. K.D. Liem, dr. B.A. Semmekrot en Mw. P. Kölling voor hun kritische beoordeling van deze richtlijn.
Belangenverklaringen
Het instituut waar mw. dr. I.M. van Vliet werkzaam is, ontving in het verleden een ‘unrestricted grant’ van de farmaceutische industrie voor basaal wetenschappelijk onderzoek. De overige werkgroepleden hebben geen belangen aan te geven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. Zie voor een voorbeeldformulier belangenverklaring bijlage 9.
De inhoud van de conclusies en aanbevelingen uit deze (concept)richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Inbreng patiëntenperspectief
Voor de ontwikkeling van een kwalitatief goede richtlijn is de input van patiënten nodig. Een behandeling moet immers ook voldoen aan de wensen en eisen van patiënten. Patiënten kunnen zorgverleners die een richtlijn ontwikkelen helpen om te begrijpen hoe het is om met een ziekte of aandoening te leven of om er mee geconfronteerd te worden. Op deze manier kan bij het ontwikkelen van een richtlijn beter rekening worden gehouden met de betekenis van verschillende vormen van diagnostiek, behandeling en zorg voor patiënten. Het in kaart brengen van de behoeften, wensen en ervaringen van patiënten biedt tevens de gelegenheid om de knelpunten beter in kaart te brengen en te accentueren in de richtlijn. Het is dus zinvol om voor verbetering van de kwaliteit van de behandeling ook knelpunten vanuit het patiëntenperspectief in kaart te brengen.
Bij de ontwikkeling van deze richtlijn is er in de beginfase een knelpuntenanalyse gemaakt door middel van een groepsinterview met een patiëntengroep (focusgroep) van vrouwen die SSRI’s gebruikten of hadden gebruikt tijdens zwangerschap en/of lactatie. Het verslag van deze focusgroepbijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten eruit zijn geadresseerd in de richtlijn. Niet alle knelpunten waren direct van toepassing op deze richtlijn, daarom wordt verwezen naar het focusgroepverslag voor het totale overzicht (zie hieronder).
De richtlijn is in de conceptfase voor commentaar voorgelegd aan de deelnemers van de focusgroep.
Patiëntenparticipatie – Focusgroep verslag
Richtlijn “SSRI-gebruik in de zwangerschap en tijdens de lactatie”
Verslag focusgroep bijeenkomst op zaterdag 10 april 2010.
In dit document worden de aandachtspunten die volgden uit het focusgroep gesprek van 10 april 2010 op een rijtje gezet.
Doel van het focusgroep gesprek:
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen, die SSRI’s gebruiken in en om de zwangerschap, patiënt gerichter kan.
Deelneemsters aan het focusgroep gesprek:
Er bestaat tot dusver geen patiëntenvereniging specifiek voor deze doelgroep. Voor het organiseren van de focusgroep werden daarom via werkgroepleden patiënten gevraagd deel te nemen, die de polikliniek bezochten en tot de doelgroep behoorden, evenals patienten die een zwangerschap hadden doorgemaakt met SSRI gebruik (maximaal vijf jaar geleden). Er namen in totaal 7 vrouwen deel, van wie er 6 ten tijde van het gesprek zwanger waren. Er waren drie vrouwen die een eerdere zwangerschap met gebruik van SSRI’s hadden doorgemaakt.
De gespreksstructuur:
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken: preconceptioneel, gedurende de zwangerschap, de partus, het kraambed, de lactatie periode, en de nazorg. Onderstaand staan de aandachtspunten gegroepeerd naar algemene punten, punten voor het het diagnostische proces, de voorlichting, behandeling en nazorg. Als laatste staan aandachtspunten beschreven die gericht zijn aan huisartsen.
Algemene punten, voor verbetering van het multidisciplinaire zorgproces:
- Bovenaan staat: vanaf het moment dat sprake is van zwangerschapswens eenduidige informatie door de verschillende zorgverleners, waaronder psychiater, gynaecoloog, kinderarts, verloskundige en de huisarts. De meeste deelnemers hebben vervelende ervaring met verschillende uitspraken door verschillende zorgverleners, wat vooral gezien de onderliggende problematiek bij deze vrouwen erg onwenselijk is en tot extra zorgen leidt.
- Er wordt aangegeven dat het fijn zou zijn als er kortere lijnen zijn tussen de verschillende zorgverleners. Contact opnemen met elkaar alvorens een besluit te nemen over wel of geen medicatie, wisselen van medicatie etc. met wederom als doel: (na onderling overleg) eenduidige informatie(en behandeling) verstrekken aan de patiënt.
- De deelnemers benadrukken dat de informatievoorziening t.a.v. SSRI gebruik en zwangerschap in ieder geval zou moeten worden verstrekt door degene die de medicatie heeft voorgeschreven. Als de zwangerschapswens er is, dan zou er een preconceptioneel consult moeten plaatsvinden met degene die de zwangerschap gaat begeleiden.
- Veel vrouwen zoeken voor informatie op internet onder andere omdat zij ervaren dat de informatievoorziening nogal eens beperkt is. Naast dat het niet duidelijk is waar informatie gevonden kan worden, leidt het soms ook tot onrust. Allen zijn het erover eens dat het belangrijk is dat de beroepsgroep ook zorg zou dragen voor betrouwbare informatie via internet. Er is ook behoefte aan een vertaling van de richtlijn die kan dienen als patiënteninformatie.
- Belangrijkste punten waarover vanaf preconceptie eenduidige informatie over verstrekt zou moeten worden zijn:
- wel of niet door blijven gebruiken in de zwangerschap,
- effecten van medicatie op het kind,
- (is een geavanceerde echo geïndiceerd, en zo ja waarom. )
- moet je in het ziekenhuis bevallen,
- wat gebeurt er na de bevalling met je kind (blijven ter observatie? zo ja hoe lang, en bij moeder of op medium-care, en waarom),
- kan borstvoeding veilig gegeven worden.
- Het komt dus neer op eenduidigheid, kennis en vertrouwen uitstralen.
Specifieke aandachtspunten per zorgmoment:
Preconceptioneel:
- Zie bovenstaande punten. Al vanaf moment dat er zwangerschapswens is eenduidige informatie verstrekken over wat de het huidige gebruik van SSRI’s voor gevolgen heeft voor het verdere traject.
- Een van de zorgen die de deelnemers aangeven is of de aandoening waarvoor de medicatie gebruikt wordt, ook over zal gaan op het kind. Bespreken (gebeurt over het algemeen al door psychiater).
Begeleiding gedurende de zwangerschap
- Er is de wens dat de zwangerschapsbegeleiding plaats vindt door een behandelaar (gynaecoloog) die als specifieke aandachtsgebied de psychiatrie heeft.
- Zo zou er voldoende bekend moeten zijn over de verschillende onderliggende ziektebeelden waarvoor SSRI’s gegeven worden. Meer rekening houden dat er bij deze patiënten een indicatie is voor SSRI gebruik en dus ook sprake is van een onderliggende aandoening.
- Deelnemers hebben de ervaring dat zorgverleners die de zwangerschap begeleiden vaak meer gericht zijn op het kind dan op de vrouw: er zou meer aandacht mogen zijn voor de invloed van de zwangerschap op de moeder en de behandeling van moeder.
- Bewust zijn van communicatie naar patiënt toe. Hebben vaak al een lang traject doorgemaakt van overwegingen rondom deze zwangerschap. Sommige van de deelnemers hebben het gevoel gehad veroordeeld te worden door de zorgverlener “Dat is iemand die voor zichzelf kiest en zomaar medicatie slikt”. (geldt ook postpartum, kindergeneeskunde)
- De rol van de partner wordt als erg belangrijk bestempeld. Niet alleen is het ook voor hem van belang om te weten van de gevolgen voor het kind zijn, maar ook heeft hij een signaalfunctie en kan hij de stemming van de vrouw goed inschatten. Tevens geeft het rust als de vrouw wanneer zij op enig moment bezorgd is ook bij haar man terecht kan. Allen zijn van mening dat het goed zou zijn als de zorgverlener de vrouw er op attendeert haar partner mee te nemen bij de consulten en te betrekken bij de zorg.
- Op de vraag of het de deelnemers zou afschrikken wanneer zwangerschapscontrole op een spreekuur zou worden gepland speciaal voor vrouwen met psychiatrische problematiek, wordt wisselend gereageerd. Er zijn er die het prettig zouden vinden vanwege de zorg op maat, terwijl het voor anderen zou afschrikken gezien het stigma en het feit dat je mogelijk gezien wordt daar terwijl deze problematiek niet bij je omgeving bekend is.
- Er bestaat onduidelijkheid over de gevolgen van het missen van een aantal doses SSRI’s door foutieve inname of door zwangerschapsbraken. Dit kan ook tot zorgen leiden.
De partus
- Er zou meer aandacht mogen zijn voor de specifieke zorg van vrouwen voor de individuele bevalsituatie, en bij het kraambed. Deze situaties kunnen juist voor vrouwen met bijvoorbeeld een angststoornis extra traumatiserend zijn. Ook hier geldt graag een gynaecoloog met specifieke ervaring met deze groep vrouwen.
Post-partum/Kraamperiode
- Unaniem wordt genoemd dat de richtlijn een uitspraak zou moeten doen over hoe de observatie postpartum zou moeten plaatsvinden. Het gaat hierbij vooral om (wederom) een eenduidig en helder beleid zodat de vrouw van begin af aan weet waar ze aan toe is.
- Als het kindje geboren wordt en opgenomen wordt ter observatie is het van belang dat de behandelaars beseffen dat het kindje daar alleen geobserveerd wordt en dus in principe niet ziek is, zodat er geen onnodige behandelingen worden uitgevoerd (voorbeeld: kind had een keer het flesje niet opgedronken en kreeg meteen een neussonde). Dit kan juist bij vrouwen met een psychische stoornis tot paniek leiden.
Lactatie
- Voor wat betreft de borstvoeding geldt ook de eenduidige informatie en de behoefte van de patiënt om hierop een duidelijk antwoord te krijgen, of als deze er niet is, samen met de zorgverleners een afgewogen besluit te kunnen maken. Hierbij zijn in ieder gevalde volgende aspecten van belang overwegen de effecten van de medicatie op het kind (stapeling), de hechting tussen moeder en kind, en de mogelijkheid om ’s nachts door te slapen als geen borstvoeding gegeven wordt.
Nazorg
- Een ander belangrijk punt waar zorgen over zijn is de kraamzorg. Er is behoefte aan specialistische kraamzorg en onduidelijkheid hierover kan al vanaf vroeg in de zwangerschap tot zorgen leiden.
Methode ontwikkeling
Evidence based
Implementatie
Een relatief groot deel van vrouwen in de fertiele levensfase worden behandeld met SSRI’s. De richtlijn ‘SSRI-gebruik in de zwangerschap en tijdens de lactatie’ biedt handvatten voor een eenduidig en wetenschappelijk onderbouwd praktisch beleid. In het onderstaande wordt een overzicht gegeven van de belangrijkste, door de opstellers van deze richtlijn voorziene, knelpunten bij de toepassing van de richtlijn in de dagelijkse praktijk. Voor een effectieve implementatie is een voortvarende aanpak van deze knelpunten essentieel. Tevens worden een drietal potentiele indicatoren aangegeven waarmee de implementatie van de richtlijn in de praktijk kan worden gevolgd.
Knelpunten op gebied van de organisatie van de zorg
De richtlijn doet geen uitspraak over of de zwangere vrouw met SSRI-gebruik moet worden gevolgd. In de eerste, tweede of derde lijn. Dit zal afhangen van de onderliggende psychiatrische aandoening en andere medische problemen. Essentieel is dat hoe de zwangerschapscontroles zullen worden georganiseerd wordt vastgelegd in een individueel behandelplan in het begin van de zwangerschap. Bij het opstellen van dit behandelplan dient naast de huisarts, 1e-lijns verloskundige en gynaecoloog ook de psychiater betrokken te zijn.
De effecten van SSRI-gebruik tijdens de zwangerschap op het kind zijn korte- en lange termijn effecten, die te onderscheiden zijn in aangeboren afwijkingen, neonatale ontrekkingsverschijnselen en PPHN. Met betrekking tot het laatste aspect wordt in de richtlijn gesteld in het ziekenhuis dan wel geboortecentrum te bevallen, waar reanimatie mogelijkheden voor de pasgeborene zijn. Er dient dan ook rekening gehouden te worden met een toename van het aantal (poli)klinische bevallingen.
Observatie van de pasgeborene om tekenen van PPHN op te sporen kan gebeuren op de afdeling verloskunde onder begeleiding van de kinderarts gedurende minimaal 12 uur. Dit betekent dat een goede overdracht moet plaatsvinden voor de observatie periode.
Met betrekking tot het optreden van aangeboren afwijkingen is de vorming van een (landelijke) database van groot belang. Alleen op deze manier kan inzicht worden verkregen in de ‘exacte’ bijwerkingen van deze medicatie op het ongeboren kind.
Zorginstellingen
Het advies om minimaal met de 1e-lijns verloskundige in het ziekenhuis of een geboortecentrum te bevallen, zal extra capaciteit vragen van de zorginstellingen. Aan de andere kant zal het verblijf in het kraambed, dat in veel ziekenhuizen 48-72 uur bedroeg, teruglopen, gezien de aanbeveling van een minimale observatie periode van 12 uur.
Zorgverlener
Het merendeel van de vrouwen in de fertiele levensfase die SSRI’s gebruiken, wordt behandeld in de huisartsenpraktijk. Een kleiner deel wordt behandeld door psychiaters. Tot op heden was niet helemaal duidelijk of en door wie deze patiënten zouden moeten worden voorgelicht over een (geplande) zwangerschap. De richtlijn adviseert patiënten hiervoor te verwijzen naar artsen die specifieke kennis op dit gebied hebben. Een lijst van centra waar deze expertise in ieder geval aanwezig is, is te vinden op de website van het recent opgerichte ‘Landelijk Kenniscentrum Psychiatrie en Zwangerschap’.
Aan het begin van de zwangerschap wordt in een multidisciplinair overleg een behandelplan opgesteld. Een dergelijk overleg zal via de Verloskundige Samenwerkingsverbanden moeten verlopen. De psychiater maakt (nog) geen deel uit van dit gremium. Hierover dienen zo spoedig mogelijk regionale afspraken gemaakt te worden tussen psychiater en VSV.
Door verkorting van de observatie periode in het ziekenhuis zullen kraamverpleegkundigen vaker geconfronteerd worden met pasgeborenen met neonatale onttrekkingsverschijnselen. Goede voorlichting en scholing voor deze beroepsgroep is obligaat.
De patiënten zijn erbij gebaat dat de adviezen uit deze richtlijn goed worden gecommuniceerd naar alle betrokkenen, zowel zorgverleners als patiënten. Een communicatie plan op landelijk niveau (op te stellen door de verschillende wetenschappelijke verenigingen) en op regionaal niveau (op te stellen door de VSV’s) is derhalve van veel belang.
Indicatoren
Is de psychiater betrokken geweest bij het opstellen van het individuele behandelplan? Of in welk percentage is een psychiater betrokken geweest bij het opstellen van het individuele behandelplan
Percentage vrouwen met SSRI-gebruik in de zwangerschap dat in het ziekenhuis/geboortecentrum bevalt?
Percentage vrouwen met SSRI-gebruik in de zwangerschap dat meer dan 12 uur na de bevalling in het ziekenhuis/geboortecentrum blijft?
Werkwijze
Methode richtlijnontwikkeling
Deze richtlijn is opgesteld aan de hand van het ‘Appraisal of Guidelines for Research & Evaluation’ (AGREE-II) instrument (www.agreetrust.org). Dit is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen. Bovendien werd gekozen om -volgens de meest recente ontwikkelingen op het gebied van richtlijnen - de methode toe te passen van The Grading of Recommendations Assessment, Development and Evaluation (GRADE) voor het graderen van de kwaliteit van bewijs en de sterkte van de aanbevelingen. Voor deze methode werd gekozen omdat naast de grootte van studies hierbij ook de kwaliteit van het onderzoek in de beoordeling wordt meegenomen. Formeel is de GRADE methode ontworpen voor het beoordelen van onderzoek naar interventies. Daarom werd afgezien van het aangeven van de sterkte van de aanbevelingen en werd alleen de kwaliteit van bewijs in de richtlijn vermeld.
Literatuur zoekstrategieën
Er werd eerst oriënterend gezocht naar bestaande richtlijnen (https://www.ahrq.gov/, http://www.nice.org.uk/, het cbo, en http://www.sign.ac.uk/ en naar systematische reviews in de Cochrane Library. Vervolgens werd er voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in de elektronische databases PubMed, Embase en PsychINFO van 1980 tot maart/april 2011 in de Engelse of Nederlandse taal. In verband met het verschijnen van belangrijke publicaties over de relatie tussen SSRI-gebruik en persisterende pulmonale hypertensie bij de pasgeborene werd voor deze onderzoeksvraag besloten de search te verlengen tot 1 februari 2012. Aanvullend aan de zoekopdracht in de elektronische databases werd handmatig gezocht naar onderzoeken aan de hand van de literatuurlijsten van de opgevraagde artikelen. De gebruikte zoekverantwoording staat vermeld in bijlage 4.
Uitkomstmaten
Bij de beoordeling van de literatuur heeft de werkgroep vooral gekeken naar onderzoeken waarbij, naar inzicht van de werkgroepleden, klinisch relevante uitkomstmaten gebruikt werden. Deze werden voorafgaand aan de literatuurselectie door de werkgroep bepaald en gedefinieerd. Ook de meetinstrumenten die volgens de werkgroep relevant en acceptabel (valide) waren voor het meten van de uitkomstmaten werden vooraf vastgesteld.
Onderstaand is een overzicht van door de werkgroep opgestelde klinisch relevante uitkomstmaten en daarbij opgestelde geaccepteerde meetinstrumenten met klinisch relevante afkappunten:
|
Tabel 1.2 |
|
|
Uitkomstmaten |
Operationalisatie |
|
Complicaties bij de zwangere/moeder |
|
|
spontane miskraam |
frequentie voorkomen |
|
hypertensieve complicaties |
frequentie voorkomen |
|
diabetes gravidarum |
frequentie voorkomen |
|
intrauteriene vruchtdood (IUVD) |
frequentie voorkomen |
|
maternale sterfte |
frequentie voorkomen (gedefinieerd tot 1 jaar na partus) |
|
Complicaties tijdens de baring |
|
|
kunstverlossingen |
frequentie voorkomen |
|
sectio’s |
frequentie voorkomen |
|
inleiding van de baring |
ja/nee |
|
bloedverlies bij de partus |
≥ 1000 ml (volgens definitie fluxus WHO) en continue uitkomsten |
|
Complicaties bij het kind: korte termijn |
|
|
congenitale afwijkingen |
ja/nee |
|
neonatale effecten |
|
|
zwangerschapsduur |
<37 weken (<32 weken) en >42 weken, continue uitkomsten |
|
geboortegewicht |
<p10 of >p90 en continue uitkomsten |
|
APGAR score |
<7 na 5 minuten en continue uitkomsten |
|
pH navelstrengarterie |
<7,00 (geen continue uitkomsten) |
|
opname op de NICU |
ja/nee |
|
opname op de kinderafdeling (niet NICU) |
ja/nee |
|
persisterende pulmonale hypertensie |
ja/nee (NB is klinische diagnose) |
|
verlengd QTc-interval |
ja/nee |
|
neonatale onttrekkingsverschijnselen/intoxicatie |
ja/nee (voedingsproblemen, prikkelbaarheid, tremor, tonusafwijkingen, slaapproblematiek, hypothermie, respiratory distress) |
|
Complicaties bij het kind: lange termijn (definitie: vanaf 2 jaar tot volwassen) |
|
|
motorische effecten |
BSID (Bayley), Aims |
|
emotionele, sociale en gedragseffecten |
CBCL (child behavior checklist), BSID, SST (strange situation procedure) |
|
cognitieve effecten |
IQ (continue maat) |
Literatuurselectie
Per uitgangsvraag werden twee werkgroepleden aangesteld om onafhankelijk van elkaar de literatuur te beoordelen op relevantie. Bij de eerste selectie op titel en abstract werden de volgende exclusiecriteria gehanteerd:
niet van toepassing op de vraagstelling
niet vergelijkbaar met de Nederlandse populatie
niet-gedefinieerde uitkomstmaat
geen vergelijkende onderzoeken
minder dan tien vrouwen in de onderzoekspopulatie (wegens imprecisie)
meer dan 5% van de vrouwen andere psychofarmaca of andere co-medicatie gebruikten, waarvoor niet is gecorrigeerd
Beoordeling van de kwaliteit van onderzoeken
Na selectie door de werkgroepleden bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De geselecteerde artikelen werden vervolgens door de werkgroepleden beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de indeling gebruikt, zoals weergegeven in tabel 1.3.
De beoordeling van de verschillende artikelen vindt u in de verschillende teksten terug onder ‘Samenvatting literatuur’. De richtlijnondersteuners maakten in samenspraak met de subgroepen per hulpvraag evidence-tabellen van de geselecteerde individuele onderzoeken als hulpmiddel bij het beoordelen en samenvatten van deze onderzoeken. Vervolgens werd de kwaliteit van het bewijs van het totaal aan gevonden onderzoeken van de betreffende vraag en uitkomstmaat (‘body of evidence’) beoordeeld. Met de kwaliteit van het bewijs wordt bedoeld in hoeverre er vertrouwen is dat de aanbevelingen gebaseerd kunnen worden op de (effectschatting van de) evidence en de GRADE tabellen. Het wetenschappelijk bewijs werd vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld inclusief de GRADE gradering van bewijs.
Bij GRADE wordt de evidence per uitkomstmaat beoordeeld. De beoordeling wordt gedaan door het invullen van een evidenceprofiel. Alleen voor kritieke en/of belangrijke uitkomstmaten is een evidenceprofiel gemaakt. Er zijn in totaal vijf factoren die de kwaliteit van het bewijs per uitkomstmaat kunnen verlagen en drie factoren die de kwaliteit kunnen verhogen. Per factor kan de kwaliteit met een of twee niveaus omlaag gaan. Als het om een ernstige beperking gaat dan gaat de kwaliteit met een niveau omlaag; als het om een zeer ernstige beperking gaat dan gaat de kwaliteit met twee niveaus omlaag.
De verschillende typen onderzoek kunnen worden ingedeeld naar mate van bewijs. RCT’s zijn in beginsel van hogere methodologische kwaliteit dan observationele onderzoeken, omdat RCT’s minder kans op vertekening (bias) geven. In het GRADE systeem beginnen daarom RCT’s met hoge kwaliteit (4) en observationele onderzoeken met lage kwaliteit (2). Niet-vergelijkende, niet-systematische onderzoeken (zoals ‘caseseries’ en ‘casereports’) worden altijd gekwalificeerd als zeer lage kwaliteit. Een overzicht van de GRADE-indeling van kwaliteit van de onderzoeken per uitkomstmaat is weergegeven in tabel 1.3.
Tabel 1.3 GRADE-indeling van de kwaliteit van de onderzoeken per uitkomstmaat.
|
Kwaliteit |
Studiedesign |
Kwaliteit verlagen |
Kwaliteit verhogen |
|
Hoog (4) |
RCT |
Studiebeperkingen -1 ernstig -2 zeer ernstig Inconsistentie -1 ernstig -2 zeer ernstig Indirectheid -1 ernstig -2 zeer ernstig Imprecisie -1 ernstig -2 zeer ernstig Publicatiebias -1 waarschijnlijk -2 zeer waarschijnlijk
|
Groot effect +1 groot +2 zeer groot Dosis-respons relatie +1 bewijs voor relatie Plausibele confounding +1 zou het effect onderschatten +2 zou het effect overschatten als er geen effect was aangetoond
|
|
Matig (3) |
|
||
|
Laag (2) |
Observationele vergelijkend onderzoek (bijv. patiënt-controle onderzoek, cohort onderzoek) |
||
|
Zeer laag (1) |
Niet-systematische klinische observaties (bijv. ‘case studies’, ‘case reports’) |
RCT’s beginnen ‘hoog’ (4), observationele onderzoeken ‘laag’ (2).
Bij RCT’s: bijvoorbeeld 1 punt downgraden: dan van hoog (4) naar matig (3), 2 punten downgraden: dan van hoog (4) naar laag (2), 3 punten downgraden: dan van hoog (4) naar zeer laag (1).
Bij observationele onderzoeken: bijvoorbeeld 1 punt upgraden: dan van laag (2) naar matig (3).
Aangezien de GRADE systematiek niet geschikt is voor de beoordeling van case reports en case series werden deze studies niet geselecteerd. Review artikelen waarin een overzicht van dit soort studies worden vermeld, werden alleen geselecteerd als geen andere studies voorhanden waren.
Formuleren van aanbevelingen
Nadat de gegevens uit de GRADE tabellen waren samengevat als tekst werden hieruit conclusies getrokken. Om vervolgens tot een gewogen aanbeveling te komen werden de overige overwegingen besproken en geformuleerd. Dit is van belang omdat voor een aanbeveling naast het wetenschappelijke bewijs ook nog andere aspecten meegewogen horen te worden, zoals patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen en organisatorische aspecten. Bij de overwegingen spelen de ervaring en opvattingen van de werkgroepleden een rol. De ‘aanbevelingen’ geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en op de belangrijkste overwegingen. De gebruikte methodiek voor richtlijnontwikkeling verhoogt de transparantie van de totstandkoming van de aanbevelingen in deze richtlijn.
Bij het beoordelen van de literatuur werd de volgende tekortkoming vastgesteld. In wetenschappelijk onderzoek naar dit onderwerp wordt vaak gebruik gemaakt van door patiënten zelf ingevulde vragenlijsten waarbij symptomen uitgevraagd worden zonder deze in de bredere context van duur, beperkingen en bijkomende relevante factoren te plaatsen. Meer in het bijzonder zijn er weinig vragenlijsten die specifiek rekening houden met de zwangerschap als lichamelijke bron van angst- en depressieve klachten.
Samenvattend zouden voor de beoordeling van de klinische relevantie bij het beantwoorden van de deelvragen uit deze richtlijn idealiter onderzoeken opgenomen dienen te worden waarbij zwangere vrouwen onderzocht zijn met een angst- of depressieve stoornis, vastgesteld door een professional volgens de DSM-IV classificatie. Aangezien er tot nu toe niet tot nauwelijks onderzoeken zijn die aan deze voorwaarden voldoen, heeft de werkgroep voor de volgende hiërarchie gekozen in het wegen van onderzoeken met afnemende klinische relevantie:
Onderzoeken die gebruik hebben gemaakt van een gestructureerd psychiatrisch interview op basis van DSM-IV criteria afgenomen door een professional.
Hieronder vallen: Structured Clinical Interview for DSM (SCID), Research Diagnostic Criteria (RDC), Mini International Neuropsychiatric Interview (MINI)
Onderzoeken waarin gebruik werd gemaakt van een gestructureerd psychiatrisch interview op basis van DSM-IV criteria afgenomen door niet-professionals, dat wil zeggen getrainde leken.
Hieronder vallen: Composite International Diagnostic Interview (CIDI), Diagnostic Interview Schedule (DIS)
Onderzoeken waarin gebruik werd gemaakt van vragenlijsten met tijdens de zwangerschap gevalideerde klinische afkappunten overeenkomend met diagnosen op basis van DSM-IV.
Hieronder vallen: Beck Depression Inventory (BDI), Edinburgh (Postnatal) Depression Scale (E(P)DS), General Health Questionnaire (GHQ), State Trait Anxiety Inventory (STAI)
Onderzoeken waarin gebruik werd gemaakt van gevalideerde vragenlijsten die een continue schaal van angst of depressie meten, waarbij vooral een uitspraak gedaan kan worden over de dosis-respons relatie.
Hieronder vallen: de Center for Epidemiologic Studies Scale (CES-D), de Hospital Anxiety and Depression Scale (HADS) en de Hamilton Depression Rating Scale (HAMD-17).
Alle conclusies en aanbevelingen werden plenair in de vergaderingen van de werkgroep besproken, waarbij door consensus tot een concepttekst werd gekomen. Indien dit niet mogelijk bleek, werd door meerderheid van stemmen de uiteindelijke concepttekst bepaald. Uiteindelijk waren alle werkgroepleden accoord met de voorliggende conceptteksten.
Zoekverantwoording
Hoofdstuk 6 Lactatie en SSRI-gebruik
|
Onderwerp: Lactatie |
Database |
Zoekstrategie |
Aantal ref. |
|
Welke SSRI’s hebben de voorkeur voor gebruik in de zwangerschap met betrekking tot het risico op late gevolgen op motoriek, cognitie, gedrag en sociaal emotionele ontwikkeling bij het kind? In hoeverre worden SSRI’s uitgescheiden in de borstvoeding (per middel, dosering en tijdstip)? Wat zijn de vroege neonatale effecten (van SSRI-bevattende borstvoeding op het kind)? Wat zijn de lange termijn effecten van SSRI-bevattende borstvoeding op het kind? Is er een verschil in associatie tussen gebruik van verschillende SSRI’s tijdens de lactatie en effecten op het kind?Welke SSRI‘s hebben de voorkeur voor gebruik tijdens de lactatieperiode? |
Medline (OVID) 1980- april/mei 2011 Engels, Nederlands
1e search maart 2010
PsycInfo (OVID)
Embase (Elsevier)
|
SSRI zie 5.1. 6 Breast Feeding/ (21461) 7 Lactation/ (28954) 8 ("breast feeding" or lactation or breastfeeding* or breast-feeding*).ti,ab. (37662) 9 6 or 7 or 8 (60432) 19 exp Child Development/ (37070) 20 exp infant, newborn, diseases/ or neonatal abstinence syndrome/ (137685) 21 convulsions.ti,ab. or Seizures/ or Startle Reaction.ti,ab. or Tremor/ or (tremor* or seizure*).ti,ab. (101496) 22 exp Sleep Disorders/ (45946) 23 Crying/ (1761) 24 "excessive crying".ti,ab. (114) 25 "neonatal tremor*".ti,ab. (2) 26 Hypothermia/ (7492) 27 Muscle Hypotonia/ (2239) 28 Vomiting/ (16864) 29 "Feeding and Eating Disorders of Childhood"/ (187) 30 exp Respiratory Distress Syndrome, Newborn/ (12291) 31 exp Hypertension, Pulmonary/ (20242) 32 exp Infant, Newborn/ (435684) 33 (infant or neonat*).ti,ab. (243743) 34 32 or 33 (556237) 35 or/21-31 (205772) 36 Motor Activity/de [Drug Effects] (26010) 37 exp Psychomotor Disorders/ (9186) 38 Nervous System Diseases/ or Autistic Disorder/ or Child Development Disorders, Pervasive/ or Developmental Disabilities/ or Attention Deficit Disorder with Hyperactivity/ (67517) 39 exp mental disorders diagnosed in childhood/ (119318) 40 exp Motor Activity/ (88315) 41 exp Child Behavior/ (11473) 42 exp Intelligence/ (66140) 43 exp Child Development/ (37070) 44 or/19-31 (360999) 45 36 or 37 or 38 or 40 or 42 (225975) 46 44 or 45 (571373) 47 34 and 46 (112228) 48 Milk, Human/me [Metabolism] (1779) 49 pharmacokinetics.fs. (197455) 50 20 or 25 or 29 or 30 or 41 or 43 (182786) 51 47 or 50 (200057) 52 48 or 49 or 51 (397829) 53 9 and 18 and 52 (74) 55 limit 54 to (yr="1980 -Current" and (dutch or english)) (69) 56 Systematische review (zoekfilter) > 6 refs. 85 55 not 56 (63) 86 from 85 keep 1-63 (63) April/mei 2011: 1 nieuwe titels SSRI zie 5.1 5. Breast Feeding/ 6. Lactation/ 7. ("breast feeding" or lactation or breastfeeding* or breast-feeding*).ti,ab. 8. 5 or 6 or 7 18. exp Childhood Development/ 19. drug withdrawal/ 20. convulsions.ti,ab. or Seizures/ or Startle Reaction.ti,ab. or Tremor/ or (tremor* or seizure*).ti,ab. 21. (neonatal adj3 withdrawal adj3 syndrome*).ti,ab. 22. exp Sleep Disorders/ 23. Crying/ 24. "excessive crying".ti,ab. 25. "neonatal tremor*".ti,ab. 26. Hypothermia/ 27. Hypotonia.ti,ab. 28. Vomiting/ 29. exp feeding disorders/ 30. (exp bottle feeding/ or exp breast feeding/) and disorder*.mp. [mp=title, abstract, heading word, table of contents, key concepts, original title, tests & measures] 31. exp Respiratory Distress/ 32. (Pulmonary adj hypertension).ti,ab. 33. exp neonatal disorders/ 35. (infant or neonat*).ti,ab. or exp neonatal period/ 36. 34 or 35 37. or/20-30 40. exp pervasive developmental disorders/ or exp developmental disabilities/ or exp attention deficit disorder/ 41. exp childhood development/ or exp developmental stages/ or exp motor development/ or exp perceptual development/ or exp physical development/ or exp psychological development/ or exp psychomotor development/ or "Cognitive & Perceptual Development ".cc. 42. exp Motor processes/ 43. exp Child Behavior/ 44. exp Intelligence/ or intelligence quotient/ 45. exp developmental disabilities/ or exp delayed development/ or exp learning disorders/ or exp mental retardation/ or exp nervous system disorders/ 46. or/18-30 47. 38 or 39 or 40 or 42 or 44 48. 46 or 47 49. 36 and 48 52. 19 or 25 or 29 or 31 or 43 or 45 53. 49 or 52 54. 50 or 51 or 53 55. 8 and 17 and 54 56. 8 and 17 and 54 57. limit 56 to (yr="1980 -Current" and (dutch or english)) 58. zoekfilter SR 87. 18 or 21 or 24 or 25 or 30 or 33 or 40 or 43 88. 19 or 20 or 22 or 23 or 24 or 26 or 27 or 28 or 29 or 32 or 40 or 42 or 44 89. 36 and 88 90. 87 or 89 91. pharmokinetics.mp. 92. risk.mp. or exp Risk Factors/ 93. exp "Side Effects (Drug)"/ 94. symptoms/ 95. 94 and 36 96. 90 or 91 or 92 or 93 or 95 97. 17 and 96 98. 8 and 97 99. limit 98 to ((dutch or english) and yr="1980 -Current") 100. 85 and 99 101. 99 not 100 102. limit 101 to "0110 peer-reviewed journal" 103. limit 98 to ((dutch or english) and yr="2010 -Current") > 88, 77 unieke referenties > April/mei 2011: 6 nieuwe titels
'serotonin uptake inhibitor'/exp/mj OR fluoxetine:ti OR paroxetine:ti OR sertraline:ti OR citalopram:ti OR escitalopram:ti OR fluvoxamine:ti OR serotonin NEAR/5 inhibitor* OR ('5 ht':ti AND inhibitor*:ti) OR ssri*:ti AND ('newborn disease'/exp/dm_et,dm_si,dm_cn OR 'child development'/exp/mj OR 'neonatal symptoms':ab,ti OR 'neonatal adaptation':ab,ti OR 'newborn vomiting'/exp OR 'neonatal stress'/exp OR 'neonatal weight loss'/exp OR (convulsion*:ab,ti OR tremor*:ab,ti OR seizure*:ab,ti OR vomiting:ab,ti OR 'excessive crying':ab,ti OR hypothermia:ab,ti OR hypotonia:ab,ti OR 'respiratory distress syndrome':ab,ti OR 'pulmonary hypertension':ab,ti AND ('newborn'/exp OR infant*:ab,ti OR neonat*:ab,ti)) OR 'learning disorder'/exp OR 'prenatal exposure'/exp OR 'autism'/exp OR 'developmental disorder'/exp OR 'attention deficit disorder'/exp OR 'behavior disorder'/exp OR 'psychomotor disorder'/exp OR 'neurologic disease'/exp OR 'motor activity'/exp OR 'child behavior'/exp OR 'intelligence'/exp OR 'child development'/exp OR 'side effect'/exp OR 'environmental exposure'/exp) AND ('breast feeding':ti OR breastfeeding* OR lactation:ti OR 'breast feeding'/exp/mj OR 'lactation'/exp/mj) AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [1980-2010]/py
109 referenties, 82 uniek April/mei 2011: 7 nieuwe titels, 6 uniek
|
228 (2010) + 13 (2011) |
