Kwaliteitsdocument Fysieke training bij Spinale Musculaire Atrofie type 2 en 3
Uitgangsvraag
What recommendations contribute to the maintenance or improvement of physical fitness in ambulant and non-ambulant patients with SMA 2/3?
In Dutch: Welke adviezen dragen bij aan behoud danwel verbeteren van fysieke fitheid bij ambulante en niet-ambulante patiënten met SMA 2/3?
Aanbeveling
Overweeg fysieke training bij patiënten met SMA om een hulpvraag van de patiënt op het gebied van fysieke fitheid te beantwoorden, achteruitgang door inactiviteit tegen te gaan, of het effect van medicamenteuze behandeling te vergroten.
Verhoging van de frequentie van het individuele fysieke trainingsprogramma dient geleidelijk plaats te vinden op basis van ervaren belasting van de individuele patiënt.
Zorg voor intensieve monitoring van patiënten met SMA bij het uitvoeren van een fysiek trainingsprogramma om mogelijke symptomen van overtraining zoals overmatige vermoeidheid en vermoeibaarheid, (spier)pijn tijdig te herkennen en daar het programma op aan te passen.
Overleg met het regionale revalidatie spierziekten team en/of het SMA Centrum Nederland bij het opstellen van een nieuw fysiek trainingsprogramma voor een patiënt met SMA.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de vergelijking van training met reguliere zorg voor ambulante en niet ambulante patiënten met SMA type 2 en 3. Er werd één SR geïncludeerd met daarin één RCT bij ambulante patiënten met SMA type 3. In deze studie werd gedurende zes maanden één groep liet trainen door een persoonlijk spierversterkingsprogramma samen met een ergometrie aerobe oefenprogramma met een zitfiets thuis in vergelijking met een controlegroep die reguliere zorg ontving. Op geen van de uitkomstmaten werd een klinisch relevant verschil gevonden. De bewijskracht is laag. Voor SMA type 2 is er geen literatuur gevonden.
Recente studies laten zien dat veel mensen met SMA last hebben van vermoeibaarheid, het niet kunnen volhouden van repeterende activiteiten van het dagelijks leven zoals schrijven, het herhaaldelijk optillen van een glas, rijden in een rolstoel en lopen (Bartels, 2020). Spierzwakte en een gestoorde neuromusculaire overgang spelen een rol bij vermoeibaarheid maar ook de metabole functie wordt onderzocht (Bartels, 2021) (Habets, 2022) (Zilio, 2022). Het effect van Disease Modifying Treatment (DMT) op vermoeibaarheid is nog niet duidelijk, maar er zijn aanwijzingen dat Pyridostigmine een positief effect heeft op het uithoudingsvermogen (Stam, 2023). Aangezien fysieke training ook bestaat uit repeterende inspanning is toename van vermoeibaarheid tijdens en na inspanning een reële bijwerking. Om het risico op overmatige vermoeibaarheid en onveilige situaties, lees valrisico, onveilige transfers etc., te minimaliseren is geleidelijke opbouw en frequente monitoring een vereiste. Op basis van consensus zijn internationale standards of care voor SMA zorg gedefinieerd (Mercuri, 2018). Advisering vanuit het regionale revalidatie spierziekten team of het Nederlands SMA Centrum wordt hierbij sterk aanbevolen. Ook kan de brochure fysiotherapie voor SMA geraadpleegd worden (SpierziektenNederland, 2024).
Voor de subgroep non-ambulante patiënten met SMA (SMA type 2) is de mate van bewijs zeer beperkt doordat er bij deze groep geen gerandomiseerde gecontroleerde studies zijn uitgevoerd. Op basis van expert opinion en enkele ongecontroleerde studies wordt echter verondersteld dat ook voor deze subgroep, mits er sprake is van stabiele respiratoire situatie, fysieke training haalbaar is en van meerwaarde kan zijn voor het behoud van fysiek functioneren (Mercuri, 2018).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is wenselijk dat de beslissing om te starten met fysieke training en de beslissing over de inhoud van het programma worden genomen door de zorgprofessional en de patiënt samen. Hierbij dienen de hulpvraag van de patiënt, persoonlijke factoren (o.a. motivatie, ziektestatus, instrueerbaarheid) en externe factoren (o.a. vervoer, dagindeling, mantelzorg) meegenomen te worden in de beslissing. Belangrijke doelen voor de patiënt kunnen liggen op het gebied van dagelijks functioneren (zelfverzorging, verplaatsing, werk, hobby’s, sport), fysieke en mentale gezondheid.
Een belangrijke afweging voor patiënten in het algemeen is of de mogelijk voordelen opwegen tegen de nadelen zoals extra tijdsinvestering, kosten en beschikbaarheid van vervoer.
Het is belangrijk om de onzekerheid over de mate en type van effect van fysieke training en de mogelijke bijwerkingen zoals overmatige vermoeibaarheid vooraf te bespreken. De inhoud van het programma moet afgestemd worden op de individuele situatie van de patiënt waarbij geleidelijk toegewerkt kan worden naar de aanbevolen frequentie en intensiteit van de training. Belangrijk om hierbij te bespreken is dat te allen tijde de training in overleg met de patiënt aangepast kan worden waarbij het uitgangspunt is dat de training veilig, haalbaar, motiverend en realistisch is. Hierbij wordt dan bijvoorbeeld rekening gehouden met de totale belastbaarheid in de impact op de andere activiteiten van het dagelijks leven.
Kosten (middelenbeslag)
Er zijn geen gegevens beschikbaar over de kosteneffectiviteit van fysieke training bij patiënten met SMA.
Aanvaardbaarheid, haalbaarheid en implementatie
Mogelijke bezwaren die een fysiotherapeut zou kunnen uiten is dat ze zich onvoldoende bekwaam voelen om op basis van de beperkte evidentie een individueel programma op te stellen voor hun patiënt. In dat geval wordt geadviseerd om in overleg te gaan met het regionaal spierziektenteam of het SMA centrum Nederland en gezamenlijk een op maat gemaakt trainingsprogramma te ontwikkelen. Mogelijke bezwaren van de patiënt zijn gebrek aan tijd, te zware belasting, gebrek aan adequate begeleiding in de thuis- of schoolsituatie en beperkt vervoer om naar een fysiotherapiepraktijk te gaan. In deze gevallen wordt geadviseerd om in overleg met de eigen fysiotherapeut, het SMA centrum Nederland en of het revalidatie team een op maat gemaakt programma te ontwikkelen waarin rekening wordt gehouden met deze belemmeringen. Voor patiënten met SMA wordt langdurige fysiotherapie vergoed met de zorgverzekeringswet ( middels een chronische indicatie).Volwassenen moeten de eerste 20 fysio afspraken zelf betalen afhankelijk van hun zorgverzekering. Hiervoor kunnen patiënten zich aanvullend verzekeren.
Er zijn een aantal factoren die belemmerend kunnen zijn bij het implementeren van fysieke training bij patienten met SMA, namelijk de beschikbaarheid van een (kinder-)fysiotherapeut in de directe leefomgeving van de patient, de beschikbare tijd van de patiënt en ouders/verzorgers/mantelzorgers, zorgpolis, therapietrouw en afstemming met betrokken 2e en 3e lijn zorgverleners.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het is vooralsnog onzeker of fysieke training bevorderlijk of nadelig is voor patiënten met SMA door een gebrek aan wetenschappelijk bewijs. De beschikbare evidentie dateert uit de periode dat er nog geen curatieve behandelingen beschikbaar waren voor SMA. In de afgelopen 10 jaar is het SMA- landschap sterk veranderd door de beschikbaarheid van meerdere ziekte modificerende therapieën. Dit heeft geleid tot een proactieve benadering waarin de huidige internationale zorgstandaard gericht is op stabilisatie en zelfs verbetering van het ziektebeloop. De rationale hierbij is dat door verbetering in motorisch functioneren en spierkracht door medicamenteuze behandeling de haalbaarheid en effectiviteit van fysieke training groter wordt. Hierbij moet echter wel in ogenschouw genomen worden dat het nog onduidelijk is wat het effect is van de huidige behandeling op vermoeibaarheid, een van de belangrijkste mogelijke bijwerkingen van fysieke training. In de huidige internationale zorgstandaard wordt dan ook gesuperviseerde fysieke inspanning aanbevolen waarbij richtlijnen m.b.t. de intensiteit en frequentie ontbreken (Mercuri, 2018). Op basis van de positieve ontwikkelingen in medicamenteuze behandeling van patiënten met SMA, de huidige internationale zorgrichtlijn en beschikbare wetenschappelijk evidentie uit een beperkt aantal studies en expert opinion kunnen er een aantal generieke aanbevelingen gedaan worden over fysieke training voor patiënten met SMA die bijdragen aan een betere zorg (Mercuri, 2018).
Onderbouwing
Achtergrond
In the last 10 years, the landscape of SMA has changed dramatically due to the introduction of multiple effective disease-modifying treatments. The perspective on management of the disease has shifted towards a pro-active approach. Physical exercise training is strongly advocated for within the standards of care to counteract deterioration due to sedentary behavior and to enhance the effect of pharmacological treatment (Mercuri, 2018). However, clear recommendations and evidence are lacking, which makes the implementation of physical training in daily practice difficult.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain regarding the effect of training compared with usual care on the HMFSE in ambulatory patients with SMA 3.
Source: Bartels, 2019 |
|
Very low GRADE |
The evidence is very uncertain regarding the effect of training compared with usual care on VO2 Max in ambulatory patients with SMA 3.
Source: Bartels, 2019 |
|
Very low GRADE |
The evidence is very uncertain regarding the effect of training compared with usual care on the 6-minute walking test in ambulatory patients with SMA 3.
Source: Bartels, 2019 |
|
No GRADE |
No evidence was found regarding the effect of training compared with usual care on peak work load (Watt) in ambulatory patients with SMA 3.
|
|
No GRADE |
No evidence was found regarding the effect of training compared with usual care on any outcome in (non-)ambulatory patients with SMA 2.
|
Samenvatting literatuur
Description of studies
Bartels, 2019 performed a systematic review of randomized controlled trials (RCTs) and quasi-randomized controlled trials to assess the effects of physical exercise training on functional performance in people with spinal muscular atrophy type 3, and to identify any adverse effects. A literature search was performed in the Cochrane Neuromuscular Specialised Register, Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE, Embase, CINAHL, AMED and LILACS to identify relevant RCTs (from database inception through May 8, 2018). One RCT was included with a total of 14 patients. Montes, 2015 was an evaluator-blinded RCT that studied the effects of a home-based, combined muscle strength and recumbent cycle ergometry training program of six months compared to usual care. The recumbent cycle ergometry training program consisted of training five times per week for 30 minutes daily. The trial used a perceived exertion scale to guide workload increase. The strengthening program consisted of training from 60-80% of the one repetition maximum three times per week for 30 minutes with resting intervals which were personalized. The study population consisted of 14 participants with SMA type 3, who were ambulatory, and ranged in age from 10 years to 48 years.
Results
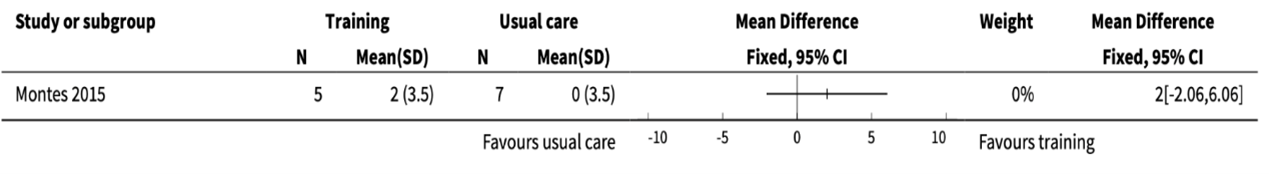
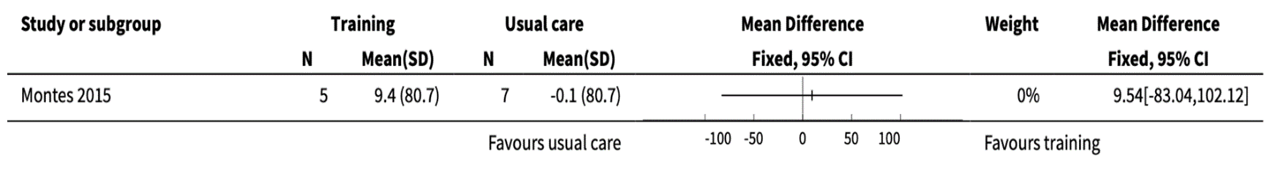
Participants in the Montes, 2015 study had SMA type 3 with mild-to-moderate severity. Two participants in the training group dropped out during the six-month period. Here we report the results of the training period versus the controlled period of six months. After the intervention the Hammersmith Functional Motor Scale - Expanded (HFMSE) averaged 52 (SD 6.63) for the exercise group and 54.0 (SD 7.07) for the usual care group, the VO2Max (mL/kg/min) averaged 12.6 (4.0) for the exercise group and 14.6 (3.1) for the control group, and the walking distance (m) averaged 347.0 (79.0) for the exercise group and 331.4 (112.0) for the control group. Peak work load (Watt) was not reported. In Figures 1 - 3 the mean before-after differences are compared.
Figure 1. Comparison of combined strength and aerobic exercise training versus usual care on Hammersmith Functional Motor Scale - Expanded (HFMSE) difference before and after (copied from Bartels, 2019)
Figure 2. Comparison of combined strength and aerobic exercise training versus usual care on VO2 Max (mL/kg/min) difference before and after (copied from Bartels, 2019)
Figure 3. Comparison of combined strength and aerobic exercise training versus usual care on 6-minute walking test difference before and after (copied from Bartels, 2019)
The differences observed between the training and control groups in the six months did not exceed the minimal clinically relevant difference of 0.5 SD.
Level of evidence of the literature
The level of evidence of RCTs starts at a high level.
HFMSE (critical)
The level of evidence for the outcome HFMSE was downgraded by two levels because of a high Risk of Bias and three levels because of imprecision (small sample size), resulting in a very low GRADE level of evidence.
VO2 Max (critical)
The level of evidence for the outcome VO2 Max was downgraded by two levels because of a high Risk of Bias and three levels because of imprecision (small sample size), resulting in a very low GRADE level of evidence.
6-minute walking test (important)
The level of evidence for the outcome of the 6-minute walking test was downgraded by two levels because of a high Risk of Bias and three levels because of imprecision (small sample size), resulting in a very low GRADE level of evidence.
Peak work load (Watt)(important)
Not reported.
Zoeken en selecteren
This quality document is the result of a pilot project aimed at developing quality documents for rare diseases. As part of this pilot, a comprehensive search strategy was applied to SMA types 2 and 3. Research questions were formulated in advance, focusing on several themes. The search results were categorized by theme. Due to limited resources only one theme could be addressed. The project group chose the following clinical question.
What are the favorable and unfavorable effects of training in ambulant and non-ambulant patients with SMA 2/3 on physical fitness?
|
P: |
Ambulant and non-ambulant patients with SMA 2/3 |
|
I: |
Combined aerobic and strength training |
|
C: |
No training |
|
O: |
Physical fitness operationalized as Hammersmith Functional Motor Scale – Expanded, VO2 peak, 6-minute walking test, peak work load (Watt). |
Relevant outcome measures
The guideline development group considered Hammersmith Functional Motor Scale – Expanded and VO2 peak as critical outcome measures for decision making; and
6-minute walking test, peak work load (Watt) as important outcome measures for decision making.
The working group defined a mean difference of 0.5 SD as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched in an umbrella search on SMA type 2 and 3 until 30-1-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 2603 hits. Studies were selected based on the following criteria: systematic reviews or RCTs comparing training with no training in patients with SMA 2/3, and reporting physical fitness as outcome. Ten studies were initially selected based on title and abstract screening. After reading the full text nine studies were excluded (See Table of excluded studies), and one study was included.
Results
One SR including one RCT was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The methodological quality is reported in the Risk of Bias table.
Referenties
- Bartels B, Montes J, van der Pol WL, de Groot JF. Physical exercise training for type 3 spinal muscular atrophy. Cochrane Database Syst Rev. 2019;3(3).
- Bartels B, de Groot JF, Habets LE, Wijngaarde CA, Vink W, Stam M, Asselman FL, van Eijk RPA, van der Pol WL. Fatigability in spinal muscular atrophy: validity and reliability of endurance shuttle tests Orphanet J Rare Dis. 2020;15(1):75.
- Bartels B, de Groot JF, Habets LE, Wadman RI, Asselman FL, Nieuwenhuis EES, van Eijk RPA, Goedee HS, van der Pol WL. Correlates of Fatigability in Patients With Spinal Muscular Atrophy. Neurology 2021;96(6):e845-e852.
- Habets LE, Bartels B, Asselman FL, Hooijmans MT, Svan den Berg S, Nederveen AJ, van der Pol WL, Jeneson JAL. Magnetic resonance reveals mitochondrial dysfunction and muscle remodelling in spinal muscular atrophy. Brain 2022;145(4):1422-1435.
- Habets, L. (2022). Motor Unit and Capillary Recruitment During Fatiguing Arm-Cycling Exercise in Spinal Muscular Atrophy Types 3 and 4. Journal of neuromuscular diseases.
- Mercuri, E. (2018). Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscular Disorders.
- Montes J, Garber CE, Kramer SS, Montgomery MJ, Dunaway S, Kamil-Rosenberg S, Carr B, Cruz R, Strauss NE, Sproule D, De Vivo DC. Single-Blind, Randomized, Controlled Clinical Trial of Exercise in Ambulatory Spinal Muscular Atrophy: Why are the Results Negative? J Neuromuscul Dis. 2015;2(4):463-470.
- SpierziektenNederland. (2024, 11 11). www.spierziekten.nl. Retrieved from https://www.spierziekten.nl/overzicht/spinale-spieratrofie-type-2/informeer-de-hulpverlener/
- Stam M, Wijngaarde CA, Bartels B, Asselman FL, Otto LA, Habets LE, ... & Van Der Pol WL. Randomized double-blind placebo-controlled crossover trial with pyridostigmine in spinal muscular atrophy types 2–4. Brain communications 2023; 5(1), fcac324.
- Zilio E, Piano V, Wirth B. Mitochondrial Dysfunction in Spinal Muscular Atrophy. Review Int J Mol Sci 2022;23(18):10878.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Bartels, 2019
|
SR and meta-analysis
Literature search up to May / 2018
A: Montes, 2015
Study design: RCT
Setting and Country: A: USA
Source of funding and conflicts of interest: A: ‘This study is supported, in part, by the Department of Defense; USAMRAA Grant/Cooperative award number: 09131005(W81XWH-10-1-0127), and the Spinal Muscular Atrophy Foundation. The sponsors had no role in the conduct of this study. The authors have no conflicts of interests to report.’ |
Inclusion criteria SR: RCTs and quasi RCTs. SMA type 3 confirmed by genetic analysis Age >4 yrs
Physical exercise training of skeletal muscles, for a period of at least 12 weeks, compared with placebo, standard or usual care, or another type of non-physical intervention.
Exclusion criteria SR: Studies of respiratory muscle training or that used a non-exercised limb as a control.
1 study included
Important patient characteristics at baseline:
N, mean age A: 14 patients, with SMA type 3; ages 10-48 years
Sex: A: 79% Male
Groups comparable at baseline? yes |
Describe intervention:
A: Individualized muscle strengthening program in combination with a home-based recumbent cycle ergometry aerobic exercise program five times weekly with target duration of 30 minutes per day for 6 months.
|
Describe control:
A: usual care |
End-point of follow-up:
A: 12 months
For how many participants were no complete outcome data available? (intervention/control) A: I: 2; C: 0
|
Outcome measure-1 6-minute walk test
Mean difference [95% CI]: A: 9.54[-83.04 to 102.12]m
Outcome measure-2 Hammersmith Functional Motor Scale - Expanded (HFMSE)
Mean difference [95% CI]: A: 2[-2.06 to 6.06]
Outcome measure-3 VO2max (mL/kg/min)
Mean difference [95% CI]: A: 1.22[-2.16 to 4.6]
|
Risk of bias (high, some concerns or low): Tool used by authors:
A: High risk of Bias, randomization and allocation concealment not reported; the participants and study personnel could not be blinded Only results of the controlled period of six months reported here
Author’s conclusion: ‘There were no changes between groups at any time point in the 6 months control-intervention period. Overall, all participants improved on their VO2 max after 12 months.’
|
Risk of Bias table
|
Study reference
|
Was the allocation sequence adequately generated?
|
Was the allocation adequately concealed?
|
Blinding: Was knowledge of the allocated interventions adequately prevented?
|
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias
|
|
Montes, 2015 |
Definitely no
Reason: Not reported |
Definitely no
Reason: Not reported |
Probably no:
Reason: Patients and healthcare providers were not blinded. The outcome assessors were blinded. |
Definitely yes
Reason: All follow-up was noted from the training group and control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No other problems noted |
High
Reason: Randomization and concealment of allocation not reported; all outcome measures were either effort dependent or participant-reported no participant blinding was possible. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Bora G, Subaşı-Yıldız Ş, Yeşbek-Kaymaz A, Bulut N, Alemdaroğlu İ, Tunca-Yılmaz Ö, Topaloğlu H, Karaduman AA, Erdem-Yurter H. Effects of Arm Cycling Exercise in Spinal Muscular Atrophy Type II Patients: A Pilot Study. J Child Neurol. 2018 Mar;33(3):209-215. doi: 10.1177/0883073817750500. Epub 2018 Jan 12. PMID: 29327642. |
Cohort study |
|
Cunha MC, Oliveira AS, Labronici RH, Gabbai AA. Spinal muscular atrophy type II (intermediary) and III (Kugelberg-Welander). Evolution of 50 patients with physiotherapy and hydrotherapy in a swimming pool. Arq Neuropsiquiatr. 1996 Sep;54(3):402-6. doi: 10.1590/s0004-282x1996000300007. PMID: 9109983. |
Cohort study |
|
Cutillo L, Pizziconi C, Tozzi AE, Verrillo E, Testa MB, Cutrera R. Predicted and measured resting energy expenditure in children with spinal muscular atrophy 2. J Pediatr. 2014 May;164(5):1228-30. doi: 10.1016/j.jpeds.2013.12.006. Epub 2014 Jan 11. PMID: 24423433. |
Case control study |
|
Habets LE, Bartels B, de Groot JF, van der Pol WL, Jeneson JAL, Asselman FL, van Eijk RPA, Stegeman DF. Motor unit reserve capacity in spinal muscular atrophy during fatiguing endurance performance. Clin Neurophysiol. 2021 Mar;132(3):800-807. doi: 10.1016/j.clinph.2020.11.044. Epub 2021 Jan 28. PMID: 33581592. |
Case control study |
|
Kant-Smits K, Hulzebos EHJ, Habets LE, Asselman FL, Veldhoen ES, van Eijk RPA, de Groot JF, van der Pol WL, Bartels B. Respiratory muscle fatigability in patients with spinal muscular atrophy. Pediatr Pulmonol. 2022 Dec;57(12):3050-3059. doi: 10.1002/ppul.26133. Epub 2022 Sep 14. PMID: 36039838; PMCID: PMC9826393. |
Cohort study |
|
Lewelt A, Krosschell KJ, Stoddard GJ, Weng C, Xue M, Marcus RL, Gappmaier E, Viollet L, Johnson BA, White AT, Viazzo-Trussell D, Lopes P, Lane RH, Carey JC, Swoboda KJ. Resistance strength training exercise in children with spinal muscular atrophy. Muscle Nerve. 2015 Oct;52(4):559-67. doi: 10.1002/mus.24568. PMID: 25597614; PMCID: PMC4506899. |
Cohort study |
|
Madsen KL, Hansen RS, Preisler N, Thøgersen F, Berthelsen MP, Vissing J. Training improves oxidative capacity, but not function, in spinal muscular atrophy type III. Muscle Nerve. 2015 Aug;52(2):240-4. doi: 10.1002/mus.24527. Epub 2015 May 23. PMID: 25418505. |
Cohort study |
|
Montes J, Garber CE, Kramer SS, Montgomery MJ, Dunaway S, Kamil-Rosenberg S, Carr B, Cruz R, Strauss NE, Sproule D, De Vivo DC. Single-Blind, Randomized, Controlled Clinical Trial of Exercise in Ambulatory Spinal Muscular Atrophy: Why are the Results Negative? J Neuromuscul Dis. 2015 Oct 7;2(4):463-470. doi: 10.3233/JND-150101. PMID: 27858749; PMCID: PMC5240606. |
RCT, included in SR |
|
Stam M, Wadman RI, Bartels B, Leeuw M, Westeneng HJ, Wijngaarde CA, van den Berg LH, van der Pol WL. A continuous repetitive task to detect fatigability in spinal muscular atrophy. Orphanet J Rare Dis. 2018 Sep 12;13(1):160. doi: 10.1186/s13023-018-0904-5. PMID: 30208915; PMCID: PMC6134509. |
Cohort study |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 31-03-2025
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Project zeldzaam
Dit kwaliteitsdocument is het resultaat van een pilotproject gericht op het ontwikkelen van kwaliteitsdocumenten voor zeldzame ziekten. Als onderdeel van deze pilot werd een uitgebreide zoekstrategie toegepast op SMA type 2 en 3. Vooraf werden onderzoeksvragen geformuleerd, met focus op meerdere thema's. De zoekresultaten werden per thema gecategoriseerd. Vanwege beperkte middelen kon slechts één thema worden behandeld.
Voor wie is deze richtlijn bedoeld?
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor ambulante en niet ambulante patiënten met SMA type 2 en type 3, in het bijzonder kinderartsen, revalidatieartsen en fysiotherapeuten.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met SMA type 2/3.
Werkgroep
Prof. Dr. W.L. Van der Pol, neuroloog, UMC Urecht, NVN (voorzitter)
Dr. B. Bartels, kinderfysiotherapeut, UMC Utrecht, KNGF, NVFK
Dr. A.M.C. Horemans, Spierziekten Nederland
Dr. E.T. Kruitwagen-van Reenen, revalidatiearts, UMC Utrecht, VRA
Dr. E.S. Veldhoen, kinderarts-intensivist, UMC Utrecht, NVK
Met ondersteuning van
I.J. Hieltjes, junior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. J.H. Van der Lee, senior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. I. van Dusseldorp, senior informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. W.L. Van der Pol |
Hoogleraar Neurologie UMC Utrecht |
Voorzitter indicatie commissie ziekte van Pompe (Erasmus MC) - onbetaald
Medisch adviseur Vereniging Spierziekten Nederland voor spinale musculaire atrofie (SMA) en multifocale motorische neuropathie (MMN) - onbetaald
Lid Scientific Advisory Board (SAB) SMA Europe - onbetaald
Ad hoc lid van Advisory Boards voor Novartis (gentherapie voor SMA), Biogen (antisense oligonucleotide therapie voor SMA), Roche (small molecule voor SMA) - fee for service voor werkgever |
Onderzoek gefinancierd door Prinses Beatrix Spierfonds Stichting Spieren voor spieren Piet Poortman fonds Argenx Biogen Novartis Roche Scholar Rock |
Geen. Commercieel gefinancierd onderzoek valt buiten de scope van dit project. |
|
Dr. B. Bartels |
Associate professor, UMC Utrecht |
Lid Wetenschappelijk Advies Raad NVFK
Consultancy activiteiten Biogen, Novartis, Roche, Scolar Rock – fee for service voor werkgever |
Onderzoek gefinancierd door: Stichting Spieren voor Spieren Prinses Beatrix Spierfonds Piet Poortman fonds SIA-RAAK |
Geen. Commercieel gefinancierd onderzoek valt buiten de scope van dit project. |
|
Dr. A.M.C. Horemans |
Hoofd kwaliteit van zorg Spierziekten Nederland |
Geen |
Geen |
Geen |
|
Dr. E.T. Kruitwagen-van Reenen |
Revalidatie arts, UMC Utrecht |
Medisch adviseur Vereniging Spierziekten Nederland voor spinale musculaire atrofie (SMA) en ALS, PLS |
Geen |
Geen |
|
Dr. E.S. Veldhoen |
Kinderarts-intervist, UMC Utrecht |
Geen |
Onderzoek gefinancierd door: Prinses Beatrix Spierfonds Duchenne Parent Project Philips |
Geen. Commercieel gefinancierd onderzoek valt buiten de scope van dit project. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afgevaardigde van Spierziekten Nederland in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Spierziekten Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met SMA type 2/3. Tevens zijn er knelpunten aangedragen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.