Prognostische factoren tav beloop van CP
Uitgangsvraag
Wat zijn prognostische factoren ten aanzien van het beloop van CP?
Aanbeveling
Vanwege het ongunstig effect van mentale retardatie, epilepsie en respiratoire complicaties op de prognose van CP, is de kinderarts, die kindergeneeskundige expertise heeft op deze drie gebieden, de meest aangewezen specialist om hierover te adviseren aan het behandelteam.
Overwegingen
Bij de interpretatie van bovengenoemde getallen, met name wat betreft de overleving, dient men zich te realiseren dat deze veelal zijn gebaseerd op een andere periode dan waarin we nu leven. Men dient daarnaast voorzichtig te zijn om epidemiologische gegevens te vertalen naar individuele gevallen.
Veel studies die prognostische factoren beschrijven, includeren niet alleen kinderen met spastische CP, maar ook met dyskinetische, ataxische CP of mengvormen. Het aantal geïncludeerde niet-spastische kinderen met CP loopt uiteen van 4% tot meer dan 30% in de verschillende studies. Dit kan de beschreven resultaten m.b.t. de functionele prognose, bijvoorbeeld de loopprognose hebben beïnvloed. In die studies die het type CP mede hebben onderzocht, blijkt dat de loopprognose ongunstiger is bij de spastische quadriplegie en de dyskinetische CP (Gorter 2004, Wichers 2001, Bottos 1995, Watt 1989). De grote spreiding in leeftijd die beschreven wordt met betrekking tot het nog verkrijgen van zelfstandige loopvaardigheid kan hier ook mee samenhangen. Waarschijnlijk is de aanwezigheid van gemengde typen bewegingsstoornissen en dyskinetische bewegingsstoornissen de reden van deze grote spreiding.
De GMFCS als prognostisch meetinstrument is bruikbaar vanaf het 2e tot het 12e levensjaar, daarna kan een achteruitgang gezien worden in de verschillende al bereikte motorische mijlpalen. Uit retrospectief onderzoek blijkt bijvoorbeeld dat spastische kinderen in de categorie GMFCS-3 (in staat tot lopen met loophulpmiddel), die nooit binnenshuis los gelopen hebben, later hun loopvaardigheid weer verliezen. Kinderen in dezelfde GMFCS-3 categorie die wel in huis iets los kunnen lopen, behouden hun loopvaardigheid in de regel.
Onderbouwing
Achtergrond
Voor de behandeling van kinderen met CP is kennis van prognostische factoren essentieel: door de heterogeniciteit van de patiëntenpopulatie geeft de diagnose zelf geen informatie over de prognose en ontwikkelingsrisico’s tijdens het opgroeien.
Conclusies / Summary of Findings
|
Niveau 1 |
Het is aangetoond dat meer dan 90% van de kinderen met CP de volwassen leeftijd bereikt.
A Hutton 1994, 2000, 2003, Blair 2001, Shavelle 2001 |
|
Niveau 1 |
Het is aangetoond dat verhoogde sterfte bij kinderen met CP optreedt in geval van ernstige mentale retardatie, ernstige motorische beperkingen in mobiliteit, en ernstige fijn-motorische beperkingen met onmogelijkheid tot zelf voeden en aankleden en vooral de combinatie van deze beperkingen.
A Hutton 1994, 2000, 2002, Blair 2001, Shavelle 2001, Crichton 1995 |
|
Niveau 2 |
Het is aannemelijk dat respiratoire complicaties (pneumonie, aspiratie) de meest voorkomende doodsoorzaak (ca. 60%) is bij kinderen met CP, met op de tweede plaats epileptische aanvallen in circa 10% van de overlijdensgevallen.
A Blair 2001 B Williams 1998 |
|
Niveau 2 |
Het is aannemelijk dat de acquisitie van motorische vaardigheden (gemeten met de 66 item versie van de GMFM), gemiddeld langzamer is en op jongere leeftijd geen progressie meer laat zien naarmate de ernst van de CP, bepaald volgens de GMFCS, toeneemt. (GMFCS niveau I zijn de kinderen met de minste belemmeringen, GMFCS niveau V zijn de kinderen met de meeste belemmeringen)
A Rosenbaum 2002 |
|
Niveau 2 |
Het is aannemelijk dat kinderen met een CP nog tot de leeftijd van 5 à 10 jaar in staat zijn zelfstandig of met hulpmiddelen te gaan lopen. Dit lijkt met name van toepassing voor kinderen met een atactische of dyskinetische CP.
B Watt 1989, Wu 2005 C Fedrizzi 2000, Wood 2000 |
|
Niveau 3 |
Er zijn aanwijzingen dat op latere leeftijd, vanaf de puberteit, het vermogen om zelfstandig of met hulpmiddelen te lopen, bij een aanzienlijk deel van de kinderen met CP afneemt.
C Bottos 2001 |
|
Niveau 2 |
Het is aannemelijk dat het zelfstandig kunnen (gaan) zitten op de leeftijd van 2 jaar bij kinderen met CP wijst op een gunstige loopprognose.
B Wu 2005, Watt 1989 |
|
Niveau 2 |
Het is aannemelijk dat epilepsie voorkomt bij ongeveer 20% van de kinderen met CP en geassocieerd is met mentale retardatie en ernstige bilaterale motorische stoornissen.
A Crichton 1995 |
|
Niveau 3 |
Er zijn aanwijzingen dat de leeftijd waarop epilepsie ontstaat bij kinderen met CP meestal ligt voor het 7e levensjaar.
C Aksu 1990, Kwong 1998, Zafeiriou 1999 |
|
Niveau 3 |
Er zijn aanwijzingen dat meer dan de helft van de kinderen met CP en epilepsie op de lange termijn, in elk geval na het 12e levensjaar, aanvalsvrij worden.
C Zafeiriou 1999, Gaggero 2001 |
Samenvatting literatuur
Natuurlijk beloop
Er zijn weinig goede, systematische studies verricht naar het natuurlijk beloop van CP. De al jarenlang bestaande grote regionale CP-registraties uit de Verenigde Staten (Californië) (Strauss 1998), West-Australia (Blair 2001), Canada (Crichton 1995) en het Verenigd Koninkrijk (Hutton 2002, Hutton 2000, Hutton, 1994) rapporteren vooral over de mortaliteit. Er is evenwel uit de tabellen die in sommige van deze artikelen zijn opgenomen wel af te leiden hoe de prevalentie is van verschillende functionele beperkingen. Over de Nederlandse situatie hieromtrent is één retrospectieve studie gevonden, gebaseerd op een ‘population-based’ cohort (Wichers, 2005). De prevalentie van verschillende functionele beperkingen is weergegeven in tabel 2.
Tabel 2. Het percentage kinderen met CP met loopproblemen, handfunctie problemen, mentale retardatie, visus- en gehoorstoornissen.
|
|
Functionele beperking |
|
|
|
geen – in lichte mate |
matig – ernstig |
|
Loopfunctie (Wichers 2005, Hutton 2002, Hutton 2000, Strauss 1998, Hutton 1994) |
27-74% |
26-73% |
|
Handfunctie (Hutton 2002, Blair 2001, Hutton 2000, Strauss 1998, Hutton 1994) |
61-80% |
20-39% |
|
Mentale retardatie (Wichers 2005, Hutton 2002, Blair 2001, Hutton 2000, Strauss 1998, Hutton 1994) |
53-69% |
31-47% |
|
Visusstoornissen (Wichers 2005, Blair 2001, Hutton 2000) |
80-94% |
6-20% |
|
Gehoorstoornissen (Blair 2001, Hutton 2000) |
93-97% |
3-7% |
In een enkele studie is ook het voorkomen van meervoudige ernstige functionele beperkingen onderzocht (Hutton 1994). Het blijkt dan dat meer dan 60% van de kinderen met CP voornamelijk lichte tot matige beperkingen kent. Circa 16% heeft een ernstige functionele beperking op één van de domeinen genoemd in tabel 2.2.1, 5% heeft deze op twee domeinen, en 16% op drie of meer domeinen (Hutton 1994). Meervoudige ernstige functiebelemmeringen komen dus in circa 20% van de gevallen voor.
Het natuurlijke beloop in de tijd van deze functionele beperkingen is alleen voor de grove motoriek, en in het bijzonder de loopfunctie in enige mate onderzocht. Opvallend is het ontbreken van studies over het natuurlijke beloop van handvaardigheid en handfunctie.
Motorische ontwikkeling en prognostische factoren
De meeste studies die de prognose van de grove motoriek bij CP behandelen, betreffen retrospectieve case series, meestal van een beperkte omvang. Er is slechts één goed opgezette, longitudinale, prospectieve studie (Rosenbaum 2002) waaruit motorische ontwikkelingscurves zijn geconstrueerd voor kinderen met CP. In het onderzoek werden ruim 650 kinderen met CP ingedeeld naar hun klasse met de GMFCS. De motorische vaardigheden werden per kind meerdere malen over de tijd gemeten met de 66-item versie van de Gross Motor Function Measure (GMFM-66) waaruit een score tussen de 0 en 100 kan worden berekend (interval-schaal) (figuur 2.2.1). De meeste kinderen blijven zich in hetzelfde GMFCS-klasse ontwikkelen en als het individuele kind (vanaf 24 maanden) tijdens zijn ontwikkeling een andere klasse bereikt dan blijft deze verandering vrijwel altijd beperkt tot één klasse verschil (Wood, 2000).
Uit figuur 2. blijkt dat hoe ernstiger de CP, hoe langzamer de acquisitie van grof-motorische vaardigheden is en ook hoe eerder er geen verdere progressie in GMFM-66 scores meer wordt bereikt (Rosenbaum, 2002). Uit deze studie blijkt voorts, dat op basis van de leeftijd en de GMFCS klasse een schatting gemaakt kan worden van het niveau van motorisch functioneren op 12-jarige leeftijd. (fig. 2). De gemiddelde, maximale GMGM-66 scores verschillen statistisch significant per GMFCS klasse. De traditionele indelingen zoals het type bewegingsstoornis en de lokalisatie hebben nagenoeg geen toegevoegde prognostische waarde in de voorspelde GMFMM-66 scores ten opzichte van de indeling naar GMFCS klasse (Gorter 2004).
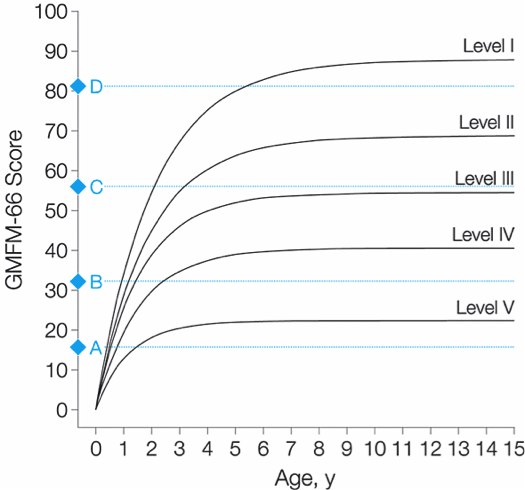
Figuur 2. Voorspelde gemiddelde ontwikkeling van de grove motoriek
GMFM-66 score bij verschillende GMFCS klassen. (Rosenbaum, 2002). De tekens met de letters A, B, C en D staan voor respectievelijk vier items van de GMFM. Deze items voorspellen wanneer kinderen naar verwachting 50% kans hebben om dit item succesvol te behalen.
GMFM item 21 (letter A): het kind zit op de mat, onderzoeker ondersteunt thorax; richt hoofd rechtop, 3 seconden.
GMFM-item 24 (letter B): het kind zit op de mat, losse armen, 3 seconden.
GMFM-item 69 (letter C): het kind staat, looopt 10 stappen voorwaarts.
GMFM-item 87 (letter D): het kind staat; loopt alternerend vier stappen omlaag, met losse armen.
(Met toestemming overgenomen uit: Rosenbaum PL, et al. Prognosis for gross motor function in cerebral palsy: creation of motor development curves. JAMA 2002;288:1357-63.)
Uit het Canadese, longitudinale onderzoek blijkt dat kinderen met CP hun eigen ‘gemiddelde’ motorische ontwikkelingslijn hebben. Ook is zichtbaar dat kinderen met CP met relatief geringe motorische stoornissen (GMFCS klasse I) in vergelijking met hun ‘gezonde’ leeftijdsgenootjes de motorische mijlpalen op een iets latere leeftijd bereiken. Overigens zegt de GMFM niets over de hoeveelheid moeite die het de kinderen kost om een bepaalde motorische activiteit te doen, of bijvoorbeeld over de kwaliteit van het lopen. Daarvoor zijn andere meetinstrumenten noodzakelijk. Ook is het belangrijk zich te realiseren dat kinderen met CP vaker gebruik maken van hulpmiddelen zoals een fiets of een rolstoel bij het verplaatsen op school of buitenshuis. Deze variatie wordt niet alleen bepaald door de ernst van de motorische belemmeringen maar ook door bijkomende stoornissen, persoonlijke of omgevingsfactoren (Palisano 2003).
De ontwikkelingscurven zijn berekend op basis van de gegevens van Canadese kinderen met CP die tijdens het onderzoek (1996-2001) regulier werden behandeld met therapie en revalidatie (Rosenbaum 2002). Dit betekent dat (1) een gemiddelde ontwikkelingscurve alleen kan worden verwacht indien de ontwikkeling wordt ondersteund met noodzakelijke therapie en (2) de effecten van nieuwe therapeutische mogelijkheden (nog) niet zijn meegenomen in deze referentiegegevens en functionele prognose.
De overige studies met betrekking tot de prognose van de motorische ontwikkeling zijn van matige methodologische kwaliteit.
Het merendeel van de kinderen met CP is, al dan niet met hulpmiddelen, in staat om vroeg of laat te gaan lopen. Dat is wel afhankelijk van het type CP. Van de kinderen bij wie als diagnose een spastische quadriplegie is vastgesteld, komt minder dan 50% tot enige vorm van lopen (Wu 2005, Da Paz Jr 1994, Watt 1989).
Het ontwikkelen van het vermogen tot zelfstandig lopen kan nog tot ver in de kinderleeftijd, in elk geval tot 5 à 10 jaar, plaatsvinden (Fedrizzi 2000, Wood 2000, Sala 1995, Watt 1989). De grote spreiding wordt waarschijnlijk voor een deel veroorzaakt door kinderen met een mengbeeld van motorische stoornissen (b.v. spastisch-atactisch) of het includeren van atactische en dyskinetische bewegingsstoornissen. Deze kinderen kunnen tot hun 10e jaar enige mate van loopvaardigheid of zelf los lopen bereiken. Een ander aspect is dat de definitie van quadriplegie in publicaties kan verschillen: volgens de in Nederland gebruikelijke definitie kunnen bij diplegische kinderen de bovenste extremiteiten in mindere mate zijn aangedaan, volgens andere definities spreekt men dan ook van quadriplegie, waardoor de groep ernstig aangedane diplegen daarin is opgenomen. Vanaf de puberteit neemt het percentage patiënten met CP dat zelfstandig of met hulpmiddelen loopt weer af, zodat na een follow-up van ruim 30 jaar ongeveer de helft van de oorspronkelijk ambulante patiënten nog in staat is tot lopen (Bottos, 2001).
Prognostische factoren voor het bereiken van zelfstandige loopvaardigheid op 5-10 jarige leeftijd zijn:
-
in staat tot zelfstandig (gaan) zitten op de leeftijd van 2 jaar (Wu 2005, Fedrizzi 2000, Da Paz Jr 1994, Watt 1989)
-
in staat tot omrollen op de leeftijd van 18 maanden tot 2 jaar (Wu 2005, Fedrizzi 2000)
-
kruipen voor de leeftijd van 30 maanden, afwezigheid van abnormale wijze van kruipen (Bottos 1995, Da Paz Jr 1994)
-
afwezigheid van persisteren van primitieve reflexen (Watt 1989)
-
redelijk tot goede intelligentie (Fedrizzi 2000, Bottos 1995)
-
goede visuele functie, geen blindheid (Wu 2005, Fedrizzi 2000)
-
type CP, hemiplegie of diplegie (Wu 2005, Da Paz Jr 1994)
Mortaliteit en prognostische factoren
Het merendeel van de kinderen met CP overleeft tot ruim in volwassen leeftijd (>90%). De al jarenlang bestaande grote regionale CP-registraties uit de Verenigde Staten (Californië) (Strauss 1998), West-Australië (Blair 2001), Canada (Crichton 1995) en het Verenigd Koninkrijk (Hutton 2002, Hutton 2000, Hutton 1994) laten opvallend gelijke uitkomsten zien (Shavelle 2001). Verbetering van de medische zorg sinds de jaren 1950-1960 heeft nauwelijks tot verbetering van de overleving geleid. Er is evenmin verschil in sterfte tussen wel en niet geïnstitutionaliseerde kinderen met CP.
Gemelde doodsoorzaken zijn in ca. 60% van de gevallen respiratoir (pneumonie of aspiratie), met epilepsie in ca 10% van de gevallen op de tweede plaats (Blair 2001, Williams 1998). Kinderen met een laag geboortegewicht hebben in het algemeen een betere lange termijn overleving dan kinderen met een normaal geboortegewicht. Dit wordt toegeschreven enerzijds aan een verhoogde sterfte in de eerste levensweken van kinderen met een laag geboortegewicht (valt buiten de registraties), anderzijds aan een betere functionele status.
De hoogste sterfte wordt in de eerste 5 levensjaren gevonden (>1%) en daalt dan langzaam tot 0,35% na het 15e levensjaar (Blair 2001). Overlevingscijfers voor na het 40e jaar zijn niet goed bekend, de registraties waarover wordt gepubliceerd gaan niet zover terug.
De 30-jaars overleving voor patiënten die geen ernstige beperkingen hebben, ligt op 98-99%. Ongunstige factoren voor overleving zijn de aanwezigheid van ernstige mentale retardatie (IQ<50, 30-jaars overleving 50-70%) (Hutton 2002, Blair 2001, Shavelle 2001, Hutton 2000, Crichton 1995), motorische beperkingen in de mobiliteit (niet zelfstandig kunnen lopen, geen rolstoel voort kunnen bewegen, 30-jaars overleving 40-80%) (Hutton 2002, Blair 2001, Hutton 2000, Crichton 1995), fijn-motorische beperkingen (niet zelf kunnen voeden of aankleden, 30-jaars overleving 50-70%) (Hutton 2002, Hutton 2000, Strauss 1998, Crichton 1995) en de aanwezigheid van epilepsie (30-jaarsoverleving ca 75%) (Strauss 1998, Crichton 1995). Eén recente studie toont ook aan dat ernstige visuele beperkingen de 30-jaars overleving fors doet afnemen (tot 38%) (Hutton 2002). Het is evenwel vooral de combinatie van ernstige functionele belemmeringen in meerdere domeinen (motorisch, cognitief, visueel) die invloed heeft op een verlaagde overleving (Hutton 2002, Strauss 1998) (figuur 3).
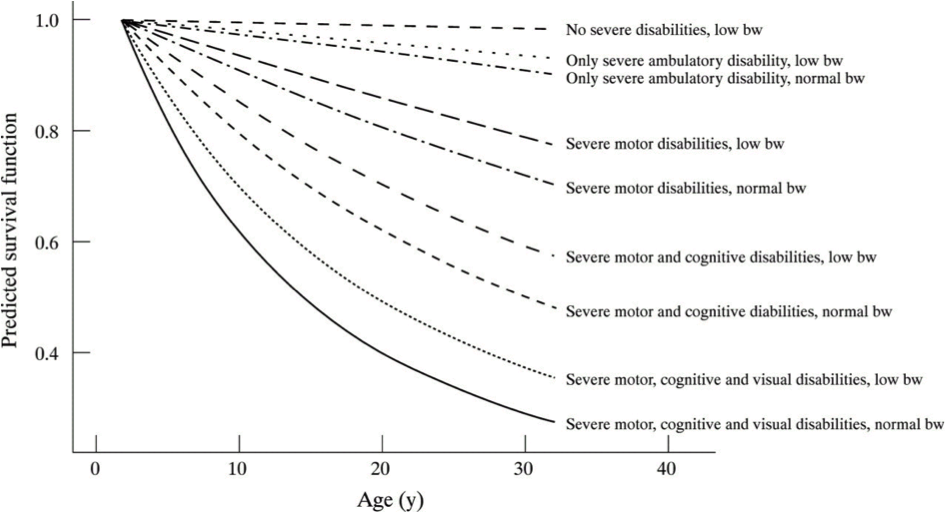
Figuur 3. Voorspelde overleving vanaf de leeftijd van 2 jaren
Normal bw, geboortegewicht >2500 gram, low bw, geboortegewicht <2500 gram.
(Met toestemming overgenomen uit: Hutton JL, Pharoah PO. Effects of cognitive, motor, and sensory disabilities on survival in cerebral palsy. Arch Dis Child 2002;86:84-9.)
Risico op epileptische manifestaties
De gerapporteerde prevalentie van epilepsie bij CP ligt rond de 40%. De meeste studies die over de prevalentie rapporteren betreffen overigens case-series of cohort studies uit één enkel ziekenhuis of centrum, waar het risico van overschatting van de prevalentie hoog is. Van de grote regionale CP-registraties rapporteert alleen die uit Canada de aantallen kinderen met epilepsie in een tabel, van waaruit dan een prevalentie van 23% kan worden berekend (Crichton 1995).
Met dit in gedachten wordt de hoogste prevalentie van epilepsie bij CP gevonden bij kinderen met de ernstigste bilaterale vorm (quadriplegie, 50-70%) en vervolgens bij de unilaterale CP (hemiplegie, 40-50%). Bij de mildere bilaterale spastische CP (diplegie) is de prevalentie veel lager, 15-30% (Wichers 2005, Kulak 2003, Hadjipanayis 1997).
Meestal ontstaat epilepsie bij CP al in de eerste levensjaren, bij 70-80% voor het 7e levensjaar. Voor de kinderen met quadriplegie is dit het snelst: de mediane leeftijd van de eerste epileptische aanval is ca 1 jaar. Voor kinderen met hemiplegie of diplegie is deze ca. 4 jaar (Kulak 2003).
De aanvalstypes die het frequentst voorkomen zijn tonisch-clonische of partieel insulten (bij quadriplegie en hemiplegie) en partiële convulsies (bij hemiplegie) (Zafeiriou 1999, Hadjipanayis 1997, Aksu 1990).
Nogal eens is het moeilijk de convulsies onder controle te krijgen. Polytherapie is nodig in 25%-80% van de gevallen (Zafeiriou 1999, Kwong 1998, Aksu 1990). Therapie resistentie wordt geschat op ca. 50% (Kulak 2003, Kwong 1998).
Risicofactoren die samenhangen met het ontwikkelen van epilepsie bij CP zijn:
-
laag geboortegewicht (Kulak, 2003)
-
positieve familie-anamnese voor epilepsie (Kulak 2003, Aksu 1990)
-
ernst en soort van de CP (Kulak 2003, Zafeiriou 1999, Hadjipanayis 1997)
-
afwijkingen bij neuro-imaging: corticale of centrale lesies, cerebraal infarct lesies (Kulak 2003, Aksu 1990)
-
aanwezigheid van ernstige mentale retardatie (Zafeiriou 1999, Kwong 1998, Hadjipanayis 1997)
-
neonatale convulsies (Kulak 2003)
Over het lange-termijn beloop van epilepsie bij CP zijn nauwelijks studies verricht. De meeste studies naar het beloop van epilepsie bij CP hebben een relatief korte follow-up, korter dan 10 jaar. De studies met de langste follow-up (9-13 jaar) laten zien dat 60-75% van de kinderen met CP uiteindelijk aanvalsvrij wordt, meestal na het 12e levensjaar (Gaggero 2001, Zafeiriou 1999). Als na 3 jaar aanvalsvrij de anti-epileptische medicatie wordt gestaakt, is het recidief percentage 13% (Zafeiriou 1999), terwijl dit na 2 jaar aanvalsvrij op 42% ligt (Delgado 1996). Het hoogste risico op recidief na staken van de anti-epileptische medicatie wordt gevonden bij de kinderen met hemiplegie (Zafeiriou 1999, Delgado 1996).
Risico op visuele en auditieve stoornissen
Van twee grote regionale CP-registraties (type A studies) (Hutton 2002, Blair 2001) kan uit de beschrijving van hun populatie de prevalentie van ernstige visuele stoornissen (9-10%) en ernstige bilaterale doofheid (5-7%) worden berekend. Er zijn geen studies gevonden die het natuurlijke beloop, risicofactoren en prognostische factoren voor visuele en auditieve stoornissen hebben bestudeerd. Er zijn wel aanwijzingen dat visuele stoornissen veel frequenter voorkomen (ca 40%) dan volgens bovenstaande registraties wordt gerapporteerd (tabel 2.2.5). Dit is dan bij alle typen CP (Stiers 2002) waarbij oogproblemen, gestoorde oogmotoriek en –coördinatie en cerebrale visueel-perceptieve stoornissen een rol spelen (Stiers 2002, Fedrizzi 1998).
Zoeken en selecteren
Methodologie
Voor de beoordeling van artikelen in deze module is gezien de informatie uit de inleiding pragmatisch uitgegaan van de volgende indeling:
- Prospectieve of retrospectieve studies op basis van grote landelijke of regionale zo compleet mogelijke registraties.
- Systematische review van studies vermeld onder A1.
- Goed opgezette cohort-studies, bij voorkeur prospectief.
- Case-series of patient-control-studies.
- Mening van deskundigen
Referenties
- Aksu F. Nature and prognosis of seizures in patients with cerebral palsy. Dev Med Child Neurol 1990;32:661-8.
- Blair E, Watson L, Badawi N, Stanley FJ. Life expectancy among people with cerebral palsy in Western Australia. Dev Med Child Neurol 2001;43:508-15.
- Bottos M, Feliciangeli A, Sciuto L, Gericke C, Vianello A. Functional status of adults with cerebral palsy and implications for treatment of children. Dev Med Child Neurol 2001;43:516-28.
- Bottos M, Puato ML, Vianello A, Facchin P. Locomotion patterns in cerebral palsy syndromes. Dev Med Child Neurol 1995;37:883-99.
- Crichton JU. The life expectancy of persons with cerebral palsy. Dev Med Child Neurol 1995;37:1032-3.
- Da Paz Jr AC, Burnett SM, Braga LW. Walking prognosis in cerebral palsy: a 22-year retrospective analysis. Dev Med Child Neurol 1994;36:130-4.
- Delgado MR, Riela AR, Mills J, Pitt A, Browne R. Discontinuation of antiepileptic drug treatment after two seizure-free years in children with cerebral palsy. Pediatrics 1996;97:192-7.
- Fedrizzi E, Anderloni A, Bono R, Bova S, Farinotti M, Inverno M et al. Eye-movement disorders and visual-perceptual impairment in diplegic children born preterm: a clinical evaluation. Dev Med Child Neurol 1998;40:682-8.
- Fedrizzi E, Facchin P, Marzaroli M, Pagliano E, Botteon G, Percivalle L et al. Predictors of independent walking in children with spastic diplegia. J Child Neurol 2000;15:228-34.
- Gaggero R, Devescovi R, Zaccone A, Ravera G. Epilepsy associated with infantile hemiparesis: predictors of long-term evolution. Brain Dev 2001;23:12-7.
- Gorter JW, Rosenbaum PL, Hanna SE, Palisano RJ, Bartlett DJ, Russell DJ et al. Limb distribution, motor impairment, and functional classification of cerebral palsy. Dev Med Child Neurol 2004;46:461-7.
- Hadjipanayis A, Hadjichristodoulou C, Youroukos S. Epilepsy in patients with cerebral palsy. Dev Med Child Neurol 1997;39:659-663.
- Hutton JL, Colver AF, Mackie PC. Effect of severity of disability on survival in north east England cerebral palsy cohort. Arch Dis Child 2000;83:468-74.
- Hutton JL, Cooke T, Pharoah PO. Life expectancy in children with cerebral palsy. BMJ 1994;309:431-5.
- Hutton JL, Pharoah PO. Effects of cognitive, motor, and sensory disabilities on survival in cerebral palsy. Arch Dis Child 2002;86:84-9.
- Kulak W, Sobaniec W. Risk factors and prognosis of epilepsy in children with cerebral palsy in north-eastern Poland. Brain Dev 2003;25:499-506.
- Kwong KL, Wong SN, So KT. Epilepsy in children with cerebral palsy. Pediatr Neurol 1998;19:31-6.
- Palisano RJ, Tieman BL, Walter SD, Bartlett DJ, Rosenbaum PL, Russell D, et al. Effect of environmental setting on mobility methods of children with cerebral palsy. Dev Med Child Neurol 2003;45:113-20.
- Rosenbaum PL, Walter SD, Hanna SE, Palisano RJ, Russell DJ, Raina P et al. Prognosis for gross motor function in cerebral palsy: creation of motor development curves. JAMA 2002;288:1357-63.
- Sala DA, Grant AD. Prognosis for ambulation in cerebral palsy. Dev Med Child Neurol 1995;37:1020-6.
- Shavelle RM, Straus DJ, Day SM. Comparison of survival in cerebral palsy between countries. Dev Med Child Neurol 2001;43:574.
- Stiers P, Vanderkelen R, Vanneste G, Coene S, De Rammelaere M, Vandenbussche E. Visual-perceptual impairment in a random sample of children with cerebral palsy. Dev Med Child Neurol 2002;44:370-82.
- Strauss DJ, Shavelle RM, Anderson TW. Life expectancy of children with cerebral palsy. Pediatr Neurol 1998;18:143-9.
- Watt JM, Robertson CM, Grace MG. Early prognosis for ambulation of neonatal intensive care survivors with cerebral palsy. Dev Med Child Neurol 1989;31:766-73.
- Wichers MJ, Odding E, Stam HJ, Van Nieuwenhuizen O. Clinical presentation, associated disorders and aetiological moments in cerebral palsy: a Dutch population-based study. Disabil Rehabil 2005;27:583-9.
- Wichers MJ, Van der Schouw YT, Moons KGM, Stam HJ, van Nieuwenhuizen O. Prevalence of cerebral palsy in The Netherlands (1977-1988). Eur J Epidemiol 2001;17:527-32.
- Williams K, Alberman E. Survival in cerebral palsy: the role of severity and diagnostic labels. Dev Med Child Neurol 1998;40:376-9.
- Wood E, Rosenbaum P. The gross motor function classification system for cerebral palsy: a study of reliability and stability over time. Dev Med Child Neurol 2000;42:292-6.
- Wu YW, Day SM, Strauss DJ, Shavelle RM. Prognosis for ambulation in cerebral palsy: a population-based study. Pediatrics 2005;114:1264-71.
- Zafeiriou DI, Kontopoulos EE, Tsikoulas I. Characteristics and prognosis of epilepsy in children with cerebral palsy. J Child Neurol 1999;14:289-94.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-05-2015
Beoordeeld op geldigheid : 09-08-2024
In 2006 is de ”richtlijn diagnostiek en behandeling van kinderen met spastische Cerebrale Parese” (VRA 2006) vastgesteld. Bij de revisie (autorisatie 01-04-2015) zijn drie nieuwe uitgangsvragen uitgewerkt en zeven uitgangsvragen gereviseerd, en is de geldigheid van de niet-gereviseerde uitgangsvragen beoordeeld. Bij de eerste modulaire revisie (autorisatie 10-09-2018) is de module 'Effect van orthopedische chirurgie op mobiliteit' (zie Behandeling gericht op verbetering mobiliteit) gereviseerd en toegevoegd aan de Richtlijnendatabase.
Geldigheid van niet-gereviseerde uitgangsvragen uit de eerdere richtlijn (2006)
De werkgroep heeft in 2015 de geldigheid van aanbevelingen uit de eerdere versie van de richtlijn (VRA 2006) beoordeeld. Een van de onderdelen werd beoordeeld als niet meer valide: vanwege nieuwe gegevens in de literatuur waren de analyse, conclusie en aanbeveling van uitgangsvraag - 'Wat is het effect van spierverlenging, tenotomie, osteotomie op ROM, spiertonus en kracht?'- niet meer geldig. Dit onderdeel is gereviseerd in 2018 (zie module 'Effect van orthopedische chirurgie op mobiliteit').
De overige aanbevelingen uit de richtlijn van 2006 werden in 2015 beoordeeld als onverminderd van toepassing, wel waren enkele tekstuele correcties en aanvullingen noodzakelijk. De belangrijkste aanvullingen en correcties zijn beschreven in het addendum (zie aanverwant ‘Addendum revisie 2015’) en betreffen onder andere de verduidelijking van de rol van de kindergeneeskundige expertise.
Algemene gegevens
Mandaterende verenigingen/instanties
Nederlandse Vereniging voor Fysiotherapie in de Kinder- en Jeugdgezondheidszorg
Organisatie
Kwaliteitsinstituut voor de Gezondheidszorg CBO
Financiering:
Deze richtlijn is tot stand gekomen met financiële steun van de Orde van Medisch Specialisten in het kader van het programma ‘Evidence-Based Richtlijn Ontwikkeling (EBRO)’.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. Er wordt aangegeven wat, volgens de huidige maatstaven en aansluitend bij de gangbare Nederlandse praktijk, in het algemeen de beste zorg is voor kinderen / jongeren met spasticiteit en CP. De richtlijn is bestemd voor personen met een spastische Cerebrale Parese in de leeftijdsgroep van 0 tot 18 jaar behalve de module met betrekking tot de transitie naar volwassenheid waar een definitie tot 25 jaar wordt gehanteerd. Met ‘kinderen’ wordt in deze richtlijn bedoeld: mensen in de leeftijd van 0 tot 18 jaar. De richtlijn geeft aanbevelingen over de diagnostiek, behandeling van spasticiteit op stoornisniveau, vaardigheidsniveau en participatie, op basis van het ICF-CY model en terminologie. Specifieke doelen van deze richtlijn voor de behandeling van spasticiteit bij kinderen met CP zijn het verkrijgen van uniformiteit met betrekking tot de diagnostiek, en de behandeling en begeleiding in de diverse centra. De richtlijn beoogt de kaders te definiëren waarbinnen de multidisciplinaire zorg van kinderen met spastische CP dient plaats te vinden. Deze richtlijn wil tevens bijdragen aan verbeterde communicatie tussen behandelaars onderling en tussen de patiënt, diens naasten en behandelaars.
Doelgroep
De richtlijn is bedoeld voor zorgverleners die primair bij de behandeling van kinderen met spastische CP betrokken zijn: (kinder-)revalidatieartsen, (kinder-)neurologen, kinderartsen, plastisch chirurgen, (kinder-)fysiotherapeuten, ergotherapeuten en logopedisten. Daarnaast zijn vele andere disciplines meer incidenteel betrokken bij diagnostiek en behandeling van deze kinderen, zoals jeugdartsen, artsen voor verstandelijk gehandicapten, psychosociale hulpverleners, onderwijsdeskundigen etc.
Samenstelling werkgroep
Voor het ontwikkelen van deze richtlijn is in 2004 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle bij de diagnostiek en behandeling van spasticiteit bij kinderen met CP betrokken medische en paramedische disciplines, de Vereniging van Motorisch Gehandicapten en hun Ouders (BOSK) en medewerkers van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie ‘Samenstelling van de werkgroep’).
Bij het samenstellen van de werkgroep is zoveel mogelijk rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties, alsmede met een spreiding van al dan niet academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging.
Kernredactie
- Prof.dr. J.G. Becher, kinderrevalidatiearts, Vrije Universiteit Medisch Centrum, Amsterdam, voorzitter
- Drs. R.F. Pangalila, kinderrevalidatiearts, Rijndam revalidatiecentrum, Rotterdam
- Dr. R.J. Vermeulen, kinderneuroloog, Vrije Universiteit Medisch Centrum, Amsterdam
- Ir. T.A. van Barneveld, epidemioloog, programmamanager, Kwaliteitsinstituut voor de Gezondheidszorg CBO
- Mw.dr. C.J.I. Raats, Kwaliteitsinstituut voor de Gezondheidszorg CBO, adviseur
Werkgroep
- Mw. P. Aarts, ergotherapeute, Sint Maartenskliniek, Nijmegen
- Prof.dr. A.F. Bos, kinderarts, Universitair Medisch Centrum, Groningen
- Mw. L. Bosma, kinderfysiotherapeute, Heliomare Revalidatie, Wijk aan Zee
- Mw. K.A. Bron, directeur BOSK, Utrecht
- Mw. L.M.A. Draaisma-van Trier, ergotherapeute, Sint Maartenskliniek, Nijmegen
- Dr. J.W. Gorter, kinderrevalidatiearts, Universitair Medisch Centrum, Utrecht
- Mw. K. van Hulst, logopedist, Universitair Medisch Centrum St. Radboud, Nijmegen
- Mw. dr. B. Ivanyi, kinderrevalidatiearts, De Vogellanden, Centrum voor revalidatie, Zwolle
- Dr. P.H. Jongerius, revalidatiearts, Sint Maartenskliniek, Nijmegen
- Mw. drs. J.G. Kalf, logopedist, Universitair Medisch Centrum St. Radboud, Nijmegen
- Dr. M. Kreulen, plastisch chirurg, Rode Kruis Ziekenhuis, Beverwijk
- Dr. C.G.B. Maathuis, revalidatiearts, Centrum voor Revalidatie Universitair Medisch Centrum, Groningen
- Dr. H. van de Meent, revalidatiearts, Universitair Medisch Centrum St. Radboud, Nijmegen
- Mw. drs. A. Meester, revalidatiearts, Academisch Medisch Centrum, Amsterdam
- E. Rameckers MRes, kinderfysiotherapeut SRL, locatie Franciscusoord, Valkenburg
- Dr. J.A. van der Sluijs, orthopedisch chirurg, Vrije Universiteit Medisch Centrum, Amsterdam
- Mw. prof.dr. B.C.M. Smits-Engelsman, kinderfysiotherapeut, Universitair Medisch Centrum St. Radboud, Nijmegen
- Mw. drs. L.A.W.M. Speth, kinderrevalidatiearts SRL, locatie Franciscusoord, Valkenburg
Belangenverklaringen
Er zijn geen voor deze richtlijn relevante relaties van werkgroepleden met farmaceutische en/of hulpmiddelenindustrie gemeld.
Inbreng patiëntenperspectief
Het perspectief van patiënten over de zorg rondom een aandoening vormt een waardevolle en essentiële aanvulling in een richtlijn. Daarom was een vertegenwoordiger van de Vereniging van Motorisch Gehandicapten en hun Ouders (BOSK) afgevaardigd in de werkgroep. Daarnaast hebben de landelijke werkgroepen ‘Volwassenen met Cerebrale Parese’ en ‘Ouders van kinderen met Cerebrale Parese’ als focusgroep bijgedragen aan module ‘Ouderbeleving ten aanzien van ziektebeeld Cerebrale Parese’ en submodules ‘Belang van ouderondersteuning’, ‘Interventies voor ouders’ en ‘Belang van trajectbegeleiding’ (Organisatie van zorg bij CP).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de CBO-website geplaatst.
Werkwijze
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. Daarnaast zorgde een redactieteam, bestaande uit de voorzitter, twee werkgroepleden en de adviseurs van het CBO, voor de coördinatie en onderlinge afstemming van de subgroepen. De werkgroep heeft gedurende een periode van ongeveer twee en een half jaar gewerkt aan de tekst voor de conceptrichtlijn. De werkgroepleden schreven afzonderlijk of in de subgroepen teksten die tijdens plenaire vergaderingen werden besproken en na verwerking van de commentaren werden geaccordeerd. De voltallige werkgroep is 28 maal bijeen geweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door het redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd op 7 september 2006 op een landelijke richtlijnbijeenkomst gepresenteerd voor commentaar. Daarnaast is de conceptrichtlijn via websites van het Kwaliteitsinstituut voor de Gezondheidszorg CBO en beroepsverenigingen voorgelegd aan alle leden van de betrokken disciplines. Na verwerking van het commentaar is de definitieve richtlijn op 9 oktober 2006 door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
Wetenschappelijke bewijsvoering
De richtlijn is voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties in de Cochrane library, Medline, Embase, Cinahl en Psychinfo. Hierbij werd de taal gelimiteerd tot Engels, Duits, Frans en Nederlands. Daarnaast werden handmatige zoekacties verricht. Er werd gezocht vanaf 1990 tot en met december 2005, zie zoekverantwoording voor de gebruikte zoekstrategie.
Belangrijke selectiecriteria hierbij waren: vergelijkend onderzoek met hoge bewijskracht, zoals meta-analyses, systematische reviews, randomized controlled trials (RCTs) en controlled trials (CTs). Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohortonderzoek, vergelijkende patiënt-controle studies of niet vergelijkend onderzoek.
De kwaliteit van deze artikelen werd door de werkgroepleden beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs, waarbij de volgende indeling is gebruikt (zie tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd is daarbij vermeld.
Tabel 1. Indeling van de literatuur naar de mate van bewijskracht
|
Niveau: Voor artikelen betreffende: interventie (preventie of therapie) |
|
|
A1 |
systematische reviews die tenminste enkele onderzoeken van A2-niveau betreffen, waarbij de resultaten van afzonderlijke onderzoeken consistent zijn; |
|
A2 |
gerandomiseerd vergelijkend klinisch onderzoek van goede kwaliteit (gerandomiseerde, dubbelblind gecontroleerde trials) van voldoende omvang en consistentie; |
|
B |
gerandomiseerde klinische trials van matige kwaliteit of onvoldoende omvang of ander vergelijkend onderzoek (niet-gerandomiseerd, vergelijkend cohortonderzoek, patiënt-controle-onderzoek); |
|
C |
niet-vergelijkend onderzoek; |
|
D |
mening van deskundigen, bijvoorbeeld de werkgroepleden. |
|
|
|
|
Niveau: Voor artikelen betreffende: diagnostiek |
|
|
A1 |
onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische tests; |
|
A2 |
onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruikgemaakt zijn van tevoren gedefinieerde afkapwaarden en de resultaten van de test en de 'gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multipele, diagnostische tests een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie; |
|
B |
vergelijking met een referentietest, beschrijving van de onderzochte test en populatie, maar niet de kenmerken die verder onder niveau A staan genoemd; |
|
C |
niet-vergelijkend onderzoek; |
|
D |
mening van deskundigen, bijvoorbeeld de werkgroepleden. |
|
|
|
|
Niveau van de conclusies op basis van het bewijs |
|
|
1 |
1 systematische review (A1) of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2; |
|
2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B; |
|
3 |
1 onderzoek van niveau B of C; |
|
4 |
mening van deskundigen, bijvoorbeeld de werkgroepleden. |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang, bijvoorbeeld: patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen.
Het volgen van deze procedure en het opstellen van de richtlijn in dit format heeft als doel de transparantie van de richtlijn te verhogen. Het biedt ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
Zoekverantwoording
Er is naar literatuur gezocht in het Cochrane Library, Medline, Embase (allen vanaf 1989 tot en met 2005), Cinahl (vanaf 1982 tot en met 2005). De taal werd gelimiteerd tot Engels, Duits, Frans en Nederlands.
Patiëntenpopulatie
Zoektermen voor Medline:
3 "Cerebral-Palsy"/ all subheadings
4 "Muscle-Spasticity"/ all subheadings
5 "Quadriplegia"/ all subheadings
6 "Paraparesis-Spastic"/ all subheadings
7 "Hemiplegia"/ all subheadings
8 upper motor neuron syndrome
9 spastic cerebral palsy
10 spastic cerebral paresis
11 spastic paresis
12 spastic paralysis
13 spastic cerebral paralysis
14 explode "Child"/ all subheadings
15 explode "Infant"/ all subheadings
16 "Adolescent"/ all subheadings
17 child* in ti,ab
18 infant* in ti,ab
19 adolescent* in ti,ab
20 #3 or #4 or #5 or #6 or #7 or #8 or #9 or #10 or #11 or #12 or #13
21 #14 or #15 or #16 or #17 or #18 or #19
22 #20 and #21
Voor de andere databases is met vergelijkbare zoektermen gezocht.
Er is naar literatuur gezocht in Medline (vanaf 1989 tot en met 2005) met de volgende zoektermen:
32 "Prognosis-"
33 "Survival-Analysis"
34 #32 or #33
44 "Walking"/ all subheadings
45 explode "Communication"/ all subheadings
46 "Quality-of-Life"/ all subheadings
47 walking*
48 ambulation*
49 communication*
50 activities of daily life
51 hand motor skills
52 fine motor
53 functional limitation*
54 #44 or #45 or #46 or #47 or #48 or #49 or #50 or #51 or #52 or #53
55 #34 and #54
Exclusiecriteria:
- incidentie van CP als uitkomstvariabele van risicogroepen of -situaties (b.v. prematuriteit)
- artikelen uit 3e wereld landen
- patiëntenpopulatie uitsluitend volwassenen
- verworven spasticiteit
- prognose bij zeer specifieke orthopedische chirurgie en vergelijkbare therapieën
In de voorbereidingsfase werden de searches voor de afzonderlijke modules op hoofdlijnen geactualiseerd voor de periode vanaf 2006. Hierbij werden de searches van de oude richtlijn herhaald, waarbij met sensitieve zoekfilters werd gelimiteerd op systematische reviews en/of gerandomiseerde klinische studies. Ook is er nog een algemene search gedaan naar systematische reviews in Medline en de Cochrane Library. De resultaten van deze searches zijn gebruikt bij het bepalen van de noodzaak tot revisie en de prioritering.
|
Database |
Zoektermen Patiëntenpopulatie: beperking systematische reviews |
Totaal |
|
Medline (OVID)
Engels
2006-maart 2012 |
1 "Cerebral-Palsy"/ (13997) 2 "Muscle-Spasticity"/ (6086) 3 "Quadriplegia"/ (6568) 4 "Paraparesis-Spastic"/ (281) 5 "Hemiplegia"/ (9762) 6 "upper motor neuron syndrome".ti,ab. (78) 7 "spastic cerebral palsy".ti,ab. (768) 8 "spastic cerebral paresis".ti,ab. (3) 9 "spastic paresis".ti,ab. (226) 10 "spastic paralysis".ti,ab. (408) 11 "spastic cerebral paralysis".ti,ab. (7) 12 "cerebral palsy".ti,ab. (12623) 13 or/1-12 (37034) 14 exp "Child"/ (1413688) 15 exp "Infant"/ (861255) 16 "Adolescent"/ (1450204) 17 child*.ti,ab. (867040) 18 infant*.ti,ab. (272035) 19 adolescent*.ti,ab. (128498) 20 14 or 15 or 16 or 17 or 18 or 19 (2815428) 21 13 and 20 (19181) 22 limit 21 to (english language and yr="2006 -Current") (4480) 23 1 or 8 or 9 or 12 (17295) 24 20 and 23 (14333) 25 limit 24 to (english language and yr="2006 -Current") (3972) 26 22 not 25 (508) Dit is wat de bredere search extra oplevert t.o.v. de smallere search (alleen specifiek CP), daarom breder gezocht. Zoekfilter SR (186) |
239 |
|
Cochrane Wiley
|
#1 MeSH descriptor Cerebral Palsy explode all trees #2 "cerebral palsy":ti,ab,kw #3 (#1 OR #2) #4 (#3), from 2006 to 2012 52 systematic reviews (Cochrane), 44 Dare-reviews 53 referenties uniek |
|
