Meerwaarde van functionele therapie/BIMT/ CP
Uitgangsvraag
Wat is de meerwaarde van functionele therapie / taakgericht oefenen / BIMT en CIMT op vaardigheidsniveau van de hand?
Aanbeveling
Pas ter verbetering van het vaardigheidsniveau van de hand (capability en performance) bij kinderen met een unilaterale spastische CP in de leeftijd van 2 tot 18 jaar de criteria van functionele therapie toe en baseer de keuze tussen BIMT of mCIMT/CIMT op deze criteria.
De criteria voor functionele therapie zijn (zie voor een toelichting, de module effect van functionele therapie op het lopen en verplaatsen):
-
doelgericht;
-
gericht op activiteiten/participatie van de ICF-CY;
-
taakspecifiek;
-
actieve rol van kind en ouders in het leren/ontdekken/vinden van oplossingen;
-
gericht op functionaliteit in plaats van normaliteit;
-
context specifiek.
Overwegingen
Uit de systematische literatuuranalyse kan worden geconcludeerd dat de BIMT en CIMT een vergelijkbaar positief effect laten zien op handvaardigheden met betrekking tot capacity, capability en individuele doelen.
Intensiteit en duur van therapie
De vergelijking van mCIMT/CIMT en BIMT met een lagere intensiteit standaard therapie (usual care; unequal dose) bleek niet tot andere conclusies te leiden dan vergelijking met een alternatieve therapie van gelijke intensiteit (equal dose; Saksewski 2013). Ten aanzien van de intensiteit van therapie is er dus in deze herziening van de richtlijn geen nieuwe evidence.
Het werken aan individuele doelen binnen de mCIMT/CIMT en BIMT leidt in principe tot afgebakende oefenperiodes waarin specifiek gewerkt wordt aan een of meerdere individuele doelen. Er zijn aanwijzingen dat de positieve behandeleffecten van mCIMT/BIMT langer aanhouden (tot drie maanden) als de duur van de interventieperiode verlengd wordt (van 60 uur naar 90 uur; Gordon 2011; Wang 2013).
Organisatie van therapie
Het aanbieden van mCIMT/CIMT en BIMT of een combinatie van beiden in groepen vraagt een grote voorbereiding en een uitgebreide organisatie en is alleen haalbaar door de zorg voor veel kinderen met dezelfde pathologie (unilaterale CP) te bundelen en te laten uitvoeren door een groot (multidisciplinair) team. Hierdoor zijn de revalidatiecentra zeer geschikt om mCIMT en BIMT vorm te geven (Green 2013; Deppe; Klingels; Aarts 2012).
Om deze intensieve behandelvormen te realiseren wordt gekozen om in te spelen op de beleving van de kinderen door attractieve speelse vormen te kiezen zoals Piraten groep (Aarts 2010, 2012) en Magic camp (Green 2013). Vooral het contact met de lotgenoten en het samen werken aan doelen zijn zeer stimulerend (bij kinderen vanaf twee tot tweeëneenhalf jaar).
In het rapport over consensus en toekomstige richtlijnen over CIMT (Eliasson 2013) komt met name naar voren dat er een grote variatie bestaat in CIMT/mCIMT en combinaties van CIMT en BIMT (hybrid CIMT) tussen de individuele studies (wel of geen shaping, wel of geen functionele activiteiten, wel of geen transferpackage). Ook is er sprake van een grote variatie in de intensiteit van behandeling. Hierdoor is een eenduidige vergelijking tussen behandelmethodes nauwelijks mogelijk. Deze grote klinische heterogeniteit is er mogelijk de oorzaak van dat in de systematische literatuuranalyse (zie samenvatting literatuur) een eventueel verschil in behandeleffecten tussen CIMT en BIMT niet kon worden aangetoond.
Ook in een recente systematische review (Novak et al., 2013) wordt geconcludeerd dat mCIMT/CIMT en BIMT behandelingen zijn met een vergelijkbare effectiviteit. Aan deze conclusie kent Novak echter een hoge bewijskracht toe. Conclusie en bewijskracht zijn grotendeels gebaseerd op dezelfde studies als in Sakzewski en de huidige systematische literatuuranalyse. De gradering van de bewijskracht in Novak is echter niet transparant en derhalve blijft onduidelijk hoe de gegradeerde conclusies en aanbevelingen tot stand zijn gekomen.
Therapeutische subgroepen
Op basis van de geïncludeerde studies is momenteel niets te concluderen over effectiviteit van CIMT en BIMT bij verschillende subgroepen, bijvoorbeeld op basis van leeftijd of MACS-niveau. De studie van Geerdink (2013) maakt aannemelijk dat met betrekking tot motorische vaardigheden (gemeten met de box en block test), kinderen jonger dan vijf jaar een effectievere (snellere en langere) leercurve hebben dan kinderen ouder dan vijf jaar. Deze resultaten suggereren dat het op jonge leeftijd starten met mCIMT of BIMT mogelijk de voorkeur heeft boven starten op latere leeftijd.
Samenvattend
Op basis van de systematische literatuuranalyse kan worden geconcludeerd dat CIMT en BIMT gelijkwaardige positieve effecten laten zien op arm hand vaardigheid, maar uit de literatuuranalyse blijkt weinig tot geen meerwaarde van CIMT of BIMT ten opzichte van controle therapie. De meerwaarde van CIMT en BIMT is mogelijk niet aan te tonen door de grote klinische heterogeniteit die bestaat tussen de huidige studies.
Onderbouwing
Achtergrond
Revisie van deze gecombineerde uitgangsvraag (onderwerpen 'functionele therapie' en 'Forced Use' uit de eerdere richtlijn) is noodzakelijk omdat alle benoemde therapie onderdelen op dit moment frequent uitgevoerde therapie-modellen zijn in de kinderrevalidatie en er sinds 2006 veel wetenschappelijke publicaties verschenen zijn over de Constraint Induced Movement Therapy (CIMT) en de Bimanual Intensive Movement Therapy (BIMT). Knelpunten in de huidige praktijk zijn de grote variatie in de hantering van de therapiemodellen en onduidelijkheid over de lange termijn effecten van deze behandelopties. Studies over specifiek functionele therapie voor de arm/handvaardigheden zijn niet verschenen.
Revisie moet zich vooral richten op BIMT als de huidige (‘moderne’) vorm van functioneel en taakgericht oefenen en op CIMT en modified CIMT (mCIMT) als de moderne vormen van forced use therapie. De criteria van functionele therapie zoals uitgewerkt in de module functionele therapie en lopen zijn identiek aan de criteria voor de functionele therapie in dit hoofdstuk en komen tot uiting in met name de BIMT en combinatie vormen van CIMT met BIMT (hybrid CIMT).
De criteria voor functionele therapie zijn (zie voor een toelichting, de module effect van functionele therapie op het lopen en verplaatsen):
- doelgericht;
- gericht op activiteiten/participatie van de ICF-CY;
- taakspecifiek;
- actieve rol van kind en ouders in het leren/ontdekken/vinden van oplossingen;
- gericht op functionaliteit in plaats van normaliteit;
- contextspecifiek.
De criteria van de functionele therapie zijn wel terug te vinden in de BIMT programma’s (doelgericht, activiteitenniveau, taakspecifiek, functionaliteit, actieve rol kind), maar nauwelijks in CIMT /mCIMT programma’s.
De literatuuranalyse beperkt zich tot de effecten van therapie op activiteitenniveau, omdat deze bepalend zijn voor het nut van de therapeutische interventie. Effecten op lichaamsfunctieniveau spelen een ondergeschikte rol. Indien in de studies effecten op lichaamsfunctieniveau zijn geëvalueerd, dan worden deze indien relevant beschreven bij de Overwegingen.
Conclusies
|
Zeer laag GRADE |
CIMT leidt mogelijk tot een lichte verbetering van het vermogen van handvaardigheid (capacity) in vergelijking tot BIMT.
Bronnen (Sakzewski et al., 2014; Deppe et al., 2013) |
|
Laag GRADE |
Er is onvoldoende bewijs voor een mogelijk verschil in effectiviteit van CIMT in vergelijking tot BIMT met betrekking tot het verbeteren van het toepassen van handvaardigheid in de eigen omgeving (capability).
Bronnen (Sakzewski et al., 2014; Deppe et al., 2013) |
|
Laag GRADE |
CIMT en BIMT lijken een vergelijkbare effectiviteit te hebben in het verbeteren van de uitvoering van handvaardigheid (performance).
Bronnen (Sakzewski et al., 2014; Deppe et al., 2013) |
|
Laag GRADE |
CIMT en BIMT lijken een vergelijkbare effectiviteit te hebben in het verbeteren van het behalen van individueel bepaalde doelen op het gebied van tweehandige vaardigheden.
Bronnen (Sakzewski et al., 2014; Deppe et al., 2013) |
|
Laag GRADE |
Er zijn geen aanwijzingen voor ernstige bijwerkingen of complicaties als gevolg van CIMT, BIMT.
Bronnen (Sakzewski et al., 2014) |
Samenvatting literatuur
In de eerdere versie van de richtlijn (2006) werd een onderscheid gemaakt tussen functionele therapie / taakgericht oefenen en ‘forced use’ (constraint-induced movement therapy, CIMT). Inmiddels zijn CIMT, bimanuele therapie (BIMT) en functionele benadering volledig integraal opgenomen in de kinderrevalidatie voor kinderen met spastische CP. In de huidige uitgangsvraag worden deze benaderingen dan ook samen geanalyseerd.
De eerdere versie van de richtlijn concludeerde dat taakgericht oefenen van een manuele vaardigheid een relevante verbetering oplevert op de korte termijn en het vroegtijdig beginnen met taakgericht oefenen (vanaf één tot zeven jaar) van bimanuele vaardigheden verslechtering van de handfunctie kan voorkomen. Deze conclusies waren echter gebaseerd op slechts een viertal, kleine, observationele, studies waarin de effecten van de therapie ten opzichte van baseline werden geëvalueerd. Met betrekking tot forced use (CIMT) concludeert de richtlijn dat immobilisatie van de niet aangedane arm/hand effectief is en leidt tot een verbetering van de vaardigheid van de meer aangedane hand voor tenminste zes maanden. Deze conclusie wordt weliswaar ondersteund door een drietal trials, maar slechts één betreft een gerandomiseerd onderzoek van kinderen met spastische CP (Taub 2014).
Beschrijving nieuwe studies
De systematische review van Sakzewski is een recente systematische review van goede kwaliteit (zie risk of bias tabel bij evidencetabellen). Sakzewski dekt de literatuur tot december 2012 en includeert gerandomiseerd onderzoek naar de effecten van niet-chirurgische therapie op de handvaardigheid van kinderen met unilaterale spastische cerebrale parese (zie exclusietabel bij evidencetabellen). De SR omvat 27 studies naar functionele oefentherapie: vijf klassieke CIMT studies (onder andere Taub 2014; zie boven) waarin de niet aangedane arm/hand werd geïmmobiliseerd met behulp van gips (: classical CIMT, cCIMT), 20 studies waarin meer kindvriendelijke immobilisatiemethoden werden gebruikt zoals een mitella of handschoen (: modified CIMT, mCIMT) en twee studies waarin CIMT werd gecombineerd met bimanuele therapie (: mCIMT+BIMT).
Sakzewski beoordeelt de studiekwaliteit van de individuele studies met de PEDro schaal onder andere op randomisatie, blindering van toewijzing van de behandeling en blindering van behandelaar, patiënt en beoordelaar (zie exclusietabel bij evidencetabellen). De methodologische kwaliteit van de RCT’s is overwegend matig, geen van de cCIMT studies en slechts 7 van de 20 (35%) van de mCIMT studies is van hoge methodologische kwaliteit. Bij de helft van alle studies is geen sprake van een adequate blindering van de randomisatie. Aan de SR zijn twee recentere RCT’s (Deppe; Klingels) toegevoegd van hoge kwaliteit (zie laatste tabel bij evidencetabellen).
De studies vertonen aanzienlijke klinische heterogeniteit met verschillen in met name de frequentie, intensiteit en duur van de behandeling en de context waarin behandeling plaatsvindt (in de thuissituatie, kleuterschool of kliniek). Als deze klinische heterogeniteit als acceptabel wordt beschouwd, is een kwantitatieve analyse (meta-analyse) mogelijk voor het vermogen van handvaardigheid (capacity) met als meetinstrument QUEST-Grasp en uitvoering van handvaardigheid (performance) met als meetinstrumenten de AHA en COPM-performance. Een klein aantal studies rapporteert de PEDI-selfcare als meetinstrument voor toepassen van handvaardigheid in de eigen omgeving (capability), door het geringe aantal studies en een grote klinische heterogeniteit is een meta-analyse niet zinvol. Om te corrigeren voor verschillen in meetschaal en precisie (grootte van de studiepopulatie) tussen de individuele studies, maakt Sakzewski (2014) gebruik van de SMD (standardized Mean Difference), het gemiddelde groepsverschil gedeeld door de (gezamenlijke) standaarddeviatie in beide onderzoeksgroepen.
Het vermogen van handvaardigheid (capacity) – belangrijke uitkomstmaat
Ter beoordeling van de positieve effecten van CIMT (cCIMT, mCIMT) op het vermogen van handvaardigheid (capacity) is een meta-analyse mogelijk van de resultaten verkregen op de QUEST-Grasp (figuur 10.1; Sakzewski). In de analyses wordt onderscheid gemaakt tussen CIMT versus een alternatieve therapie met een vergelijkbare intensiteit (‘equal dose alternative’, meestal BIMT) en CIMT versus functionele oefentherapie of standaard therapie met een lagere intensiteit (‘control/unequal dose’). Daarnaast wordt ook het overall positief effect bepaald waarbij bovenstaande vergelijkingen worden samengenomen.
Figuur 10.1 Meta-analyse van de effecten van CIMT/mCIMT op het vermogen van handvaardigheid (capacity): QUEST-Grasp postinterventie. Fixed effects model (Sakzewski 2014).
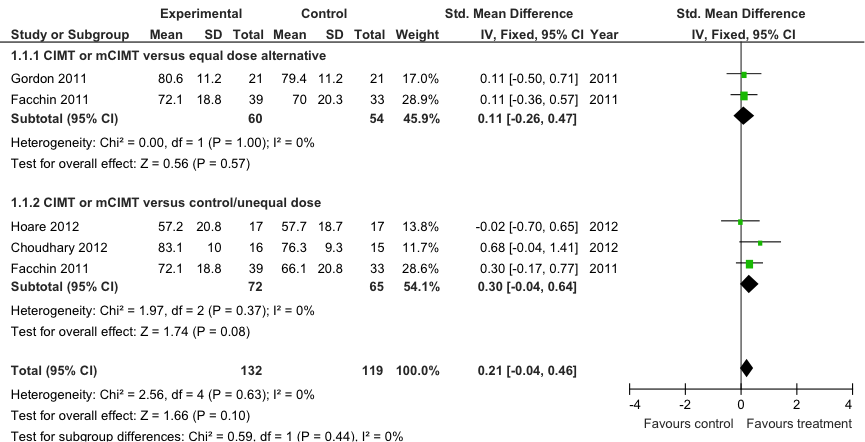
Meta-analyse van het effect van CIMT op het vermogen van handvaardigheid (QUEST-Grasp) laat geen statistisch significant verschil zien tussen CIMT en een alternatieve behandeling (BIMT, HABIT) van vergelijkbare intensiteit: direct na de interventie is het gemiddelde verschil in QUEST score, SMD= 0,11 (95%BI= [-0,26; 0,47]; twee studies, n=114 patiënten; figuur 10.1), in het voordeel van de interventiegroep. Ook bij vergelijking met een controle-interventie van lagere intensiteit wordt geen statistisch significant verschil bereikt: SMD=0,30 (95%BI= [-0,04; 0,67]; drie studies, n=137 patiënten), in het voordeel van de interventiegroep. Als in de meta-analyse bovenstaande vergelijkingen worden samengenomen bedraagt het overall positieve effect van CIMT op de QUEST score: SMD= 0,21 (95%BI= [-0,04; 0,46]; vijf studies, n=251 patiënten), in het voordeel van de interventiegroep. Deze groepsverschillen zijn statistisch niet significant en waarschijnlijk eveneens klinisch niet relevant, Een meta-analyse van het behandeleffect na zes maanden followup, geeft nog kleinere verschillen tussen interventie (CIMT) en controle te zien. Geen van de individuele studies laat een statistisch significant verschil zien tussen interventie- en controlegroep (figuur 10.1).
In de aanvullende studies (Deppe 2013; Klingels 2013) wordt de QUEST niet gerapporteerd, maar wel resultaten op de Melbourne (MUUL) vermeld. Deppe vergelijkt in een vierweekse behandeling mCIMT met BIMT (van vergelijkbare intensiteit; n= 29 kinderen met CP) en vindt een grotere toename op MUUL in de mCIMT groep. De gemiddelde toename ten opzichte van baseline bedraagt 6,4 procentpunt (SD 5,7) in de mCIMT groep versus 2,2 (SD 4,6) in de BIMT groep, het groepsverschil is mogelijk klinisch relevant maar bereikt net geen statistische significantie (p=0.051). Klingels vergelijkt mCIMT met een behandeling waarin naast mCIMT (met dezelfde intensiteit) additioneel BIMT werd toegepast (n= 51 kinderen met CP). Na afloop van de tienweekse behandeling en na tien weken followup werd geen klinisch relevant of statistisch significant verschil waargenomen in de Melbourne score tussen de behandelgroepen (p=0,56).
Toepassen van handvaardigheid in de eigen omgeving (capability) – kritieke uitkomstmaat
Een drietal van de geïncludeerde studies (Sakzewski; Hoare 2012; de Brito 2012; de Brito 2010) rapporteert de PEDI-selfcare, maar met name door grote verschillen in de duur van de interventies is de klinische heterogeniteit te groot en een meta-analyse niet zinvol. Geen van de individuele studies geeft een statistisch significant verschil te zien in PEDI-selfcare scores tussen interventie- en controlegroep (zie tabel 2 in de Zoekverantwoording). Van de aanvullende studies rapporteert Deppe de PEDI-selfcare en vindt na afloop van de vierweekse behandeling een statistisch niet significant en klinisch niet relevant verschil tussen mCIMT en BIMT (van vergelijkbare intensiteit).
Uitvoering van handvaardigheid (performance) – kritieke uitkomstmaat
Ter beoordeling van de effecten van CIMT op de uitvoering van handvaardigheid (performance) is een meta-analyse mogelijk van de resultaten verkregen op de AHA (figuur 10.2 en 10.3; Sakzewski).
Figuur 10.2 Meta-analyse van de effecten van CIMT/mCIMT op de uitvoering van handvaardigheid (performance): AHA postinterventie. Random effects model (Sakzewski 2014).
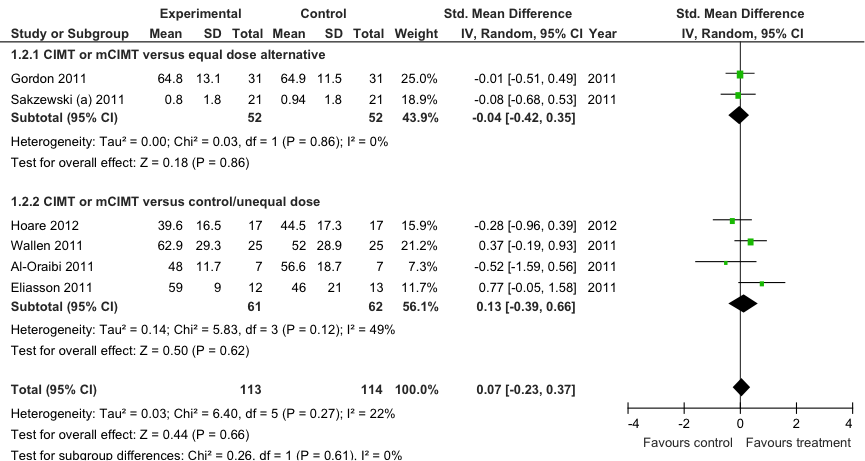
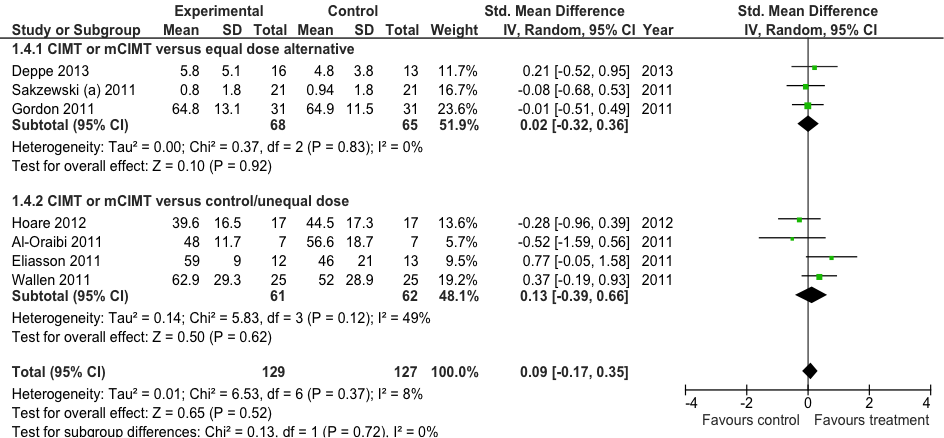
Meta-analyse van het effect van CIMT op de uitvoering van handvaardigheid (performance) gemeten met de AHA geeft geen statistisch significant verschil te zien tussen CIMT en een alternatieve behandeling (BIMT, HABIT) van vergelijkbare intensiteit: direct na de interventie is het gemiddelde verschil in AHA score, SMD= -0,04 (95%BI= [-0,42; 0,35]; twee studies, n=104 patiënten; figuur 10.2), in het voordeel van de controlegroep. Ook bij vergelijking met een controle-interventie van lagere intensiteit wordt geen statistisch significant verschil bereikt: SMD=0,13 (95%BI= [-0,39; 0,66]; vier studies, n=123 patiënten), in het voordeel van de interventiegroep. Als in de meta-analyse bovenstaande vergelijkingen worden samengenomen bedraagt het overall positieve effect van CIMT op de AHA score: SMD= 0,07 (95%BI= [-0,23; 0,37]; zes studies, n=227 patiënten), in het voordeel van de interventiegroep. Deze groepsverschillen zijn statistisch niet significant en waarschijnlijk eveneens klinisch niet relevant, Een meta-analyse van het behandeleffect na zes maanden followup, geeft vergelijkbare resultaten (zie exclusietabel bij evidencetabellen). Geen van de individuele studies geeft een statistisch significant verschil te zien tussen interventie- en controlegroep (figuur 10.2). Een update van de meta-analyse door inclusie van Deppe (mCIMT versus BIMT) leidt niet tot nieuwe inzichten (figuur 10.3): overall SMD= -0,09 (95%BI= [-0,17; 0,35]; zeven studies, n=256 patiënten).
Klingels vergelijkt mCIMT met een behandeling waarin naast mCIMT (met dezelfde intensiteit) additioneel BIMT werd toegepast (n= 51 kinderen met CP) en vindt een statistisch significant verschil in AHA scores in het voordeel van de gecombineerde behandeling (p=0,04). Hierbij dient wel te worden opgemerkt dat de gemiddelde AHA scores van de twee behandelgroepen vergelijkbaar zijn na afloop van de tienweekse behandeling en na tien weken followup en alleen significant van elkaar verschillen op baseline. Klingels (2013) rapporteert scores op de ABILHAND-kids als een tweede maat voor de uitvoering van handvaardigheid (performance) en vindt geen statistisch significant verschil tussen de behandelgroepen (mCIMT versus BIMT met vergelijkbare intensiteit; p=0,40).
Figuur 10.3 Update: meta-analyse van de effecten van CIMT/mCIMT functionele oefentherapie op de uitvoering van handvaardigheid (performance): AHA postinterventie. Random effects model (Sakzewski 2014; Deppe 2013, Klingels 2013).
Individueel bepaalde doelen op het gebied van tweehandige vaardigheden (capacity en performance) – kritieke uitkomstmaat
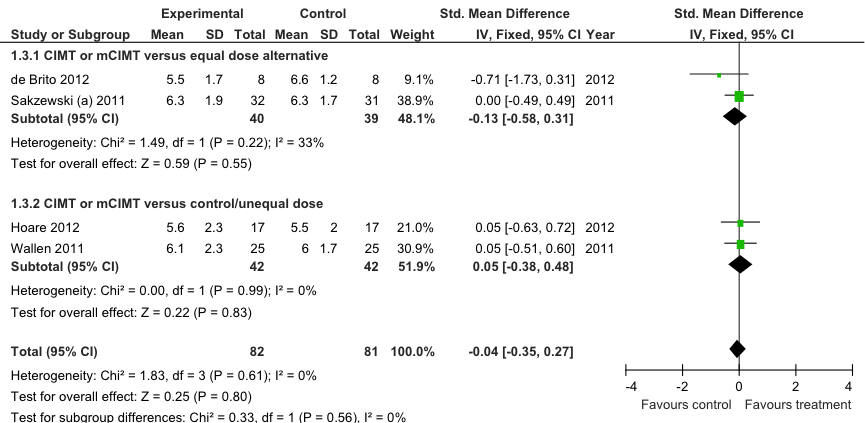
Ter beoordeling van de positieve effecten van CIMT op het behalen van individueel bepaalde doelen op het gebied van tweehandige vaardigheden (capacity en performance) is een meta-analyse mogelijk van de resultaten verkregen op de COPM-performance (figuur 10.4; Sakzewski).
Meta-analyse van het effect van CIMT op het behalen van individueel bepaalde doelen op het gebied van tweehandige vaardigheden gemeten met de COPM-performance geeft eveneens geen statistisch significant verschil te zien tussen CIMT en een alternatieve behandeling (BIMT, HABIT) van vergelijkbare intensiteit: direct na de interventie is het gemiddelde verschil in COPM score, SMD= -0,13 (95%BI= [-0,58; 0,31]; twee studies, n=79 patiënten; figuur 10.4), in het voordeel van de controlegroep. Ook bij vergelijking met een controle-interventie van lagere intensiteit wordt geen statistisch significant verschil bereikt: SMD=0,05 (95%BI= [-0,38; 0,48]; twee studies, n=84 patiënten), in het voordeel van de interventiegroep. Als in de meta-analyse bovenstaande vergelijkingen worden samengenomen bedraagt het overall positieve effect van CIMT op de COPM score: SMD= -0,04 (95%BI= [-0,35; 0,27]; vier studies, n=163 patiënten), in het voordeel van de controlegroep. Deze groepsverschillen zijn statistisch niet significant en waarschijnlijk eveneens klinisch niet relevant. Geen van de individuele studies geeft een statistisch significant verschil te zien tussen interventie- en controlegroep (figuur 10.4).
Figuur 10.4 Meta-analyse van de effecten van CIMT/mCIMT op het behalen van individueel bepaalde doelen op het gebied van tweehandige vaardigheden: COPM-performance postinterventie. Fixed effects model (Sakzewski 2014).
Algemene uitkomstmaten - bijwerkingen en complicaties
Er worden geen ernstige bijwerkingen of complicaties gemeld van CIMT, BIMT. Formeel moet wel worden vermeld dat de studieomvang (power) van de geïncludeerde RCT’s niet is afgestemd op de analyse van zeldzame (ernstige) bijwerkingen en complicaties. Milde bijwerkingen worden wel geconstateerd, CIMT (cCIMT) kan gepaard gaan met milde huidirritaties als gevolg van immobilisatie van de arm/hand met gips en vijf van de 20 mCIMT studies rapporteren een lage tolerantie voor het dragen van een mitella of handschoen aan de niet aangedane arm/hand bij 8 tot 20% van de kinderen (Sakzewski 2014).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat vermogen van handvaardigheid (capacity) is met drie niveaus verlaagd (ten opzichte van de richtlijn in 2006) gezien beperkingen in de onderzoeksopzet (grootste studie heeft lage studiekwaliteit; één punt aftrek), ernstige imprecisie (geringe studieomvang ook na pooling, betrouwbaarheidsinterval bevat nul effect; twee punten aftrek). De bewijskracht voor de uitkomstmaat toepassen van handvaardigheid in de eigen omgeving (capabilitiy) is met twee niveaus verlaagd vanwege imprecisie (geringe studieomvang ook na pooling, betrouwbaarheidsinterval bevat nul effect; twee punten aftrek). De bewijskracht voor de uitkomstmaat de uitvoering van handvaardigheid (performance) is met twee niveaus verlaagd vanwege imprecisie (betrouwbaarheidsinterval bevat het klinisch relevant effect; twee punten aftrek). De bewijskracht voor de uitkomstmaat voor individuele doelen (COPM) is met twee niveaus verlaagd vanwege imprecisie (geringe studieomvang ook na pooling, betrouwbaarheidsinterval bevat nul effect; twee punten aftrek). De bewijskracht voor de uitkomstmaat ernstige bijwerkingen en complicaties is verlaagd met twee niveau’s, twee punten aftrek vanwege ernstige imprecisie (studieomvang niet afgestemd op analyse van zeldzame events zoals ernstige bijwerkingen en complicaties).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling: wat zijn de gunstige en ongunstige effecten van functionele oefentherapie/BIMT en CIMT op de handvaardigheid van kinderen met spastische cerebrale parese? De literatuuranalyse richt zich op: BIMT / CIMT / combinaties van BIMT en CIMT versus controle, waarbij de controle-interventie bestaat uit (a) een alternatieve therapie met een vergelijkbare intensiteit (een zelfde ‘dosis’); of (b) dezelfde therapie of standaard therapie met een lagere intensiteit (een lagere ‘dosis’).
Relevante uitkomstmaten
Er wordt onderscheid gemaakt tussen capacity, capability en performance van de handvaardigheid. Onder capacity wordt verstaan of een patiënt een taak of activiteit zoals een voorwerp hanteren, kan in een gestandaardiseerde omgeving (can do). Capability geeft weer wat een patiënt kan in zijn eigen omgeving. Onder performance wordt verstaan wat een patiënt in eigen omgeving feitelijk doet (does do). Bij het meten van handvaardigheid is van belang of er unilateraal of bimanueel gemeten wordt. In het eerste geval wordt alleen de aangedane hand gemeten, in het tweede geval wordt de aangedane hand als ondersteunende hand bij tweehandig vaardigheden beoordeeld.
De relevante uitkomstmaten zijn gekozen in overeenstemming met de module botulinetoxine-A en handvaardigheid. In voornoemde module is eveneens een beschrijving van de relevante meetinstrumenten terug te vinden.
De werkgroep acht het vermogen van eenhandige handvaardigheid (capacity) een belangrijke uitkomstmaat, met de Melbourne assessment of unilateral upper limb function (MUUL) en Quality of Upper Extremity Skills Test (QUEST) als relevante meetinstrumenten. Toepassen van handvaardigheid in het algemeen (eenhandig of tweehandig) in de eigen omgeving (capability) wordt benoemd als een kritieke uitkomstmaat, met de Pediatric Evaluation of Disability Inventory (PEDI; selfcare) en Functional Independence Measure for Children (WeeFIM; selfcare) en de Assessment of Motor and Proces Skills (AMPS; Fisher 2003; uitvoering van ADL-taken) als relevante meetinstrumenten. Uitvoering van tweehandige handvaardigheid (performance) is eveneens een kritieke uitkomstmaat; de Assisting Hand Assessment (AHA) en ABILHAND-kids zijn hiervoor de meest relevante instrumenten. De scoring van de individueel bepaalde doelen op het gebied van tweehandige vaardigheden is ook een kritische uitkomstmaat. De Goal Attainment Scaling (GAS) en Canadian Occupational Performance Measure (COPM) zijn de relevante meetinstrumenten.
Klinische relevantie
De werkgroep definieerde het klinisch relevant verschil als een verschil van tenminste: 12 punten op de MUUL, 12% van de in totaal 100 punten (Randall 1999), 10% van de helft van de in totaal 174 punten (bij bilaterale scoring) dus 8,7 punten op de QUEST (DeMatteo 1992), twee punten op de COPM volgens de oorspronkelijke handleiding (Law 1998) en een GAS score van groter of gelijk aan 0 (Steenbeek 2011) en bij gebruik van de T score een score groter dan 50 (Lynne Turner-Stokes 2009). Uitgaande van een verschil van 10% op een schaal van 20-80 zou het minimale klinisch relevante verschil van de GAS zes punten zijn. Bij de AHA wordt een verschil van meer dan 0,97 logit (Krumlinde-Sundholm, 2012) gebruikt als klinische relevant verschil. Voor meetinstrumenten waar geen minimaal klinisch relevante verschillen bekend zijn werd een verschil van minimaal 10% van het meetbereik aangehouden als klinisch relevant voor de hele groep kinderen met CP (GMFCS-categorie I-V).
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Cinahl en Cochrane is met relevante zoektermen gezocht vanaf 2006. De zoekverantwoording is weergegeven in de desbetreffende sectie. De literatuurzoekactie leverde 288 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review of RCT, waarbij de effecten van functionele oefentherapie bij kinderen met spastische CP op activiteitenniveau (handvaardigheid) zijn beschreven. Op basis van titel en abstract werd in eerste instantie één studie geselecteerd (Sakzewski et al., 2014). Sakzewski is een systematische review van goede kwaliteit (zie Table of quality assessment in de Zoekverantwoording) en dekt de literatuur tot december 2012. Op basis van titel en abstract werden 12 recentere studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden tien studies geëxcludeerd (zie exclusietabel bij evidencetabellen) en twee studies definitief geselecteerd.
Naast de recente systematische review (Sakzewski), zijn een tweetal RCT’s opgenomen in de literatuuranalyse (Deppe et al., 2013; Klingels et al., 2013). De belangrijkste studiekarakteristieken en resultaten zijn samengevat in de evidencetabellen.
Referenties
- Deppe W, Thuemmler K, Fleischer J, et al. Modified constraint-induced movement therapy versus intensive bimanual training for children with hemiplegia - a randomized controlled trial. Clin Rehabil 2013;27:909-920. PubMed PMID: 23818409.
- Klingels K, Feys H, Molenaers G, et al. Randomized trial of modified constraint-induced movement therapy with and without an intensive therapy program in children with unilateral cerebral palsy. Neurorehabil Neural Repair 2013;27:799-807. PubMed PMID: 23901061.
- Krumlinde-Sundholm L. Reporting outcomes of the Assisting Hand Assessment: what scale should be used? Dev Med Child Neurol 2012;54:807-808. PubMed PMID: 22803624.
- Novak I, McIntyre S, Morgan C, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Dev Med Child Neurol 2013;55:885-910. PubMed PMID: 23962350.
- Sakzewski L, Ziviani J, Boyd RN. Efficacy of upper limb therapies for unilateral cerebral palsy: a meta-analysis. Pediatrics 2014;133:e175-204. PubMed PMID: 24366991.
Evidence tabellen
Evidence table for (systematic review of) RCT’s and observational studies (intervention studies)
Research question: What is the value of CIMT and BIMT in treatment of the upper extremity in children with cerebral palsy, at the level of (bi)manual functioning?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Sadzewski 2014
[individual study characteristics deduced from Sadzewski 2014]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCT’s / cohort / case-control studies]
Literature search up to Dec 2012
CIMT 5 studies A: Taub 2004 B: DeLuca 2006 C: Taub 2011 D: Case-Smith 2012 E: DeLuca 2012
mCIMT 20 studies F: Charles 2006 G: Smania 2009 H: Al-Oraibi 2011 I: Lin 2011 J: Sakzewski 2011a K: Sakzewski 2011b L: Sakzewski 2011c M: Wallen 2011 N: Gordon 2011 O: Eliasson 2011 P: Facchin 2011 Q: Fedrizzi 2012 R: Xu 2012 S: Hsin 2012 T: Chen 2012 U: de Brito 2012 V: Rostami 2012a W: Rostami 2012b X: Choudhary 2012 Y: Hoare 2012
nCIMT+BIMT 2 studies; n=68 Z: de Brito 2010 ZZ: Aarts 2010
Study design: RCT’s; parallel except B,C,G,O (crossover RCT’s)
|
Inclusion criteria SR: RCT; age 0-18; (subset with) unilat CP;nonsurgical UL therapy; uni or bimanual capacity and performance, individualized goals, or self-care skills.
Exclusion criteria SR: quasi-random; general developm therapy without specified UL training; assessed impairment, quality of life, or participation
27 studies included (cCIMT, mCIMT, CIMT+BIMT)
cCIMT 5 studies; age A: 7m-8y B: 7m-8y C: 2y-6y D: 3y-6y E: 3y-6y
mCIMT 20 studies; age F: 4y-8y G: 1y-9y H: 2y-9y I: 4y-9y J: 5y-16y K: ,, L: ,, M: 2y-7y N: 3y-10y O: 1,5y-5y P: 2y-8y Q: 2y-8y R: 2y-14y S: 6y-8y T: 6y-12y U: 3.7y- 10,3y V: 6,2y (mean) W: 6y-11y X: 3y-8y Y: 1,5y-6y
nCIMT+BIMT 2 studies; age Z: 4y-8y ZZ: 2,5y-8y
|
CIMT
cCIMT (5 studies) [n] A: CIMT [9] B: CIMT [9] C: CIMT [10] D: CIMT 6h/d [9] E: CIMT 6h/d [9]
mCIMT (20 studies) F: mCIMT [11] G: mCIMT [5] H: mCIMT [7] I: mCIMT [10] J: mCIMT [32] K: ,, L: ,, M: mCIMT [25] N: mCIMT [21] O: Eco mCIMT [12] P: mCIMT [39] Q: mCIMT [39] R: mCIMT+FES; mCIMT [23] S: mCIMT home [11] T: mCIMT home [24] U: mCIMT [8] V: mCIMT home [7] W: mCIMT [8] X: mCIMT [16] Y: BoNT-A+CIMT [17]
mCIMT+BIMT (2 studies) Z: mCIMT+BIM [8] ZZ: mCIMT-BiT [28]
|
Equal dose alternative, or Control (unequal dose)
A: regular therapy [9] B: control [9] C: usual care [10] D: CIMT (3h/d) [9] E: CIMT (3h/d) [9]
F: control [11] G: PT [5] H: NDT [7] I: therapy [11] J: BIM training [31] K: ,, L: ,, M: standard OT [25] N: HABIT [21] O: usual care [13] P: BIM training [33] Q: standard care [33] R: mCIMT; OT [23] S: standard care [11] T: standard care [23] U: HABIT [8] V: mCIMT clinic [7] W: mCIMT+VR [8] X: regular therapy [15] Y: BoNT-A+BIM OT [17]
Z: regular therapy [8] ZZ: regular therapy [24]
|
End-point of follow-up: Postintervention; 6-months postintervention
Length of intervention I/C A: 3w/3w B: 3w/3w C: 2.1w/2.1w D: 3w/3w E: 3w/3w
F: 2w/2w G: 5w/5w H: 8w/8w I: 4w/4w J: 2w/2w K: 2w/2w L: ,, M: 8w/8w N: 3w/3w O: 8w/8w P: 10w/10w Q: 10w/10w R: 2w/2w S: 4w/4w T: 4w/4w U: 3w/3w V: 3w/3w W: 4w/4w X: 4w/4w Y: 8w/8w
Z: 3w/3w ZZ: 8w/8w
|
Standardized mean difference (SMD) [95%CI]; SMD=group difference devided by pooled SD
Capacity: QUEST-Grasp Capability: PEDI-selfcare Performance: AHA; COPM-performance Adverse events
(a) comparison equal dose (b) control (unequal dose)
Positive SMD favors CIMT Negative SMD favors control
Capacity: QUEST-Grasp Postintervention (a) 2 studies: P, N [114] SMD= 0.11 [-0.26; 0.47] NS (b) 3 studies: P,X,Y [137] SMD= 0.30 [-0.04; 0.64] NS Total 5 studies [241] SMD= 0.21 [-0.04; 0.46] NS Fixed effects model; I2=0%
6 months postintervention (a) 2 studies [114] SMD= 0.07 [-0.29; 0.44] NS (b) 2 studies [106] SMD= 0.18 [-0.21; 0.56] NS Total 4 studies [220] SMD= 0.12 [-0.14; 0.39] NS Fixed effects model; I2=0%
All differences are statistically non-significant
Capability: PEDI-selfcare 3 studies no meta-analysis possible Y: 4/12/26weeks [n=34], resp SMD= -0.64 [-1.31; 0.06] NS SMD= -0.32 [-0.99; 0.36] NS SMD= -0.55 [-1.22; 0.15] NS U: 15 days [n=16] SMD= -0.60 [-1.57; 0.43] NS Z: 1/4 weeks [n=15], resp SMD= 0.63 [-0.44;1.63] NS SMD= 0.78 [-0.31;1.78] NS
All differences are statistically non-significant
Performance: AHA Posterintervention (a) 2 studies: N,J [104] SMD= -0.04 [-0.42;0.35] NS (b) 4 studies: H,O,Y,M [123] SMD= 0.13 [-0.39; 0.66] NS Total 6 studies [127] SMD= 0.07 [-0.23; 0.37] NS Random effects model; I2=22%
6 months postintervention (a) 2 studies: N,J [100] SMD= -0.09 [-0.48;0.30] NS (b) 2 studies: Y,M [84] SMD= 0.10 [-0.72;0.92] NS Total 4 studies [184] SMD= 0.02 [-0.34; 0.37] NS Random effects model; I2=32%
COPM-performance Postintervention (a) 2 studies: U,J [79] SMD= -0.13 [-0.58; 0.31] NS (b) 2 studies:Y,M [84] SMD= 0.05 [-0.38; 0.48] NS Total 4 studies [163] SMD= -0.04 [-0.35; 0.27] NS Fixed effects model; I2=0%
All differences are statistically non-significant
Adverse events Minor skin irritations were reported after casting for cCIMT; poor tolerance with wearing a mitt/constraint in mCIMT was reported in 5 studies (8%–20% of cohort); difficulties achieving the proposed dose of home practice/constraint wear were reported in studies of mCIMT ranging from achievement of 50% to 80% of the anticipated dose. |
Authors conclude that there is modest evidence that intensive activity-based, goal-directed interventions (eg, CIMT, BIMT) are more effective than standard care in improving UL and individualized outcomes. There is strong evidence that goal-directed OT home programs are effective and could supplement hands-on direct therapy to achieve increased dose of intervention.
Note: individual studies do not show a statistically significant effect, and all pooled effect estimates are statistically non-significant. All CIs include the null effect, and some CIs include both a considerable effect in favour of the treatment (CIMT) as well as an effect favouring the control
Methodological quality PEDro; total; Max score = 10 H (score≥8); L (score<6) CA (conc alloc) cCIMT A5;B4;C5;D6;E6 H: none; L: 3 (60%) CA:D,E (40%) mCIMT F5;G5;H4;I6;J8; K7;L8;M8;N8; O6;P5;Q6;R6;S7; T6;U6;V5;W8;X8;Y8 H: 7 (35%); L: 5 (25%) CA: J,K,L,M,N, S,U,W,X,Y (50%) CIMT+BIMT Z8;ZZ6 H: 1 (50%); L: none CA: Z (50%) Note: low number of high quality studies; low number of studies with allocation concealment
Clinical relevance: not discussed; paper contains following general statement ‘Continuous outcomes for each study were summarized by using means, effect sizes (ESs), and 95% confidence intervals (CIs). An ES of 0.2 was considered small, 0.4 to 0.6 moderate, and 0.8 large.’ [Note: these numbers are not defined in relation to MCID of the actual outcome measures and measuring instruments]
Note: authors chose to exclude the PMAL from meta-analysis, because ‘significant concerns have been raised about the measure’
|
|
Deppe 2013
|
RCT; parallel
Setting: Rehabilitation centre; Germany
Source of funding: no external funding |
Inclusion criteria: children assigned for inpatient rehabilitation from different parts of Germany between 2007 and 2010; unilateral spastic cerebral palsy, or acquired non-progressive central hemiplegia with other aetiologies of >2 years’ duration; 3.0–12.0 years; active movements of wrist and metacarpophalangeal joints with extension from full flexion of at least 20 degrees.
Exclusion criteria: inability to stand and walk independently; UL treatment with botox <6 months ago; UL orthop surg <1 year ago; uncontrolled epilepsy;(e) insufficient cognitive abilities to understand tasks and instructions; severe behavioural problems.
N total at baseline: Intervention: 26 Control: 21 Total 47
42 analyzed; 29 (16/13) with CP
Subgroup with CP: Important prognostic factors2: Age mean I: 5y11m C:6y10m Sex I: 38% M C: 54% M MACS I/II/III (n) I: 5/11/0 C: 4/7/2 Melbourne (%) I: 62.0 ± 18.3 C: 66.4 ± 19.3 AHA (% score) I: 55.8 ± 12.8 C: 59.4 ± 21.0 PEDI-selfcare (raw) I: 60.3 ± 7.7 C: 58.9 ± 9.3
Groups comparable at baseline? Yes |
mCIMT 16 patients with CP
Kid-CIMT integrative treatment approach with physical and occupational, music and sport therapists as well as nursery-school teachers , on jointly defined goals
restriction of non-involved arm using elastic bandages
After 3 weeks mCIMT (60 hours) programme is terminated with 1 week of bimanual training (20 hours) in order to incorporate the newly developed abilities into typical bimanual activities of daily living.
intensive therapy four weeks, 4 sessions daily, 60 min, 5 days per week (total 80 hours)
|
BIMT (same intensity); ‘IBT’ 13 patients with CP
Intensive bimanual training; similar to Kid-CIMT but without restricting the non-involved arm
intensive therapy four weeks, 4 sessions daily, 60 min, 5 days per week (total 80 hours)
|
Length of follow-up: 4 weeks
Loss-to-follow-up: Intervention: overall 2/26 Control: overall 3/21 Due to family reasons, interfering disease, behavioural problems (similar in I/C)
|
Melbourne (unilat upper limb); AHA; PEDI-selfcare (2nd outcome); percent scores; p-values
Assessed by assessors blinded to group allocation
Only data for CP subgroup shown below
Capacity: Melbourne (%score) Postintervention gain (SD) I: 6.4 ± 5.7 C: 2.2 ± 4.6 P=0.051 (NS) ‘almost statistically significant’
Note: overall (including non-CP patients; the treatment effect [Melbourne] is statistically significant in favour of mCIMT; p=0.03)
Capability: PEDI-selfcare (raw) Postintervention I: 1.8 ± 3.0 C: 1.4 ± 5.1 P= 0.70 (NS) Similar result overall (including non-CP patients)
Performance: AHA (% score) Posterintervention I: 5.8 ± 5.1 C: 4.8 ± 3.8 P= 0.76 (NS) Similar result overall (including non-CP patients)
|
Authors conclude that mCIMT can improve isolated functions of the hemiplegic arm better than intensive bimanual training; but mCIMT and intensive bimanual training are basically equally effective for improving the use of the paretic hand in everyday life activities; more severely impaired children show greater improvement compared to those less impaired and might profit more from CIMT; outcome is not age-dependent
‘The significantly greater improvement in diverse motor functions of the impaired limb after kid-CIMT was not transferred into a comparative advantage for the practice of everyday life activities. There was no additional benefit from the restraint of the non-involved arm for this aim.’
Note: the Melbourne group difference (mean) is <5.7 points and thus clinical relevance is questionnable
Clinical relevance: Melbourne: difference of 7 points (raw score, corresponding to a percent score of 5.7) is accepted as clinically relevant change (Randall M, Johnson L and Reddihough D. The Melbourne Assessment of Unilateral Upper Limb Function. Melbourne: Royal Children’s Hospital, 1999) AHA: clinically significant effect are reported as 4 raw score units (percent score 6.0; Gilmore R, Sakzewski L and Boyd RN. Upper limb activity measures for 5- to 16-year-old children with congenital hemiplegia: a systematic review. Dev Med Child Neurol 2010; 52: 14–21)
Power calc: based on Melbourne, assuming clinically relevant MD of 7 points in raw score for posttreatment changes, SD of 9, α = 0.05, power level 1–β = 0.80, and drop-out rate of 10% >> minimum of 30 children for each group [not reached in current study; in particular not in the subgroup of CP patients]
Note: correlation analysis on severity/AHA (r = –0.40, P <0.01), indicated that more severely impaired children achieved greater gains than less severely affected ones;. correlation not be found for Melbourne Assessment >> ‘should be subjected to further research, since it might help to decide which method would be appropriate for a concrete child’ |
|
Klingels 2013 |
RCT; parallel
Setting: University Rehabilitation Dept; Belgium
Source of funding: no external funding; authors declared ’no potential conflicts of interest’ |
Inclusion criteria: unilateral CP; 4.5-12 years;minimal ability to grasp with affected hand; ability to perform assessments
Exclusion criteria: previous UL surgery; botox in UL within 6 months
Children enrolled prospectively between August 2009 and April 2010
N total at baseline: Intervention: Control:
Important prognostic factors2: Age mean I: 8 y 8 mo C: 8 y 9 mo Sex I: 54% M C: 56% M MACS I/II/III (n) I: 2/19/5 C: 2/19/4 Melbourne (%) I: 68.9 (55.7-87.7) C: 68.9 (56.0-85.3) AHA (logits 0-100) I: 63.6 (SD 16.2) C: 61.0 (SD 14.6) ABILHAND-Kids (logits) I: 1.42 (SD 1.38) C: 1.36 (SD 1.27)
Groups comparable at baseline? Unclear [note the difference in AHA score at baseline] |
mCIMT n=26
home-based with instructions to parents; splint on the unaffected hand for 1 hour, 5 times a week, for 10 weeks (total time 50 hours)
|
mCIMT+BIMT n=25
as mCIMT, but additionally received integrated program with focus on distal muscle strength and hand function, using unimanual and bimanual approach; 3 times a week for 45 minutes (total time 22 hours 30 minutes).
|
Length of follow-up: postintervention; after 10 weeks followup
Loss-to-follow-up: Intervention: 4/26 Control: none Behavioural difficulties (1), ‘too much commitment’ (2), lost to fup (1)
differential loss (mCIMT group only)
Postintervention I: 23/26 analyzed C: 25/25 analyzed
10 weeks followup I: 22/26 analyzed C: 25/25 analyzed
|
AHA (prim); Melbourne and ABILHAND-kids (2nd outcomes); scores; p-values
Assessed by assessors blinded to group allocation
Capacity: Melbourne (%score) Postintervention (IQR) I: 74.6 (59.0-90.2) C: 74.6 (61.5-88.0) 10 week followup I: 74.2 (56.0-88.5) C: 75.4 (59.8-89.3) P=0.56 (Time*Group) NS
Performance: AHA (logits 0-100; SD) Posterintervention I: 65.6 (13.3) C: 65.2 (14.5) 10 week followup I: 65.5 (15.0) C: 64.7 (14.8) P=0.04 (Time*Group) Note: groups differ in baseline score!
ABILHAND-Kids (logits; SD) I: 1.77 (1.46) C: 1.79 (1.38) 10 week followup I: 1.63 (1.60) C: 1.75 (1.80) P=0.40 (Time*Group) NS
|
Authors conclude that the combination of m-CIMT with an intensive therapy program on distal hand function and strength enhances the effects of m-CIMT alone for improving bimanual performance
Note: only the results on AHA scores are statistically significant; absolute scores on AHA between treatment groups are similar postintervention and after 10 weeks follow-up but differ at baseline (lower in the mCIMT+BIMT group)
Note: the AHA group difference (mean) is <5 points (see below) and thus clinical relevance is questionable. Also note that BIMT was added to mCIMT i.e. the intensity of treatment differs between treatment groups (which may also explain any difference in treatment effects)
Note: in this study m-CIMT is applied in the home situation, provided by parents and supervised by the main investigators
Power calc: based on AHA;smallest detectable difference (SDD) 5 units on 0-100 scale (Krumlinde-Sundholm 2012, Dev Med Child Neurol 54,807); SD of 6 units; statistical power of 80%, α of .05, a sample size of 24 children in each group required >> study has sufficient power |
Exclusietabel na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Dong 2013 |
SR zonder meerwaarde t.o.v. Sakzewski 2014: kortere zoekperiode (tot dec 2011) |
|
Green 2013 |
Geen vergelijkende studie |
|
Houwink 2013 |
Verkeerde PICO; geen antwoord op uitgangsvraag; valideert een meetinstrument |
|
Nordstrand 2013 |
Verkeerde PICO; geen vergelijkende studie |
|
Öhrvall 2013 |
Verkeerde PICO; geen antwoord op de uitgangsvraag |
|
Wang 2013 |
Verkeerde PICO; geen RCT maar prognostische studie naar voorspellers van behandelsucces |
|
Geerdink 2013 |
RCT maar een vervolg op eerdere RCT (Aarts 2010); die deel uitmaakt van Sadzewski (2014); voegt langere followup (zes maanden en één jaar) toe. De statistische vergelijking van interventie- controlegroep is alleen na zes maanden gedaan niet meer na één jaar. |
|
Reidy 2012 |
Verkeerde PICO; geen vergelijkende studie |
|
Aarts 2012 |
Geen RCT maar case-report; geen vergelijkende studie |
|
Ballaz 2012 |
Geen RCT; geen vergelijkende studie |
Table of quality assessment
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the value of CIMT and BIMT in treatment of the upper extremity in children with cerebral palsy, at the level of (bi)manual functioning?
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/ no/ unclear |
Comprehensive and systematic literature search?
Yes/ no/ unclear |
Description of included and excluded studies?
Yes/ no/ unclear |
Description of relevant charac-teristics of included studies?
Yes/ no/ unclear |
Appropriate adjustment for potential confounders in observa-tional studies?
Yes/ no/ unclear/ notapplicable |
Assessment of scientific quality of included studies?
Yes/ no/ unclear |
Enough similarities between studies to make combining them reasonable?
Yes/ no/ unclear |
Potential risk of publication bias taken into account?
Yes/ no/ unclear |
Potential conflicts of interest reported?
Yes/ no/ unclear |
|
Sakzewski 2014 |
Yes |
Yes |
Unclear*1 |
Yes |
Not applicable |
Yes |
Unclear*1 |
No*1 |
Yes |
*1 Inclusion and exclusion criteria are clearly stated, but the exact reasons for exclusion of individual papers are not provided; studies differ in many aspects (and these are clearly stated) and pooling of data may or may not be reasonable; publication bias was not taken into account, but is unlikely
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the value of CIMT and BIMT in treatment of the upper extremity in children with cerebral palsy, at the level of (bi)manual functioning?
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/ likely/ unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/ likely/ unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/ likely/ unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/ likely/ unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/ likely/ unclear) |
Bias due to loss to follow-up?
(unlikely/ likely/ unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/ likely/ unclear) |
|
Deppe 2012 |
computer-generated list of randomized numbers in concealed envelopes |
Unlikely |
Unlikely*1 |
Unlikely*1 |
Unlikely*1 |
Unlikely |
Unlikely |
Unlikely |
|
Klingels 2013 |
Block randomization using computer random number generator |
Unlikely |
Unlikely*2 |
Unclear*2 |
Unlikely*2 |
Unlikely |
Unlikely |
Unlikely |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-04-2015
Laatst geautoriseerd : 01-04-2015
Geplande herbeoordeling :
In 2006 is de ”richtlijn diagnostiek en behandeling van kinderen met spastische Cerebrale Parese” (VRA 2006) vastgesteld. Bij de revisie (autorisatie 01-04-2015) zijn drie nieuwe uitgangsvragen uitgewerkt en zeven uitgangsvragen gereviseerd, en is de geldigheid van de niet-gereviseerde uitgangsvragen beoordeeld. Bij de eerste modulaire revisie (autorisatie 10-09-2018) is de module 'Effect van orthopedische chirurgie op mobiliteit' (zie Behandeling gericht op verbetering mobiliteit) gereviseerd en toegevoegd aan de Richtlijnendatabase.
Geldigheid van niet-gereviseerde uitgangsvragen uit de eerdere richtlijn (2006)
De werkgroep heeft in 2015 de geldigheid van aanbevelingen uit de eerdere versie van de richtlijn (VRA 2006) beoordeeld. Een van de onderdelen werd beoordeeld als niet meer valide: vanwege nieuwe gegevens in de literatuur waren de analyse, conclusie en aanbeveling van uitgangsvraag - 'Wat is het effect van spierverlenging, tenotomie, osteotomie op ROM, spiertonus en kracht?'- niet meer geldig. Dit onderdeel is gereviseerd in 2018 (zie module 'Effect van orthopedische chirurgie op mobiliteit').
De overige aanbevelingen uit de richtlijn van 2006 werden in 2015 beoordeeld als onverminderd van toepassing, wel waren enkele tekstuele correcties en aanvullingen noodzakelijk. De belangrijkste aanvullingen en correcties zijn beschreven in het addendum (zie aanverwant ‘Addendum revisie 2015’) en betreffen onder andere de verduidelijking van de rol van de kindergeneeskundige expertise.
Algemene gegevens
In samenwerking met
Nederlandse Vereniging voor Fysiotherapie in de Kinder- en Jeugdgezondheidszorg
Financiering
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. Er wordt aangegeven wat, volgens de huidige maatstaven en aansluitend bij de gangbare Nederlandse praktijk, in het algemeen de beste zorg is voor kinderen / jongeren met spasticiteit en CP. De richtlijn is bestemd voor personen met een spastische Cerebrale Parese in de leeftijdsgroep van 0 tot 18 jaar behalve de module met betrekking tot de transitie naar volwassenheid waar een definitie tot 25 jaar wordt gehanteerd. Met ‘kinderen’ wordt in deze richtlijn bedoeld: mensen in de leeftijd van 0 tot 18 jaar. De richtlijn geeft aanbevelingen over de diagnostiek, behandeling van spasticiteit op stoornisniveau, vaardigheidsniveau en participatie, op basis van het ICF-CY model en terminologie. Specifieke doelen van deze richtlijn voor de behandeling van spasticiteit bij kinderen met CP zijn het verkrijgen van uniformiteit met betrekking tot de diagnostiek, en de behandeling en begeleiding in de diverse centra. De richtlijn beoogt de kaders te definiëren waarbinnen de multidisciplinaire zorg van kinderen met spastische CP dient plaats te vinden. Deze richtlijn wil tevens bijdragen aan verbeterde communicatie tussen behandelaars onderling en tussen de patiënt, diens naasten en behandelaars.
Doelgroep
De richtlijn is bedoeld voor zorgverleners die primair bij de behandeling van kinderen met spastische CP betrokken zijn: (kinder-)revalidatieartsen, (kinder-)neurologen, kinderartsen, plastisch chirurgen, (kinder-)fysiotherapeuten, ergotherapeuten en logopedisten. Daarnaast zijn vele andere disciplines meer incidenteel betrokken bij diagnostiek en behandeling van deze kinderen, zoals jeugdartsen, artsen voor verstandelijk gehandicapten, psychosociale hulpverleners, onderwijsdeskundigen etc.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2012 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met spastische cerebrale parese.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep:
- Prof. dr. J.G. Becher, kinderrevalidatiearts, VRA (voorzitter)
- Dr. R.J. Vermeulen, kinderneuroloog, NVKN en NVN
- Dr. M. Ketelaar, bewegingswetenschapper, op persoonlijke titel
- Mw. M.W. Harmer-Bosgoed, ergotherapeut, Ergotherapie Nederland
- Dr. J.M. Voorman, kinderrevalidatiearts, VRA
- Dr. A.I. Buizer, kinderrevalidatiearts, VRA
- Dr. O.W. Verschuren, kinderfysiotherapeut, NVFK/KNGF
- Drs. L.A.W.M. Speth, kinderrevalidatiearts, VRA
- Dr. E.A.A. Ramaeckers, kinderfysiotherapeut, NVFK/KNGF
- Dr. S.R. Hilberink, psycholoog, BOSK
- Dr. L. van Wely, bewegingswetenschapper, op persoonlijke titel
Klankbordgroep:
- Dr. P.B.M. Aarts, ergotherapeut, Ergotherapie Nederland
- Dr. M.J.M. Heim, taalwetenschapper, persoonlijke titel
- Mw. K. van Hulst, logopedist, NVLF
- Mw. K Boeschoten, ergotherapeut, Ergotherapie Nederland
- Drs. J.J.M. Geijtenbeek, logopedist, NVLF
- Dr. P. van Schie, fysiotherapeut, NVFK/KNGF
- Mw. B. Piskur, ergotherapeut, Ergotherapie Nederland
- Dr. M. Roebroek, bewegingswetenschapper, persoonlijke titel
- Mw. N. van den Dikkenberg, kinderergotherapeut, Ergotherapie Nederland
- Dhr. R. Wong Chung, kinderfysiotherapeut, NVFK/KNGF
- Dr. A. Dallmeijer, bewegingswetenschapper, persoonlijke titel
- Mw. H. Dekkers, kinderrevalidatiearts, VRA
- Dr. R. van den Berg, bewegingswetenschapper, persoonlijke titel
- Dr. F.C. Schasfoort, bewegingswetenschapper, persoonlijke titel
- Mw. K. Folmer, revalidatiearts, VRA
- Mw. E.E.H. van Bommel, kinderfysiotherapeut, NVFK/KNGF
- Mw. C. Scheijmans, ergotherapeut, Ergotherapie Nederland
- Dr. C.G.B. Maathuis, kinderrevalidatiearts, VRA; BOSK
- Dr. W.M.A. van der Slot, revalidatiearts, VRA
Met ondersteuning van:
- Dr. K.N.J. Burger, epidemioloog, adviseur Kennisinstituut van Medisch Specialisten
- Drs. M. Wessels, informatiespecialist Kennisinstituut van Medisch Specialisten
- Mw. S.K. Josso, secretariaat, Kennisinstituut van Medisch Specialisten
- Mw. N.F. Bullock, secretariaat, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (Kennisinstituut) en hieronder weergegeven.
|
Naam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie manage-ment |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
|
Ketelaar |
Senior onderzoeker Kenniscentrum Revalidatie-geneeskunde Utrecht, UMC Utrecht en De Hoogstraat Revalidatie |
Bestuurslid Dutch-ACD - niet betaald; Editorial Board Physical and Occupational Therapy in Pediatrics - niet betaald; Bestuurslid CP-Net |
n.v.t. |
n.v.t. |
n.v.t. |
- PERRIN - subsidie ZonMw - LEARN2MOVE - subsidie ZonMw - Fitheid bij kinderen met CP - subsidie Phelps Stichting Participatie van kinderen - subsidie Johanna KinderFonds en KinderFonds AdriaanStichting |
n.v.t. |
n.v.t. |
|
van Wely |
Beoordelen van de literatuur, opstellen evidence-tabellen, schrijven van een samenvatting met gegradeerde literatuur-conclusies |
Promovendus (fulltime): Onderzoek naar de effectiviteit van een bewegings-stimulerings-programma bij kinderen met cerebrale parese. Betaald
Incidenteel (2-3 x per jaar): gastcolleges op de Hogeschool van Amsterdam, minor kinderen (fysiotherapie, oefentherapie, ergotherapie). betaald |
Geen |
Collega / promotiebegeleider houdt zich bezig met onder andere krachttraining bij kinderen met CP. Andere promotie begeleider (arts) houdt zich bezig met diagnose en behandeling van kinderen met CP. Zij hebben geen financieel belang (m.i.) in een bepaalde uitkomst of advies. Hoogstens qua reputatie |
Geen |
Promotie-onderzoek (LEARN 2 MOVE 7-12 years: a randomized controlled trial on the effects of a physical activity stimulation program in children with cerebral palsy) is gefinancieerd door ZonMw en diverse Nederlandse fondsen. Financiers zijn niet betrokken bij studie opzet, analyzes en publicate beslissingen. |
Expertise op het gebied van krachttraining, conditietraining, fysiotherapie thuis en motivational interviewing (counseling) bij kinderen met CP. Eventuele plannen voor een cursus voor kinder-fysiotherapeuten en/of implementatie in de praktijk. |
Nee |
|
Harmer-Bosgoed |
Projectpleider Implementatie; Ergotherapeut revalidatie volwassenen; coordinator Stichting CP-Net |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Projectleider van de richtlijn CP in Praktijk dat gesubsidieerd wordt door de innovatiegelden van Revalidatie Nederland en ZonMw Voorheen implementatie-medewerker voor PERRIN - subsidie ZonMw |
n.v.t. |
Nee |
|
Speth |
Kinder-revalidatiearts |
Wetenschappelijk onderzoek, BoBiVa, effect botuline toxine A injecties in de bovenste extremiteit al dan niet gecombineerd met taakspecifieke oefentherapie op functies en tweehandige vaardigheden bij CP kinderen met een unilaterale spastische handfunctie stoornis. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Nee |
|
Verschuren |
onderzoeker |
Editorial Board Psychical and Occupational Therapy in Pediatrics (niet betaald) Review Board Pediatric Psychical Therapy (niet betaald) |
n.v.t. |
n.v.t. |
n.v.t. |
PERRIN - subsidie ZonMw LEARN2MOVE - subsidie ZonMw Fitheid bij kinderen met CP - subsidie Phelps Stichting Participatie van kinderen - subsidie Johanna KinderFonds en KinderFonds AdriaanStichting |
n.v.t |
n.v.t. |
|
Becher |
hoogleraar kinderrevalidatie geneeskunde Vumc, kinder-revalidatiearts |
voorzitter Dutch Academy of childhood disability (onbezoldigd), task officer cerebral Palsy van de International Society for prosthetics and orthotics (onbezoldigd), voorzitter medisch comité Wandafonds (onbezoldigd), cursusleider: multi-level behandeling met Botuline toxine bij kinderen met cerebrale parese, ter verbetering van de loopvaardigheid (bezoldigd, financiële ondersteuning van firma Allergan). |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Geen patenten, cursusondersteuning firma Allergan t.a.v. behandeling kinderen met cerebrale parese met botuline toxine (botox) in de zin van vergoeding van personele inzet. |
n.v.t. |
|
Voorman |
kinder-revalidatiearts Merem - RC De Trappenberg |
deelname werkgroep Cerebrale parese (niet betaald) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Buizer |
kinder-revalidatiearts |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Rameckers |
Onderzoeker Aselante kinderen, valkenburg Inhoudelijk coordinator Avansplus MSPT opleiding |
onderzoeker en docentfunctie (betaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Hilberink |
Lid kernwerkgroep |
|
geen |
geen |
Zelf volwassene met Cerale Parese, maar richtlijn richt zich op kinderen. |
geen |
Werkzaam bij het Erasmus MC, de Transition &Lifespan Research Group |
geen |
|
Vermeulen |
Kinderneuroloog VUmc Amsterdam |
Lid Raad van Toezicht Stichting Heliomare (vergoeding gaat naar het VUmc) |
geen |
geen |
geen |
Jack Rabbit foundation: Onderzoek naar taalbegrip bij kinderen met een ernstige cerebrale parese. Phelps stichting (2008043): Onderzoek naar taalbegrip bij kinderen met een ernstige cerebrale parese. ONWAR meertfonds: ABIP-2011-23: Fetal brain imaging, imaging Phelps stichting, Revalidatie fonds, Johanna Kinderfonds: baclofen treatment in dystonic cerebral palsy: a randomized clinical trial (VUmc MUMC) 2013015: implementatie van C-BiLLT voor gebruik in klinische setting. |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de Vereniging van en voor mensen met een aangeboren lichamelijke handicap (BOSK) in de werkgroep. De BOSK is tevens gevraagd een knelpunt te benoemen en dit knelpunt is bewerkt tot een uitgangsvraag (zie module 'Begeleiding transitie naar volwassenheid'). Daarnaast is de conceptrichtlijn voor commentaar voorgelegd aan de BOSK.
Methode ontwikkeling
Evidence based
Implementatie
Naar aanleiding van de publicatie van de richtlijn in 2006 zijn er twee projecten uitgevoerd om de aanbevelingen te implementeren: (i) Richtlijn CP in praktijk en (ii) Richtlijn CP in praktijk-2. In deze projecten is een landelijk netwerk opgebouwd van mensen met CP en hun ouders, onderzoekers en ervaren zorgverleners (knowledge brokers) in revalidatieteams voor personen met CP. De aanbevelingen zijn naar de dagelijkse praktijk vertaald door de uitwisseling van kennis en ervaring in het netwerk. Implementatie van de aanbevelingen in de praktijk wordt in het netwerk begeleid en implementatie-ervaringen worden uitgewisseld (zie http://www.cp-research.nl). In april 2014 is door BOSK, De Hoogstraat Revalidatie en de afdeling revalidatiegeneeskunde van het VUmc, de onafhankelijke stichting CP-Net opgericht (zie http://www.cp-net.nl). Inmiddels hebben 27 multidisciplinaire revalidatieteams verbonden aan revalidatiegeneeskundige afdelingen zich aangesloten. Het is de bedoeling de nieuwe aanbevelingen in de richtlijn opnieuw te vertalen naar de dagelijkse praktijk en via CP-Net de implementatie te ondersteunen. Daarnaast zal er aandacht besteed worden aan de nieuwe aanbevelingen via scholing voor revalidatieartsen in opleiding (CP werkgroep van de VRA), en het D-ACD congres (zie http://www.dutch-acd.nl). Financiële ondersteuning moet aangevraagd worden om verdere implementatie activiteiten te bekostigen.
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (VRA 2006) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de Vereniging van en voor mensen met een aangeboren lichamelijke handicap (BOSK). De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse en prioritering zijn door de werkgroep de definitieve uitgangsvragen vastgesteld (zeven revisies en drie nieuwe uitgangsvragen). Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Als eerste werden de searches voor de afzonderlijke modules op hoofdlijnen geactualiseerd voor de periode vanaf 2006. Hierbij werden de searches van de oude richtlijn herhaald, waarbij met sensitieve zoekfilters werd gelimiteerd op systematische reviews en/of gerandomiseerde klinische studies. Ook is er nog een algemene search gedaan naar systematische reviews in Medline en de Cochrane Library. De resultaten van deze searches zijn gebruikt bij het bepalen van de noodzaak tot revisie en de prioritering. Een overzicht van de zoekstrategieën per module zijn te vinden in de zoekverantwoording oriënterende search Revisie - actualisatie per module in desbetreffend aanverwant.
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie (WHO Handbook for guideline development).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose.
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten.
Bij dit type vraagstelling kan GRADE noch de EBRO-methode worden gebruikt. Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaatkims@demedischspecialist.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolgonderzoek staat in de aanverwant ‘Kennislacunes’.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
