Vroege herkenning van (dreigende) sepsis
Uitgangsvraag
Hoe kan vroegtijdige herkenning van (dreigende) sepsis (aan de poort van het ziekenhuis en op alle ziekenhuisafdelingen) worden bevorderd in Nederlandse ziekenhuizen?
- Welke instrumenten zijn daarbij behulpzaam?
Aanbeveling
Maak in de vroegtijdige herkenning van sepsis gebruik van een combinatie van twee methoden.
- Is er verdenking op een infectie?
- Screen op vitale bedreiging met behulp van de MEWS/NEWS.
Gebruik hierbij de signaalvraag: Kan dit een sepsis zijn?
- Maak bij de patiënt met verdenking op een infectie gebruik van de MEWS/NEWS om een indruk te krijgen of de patiënt vitaal bedreigd is.
- Zorg voor een lokaal protocol met minimaal afspraken over de frequentie van afname van de score en de afkapwaarde.
- Maak bij een patiënt die vitaal bedreigd is volgens de MEWS/NEWS de afweging of er een verdenking op een infectie is.
Maak in de vroegtijdige herkenning van sepsis geen gebruik van de qSOFA-score.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is onvoldoende bewijs voor het gebruik van specifieke criteria in het vroeg herkennen van sepsis. Uit een recente retrospectieve Nederlandse studie kwam naar voren dat met de SIRS-criteria de meeste patiënten geclassificeerd konden worden als hebbende sepsis en met de qSOFA-score de minste. De MEWS zat hier tussenin, maar zat meer richting SIRS-criteria dan qSOFA-score (van der Woude, 2018).
Er is met name literatuur gevonden over het gebruik van instrumenten om de mortaliteit dan wel IC-opname te voorspellen bij septische patiënten. Gezien dit belangrijke parameters zijn, ook voor de patiënt, is ervoor gekozen dit verder uit te werken. Om de mortaliteit zo laag mogelijk te houden is het belangrijk zo min mogelijk septische patiënten te missen. Hierin speelt sensitiviteit een belangrijkere rol dan specificiteit. Hier is rekening mee gehouden in de formulering van de aanbeveling.
Uit genoemde studies lijkt de sensitiviteit het hoogst te zijn voor de SIRS-criteria. De MEWS en NEWS behalen ongeveer dezelfde sensitiviteit en de qSOFA-score zit hieronder. De bewijskracht voor bovenstaande bevindingen is laag in alle studies. Ook de PIRO is onderzocht. Echter, de bewijskracht is zeer laag en kunnen er geen conclusies getrokken worden over deze tool.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het is in het voordeel van de patiënt dat sepsis vroegtijdig wordt herkend. Met de aanbeveling die we nu doen, zal er van de zorgverleners mogelijk een kleine extra inzet gevraagd worden wat betreft het meten van de vitale parameters. Dit zal echter de behandeling en de uitkomst overleving ten goede komen.
Kosten (middelenbeslag)
Niet van toepassing, niet geheel duidelijk wat de extra kosten zullen zijn en of deze er überhaupt zullen zijn.
Haalbaarheid en implementatie
Een belemmering voor de implementatie van zowel de SOFA-score als de PIRO is het feit dat hier laboratoriumbepalingen voor zijn vereist. Bij de andere scores gaat het veelal om vitale parameters, welke bij elke patiënt worden gemeten. Er zullen dus geen bijkomende kosten zijn.
De MEWS/NEWS is al geïmplementeerd in het kader van het VMS-veiligheidsprogramma “Vitaal bedreigde patiënt” in het monitoren van patiënten op verpleegafdelingen in de ziekenhuizen in Nederland. Daarom is ervoor gekozen deze score aan te bevelen in de vroegtijdige herkenning van sepsis. De SIRS-criteria lijken niet significant beter dan de MEWS/NEWS in studies tot nu toe. De SIRS-criteria zijn recentelijk verworpen en het zou voor verwarring kunnen zorgen bij zorgverleners over de vroege herkenning van sepsis als dit opnieuw aanbevolen wordt.
De MEWS/NEWS is een score die gebruikt wordt om verandering in de trend van vitale parameters te objectiveren. Daarom is tevens gezocht naar literatuur om een eventuele frequentie van MEWS/NEWS aan te bevelen. In de literatuur werd geen wetenschappelijk bewijs voor een bepaalde frequentie gevonden. Wel werd een studie gevonden waaruit mogelijk blijkt dat een gestandaardiseerde meting tot meer compliantie leidt dan meting op indicatie (Ludikhuijze, 2014).
Aanbeveling-1
Rationale/ balans tussen de argumenten voor en tegen de interventie
Voor een goede behandeling en een betere prognose is het essentieel sepsis vroegtijdig te herkennen. Hierbij is gekeken naar een score met een hoge sensitiviteit en een haalbare implementatie. Gezien de SIRS-criteria recentelijk zijn verworpen, zou dit tot verwarring kunnen leiden. De MEWS/NEWS zijn al op verpleegafdelingen in de ziekenhuizen geïmplementeerd. Bovendien zijn MEWS/NEWS-criteria ook te gebruiken op ieder afdeling in een ziekenhuis. Deze kennis in acht nemend is de volgende aanbeveling opgesteld door de werkgroep. Het gebruik van de SIRS-criteria wordt dus niet per se afgeraden, maar vormt geen onderdeel van de screening op en diagnose van sepsis.
Aanbeveling-2
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep gaat uit van twee verschillende presentaties van sepsis. De eerste is de patiënt met een verdenking op een infectie, waarbij de vitale parameters bedreigd zijn. De tweede is de patiënt met vitaal bedreigde parameters, waarbij sprake zou kunnen zijn van een infectie. Hiervoor is een aparte aanbeveling opgesteld.
Omdat het gaat om een score die verandering in vitale parameters objectiveert wordt ook een aanbeveling gedaan omtrent frequentie van meting. Er is geen literatuur gevonden voor één gestandaardiseerde meting, vandaar dat de werkgroep komt tot de volgende aanbeveling.
Aanbeveling-3
Rationale/ balans tussen de argumenten voor en tegen de interventie
Met de komst van de sepsis-3 richtlijn is er tevens een nieuwe definitie van sepsis. In de SSC-richtlijn (Rhodes, 2017) wordt de qSOFA-score aanbevolen als instrument in de vroege herkenning van sepsis. Uit de literatuur blijkt echter dat de qSOFA-score een lagere sensitiviteit heeft dan de MEWS/NEWS, waardoor patiënten met sepsis gemist kunnen worden als men de qSOFA gebruikt in de vroege herkenning van sepsis. De werkgroep heeft daarom de volgende negatieve aanbeveling opgesteld.
Onderbouwing
Achtergrond
Om op tijd met de juiste behandeling te starten is het van belang dat sepsis vroeg herkend wordt, zowel op de SEH als op de verpleegafdelingen in het ziekenhuis. De patiënt die al op de IC ligt, valt hierbuiten.
Met de komst van de Sepsis-3 richtlijn vervallen de huidige SIRS-criteria en wordt er gezocht naar een nieuwe screeningsmethode (Singer, 2016). In deze module wordt getracht een aanbeveling te geven welk instrument het best gebruikt kan worden in de screening voor de herkenning van sepsis.
Conclusies / Summary of Findings
Accuratesse voorspelling mortaliteit: qSOFA-score versus SIRS-criteria
|
Laag GRADE |
Er lijkt geen verschil te zijn tussen het discriminerend vermogen van de qSOFA-score (afkappunt ≥ 2) en SIRS-criteria (afkappunt ≥ 2) voor de voorspelling van mortaliteit bij patiënten met een infectie buiten de IC.
De sensitiviteit lijkt beter voor de SIRS-criteria (afkappunt ≥ 2) vergeleken met de qSOFA-score (afkappunt ≥ 2) en de specificiteit lijkt beter bij gebruik van de qSOFA ≥ 2 vergeleken met de SIRS-criteria (afkappunt ≥ 2).
De positive likelihood ratio lijkt iets beter voor de qSOFA-score (afkappunt ≥ 2) vergeleken met de SIRS-criteria (afkappunt ≥ 2), er lijkt geen verschil in de negative likelihood ratio tussen de qSOFA-score (afkappunt ≥ 2) en de SIRS-criteria (afkappunt ≥ 2).
Bronnen: (Song, 2008) |
Accuratesse voorspelling IC-opname: qSOFA-score versus SIRS-criteria
|
Laag GRADE |
Het discriminerend vermogen van de SIRS-criteria (afkappunt ≥ 2) zou enigszins beter kunnen zijn dan van de qSOFA-score (afkappunt ≥ 2) voor de voorspelling van IC-opname bij patiënten met een infectie buiten de IC.
De sensitiviteit van de SIRS-criteria lijkt beter vergeleken met de qSOFA-score (afkappunt ≥ 2) en de specificiteit lijkt beter bij gebruik van de qSOFA-score (afkappunt ≥ 2) vergeleken met de SIRS-criteria (afkappunt ≥ 2).
Er lijkt geen verschil in de positive likelihood ratio tussen de qSOFA-score (afkappunt ≥ 2) en de SIRS-criteria (afkappunt ≥ 2). De negative likelihood ratio lijkt iets beter voor de SIRS-criteria (afkappunt ≥ 2) vergeleken met de qSOFA-score (afkappunt ≥ 2)
Bronnen: (Song, 2008) |
Accuratesse voorspelling acute orgaandisfunctie: qSOFA-score versus SIRS-criteria
|
Laag GRADE |
Het discriminerend vermogen van de SIRS-criteria (afkappunt ≥ 2) lijkt beter dan van de qSOFA-score (afkappunt ≥ 2) voor de voorspelling van acute orgaandisfunctie bij patiënten met een infectie buiten de IC.
De sensitiviteit lijkt beter voor de SIRS-criteria (afkappunt ≥ 2) vergeleken met de qSOFA-score (afkappunt ≥ 2) en de specificiteit lijkt beter bij gebruik van de qSOFA-score (afkappunt ≥ 2) vergeleken met de SIRS-criteria (afkappunt ≥ 2).
De positive likelihood ratio lijkt iets beter van de qSOFA-score (afkappunt ≥ 2) vergeleken met de SIRS-criteria (afkappunt ≥ 2). De negative likelihood ratio lijkt iets beter voor de SIRS ≥ 2 criteria vergeleken met de qSOFA-score (afkappunt ≥ 2).
Bronnen: (Song, 2008) |
Accuratesse voorspelling mortaliteit: PIRO versus qSOFA-score, SOFA-score, MEWS of NEWS
|
Zeer laag GRADE |
Het is onzeker of het discriminerend vermogen en voorspellende waarde van de PIRO-score beter is dan van de qSOFA-score, SOFA-score, MEWS of NEWS voor de voorspelling van mortaliteit bij patiënten met een infectie buiten de IC.
Bronnen: (Quinten, 2017; de Groot, 2017; Yu, 2014; MacDonald, 2014) |
Accuratesse voorspelling IC-opname: PIRO versus qSOFA-score, SOFA-score, MEWS of NEWS
|
Zeer laag GRADE |
Het is onzeker of de voorspellende waarde van de PIRO-score beter is dan de qSOFA-score van de voorspelling van IC-opname bij patiënten met een infectie buiten de IC.
Het is onzeker of het discriminerend vermogen van de PIRO-score beter is dan de qSOFA-score, SOFA-score, NEWS of MEWS voor de voorspelling van IC-opname of klinische verslechtering bij patiënten met een infectie buiten de IC.
Bronnen: (Quinten, 2017; De Groot, 2017; Yu, 2014) |
Accuratesse voorspelling mortaliteit: NEWS versus qSOFA-score of SIRS-criteria
|
Laag GRADE |
Er lijkt geen verschil in discriminerend vermogen van de NEWS vergeleken met de qSOFA-score of SIRS-criteria voor de voorspelling van mortaliteit bij patiënten met een infectie op de SEH.
De sensitiviteit lijkt hoger van de NEWS vergeleken met de qSOFA-score en gelijk aan de SIRS-criteria.
De specificiteit lijkt hoger van de NEWS vergeleken met de SIRS-criteria en lager dan de qSOFA-score.
Er lijkt geen verschil in de positief en negatief voorspellende waarde tussen de NEWS, qSOFA-score en SIRS-criteria.
De positive likelihood ratio lijkt iets beter van de qSOFA-score vergeleken met de SIRS-criteria en de NEWS. De negative likelihood ratio lijkt iets beter van de NEWS vergeleken met de qSOFA-score en de SIRS-criteria.
Bronnen: (Goulden, 2018) |
Accuratesse voorspelling mortaliteit: NEWS/MEWS versus qSOFA-score, SOFA-score of SIRS-criteria
|
Laag GRADE |
Het discriminerend vermogen van de NEWS/MEWS-score lijkt mogelijk beter dan van de qSOFA-score, SOFA-score of SIRS-criteria voor de voorspelling van mortaliteit en/of IC-opname bij patiënten met een infectie buiten de IC.
De sensitiviteit lijkt hoger van de NEWS/MEWS vergeleken met de qSOFA-score en vergelijkbaar met de SIRS-criteria en SOFA-score.
De specificiteit lijkt lager bij gebruik van de NEWS/MEWS vergeleken met de qSOFA-score, vergelijkbaar met de SOFA-score en hoger dan de SIRS-criteria.
Er lijken geen verschillen te zijn in positief of negatief voorspellende waarde tussen de NEWS en MEWS vergeleken met de qSOFA-score, SOFA-score en SIRS-criteria.
Bronnen: (Churpek, 2017; Goulden, 2018) |
Samenvatting literatuur
Beschrijving studies
In de review van Song (2018) is de qSOFA-score vergeleken met de SIRS-criteria (≥ 2 punten verhoging) in het vroeg voorspellen van mortaliteit, IC-opname, acute orgaandisfunctie in de niet-IC-setting bij patiënten met een verdenking op een infectie of vastgestelde infectie. Er werden 23 studies geïncludeerd met in totaal 146.551 patiënten; dit varieerde van 151 tot 66.522 patiënten per studie. De prevalentie van mortaliteit varieerde van 2,8% tot 33,0%. De meerderheid van de studies was uitgevoerd in patiënten op de SEH (n=17). De meerderheid van de studies includeerde patiënten met verdenking op infectie (n=17).
Twintig studies gebruikten een qSOFA-score van ≥ 2 als afkappunt, drie studies hanteerden een ander afkappunt, en wel ≥ 1 of ≥ 3, deze resultaten zijn niet beschreven in de resultaten van deze literatuuranalyse (Song, 2018).
Na het verschijnen van de review van Song (2018) zijn er nog 12 studies gepubliceerd die ook de accuratesse van de qSOFA-score presenteren voor de voorspelling van mortaliteit en/of IC-opname (Goulden, 2018; Boulos, 2017; Sterling, 2017; LeGuen, 2018; Williams, 2017; Umemura, 2017; Shetty, 2017; Moskowitz, 2017; Muller, 2017; Haydar, 2017; Guirgis, 2017; de Groot, 2017). De sensitiviteit en specificiteit van deze studies viel binnen de range van de studies die in Song (2018) zijn opgenomen en zijn niet apart uitgewerkt voor deze literatuuranalyse. Dit staat gerapporteerd in de exclusietabel onder het tabblad Verantwoording.
Churpek (2017) includeerde in een prospectief cohort met retrospectieve data verzameling 53.849 patiënten bij verschillende groepen met verdenking op infectie (ten minste voldoen aan één infectie criterium: 1) positieve kweek, 2) positieve bloedkweek, 3) een positieve kweek + intraveneuze (IV) antibiotica, 4) bloedkweek + IV antibiotica 5) een kweek + IV antibiotica tenminste 4 tot 7 dagen 6) Bloedkweek + IV antibiotica 4 tot 7 dagen). Het mortaliteitspercentage varieerde van 3% tot 9% in de verschillende categorieën met een verdenking op een infectie. De qSOFA-score, SIRS-criteria, NEWS, MEWS en SOFA-score werden vergeleken op accuratessematen voor de voorspelling van een gecombineerde maat voor mortaliteit en/of IC-opname. De hoogste scores per patiënt tijdens verblijf in het ziekenhuis (niet IC) tot aan verdenking van infectie werden meegenomen in de analyses (Churpek, 2017).
Goulden (2018) includeerde 1818 patiënten in een retrospectieve cohortstudie op de spoedeisende hulp met verdenking op sepsis. De qSOFA-score (afkappunt ≥ 2) werd vergeleken met de SIRS-criteria (afkappunt ≥ 2) en de NEWS (afkappunt ≥ 5) op accuratessematen voor de voorspelling van mortaliteit en IC-opname. De prevalentie van mortaliteit in het ziekenhuis was 15% (n=265) en 3% (n=53) werd opgenomen op de IC.
Quinten (2017) vergeleek de PIRO-score (afkappunt ≥ 12) met de qSOFA-score (afkappunt ≥ 2) op de voorspellende waarde en discriminerend vermogen voor mortaliteit en IC-opname bij patiënten op de SEH met een verdenking of bevestigde infectie en SIRS-criteria ≥ 2 in een prospectieve studie met 193 patiënten. De prevalentie van mortaliteit in het ziekenhuis was 4,1% (n=8) en 10,9% (n=21) werd opgenomen op de IC. De initiële scores tijdens de SEH-opname werden meegenomen in de analyse.
De Groot (2017) vergeleek de PIRO-score (afkappunt ≥ 14) met de qSOFA-score (afkappunt ≥ 2), de MEWS (afkappunt ≥ 7) en de NEWS (afkappunt ≥ 8) op de voorspellende waarde en discriminerend vermogen voor mortaliteit en IC-opname bij patiënten op de SEH die werden opgenomen met verdenking op een infectie in een prospectieve studie met 783 oudere patiënten (≥ 70 jaar) en 1497 jongere patiënten (< 70 jaar). Er werd ook een vergelijking gemaakt van de voorspellende waarde en discriminerend vermogen tussen deze beide leeftijdscategorieën.
Yu (2014) vergeleek de PIRO-score met de SOFA-score en de MEWS op de voorspellende waarde en discriminerend vermogen voor mortaliteit bij patiënten met een bevestigde infectie op niet-IC-verpleegafdelingen in een retrospectieve nested case-control studie met 328 cases en 328 gematchte controle cases. Verschillende afkappunten werden onderzocht.
MacDonald (2014) vergeleek de PIRO-score (verschillende afkappunten) met de SOFA-score op de voorspellende waarde en discriminerend vermogen voor mortaliteit bij patiënten met sepsis op de SEH in een prospectieve studie met 240 patiënten. De slechtste scores tijdens de SEH-opname werden meegenomen in de analyse.
Zie de aanverwant producten voor een overzicht van alle opgenomen scoringssystemen.
Resultaten
qSOFA-score vergeleken met SIRS-criteria: voorspellende waarde en discriminerend vermogen voor mortaliteit
20 studies in de review van Song (2018) rapporteerden over deze uitkomst voor de qSOFA-score (afkappunt ≥ 2). In de gepoolde schattingen hadden patiënten met een positieve qSOFA-score en SIRS-criteria een prevalentie van overlijden binnen het ziekenhuis van respectievelijk 12,9% (3.847/29.709) en 5,8% (3.906/67.225) bij patiënten met een verdenking op een infectie of vastgestelde infectie.
In figuur 1 zijn de resultaten voor sensitiviteit en specificiteit gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de qSOFA-score (afkappunt ≥ 2) was laag met 0,51 (95% Betrouwbaarheidsinterval (BI) 0,39 tot 0,62), met een hoge heterogeniteit van I2=97,6%. De oorzaken van heterogeniteit zijn onderzocht en konden deels verklaard worden door het tijdstip waarop de qSOFA-score is afgenomen. De sensitiviteit was statistisch significant (p<0.01) hoger wanneer de slechtste qSOFA-scores werden gebruikt vergeleken met afname van de score tijdens het eerste moment van verdenking van infectie (Song, 2018).
De gepoolde specificiteit voor de qSOFA-score (afkappunt ≥ 2) was redelijk goed met 0,83 (95% BI 0,75 tot 0,89), met een hoge heterogeniteit van I2=99,8%. De oorzaken van heterogeniteit zijn onderzocht en konden deels verklaard worden door studie locatie, mortaliteit percentage en ernst van de ziekte. De specificiteit was statistisch significant hoger in Amerikaanse studies vergeleken met Europese studies (p<0,01). In studies met een mortaliteit van ≥ 10% was de specificiteit statistisch significant lager dan in studies met een lager percentage van de mortaliteit (p=0,01). De specificiteit was statistisch significant lager in studies waar enkel patiënten met bevestigde sepsis werden geïncludeerd vergeleken met patiënten met een vermoeden van of een bevestigde infectie (p<0,01). De positive en negative likelihood ratio (LR+ en LR-) voor de qSOFA-score was respectievelijk 3,00 (95% BI 2,39 tot 3,77) en 0,60 (95% BI 0,50 tot 0,7). De LR+ en LR- voor de SIRS-criteria was respectievelijk 1,22 (95% BI 1,06 tot 1,39) en 0,46 (95% BI 0,39-0,56) (Song, 2018).
In 11 studies in de review van Song (2018) werd de qSOFA-score (afkappunt ≥ 2) met de SIRS-criteria ≥ 2 vergeleken voor deze uitkomstmaat. In figuur 2 zijn de resultaten gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de SIRS-criteria was redelijk hoog met 0,86 (95% BI 0,79 tot 0,92) , met een hoge heterogeniteit van I2=98,3%. De oorzaken van heterogeniteit voor de SIRS-criteria zijn niet onderzocht of niet gepresenteerd.
De gepoolde specificiteit voor de SIRS-criteria was laag met 0,29 (95% BI 0,17 tot 0,45), met een hoge heterogeniteit van I2=99,9%. De oorzaken van heterogeniteit voor de SIRS-criteria zijn niet onderzocht of niet gepresenteerd (Song, 2018).
In figuur 3 zijn de gepoolde resultaten gepresenteerd in een summary receiver operating characteristic (SROC) curve voor beide instrumenten. Dit is een gecombineerde maat, waarbij sensitiviteit wordt afgezet tegen 1-specificiteit en zegt iets over het discriminerend vermogen van een test. De area under the curve (AUC) was 0,74 (95% BI 0,70 tot 0,78) voor positieve qSOFA scores en 0,71 (95% BI 0,67 tot 0,75) voor positieve SIRS-criteria. Het verschil tussen beide testen was niet significant voor het discriminerend vermogen (p=0,82) (Song, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen mortaliteit voor de qSOFA-score vergeleken met de SIRS-criteria is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: meerderheid retrospectieve studie-opzet, onduidelijke blindering tijdens interpretatie van resultaten en uitval van patiënten is onduidelijk gerapporteerd); tegenstrijdige resultaten (inconsistentie; hoge heterogeniteit en niet alle oorzaken hiervan zijn onderzocht of gepresenteerd). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
Figuur 1 Sensitiviteit en specificiteit van de qSOFA voor het voorspellen van mortaliteit bij patiënten met een infectie buiten de IC
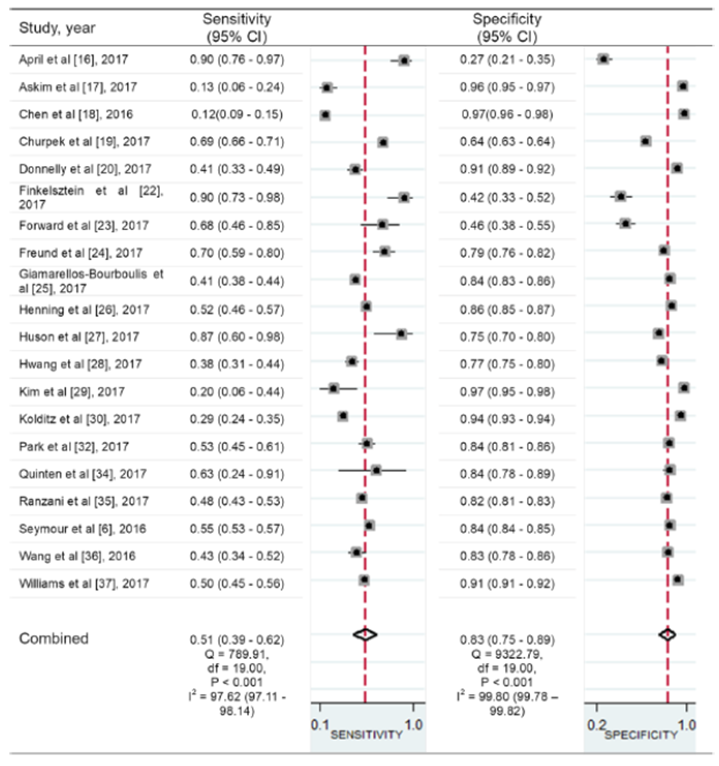
Bron: Song, 2018. Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 2 Sensitiviteit en specificiteit van de SIRS-criteria (afkappunt ≥ 2) voor het voorspellen van mortaliteit bij patiënten met een infectie buiten de IC
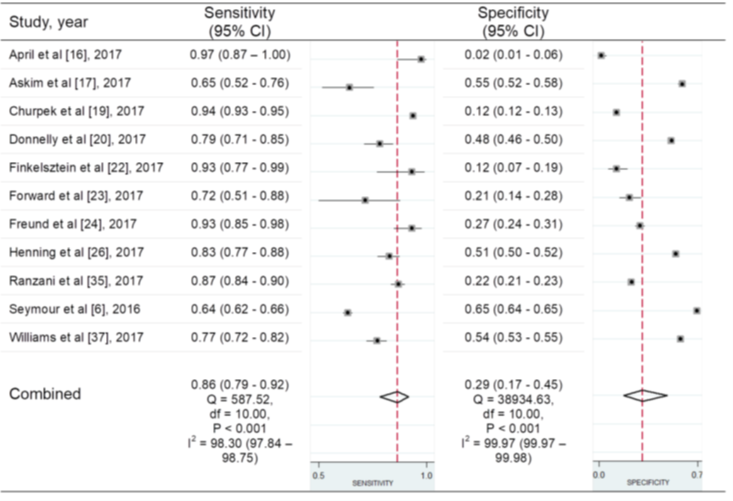
Bron: Song, 2018. Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 3 Hiërarchische SROC-curves voor a) qSOFA-score (afkappunt ≥ 2) en b) SIRS-criteria (≥ 2 punten verhoging) voor het voorspellen van mortaliteit bij patiënten met een infectie buiten de IC
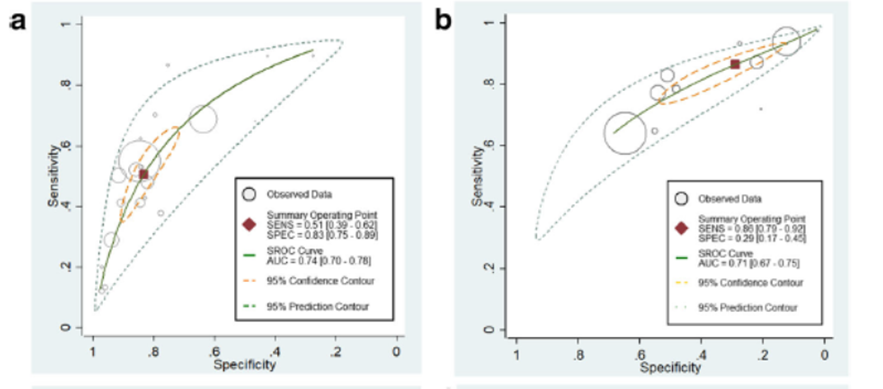
Bron: Song, 2018
qSOFA-score vergeleken met SIRS-criteria: voorspellende waarde en discriminerend vermogen voor IC-opname
10 studies in de review van Song (2018) rapporteerden over deze uitkomst voor de qSOFA-score (afkappunt ≥ 2). In de gepoolde schattingen hadden patiënten met een positieve score qSOFA en SIRS-criteria (≥2 punten verhoging) een prevalentie van IC-opname van respectievelijk 37,0% (5.325/14.384) en 24,3% (6.741/27.759).
In figuur 4 zijn de resultaten voor sensitiviteit en specificiteit gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de qSOFA-score was laag met 0,53 (95% BI 0,52 tot 0,54), met een hoge heterogeniteit van I2=98,6%. De gepoolde specificiteit voor de qSOFA-score was redelijk met 0,75 (95% BI 0,75 tot 0,76), met een hoge heterogeniteit van I2=99,8%. De oorzaken van heterogeniteit zijn niet onderzocht of niet gepresenteerd.
De LR+ en LR- voor de qSOFA-score was respectievelijk 2,24 (95% BI 1,91 tot 2,77) en 0,74 (95% BI 0,67 tot 0,83). De LR+ en LR- voor de SIRS-criteria was respectievelijk 1,11 (95% BI 0,96 tot 2,26) en 0,14 (95% BI 0,13 tot 0,14).
In drie studies in de review van Song (2018) werd de qSOFA-score (afkappunt ≥ 2) met de SIRS-criteria (≥ 2 punten verhoging) vergeleken voor deze uitkomstmaat. In figuur 5 zijn de resultaten voor sensitiviteit en specificiteit gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de SIRS was redelijk hoog met 0,91 (95% BI 0,90 tot 0,92), met een matige heterogeniteit van I2=42,7%.
De gepoolde specificiteit voor de SIRS was laag met 0,14 (95% BI 0,13 tot 0,14) , met een hoge heterogeniteit van I2=98,4%. De oorzaken van heterogeniteit voor de SIRS-criteria zijn niet onderzocht of niet gepresenteerd.
In figuur 6 zijn de gepoolde resultaten gepresenteerd in een SROC-curve voor beide instrumenten. De AUC was 0,63 (95% BI 0,62 tot 0,64) voor positieve qSOFA-scores en 0,78 (95% BI 0,58 tot 0,98) voor positieve SIRS-criteria. De qSOFA-scores lijken een slechter discriminerend vermogen te hebben vergeleken met SIRS-criteria, maar dit verschil was niet significant (p=0,12) (Song, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen voor IC-opname voor de qSOFA-score vergeleken met de SIRS-criteria is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: meerderheid retrospectieve studie-opzet, onduidelijke blindering tijdens interpretatie van resultaten en uitval van patiënten is onduidelijk gerapporteerd); tegenstrijdige resultaten (inconsistentie; hoge heterogeniteit en niet alle oorzaken hiervan zijn onderzocht of gepresenteerd). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
Figuur 4 Sensitiviteit en specificiteit van de qSOFA-score (afkappunt ≥ 2) voor het voorspellen van IC-opname bij patiënten met een infectie buiten de IC
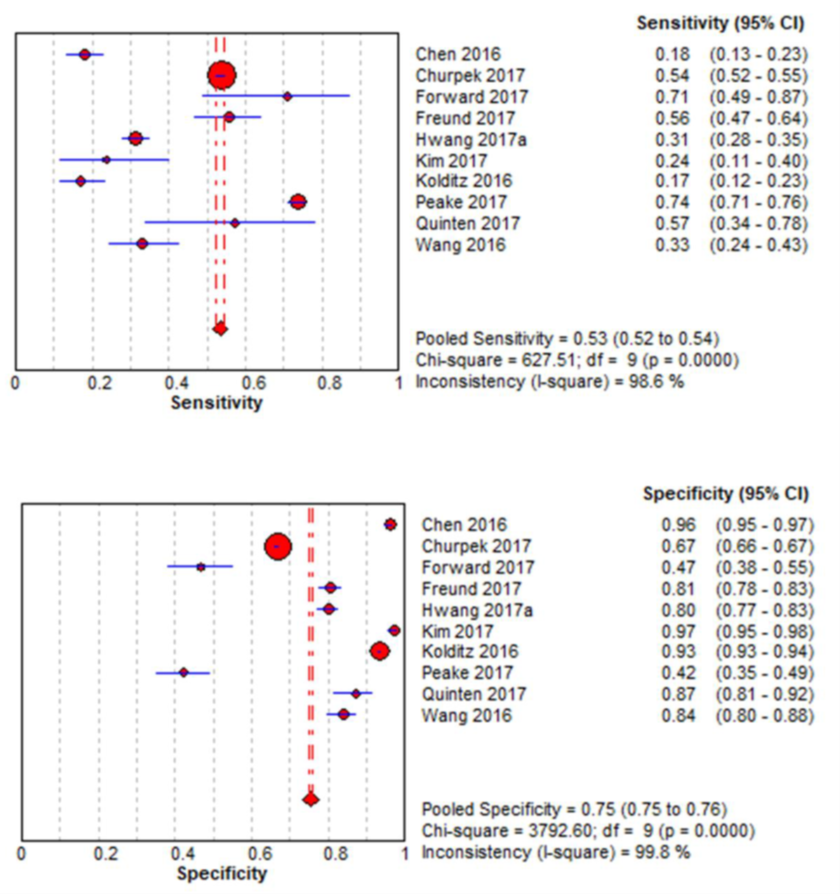
Bron: Song, 2018
Figuur 5 Sensitiviteit en specificiteit van de SIRS-criteria (≥ 2 punten verhoging) criteria voor het voorspellen van IC-opname bij patiënten met een infectie buiten de IC
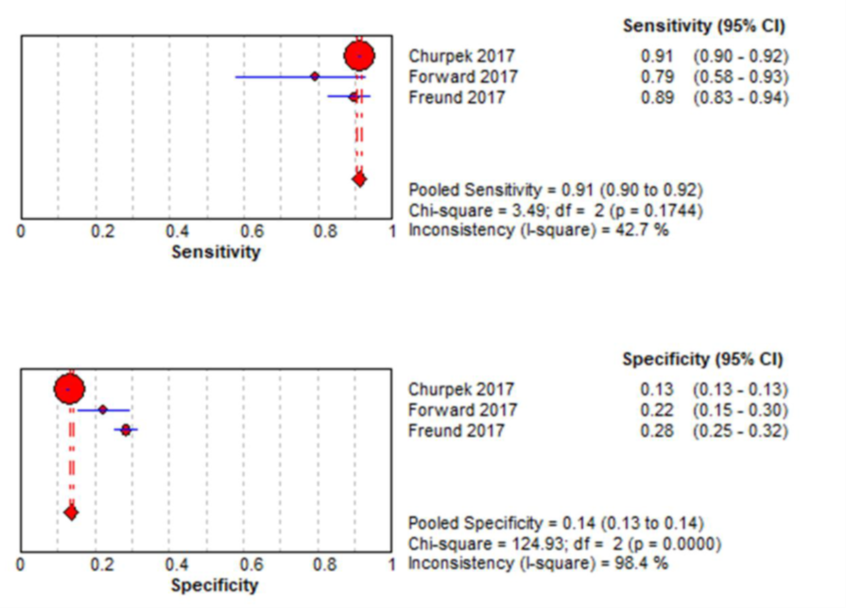
Bron: Song, 2018
Figuur 6 SROC-curves voor a) qSOFA-score (afkappunt ≥ 2) en b) SIRS-criteria (afkappunt≥ 2) voor het voorspellen van IC-opname bij patiënten met een infectie buiten de IC
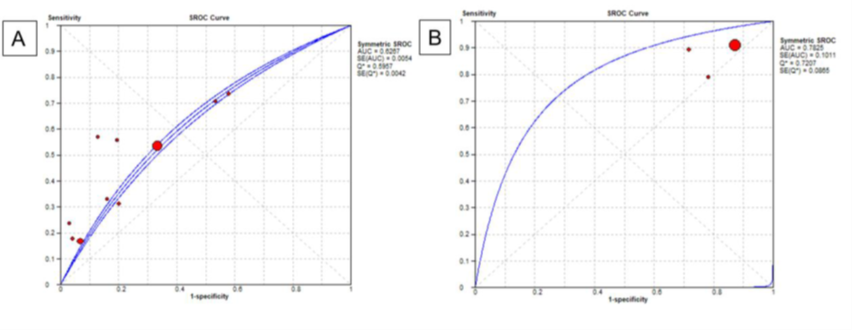
Bron: Song, 2018
qSOFA vergeleken met SIRS-criteria: voorspellende waarde en discriminerend vermogen voor acute orgaandisfunctie
9 studies met 10 datasets in de review van Song (2018) rapporteerden over deze uitkomst voor de qSOFA-score (afkappunt ≥ 2). In de gepoolde schattingen hadden patiënten met een positieve qSOFA-score en SIRS-criteria een prevalentie van acute orgaandisfunctie van respectievelijk 82,8% (2.433/2.936) en 36,2%% (1.830/5.047).
In figuur 7 zijn de resultaten voor sensitiviteit en specificiteit gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de qSOFA-score was laag met 0,47 (95% BI 0,28 tot 0,66), met een hoge heterogeniteit van I2=98,6%. De gepoolde specificiteit voor de qSOFA-score was hoog met 0,93 (95% BI 0,88 tot 0,97), met een hoge heterogeniteit van I2=99,0%. De oorzaken van heterogeniteit zijn niet onderzocht of niet gepresenteerd.
De LR+ en LR- voor de qSOFA-score was respectievelijk 7,13 (95% BI 4,42 tot 11,49) en 0,57 (95% BI 0,40 tot 0,81). De LR+ en LR- voor de SIRS-criteria was respectievelijk 1,64 (95% BI 1,19 tot 2,26) en 0,34 (95% BI 0,24 tot 0,47).
In vier studies in de review van Song (2018) werd de qSOFA-score met de SIRS-criteria vergeleken voor deze uitkomstmaat. In figuur 8 zijn de resultaten voor sensitiviteit en specificiteit gepresenteerd in een forest plot. De gepoolde sensitiviteit voor de SIRS-criteria was redelijk hoog met 0,83 (95% BI 0,71 tot 0,91), met een hoge heterogeniteit van I2=92%.
De gepoolde specificiteit voor de SIRS-criteria was redelijk laag met 0,49 (95% BI 0,29 tot 0,69), met een hoge heterogeniteit van I2=99,0%. De oorzaken van heterogeniteit voor de SIRS-criteria zijn niet onderzocht of niet gepresenteerd.
In figuur 9 zijn de gepoolde resultaten gepresenteerd in een SROC-curve voor beide instrumenten. De AUC was 0,86 (95% BI 0,83 tot 0,89) voor positieve qSOFA-scores en 0,76 (95% BI 0,73 tot 0,80) voor positieve SIRS-criteria. De qSOFA-scores hebben een statistisch significant beter discriminerend vermogen vergeleken met de SIRS-criteria (p<0,001). (Song, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen van acute orgaandisfunctie voor de qSOFA-score vergeleken met de SIRS-criteria is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: meerderheid retrospectieve studie-opzet, onduidelijke blindering tijdens interpretatie van resultaten en uitval van patiënten is onduidelijk gerapporteerd); tegenstrijdige resultaten (inconsistentie; hoge heterogeniteit en niet alle oorzaken hiervan zijn onderzocht of gepresenteerd). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
Figuur 7 Sensitiviteit en specificiteit van de qSOFA-score (afkappunt ≥ 2) voor het voorspellen van acute orgaandisfunctie bij patiënten met een infectie buiten de IC
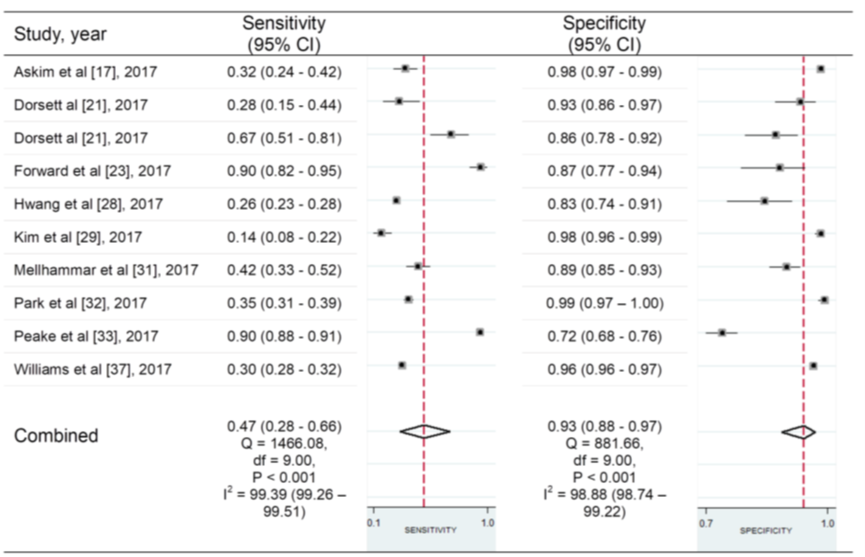
Bron: Song, 2018
Figuur 8 Sensitiviteit en specificiteit van de SIRS-criteria (afkappunt ≥ 2) criteria voor het voorspellen van acute orgaandisfunctie bij patiënten met een infectie buiten de IC
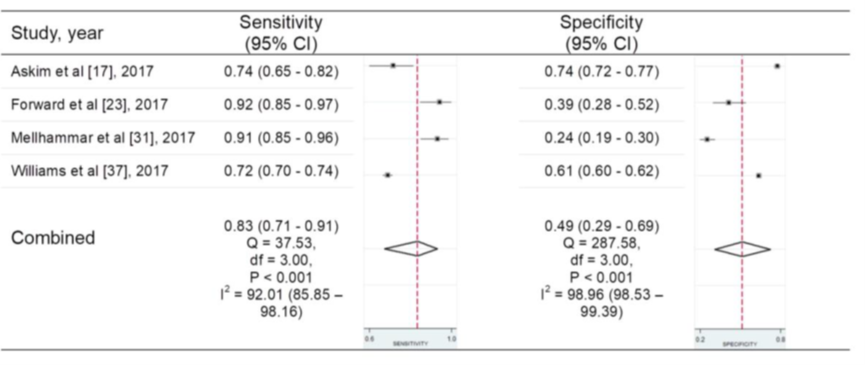
Bron: Song, 2018
Figuur 9 Hiërarchische SROC-curves voor c) qSOFA-score (afkappunt ≥ 2) en d) SIRS-criteria (afkappunt ≥ 2) voor het voorspellen van acute orgaandisfunctie bij patiënten met een infectie buiten de IC
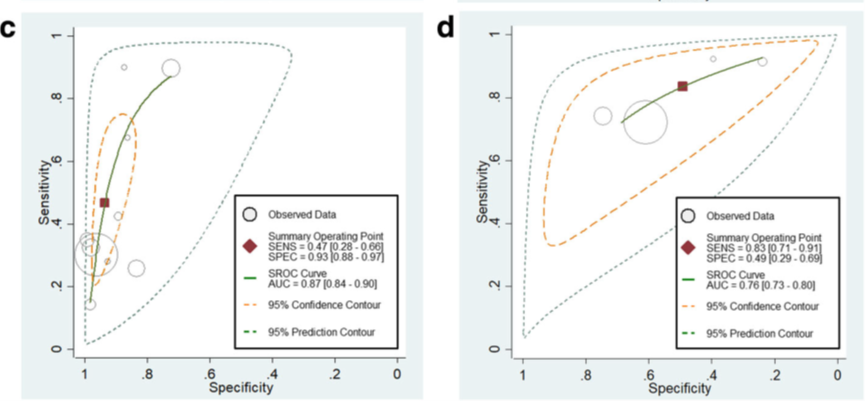
Bron: Song, 2018
PIRO vergeleken met andere relevante criteria: voorspellende waarde en discriminerend vermogen voor mortaliteit
Vier studies rapporteerden over de accuratesse van de PIRO-score vergeleken met een andere relevante score voor de voorspellende waarde voor mortaliteit (Quinten, 2017; de Groot, 2017; Yu, 2014; MacDonald, 2014).
De sensitiviteit voor de voorspelling van mortaliteit in het ziekenhuis voor de PIRO (≥ 12 of ≥ 14) varieerde tussen de 55% tot 75% (Quinten, 2017; de Groot, 2017). In de studie van de Groot (2017) was de sensitiviteit statistisch significant hoger in de subgroep onder de 70 jaar (PIRO ≥ 9) vergeleken met de groep gelijk of boven de 70 jaar (PIRO ≥ 16).
De specificiteit voor de voorspelling van mortaliteit in het ziekenhuis voor de PIRO (≥ 12 of ≥ 14) varieerde tussen de 76,8% tot 77%. In de studie van de Groot (2017) was de specificiteit statistisch significant lager in de subgroep onder de 70 jaar (PIRO ≥ 9) vergeleken met de groep gelijk of boven de 70 jaar (PIRO ≥ 16) (Quinten, 2017; de Groot, 2017).
In de studie van de Groot was de positief voorspellende waarde (PVW) voor de PIRO-score 0,12 (0,11 tot 0,14) en de negatief voorspellende waarde (NVW) 0,96 (0,95 tot 0,97), dit was niet verschillend voor de verschillende leeftijdscategorieën (de Groot, 2017). In de studie van Quinten (2017) was de LR+ en LR- 4,0 en 0,4 respectievelijk.
De AUC voor het discriminerend vermogen van de PIRO voor mortaliteit in het ziekenhuis varieerde tussen de 0.73 en 0.87. In de studie van de Groot, 2017 was de AUC statistisch significant hoger in de subgroep onder de 70 jaar (PIRO ≥ 9) vergeleken met de groep gelijk of boven de 70 jaar (PIRO ≥ 16) (Quinten, 2017; de Groot, 2017; Yu, 2014; MacDonald, 2014).
PIRO versus qSOFA-score
In de studies van Quinten (2017) en de Groot (2017) werd de PIRO-score vergeleken met de qSOFA-score. De sensitiviteit was statistisch significant lager voor de qSOFA-score vergeleken met de PIRO, en de specificiteit was statistisch significant hoger. Dit verschil is kleiner in een subgroep boven de 70 jaar.
In de studie van de Groot (2017), verschilde de PVW en NVW niet significant van de PIRO-score (de Groot, 2017). In de studie van Quinten (2017), was de LR+ hoger voor de qSOFA-score vergeleken met de PIRO, en de LR- was nagenoeg gelijk, er werden geen spreidingsmaten gepresenteerd.
Het verschil in AUC is in de studie van Quinten (2017) niet statistisch significant en in de studie van de Groot (2017) is de AUC significant groter voor de PIRO vergeleken met de qSOFA-score.
PIRO versus MEWS
In de studies van de Groot (2017) en Yu (2014) werd de PIRO-score vergeleken met de MEWS (afkappunt ≥ 7). De sensitiviteit was statistisch significant lager voor de MEWS vergeleken met de PIRO, en de specificiteit was gelijk. Dit verschil is kleiner in een subgroep boven de 70 jaar. In de groep < 70 werd een ander afkappunt gehanteerd voor de MEWS, namelijk ≥ 5.
In de studie van de Groot (2017) verschilden de PVW en NVW niet significant van de PIRO-score.
Het verschil in AUC is in de studie van Yu (2014) niet statistisch significant en in de studie van de Groot (2017) is de AUC, het discriminerend vermogen significant groter voor de PIRO vergeleken met de MEWS (de Groot, 2017; Yu, 2014).
PIRO versus NEWS
In de studie van de Groot (2017) werd de PIRO-score vergeleken met de NEWS (afkappunt ≥ 8). De sensitiviteit was statistisch significant hoger voor de NEWS vergeleken met de PIRO, en de specificiteit was statistisch significant lager. Dit verschil is kleiner in een subgroep boven de 70 jaar.
De positief en negatief voorspellende waarde verschilde statistisch niet significant van de PIRO-score. Het discriminerend vermogen was significant groter voor de PIRO vergeleken met de NEWS (de Groot, 2017).
PIRO versus SOFA-score
In de studie van MacDonald (2014) en Yu (2014) werd de PIRO-score vergeleken met de SOFA-score. De AUC, het discriminerend vermogen was significant groter voor de PIRO vergeleken met de SOFA-score in de studie van MacDonald (2014), dit verschil was niet aanwezig in de studie van Yu (2014).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen voor mortaliteit voor de PIRO-score vergeleken met andere relevante scores is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: patiënt selectie, onduidelijke blindering tijdens interpretatie van resultaten en uitval van patiënten is onduidelijk gerapporteerd) en het geringe aantal events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
PIRO vergeleken met andere relevante criteria: voorspellende waarde en discriminerend vermogen voor IC-opname of andere vorm van klinische verslechtering
In de studie van Quinten (2017) was de sensitiviteit voor de voorspelling van IC-opname redelijk laag met 57,1% voor de PIRO (≥ 14) en 57,1% voor de qSOFA-score (afkappunt ≥ 2). De specificiteit was beter met 89,0% voor de PIRO (≥ 12) en 87,2% voor de qSOFA-score (afkappunt ≥b2). Er werden geen spreidingsmaten of p-waarden gepresenteerd.
De LR+ was hoger voor de PIRO-score vergeleken met de qSOFA-score, en de LR- was gelijk, er werden geen spreidingsmaten gepresenteerd.
De AUC was voor het discriminerend vermogen voor IC-opname 0.75 (0.63 tot 0.88) voor de PIRO, en 0,81 (0,72 tot 0,90) voor de qSOFA-score (Quinten, 2017).
In de studie van de Groot (2017) was er geen verschil tussen de AUC voor het discriminerend vermogen voor IC-opname, beide 0.72 tussen de PIRO en qSOFA-score. De AUC voor de MEWS en NEWS was niet significant anders, namelijk 0,71 en 0,75.
Yu (2014) definieerde ook als eindpunt van klinisch verslechtering IC-opname, IC-transfer, kritische zorg consult voor IC-transfer, SIT-team evaluatie, of mortaliteit binnen het ziekenhuis. De AUC voor het discriminerend vermogen voor een dergelijke klinische verslechtering was in de eerste 0 tot 12 uur het hoogst voor de SOFA-score met 0,78, daarna de PIRO met 0,78 en dan de MEWS met 0,73, ze verschilden niet significant van elkaar.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen voor IC-opname voor de PIRO-score vergeleken met andere relevante criteria is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: patiënt selectie, onduidelijke blindering tijdens interpretatie van resultaten en uitval van patiënten is onduidelijk gerapporteerd) en het geringe aantal events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
NEWS vergeleken met andere relevante criteria: voorspellende waarde en discriminerend vermogen voor mortaliteit en IC opname
Eén studie rapporteerde over de accuratesse van de NEWS-score vergeleken met andere relevante score voor de voorspellende waarde en discriminerend vermogen voor mortaliteit (Goulden, 2018).
In de studie van Goulden (2018) was de sensitiviteit voor de NEWS (afkappunt ≥ 5) 74% (95% BI 68 tot 79), dit was vergelijkbaar met de SIRS-criteria en significant hoger dan de qSOFA-score. De specificiteit was voor de NEWS (afkappunt ≥ 5) 43% (95% BI 41 tot 46), dit was significant hoger dan voor de SIRS-criteria, maar significant lager dan voor de qSOFA-score. De negatief voorspellende waarde verschilde niet tussen qSOFA-score, SIRS-criteria en NEWS, deze varieerde tussen de 86% tot 91%. De AUC, het discriminerend vermogen voor mortaliteit was voor de NEWS 0,65 (95% BI 0,61 tot 0,68), vergelijkbaar met de qSOFA-score en significant beter dan de SIRS-criteria. Resultaten waren vergelijkbaar voor de voorspelling van IC-opname (Goulden, 2018).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen voor mortaliteit of IC-opname voor de NEWS vergeleken met qSOFA-score en SIRS-criteria is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk-of-bias: patiëntenselectie, onduidelijke blindering tijdens interpretatie van resultaten) en het geringe aantal events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
MEWS/NEWS vergeleken met andere relevante criteria: voorspellende waarde en discriminerend vermogen voor de gecombineerde maat mortaliteit en/of IC-opname
Drie studies rapporteerden over de accuratesse van de MEWS- of NEWS-score vergeleken met andere relevante score voor de voorspellende waarde en discriminerend vermogen voor de gecombineerde maat mortaliteit en/of IC-opname (Churpek, 2017; Yu, 2017; Goulden, 2018). De vergelijking van de PIRO met de MEWS is hierboven al beschreven. (Yu, 2014) De resultaten van Goulden (2018) waren vergelijkbaar voor de samengestelde maat zoals hierboven beschreven.
In de studie van Churpek (2017) was de sensitiviteit het laagst voor de qSOFA-score (afkappunt ≥ 2) met 8%, gevolgd door de NEWS (afkappunt ≥ 5) met 63%, de SIRS-criteria (afkappunt ≥ 2) met 66%, de SOFA-score (afkappunt ≥ 1) met 68% en de MEWS(afkappunt ≥ 3) met 69%.
De specificiteit was het laagst voor de SOFA-score (afkappunt ≥ 1) met 45%, gevolgd door de SIRS-criteria (≥ 2) criteria met 50%, de MEWS (afkappunt ≥ 3) met 57%, de NEWS afkappunt (≥ 5) met 64% en de qSOFA-score (afkappunt ≥ 2) met 92%.
De positief voorspellende waarde was het laagst voor de SOFA-score (afkappunt ≥ 1) en SIRS-criteria (afkappunt ≥ 2) met 15%, gevolgd door de MEWS (afkappunt ≥ 3) met 18%, de NEWS (afkappunt ≥ 5) met 19% en de qSOFA-score met 25%.
De negatief voorspellende waarde was het laagst voor de qSOFA-score (afkappunt ≥ 2) met 89%, gevolgd door de SIRS-criteria (afkappunt ≥ 2) en SOFA-score (afkappunt ≥ 1) met 91%, en de MEWS (afkappunt ≥ 3) en NEWS (afkappunt ≥ 5) met 91%.
De mediane AUC, het discriminerend vermogen was het laagst voor de SIRS met 0,60, gevolgd door de SOFA-score met 0,62, de qSOFA-score met 0,65, MEWS met 0,67 en NEWS met 0,71.
Er werden geen spreidingsmaten of p-waardes gepresenteerd (Churpek, 2017).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat voorspellende waarde en discriminerend vermogen voor de gecombineerde maat mortaliteit en/of IC-opname voor de NEWS/MEWS-score vergeleken met andere relevante scores is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk-of-bias: patiëntenselectie, onduidelijke blindering tijdens interpretatie van resultaten). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Is er een instrument waarmee (verslechtering van patiënten met) sepsis beter herkend of voorspeld kan worden dan met de SIRS-criteria op de SEH en de verpleegafdelingen?
P: patiënten van 18 jaar en ouder met verdenking sepsis zowel op de SEH als op de verpleegafdelingen in het ziekenhuis;
I: quick sepsis related organ failure assessment (qSOFA) score, early warning score (EWS), national early warning score (NEWS), modified early warning score (MEWS), predisposition, infection (or insult), response and organ dysfunction (PIRO);
C: systemic inflammatory response syndrome (SIRS) criteria, sepsis related organ failure assessment (SOFA) score of vergelijking met andere bovengenoemde test;
O: Voorspellende waarde en discriminerend vermogen mortaliteit, IC-opname, acute orgaandisfunctie; tijd tot behandeling; door-to-needle time; functionele uitkomst.
Relevante uitkomstmaten
De werkgroep achtte de voorspellende waarde (met name sensitiviteit) en discriminerend vermogen voor mortaliteit en/of IC-opname een voor de besluitvorming kritieke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 19 april 2018 met relevante zoektermen gezocht naar de verschillende instrumenten voor de herkenning van sepsis bij volwassen patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 731 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews, gerandomiseerde trials of vergelijkend observationele studies waar twee of meerdere relevante instrumenten (qSOFA-score, SOFA-score, SIRS-criteria, NEWS, MEWS, PIRO) met elkaar werden vergeleken op de hierboven genoemde uitkomstmaten bij patiënten met verdenking van een infectie in een niet-IC-setting. Op basis van titel en abstract werden in eerste instantie 65 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 58 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 7 studies definitief geselecteerd (Song, 2018; Churpek, 2017; Goulden, 2018; Quinten, 2017; de Groot, 2017; Yu, 2014; MacDonald, 2014).
Zeven studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk-of-bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Churpek MM, Snyder A, Sokol S, Pettit NN, Edelson DP. Investigating the Impact of Different Suspicion of Infection Criteria on the Accuracy of Quick Sepsis-Related Organ Failure Assessment, Systemic Inflammatory Response Syndrome, and Early Warning Scores. Crit Care Med. 2017 Nov;45(11):1805-1812. doi: 10.1097/CCM.0000000000002648.
- Goulden R, Hoyle MC, Monis J, Railton D, Riley V, Martin P, Martina R, Nsutebu E. qSOFA, SIRS and NEWS for predicting inhospital mortality and ICU admission in emergency admissions treated as sepsis. Emerg Med J. 2018 Feb 21. pii:emermed-2017-207120. doi: 10.1136/emermed-2017-207120. (Epub ahead of print)
- de Groot B, Stolwijk F, Warmerdam M, Lucke JA, Singh GK, Abbas M, Mooijaart SP, Ansems A, Esteve Cuevas L, Rijpsma D. The most commonly used disease severity scores are inappropriate for risk stratification of older emergency department sepsis patients: an observational multi-centre study. Scand J Trauma Resusc Emerg Med. 2017 Sep 11;25(1):91. doi: 10.1186/s13049-017-0436-3.
- Macdonald SP, Arendts G, Fatovich DM, Brown SG. Comparison of PIRO, SOFA, and MEDS scores for predicting mortality in emergency department patients with severe sepsis and septic shock. Acad Emerg Med. 2014 Nov;21(11):1257-63. doi: 10.1111/acem.12515.
- Quinten VM, van Meurs M, Wolffensperger AE, Ter Maaten JC, Ligtenberg JJM. Sepsis patients in the emergency department: stratification using the Clinical Impression Score, Predisposition, Infection, Response and Organ dysfunction score or quick Sequential Organ Failure Assessment score? Eur J Emerg Med. 2017 May 8. doi: 10.1097/MEJ.0000000000000460. (Epub ahead of print)
- Rhodes, A., Evans, L. E., Alhazzani, W., Levy, M. M., Antonelli, M., Ferrer, R., . . . Dellinger, R. P. (2017). Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med, 43(3), 304-377. doi:10.1007/s00134-017-4683-6
- Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016 Feb 23;315(8):801-10. doi: 10.1001/jama.2016.0287.
- Song JU, Sin CK, Park HK, Shim SR, Lee J. Performance of the quick Sequential (sepsis-related) Organ Failure Assessment score as a prognostic tool in infected patients outside the intensive care unit: a systematic review and meta-analysis. Crit Care. 2018 Feb 6;22(1):28. doi: 10.1186/s13054-018-1952-x.
Evidence tabellen
Evidence table for diagnostic test prognostic accuracy systematic review studies
Research question: Is er een instrument waarmee (verslechtering van) sepsis beter herkend of voorspeld kan worden dan met de SIRS criteria op de verpleegafdelingen en de spoedeisende hulp?
Evidence table for diagnostic test prognostic accuracy studies
Research question: Is er een instrument waarmee (verslechtering van) sepsis beter herkend of voorspeld kan worden dan met de SIRS-criteria op de verpleegafdelingen en de spoedeisende hulp?
|
Study reference |
Study characteristics |
Patient characteristics |
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Churpek, 2017 |
Type of study[1]: Prospective Observational cohort study (data collection mainly retrospective)
Setting: Hospitalized patients outside the ICU. Single academic centre
Country: US
Conflicts of interest: Drs. Chupek and Edelson disclosed having a patent pending for risk-stratification algorithms for hospitalized patients. Dr. Edelson’s institution received funding in the form of research support from Philips Healthcare (Andover, MA) and EarlySense (Tel Aviv, Israel), and she received funding from QuantHC (Chicago, IL) (ownership interest). The remaining authors have disclosed that they do not have any potential conflicts of interest. |
Inclusion criteria: - all adult patients admitted to the University of Chicago Medicine - varying levels of suspicion of infection were created using EHR data based on culture orders and antibiotic administration: 1) any culture, 2) blood culture, 3) any culture plus IV antibiotics, 4) blood culture plus IV antibiotics, 5) any culture plus IV antibiotics for at least 4 out of 7 days, and 6) blood culture plus IV antibiotics for at least 5 out of 7 days.
Exclusion criteria: prophylactic dose antibiotics
N=53,849
Prevalence: In-hospital mortality=3% IC-transfer=17%
Mean age ± SD: 57 (18)
Sex:54% F |
Describe index test: SIRS Cut-off point(s): different used
Comparator test[2]: SOFA Cut-off point(s): different used
Comparator test[3]: qSOFA Cut-off point(s): different used
Comparator test[4]: MEWS Cut-off point(s): different used
Comparator test[5]: NEWS Cut-off point(s): different used
Only scores calculated in the ED and wards were included in the analyses. In addition, non-physiologic values were changed to missing. |
Describe reference test[6]: In-hospital mortality
|
Time between the index test and reference test: not relevant
For how many participants were no complete outcome data available? Unclear
|
Outcome measures and effect size (include 95%CI and p-value if available)4:
Sensitivity/Specificity for any culture SOFA≥1: 68%/45% SIRS≥1: 66%/50% qSOFA≥2: 18%/92% MEWS≥3: 69%/93% NEWS≥5: 63%/64%
PPV/NPV for any culture SOFA≥1: 15%/91% SIRS≥1: 15%/91% qSOFA≥2: 24%/89% MEWS≥3: 18%/93% NEWS≥5: 19%/93%
Median AUC SOFA: 0.62 SIRS: 0.60 qSOFA: 0.65 MEWS: 0.67 NEWS: 0.71
|
|
|
Quinten, 2017 |
Type of study: Prospective observational cohort study
Setting: ED
Country: The Netherlands
Conflicts of interest: There are no conflicts of interest.
|
Inclusion criteria: -adults visiting the ED between 8am and 6pm - patients of 18 years and older age, suspected or confirmed infection and two or more Systemic Inflammatory Response Syndrome criteria as defined by the International Sepsis Definitions Conference
Exclusion criteria:-
N=193
Prevalence:10.9% for ICU admission; 4,1% in-hospital mortality
Mean age (IQR): 60 (48–71)
Sex: 56% M |
Describe index test: PIRO Comparator test: qSOFA
Assessed by ED staff upon arrival
Different cut-off points were used based on optimum derived from ROC curves |
Describe reference test: Mortality Admission to ICU
|
Time between the index test en reference test: NA
For how many participants were no complete outcome data available? N=0
|
Outcome measures and effect size (include 95%CI and p-value if available):
Sensitivity/Specificity for in-hospital mortality: PIRO≥12: 75%/76.8% qSOFA≥2: 62.5%/84.3%
LR+/LR- for in-hospital mortality: PIRO≥12: 3.2/0.3 qSOFA≥2:4.0/0.4
AUC for in-hospital mortality: PIRO: 0.76 (0.65-0.88) qSOFA: 0.75 (0.63-0.88)
Sensitivity/Specificity for ICU admission PIRO≥14: 57.1%/89.0% qSOFA≥2: 57.1%/87.2%
LR+/LR- for ICU admission: PIRO≥14:5.2/0.5 qSOFA≥2:4.5/0.5
AUC for ICU admission: PIRO: 0.75 (0.63-0.88) qSOFA: 0.81 (0.72-0.90) |
In this study also comparison with Clinical Impression Scores (CIS), appraised by a nurse and the attending physician. |
|
Goulden, 2017 |
Type of study: retrospective cohort study
Setting: ED or medical admissions unit
Country: UK
Conflicts of interest: None declared
|
Inclusion criteria: all adult patients presenting to the ED or medical admissions unit, in whom sepsis was suspected and treated by the clinical team.
Exclusion criteria: -
N=1942 unique patients of which 1818 with complete scores
Prevalence of mortality (in hospital): 265 (15%)
Prevalence of ICU admission: 53 (3%)
Mean age: 68 yr
Sex: 49% Female
Other important characteristics:
|
Describe index test: qSOFA≥2 Comparator test 1: SIRS≥2 Comparator test 2: NEWS≥5
|
Describe reference test: In hospital mortality Admission to ICU
|
Time between the index test en reference test: NA
For how many participants were no complete outcome data available? N =124 (6%)
Reasons for incomplete outcome data described? After manual review of paper charts for missing scores, the value of all three scoring systems on arrival was available for 1818 of these patients (94%), forming our study population. We found no evidence that missingness was predicted by other variables; thus, a complete case analysis was performed. |
Outcome measures and effect size (include 95%CI and p-value if available):
All analyses except AUROC used thresholds of qSOFA ≥2, SIRS≥2 and NEWS≥5.
Sens/ Spec for predicting inhospital death, % (95% CI): qSOFA: 37 (31 to 43) / 79 (77 to 81) SIRS: 80 (74 to 84)/ 21 (19 to 23) NEWS: 74 (68 to 79) / 43 (41 to 46)
Sens: SIRS versus qSOFA: P<0.001 Sens: NEWS versus qSOFA: P<0.001 Sens: NEWS versus SIRS: P: 0.02 (not significant when using bonferroni correction) Spec: qSOFA versus NEWS: P<0.001 Spec: qSOFA versus SIRS: P<0.001 NEWS versus SIRS: P<0.001
PPV/NPV for predicting inhospital death, % (95% CI): qSOFA: 23 (19 to 28) / 88 (86 to 90) SIRS: 15 (13 to 17) / 86 (82 to 89) NEWS: 18 (16 to 21)/ 91 (88 to 93)
LR+/LR- for predicting inhospital death (95% CI): qSOFA: 1.78 (1.48 to 2.14) / 0.80 (0.72 to 0.88) SIRS: 1.01 (0.94 to 1.08) / 0.96 (0.75 to 1.25) NEWS: 1.30 (1.19 to 1.41) / 0.61 (0.55 to 0.61)
AUROC for predicting inhospital death (95% CI): qSOFA: 0.62 (0.59 to 0.66) SIRS: 0.49 (0.45 to 0.52) NEWS: 0.65 (0.61 to 0.68)
NEWS versus qSOFA: NS SIRS versus NEWS: p<0.001 qSOFA versus SIRS: p<0.001
Sens/ Spec for predicting ICU admission, % (95% CI): qSOFA: 36 (23 to 50) / 77 (75 to 79) SIRS: 85 (72 to 93) / 21 (19 to 23) NEWS: 77 (64 to 88) / 41 (39 to 44)
PPV/NPV for predicting ICU admission, % (95% CI): qSOFA: 5 (3 to 7) / 98 (97 to 98) SIRS: 3 (2 to 4) / 98 (96 to99) NEWS: 4 (3 to 5) / 99 (97 to 99)
LR+/LR- for predicting ICU admission (95% CI): qSOFA: 1.57 (1.09 to 2.28) / 0.83 (0.68 to 1.02) SIRS: 1.08 (0.96 to 1.21) / 0.71 (0.37 to 1.36) NEWS: 1.32 (1.13 to 1.53) / 0.55 (0.33 to 0.90)
AUROC for predicting ICU admission (95% CI): qSOFA: 0.59 (0.52 to 0.67) SIRS: 0.54 (0.47 to 0.61) NEWS: 0.64 (0.57 to 0.71) |
Results were similar for the composite of inhospital death or ICU admission (online supplementary table 1). |
|
De Groot, 2017 |
Type of study: Observational prospective cohort study
Setting: ED
Country: The Netherlands
Conflicts of interest: None declared
|
Inclusion criteria: 17 years and older with a suspected infection and Manchester triage category yellow, orange or red who received intravenous antibiotics in the ED and were subsequently admitted to the hospital
Exclusion criteria: Triage categories blue and green were excluded because most of these patients were expected to be at very low risk for mortality or admission. Patients who appeared to have no infection according to the final hospital discharge letter were excluded.
N=2280
Prevalence of mortality (in hospital): N=143, 6.3%
Prevalence of ICU/MCU admission: N=220, 9.6%
Mean age (SD): 61.1 (17.0)
Sex: 57.7 male |
Describe index test: PIRSO Comparator test 1: qSOFA Comparator test 2: NEWS Comparator test 3: MEWS
|
Describe reference test: 1. In-hospital mortality 2. ICU/MCU admission
|
Time between the index test en reference test: NA
For how many participants were no complete outcome data available? N =0
Reasons for incomplete outcome data described? NA |
Outcome measures and effect size (include 95%CI and p-value if available):
Sens/spec to predict in-hospital mortality, %, 95% CI: PIRO≥14: 0.55 (0.53–0.57) / 0.77 (0.75–0.79) qSOFA≥2: 0.32 (0.30–0.33) / 0.87 (0.85–0.88) MEWS≥7: 0.42 (0.40–0.44) / 0.77 (0.76–0.79) NEWS≥8: 0.63 (0.61–0.65) / 0.63 (0.61–0.65)
PPV/NPV to predict in-hospital mortality, %, 95% CI: PIRO≥14: 0.12 (0.11–0.14) / 0.96 (0.95–0.97) qSOFA≥2: 0.11 (0.10–0.12) / 0.95 (0.94–0.96) MEWS≥7: 0.11 (0.10–0.13) / 0.95 (0.94–0.96) NEWS≥8: 0.10 (0.08–0.11) / 0.96 (0.95–0.97)
AUC (95% CI) for mortality: PIRO: 0.73 (0.69–0.77) qSOFA: 0.68 (0.63–0.72) MEWS: 0.63 (0.58–0.67) NEWS: 0.67 (0.62–0.72)
AUC (95% CI) for ICU/MCU admission PIRO: 0.72 (0.69-0.75) qSOFA: 0.72 (0.68-0.75) MEWS: 0.71 (0.68-0.75) NEWS: 0.75 (0.72-0.79) |
|
|
Yu, 2014 |
Type of study: retrospective nested case-control study
Setting: ED
Country: USA
Conflicts of interest: None to declare
|
Inclusion criteria: an infection ICD-9 code present on admission
Exclusion criteria: Patients admitted directly to the ICU from the ER were excluded
N=328 cases and 328 matched controls
Prevalence of mortality (in hospital):
Prevalence of ICU admission:
Median age (IQR): Controls: 64 (49-78) Cases: 67 (55-79)
Sex: Controls: 63% F Cases: 53% F |
Describe index test: PIRO Comparator test 1: MEWS Comparator test 2: SOFA
|
Describe reference test: - clinical deterioration defined as in-hospital mortality - clinical deterioration, defined as ICU transfer, critical care consult for ICU transfer, rapid response evaluation, or in-hospital mortality
|
Time between the index test and reference test: NA
For how many participants were no complete outcome data available? N =0
Reasons for incomplete outcome data described? NA |
Outcome measures and effect size (include 95%CI and p-value if available):
0-12hr interval before clinical detoriation; AUC (95% CI) for discriminating power for predicting mortality: SOFA : 0.83 (0.77-0.88) PIRO: 0.87 (0.82-0.92) MEWS: 0.82 (0.77-0.88)
0-12hr interval before clinical detoriation; AUC (95% CI) for discriminating power for predicting clinical detoriation: SOFA : 0.78 (0.74-0.81) PIRO: 0.76 (0.72-0.79)) MEWS: 0.73 (0.69-0.77)
|
|
|
Mac-Donald, 2014 |
Type of study: Subgroup analysis of prospective observational cohort
Setting: ED
Country: Australia
Conflicts of interest: None to declare
|
Inclusion criteria: patients presenting to the ED with a range of critical illnesses and meeting physiologic criteria suggesting shock or organ failure undergo real-time clinical data collection and repeated blood sampling by trained research nurses over the initial 24 hours of their hospital stays. Patients are recruited during research nurse hours (07:00 to 22:00), 7 days per week. Exclusion criteria: - excluding CISS patients with clear nonsepsis diagnoses (e.g., trauma, myocardial infarction, pulmonary embolism)
N=240
Prevalence of 30 day mortality: 20%
Prevalence of ICU admission: 44%
Mean age: 67 (51–78)
Sex: 64% male |
Describe index test: PIRO Comparator test 1: SOFA
|
Describe reference test: 30-day mortality
|
Time between the index test and reference test: NA
For how many participants were no complete outcome data available? N =0
Reasons for incomplete outcome data described? NA |
Outcome measures and effect size (include 95%CI and p-value if available):
AUROC for predicting 30-day mortality (95% CI): PIRO: 0.86 (0.80-0.92) SOFA: 0.78 (0.71-0.85)
|
|
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea,2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Is er een instrument waarmee (verslechtering van) sepsis beter herkend of voorspeld kan worden dan met de SIRS criteria op de verpleegafdelingen en de spoedeisende hulp?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Song, 2018 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined.
- Search period and strategy should be described; at least Medline searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to the research question (PICO) should be reported.
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis.
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
Research question: Is er een instrument waarmee (verslechtering van) sepsis beter herkend of voorspeld kan worden dan met de SIRS-criteria op de verpleegafdelingen en de spoedeisende hulp?
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Churpek, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes (different levels of infection suspicion) However, it is unknown which of the patients in the large data set truly were infected. |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Unclear |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
|
Quinten, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? Yes (only ED patients)
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Goulden, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No, complete case analysis (however 6% missing and investigated and deemed random) |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
De Groot, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Yu, 2014 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
MacDonald 2014 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? NA |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? NA
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
Judgments on risk of bias are dependent on the research question: some items are more likely to introduce bias than others, and may be given more weight in the final conclusion on the overall risk of bias per domain:
Patient selection:
- Consecutive or random sample has a low risk to introduce bias.
- A case control design is very likely to overestimate accuracy and thus introduce bias.
- Inappropriate exclusion is likely to introduce bias.
Index test:
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
- Selecting the test threshold to optimise sensitivity and/or specificity may lead to overoptimistic estimates of test performance and introduce bias.
Reference standard:
- When the reference standard is not 100% sensitive and 100% specific, disagreements between the index test and reference standard may be incorrect, which increases the risk of bias.
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
Flow and timing:
- If there is a delay or if treatment is started between index test and reference standard, misclassification may occur due to recovery or deterioration of the condition, which increases the risk of bias.
- If the results of the index test influence the decision on whether to perform the reference standard or which reference standard is used, estimated diagnostic accuracy may be biased.
- All patients who were recruited into the study should be included in the analysis, if not, the risk of bias is increased.
Judgement on applicability:
Patient selection: there may be concerns regarding applicability if patients included in the study differ from those targeted by the review question, in terms of severity of the target condition, demographic features, presence of differential diagnosis or co-morbidity, setting of the study and previous testing protocols.
Index test: if index tests methods differ from those specified in the review question there may be concerns regarding applicability.
Reference standard: the reference standard may be free of bias but the target condition that it defines may differ from the target condition specified in the review question.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Hamilton 2018 |
Voldoet niet aan PICO: Geen comparator |
|
Williams 2016 |
Voldoet niet aan PICO: Geen relevante tests meegenomen |
|
Corfield 2014 |
Voldoet niet aan PICO: Geen comparator |
|
Geier 2013 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Cildir 2013 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Gabem Zoubi 2011 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Camm 2018 |
Voldoet niet aan PICO: ambulatory care |
|
Tusgul 2017 |
Vergelijkbare resultaten met song review |
|
Fukushima 2017 |
Vergelijkbare resultaten met song review |
|
Rathour 2015 |
Voldoet niet aan PICO: Geen comparator |
|
Boulos 2017 |
Vergelijkbare resultaten met song review |
|
Sterling 2017 |
Vergelijkbare resultaten met song review |
|
LeGuen 2018 |
Vergelijkbare resultaten met song review |
|
Williams 2017 |
Vergelijkbare resultaten met song review |
|
Umemura 2017 |
Vergelijkbare resultaten met song review |
|
Shetty 2017 |
Vergelijkbare resultaten met song review |
|
Muller 2017 |
Vergelijkbare resultaten met song review |
|
Moskowitz 2017 |
Vergelijkbare resultaten met song review |
|
Haydar 2017 |
Vergelijkbare resultaten met song review |
|
Guirgis 2017 |
Vergelijkbare resultaten met song review |
|
de Groot 2014 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Chen 2014b |
Voldoet niet aan PICO: Geen relevante comparator |
|
De Groot 2012 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Seymour 2016 |
In Song review 2018 |
|
Szakmany 2018 |
In Song review 2018 |
|
Donnelly 2017 |
In Song review 2018 |
|
Wang 2016 |
In Song review 2018 |
|
Henning 2017 |
In Song review 2018 |
|
Freund 2017 |
In Song review 2018 |
|
Barnaby 2018 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Zhang 2017 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Gunes 2017 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Williams 2016 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Junhasavasdikul 2016 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Lee 2016 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Sasko 2015 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Ryoo 2015 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Innocenti 2014 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Chen 2014a |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Chen 2014c |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Oltean 2012 |
Voldoet niet aan PICO: SOFA +andere niet relevante instrumenten |
|
Ryoo |
Voldoet niet aan PICO: Geen relevante comparator |
|
Jones 2009 |
Voldoet niet aan PICO: Geen relevante comparator |
|
Kim 2017 |
In Song review 2018 |
|
Jouffroy 2017 |
Voldoet niet aan PICO: Pre-hospital triage patiënten |
|
Serafim 2017 |
Overlap met Song review |
|
Desautels 2016 |
Voldoet niet aan PICO: IC-patiënten |
|
Dorsett 2017 |
In Song review 2018 |
|
Chen 2016 |
In Song review 2018 |
|
Peake 2017 |
In Song review 2018 |
|
Hwang 2018 |
In Song review 2018 |
|
Ranzani 2017 |
In Song review 2018 |
|
Park 2017 |
In Song review 2018 |
|
Finkelsztein 2017 |
In Song review 2018 |
|
April MD 2017 |
In Song review 2018 |
|
Martin-Martin 2016 |
Spaanstalig artikel |
|
Wang 2013 |
Chinees artikel |
|
Roney 2015 |
Voldoet niet aan PICO |
[1] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer et al., 1999)
[2] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[3] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[4] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[5] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[6] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-01-2020
Beoordeeld op geldigheid : 26-03-2020
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Vroege herkenning van (dreigende) sepsis |
NIV |
2020 |
2025 |
Eens in de vijf jaar |
NIV |
- |
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De ontwikkeling van deze richtlijn wordt gefaseerd doorlopen en opgeleverd. Op dit moment wordt alleen Sepsis fase 1 opgeleverd. Later wordt het ontwikkeltraject voor Sepsis fase 1 uitgebreid met fase 2 en 3. Er wordt naar gestreefd om de gehele richtlijn in 2021 af te ronden.
In fase 1 zijn de thema’s vroege herkenning, diagnostiek en eerste behandeling (vloeistofrecusatie en zuurstoftoediening) reeds behandeld.
In het vervolgtraject komen fase 2 en 3 aan bod en worden samengevoegd tot één richtlijn. Deze omvatten de volgende thema’s:
- Fase 2 (behandeling): vasopressoren en/of inotropica, nierfunctievervangende therapie, transfusiebeleid, sedatiemethode en delier.
- Fase 3 (nazorg en aandacht voor langetermijngevolgen voor de patiënt): (vroeg)mobilisatie, voeding, aandacht voor langetermijneffecten, revalidatie, voorlichting en begeleiding van patiënt en/of naasten.
Aan het einde van het gehele traject wordt er een overkoepelende gezamenlijke module over de organisatie van zorg/randvoorwaarden opgeleverd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een discipline overstijgende evidence-based richtlijn te ontwikkelen, gericht op de vroegtijdige herkenning, diagnose, (initiële) behandeling, monitoring, nazorg en revalidatie van patiënten met (dreigende) sepsis.
Met deze richtlijn kan de kwaliteit van de sepsiszorg worden verbeterd en gewaarborgd, met als doel minder sepsis gerelateerde morbiditeit en mortaliteit.
Doelgroep
Deze richtlijn wordt geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met (dreigende) sepsis in de ziekenhuiszorg.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met sepsis te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht NVIC
- Drs. A. Klijn, AIOS Spoedeisende geneeskunde, Westfriesgasthuis te Hoorn, NVSHA
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. D. Snijders, longarts, Spaarne Gasthuis te Haarlem en te Hoofddorp, NVALT
- Dr. A.K. van der Bij, arts-microbioloog, Diakonessenhuis te Utrecht, NVMM
- I. Nutma, patiëntenvertegenwoordiger (Stichting Family and Patient Centered Intensive Care (FCIC))/ IC connect
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-SEH
- M. Hoogendoorn, kwaliteitsmedewerker Vakgroep Anesthesiologie & Intensive Care, Isala, beleidsmedewerker Raad van Bestuur, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, senior onderzoeker Sector Verplegingswetenschap afdeling Interne Geneeskunde en senior onderzoeker Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Prof. dr. D. van de Beek, neuroloog, Amsterdam UMC locatie AMC te Amsterdam, NVN
- Drs. O.J.D. Snieders, uroloog, Diakonessenhuis, te Utrecht/Zeist/Doorn en St. Antonius ziekenhuis, te Utrecht/Nieuwegein, NVU
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten (voorzitter) |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede, Medisch Hoofd IC, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald:
|
Participatie als onderzoeker in lC sepsis trials (b.v. AKPA-ART 123 trombomoduline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau lnteractie dat voor vele wetenschappelijke verenigingen congressen organiseert. Bestaande activiteiten rond sepsis lopen al meer dan 10 jaar en door de richtlijn zullen deze niet wijzigen.
|
Geen actie |
|
S. Sankatsing |
internist-infectioloog/internist-acute geneeskunde in het Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van Internist Infectiologen (NVII)
Lid Commissie Richtlijnen Nederlandse Internisten Vereniging (NIV) |
Geen |
Geen actie |
|
M. de Regt |
Internist Acute Geneekunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam (sinds april 2019, daarvoor in UMCU) |
Geen |
Geen |
Geen actie |
|
L. Derde |
Intensivist UMC Utrecht |
Co-lead WP5 PREPARE Lid NVVM influenza richtlijn Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia) Voorzitter van de Clinical Training Committee (CTC) van ESICM. Faculty ESICM masterclass sepsis and severe infections. |
Betrokken bij onderzoek dat door EU wordt gefinancierd: 1. Co-lead van WP5 PREPARE project (EU FP7 funded): doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC 2. Lid International Trial Steering Committee, European Regional Management Committee en diverse domein-specifieke werkgroepen van REMAP-CAP. REMAP-CAP is de internationale overkoepelende studie waarvan PREPARE-WP5 het Europese deel is. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Op moment van tekenen is er geen industrie-betrokkenheid. |
Geen actie |
|
A. Klijn |
AIOS SEG in het Dijklander Ziekenhuis te Hoorn |
Buitengewoon lid richtlijnen commissie van de NVSHA, onbetaald. |
Geen |
Geen actie |
|
R. Schellaars |
intensivist, Ziekenhuis Gelderse Vallei, Ede |
bestuurslid SIC-NVA |
Geen |
Geen actie |
|
R. Wilting |
chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen actie |
|
D. Snijders |
longarts, medisch manager vakgroep longziekten Spaarne Gasthuis |
Docent Inholland, opleiding EHLH verpleegkundige, vergoeding. Lid richtlijn bronchiëctasieën NVALT, vergoeding. |
Geen |
Geen actie |
|
A. van der Bij |
Arts-microbioloog, werkzaam bij het Diakonessenhuis/Medisch Specialistisch Bedrijf Domstad (MSBD) Utrecht |
voorzitter van de Commissie Kwaliteitsbevordering van de NVMM. |
Geen |
Geen actie |
|
I. Nutma |
- Ex-patiënt, voormalig verpleegkundige, auteur van Septische shock en Sepsis en daarna. - Ervarings-professional. Eigenaar van Sepsis en daarna. - Mede-initiatiefnemer van de website www.opeenicliggen.nl; overgegaan in icconnect.nl
|
- Werkzaamheden op het gebied van voorlichting (Lezingen, lessen, workshops), begeleiding (huisbezoek, telefonische consulten) en advisering (bij onderzoek, richtlijnen, etc.) geschieden, betaald. - Mede-initiatiefnemer van de website opeenicliggen.nl, inmiddels overgegaan in de website icconnect.nl, onbetaald -Lid werkgroep ervaringsdeskundigen FCIC/IC-connect tot jan. 2019, onbetaald - beheerder (sinds ’17) online sepsis- lotgenotenplatform, onbetaald - organisator Sepsis Lotgenoten Dag, (vanaf 2018), onbetaald |
Geen |
Geen actie |
|
V. Bon |
Verpleegkundig Specialist SEH (18 uur/week) OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam (12uur/week) |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen actie |
|
M. Hoogendoorn |
Kwaliteitsmedewerker Vakgroep Anesthsesiologie & Intensive Care, Isala, Zwolle (0,5 FTE) Beleidsmedewerker Raad van Bestuur, Isala, Zwolle (0,5 FTE) |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen actie |
|
E. Ista |
universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
universitair Docent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijne V&VN, Utrecht (onbetaald) |
|
Geen actie |
|
R. Jansen |
100% dienstverband als klinisch geriater Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amsteracademie voor verschillende verpleegkundigen opleidingen (betaald). |
Honoraria van Bayer, Boehringer en BMS voor houden lezingen, webTV, etc over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen actie |
|
D. van de Beek |
Neuroloog, Amsterdam UMC, locatie AMC |
Consultancy GSK malaria vaccin (betaald aan werkgever, AMC) |
Geen |
Geen actie |
|
O. Snieders |
functioneel uroloog maatschap Urologen voor U (diakonessenhuis utrecht/zeist/doorn en st. antonius ziekenhuis utrecht/nieuwegein) |
lid calamiteiten onderzoeksgroep (COG) diakonessenhuis (betaald) penningmeester regiomaatschap (onbetaald) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
|
M. Ruiter |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afgevaardigde patiëntvertegenwoordiger in de werkgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Paitent Centered Intensive Care/ IC connect, Sepsis en daarna, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen, Dutch Acute Medicine via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vond.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk-of-bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk-of-biastabellen. De gebruikte risk-of-biasinstrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk-of-bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module toekomstige module Randvoorwaarden. Die wordt ontwikkeld bij de richtlijn Sepsis fase 2 en 3.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken en er zijn al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk zoals de huidige indicator vroege herkenning sepsis in de basisset 2019.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1988 – april 2018
|
1 exp *SEPSIS/ or (sepsis or sepses).ti. (83886) 2 exp Organ Dysfunction Scores/ or (organ adj2 (failure or dysfunction) adj2 (score* or criteria*)).ab,ti. or (warning adj2 (score* or system*)).ab,ti. or mods.ab,ti. or meds.ab,ti. or mews.ab,ti. or ews.ab,ti. or charlson.ab,ti. or cci.ab,ti. or piro.ab,ti. or sofa.ti. or qsofa.ti. or news.ti. (29280) 3 exp Emergency Service, Hospital/ or hospital*.ab,ti. or (emergency adj2 (room* or department* or unit* or ward*)).ab,ti. (1162423) 4 (screen* or assess* or score*).ab,ti. (3412034) 5 1 and 2 and 3 and 4 (586) 6 limit 5 to yr="1988 -Current" (586) 7 limit 6 to english language (529) 8 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (351270) 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1746889) 10 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (2954539) 11 7 and 8 (10) 12 7 and 9 (142) 13 7 and 10 (455) 14 11 or 12 or 13 (484) = 484 (478 uniek) |
|
|
Embase (Elsevier) |
(('sepsis'/exp OR sepsis:ti OR sepses:ti) AND ('organ dysfunction score'/exp OR ((organ* NEAR/2 (failure OR dysfunction) NEAR/2 (score* OR criteria*)):ab,ti OR ('early warning score'/exp OR 'early warning system'/exp OR mods:ab,ti OR meds:ab,ti OR mews:ab,ti OR ews:ab,ti OR 'warning score*':ab,ti OR charlson:ab,ti OR cci:ab,ti OR piro:ab,ti) OR (sofa*:ti OR qsofa*:ti OR news:ti))) AND ('emergency ward'/exp OR hospital*:ab,ti OR ((emergency NEAR/2 (room* OR department* OR unit* OR ward*)):ab,ti)) AND (screen*:ab,ti OR assess*:ab,ti OR score*:ab,ti)) AND (1988-2018)/py AND (english)/lim NOT 'conference abstract':it
Filter SR: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
Filter RCT: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 587 (582 uniek) |
