Biomarkers voor vroege herkenning van sepsis bij kinderen
Uitgangsvraag
Wat is de diagnostische waarde van de point of care testen met biomarkers PCT, CRP, en leucocyten getal voor vroege herkenning van sepsis bij kinderen?
Aanbeveling
Overweeg bij kinderen met verdenking op sepsis CRP en/of PCT en leukocytengetal te bepalen. Deze biomarkers kunnen worden gebruikt ter ondersteuning van de diagnose sepsis, maar het klinisch beeld is bepalend voor het wel/niet starten van de sepsis behandeling. Overweeg om de biomarkers te gebruiken als follow-up markers.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Twee systematische reviews en twee additionele cohortstudies, die de sensitiviteit en specificiteit van PCT, CRP en/of leukocyten getal onderzochten, werden geïncludeerd in de literatuuranalyse. Over het algemeen lijkt de specificiteit van PCT en voor het opsporen van ernstige bacteriele infectie (SBI) of invasieve bacteriële infecties (IBI) wat hoger te zijn dan de sensitiviteit bij een afkapwaarde van 0,5 ng/mL. De sensitiviteit en specificiteit van CRP lijkt ongeveer even hoog, maar de spreiding in sensitiviteit is wel wat groter. In het algemeen lijkt de sensitiviteit van PCT wat groter te zijn dan de sensitiviteit van CRP.
De bewijskracht van de diagnostische waarde is beoordeeld als redelijk of laag. Dit heeft te maken met het risico op bias, doordat veel studies niet of beperkt rapporteren hoe en op welk moment de referentietest is afgenomen, zodat onduidelijk is of de resultaten onafhankelijk van de indextest zijn beoordeeld. De heterogeniteit in de gemeten sensitiviteit en specificiteit tussen studies kan deels toegeschreven worden aan de verschillen in leeftijden of het tijdstip van afnemen van de test.
De literatuur over de diagnostische accuratesse van de biomarkers C-reactive protein (CRP), procalcitonine (PCT) en leukocyten aantal is erg heterogeen. Gezien de forse spreiding in sensitiviteit en specificiteit lijkt geen van de onderzochte biomarkers alle vormen van sepsis met grote mate van zekerheid te kunnen aantonen danwel uit te sluiten. Vergeleken met CRP en leukocytengetal lijkt PCT een hogere sensitiviteit te hebben voor het aantonen van een SBI. Dit is mede toe te schrijven aan de kinetiek van PCT en CRP. De piek in PCT release als reactie op een systemische infectie is na 12 tot 24 uur terwijl CRP en leukocyten na 48 tot 72 uur op de piekwaarde zit, waardoor de sensitiviteit van de markers sterk bepaald wordt door het tijdstip van afname van de test.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
In het geval van uitsluiten van een bacteriële infectie is een snelle terugrapportagetijd gewenst.
Kosten (middelenbeslag)
PCT is niet wijdverbreid in alle ziekenhuizen aanwezig vanwege de hogere kosten ten opzichte van CRP. Het gebruik van PCT boven CRP is afhankelijk van de lokale situatie.
Geen van de onderzochte biomarkers kan een sepsis volledig uitsluiten of aantonen. Tegen deze achtergrond is het de vraag of de iets hogere sensitiviteit van een PCT bepaling opweegt tegen de hogere kosten hiervan. Deze vraag kan niet beantwoord worden met de huidige informatie.
Aanvaardbaarheid, haalbaarheid en implementatie
Niet elk ziekenhuis beschikt over een PCT-test. De afgelopen jaren zijn naast de point-of-care testen voor CRP ook verschillende PCT-testen beschikbaar gekomen maar deze test is nog niet door veel laboratoria geïmplementeerd omdat de meerwaarde van deze test niet is aangetoond.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Een gemiste diagnose van een bacteriële infectie heeft ernstige gevolgen voor morbiditeit en mortaliteit door uitstel van de start van behandeling met antibiotica. Om die reden dient gestreefd te worden naar een test met een zo hoog mogelijke sensitiviteit.
Onderbouwing
Achtergrond
Point-of-care testen met biomarkers worden steeds vaker ingezet in de medische praktijk om op een gemakkelijke en snelle manier tot een diagnose te komen en er zijn steeds meer van deze testen beschikbaar. Voor de verdenking van een ernstige invasieve bacteriële infectie zoals sepsis zijn er point-of-care testen beschikbaar voor de biomarkers C-reactive protein (CRP), procalcitonine (PCT) en leukocyten aantal. Een accurate point-of-care test zou bevorderend kunnen zijn voor vroege herkenning van sepsis en daarmee een belangrijke aanvulling voor de huidige diagnostiek.
Conclusies / Summary of Findings
PCT
|
Laag GRADE |
De sensitiviteit voor het opsporen van ernstige bacteriële infecties (SBI) bij kinderen met koorts zonder focus middels procalcitonine (PCT) met een afkapwaarde van 0,5 ng/mL varieert in de verschillende studies tussen 38% en 93% en de specificiteit varieert tussen 62% en 96%.
Bronnen: (Trippelli, 2017; Yo, 2012; Jacobs, 2017; Hubert-Dinon, 2018) |
|
Redelijk GRADE |
De sensitiviteit voor het opsporen van invasieve bacteriële infecties (IBI) bij kinderen met koorts zonder focus middels procalcitonine (PCT) met een afkapwaarde van 0,5 ng/mLvarieert in de verschillende studies tussen 73% en 87% en de specificiteit varieert tussen 72% en 93%.
Bronnen: (Trippelli, 2017; Hubert-Dinon, 2018) |
CRP
|
Laag GRADE |
De sensitiviteit voor het opsporen van ernstige bacteriële infecties (SBI) bij kinderen met koorts zonder focus middels C-reactive protein (CRP) met een afkapwaarde van 40 mg/L varieert in de verschillende studies tussen 43% en 89%.
Bronnen: (Yo, 2012; Hubert-Dinon, 2018) |
|
Redelijk GRADE |
De specificiteit voor het opsporen van ernstige bacteriële infecties (SBI) bij kinderen met koorts zonder focus middels C-reactive protein (CRP) met een afkapwaarde van 40 mg/L varieert in de verschillende studies tussen 65% en 82%.
Bronnen: (Yo, 2012; Hubert-Dinon, 2018) |
WBC
|
Laag GRADE |
De sensitiviteit voor het opsporen van ernstige bacteriële infecties (SBI) bij kinderen met koorts zonder focus middels leukocyten getal (WBC) met een afkapwaarde van 15000/mm3 varieert in de verschillende studies tussen 50% en 68%.
Bronnen: (Yo, 2012) |
|
Redelijk GRADE |
De specificiteit voor het opsporen van ernstige bacteriële infecties (SBI) bij kinderen met koorts zonder focus middels leukocyten getal (WBC) met een afkapwaarde van 15000/mm3 varieert in de verschillende studies tussen 53% en 79%.
Bronnen: (Yo, 2012; Hubert-Dinon, 2018) |
Samenvatting literatuur
Beschrijving studies
Trippella (2017) verrichte een systematische review met meta-analyse naar de diagnostische waarde van procalcitonine (PCT) in het opsporen van ernstige bacteriële infecties (SBI) of invasieve bacteriële infecties (IBI) bij kinderen met koorts zonder focus. Door de auteurs werd in 2017 een literatuursearch verricht in Medline, en werd gezocht via PubMed tot 10 jaar terug (2007). Studies werden geïncludeerd als ze waren uitgevoerd bij kinderen ≤ 18 jaar met koorts zonder focus, er sprake was van een ziekenhuis of ambulante setting in westerse landen, serum concentraties van PCT werden verkregen als onderdeel van de eerste patiënt evaluatie en de resultaten kwantitatief werden gerapporteerd, als SBI en/of IBI werden onderzocht als uitkomstmaat. Studies met onvoldoende data over PCT diagnostische waarde (sensitiviteit en/of specificiteit) werden geëxcludeerd. SBI werd gedefinieerd als een breed spectrum van condities: onder andere bacteriële meningitis, sepsis, bacteriemie, urineweginfecties, pneumonie, bacteriële gastroenteritis, bot of zacht weefsel infecties. IBI werd gedefinieerd als een subgroep van de meest ernstige infecties: bacteriële meningitis, sepsis en bacteriemie. De QUADAS-2 tool werd gebruikt om de methodologische kwaliteit van de studies te beoordelen. Eén studie werd na beoordeling van de risk of bias geëxcludeerd (Freyne, 2013) vanwege hoog risico op bias op meer dan 2 domeinen. Twaalf studies werden geïncludeerd in de meta-analyse, met in totaal 7260 kinderen. Alle studies werden uitgevoerd op de spoedeisende hulp afdeling. De prevalentie van SBI/IBI varieerde tussen 1,0% en 45,9%. De meest gebruikte afkappunten voor PCT waren 0,5 ng/mL (9 studies) en 2 ng/mL (6 studies). Meta-analyses werden verricht waarbij gepoolde schattingen van sensitiviteit, specificiteit en diagnostische odds ratio voor PCT voor de afkapwaarden 0,5 en 2 ng/mL werden berekend.
Yo (2012) verrichtte een systematische review met meta-analyse naar de diagnostische waarden van PCT, C-reactive protein (CRP) en leukocyten getal in het opsporen van ernstige bacteriële infecties (SBI) bij kinderen die zich presenteren met koorts zonder focus op de spoedeisende hulp afdeling. In april 2011 werd gezocht in Medline, Embase en Cochrane databases. Studies werden geïncludeerd als ze waren uitgevoerd bij kinderen tussen 7 dagen en 36 maanden, wanneer procalcitonine alleen werd onderzocht of werd vergeleken met andere laboratorium markers om ernstige bacteriële infecties bij kinderen met koorts zonder focus te detecteren, en wanneer er voldoende data was om 2 x 2 tabellen te maken. De referentietest werd niet gedefinieerd in de review. De uitkomst SBI werd verschillend gedefinieerd in de geïncludeerde studies, bijvoorbeeld bacteriemie, pyelonefritis, lobaire pneumonie, meningitis osteoartritis (Lacour, 2001) of urineweginfectie, bacteriemie, cellulitis, sepsis, bacteriële gastroenteritis, pneumonie (Olaciregui, 2009). De kwaliteit van de geïncludeerde studies werd beoordeel met de QUADAS tool. Acht studies werden geïncludeerd in de meta-analyse met in totaal 1883 kinderen. Alle studies bevatten een analyse met PCT, 6 studies een analyse met CRP en 7 studies een analyse met leukocyten. De prevalentie van SBI varieerde tussen 3,2% en 29,2%. De meest gebruikte afkappunten waren 0,5 ng/mL voor PCT (5 van de 8 studies), 40 mg/L voor CRP (4 van de 6 studies) en 15.000 /mm3 voor leukocyten (6 van de 7 studies). Een bivariaat random-effect model voor diagnostische meta-analyses werd gebruikt om overall gewogen schattingen van de sensitiviteit en specificiteit te verkrijgen voor de markers voor SBI bij kinderen met koorts zonder focus. Daarbij werden de resultaten van alle afkappunten bij elkaar genomen, en werden subgroepanalyses gedaan voor de meest voorkomende afkappunten.
Jacobs (2017) verrichtte een retrospectieve cohortstudie naar de diagnostische waarde van PCT in het herkennen van SBI bij kinderen van 0 tot 18 jaar opgenomen op een PICU in Buffalo (USA) tussen 1 januari 2013 en 30 juni 2015. Patiënten waarbij een PCT-concentratie was gedocumenteerd in het patiëntendossier, voor welke reden dan ook, konden worden geïncludeerd. Patiënten werden geëxcludeerd als ze gedurende meer dan 48 uur antibiotica therapie hadden gehad op het moment dat de PCT-concentratie werd verkregen, of als kweken (bijvoorbeeld bloed, urine, sputum) niet binnen 24 uur na de PCT werden afgenomen, of als patiënten aan de ECMO (extracorporeal membrane oxygenation) lagen op het moment dat PCT werd afgenomen. De primaire vergelijking was de performance van PCT om patiënten met SBI te onderscheiden van patiënten zonder infectie. Voor de definitie van SBI werd verwezen naar de richtlijn van de ‘Centers for Disease Control and Prevention and the National Healthcare Safety Network’ (Horan, 2008). Echter, in deze publicatie is de definitie van SBI niet expliciet beschreven, waardoor onbekend is welke definitie door Jacobs werd aangehouden. De diagnostische waarde van PCT werd getest bij verschillende afkapwaarden (≥ 0,5; ≥ 1; ≥ 1,28 ≥ 1,5). In totaal werden 75 kinderen geïncludeerd, waarvan 28 (37%) met een SBI. De mediane leeftijd was 5 jaar (IQR 1,1 tot 14), 49% was jongen.
Hubert-Dinon (2018) verrichtte een prospectieve cohortstudie naar de diagnostische waarde van PCT en CRP in het herkennen van SBI bij kinderen van 6 dagen tot 5 jaar oud, opgenomen op een Franse pediatrische spoedeisende hulp afdeling tussen 1 januari tot en met 31 december 2016. Kinderen die zich presenteerden met koorts zonder focus ≥ 38° C thuis en/of op de spoedeisende hulp, konden worden geïncludeerd. SBI werd gedefinieerd als invasieve bacteriële infecties, urineweginfecties, bot en gewricht infecties, bacteriële gastro-enteritis, omphalitis en cellulitis met negatieve kweken. In totaal werden 1060 kinderen geïncludeerd, waarvan 127 (11,2%) werden gediagnosticeerd met een SBI en 11 (1,0%) met een IBI. De mediane leeftijd was 17 maanden (IQR 6,6 tot 24,3), 52% was jongen.
Resultaten
1. Procalcitonine
1.1 Ernstige bacteriële infectie (SBI)
1.1.1 Diagnostische waarde: sensitiviteit en specificiteit
De gepoolde sensitiviteit in de review van Tripella in 7 studies met in totaal 5357 kinderen (Milcent, 2016; Markic, 2015; Nijman, 2014; Mahajan, 2014; Gomez, 2012; Olaciregui, 2009; Andreola, 2007)) voor het opsporen van SBI bij een afkappunt voor PCT van 0,5 ng/mL was 55% (95% BI 52 tot 58) en de gepoolde specificiteit was 85% (95% BI 84 tot 86).
Yo (2012) verrichtte een subgroepanalyse met de studies met een afkappunt voor PCT van 0,5 ng/mL. De gepoolde sensitiviteit in 5 studies met in totaal 1310 kinderen (Galetto-Lacour, 2003; Thayyil, 2005; Andreola, 2007; Olaciregui, 2009; Manzano, 2010) voor het opsporen van SBI bij een afkappunt voor PCT van 0,5 ng/mL was 78% (95% BI 68 tot 85) en de gepoolde specificiteit was 72% (95% BI 59 tot 82).
In de studie van Jacobs (2017) was de sensitiviteit voor het opsporen van SBI bij 75 kinderen bij een afkappunt voor PCT van 0,5 ng/mL 86% (95% BI 57 tot 96) en de specificiteit 62% (95% BI 46 tot 76).
In de studie van Hubert-Dinon (2018) was de sensitiviteit voor het opsporen van SBI bij 1060 kinderen bij een afkappunt voor PCT van 0,5 ng/mL 46% (95% BI 37 tot 56) en de specificiteit 75% (95% CI 71 tot 78). In figuur 1 zijn de sensitiviteit en specificiteit van de geïncludeerde studies in de systematische review van Yo (2012) en de studies van Jacobs (2017) en Hubert-Dinon (2018) toegevoegd aan de sensitiviteit en specificiteit van de studies geïncludeerd in de systematische review van Trippella.
Figuur 1 Sensitiviteit en specificiteit van procalcitonine bij een afkapwaarde van 0,5 ng/mL voor opsporen SBI (Trippella, 2017; Yo, 2012; Jacobs, 2017; Hubert-Dinon, 2018).
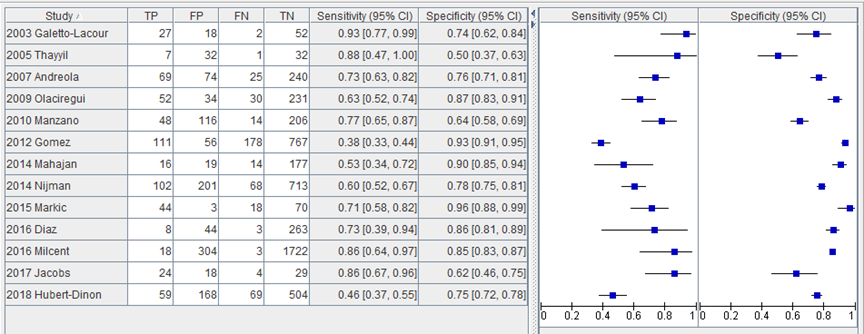
De gepoolde sensitiviteit in de review van Tripella (2017) in 4 studies met in totaal 4651 kinderen (Milcent, 2016; Nijman, 2014; Gomez, 2012; Olaciregui, 2009) voor het opsporen van SBI bij een afkappunt voor PCT van 2 ng/mL was 30% (95% BI 27 tot 34) en de gepoolde specificiteit was 95% (95% BI 94 tot 95).
1.2 Invasieve bacteriële infectie (IBI)
1.2.1 Diagnostische waarde: sensitiviteit en specificiteit
Trippella (2017) verrichtte aparte meta-analyses naar de diagnostische waarde van PCT in de diagnose van IBI en SBI. De gepoolde sensitiviteit in 5 studies met in totaal 4692 kinderen (Diaz, 2016; Milcent, 2016; Gomez, 2012; Luaces-Dubells, 2012; Olaciregui, 2009) voor het opsporen van IBI bij een afkappunt voor PCT van 0,5 ng/mL was 82% (95% BI 73 tot 90) en de gepoolde specificiteit was 86% (95% BI 85 tot 87). De gepoolde sensitiviteit in 4 studies met in totaal 4345 kinderen (Diaz, 2016; Milcent, 2016; Gomez, 2012; Luaces-Dubells, 2012) voor het opsporen van IBI bij een afkappunt voor PCT van 2 ng/mL was 61% (95% BI 49 tot 73) en de gepoolde specificiteit 94% (95% BI 93 tot 95).
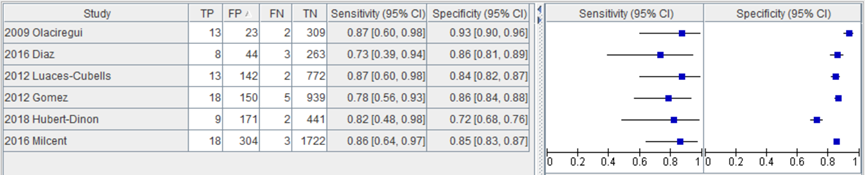
In de studie van Hubert-Dinon (2018) was de sensitiviteit voor het opsporen van IBI bij 1060 kinderen bij een afkappunt voor PCT van 0,5 ng/mL 82% (95% BI 48 tot 97) en de specificiteit 72% (95% BI 68 tot 75). In figuur 2 zijn de sensitiviteit en specificiteit van de studie van Hubert-Dinon toegevoegd aan de sensitiviteit en specificiteit van de studies geïncludeerd in de systematische review van Trippella.
Figuur 2 Sensitiviteit en specificiteit van procalcitonine bij een afkapwaarde van 0,5 ng/mL voor opsporen IBI (Trippella, 2017; Hubert-Dinon, 2018).
2. C-reactive protein (CRP)
2.1 Ernstige bacteriële infectie (SBI)
2.1.1 Diagnostische waarde: sensitiviteit en specificiteit
Yo (2012) verrichtte een subgroepanalyse met de studies met een afkappunt voor CRP van 40 ng/mL. De gepoolde sensitiviteit in 4 studies met in totaal 846 kinderen (Lacour, 2001; Galetto-Lacour, 2003; Andreola, 2007; Guen, 2007) voor het opsporen van SBI bij een afkappunt voor CRP van 40 mg/L was 74% (95% BI 58 tot 85). De sensitiviteit van de individuele studies was respectievelijk 89%, 79%, 71% en 43%. De gepoolde specificiteit was 76% (95% BI 68 tot 82). De specificiteit van de individuele studies was respectievelijk 75%, 79%, 81% en 65%.
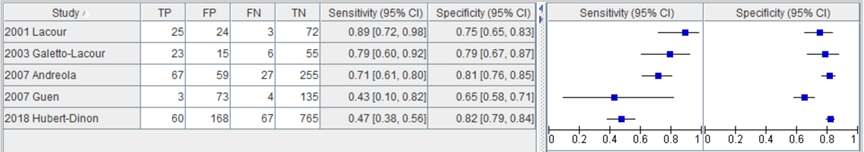
In de studie van Hubert-Dinon (2018) was de sensitiviteit voor het opsporen van SBI bij 1060 kinderen bij een afkappunt voor CRP van 40 mg/L 47% (95% BI 37 tot 57) en de specificiteit 82% (95% BI 77 tot 85). In figuur 3 zijn de sensitiviteit en specificiteit van de studie van Hubert-Dinon toegevoegd aan de sensitiviteit en specificiteit van de studies geïncludeerd in de systematische review van Yo (2012).
Figuur 3 Sensitiviteit en specificiteit van C-reactive protein bij een afkapwaarde van 40 mg/L voor opsporen SBI (Yo, 2012; Hubert-Dinon, 2018).
3. Leukocyten getal (WBC)
3.1 Ernstige bacteriële infectie (SBI)
3.1.1 Diagnostische waarde: sensitiviteit en specificiteit
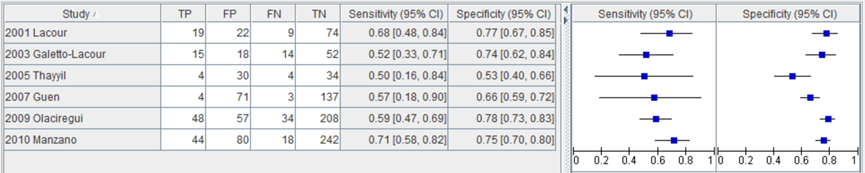
Yo (2012) verrichtte een subgroepanalyse met de studies met een afkappunt voor WBC van 15000/mm3. De gepoolde sensitiviteit in 6 studies met in totaal 1241 kinderen (Lacour, 2001; Galetto-Lacour, 2003; Thayyil, 2005; Guen, 2007; Olaciregui, 2009; Manzano, 2010) voor het opsporen van SBI bij een afkappunt voor WBC van 15000/mm was 61% (95% BI 52 tot 70). De sensitiviteit van de individuele studies was respectievelijk 68%, 52%, 50%, 63%, 59% en 71%. De gepoolde specificiteit was 72% (95% BI 65 tot 77). De specificiteit van de individuele studies was respectievelijk 77%, 74%, 53%, 66%, 79% en 75% (figuur 4).
Figuur 4 Sensitiviteit en specificiteit van leukocyten getal bij een afkapwaarde van 15000/mm3 voor opsporen SBI (Yo, 2012).
Bewijskracht van de literatuur
De bewijskracht van vergelijkend onderzoek naar diagnostische waarde start hoog.
Sensitiviteit
De bewijskracht voor de uitkomstmaat sensitiviteit bij SBI voor PCT, CRP en WBC is met 2 niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (risk of bias omdat het onduidelijk is of resultaten van referentiestandaard onafhankelijk van de resultaten van index test zijn beoordeeld) en tegenstrijdige resultaten (inconsistentie). De bewijskracht komt daarmee uit op een GRADE ‘laag’.
De bewijskracht voor de uitkomstmaat sensitiviteit bij IBI voor PCT is met 1 niveau verlaagd naar redelijk gezien beperkingen in de onderzoeksopzet (risk of bias omdat het onduidelijk is of resultaten van referentiestandaard onafhankelijk van de resultaten van index test zijn beoordeeld). De bewijskracht komt daarmee uit op een GRADE ‘redelijk.
Specificiteit
De bewijskracht voor de uitkomstmaat specificiteit bij SBI voor PCT is met 2 niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (risk of bias omdat het onduidelijk is of resultaten van referentiestandaard onafhankelijk van de resultaten van index test zijn beoordeeld) en tegenstrijdige resultaten (inconsistentie). De bewijskracht komt daarmee uit op een GRADE ‘laag’.
De bewijskracht voor de uitkomstmaat specificiteit bij SBI voor CRP en WBC is met 1 niveau verlaagd naar laag gezien beperkingen in de onderzoeksopzet (risk of bias omdat het onduidelijk is of resultaten van referentiestandaard onafhankelijk van de resultaten van index test zijn beoordeeld). De bewijskracht komt daarmee uit op een GRADE ‘redelijk’.
De bewijskracht voor de uitkomstmaat specificiteit bij IBI voor PCT is met 1 niveaus verlaagd naar redelijk gezien beperkingen in de onderzoeksopzet (risk of bias omdat het onduidelijk is of resultaten van referentiestandaard onafhankelijk van de resultaten van index test zijn beoordeeld). De bewijskracht komt daarmee uit op een GRADE ‘redelijk’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de diagnostische accuratesse van point-of-care testen voor de biomarkers procalcitonine, C-reactive protein, leucocyten getal, vergeleken met positieve bloedkweken, bij kinderen met een verdenking op sepsis?
P: kinderen (leeftijd> 1 maand) met verdenking op sepsis;
I: point of care testen: procalcitonine, c-reactive protein, leukocyten getal;
C: vergelijkende testen: procalcitonine, c-reactive protein, leukocyten getal;
R: positieve bloedkweek;
O: diagnostische accuratesse (sensitiviteit (zo weinig mogelijk vals negatieven)/specificiteit);
Timing/setting: bij opname in het ziekenhuis.
Relevante uitkomstmaten
De werkgroep achtte sensitiviteit van de point-of-care test een voor de besluitvorming cruciale uitkomstmaat omdat een gemiste diagnose ernstige gevolgen kan hebben met betrekking tot morbiditeit en mortaliteit door uitstel van start met antibiotica; en specificiteit een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 29 juli 2019 met relevante zoektermen gezocht vanaf het jaar 2000 naar studies die de diagnostische waarde van de biomarkers PCT, CRP of leukocyten beschrijven in kinderen met verdenking op sepsis. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 495 treffers op. Hierbij werden vrijwel geen studies gevonden over point-of-care testen die van toepassing waren op de uitgangsvraag. Een studie onderzocht PCT als point-of-care test, maar dat betrof kinderen onder de 3 maanden waaronder ook neonaten, zonder deze groepen verder uit te splitsen (Waterfield, 2018). Een andere studie vergeleek point-of-care CRP en leukocyten testen met routine bepalingen bij kinderen met koorts op de spoedeisende hulp, maar rapporteerde niet sensitiviteit en specificiteit voor de diagnose van sepsis (Ivaska, 2015).
In aanvulling op de uitgangsvraag, die gezien bovenstaande niet kon worden beantwoord, is vervolgens nog wel gekeken naar studies die de diagnostische waarde van routinematige PCT, CRP en leukocyten bepalingen beschrijven bij kinderen opgenomen met koorts zonder focus, ernstige bacteriële infecties (SBI) en invasieve bacteriële infecties (IBI). Op basis van titel en abstract werden in eerste instantie 73 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 69 studies geëxcludeerd, waaronder studies die uitsluitend meningitis behandelen (zie exclusietabel onder het tabblad Verantwoording). Uiteindelijk werden vier studies definitief geselecteerd.
Resultaten
Vier publicaties zijn opgenomen in de literatuuranalyse, waarvan 2 systematische reviews en 2 cohortstudies gepubliceerd na de zoekdatum van deze reviews. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Horan, T. C., Andrus, M., & Dudeck, M. A. (2008). CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. American journal of infection control, 36(5), 309-332.
- Hubert‐Dibon, G., Danjou, L., Feildel‐Fournial, C., Vrignaud, B., Masson, D., Launay, E., & Gras‐Le Guen, C. (2018). Procalcitonin and C‐reactive protein may help to detect invasive bacterial infections in children who have fever without source. Acta Paediatrica, 107(7), 1262-1269.
- Ivaska, L., Niemelä, J., Leino, P., Mertsola, J., & Peltola, V. (2015). Accuracy and feasibility of point-of-care white blood cell count and C-reactive protein measurements at the pediatric emergency department. PLoS One, 10(6), e0129920.
- Jacobs, D. M., Holsen, M., Chen, S., Fusco, N. M., & Hassinger, A. B. (2017). Procalcitonin to detect bacterial infections in critically ill pediatric patients. Clinical pediatrics, 56(9), 821-827.
- Trippella, G., Galli, L., De Martino, M., Lisi, C., & Chiappini, E. (2017). Procalcitonin performance in detecting serious and invasive bacterial infections in children with fever without apparent source: a systematic review and meta-analysis. Expert review of anti-infective therapy, 15(11), 1041-1057.
- Yo, C. H., Hsieh, P. S., Lee, S. H., Wu, J. Y., Chang, S. S., Tasi, K. C., & Lee, C. C. (2012). Comparison of the test characteristics of procalcitonin to C-reactive protein and leukocytosis for the detection of serious bacterial infections in children presenting with fever without source: a systematic review and meta-analysis. Annals of emergency medicine, 60(5), 591-600.
- Waterfield, T., Maney, J. A., Hanna, M., Fairley, D., & Shields, M. D. (2018). Point-of-care testing for procalcitonin in identifying bacterial infections in young infants: a diagnostic accuracy study. BMC pediatrics, 18(1), 1-6.
Evidence tabellen
Evidence table for systematic reviews of diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Tripella, 2017
|
SR and meta-analysis
Literature search up to July 2017
A: Diaz, 2016 B: Milcent, 2016 C: Markic, 2015 D: Nijman, 2014 E: Mahajan, 2014 F: Gomez, 2012 G: Woelker, 2012 H: Luaces-Cubells, 2012 I: Manzano, 2011 J: Olaciregui, 2009 K: Maniaci, 2008 L: Andreola, 2007
Study design: A, C, F, J: retrospective cohort B, D, E, G, H, I: prospective cohort
Setting and Country: A: PED, Spain B: PED, France C: PED, Croatia D: PED, Netherlands E: Eds, USA F: PED, 5 Spanish and 2 Italian G: PED, USA H: PED, Spain I: PED, Canada J: ED, Spain K: PED, USA L: PED, Italy
Source of funding and conflicts of interest: No funding and no conflicts of interests reported
|
Inclusion criteria SR: children ≤18 years with FWAS, evaluated in hospital or ambulatory settings in Western countries; serum concentrations of PCT were obtained as part of the first patient evaluation and the results reported quantitatively; and SBI and/or IBI were considered.
Exclusion criteria SR: studies enrolling patient with comorbidities (e.g. immune deficiency, major congenital malformation, chronic disease, neoplasia); studies conducted on adult populations (>18 years); studies not conducted in Western countries; reviews, case reports, comments; and studies with insufficient data about PCT diagnostic performance (sensitivity and/or specificity).
12 studies included in meta-analysis
Important patient characteristics: N, mean age A: 318 patients, <60 days B: 2047 patients, 7-91 days C: 135 patients, <6 months D: 1084 patients, 1 month to 16 yrs E: 226 patients, <36 months F: 1112 patients, <3 months G: 155 patients, 2-60 days H: 868 patients, 1-36 months I: 328 patients, 1-36 months J: 347patients, <3 months K: 234 patients, <90 days L: 408 patients, 7 days to 36 months
Sex not reported
|
A: PCT; cut-off 0.5 and 2 ng/mL B: PCT; cut-off 0.3, 0.5 and 2 ng/mL C: PCT; cut-off 0.5 ng/mL D: PCT; cut-off 0.5 and 2 ng/mL E: PCT; cut-off 0.5 and 0.6 ng/mL F: PCT; cut-off 0.5 and 2 ng/mL G: PCT; cut-off 0.2, 0,.26 and 0.3 ng/mL H: PCT; cut-off 0.5, 0.9, 1 and 2 ng/mL I: PCT; cut-off 0.2 ng/mL J: PCT; cut-off 0.5 ng/mL K: PCT; cut-off 0.12 ng/mL L: PCT; cut-off 0.5, 1 and 2 ng/mL
|
A: Blood culture, CSF culture B: Blood culture, CSF culture, urine culture, stool culture C: Blood culture, CSF culture, urine culture, stool culture, chest X-ray consistent with pneumonia, appropriate physical examination D: Bacterial cultures from otherwise sterile sites, chest X-ray consistent with pneumonia, clinical consensus diagnoses by the investigators E: Blood culture, CSF culture, urine culture, chest X-ray consistent with pneumonia F: Blood culture, CSF culture, urine culture, stool culture G: Blood culture, CSF culture, urine culture, stool culture H: Blood culture, CSF culture I: Blood culture, CSF culture, urine culture, chest X-ray consistent with pneumonia, bone scintigraphy, synovial fluid culture J: Blood culture, CSF culture, urine culture, stool culture, chest X-ray consistent with pneumonia, appropriate physical examination K: Blood culture, CSF culture, urine culture, chest X-ray consistent with pneumonia, pleural fluid culture, sputum culture result with a respiratory pathogen, stool culture L: Blood culture, CSF culture, urine culture, chest X-ray consistent with pneumonia, synovial fluid culture
Prevalence (%) IBI A: 3.5% B: 1.0% F: 2.1% H: 1.7% J: 4.3%
SBI B: 6.8% C: 45.9% D: 14.7% E: 13.3% F: 26.0% G: 8.4% I: 16.5% J: 23.6% K: 12.8% L: 22.7%
For how many participants were no complete outcome data available? Not reported
|
Endpoint of follow-up: not reported
|
IBI sensitivity / specificity (%) PCT cut-off 0.5 ng/mL A: 73 / 86 B: 86 / 85 F: 78 / 86 H: 87 / 83 J: 87 / 93
Pooled sensitivity (random-effects model): 82 (95% CI 73 to 90) I2: 0.0%
Pooled specificity (random-effects model): 86 (95% CI 85 to 87) I2: 82.1%
PCT cut-off 2.0 ng/mL A: 45 / 94 B: 62 / 94 F: 70 / 94 H: 60 / 95
Pooled sensitivity (random-effects model): 61 (95% CI 49 to 73) I2: 0.0%
Pooled specificity (random-effects model): 94 (95% CI 93 to 95) I2: 0.0%
SBI sensitivity / specificity (%) PCT cut-off 0.5 ng/mL B: 60 / 85 C: 71 / 96 D: 60 / 78 E: 53 / 90 F: 38 / 93 J: 63 / 87 L: 73 / 76
Pooled sensitivity (random-effects model): 55 (95% CI 52 to 58) I2: 89.6%
Pooled specificity (random-effects model): 85 (95% CI 84 to 86) I2: 94.8%
PCT cut-off 2.0 ng/mL B: 36 / 94 D: 33 / 94 F: 20 / 97 L: 48 / 96
Pooled sensitivity (random-effects model): 30 (95% CI 27 to 34) I2: 89.9%
Pooled specificity (random-effects model): 95 (95% CI 94 to 95) I2: 82.2% |
IBI = invasive bacterial infection SBI = serious bacterial infection
Study quality (ROB): Reference standard labeled as high risk for 6 studies (C, D, E, I, J, L) because the reference standard for the diagnosis of SBI or IBI was not a culture exam on biological samples. Flow and timing was labelled as high risk for 6 studies (B, D, E, H, J) because the reference standard was not applied to all patients (i.e. blood cultures were not performed in the entire study population).
Place of the index test in the clinical pathway: triage
Choice of cut-off point: different cut-off points used in included studies. These are separately reported and pooled.
Brief description of author’s conclusion: PCT level determination could be helpful in detecting meningitis, bacteremia and sepsis in children with FWAS.
Sensitivity analysis for studies including only children < 3 months (A, B, F, J) IBI Cut-off 0.5 ng/mL Pooled sensitivity (random-effects model): 81 (95% CI 70 to 90)
Pooled specificity (random-effects model): 86 (95% CI 85 to 87)
Cut-off 2.0 ng/mL Pooled sensitivity (random-effects model): 62 (95% CI 48 to 75)
Pooled specificity (random-effects model): 94 (95% CI 93 to 95)
SBI Cut-off 0.5 ng/mL Pooled sensitivity (random-effects model): 48 (95% CI 44 to 53)
Pooled specificity (random-effects model): 87 (95% CI 86 to 89)
Cut-off 2.0 ng/mL Pooled sensitivity (random-effects model): 25 (95% CI 21 to 30)
Pooled specificity (random-effects model): 95 (95% CI 94 to 96)
Heterogeneity: none of the above covariates included in the meta-regression were found to be significant sources of heterogeneity. Leaving study J out reduces heterogeneity, particularly the I2 decreases from 82.1% to 5.7% for PCT specificity at a threshold of 0.5 in detecting IBI. |
|
Yo, 2012
|
SR and meta-analysis
Literature search up to April 2011
A: Lacour, 2001 B: Galetto-Lacour, 2003 C: Thayyil, 2005 D: Andreola, 2007 E: Guen, 2007 F: Maniaci, 2008 G: Olaciregui, 2009 H: Manzano, 2010
Study design: A - GJ: prospective cohort H: RCT
Setting and Country: A: ED, Switzerland B: ED, Switzerland C: Pediatric unit, England D: ED, Italy E: Pediatric unit, France F: ED, USA G: ED, Spain H: ED, Canada
Source of funding and conflicts of interest: non-commercial funding/ no conflicts of interest reported
|
Inclusion criteria SR: (1) age range between 7 days and 36 months; (2) evaluation of procalcitonin alone or compared with other laboratory markers, such as C-reactive protein or leukocyte count, to detect severe bacterial infection in children with fever without source; and (3) sufficient data to construct a 2x2 contingency table
Exclusion criteria SR: studies having significant overlap (> 50%) of study patients with the selected studies
8 studies included
Important patient characteristics: Number of patients; characteristics important to the research question; for example, age, sex, bmi, ...
N, mean age A: 124 patients, 7 days to 36 months B: 99 patients, 7 days to 36 months C: 72 patients, 7 days to 36 months D: 408 patients, 7 days to 36 months E: 215 patients, 7 days to 36 months F: 234 patients, <3 months G: 347 patients, <3 months H: 384 patients, 1 to 36 months
Sex not reported |
Describe index test and cut-off point(s): : PCT; cut-off 0.5 and 2 ng/mL A-1: PCT; cut-off 0.9 A-2: CRP, cut-off 40 A-3: WBC, cut-off 15.000 B-1: PCT; cut-off 0.5 B-2: CRP, cut-off 40 B-3: WBC, cut-off 15.000 C-1: PCT; cut-off 0.5 C-2: CRP, cut-off 50 C-3: WBC, cut-off 15.000 D-1: PCT; cut-off 0.5 D-2: CRP, cut-off 40 D-3: WBC, cut-off 10.000 E-1: PCT; cut-off 2.0 E-2: CRP, cut-off 40 and 80 E-3: WBC, cut-off 15.000 F-1: PCT; cut-off 0.12 F-2: WBC, NA G-1: PCT; cut-off 0.5 G-2: CRP, cut-off 30 G-3: WBC, cut-off 15.000 H-1: PCT; cut-off 0.5 H-2: WBC, cut-off 15.000 |
Reference tests not described
Prevalence (%) (based on refence test at specified cut-off point) SBI A: 22.5% B: 29.2% C: 11.1% D: 23.1% E: 3.2% F: 12.8% G: 23.6% H: 16.1%.
For how many participants were no complete outcome data available? Not reported
|
Endpoint of follow-up: not reported |
SBI sensitivity / specificity (%) PCT cut-off 0.5 ng/mL B: 93.1 / 74.3 C: 87.5 / 50 D: 73.4 / 76.4 G: 63.4 / 87.2 H: 77.4 / 64.0
Pooled sensitivity (random-effects model): 78 (95% CI 68 to 85) I2: 30.9%
Pooled specificity (random-effects model): 72 (95% CI 59 to 82) I2: 30.9%
PCT cut-off 0.12 ng/mL F: 96.7 / 25.5
PCT cut-off 0.9 ng/mL A: 92.9 / 78.1
PCT cut-off 2.0 E: 57.1 / 84.6
CRP cut-off 40 mg/L A: 89.3 / 75.0 B: 79.3 / 78.6 D: 71.3 / 81.2 E: 42.9 / 64.9
Pooled sensitivity (random-effects model): 74 (95% CI 58 to 85) I2: 66%
Pooled specificity (random-effects model): 76 (95% CI 68 to 82) I2: 66%
CRP cut-off 30 mg/L F: 63.4 / 84.2
CRP cut-off 50 mg/L C: 75.0 / 68.8
WBC cut-off 15.000 /mm A: 67.9 / 77.1 B: 51.7 / 74.3 C: 50.0 / 53.1 E: 62.5 / 65.9 G: 58.5 / 78.6 H: 71.0 / 75.1
Pooled sensitivity (random-effects model): 61 (95% CI 52 to 70) I2: 33.5%
Pooled specificity (random-effects model): 72 (95% CI 65 to 77) I2: 33.5%
WBC cut-off 10.000 /mm D: 50.0 / 75.4 |
Study quality (ROB): Among the possible sources of bias, about 80% of the studies did not indicate whether physicians were blinded to the index tests when making a final diagnosis of severe bacterial infection. Several studies did not explicitly explain withdrawals, define an acceptable delay between tests, or report uninterpretable results. A small proportion of studies did not adequately describe reference standards or reference tests.
Place of the index test in the clinical pathway: triage
Choice of cut-off point: sensitivity analyses were performed for only 1 cutoff point for each index test. Diagnostic accuracy data of individual studies only reported in supplementary data.
Brief description of author’s conclusion: Procalcitonin performs better than leukocyte count and C-reactive protein for detecting serious bacterial infection among children with fever without source.
|
*comparator test equals the C of the PICO; two or more index/ comparator tests may be compared; note that a comparator test is not the same as a reference test (golden standard)
Evidence table for diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Jacobs, 2017 |
Type of study[1]: retrospective cohort study
Setting and country: PICU, USA
Funding and conflicts of interest: non-commercial funding, no conflicts of interest reported |
Inclusion criteria: <18 yrs, admitted to PICU with a PCT level documented in EMR during the study time period for any reason.
Exclusion criteria: had received antibiotic therapy for over 48 hours at the time the PCT level was obtained; if cultures were not obtained within 24 hours of PCT ordering, or if patients were on extracorporeal membrane oxygenation (ECMO)
N=75
Prevalence SBI: 37%
Median age (IQR): 5 (1.1 to 14) yrs
Sex: 49% M / 51% F |
Describe index test: Procalcitonin (PCT)
Cut-off point(s): (≥0.5; ≥1; ≥1.28 ≥1.5
Comparator test[2]: WBC
Cut-off point(s): not reported
|
Describe reference test[3]: not reported
Cut-off point(s):
|
Time between the index test en reference test: not reported
For how many participants were no complete outcome data available? 0
|
SBI sensitivity / specificity (95% CI) PCT cut-off 0.5 ng/mL Sens: 85.7 (67.3 to 95.9) Spec: 61.7 (46.4 to 75.5)
PCT cut-off 1.0 ng/mL Sens: 82.1 (63.1 to 93.9) Spec: 74.5 (59.7 to 86.1)
PCT cut-off 1.28 ng/mL Sens: 82.1 (63.1 to 93.9) Spec: 85.1 (71.6 to 93.8)
PCT cut-off 1.5 ng/mL Sens: 78.6 (59.0 to 91.7) Spec: 85.1 (71.7 to 93.8) |
PCT = procalcitonin SBI = serious bacterial infection |
|
Hubert-Dinon, 2018 |
Type of study: prospective cohort study
Setting and country: paediatric emergency department, France
Funding and conflicts of interest: non-commercial funding, no conflicts of interests reported |
Inclusion criteria: >6 days and <5 years of age, presenting with a FWS ≥38°C at home and/or at the PED, measured in a suitable way with axillary or rectal temperature.
Exclusion criteria: fever was not measured or was below 38°C in the PED or at home, the medical history performed on arrival in the PED, or the physical examination, allowed the origin of the fever to be identified or the parents refused to participate
N= 1060
Prevalence SBI: 11%
Median age (IQR): 17 (6.6 to 24.3) months
Sex: 52% M / 48% F |
Describe index test: PCT
Cut-off points: Optimum cut-offs calculated (0.3; 0.5; 1 ng/mL)
Comparator test: CRP
Cut-off points: Optimum cut-offs calculated (20; 40 mg/L)
|
Describe reference test: bacterial culture
Cut-off point(s): not reported
|
Time between the index test en reference test:
For how many participants were no complete outcome data available? 592 (56%)
Reasons for incomplete outcome data described? Children not reached by telephone |
SBI sensitivity / specificity (95% CI) PCT cut-off 0.5 ng/mL Sens: 46 (37 to 56) Spec: 75 (71 to 78)
PCT cut-off 1.0 ng/mL Sens: 32 (24 to 42) Spec: 83 (80 to 86)
CRP cut-off 20 mg/L Sens: 62 (52 to 71) Spec: 66 (62 to 70)
CRP cut-off 40 mg/L Sens: 47 (37 to 57) Spec: 82 (79 to 85)
IBI sensitivity / specificity (95% CI) PCT cut-off 0.5 ng/mL Sens: 82 (48 to 97) Spec: 72 (68 to 75)
PCT cut-off 1.0 ng/mL Sens: 82 (48 to 97) Spec: 82 (79 to 85)
CRP cut-off 20 mg/L Sens: 64 (32 to 88) Spec: 62 (58 to 65)
CRP cut-off 40 mg/L Sens: 64 (32 to 88) Spec: 78 (75 to 81) |
|
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Tripella, 2014 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
No, not for included studies |
|
Yo, 2012 |
Yes |
Yes |
No |
Yes |
Yes |
Yes |
Yes |
No, not for included studies |
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined.
- Search period and strategy should be described; at least Medline searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to the research question (PICO) should be reported.
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis.
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Jacobs, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
|
Hubert-Dinon, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Unclear
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Onyenekwu 2017 |
Protocol for Cochrane review |
|
Henry 2016 |
wrong comparison: PCT for differentiating between bacterial and viral etiologies in children with suspected meningitis |
|
Gilsdorf 2012 |
Commentary article |
|
Sanders 2008 |
wrong comparison: CRP to differentiate serious bacterial infection from self-limiting bacterial or nonbacterial infection or bacterial from viral infection |
|
Dubos 2008 |
wrong comparison: PCT for early discrimination between bacterial and aseptic meningitis |
|
Al-Majali 2004 |
wrong comparison: white blood cell count and absolute neutrophil count |
|
Kim 2019 |
wrong comparison and study design: CRP, WBC and ANC. Associations calculated |
|
Ogawa 2019 |
wrong study design: mean levels of CRP calculated, but no diagnostic accuracy study |
|
Sharma 2018 |
letter to the editor |
|
Nadeem 2018 |
wrong population (children with meningitis) and study design: mean levels of CRP compared between bacterial and aseptic mengititis groups |
|
Loganathan 2018 |
wrong comparison: differentiation between bacterial infection and noninfectious inflammation |
|
Shokrollahi 2018 |
wrong population: children with systemic autoimmune disease. Differentiation PCT between bacterial infection and noninfectious inflammation |
|
Sahoo 2018 |
wrong study design: optimum cutoff value for CRP, WBC and ANC calculated based on AUC |
|
Paydar-Darian 2018 |
wrong study design: mean levels of CRP calculated, but no diagnostic accuracy study |
|
Leroy 2018 |
wrong study design: development and external validation of risk score for serious bacterial infection |
|
Chaudhary 2018 |
wrong population: children with meningitis |
|
Nijman 2018 |
wrong study design: validation study of prediction model |
|
El shorbagy 2018 |
wrong population: children with acute meningitis |
|
Sanaei Dashti 2017 |
wrong population: children with suspected meningitis |
|
Shokrollahi 2016 |
wrong population: children with suspected meningitis |
|
Mandell 2016 |
wrong outcome: no sensitivity or specificity reported |
|
Asadi 2016 |
wrong study design: comparing PCT, CRP and ESR levels in children with sepsis. No diagnostic accuracy study |
|
Nellis 2016 |
wrong population: children with abnormal temperature |
|
Matha 2016 |
wrong comparison: establish predictive thresholds for bacteraemia and to determine distinguishment of PCT of bacterial from viral infection |
|
Lautz 2016 |
wrong comparison: peak blood PCT <48h of PICU admission to differentiate severe bacterial infetions from severe viral illness and systemic sterile inflammation |
|
Bal 2015 |
wrong comparison: eosinophil to differentiate bacterial and viral infection |
|
Soares Lanziotti 2015 |
wrong study design: patterns of CRP respons to antibiotic therapy, no diagnostic accuracy |
|
De 2015 |
wrong outcome: UTI, pneumonia, bacteraemia and other serious bacterial infection |
|
Kaya 2014. |
wrong population (children with fever) and wrong outcome (bacterial infection) |
|
De 2014 |
republised in 2015 |
|
Umran 2014 |
wrong population: patients with |
|
Segal 2014 |
wrong comparison: optimal cutoff for CRP at different time points from fever onset; wrong population: children presented with fever on ED |
|
Nijman 2014 |
included in Tripella, 2017 |
|
Mahajan 2014 |
included in Tripella, 2017 |
|
Mathew 2013 |
wrong study desing: no diagnostic accuray data reported (only mean levels of PCT) |
|
Gupta 2013 |
|
|
Prasad 2013 |
wrong population: children with diagnosed meningitis |
|
Alnader 2012 |
wrong outcome: no diagnostic accuracy data |
|
Luaces-Cubells 2012 |
included in Tripella, 2017 |
|
Diez-Padrisa 2012 |
wrong population: children with clinical severe pneumonia and no malaria parasites |
|
Bressan 2012 |
Lab score (combination PCT, CRP and urine dipstick). PCT data not available |
|
Rustici 2011 |
wrong comparison: PCT, CRP, WBC, ANC to differentiate bacterial from viral infection |
|
Ibrahim 2011 |
wrong outcome: bacterial meningitis |
|
Manzano 2011 |
included in Tripella, 2017 |
|
Galetto-Lacour 2010 |
Non systematic review |
|
Fioretto 2010 |
wrong study design: comparing PCT and CRP values for children with sepsis or septic shock. No diagnostic accuracy |
|
Krysan 2009 |
wrong outcome: |
|
Carrol 2009 |
wrong population: children identified as possible cases of pneumonia or meningitis |
|
Bilavsky 2009 |
wrong outcome: serious bacterial infection: UTI (N=84), bacteremia (N=6), pneumonia (N=11) and meningitis (M=1) |
|
Shaoul 2008 |
wrong outcome: diagnostic accuracy to differentiate between true bacteremia versus contaminated and contaminated plus negative cultures |
|
Simon 2008 |
wrong outcome: diagnostic accuracy to differentiate between bacterial from nonbacterial SIRS |
|
Fioretto 2008 |
wrong study design: describing PCT and IL-6 values of children wiht clinical diagnose of sepsis or septic shock |
|
Guen 2007 |
Included in Yo 2012 |
|
Pratt 2007 |
wrong comparison: duration of fever <12h and >12h when presenting |
|
Kyr 2007 |
wrong outcome: effect of septic condition on course of CRP levels over time |
|
Fioretto 2007 |
Article in Spanish |
|
Andreola 2007 |
Included in Yo 2012 |
|
Dubos 2007 |
wrong comparison: PCT, WBC and CSF to distinguish between baceterial and aseptic meningitis |
|
Arkader 2007 |
wrong comparison: discrimination between sepsis and systemic inflammatory response syndrome. |
|
Thayyil 2005 |
Included in Yo 2012 |
|
Prasad 2005 |
wrong population (children with meningitis) |
|
Casado-Flores 2003 |
wrong study design: CRP levels over time in children with spesis, no diagnostic accuracy |
|
Han 2003 |
wrong study design: CRP and neutrophil count levels, no diagnostic accuracy |
|
Fernandez Lopez 2003 |
wrong comparison: CRP and PCT for discrimination between viral and bacterial infections |
|
Isaacman 2002 |
Included in Sanders, 2008 |
|
Lacour 2001 |
Included in Yo 2012 |
|
Pulliam 2001 |
Included in Sanders, 2008 |
|
Enguix 2001 |
wrong study design |
|
Tatara 2000 |
wrong comparison: CRP for discrimination between bacterial and aseptic meningitis |
[1] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer, 1999)
[2] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[3] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-05-2021
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
In samenwerking met:
Dr. W. (Wieke) Altorf - van der Kuil, Centrum Infectieziektebestrijding, Epidemiologie en Surveillance van Infectieziekten, Rijksinstituut voor Volksgezondheid en Milieu
(RIVM), Bilthoven, Nederland
Doel en doelgroep
Doel
Het doel van dit project was het ontwikkelen van een landelijke richtlijn “Herkenning, diagnostiek en behandeling van sepsis bij kinderen” voor de algemene Kindergeneeskunde gebaseerd op evidence waar mogelijk en consensus waar het moet.Met deze richtlijn kan de kwaliteit van de sepsiszorg worden verbeterd en gewaarborgd, met als doel minder sepsis gerelateerde morbiditeit en mortaliteit.
Doelgroep
De richtlijn is primair bedoeld voor algemene kinderartsen, en spoedeisende hulp artsen. Daarnaast zal de richtlijn relevant zijn voor verpleegkundigen, medisch microbiologen en ziekenhuisapothekers.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met sepsis.
Werkgroep
- Dr. C.L. (Clementien) Vermont, kinderarts-infectioloog/immunoloog, werkzaam in het Erasmus MC - Sophia te Rotterdam, NVK (voorzitter)
- Dr. P.L.A. (Pieter) Fraaij, kinderarts-infectioloog/immunoloog, werkzaam in het Erasmus MC - Sophia te Rotterdam, NVK
- Dr. J. (Joris) Lemson, anesthesioloog en kinderintensivist, werkzaam in het RadboudUmc te Nijmegen, NVK en NVA
- Drs. A.V.N. (Anne) Schmetz, kinderarts/ fellow IC kinderen, werkzaam in het Erasmus MC te Rotterdam, NVK
- Dr. J.T. (Tjomme) van der Bruggen, arts-microbioloog, werkzaam in het UMCU te Utrecht, NVMM
- Prof. dr. Y.B. (Yolanda) de Rijke, klinisch chemicus, werkzaam in het Erasmus MC te Rotterdam, NVKC
- J. (Janine) Pingen MSc, junior project- en beleidsmedewerker, Stichting Kind en Ziekenhuis
- I. (Idelette) Nutma, patiëntvertegenwoordiger Sepsis-en-daarna, Stichting Kind en Ziekenhuis
- Drs. B.M. (Barbara) Geven, IC-kinderverpleegkundige, werkzaam in het Amsterdam UMC te Amsterdam, V&VN
Samenstelling klankbordgroep
- Dr. A.W.J.M. (Andor) Glaudemans, nucleair geneeskundige, werkzaam in het UMCG te Groningen, NVNG
- Dr. M.S. (Mathieu) Bolhuis, ziekenhuisapotheker, werkzaam in het UMCG te Groningen, NVZA
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A.L.J. (Andrea) Kortlever - van der Spek, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. N.M. (Nicole) Verheijen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Rijke de |
Laboratoriumspecialist Klinische Chemie, Erasmus MC
|
Extern auditor Raad van Accreditatie (ISO norm 15189); betaald. |
Geen sprake van relevant extern gefinancierd onderzoek: Sprake van unrestricted grants van Roche Diagnostics Nederland over biomarker innovatie en operational research |
Geen actie |
|
Glaudemans |
Nucleair geneeskundige, Medical Imaging Center, Afdeling Nucleaire Geneeskunde en Moleculaire Beeldvorming, Universitair Medisch Centrum Groningen
Plaatsvervangend afdelingshoofd bij afdeling hierboven
Chair Infection & Inflammation Committee European Association of Nucleair Medicine |
Chair Infection & Inflammation Committee European Association of Nuclear Medicine, onbetaald |
Geen |
Geen actie |
|
Nutma-Bade |
Ex-patiënt, voormalig verpleegkundige, auteur van Septische shock en Sepsis en daarna. Ervarings-professional. Eigenaar van Sepsis en daarna, ervaringsdeskundige begeleiding en voorlichting. Mede-initiatiefnemer van de website opeenicliggen.nl, die inmiddels is overgegaan in de website icconnect.nl |
Werkzaamheden op het gebied van voorlichting (Lezingen, lessen, workshops), begeleiding (huisbezoek, telefonische consulten) en advisering (bij onderzoek, richtlijnen, et cetera) geschieden betaald. |
Mogelijk kan de richtlijn (meer) aandacht genereren voor genoemde |
Geen actie |
|
Bruggen van der |
Arts-microbioloog, UMC Utrecht |
Lid werkgroep Consultkaart GBS behorende bij de NVK-richtlijn Preventie en behandeling van early-onset neonatale infecties georganiseerd door het Kennisinstituut. Betaald. |
Geen |
Geen actie |
|
Vermont* |
Kinderarts-infectioloog/immunoloog Erasmus MC |
Geen |
Geen |
Geen actie |
|
Lemson |
Anesthesioloog en kinderintensivist. Medisch manager kinder-IC van het Radboudumc |
Medeauteur van surviving sepsis guideline van SCCM (vooral IC) |
Geen |
Geen actie |
|
Schmetz |
Kinderarts, fellow IC Kinderen, Sophia Kinderziekenhuis, Erasmus MC Rotterdam |
Binnen de fellowship: het schrijven van enkele lokale protocollen voor intern gebruik |
Geen |
Geen actie |
|
Geven |
Intensive Care Kinderverpleegkundige, Amsterdam UMC/ Emma Kinderziekenhuis, 0.45 Fte Klinisch Epidemioloog, Amsterdam UMC/ Emma Kinderziekenhuis, 0.45 Fte |
Geen |
Geen |
Geen actie |
|
Schmidt-Cnossen |
Stichting kind en ziekenhuis, projectmanager 32 uur p.w. Laat ons ouders zijn, psycholoog 8 uur p.w. |
Geen |
Geen |
Geen actie |
|
Pingen |
Junior project- en beleidsmedewerker |
Verzorgende IG in de ouderenzorg - betaald |
Geen |
Geen actie |
|
Fraaij |
Kinderarts infectioloog immunoloog en klinische wetenschapper bij de Viroscience |
Geen |
PREPARE Europe (EU FP97 grant no. 602525) |
Geen actie (genoemde studie en presentaties hebben geen raakvlakken met de richtlijn) |
|
Hoogervorst-Schilp |
Adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
|
Kortlever-van der Spek |
Junior adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
*Voorzitter werkgroep
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Stichting Kind en Ziekenhuis af te vaardigen in de werkgroep.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten in de zorg voor kinderen met sepsis. Tevens zijn er knelpunten aangedragen door NVK, NVNG, NVMM, Sepsis en Daarna, V&VN, NHG, Zorginstituut Nederland, Stichting Kind en Ziekenhuis, AJN, Lareb, Nederlands Centrum Jeugdgezondheidszorg, SWAG en Nederlandse Meningitis Stichting via een schriftelijke knelpunteninventarisatie. Een overzicht hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en patiëntorganisatie voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., ... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11).
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., ... & Morelli, A. (2018). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. Gaceta sanitaria, 32(2), 166-e1.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A., ... & Katikireddi, S. V. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4-13.
Richtlijnen, A., & Kwaliteit, R. (2012). Medisch specialistische richtlijnen 2.0. Utrecht: Orde van Medisch Specialisten.
https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P., ... & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Schünemann, H., Brożek, J., Guyatt, G., & Oxman, A. (2013). GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from guidelinedevelopment. org/handbook. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. Bmj, 336(7653), 1106-1110.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
