Vasopressoren
Uitgangsvraag
Wat is de optimale vasopressorbehandeling bij patiënten met sepsis?
Aanbeveling
Start bij patiënten met sepsis met persisterende hypotensie na resuscitatie met kristalloïde vloeistof, noradrenaline als eerste keus vasopressor.
Voeg niet standaard vasopressine of een vasopressine-analoog toe aan de behandeling van patiënten met sepsis.
Overweeg bij patiënten met sepsis bij wie vasopressie geïndiceerd is om naast noradrenaline te starten met vasopressine(-analogen) indien er sprake is van refractaire hypotensie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Behandeling van septische shock bij patiënten met noradrenaline in combinatie met vasopressine(analogen) lijkt niet te leiden tot lagere mortaliteit na 28/30 dagen vergeleken met behandeling met noradrenaline alleen. De bewijskracht voor deze cruciale uitkomstmaat is laag. Er lijkt ook geen verschil in IC- of ziekenhuisverblijfsduur tussen deze twee groepen.
Tegelijkertijd is er steeds meer bewijs dat tijdens sepsis noradrenaline ook een nadelig immuunmodulerend effect kan hebben (Stolk, 2020). Om die reden blijft het noodzakelijk te blijven zoeken naar alternatieven voor noradrenaline. Naast vasopressine (argipressine, empressine) is ook angiotensine II onderwerp van onderzoek als alternatief of als toevoeging aan de behandeling van patiënten met sepsis met noradrenaline. Gezien het ontbreken van literatuur bij aanvang van de richtlijnontwikkeling is angiotensine II in deze richtlijn niet verder onderzocht. Voor deze middelen is het ook nog niet geheel duidelijk of ze immuunmodulerende effecten hebben in vivo. Naast een keuze voor een van deze aanvullende therapieën is ook het moment van starten; welke bloeddruk, welke hoeveelheid noradrenaline, vaak een punt van discussie.
Voor vasopressine(-analogen) geldt dat het ook nadelige effecten kan hebben, zoals zout- en waterretentie, NO-release, en een toename in pro-coagulante factoren. Verder werd vasopressine gebruik vaak geassocieerd met ischemische complicaties, zowel cardiaal, mesenteriaal als perifeer. In de SEPSIS-ACTstudie (Laterre, 2019) werd er echter geen significant verschil gevonden in ischemische complicaties tussen noradrenaline en de groep met combinatietherapie met selepressine. In een zeer recente systematische review en meta-analyse werd voor vasopressine(-analogen) alleen een associatie gevonden met ischemie aan de extremiteiten (Yao, 2020).
In de dubbelblinde gerandomiseerde VANISH trial (Gordon, 2016) werd noradrenaline vergeleken met vroeg toegediende argipressine (tot 0,06 E/min). Er werd gefocused op het voorkomen van orgaanschade (nierfalen) vanwege het potentiele effect hierop dat was gezien in de VASST studie. VANISH heeft een 2x2 factorieel design waarbij beide vasopressoren met en zonder hydrocortison werden gegeven. In aanvulling op de toegewezen vasopressor mochten, open label, aanvullende vasopressoren gegeven worden. Er werd geen verschil gevonden in het voorkomen van nierfalen tussen de groepen, wel was er significant minder nierfunctievervangende therapie nodig in de argipressinegroep in vergelijking met de noradrenalinegroep (25,4% versus 35,3%). Er was geen interactie met steroïde gebruik. Hoewel de resultaten het vroege gebruik van argipressine in plaats van noradrenaline niet ondersteunen, valt een klinisch relevant effect voor vasopressine binnen de mogelijke uitkomsten gezien het betrouwbaarheidsinterval. Er werden een of meer ernstige ongewenste voorvallen waargenomen bij 10,7% van de met argipressine en 8,3% van de met noradrenaline behandelde patiënten. In deze studie was het gebruik van nierfunctievervangende therapie niet vooraf vastgelegd en werd dus gestart naar eigen inzicht. Desondanks zou gezien de dubbelblinde opzet van deze studie dit een belangrijk signaal voor het gebruik van vasopressine kunnen zijn.
Voor noradrenaline met vasopressine(analogen)
Zoals hierboven reeds aangegeven kan noradrenaline catecholaminerge nadelige effecten hebben onder andere op het immuunsysteem. Het gebruik van een non-catecholaminerge vasopressor zoals de directe vasopressine V1a receptor agonist selepressine zou deze nadelige effecten wellicht kunnen verminderen. Daarnaast zijn er aanwijzingen dat het gebruik van vasopressine of selepressine noradrenaline-sparende effecten heeft. Het gebruik van vasopressine(-analogen) is echter niet eenduidig wat betreft het moment van starten en de dosering waarmee te starten.
Er is op dit moment onvoldoende bewijs om naast noradrenaline te starten met een vasopressine-analoog. Tegelijkertijd is er ook geen bewijs dat combinatietherapie per se slechter is voor de patiënt. Wel zijn er aanwijzingen dat combinatietherapie met vasopressine voor minder boezemfibrilleren zorgt bij patiënten met een distributieve shock (McIntyre, 2018), maar zijn er ook aanwijzingen dat het leidt tot meer perifere ischemie (Yao, 2020).
In de meest recente richtlijn van de Surviving Sepsis Campaign (uitgekomen in de autorisatiefase van deze richtlijn) wordt nogmaals duidelijk dat het starten van vasopressine(analogen) in studies wereldwijd varieert. Derhalve suggereert de SSC dat het redelijk lijkt om te starten met vasopressine bij patiënten met een indicatie voor vasopressie en een noradrenaline behoefte in de range van 0,25-0,5 μg/kg/min (Evans, 2021). Gegeven de ontbrekende literatuur hebben we deze suggestie van de SSC als overweging en niet als aanbeveling in deze richtlijn opgenomen.
Vasopressine zal in tegenstelling tot de sympaticomimetische effecten van onder andere noradrenaline en fenylefrine op basis van fysiologische eigenschappen niet leiden tot pulmonale vasoconstrictie. Bij 241 patiënten (31%) uit de VASST trial (Russell, 2008) werd aanvullende hemodynamische monitoring gedaan middels een Swan-Ganz katheter. Behoudens een significant effect op de hartfrequentie (lager in de vasopressine groep) werd er geen verschil gevonden in Cardiac Output of andere perfusiemarkers, in het bijzonder ook geen verschil in pulmonaaldrukken. In deze studie werden patiënten met hartfalen uitgesloten (Gordon, 2012).
Bij patiënten die na een CABG met milrinon werden behandeld werd gebruik gemaakt van noradrenaline of vasopressine om de milrinone geinduceerde hypotensie te behandelen. In deze studie zorgde zowel noradrenaline als vasopressine voor herstel van de SVR en PVR. Echter de PVR/SVR ratio was in het voordeel van vasopressine (Yeon, 2006).
Bovenbeschreven bevindingen in verschillende populaties patiënten maakt dat er wellicht groepen sepsispatiënten zijn waarbij behandeling met vasopressine van toegevoegde waarde kan zijn. Patiënten at risk voor het ontwikkelen van boezemfibrilleren, het ontwikkelen van nierfalen en tekenen van pulmonale hypertensie of rechterventrikelfalen zouden wellicht baat kunnen hebben bij het vroegtijdig starten met vasopressine. Het identificeren van de specifieke patiënten waarvoor dit geldt is moeilijk. Per patiënt zullen de mogelijke voor- en nadelen zorgvuldig moeten worden afgewogen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De voorkeur van de patiënt voor deze interventies is niet onderzocht en onbekend. Goede voorlichting en communicatie over behandeldoelen, voor- en nadelen, risico’s, monitoring en verwacht resultaat is belangrijk om een goede afweging te maken voor patiënten en naasten. Vasopressoren worden alleen toegediend op een afdeling waar de patiënt bewaakt wordt (IC of medium care). Om naast noradrenaline te starten met vasopressine(-analogen) hoeven er voor de patiënt geen extra maatregelen te worden genomen.
Kosten (middelenbeslag)
Behandeling met noradrenaline aangevuld met vasopressine (-analogen) is geen kostbare behandeling. De kosten van vasopressine (-analogen) liggen wel hoger dan de kosten voor noradrenaline alleen. Gekeken naar bovenbeschreven uitkomstmaten, zal het toevoegen van vasopressine(-analogen) niet leiden tot minder kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Het toedienen van vasopressoren op een IC of Medium Care is dagelijkse praktijk. Het toevoegen van een vasopressine(-analoog) aan een behandeling met noradrenaline zal geen probleem zijn. Selepressine is in Nederland niet verkrijgbaar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het toevoegen van een vasopressine (-analoog) leidt niet tot een verbetering van de mortaliteit. Echter op pathofysiologische gronden kan bij specifieke patiëntpopulaties gekozen worden voor het gebruik van vasopressine.
Tegelijkertijd is er ook geen bewijs dat combinatietherapie per se slechter is voor de patiënt. Wel zijn er aanwijzingen dat combinatietherapie met vasopressine voor minder boezemfibrilleren zorgt bij patiënten met een distributieve shock, maar zijn er ook aanwijzingen dat het leidt tot meer perifere ischemie.
Onderbouwing
Achtergrond
Er is veel praktijkvariatie in het toedienen van vasopressoren bij sepsis. Na initiële resuscitatie met kristalloïde vloeistof dient bij persisterende hypotensie gestart te worden met vasopressietherapie (farmacologische vasopressoren) op een bewaakte afdeling. Op dit moment is noradrenaline de vasopressor van eerste keuze (Rhodes, 2017). Het komt echter frequent voor dat het ophogen van noradrenaline niet het gewenste effect op de bloeddruk heeft. Op dat moment wordt nu in de praktijk vaak een tweede vasopressor toegevoegd, hiervoor is echter nog geen bewijs.
De timing van het toevoegen van een ander middel evenals de keuze voor een ander middel zijn sterk afhankelijk van de verschillende patiëntfactoren, zoals bijvoorbeeld aanwezigheid van pulmonale hypertensie, en/of hartfalen.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onzeker of behandeling van patiënten met septische shock met noradrenaline in combinatie met vasopressine (analogen) leidt tot een lagere IC-mortaliteit vergeleken met behandeling met noradrenaline alleen.
Bronnen: (McIntyre, 2018; Xiao, 2016) |
|
Laag GRADE |
Behandeling van patiënten met septische shock met noradrenaline in combinatie met vasopressine (analogen) lijkt niet te leiden tot een kortere verblijfsduur op de intensive care vergeleken met behandeling met noradrenaline alleen.
Bronnen: (McIntyre, 2018) |
|
Laag GRADE |
Behandeling van patiënten met septische shock met noradrenaline in combinatie met vasopressine (analogen) lijkt niet te leiden tot een kortere verblijfsduur in het ziekenhuis vergeleken met behandeling met noradrenaline alleen.
Bronnen: (McIntyre, 2018) |
|
- GRADE |
Er werden geen studies gevonden over de behandeling van patiënten met septische shock met noradrenaline in combinatie met vasopressine (analogen) vergeleken met behandeling met noradrenaline alleen met reversibiliteit van shock als uitkomstmaat. |
Samenvatting literatuur
Beschrijving studies
De systematische literatuurreview van McIntyre (2018) werd als uitgangspunt genomen voor deze literatuuranalyse, hieruit werden 12 studies geëxcludeerd, zie exclusietabel onder het tabblad Verantwoording inclusief exclusiereden. Er werden drie losse RCT’s toegevoegd aan de studies van McIntyre (2018), te weten Laterre (2019), Xiao (2016) en Hammond (2018).
De belangrijkste karakteristieken per studie staan beschreven in tabel 1. De studiepopulaties bestonden uit patiënten met sepsis of septische shock.
Tabel 1 Studiekarakteristieken
|
Auteur, jaar |
Populatie |
Interventie |
Controle |
Open-label catecholamines toegestaan |
|
Lauzier 2006 |
Septische shock |
Vasopressine: 0,04-0,20 U/min |
Noradrenaline: 0,1-2,8 μg/kg/min |
ja |
|
Albanese 2005 |
Septische shock en twee of meer orgaan dysfuncties |
Terlipressine: 1-mg bolus, daarna 1-mg bolus als MAP <65 mm Hg |
Noradrenaline: 0,3 μg/kg, daarna verhogen met 0,3 μ/kg elke 4 min totdat MAP tussen 65-75 mm Hg is |
ja |
|
Barzegar 2014 |
Septische shock |
Vasopressine: 0,03 U/min |
Noradrenaline: zonodig voor MAP >65 mm Hg |
ja |
|
Chen 2017 |
Acuut respiratoir distress syndroom en septische shock |
Terlipressine en noradrenaline: 0,01-0,04 U/min terlipressine en noradrenaline zoals nodig om MAP tussen 65-75 mm Hg te houden. |
Noradrenaline: >1 μg/min |
ja |
|
Choudhury 2016 |
Septische shock en cirrose |
Terlipressine: 1,3-5,2 μg/min gedurende 24 uur |
Noradrenaline: 7,5-60 μg/min |
ja |
|
Fonseca Ruiz 2013 |
Septische shock |
Noradrenaline + vasopressine met getitreerde doseringen van 0,01 U/min, daarna verhogen met 0,01 U/min elke 10 min om MAP >65 mm Hg te halen of tot de maximale dosis van 0,04 U/min |
Noradrenaline: |
Ja |
|
Gordon 2016 |
Septische shock |
Vasopressine: tot aan 0,06 U/min met target MAP tussen 65-75 mm Hg, of beoordeling van de arts. |
Noradrenaline: tot 12 μg/min met target MAP tussen 65-75 mm Hg, of beoordeling van de arts. |
Ja |
|
Russell 2008 |
Septische shock |
Vasopressine: 0,01 U/min, daarna titratie tot aan 0,03 U/min met target MAP tussen 65-75 mm Hg, of beoordeling van de arts. |
Noradrenaline: 5 μg/min tot 15 μg/min met target MAP tussen 65-75 mm Hg, of beoordeling van de arts. |
Ja |
|
Svoboda 2012 |
Septische shock |
Terlipressine: 4 mg gedurende 24 uur voor 72 uur |
Noradrenaline zoveel als nodig |
Ja |
|
Russel 2017 |
Septische shock |
Selepressine: 1,25, 2,5, of 3,75 ng/kg/min totdat shock genormaliseerd of een maximum van 7 dagen |
Placebo; Open label noradrenaline om MAP > 65 te bereiken |
Ja |
|
Morelli 2009 |
Septische shock |
Groep 1: vasopressine: 0,03 U/min continue gedurende 48 uur |
Noradrenaline titratie zoveel als nodig |
Ja |
|
Septische shock |
Groep 2: terlipressine: 1,3 μg/kg/min continue |
Noradrenaline titratie zoveel als nodig |
Ja |
|
|
Xiao 2016 |
Septische shock |
Terlipressine (1.3 mg/kg/h) in combinatie met continue infusie van Noradrenaline |
Noradrenaline |
Onduidelijk |
|
Laterre 2019 |
Septische shock (>5 μg/min noradrenaline nodig) |
Random toewijzing aan 1 van de 3 dosering regimes met selepressine (start infusie rate van 1,7, 2,5, en 3,5 ng/kg/min. Eerder is noradrenaline toegediend. |
Placebo, eerder noradrenaline toegediend |
Onduidelijk |
|
Hammond 2018 |
Septische shock |
Vroege gelijktijdige behandeling met vasopressine en noradrenaline |
Noradrenaline monotherapie |
Ja |
MAP=Mean Arterial Pressure
Resultaten
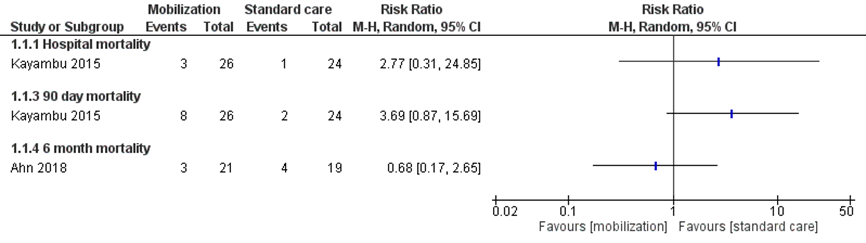
In totaal rapporteerden 14 studies, met in totaal 2.480 patiënten, over IC-mortaliteit en ziekenhuismortaliteit na 28 tot 30 dagen. In totaal was de ziekenhuismortaliteit 35,9% in de noradrenaline + vasopressine groep en 38.2% in de groep die alleen noradrenaline ontving. Op basis van de meta-analyse was er geen statistisch significant en klinisch relevant verschil in mortaliteit tussen de groepen (RR 0,93 (95% BI 0,85 tot 1,03) (figuur 6.2).
Voor IC-mortaliteit waren er ook geen verschillen tussen de groepen (RR 0,80 (BI 0,56 tot 1,16), er was een breed betrouwbaarheidsinterval.
In figuur 3 zijn de resultaten voor mortaliteit opgesplitst voor de verschillende middelen (vasopressine, terlipressine en selepressine).
Mortaliteit
Figuur 2 Mortaliteit bij toediening van noradrenaline met of zonder vasopressine(analoog)
Mortaliteit (relatief risico) bij patiënten met septische shock. NE: noradrenaline; Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 3 Mortaliteit op 28/30 dagen bij toediening van noradrenaline met of zonder vasopressine(analoog), subgroepen per middel
Mortaliteit (relatief risico) bij patiënten met septische shock per middel. NE: noradrenaline; Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met twee niveaus afgewaardeerd tot laag vanwege beperkingen in de extrapoleerbaarheid (klinische heterogeniteit van de studies) en vanwege overschrijding van de grenzen van klinische relevantie (imprecisie). Voor mortaliteit op de IC is nog met één extra niveau afgewaardeerd tot zeer laag vanwege inconsistentie van de resultaten.
Verblijfsduur op de IC
In totaal rapporteerden zes studies, met in totaal 1.387 patiënten, over IC-verblijfsduur. Gemiddeld was de IC-verblijfsduur in de noradrenaline + vasopressine groep 15 dagen (sd 16) en 15 dagen (sd 18) in de groep die alleen noradrenaline ontving. Op basis van de meta-analyse was er geen statistisch significant en klinisch relevant verschil in mortaliteit tussen de groepen (MD -0,83 (95% BI -2,21 tot 0,56)) (figuur 6.4).
Verblijfsduur in het ziekenhuis
Voor verblijfsduur in het ziekenhuis was er ook geen verschil tussen de groepen (MD -0,37 (BI -3,17 tot 2,43)) (figuur 4).
Figuur 4 Verblijfsduur op de IC en in het ziekenhuis bij toediening van noradrenaline met of zonder vasopressine (analoog) bij patiënten met septische shock
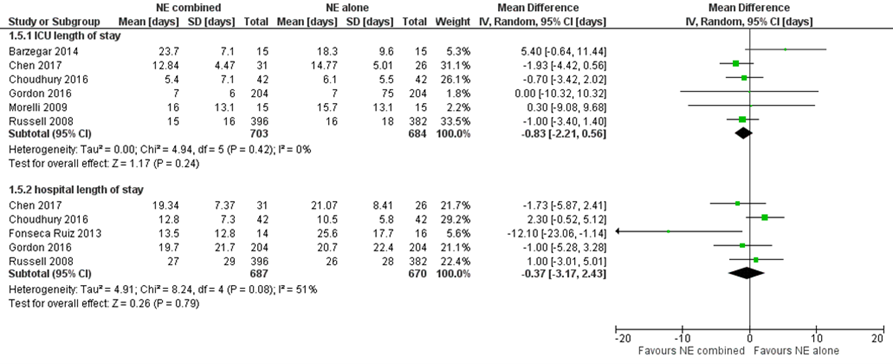
Verblijfsduur in dagen bij patiënten met septische shock. IC=Intensive Care; NE: norepinephrine; Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat verblijfsduur is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met twee niveaus afgewaardeerd tot laag vanwege beperkingen in de extrapoleerbaarheid (klinische heterogeniteit van de studies) en vanwege overschrijding van de grenzen van klinische relevantie (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van het additioneel toedienen van vasopressine (of een analoog) ten opzichte van noradrenaline alleen bij volwassen patiënten met sepsis of septische shock?
P: volwassen patiënten met sepsis of septische shock;
I: noradrenaline plus vasopressine (of een analoog);
C: noradrenaline;
O: mortaliteit, reversibiliteit van shock, intensive-careverblijfsduur en ziekenhuisverblijfsduur.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en reversibiliteit van shock voor de besluitvorming cruciale uitkomstmaten; en ziekenhuis- en intensive-careverblijfsduur voor de besluitvorming belangrijke uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hanteerde voor mortaliteit 3% als een klinisch (patiënt) relevant verschil (gebaseerd op de SDD-trial van de Smet, 2009). Voor reversibiliteit van shock als dichotome uitkomstmaat werd de GRADE standaardgrens van 25% gehanteerd. Voor verblijfsduur op de intensive care (IC) werd één dag als klinisch relevant verschil gedefinieerd, voor ziekenhuisverblijfsduur twee dagen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 20 maart 2020 met relevante zoektermen gezocht naar gerandomiseerde trials (RCT) of systematische literatuur reviews over noradrenaline en vasopressine (of een analoog) bij patiënten met sepsis. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 456 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde trials of systematische reviews betreffende de PICO. Op basis van titel en abstract werden in eerste instantie 37 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 33 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Resultaten
Vier publicaties, waarvan één systematische literatuur analyse zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Chang, W., Xie, J. F., Xu, J. Y., & Yang, Y. (2018). Effect of levosimendan on mortality in severe sepsis and septic shock: a meta-analysis of randomised trials. BMJ open, 8(3).
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. Doi:10.1056/NEJMoa0800394.
- Gordon AC, Wang N, Walley KR, Ashby D, Russell JA. The cardiopulmonary effects of vasopressin compared with norepinephrine in septic shock. Chest. 2012 Sep;142(3):593-605. doi: 10.1378/chest.11-2604. PMID: 22518026.
- Gordon AC, Mason AJ, Thirunavukkarasu N, Perkins GD, Cecconi M, Cepkova M, Pogson DG, Aya HD, Anjum A, Frazier GJ, Santhakumaran S, Ashby D, Brett SJ; VANISH Investigators. Effect of Early Vasopressin vs Norepinephrine on Kidney Failure in Patients With Septic Shock: The VANISH Randomized Clinical Trial. JAMA. 2016 Aug 2;316(5):509-18. doi: 10.1001/jama.2016.10485. PMID: 27483065.
- Hammond DA, Ficek OA, Painter JT, et al. Prospective Open-label Trial of Early Concomitant Vasopressin and Norepinephrine Therapy versus Initial Norepinephrine Monotherapy in Septic Shock. Pharmacotherapy. 2018;38(5):531‐538. Doi:10.1002/phar.2105.
- Laterre PF, Berry SM, Blemings A, et al. Effect of Selepressin versus Placebo on Ventilator- and Vasopressor-Free Days in Patients With Septic Shock: The SEPSIS-ACT Randomized Clinical Trial (published online ahead of print, 2019 Oct 2) (published correction appears in JAMA. 2019 Oct 15;:). JAMA. 2019;322(15):1476‐1485. doi:10.1001/jama.2019.14607.
- McIntyre WF, Um KJ, Alhazzani W, Lengyel AP, Hajjar L, Gordon AC, Lamontagne F, Healey JS, Whitlock RP, Belley-Côté EP. Association of Vasopressin Plus Catecholamine Vasopressors vs Catecholamines Alone With Atrial Fibrillation in Patients With Distributive Shock: A Systematic Review and Meta-analysis. JAMA. 2018 May 8;319(18):1889-1900. doi: 10.1001/jama.2018.4528. PMID: 29801010; PMCID: PMC6583502.
- Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017;43(3):304‐377. doi:10.1007/s00134-017-4683-6.
- Russell JA, Walley KR, Singer J, Gordon AC, Hébert PC, Cooper DJ, Holmes CL, Mehta S, Granton JT, Storms MM, Cook DJ, Presneill JJ, Ayers D; VASST Investigators. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008 Feb 28;358(9):877-87. doi: 10.1056/NEJMoa067373. PMID: 18305265.
- Schumann, J., Henrich, E. C., Strobl, H., Prondzinsky, R., Weiche, S., Thiele, H., ... & Unverzagt, S. (2018). Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. Cochrane Database of Systematic Reviews, (1).
- Stolk R, van der Pasch E, Naumann F, et al. Norepinephrine Dysregulates the Immune Response and Compromises Host Defense During Sepsis (published online ahead of print, 2020 Jun 10). Am J Respir Crit Care Med. 2020;10.1164/rccm.202002-0339OC. doi:10.1164/rccm.202002-0339OC.
- Xiao X, Zhang J, Wang Y, et al. Effects of terlipressin on patients with sepsis via improving tissue blood flow. J Surg Res. 2016;200(1):274‐282. doi:10.1016/j.jss.2015.07.016.
- Yao RQ, Xia DM, Wang LX, et al. Clinical Efficiency of Vasopressin or Its Analogs in Comparison With Catecholamines Alone on Patients With Septic Shock: A Systematic Review and Meta-Analysis. Front Pharmacol. 2020;11:563. Published 2020 May 6. doi:10.3389/fphar.2020.00563.
- Jeon Y, Ryu JH, Lim YJ, Kim CS, Bahk JH, Yoon SZ, Choi JY. Comparative hemodynamic effects of vasopressin and norepinephrine after milrinone-induced hypotension in off-pump coronary artery bypass surgical patients. Eur J Cardiothorac Surg. 2006 Jun;29(6):952-6. doi: 10.1016/j.ejcts.2006.02.032. Epub 2006 May 3. PMID: 16675238.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat zijn de (on)gunstige effecten van het additioneel toedienen van vasopressine (of een analoog) ten opzichte van noradrenaline alleen bij volwassenen met sepsis of septische shock?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
McIntyre (2018) (selection of studies, see exclusion table)
|
SR and meta-analysis of RCTs
Literature search up to February 2018
A: Lauzier 2006 B: Albanese 2005 C: Barzegar 2014 D: Chen 2017 E: Choudhury 2016 F: Fonseca Ruiz 2013 G: Gordon 2016 H: Russell 2008 I: Svoboda 2012 J: Russel 2017 K: Morelli 2009
Study design: A: open-label RCT B: open-label RCT C: open-label RCT D: single-blind RCT E: open-label RCT F: open-label RCT G: 2x2 factorial double blind with hydrocortisone RCT H: double blind RCT I: open-label RCT J: double blind RCT K: open-label RCT, 3 arms
Setting and Country: A: Tertiary care one hospital, Canada B: Tertiary care one hospital, France C: Tertiary care one hospital, Iran D: One hospital, China E: One hospital, India F: One hospital, Colombia G: Multicentre, 18 ICUs, UK H: Multicentre, Canada, US Australia I: One hospital, Czech Republic J: Multicentre, Belgium, Denmark and the US K: Tertiary care one hospital, Italy
Source of funding: A: non-commercial B: no funding source C: Not stated D: non-commercial E: Not stated F: Not stated G: non-commercial H: non-commercial I: non-commercial J: Ferring pharmaceuticals, patents related to the use of vasopressin in septic shock
K: non-commercial |
Inclusion criteria SR: RCTS comparing vasopressin in combination with catecholamine vasopressors to catecholamines alone for patients with distributive shock
Exclusion criteria SR: -
11 studies included for this analysis for the guideline
Important patient characteristics at baseline:
N, mean age A: n=23; 55 yrs B: n=20; 66 yrs C: n=30; 64 yrs D: n=57; NR E: n=84; 48 yrs F: n=30; 58 yrs G: n=421; 66 yrs H: n=802; 61 yrs I: n=32; 73 yrs J: n=53; 63.2 yrs K: n=45; 66 yrs
Sex: A: 63% Male B: 65% Male C: 63% Male D: NR E: 82% Male F: 59% Male G: 58% Male H: 61% Male I: 61% Male J: 71% Male K: 73% Male
APACHE score: A: 23.2 B: 28.5 C: NR (SOFA=12) D: NR (SOFA=14.3) E: 19 F: 24 G: 27.1 H: 27.1 I: NR (SOFA=18) J: 12 K: NR (SAP=60)
Groups comparable at baseline? Yes, as far as known |
Describe intervention:
A: Vasopressin 0.04–0.20 U/min B: Terlipressin 1 mg bolus, followed by second bolus 1 mg if MAP <65 mm Hg C: Vasopressin 0.03 u/min D: Terlipressin (0.01-0.04U/min) and norepinephrine as needed to maintain MAP between 65 and 75 mm Hg E: Terlipressin 1.3-5.2mcg/min over 24 h F: Vasopressin: noradrenaline plus vasopressin at titrated doses of 0.01 U / min and increasing every 10 minutes 0.01 U / min to achieve a mean arterial pressure (MAP) of 6 G: Vasopressin up to 0.06 U/min with target MAP 65-75 mm Hg or physician discretion H: Vasopressin started at 0.01 U/min, titrated up to 0.03 U/min with target MAP 65-75 mm Hg or physician discretion I: Terlipressin 4 mg/24 h for 72 h J: Selepressin infused at 1.25, 2.5 or 3.75 ng/kg/min until shock resolution or a maximum of 7 days K1: Vasopressin continuous infusion 0.03 U/min over a period of 48 hrs versus K2: Terlipressin continuous infusion 1.3 mcg/kg over a period of 48 hrs
|
Describe control:
A: Norepinephrine 0.1–2.8 mcg/kg/min B: Norepinephrine started with 0.3 mcg/kg and increased by 0.3 mcg/kg every 4 minutes until MAP 65 to 75 mm Hg C: Norepinephrine adjusted to MAP > 65 mm Hg D: Norepinephrine (>1mcg/min) E: Norepinephrine 7.5-60mcg/min F: Norepinephrine G: Norepinephrine up to 12 mcg/min with target MAP 65-75 mm Hg or physician discretion H: Norepinephrine 5 mcg/min up to 15 mcg/min with target MAP 65-75 mm Hg or physician discretion I: Norepinephrine as needed J: Open label norepinephrine to achieve MAP > 65 K3: Norepinephrine titrated as needed
|
End-point of follow-up:
A: until IC admission B: in-hospital data C: 28-days D: 28-days E: 28-days F: 28-days G: 28-days H: 90 days I: 28-days J: 28-days K: in-hospital data (length of stay)
For how many participants were no complete outcome data available? (intervention/control) A: 0 B: 0 C: 0 D: Large numbers of post-randomization exclusions in both arms E: 0 F: 0 G: Modified intention to treat analysis, 9 patients randomized in vasopressin arm but not analyzed exceed fragility threshold H: 0, intention to treat analysis for mortality outcome, modified intention to treat for others I: Two patients who died were excluded post randomization J: 2/19 lost to follow up in group 1 K: 0
|
Outcome measure-1: mortality 28-30 days Effect measure: RR (95% CI): A: - B: 1.25 (0.47 to 3.33) C: 0.71 (0.29 to 1.75) D: 0.94 (0.43 to 2.09) E: 0.86 (0.69 to 1.07) F: 0.91 (0.30 to 2.75) G: 1.13 (0.83 to 1.52) H: 0.91 (0.76 to 1.09) I: 0.82 (0.69 to 1.13) J: 0.98 (0.32 to 3.03) K: -
Pooled effect from McIntyre is not relevant, see overall forest plots in text in figures.
Outcome measure-2: IC mortality Effect measure: RR (95% CI): A: 0.77 (0.20 to 3.03) K1: 0.90 (0.53 to 1.54) K2: 1.00 (0.61 to 1.64)
Pooled effect from McIntyre is not relevant, see overall forest plots in text in figures.
Outcome measure-3: Hospital length of stay in days Effect measure: MD (95% CI): D: -1.73 (-5.87 to 2.41) E: 2.30 (-0.52 to 5.12) F: -12.10 (-23.06 to -1.14) G: -1.00 (-5.28 to 3.28) H: -0.60 (-4.63 to 3.43)
Pooled effect from McIntyre is not relevant, see overall forest plots in text in figures.
Outcome measure-4: IC length of stay in days Effect measure: MD (95% CI): C: 5.40 (-0.64 to 11.44) D: -1.93 (-4.42 to 0.56) E: 0.30 (-2.42 to 3.02) G: 0.00 (-1.32 to 1.32) H: -1.70 (-4.11 to 0.71) K: 0.30 (-9.08 to 9.68)
Pooled effect from McIntyre is not relevant, see overall forest plots in text in figures. |
|
NR=Not reported
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat zijn de (on)gunstige effecten van het additioneel toedienen van vasopressine (of een analoog) ten opzichte van noradrenaline alleen bij volwassenen met sepsis of septische shock?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Xiao 2016 |
Type of study: RCT
Setting: ICU
Country: China
Source of funding: National Natural Science Foundation of China (grant no. 81272077), the Program for Changjiang Scholars and Innovative Research Team in University (IRT1216), the Major State Basic Research Program (grant no. 2012CB518101), and the Chongqing Scientific Foundation for Distinguished Young Scholars (grant no. cstc2011jjjq0019). |
Inclusion criteria: - ICU patients with existing sepsis; -Patients with refractory hypotension (SBP <90 mm Hg, MAP <65 mm Hg); -vasoactives must be given to maintain the MAP 65 mm Hg after adequate fluid Resuscitation
Exclusion criteria: - age <18 y; - complicated with left ventricular dysfunction (cardiac index <2.2 L/min/m2 when pulmonary wedge pressure >18 mm Hg); - with coronary heart disease; -with apparent valvular heart disease; - presence (or suspected) of ischemia in the mesenteric arteries or vascular spasm diseases.
N total at baseline: Intervention: 15 Control: 17
Important prognostic factors2: age ± SD: I: 63 ± 11 C: 62 ± 14
Sex: I: 67% M C: 71% M
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Patients received enough fluid plus intravenous infusion of norepinephrine (NE) and a small dose of Terlipressin (TP) (1.3 mg/kg/h) to maintain MAP 65 mm Hg
All patients received anesthesia and ventilator-assisted control breathing. The breathing mode was volume-controlled ventilation. According to the 2008 international sepsis treatment guidelines, except for fluid resuscitation, NE and NE + TP, the basic treatment measures including organ protection and antibiotics, and so on for each patient in the two groups were similar.
|
Describe control (treatment/procedure/test):
Patients received enough fluid plus intravenous infusion of NE to maintain the MAP ≥65 mm Hg but ≤95 mm Hg.
All patients received anesthesia and ventilator-assisted control breathing. The breathing mode was volume-controlled ventilation. According to the 2008 international sepsis treatment guidelines, except for fluid resuscitation, NE and NE + TP, the basic treatment measures including organ protection and antibiotics, and so on for each patient in the two groups were similar.
|
Length of follow-up: Mortality: 7-day survival
Loss-to-follow-up: Intervention: N=0 (0%) Reasons (describe)
Control: N=0 (0%) Reasons (describe)
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality rate (7-days) I: 5/15 =33% C: 13/17 = 76% |
|
|
Laterre 2019 |
Type of study: adaptive RCT phase 2b/3
Setting: 63 hospitals
Country: Belgium, Denmark, France, The Netherland and US
Source of funding: Ferring Farmaceuticals F/S Several conflicts of interests reported by the author group |
Inclusion criteria: -+>18 yr -proven or suspected infection and septic shock
Exclusion criteria: -if they were receiving vasopressin or terlipressin -if it was not possible to start study drug within 12 hours after of the use of any vasopressor treatment -if sepsis was not the primary cause of hypotension
N total at baseline: Intervention: 585 Control: 283
Important prognostic factors2: age ± SD: I:66.6 ± 12.8 C: 65.7 ± 14.6
Sex: I: 61% M C: 55% M
Apache II: I:25.7 ± 7.8 C: 26.0 ± 7.7
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Random assignment to 1 of 3 dosing regimens of selepressin: 1. starting infusion rate 1.7 ng/kg/min 2. starting infusion rate 2.5 ng/kg/min 3. starting infusion rate 3.5 ng/kg/min
Administered as continuous infusions titrated according to hemodynamic parameters
|
Describe control (treatment/procedure/test):
Placebo
Administered as continuous infusion titrated according to hemodynamic parameters
|
Length of follow-up: Mortality up to 180 days
Loss-to-follow-up: Intervention: N=29 (5%) Reasons: withdrawal of consent, lost to follow-up +n=23 did not receive selepressin (died, withdrawal by investigator, not eligible)
Control: N=3 (1%) Reasons: withdrawal of consent, lost to follow-up +n=17 did not receive selepressin (died, withdrawal by investigator, withdra consent not eligible)
Modified intention to treat analysis with patients that received intervention or placebo: I: N=562 C: N=266
Incomplete outcome data: NA |
Outcome measures and effect size (include 95%CI and p-value if available):
30-day mortality N, RR (95% CI) I: 193/562 C: 91/266 RR: 1.0 (0.82 to 1.32)
|
|
|
Hammond 2018 |
Type of study: Prospective open-label trial
Setting: One medical intensive care unit in an academic medical center
Country:US
Source of funding: organizational grant from the American Colleges of Clinical Pharmacy Critical Care Practice & Research Network, Lenexa, Kansas |
Inclusion criteria: -Adults who presented to the emergency department or were receiving care in the ward were assessed for enrolment -at least two systemic inflammatory response syndrome criteria -with a suspected or confirmed source of infection -had MAP less than 60 mm Hg despite at least 30 ml/kg of crystalloid resuscitation within the previous 4 hours -admitted to the 28-bed medical intensive care unit at our institution
Exclusion criteria: -shock not caused by sepsis -end-stage renal disease requiring long-term dialysis -endstage hepatic disease -were not expected to be alive at 48 hours from septic shock diagnosis in the opinion of the attending physician -received a continuous infusion of a vasopressor other than norepinephrine or vasopressin before receipt of either agent -were enrolled in another clinical trial -were admitted from an outside hospital -received a nonstudy vasopressor before receipt of a study vasopressor
N total at baseline: Intervention: 41 Control: 41
Important prognostic factors2: age (median (IQR)): I: 62 (51–74) C: 60 (49–68)
Sex: I: 54% M C: 44% M
APACHE II (Mean (sd): I: 28 (21–34) C: 22 (18–30)
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
Vasopressin initiated within 4 hours of norepinephrine
+ initial sepsis management according to the institution’s usual care measures that were aligned with recommendations from the Surviving Sepsis Campaign.
|
Describe control (treatment/procedure/test):
Norepinephrine monotherapy
+ initial sepsis management according to the institution’s usual care measures that were aligned with recommendations from the Surviving Sepsis Campaign.
|
Length of follow-up: 28-days
Loss-to-follow-up: Intervention: N=0
Control: N=0
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
28-day mortality N, RR (95% CI) I: 19/41 (46%) C:21/41 (51%) p=0.66
ICU duration, days, median (IQR) I: 4.1 (2.4–8.9) C: 3.8 (2.1–7.4) p=0.54 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Mohe, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Wat zijn de (on)gunstige effecten van het additioneel toedienen van vasopressine (of een analoog) ten opzichte van noradrenaline alleen bij volwassenen met sepsis of septische shock?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
McIntyre (2018) |
Yes
We used a selection of the included papers described in McIntyre as described |
Yes |
Yes |
Yes
|
NA |
Yes |
Unclear
Very heterogenous treatments and populations |
Yes |
Yes |
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat zijn de (on)gunstige effecten van het additioneel toedienen van vasopressine (of een analoog) ten opzichte van noradrenaline alleen bij volwassenen met sepsis of septische shock?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/ likely/ unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Xiao 2016 |
Patients were randomized and blindly into sole NE group and NE + TP group |
Unclear |
Unlikely |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Laterre 2019 |
Randomization was stratified by study site, need for mechanical ventilation, baseline NE requirement, and serum creatinine level. The first 200 patients were randomized in a fixed ration of one third placebo and the remainder allocated evenly among the 3 lowest doses of the 4 possible selepressin groups. Thereafter, the probability of randomization to placebo was held constant while a response-adaptive randomization algorithm determined probabilities of allocation to the selepressin groups. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely
97% of dosed patients in selepressin group completed follow-up versus 99% of dozed patients in placebo group |
Unlikely
Adapted intention to treat analysis with population that received the study drug |
|
Hammond 2018 |
Between November 2015 and February 2016, patients who developed septic shock were initiated on norepinephrine monotherapy. Between March 2016 and June 2016, patients who developed septic shock were initiated on norepinephrine at 5 lg/minute and vasopressin at 0.04 units/minute within 4 hours of each other as combination therapy. |
Likely
Method of allocation was based on the month of presentation. |
Unlikely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusie tabel van zoekactie
|
Auteur jaar |
Reden voor exclusie |
|
Lauzier 2006 |
Studie is al opgenomen in SR van McIntyre |
|
Albanese 2005 |
Studie is al opgenomen in SR van McIntyre |
|
Barzegar 2014 |
Studie is al opgenomen in SR van McIntyre |
|
Choudhury 2016 |
Studie is al opgenomen in SR van McIntyre |
|
Gordon 2016 |
Studie is al opgenomen in SR van McIntyre |
|
Russell 2008 |
Studie is al opgenomen in SR van McIntyre |
|
Svoboda 2012 |
Studie is al opgenomen in SR van McIntyre |
|
Russel 2017 |
Studie is al opgenomen in SR van McIntyre |
|
Lauzier 2006 |
Studie is al opgenomen in SR van McIntyre |
|
Albanese 2005 |
Studie is al opgenomen in SR van McIntyre |
|
Barzegar 2014 |
Studie is al opgenomen in SR van McIntyre |
|
Chen 2017 |
Studie is al opgenomen in SR van McIntyre |
|
Choudhury 2016 |
Studie is al opgenomen in SR van McIntyre |
|
Gordon 2016 |
Studie is al opgenomen in SR van McIntyre |
|
Russell 2008 |
Studie is al opgenomen in SR van McIntyre |
|
Svoboda 2012 |
Studie is al opgenomen in SR van McIntyre |
|
Russel 2017 |
Studie is al opgenomen in SR van McIntyre |
|
Lauzier 2006 |
Studie is al opgenomen in SR van McIntyre |
|
Morelli 2009 |
Studie is al opgenomen in SR van McIntyre |
|
Liu 2018 |
Voldoet niet aan PICO: terlipressin before open-label vasopressors. |
|
Hajjar 2019 |
Voldoet niet aan PICO: either NE or vasopressin as first-line vasopressor Therapy, daarna open-label NE. Subgroep met kanker patiënten met zeer hoge mortality rate. |
|
Senatore 2019 |
angiotensin II |
|
Patel 2002 |
Follow-up van 4 uur is te kort |
|
Dunser 2003 |
Voldoet niet aan PICO: patients with both sepsis and post–cardiac surgery vasoplegia, but subgroup data were obtained for atrial fibrillation only, not for other relevant outcomes |
|
Zhu 2019 |
SR alleen terlipressin, voldoet niet aan PICO |
|
Jiang 2019 |
SR overlapt met andere geïncludeerde SR, voldoet niet helemaal aan de PICO |
|
Huang 2020 |
SR alleen terlipressin, voldoet niet aan PICO |
|
Honarm 2020 |
Canadese richtlijn |
|
Chidambaram 2019 |
SR overlapt met andere geïncludeerde SR |
|
Serpa-Neto 2012 |
SR overlapt met andere geïncludeerde SR, voldoet niet helemaal aan de PICO |
|
Cheng 2019 |
NMA voldoet niet aan PICO |
|
Chen 2019 |
NMA voldoet niet aan PICO |
|
Avni 2015 |
Nieuwere SR beschikbaar |
Exclusie tabel van andere artikelen in McIntyre (2018)
|
Auteur jaar |
Reden voor exclusie |
|
Chen 2017 |
Studie is al opgenomen in SR van McIntyre |
|
Fonseca Ruiz 2013 |
Studie is al opgenomen in SR van McIntyre |
|
Hajjar 2017 |
Voldoet niet aan PICO: Vasoplegia after cardiac surgery |
|
Abdullah 2012 |
Paracentesis-induced vasodilatory shock and end-stage liver disease, follow-up van slechts 48hr |
|
Han 2012 |
Pituitrin |
|
Hua 2013 |
Dopamine |
|
Malay 1999 |
Follow-up van 24 uur is te kort |
|
Acevedo 2009 |
Abstract only data |
|
Capoletto 2017 |
Abstract only data |
|
Clem 2016 |
Abstract only data |
|
Oliveira 2014 |
Abstract only data |
|
Prakash 2017 |
Abstract only data |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – maart 2020
|
1 exp *Organ Dysfunction Scores/ or exp *Systemic Inflammatory Response Syndrome/ or sirs.ti,ab. or septic.ti,ab. or bacteremia.ti,ab. or sepsis.ti,ab. or ((bacter* or bacterial or bacteriemic or endotoxi* or toxic or distributive) adj2 shock).ti,ab. or 'sequential organ failure Assessment score'.ti,ab. or 'systemic inflammatory response syndrome'.ti,ab. or sofa.ti,ab. or (blood adj3 poisoning).ti,ab. (193829) 2 (vasopressin* or AVP or lypressin or glypressin or felypressin or ornipressin or argipressin or desmopressin or terlipressin or selepressin or pressinoic acid or argipressinoic acid).ti,ab,kw. (38802) 3 exp Catecholamines/ or (noradrenalin* or norepinephrin* or catecholamin*).ti,ab,kw. (303946) 4 1 and 2 and 3 (452) 5 limit 4 to (english language and yr="2000 -Current") (402) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (437748) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1962226) 8 5 and 6 (38) 9 (5 and 7) not 8 (121) 10 8 or 9 (159) = 159 |
456 |
|
Embase (Elsevier) |
('sequential organ failure assessment score'/exp/mj OR 'systemic inflammatory response syndrome'/exp/mj OR sirs:ti,ab,kw OR septic:ti,ab OR bacteremia:ti,ab OR sepsis:ti,ab OR (((bacter* OR bacterial OR bacteriemic OR endotoxi* OR toxic OR distributive) NEAR/2 shock):ti,ab) OR 'sequential organ failure assessment score':ti,ab OR 'systemic inflammatory response syndrome':ti,ab OR sofa:ti,ab OR ((blood NEAR/3 poisoning):ti,ab)) AND ('vasopressin derivative'/exp OR vasopressin*:ti,ab OR avp:ti,ab OR lypressin:ti,ab OR glypressin:ti,ab OR felypressin:ti,ab OR ornipressin:ti,ab OR argipressin:ti,ab OR desmopressin:ti,ab OR terlipressin:ti,ab OR selepressin:ti,ab OR 'pressinoic acid':ti,ab OR 'argipressinoic acid':ti,ab) AND ('catecholamine'/exp OR noradrenalin*:ti,ab OR norepinephrin*:ti,ab OR catecholamin*:ti,ab) AND (2000-2020)/py AND (english)/lim NOT 'conference abstract'/it
Sytematische reviews ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 72
RCT’s ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 355 Totaal = 427 |
