Type resuscitatievloeistof bij sepsis
Uitgangsvraag
Welk type vloeistof dient te worden gebruikt voor resuscitatie bij volwassen patiënten met (een sterke verdenking op) sepsis of septische shock?
De uitgangsvraag omvat de volgende deelvragen:
- Is er een verschil tussen resuscitatie met kristalloïde vloeistoffen en colloïdale vloeistoffen?
- Zijn hydroxyethyl starch (HES)-vloeistoffen beter/slechter dan andere colloïdale vloeistoffen, inclusief albumine?
- Is er een verschil tussen resuscitatie met gebalanceerde kristalloïde vloeistoffen en NaCl 0,9%?
Aanbeveling
Gebruik kristalloïde infuusvloeistoffen voor de resuscitatie van patiënten met sepsis of septische shock.
Albumine heeft geen meerwaarde voor de resuscitatie van patiënten met sepsis of septische shock, mede gezien de hogere kosten.
Gebruik geen colloïde infuusvloeistoffen, anders dan albumine, voor de resuscitatie van patiënten met sepsis of septische shock.
Overweeg het gebruik van gebalanceerde kristalloïde infuusvloeistoffen bij de resuscitatie bij patiënten met sepsis of septische shock.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit geen van de studies blijkt er een verschil in overleving bij het gebruik van colloïden in vergelijking met kristalloïden bij patiënten met (verdenking op) sepsis en septische shock.
Er lijken wel meer patiënten met (verdenking op) sepsis en septische shock acuut nierfalen te ontwikkelen en nierfunctievervangende therapie nodig te hebben bij gebruik van colloïden in vergelijking met kristalloïden.
Het is niet duidelijk of de beademingsduur en de IC- en ziekenhuisopnameduur verschillend is bij patiënten met sepsis of septische shock die behandeld zijn met colloïden of kristalloïden.
Uit geen van de studies blijkt er een verschil in overleving tussen gelatine- of dextraanbevattende infuusvloeistoffen en kristalloïden bij patiënten met sepsis en septische shock. Er zijn geen vergelijkende studies over acuut nierfalen, starten van nierfunctievervangende therapie, beademingsduur, IC- en ziekenhuisopnameduur.
Bij de vergelijking tussen albumine en kristalloïden bij patiënten met sepsis of septische shock lijkt er geen verschil in mortaliteit, acuut nierfalen, starten van nierfunctievervangende therapie, beademingsduur en opnameduur op de IC of ziekenhuis.
Er is mogelijk een iets betere niet-significante overleving bij de behandeling met gebalanceerde kristalloïden in vergelijking met ongebalanceerde kristalloïden maar geen verschil over het starten van nierfunctievervangende therapie. Er zijn geen studies die hebben gekeken naar acuut nierfalen, beademingsduur en IC- en ziekhuisopnameduur.
Albumine geeft bij patiënten met sepsis of septische shock mogelijk een iets betere overleving en er is mogelijk minder nierfunctievervangende therapie nodig in vergelijking met HES-vloeistoffen. Er zijn geen studies die hebben gekeken naar het effect op acuut nierfalen, beademingsduur en IC- en ziekenhuisopnameduur.
Er zijn geen vergelijkende studies die hebben gekeken naar het verschil tussen HES- en dextraanbevattende infusievloeistoffen bij patiënten met sepsis en septische shock.
Er lijkt geen verschil in mortaliteit en het starten van nierfunctievervangende therapie tussen HES- en gelatinebevattende infuusvloeistoffen bij sepsis en septische shock. Er zijn geen studies die hebben gekeken naar beademingsduur en IC- en ziekenhuisopnameduur.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het gebruik van colloïden zou mogelijk vaker tot acuut nierfalen en de noodzaak tot starten van nierfunctievervangende therapie leiden in vergelijking met kristalloïden zonder dat dit een gunstig effect heeft op de overleving, beademingsduur of IC- en ziekenhuisopnameduur.
Kosten (middelenbeslag)
Colloïden geven geen betere uitkomst dan kristalloïden maar zijn wel duurder.
Aanvaardbaarheid voor de overige relevante stakeholders
In de praktijk worden colloïde infuusvloeistoffen reeds weinig gebruikt. Er zal vooral een afweging gemaakt moeten worden tussen gebalanceerde en ongebalanceerde kristalloïde infuusvloeistoffen.
Haalbaarheid en implementatie
Er lijken geen haalbaarheidsproblemen, de onderzochte infuusvloeistoffen worden nu al gebruikt in de ziekenhuizen.
Aanbeveling-1
Rationale/ balans tussen de argumenten voor en tegen de interventie
Het gebruik van colloïde infuusvloeistoffen voor resuscitatie van patiënten met sepsis of septische shock geeft geen verbeterde overleving, kortere beademingsduur en IC- of ziekenhuisopname maar, behoudens albumine, mogelijk vaker acuut nierfalen en de noodzaak voor het starten van nierfunctievervangende therapie dan het gebruik van kristalloïde infuusvloeistoffen.
Er is geen verschil in gebruik van albumine versus kristalloïde infuusvloeistoffen in geen van de parameters maar albumine is wel duurder.
Aanbeveling-2
Rationale/ balans tussen de argumenten voor en tegen de interventie
Er is mogelijk een betere overleving bij het gebruik van gebalanceerde kristalloïde infuusvloeistoffen ten opzichte van ongebalanceerde kristalloïde infuusvloeistoffen bij de resuscitatie van patiënten met sepsis of septische shock, maar geen verschil op het ontwikkelen van acuut nierfalen, het starten van nierfunctievervangende therapie en IC of ziekenhuis opnameduur.
Onderbouwing
Achtergrond
De resultaten en conclusies zijn voor de overzichtelijkheid opgesplitst in I. kristalloïden versus colloïdale vloeistoffen (en HES versus andere colloïdale vloeistoffen, inclusief albumine) en II. Gebalanceerde versus niet-gebalanceerde kristalloïden.
Bij patiënten met een septische shock is een van de speerpunten van de behandeling naast adequate antibiotica een optimale vloeistofresuscitatie. Er is nog veel discussie over welke vloeistof hierbij het beste is.
De volgende definities worden aangehouden voor de verschillende resuscitatievloeistoffen in deze module:
- Kristalloïdenvloeistoffen bevatten kleine moleculen zoals elektrolyten of niet-geïoniseerde stoffen zoals glucose of mannitol.
- Ongebalanceerde kristalloïdevloeistoffen bevatten alleen NaCl.
- Gebalanceerde kristalloïde vloeistoffen bevatten naast NaCl ook alkaliserende stoffen en benaderen daardoor beter de samenstelling van extracellulair vocht.
- Dextraan-bevattende vloeistoffen bevatten grote polysachariden moleculen gevormd uit glucose.
- Colloïdale vloeistoffen bevatten grote moleculen die niet of moeilijk de bloedvaten kunnen verlaten.
- Hydroxyethyl starch (HES)-vloeistoffen zijn colloïdale vloeistoffen die zetmeel bevatten.
- Gelatinevloeistoffen zijn colloïdale vloeistoffen die synthetische colloïdale stoffen bevatten.
- Albumine-bevattende vloeistoffen zijn colloïdale vloeistoffen die in tegenstelling tot de andere colloïdale vloeistoffen bereid zijn uit humaan plasma
Conclusies / Summary of Findings
1. Kristalloïden versus colloïden
1.1.1 HES-vloeistoffen versus kristalloïden: mortaliteit
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in mortaliteit na 28 dagen en na 90 dagen tussen behandeling met HES-vloeistoffen vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Rochwerg, 2014) |
1.1.2 HES-vloeistoffen versus kristalloïden: acuut nierfalen
|
Redelijk GRADE |
Er is waarschijnlijk meer acuut nierfalen na behandeling met HES-vloeistoffen vergeleken met kristalloïden bij patiënten met sepsis of septische shock (zoals bij 1.1.3).
Bronnen: (Serpa-Neto, 2014) |
1.1.3 HES-vloeistoffen versus kristalloïden: nierfunctievervangende therapie
|
Redelijk GRADE |
Er is waarschijnlijk meer nierfunctievervangende therapie nodig na behandeling met HES-vloeistoffen vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Serpa-Neto, 2014; Rochwerg, 2015) |
1.1.4 HES-vloeistoffen versus kristalloïden: beademingsduur
|
Zeer laag GRADE |
Het is onzeker of er een verschil in beademingsduur is bij behandeling met HES-vloeistoffen vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Brunkhorst, 2008) |
1.1.5 HES-vloeistoffen versus kristalloïden: verblijfsduur IC/ziekenhuis
|
Laag GRADE |
Er is mogelijk geen verschil in verblijfsduur zowel op de IC als in het ziekenhuis bij behandeling met HES-vloeistoffen vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Brunkhorst, 2008; Guidet, 2012; McIntyre, 2008) |
1.2.1 Gelatines versus kristalloïden: mortaliteit
|
Zeer laag GRADE |
Het is onzeker of er een verschil is in mortaliteit bij behandeling met gelatines vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Rochwerg, 2014) |
1.2.2 Gelatines versus kristalloïden: overige uitkomstmaten
|
- GRADE |
De uitkomsten voor acuut nierfalen, nierfunctievervangende therapie, beademingsduur en IC en ziekenhuis verblijfduur bij behandeling met gelatines vergeleken met kristalloïden bij patiënten met sepsis of septische shock zijn onbekend. Geen van de studies rapporteert dit. |
1.3.1 Dextranen versus kristalloïden: mortaliteit
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil in mortaliteit is bij behandeling met dextranen vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018) |
1.3.2 Dextranen versus kristalloïden: overige uitkomstmaten
|
- GRADE |
De uitkomsten voor acuut nierfalen, nierfunctievervangende therapie, beademingsduur en IC en ziekenhuis verblijfduur bij behandeling met dextranen vergeleken met kristalloïden bij patiënten met sepsis of septische shock zijn onbekend. Geen van de studies rapporteert dit. |
1.4.1 Albumine versus kristalloïden: mortaliteit
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in mortaliteit na 28 en 90 dagen bij behandeling met albumine vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018) |
1.4.2 Albumine versus kristalloïden: acuut nierfalen
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in het aantal patiënten met acuut nierfalen na behandeling met albumine vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Caironi, 2004) |
1.4.3 Albumine versus kristalloïden: nierfunctievervangende therapie
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in het starten van nierfunctievervangende therapie bij behandeling met albumine vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018) |
1.4.4 Albumine versus kristalloïden: beademingsduur
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in beademingsduur na de behandeling met albumine vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Caironi, 2004) |
1.4.5 Albumine versus kristalloïden: verblijfsduur IC/ziekenhuis
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in verblijfsduur, zowel op de IC als in het ziekenhuis, na de behandeling met albumine vergeleken met kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Lewis, 2018; Caironi, 2004) |
1.5.1 HES versus albumine: mortaliteit
|
Redelijk GRADE |
Er is waarschijnlijk een reductie in mortaliteit in het voordeel van albumine bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2014) |
1.5.2 HES versus albumine: nierfunctievervangende therapie
|
Laag GRADE |
Er is mogelijk een verschil in het starten van nierfunctievervangende therapie in het voordeel van albumine bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2015) |
1.5.3 HES versus albumine: overige uitkomstmaten
|
- GRADE |
De uitkomsten voor acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfduur bij behandeling met HES vergeleken met albumine bij patiënten met sepsis of septische shock zijn onbekend. Geen van de studies rapporteert dit. |
1.6 HES versus dextranen: alle uitkomstmaten
|
- GRADE |
Geen van de studies rapporteert over de vergelijking tussen de behandeling met HES versus dextranen, voor geen van de relevante uitkomstmaten bij patiënten met sepsis of septische shock. |
1.7.1 HES versus gelatines: mortaliteit
|
Laag GRADE |
Er is mogelijk geen verschil in mortaliteit bij de behandeling met HES vergeleken met gelatines bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2014) |
1.7.2 HES versus gelatines: nierfunctievervangende therapie
|
Laag GRADE |
Er is mogelijk geen verschil in het starten van nierfunctievervangende therapie na de behandeling met HES vergeleken met gelatines bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2015) |
1.7.3 HES versus gelatines: overige uitkomstmaten
|
- GRADE |
De uitkomsten voor acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfduur bij behandeling met HES versus gelatines bij patiënten met sepsis of septische shock zijn onbekend. Geen van de studies rapporteert dit. |
2. Gebalanceerde kristalloïden versus ongebalanceerde kristalloïden
2.1 Gebalanceerde kristalloïden versus ongebalanceerde kristalloïden: mortaliteit
|
Laag GRADE |
Er is mogelijk een klein verschil in mortaliteit bij behandeling met gebalanceerde kristalloïden vergeleken met ongebalanceerde kristalloïden, in het voordeel van gebalanceerde kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2014) |
2.2 Gebalanceerde kristalloïden versus ongebalanceerde kristalloïden: nierfunctievervangende therapie
|
Laag GRADE |
Mogelijk is er geen verschil in het starten van nierfunctievervangende therapie na behandeling met gebalanceerde kristalloïden vergeleken met ongebalanceerde kristalloïden bij patiënten met sepsis of septische shock.
Bronnen: (Rochwerg, 2014) |
2.3 Gebalanceerde kristalloïden versus ongebalanceerde kristalloïden: overige uitkomstmaten
|
- GRADE |
De uitkomsten voor acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfduur bij behandeling met gebalanceerde kristalloïden vergeleken met ongebalanceerde kristalloïden bij patiënten met sepsis of septische shock zijn onbekend. Geen van de studies rapporteert dit. |
Samenvatting literatuur
Beschrijving studies
In de systematische Cochrane literatuurreview van Lewis (2018) werden kristalloïden vergeleken met colloïden voor vitaal bedreigde patiënten waarbij er een noodzaak was tot vloeistofresuscitatie. Er werd gezocht naar relevante literatuur tot en met februari 2018. Voor deze literatuursamenvatting zijn alleen de studies meegenomen waarin expliciet volwassen (16 jaar of ouder) sepsispatiënten (apart) werden beschreven, dit waren in totaal negentien studies. De precieze populatie, gebruikte vloeistoffen en doseringen per studie staan vermeld in de evidencetabel. Mortaliteit en nierfunctievervangende therapie werden meegenomen als relevante uitkomstmaten voor deze literatuursamenvatting (Lewis, 2018).
Voor een aantal studies binnen de review van Lewis (2018) is het zo dat er in de kristalloïden-groep colloïden zijn gegeven tijdens of voorafgaand aan de studieperiode.
Waar nodig zijn voor een aantal losse studies uit de review van Lewis data meegenomen uit de originele artikelen. Dit betrof de studies Brunkhorst (2008); McIntyre (2008); Guidet (2012); Finfer (2004) en Caironi (2014). Deze studies rapporteerden over de uitkomstmaten beademingsduur en IC- en ziekenhuis verblijfsduur. Dit werd niet meegenomen in de review van Lewis (2018). De losse resultaten zijn in de evidencetabel van Lewis (2018) toegevoegd en niet in losse evidencetabellen per artikel.
Rochwerg (2014) heeft een netwerk meta-analyse uitgevoerd voor mortaliteit met veertien RCT’s (18916 deelnemers) vanwege het grote aantal relevante vloeistoffen en het gebrek aan directe vergelijking tussen deze vloeistoffen, met name voor de vergelijking gebalanceerde kristalloïden versus ongebalanceerde kristalloïden. Een netwerk meta-analyse maakt ook gebruik van informatie afkomstig uit indirecte vergelijkingen tussen interventies en geeft een completer beeld van de relatieve effectiviteit van de behandelopties. Hierbij moet wel rekening worden gehouden met een eventueel verminderde betrouwbaarheid van effectschattingen die geheel of gedeeltelijk zijn gebaseerd op indirecte data.
In figuur 1 zijn de twee netwerken voor de 4-knoops-analyse en 6-knoops-analyse getoond.
Effectschattingen worden weergegeven samen met een 95% geloofwaardigheidsinterval (credibility interval, CrI), de Bayesiaanse tegenhanger van het 95% betrouwbaarheidsinterval (BI): er is 95% kans dat het ware effect in het geloofwaardigheidsinterval ligt (Rochwerg, 2014).
Voor de uitwerking in deze literatuursamenvatting is een selectie gemaakt uit de vergelijkingen. De volgende vergelijkingen zijn meegenomen uit de 4- en 6-knoops-analyses:
- HES-vloeistoffen versus kristalloïden (4-knopen).
- Albumine versus kristalloïden (4-knopen).
- Gelatinevloeistoffen versus kristalloïden (4-knopen).
- Albumine versus HES-vloeistoffen (4-knopen).
- Gelatinevloeistoffen versus zetmeelbevattende vloeistoffen (4-knopen).
- Gebalanceerde kristalloïden versus 0.9% NaCl (6-knopen).
Rochweg (2015) heeft eenzelfde netwerk meta-analyse, met dezelfde vergelijkingen, uitgevoerd maar dan voor de uitkomstmaat nierfunctievervangende therapie. In totaal werden er voor deze studie tien studies geïncludeerd (6664 patiënten) (Rochwerg, 2015).
In de review van Serpa-Neto (2014) werd onder andere acuut nierfalen meegenomen als uitkomstmaat. Verder overlapte de review met de recentere Cochrane review van Lewis (2018). Eén studie uit Serpa-Neto (2014) werd geëxcludeerd voor deze literatuursamenvatting want dit betrof een cohortstudie met een voor- en nameting en geen RCT (Serpa-Neto, 2014).
Figuur 1 A Netwerk voor 4-knoops-analyse; B. Netwerk voor 6-knoops-analyse
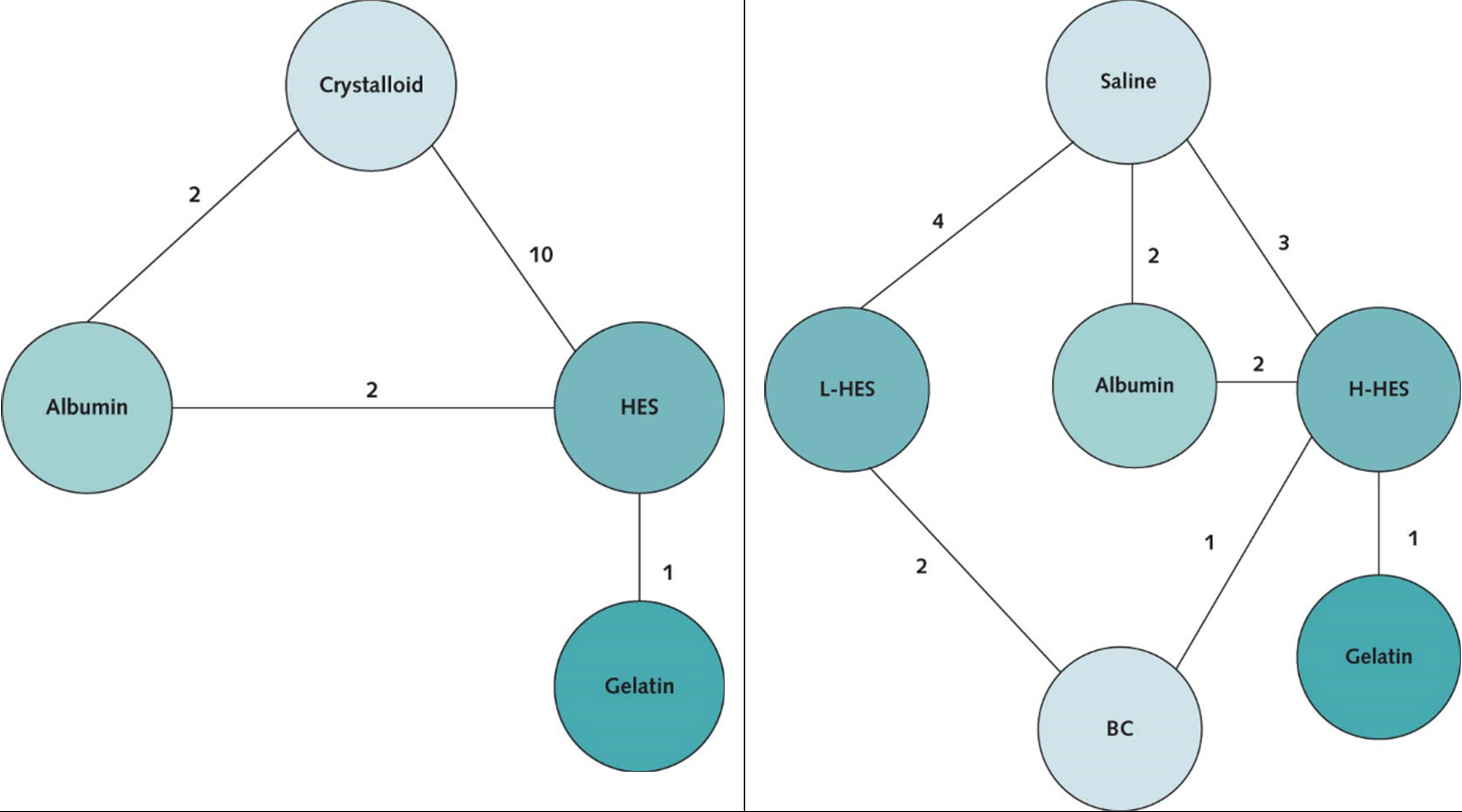
Bron: Rochwerg, 2014. BC = balanced crystalloid; H-HES = high-molecular-weight hydroxyethyl starch; L-HES = low-molecular-weight hydroxyethyl starch
Resultaten kristalloïden versus colloïden
1. Kristalloïden versus colloïden
De vergelijking tussen alle kristalloïden en colloïden is niet gemaakt voor deze literatuuranalyse, er is gekozen om dit op te delen in een aantal categorieën, zoals hieronder beschreven.
1.1 HES-vloeistoffen versus kristalloïden
1.1.1 Mortaliteit
Voor deze vergelijking zijn alle studies bij volwassen sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018) meegenomen. In totaal rapporteerden twaalf studies, met in totaal 4.821 patiënten, over mortaliteit met verschillende follow-up tijden tot 90 dagen. De follow-up duren zijn aangegeven in de voetnoten van figuur 6 en de evidencetabel. In totaal was de mortaliteit 31,4% in de HES-vloeistoffen groep en 32,4% in de kristalloïden groep. Op basis van de meta-analyse was er geen statistisch significant en geen klinisch relevant verschil in mortaliteit tussen de patiënten die HES-vloeistoffen kregen toegediend vergeleken met kristalloïden. (RR 0,97 (95% BI 0,84 tot 1,12 (figuur 2).
In figuur 3 en 4 is de mortaliteit na 28 en 90 dagen gepresenteerd. Vergelijkbare resultaten werden gevonden. Voor mortaliteit na 90 dagen werd een RR gevonden van 1,10 (95% BI 0,97 tot 1,24), dit is niet significant, maar mogelijk wel een klinisch relevant verschil in het voordeel van kristalloïden.
In de netwerk meta-analyse van Rochwerg (2014) grotendeels dezelfde studies, met directe en indirecte vergelijkingen is een verschil gevonden voor mortaliteit na verschillende follow-up duren bij HES-vloeistoffen vergeleken met kristalloïden in het voordeel van de kristalloïden, dit is niet significant, maar mogelijk wel een klinisch relevant verschil (NMA estimate, 1,13 (95% CrI 0,99 tot 1,30).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische trials start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking HES-vloeistoffen versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de studie opzet (risk of bias: colloïden werden in meerdere studies vooraf of tijdens de studie ook in de kristalloïden groep gegeven). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
Figuur 2 Mortaliteit tot einde follow-up vergelijking HES-vloeistoffen versus kristalloïden
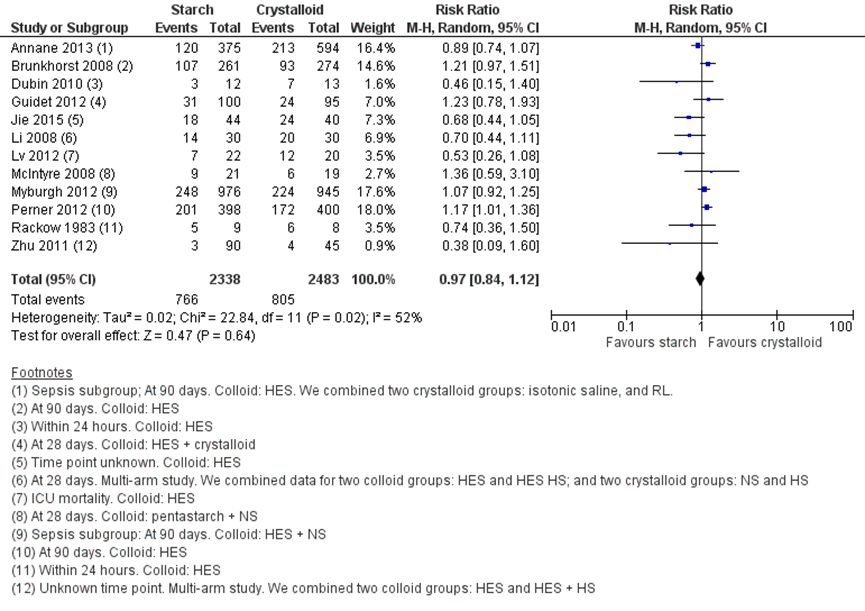
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 3 Mortaliteit na 28 dagen follow-up vergelijking HES-vloeistoffen versus kristalloïden
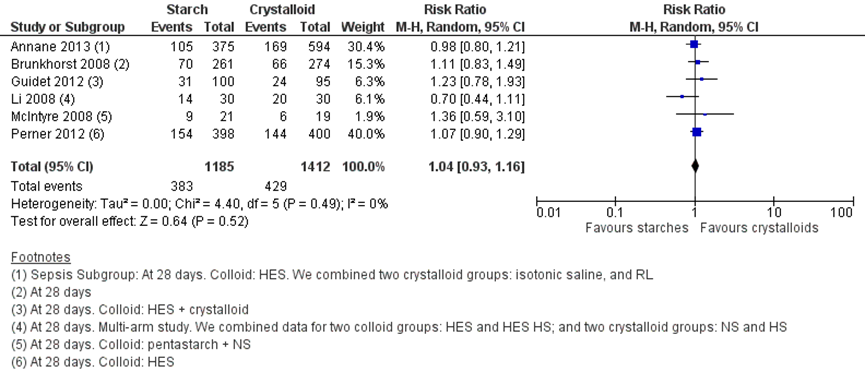
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 4 Mortaliteit na 90 dagen follow-up vergelijking HES-vloeistoffen versus kristalloïden
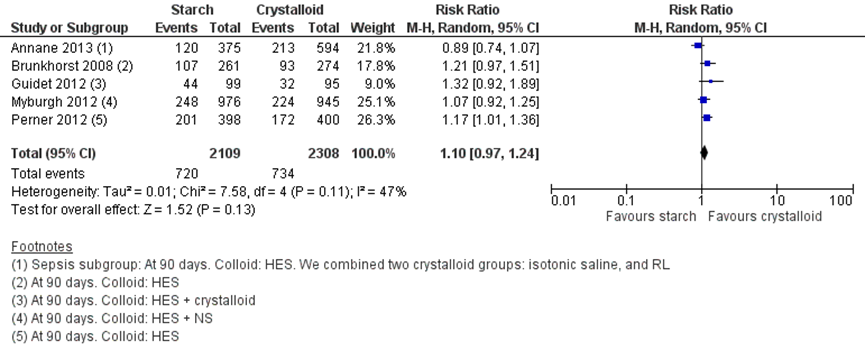
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
1.1.2 Acuut nierfalen
In de review van Serpa-Neto (2014) is de uitkomstmaat acuut nierfalen gerapporteerd door drie studies, met in totaal 1531 patiënten. In totaal kregen 32,1% patiënten in de zetmeelbevattende vloeistoffen groep acuut nierfalen en 24,5% in de kristalloïden groep. Op basis van de meta-analyse was er een statistisch significant verschil in acuut nierfalen tussen de patiënten die HES-vloeistoffen kregen toegediend vergeleken met kristalloïden in het voordeel van de kristalloïden (RR 1,31 (95% BI 1,11 tot 1,54), number needed to harm (NNH)=13,2 (7,7 tot 34,5) (figuur 5). Guidet (2012) en Perner (2012) keken naar de Acute Kidney Injury Network (AKIN) classificatie voor de ernst van acuut nierfalen, in de HES-groep kwam uiteindelijk meer AKIN III (meest ernstig) voor. Brunkhorst (2008) definieerde acuut nierfalen als een verdubbeling in het baseline serum creatinine level of de noodzaak voor nierfunctievervangende therapie. Perner (2012) definieerde acuut nierfalen als een renale SOFA-score ≥ 2 (plasma creatinine level > 1,9 mg per deciliter of urine < 500 ml per dag).
Figuur 5 Acuut nierfalen vergelijking HES-vloeistoffen versus kristalloïden
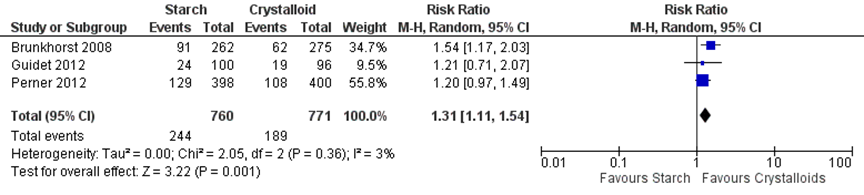
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische trials start ‘hoog’. De bewijskracht voor de uitkomstmaat acuut nierfalen bij de vergelijking HES-vloeistoffen versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering, colloïden werden in meerdere studies vooraf of tijdens de studie ook in de kristalloïden groep gegeven). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.1.3 Nierfunctievervangende therapie
Voor deze vergelijking zijn alle studies met sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018) meegenomen, dit is aangevuld met resultaten uit de Siegemund Basel Starch Evaluation in Sepsis (BaSES) trial uit de review van Serpa-Neto (2014). In totaal rapporteerden zeven studies, met in totaal 3803 patiënten, over nierfunctievervangende therapie. In totaal was de nierfunctievervangende therapie gestart in 17,7% van de HES-vloeistoffen groep en 15,2% in de kristalloïden groep. Op basis van de meta-analyse was er een statistisch significant verschil in nierfunctievervangende therapie tussen de patiënten die HES-vloeistoffen kregen toegediend vergeleken met kristalloïden in het voordeel van de kristalloïden, (RR 1,29 (95% BI 1,02 tot 1,63), NNT=23,3 (11 tot 333) (figuur 6).
In de netwerk meta-analyse van Rochwerg (2015) met grotendeels dezelfde studies werd een iets groter verschil gevonden in het voordeel van de kristalloïden met enkel directe vergelijkingen (NMA estimate, 1,39 (95% CrI 1,17 tot 1,66).
Figuur 6 Nierfunctievervangende therapie vergelijking HES-vloeistoffen versus kristalloïden
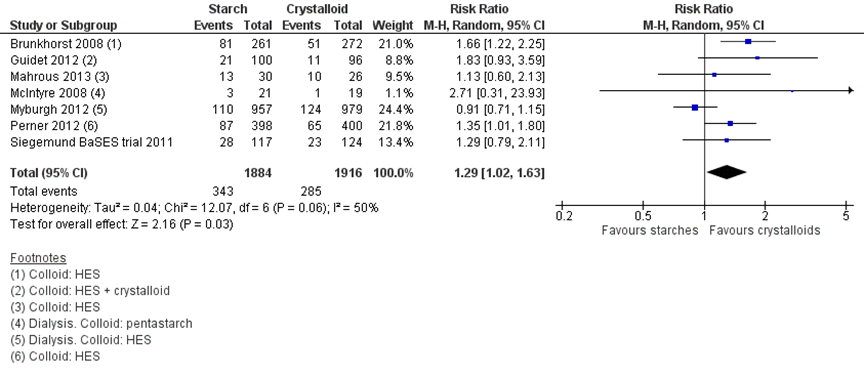
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische trials start ‘hoog’. De bewijskracht voor de uitkomstmaat nierfunctievervangende therapie bij de vergelijking HES-vloeistoffen versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering; en colloïden werden in meerdere studies vooraf of tijdens de studie ook in de kristalloïden groep gegeven). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.1.4 Beademingsduur
Brunkhorst (2008) vond geen significant verschil (p=0,06) in het mediaan aantal beademingsvrije dagen tussen de HES-groep en de Ringer’s Lactate-groep, respectievelijk was de mediaan 3 (IQR 1 tot 7) en 2 (IQR 1 tot 6) dagen.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat beademingsduur bij de vergelijking HES-vloeistoffen versus kristalloïden is met twee niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering en colloïden werd vooraf of tijdens de studie ook in de kristalloïden groep gegeven) en één niveau vanwege de imprecisie (slechts één studie met medianen). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
1.1.5 Verblijfsduur IC/ziekenhuis
In totaal rapporteerden drie studies over verblijfsduur in de IC en/of het ziekenhuis.
Brunkhorst (2008) vond geen significant verschil (p=0,32) in het mediaan aantal IC dagen tussen de HES-groep en de Ringer’s Lactate-groep, respectievelijk 14 (IQR 7 tot 28) en 16 (IQR 8 tot 28) dagen.
McIntyre (2008) rapporteerde kortere verblijfsduren op de IC, maar ook geen significante mediaan tussen de Pentastarch-groep en de NaCL-groep, respectievelijk 5 (IQR 1 tot 13) en 7,5 (IQR 3 tot 13), p=0,33. Eenzelfde resultaat werd gezien bij mediane ziekenhuis verblijfsduur, respectievelijk 20 (IQR 12 tot 33) en 19 (IQR 10 tot 27) dagen, p=0,86.
Guidet (2012) rapporteerde ook geen significant gemiddeld verschil tussen de HES-groep en de NaCL-groep in IC-verblijfsduur (mean 15,4 ± 11,1 dagen versus 20,2 ± 22,2 dagen) en verblijfsduur in het ziekenhuis (mean 37,7 ± 26,5 dagen versus 42,7 ± 31,6 dagen).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat verblijfsduur bij de vergelijking HES-vloeistoffen versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering in één studie en colloïden werden in één studie vooraf of tijdens de studie ook in de kristalloïden groep gegeven) en één niveau vanwege de imprecisie. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
1.2.Gelatines versus kristalloïden
1.2.1 Mortaliteit
Voor deze vergelijking zijn de studies met sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018) meegenomen. In totaal rapporteerde slechts één studie (Annane, 2013), met in totaal 709 patiënten, over mortaliteit na 90 dagen. In totaal was de mortaliteit 30,8% in de gelatinesgroep en 35,4% in de kristalloïden-groep. Er was geen statistisch significant en geen klinisch relevant verschil in mortaliteit tussen de patiënten die gelatines kregen toegediend vergeleken met kristalloïden (in dit geval isotonic saline en Ringer’s lactate) (RR 0,87 (95% BI 0,67 tot 1,14)).
In de netwerk meta-analyse (NMA) van Rochwerg (2014) met één indirecte vergelijking werd een NMA estimate gevonden van 1,24 in het voordeel van kristalloïden met een wijd geloofwaardigheidsinterval (95% CrI 0,61 tot 2,55).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking zetmeelbevattende vloeistoffen versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: colloïden werden vooraf of tijdens de studie ook in de kristalloïden groep gegeven) en met twee niveaus verlaagd vanwege de imprecisie (één studie en betrouwbaarheid en geloofwaardigheidsinterval overlapt grens van klinische relevantie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
1.2.2 Overige uitkomstmaten
Voor de uitkomstmaten acuut nierfalen, nierfunctievervangende therapie, beademingsduur en IC en ziekenhuis verblijfsduur zijn geen studies geïncludeerd.
1.3. Dextranen versus kristalloïden
1.3.1 Mortaliteit
Voor deze vergelijking zijn de studies met sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018), meegenomen. In totaal rapporteerden twee kleine studies, met in totaal 60 patiënten over mortaliteit na een niet gerapporteerde follow-up periode. Er was geen statistisch significant en geen klinisch relevant verschil in mortaliteit tussen de patiënten die dextranen kregen toegediend vergeleken met kristalloïden. (RR 0,49 (95% BI 0,20 tot 1,21).
Figuur 7 Mortaliteit vergelijking dextranen versus kristalloïden
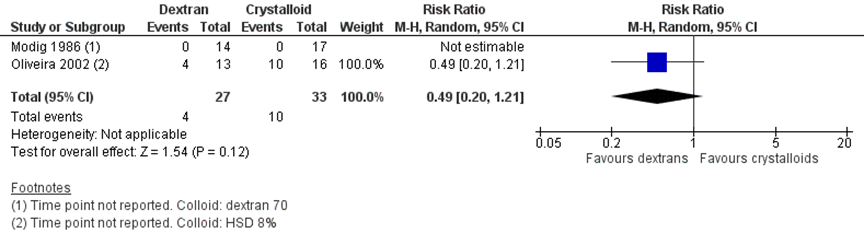
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking dextranen versus kristalloïden is met één niveau vanwege beperkingen in de onderzoeksopzet (risk of bias: mogelijke selectie bias) en met twee niveaus verlaagd vanwege de imprecisie. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
1.3.2 Overige uitkomstmaten
Voor de uitkomstmaten acuut nierfalen, nierfunctievervangende therapie, beademingsduur en IC en ziekenhuis verblijfsduur zijn geen studies geïncludeerd.
1.4. Albumine versus kristalloïden
1.4.1 Mortaliteit
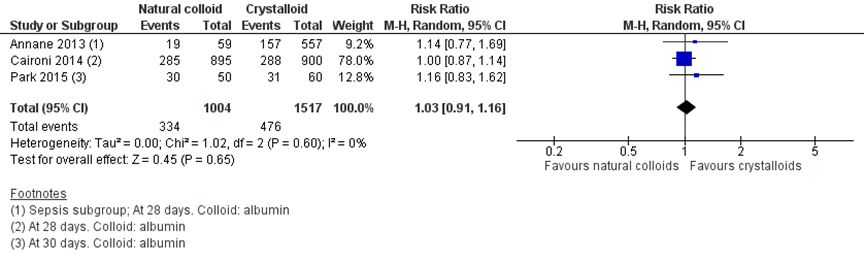
Voor deze vergelijking zijn de studies met sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018) meegenomen. In totaal rapporteerden zes studies, met in totaal 3762 patiënten over mortaliteit na verschillende follow-up duren. In totaal was de mortaliteit 37,0% in de albuminegroep en 39,3% in de kristalloïdengroep. Er was geen statistisch significant en geen klinisch relevant verschil in mortaliteit tussen de patiënten die albumine kregen toegediend vergeleken met kristalloïden. (RR 0,94 (95% BI 0,86 tot 1,02). (figuur 8) In figuur 9 en 10 is de mortaliteit na 28 en 90 dagen gepresenteerd waarbij vergelijkbare resultaten werden gevonden.
In de netwerk meta-analyse van Rochwerg (2014) met directe en indirecte vergelijkingen werd een NMA-schatting van 0,83 (95% CrI 0,65 tot 1,04) gevonden, in het voordeel van albumine vergeleken met kristalloïden.
Figuur 8 Mortaliteit tot einde follow-up vergelijking albumine versus kristalloïden
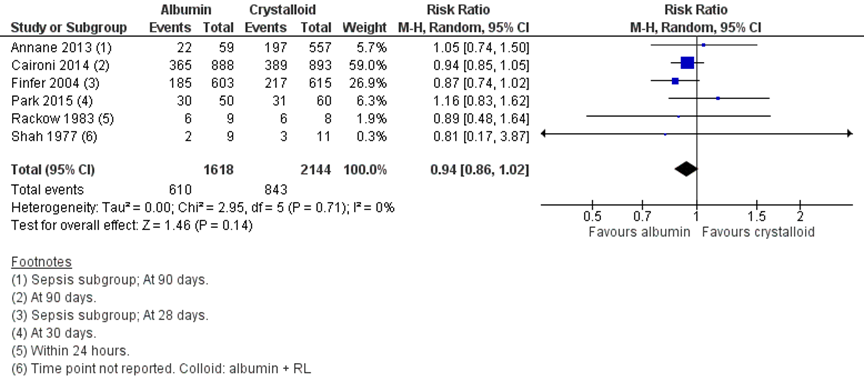
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 9 Mortaliteit na 28 dagen follow-up vergelijking albumine versus kristalloïden
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Figuur 10 Mortaliteit na 90 dagen follow-up vergelijking albumine versus kristalloïden
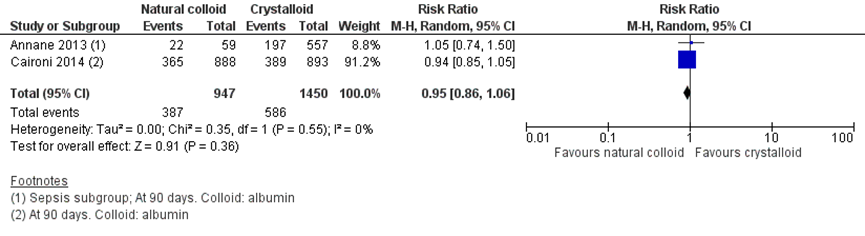
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking albumine versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: albumine werd in meerdere studies vooraf of tijdens de studie ook in de kristalloïden groep gegeven). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.4.2 Acuut nierfalen
Eén studie rapporteerde over acuut nierfalen, Caironi (2014) met in totaal 1818 patiënten. Er was geen statistisch significant en geen klinisch relevant verschil in mortaliteit tussen de patiënten die albumine kregen toegediend vergeleken met kristalloïden(RR 0,97 (95% BI 0,81 tot 1,16)).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat acuut nierfalen bij de vergelijking albumine versus kristalloïden is met één niveau vanwege de imprecisie. Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.4.3 Nierfunctievervangende therapie
Voor deze vergelijking zijn alle studies met sepsispatiënten of een apart beschreven sepsis populatie uit de review van Lewis (2018) meegenomen. In totaal rapporteerden twee studies, met in totaal 3028 patiënten, over nierfunctievervangende therapie. In totaal was er nierfunctievervangende therapie gestart bij 22,3% van de patiënten in de albumine-groep en 20,1% in de kristalloïden-groep. Op basis van de meta-analyse was er geen statistisch significant en klinisch relevant verschil in nierfunctievervangende therapie tussen de patiënten die albumine kregen toegediend vergeleken met kristalloïden in het voordeel van de kristalloïden, (RR 1,11 (95% BI 0,96 tot 1,27 (figuur 11).
In de netwerk meta-analyse van Rochwerg (2015), met dezelfde studies werd een vergelijkbaar resultaat gepresenteerd met een direct en indirecte vergelijkingen (NMA estimate, 1,04 (95% CrI 0,78 tot 1,38).
Figuur 11 Nierfunctievervangende therapievergelijking albumine versus kristalloïden
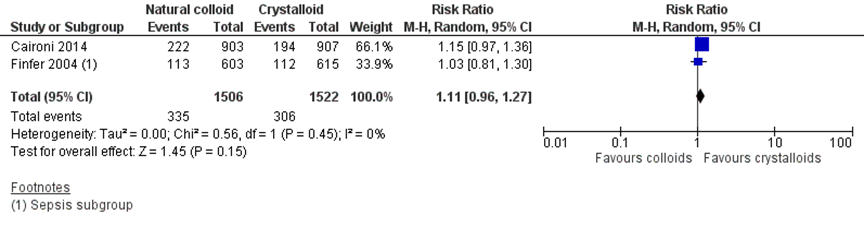
Z: p-waarde van het gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat nierfunctievervangende therapie bij de vergelijking albumine versus kristalloïden is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: albumine werd in meerdere studies vooraf of tijdens de studie ook in de kristalloïden groep gegeven). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.4.4 Beademingsduur
Caironi (2004) vond geen statistisch significant en geen klinisch relevant verschil in het aantal dagen aan de mechanische ventilator; mediaan 6 (IQR 2 tot 14) dagen in de albumine groep en 6 (IQR 2 tot 13) dagen in de kristalloïden groep, p=0,50.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat beademingsduur bij de vergelijking albumine versus kristalloïden is met één niveau verlaagd vanwege de imprecisie (slechts één studie met medianen). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.4.5 IC en ziekenhuis verblijfsduur
Caironi (2004) vond geen statistisch significant en klinisch relevant verschil in het aantal verblijfsdagen op de IC en in het ziekenhuis; respectievelijk mediaan 9 (IQR 4 tot 18) dagen in de albumine-groep en 9 (IQR 4 tot 17) dagen in de kristalloïden-groep, p=0,42 en mediaan 20 (IQR 10 tot 36) dagen in de albumine-groep en 20 (IQR 9 tot 38) dagen in de kristalloïden-groep, p=0,65.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat verblijfsduur bij de vergelijking albumine versus kristalloïden is met één niveau vanwege de imprecisie (slechts één studie met medianen). Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.5. HES versus Albumine
1.5.1 Mortaliteit
Er zijn twee studies met een directe vergelijking gevonden in de netwerk meta-analyse van Rochwerg (2014); hier zijn resultaten van indirecte vergelijkingen aan toegevoegd. In de netwerk meta-analyse is een NMA-schatting gepresenteerd van 0,73 (95% BI 0,56 tot 0,95). Het risico op overlijden is 27% lager bij gebruik van albumine in vergelijking met HES-vloeistoffen. Deze reductie is een mogelijk klinisch relevant verschil.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking HES versus albumine is met één niveau verlaagd vanwege indirectheid. Het niveau van de bewijskracht komt uit op GRADE ‘redelijk’.
1.5.2 Nierfunctievervangende therapie
Er zijn geen studies met een directe vergelijking gevonden in de netwerk meta-analyse van Rochwerg (2015), hieraan zijn wel indirecte vergelijkingen toegevoegd. In de netwerk meta-analyse is een NMA-schatting gepresenteerd van 0,74 (95% BI 0,53 tot 1,04) in het voordeel van albumine (vergeleken met nierfunctievervangende therapie); dit is niet significant, maar mogelijk wel klinisch relevant verschil.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat nierfunctievervangende therapie bij de vergelijking HES versus albumine is met één niveau verlaagd vanwege de imprecisie en één niveau vanwege indirectheid. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
1.5.3 Overige uitkomstmaten
Voor de uitkomstmaten acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfsduur zijn geen studies geïncludeerd.
1.6 HES versus dextranen
Er zijn geen studies geïncludeerd voor deze vergelijking.
1.7 HES versus gelatines
1.7.1 Mortaliteit
Er is één studie met een directe vergelijking gevonden in de netwerk meta-analyse van Rochwerg (2014), hieraan zijn geen indirecte vergelijkingen toegevoegd. In de netwerk meta-analyse is een NMA-schatting gepresenteerd van 1,10 (0,54 tot 2,22) in het voordeel van HES-vloeistoffen, dit is een niet-significant en niet-klinisch relevant verschil.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking HES versus dextranen is met twee niveaus verlaagd vanwege de imprecisie. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
1.7.2 Nierfunctievervangende therapie
Er is één studie met een directe vergelijking gevonden in de netwerk meta-analyse van Rochwerg (2015), hieraan zijn geen indirecte vergelijkingen toegevoegd. In de netwerk meta-analyse is een NMA-schatting gepresenteerd van 0,75 (0,30 tot 1,81) in het voordeel van gelatine, dit is een niet significant en niet klinisch relevant verschil.
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking HES versus dextranen is met één niveau verlaagd vanwege beperkingen in de studieopzet (risk of bias: ontbreken van blindering) en één niveau verlaagd vanwege de imprecisie. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
1.7.3 Overige uitkomstmaten
Voor de uitkomstmaten acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfsduur zijn geen studies geïncludeerd.
Resultaten gebalanceerde kristalloïden versus ongebalanceerde kristalloïden
2. Gebalanceerde kristalloïden versus ongebalanceerde kristalloïden
2.1 Mortaliteit
Er zijn geen studies gevonden die deze vergelijkingen direct onderzoeken, echter in de netwerk meta-analyse van Rochwerg (2014) is er wel een inschatting gemaakt op basis van indirecte vergelijkingen. Een niet-significante, maar mogelijk klein klinisch relevant verschil voor mortaliteit in het voordeel van de gebalanceerde kristalloïden werd gevonden, NMA estimate van 0,78 (95% CrI 0,58 tot 1,05) (Rochwerg, 2014).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat mortaliteit bij de vergelijking gebalanceerde kristalloïden versus ongebalanceerde kristalloïden is met één niveau verlaagd vanwege imprecisie (weinig studies en geloofwaardigheidsinterval overlapt met grenzen van klinische relevantie) en één niveau vanwege indirectheid. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
2.2 Nierfunctievervangende therapie
Er zijn geen studies gevonden die deze vergelijkingen direct onderzoeken, echter in de netwerk meta-analyse van Rochwerg (2015) is er wel een inschatting gemaakt op basis van indirecte vergelijkingen. Een niet-significante en niet klinisch relevante relevant verschil in het voordeel van de gebalanceerde kristalloïden werd gevonden, NMA estimate van 0,85 (95% CrI 0,56 tot 1,30) (Rochwerg, 2015).
Bewijskracht van de literatuur
De bewijskracht voor gerandomiseerde klinische studies start ‘hoog’. De bewijskracht voor de uitkomstmaat nierfunctievervangende therapie bij de vergelijking gebalanceerde kristalloïden versus ongebalanceerde kristalloïden is met één niveau verlaagd vanwege imprecisie (weinig studies en geloofwaardigheidsinterval overlapt met grenzen van klinische relevantie) en één niveau vanwege indirectheid. Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
2.3 Overige uitkomstmaten
Voor de uitkomstmaten acuut nierfalen, beademingsduur en IC en ziekenhuis verblijfsduur zijn geen studies geïncludeerd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 1 en 2 zijn samen onderzocht binnen één literatuursearch (PICO 1 en 3):
Wat zijn de (on)gunstige effecten van kristalloïden vergeleken met colloïden, of gebalanceerde kristalloïden vergeleken met ongebalanceerde kristalloïden bij volwassen patiënten met (verdenking op) sepsis of septische shock op de gedefinieerde uitkomstmaten?
Voor de deelvraag 1 over HES-vloeistoffen was de zoekvraag (PICO 2):
Wat zijn de (on)gunstige effecten van HES vergeleken met andere colloïden, inclusief albumine, bij volwassen patiënten met (verdenking op) sepsis of septische shock op de gedefinieerde uitkomstmaten?
PICO 1
P: patiënten van 18 jaar of ouder met (verdenking op) sepsis of septische shock;
I: kristalloïden;
C: colloïden;
O: mortaliteit, acuut nierfalen, nierfunctievervangende therapie, beademingsvrije dagen, Intensive Care (IC) en ziekenhuisverblijfsduur.
PICO 2
P: patiënten van 18 jaar of ouder met (verdenking op) sepsis of septische shock;
I: HES;
C: andere colloïden, inclusief albumine;
O: mortaliteit, acuut nierfalen, nierfunctievervangende therapie, beademingsvrije dagen, IC- en ziekenhuisverblijfsduur.
PICO 3
P: patiënten van 18 jaar of ouder met (verdenking op) sepsis of septische shock;
I: gebalanceerde kristalloïden;
C: ongebalanceerde kristalloïden;
O: mortaliteit, acuut nierfalen, nierfunctievervangende therapie, beademingsvrije dagen, IC- en ziekenhuisverblijfsduur.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming cruciale uitkomstmaat en acuut nierfalen, nierfunctievervangende therapie, beademingsduur, en IC- en ziekenhuisverblijfsduur voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Tenzij anders vermeld werden de door de internationale GRADE-werkgroep voorgestelde standaard grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 31 oktober 2018 met relevante zoektermen gezocht naar Engelstalige systematische reviews en gerandomiseerde gecontroleerde studies over kristalloïden al dan niet vergeleken met colloïden bij sepsispatiënten. In een tweede search is in de databases Medline (via OVID) en Embase (via Embase.com) op 31 oktober 2018 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde gecontroleerde trials waarin HES-vloeistoffen werden vergeleken met andere colloïden bij sepsispatiënten. Beide zoekverantwoordingen zijn weergegeven onder het tabblad Verantwoording. De eerste literatuurzoekactie leverde 286 treffers op, de tweede literatuurzoekactie leverde 72 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde gecontroleerde studies met één of meer vergelijkingen zoals in de PICO beschreven. Op basis van titel en abstract werden in eerste instantie 45 studies voorgeselecteerd voor PICO 1 en 3. Na raadpleging van de volledige tekst, werden vervolgens 41 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Op basis van titel en abstract werden in eerste instantie vijf studies voorgeselecteerd voor PICO 2. Na raadpleging van de volledige tekst, werden vervolgens alle vijf studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording). Voor het beantwoorden van PICO 2 zijn echter wel twee netwerk meta-analyses (NMA) uit de geselecteerde studies van PICO 1 en 3 meegenomen.
Resultaten
Vier onderzoeken zijn opgenomen in de literatuuranalyse, allen systematische literatuur reviews. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, Roberts I. Colloids versus crystalloids for fluid resuscitation in critically ill people. Cochrane Database Syst Rev. 2018 Aug 3;8:CD000567. doi: 10.1002/14651858.CD000567.pub7.
- Rochwerg B, Alhazzani W, Sindi A, Heels-Ansdell D, Thabane L, Fox-Robichaud A, Mbuagbaw L, Szczeklik W, Alshamsi F, Altayyar S, Ip WC, Li G, Wang M, Wludarczyk A, Zhou Q, Guyatt GH, Cook DJ, Jaeschke R, Annane D; Fluids in Sepsis and Septic Shock Group. Fluid resuscitation in sepsis: a systematic review and network meta-analysis. Ann Intern Med. 2014 Sep 2;161(5):347-55. doi: 10.7326/M14-0178. Review.
- Rochwerg B, Alhazzani W, Gibson A, Ribic CM, Sindi A, Heels-Ansdell D, Thabane L, Fox-Robichaud A, Mbuagbaw L, Szczeklik W, Alshamsi F, Altayyar S, Ip W, Li G, Wang M, Włudarczyk A, Zhou Q, Annane D, Cook DJ, Jaeschke R, Guyatt GH; FISSH Group (Fluids in Sepsis and Septic Shock). Fluid type and the use of renal replacement therapy in sepsis: a systematic review and network meta-analysis. Intensive Care Med. 2015 Sep;41(9):1561-71. doi: 10.1007/s00134-015-3794-1. Epub 2015 Apr 23. Review.
- Serpa Neto A, Veelo DP, Peireira VG, de Assunção MS, Manetta JA, Espósito DC, Schultz MJ. Fluid resuscitation with hydroxyethyl starches in patients with sepsis is associated with an increased incidence of acute kidney injury and use of renal replacement therapy: a systematic review and meta-analysis of the literature. J Crit Care. 2014 Feb;29(1):185.e1-7. doi:10.1016/j.jcrc.2013.09.031. Epub 2013 Oct 22. Review.
Evidence tabellen

Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Welk type vloeistof dient te worden gebruikt voor resuscitatie bij volwassen patiënten met (een sterke verdenking op) sepsis of septische shock?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Lewis, 2018
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to February 2018
A: Annane, 2013 B: Brunkhorst, 2008 C: Caironi, 2004 D: Dubin, 2010 E: Finfer, 2004 F: Guidet, 2012 G: Jie, 2015 H: Li, 2008 I: Lv, 2012 J: Mahrous, 2013 K: McIntyre, 2008 L: Modig, 1986 M: Myburgh, 2012 N: Oliveira, 2002 O: Park, 2015 P: Perner, 2012 Q: Rackow, 1983 R: Shah, 1977 S: Zhu, 2011
Study design: All RCT (parallel) One quasi RCT (Modig, 1986)
Setting and Country: A: ICU; France, Belgium, Canada, Algeria, Tunisia B: ICU; Germany C: ICU; Italy D: ICU; Argentina E: ICU; Australia and New Zealand F: Hospital; Germany and France G: Hospital; China H: Hospital; China I: Hospital; China J: Hospital; Saudi Arabia K: Hospital; Canada L: Hospital; Sweden M: ICU; Australia and New Zealand N: Hospital; Brazil O: Hospital; Brazil P: ICU; Denmark, Norway, Finland and Iceland Q: Hospital; USA R: Hospital; USA S: ICU; China
Source of funding: A: French Ministry of Health B: German Federal Ministry of Education and Research and by unrestricted grants from B Braun, HemoCue and Novo Nordisk C: Italian Medicines Agency D: Agencia Nacional de Promoción Científica y Tecnológica, Argentina E: Auckland District Health Board and the Health Research Council of New Zealand F: Fresenius Kabi, Germany. The pharmaceutical company was involved in the study design, analysis and preparation of the report G: None reported H: not reported in abstract I: not reported in abstract J: None reported K: unrestricted funds from Bristol Myers Squibb and Edwards Life Sciences to conduct trial. Also unrestricted funds from Abbott Laboratories L: Swedish National Defense Research Institute, Swedish Association against Heart and Chest Diseases, and the Laerdal Foundation M: National Health and Medical Research Council of Australia, and by unrestricted grants from NewSouthWales Ministry of Health, and Fresenius Kabi (supplied study fluids and distributed them to sites). N: The Wellcome Trust O: none reported P: Danish research Council. Study fluids supplied free of charge by B Braun Q: American Critical Care R: National Institute of General Medical Sciences S: none reported
|
Inclusion criteria SR: -studies that compared a colloid (suspended in any crystalloid solution) versus a crystalloid -The following colloids: starches; dextrans; gelatins; albumin or fresh frozen plasma (FFP).We included crystalloids of different electrolyte compositions (isotonic or hypertonic). -parallel-design randomised controlled trials (RCTs) and quasi-randomised studies
Exclusion criteria SR: -randomised cross-over trials -randomised cross-over trials -studies in which a colloid was given in both groups of participants -studies in which the colloid was given to replace a known nutritional deficiency (for example, given for hypoalbuminaemia), or was given as a preloading solution before surgery. - studies in which fluids were given to people with head injury to control intracranial pressure.
69 studies included For our purpose we only included studies with sepsis patients or for which separate sepsis data could be retrieved and with relevant outcomes for this review.
Important patient characteristics at baseline: N; mean age ± SD (Co/Cr) A: 1414/1443 ; median (IQR): 63 (50-76) yrs / median (IQR): 50 (36-65) yrs (not only sepsis) Recruitment for the study was stopped early because study authors noted no difference mortality rates (pre-specified with triangular test) B: 262/275; 64.4 (± 13.3) yrs; 64.9 (± 14.1) years Study was stopped early, at the first planned safety analysis, because intensive insulin therapy was associated with a significantly increased rate of severe hypoglycemic events and a trend toward a prolonged stay in the ICU. C: 90s/907; median (IQR): 70 (57-77) yrs/ 69 (59-77) years D: 12/13; 62 (± 21) yrs/ 65 (± 12) yrs E: 3497/3500; 58.6 (± 19.1) yrs; 58.5 (± 18.7) yrs (not only sepsis) F: 100/ 96; 65.8 (± 15.4) yrs/ 65.9 (± 14.7) yrs G: 44/40; 65.7 (± 15.1) yrs / 64.7 (± 13.7) years H: 15/15; 44.8 (± 23.7) years (HES); 46.0 (± 22.2) years (HES with HS) /38.6 (± 19.5) years (NS); 50.2 (± 28.4) years (HS) I: 22/20; 65.7 (± 15.1) yrs/64.7 (± 13.7) yrs J: 30/26 ; age not reported (abstract only) K: 21/19 ; 63.1 (± 13.1) yrs/ 63.6 (± 16.3) yrs L: 14/ 17; 37 (range 18-56) ; yrs/40 (range 22-60) yrs M: 3500/3500 ; 63.1 (± 17.0) yrs/ 62.9 (± 16.9) yrs (not only sepsis) N: 13/16 ; 43.7 yrs/47.9 yrs O: 50/60 ; 63 (range 57-70) yrs/ 61 (range 51-71) yrs P: 400/400 ; median (IQR): 66 (56-75) yrs/ median (IQR): 67 (56-76) yrs Q: 9/9 ; 78.7 yrs / 78.2 yrs R: 9/11 ; range: 19-71 yrs / 19-74 yrs S: 45/45 ; 59.9 (± 9.4) yrs / 59.4 (± 8.8) yrs
Groups comparable at baseline? A: Yes B: Yes C: slight imbalance in the number of patients with organ dysfunction and values of central venous oxygen saturation D: Yes E: albumin group had a higher CVP at baseline F: Yes G: Largely comparable H: Largely comparable I: No details. Abstract only J: No details. Abstract only K: Baseline characteristics were similar between groups with the exception of the need for organ support at baseline. Fewer patients in the saline group (versus pentastarch group) were on a vasopressor at baseline. L: Yes M: Yes N: participants in the colloids group were younger, with statistically significantly lower APACHE II scores. O: No details. Abstract only P: Yes Q: larger number of male participants in the colloids group. However, overall numbers of participants were few and we assumed that gender differences would not influence outcome data R: Yes S: Yes
Participant condition: A: acute hypovolaemia, sepsis, and trauma (only results of sepsis patients included) B: severe sepsis or septic shock C: severe sepsis D: sepsis E: various ICU admissions (to include trauma, sepsis, ARDS) (only results of sepsis patients included) F: severe sepsis G: septic shock H: septic shock I: severe sepsis or septic shock J: severe sepsis or septic shock K: septic shock L: severe traumatic shock M: requiring fluid resuscitation in the ICU (to include trauma, sepsis, brain injury) (only results of sepsis patients included) N: severe sepsis O: patients with cancer and septic shock P: severe sepsis Q: septic or hypovolaemic shock R: severe multiple trauma and shock (SBP < 90 mmHg) S: severe sepsis
Contamination of fluids between arms: A: 47.5% of participants in the crystalloid group were given colloids within 12 h before the start of the Study B: 26.6% of participants in the crystalloid group were given colloids during the study period C: In colloids group were given crystalloids whenever clinically indicated by attending physician D;- E: 3.9% of participants in the saline group were given albumin in the previous 72 h; this represents few participants and it is not likely to have introduced significant bias. However, some participants were given additional resuscitation fluids during the study period according to clinician preference, and numbers for this were not reported. F:- G: Not much details, data from English abstract only. Article in Chinese. H: Not much details, data from English abstract and google translate. Article in Chinese I: Not much details, data from English abstract only. Article in Chinese J: Not much details, data from abstract only. K:- L: - M: 15% of participants in each group had HES before start of study N:- O: Not much details, data from abstract only. P: Most participants in each group received other fluids (study authors listed other fluids as crystalloids, nutrition, water, fluid with medications, synthetic colloids, and albumin); Q: - R:- S: Not much details, data from English abstract only. Article in Chinese. See intervention arms. |
Describe intervention: colloids
A: colloids, any type from 4% gelatin, 5% albumin, dextrans, HES, 20% or 25% albumin; at discretion of local investigators; not > 30 mL/kg/d; median in first 7 days 2000 mL (IQR, 1000 mL-3502 mlL; median 2 d duration B: 10% pentastarch; HES 200/0.5 with 0.9% NS; to achieve CVP 8 mmHg, MAP > 70 mmHG or central venous oxygen saturation > 70%; given for up to 96 h C: 20% albumin; 300 mL; fluids administered according to the “early-goal directed therapy” protocol; administered from day 1 until day 28 or ICU discharge to maintain serum concentration ≥ 30 g/L; given crystalloids whenever clinically indicated by attending physician D: 6% HES 130/0.4 (Voluven); early goal-directed therapy; administered to achieve CVP 8-12 mmHg, MAP > 65 mmHg, and ScV02 ≥ 70% E: 4% albumin; volume determined by treating clinicians F: 6% HES 130/0.4; maximum dose 50 mL/kg/day on day 1, then 25 mL/kg/day from day 2-day 4; to ensure sufficient hydration, additional crystalloid infusions given in ratio of 1:2 G: HES 130/0.4 H-1: HES H-2: HES + HS I:HES 130/0.4 J: HES 130/0.4 (Voluven) K: pentastarch; after maximum dose given, open-label 500 mL boluses of NS given for remaining 12 h; thereafter type and quantity dictated by treating physician L: 0.5 L dextran 70 daily for 7-8 days after initial shock treatment M: 6% HES 130/0.4; treating clinicians determined the initial and subsequent volumes and the rate of administration of resuscitation fluid, depending on clinical signs and subsequent response to fluid administration; maximum dose of 50 mL/kg of body weight/h, followed by open-label 0.9% NS for remainder of 24-h period; for all fluid resuscitation in the ICU, until ICU discharge, death or 90 days after randomisation. study fluid was stopped in participants who were treated with any mode of RRT. In these participants, treatment with saline was recommended, but any other fluid, apart from HES, was permitted. The administration of resuscitation fluids outside the ICU was not controlled. N: 7.5% NaCl in dextran 8% 70; 250 mL; 10-min infusion via central venous catheter O: albumin 4%; bolus of solution; started within 12 h of ICU admission P: 6% HES (Tetraspan) 130/0.4; 33 mL/kg/ideal body weight; if doses > maximum daily dose were required then unmasked Ringer’s acetate Q: 6% hetastarch; 250 mL every 15 min until WP = 15 mmHg; thereafter fluid given to maintain WP at 15 mmHg for next 24 h R: 5% salt-poor albumin in RL alternated with equal volumes of RL; to maintain stroke work index of left ventricle > 5 x 10 dynes-cm/m² or pulmonary WP > 10 mmHg S-1: HES: RL followed by 500 mL 6% HES 130.0.4 S-2: HES+HS: RL followed by 4 mL/kg 7.5% HS and 500 mL 6% HES 130/0.4
|
Describe control: crystalloids
A: crystalloids, any type; at discretion of local investigator; median for first 7 days 3000 mL (IQR, 500 mL-5200 mL); median 2 d duration B: RL; to achieve CVP 8 mmHg, MAP > 70 mmHg or central venous oxygen saturation > 70%; given for up to 96 h C: no details of crystalloid solution or administration D: 0.9% saline; early goal directed therapy: administered to achieve CVP 8-12 mmHg, MAP > 65 mmHg, and ScV02 ≥ 70% E: 0.9% NaCl; volume determined by treating clinicians F: 0.9% NaCl; maximum dose 50 mL/kg/day on day 1, then 25 mL/kg/day from day 2-day 4; to ensure sufficient hydration, additional crystalloid infusions given in ratio of 1:2 G: RL H-1: NS H-2: HS I:Ringer’s Lactate (RL) J:RL K: Details: not stated, we have assumed from information in the study report that it was 0.9% NS; administered in 500 mL boluses according to prespecified algorithm; maximum of 28 mL/kg (or 3000 mL) during 12-h period; after maximum dose given, open-label 500 mL boluses of NS given for remaining 12 h; thereafter type and quantity dictated by treating physician L: Ringer’s acetate; 1.0 L-1.5 L Ringer’s acetate for 7-8 days after initial shock treatment M: 0.9% NS; volume determined by treating clinicians. N: 0.9% NS; 250 mL; 10-min infusion via central venous catheter O: RL P: Ringer’s acetate; 33 mL/kg/ ideal body weight; if doses > maximum daily dose were required then used unmasked Ringer’s acetate Q: 5% human serum albumin; 250 mL every 15 min until WP = 15 mmHg; thereafter fluid given to maintain WP at 15 mmHg for next 24 h R: RL; to maintain stroke work index of left ventricle > 5 x 10 dynes-cm/m² or pulmonary WP > 10 mmHg S: RL only
|
End-point of follow-up:
A: mortality at 28 and 90 days and at ICU and hospital discharge. B: mortality at 28 and 90 days C: mortality at 28 and 90 days D: mortality (time point not reported) E: mortality 28 days F: mortality 28 days G: mortality (time point unknown) H: mortality 28 days I: mortality (time point not reported) J: mortality 28 days, however, mortality data was not included from this report, which were reported as percentages; we could not be certain whether the data were for all randomised participants or whether some participant data were lost. K: mortality 28 days L: mortality (time point not reported) M: mortality 28 days N: mortality (time point not reported) O: mortality (30 days, 90 days, in the ICU) P: mortality (at 28 days, and at 90 days) Q: mortality (within 24 h) R: mortality (time point not reported) S: mortality (time point not reported)
For how many participants were no complete outcome data available? (intervention/control) A: 0/0 B: 0/0 C: 0/0 D: 0/0 E: 26/41 losses- mostly because of withdrawal of surrogate consent F: 0/1 G: 0/0 H: 0/0 I: 0/0 J: not reported K: 0/0 L: 0/0 M: 142/116 (not only sepsis) N: 0/0 O: 0/0 P: 2/0 Q: 0/0 R: 0/0 S: 0/0
|
See publication for outcome measures and effect size
|
Brief description of author’s conclusion
Using starches, dextrans, albumin or FFP (moderate-certainty evidence), or gelatins (low-certainty evidence), versus crystalloids probably makes little or no difference to mortality. Starches probably slightly increase the need for blood transfusion and RRT (moderate-certainty evidence), and albumin or FFP may make little or no difference to the need for renal replacement therapy (low-certainty evidence). Evidence for blood transfusions for dextrans, and albumin or FFP, is uncertain. Similarly, evidence for adverse events is uncertain. Certainty of evidence may improve with inclusion of three ongoing studies and seven studies awaiting classification, in future updates. |
|
Rochwerg, 2014 |
See publication for more detail |
|
|
|
|
|
|
|
Rochwerg, 2015 |
See publication for more detail |
|
|
|
|
|
|
|
Serpa-Neto, 2014 |
See publication for more detail |
|
|
|
|
|
|
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wittbrodt 2013 |
Voldoet niet aan PICO: QoL is geen relevante uitkomstmaat |
|
Brunkhorst 2008 |
Wordt meegenomen via andere geincludeerde systematische review |
|
McIntyre 2008 |
Wordt meegenomen via andere geincludeerde systematische review |
|
Asfar 2017 |
Geen origineel onderzoek: correctie |
|
Ichai 2003 |
Pdf (nog) niet beschikbaar, waarschijnlijk geen origineel onderzoek |
|
Winters, 2017 |
Gegevens in systematische review zijn niet volledig en daardoor niet bruikbaar |
|
Silversides, 2017 |
conservative fluid versus liberal fluid management, voor PICO 6B? |
|
Owyang 2015 |
Geen origineel onderzoek: Commentaar |
|
Lira 2014 |
Beschrijvende review |
|
Jiang 2014 |
Overlap met andere reviews en voldoet niet goed aan PICO: Albumin versus other fluids |
|
Zhong 2013 |
JA voor PICO 2 |
|
Leitch 2013 |
Overlap met andere reviews en voldoet niet goed aan PICO: Albumin versus other fluids |
|
Tollefson 2012 |
Geen origineel onderzoek: Commentaar |
|
Groeneveld 2011 |
Verouderde review, data niet bruikbaar |
|
Delaney 2011 |
Verouderde meta-analyse, overlap met andere reviews |
|
Cook 2004 |
Geen origineel onderzoek: Editorial |
|
Hasibeder 2002 |
Geen origineel onderzoek: Commentaar |
|
Osborn 2017 |
Beschrijvende review, voldoet niet aan PICO: over fluid bolus |
|
Muller 2016 |
Voldoet niet aan PICO: geen relevante uitkomstmaten (endothelial damage and coagulation impairment) |
|
Correa 2016 |
Beschrijvende review |
|
Wiedermann 2015 |
Beschrijvende review |
|
Correa 2015 |
Beschrijvende review |
|
Perner 2014 |
Voldoet niet aan PICO: geen relevante uitkomstmaat (long-term mortality after 1 year) |
|
Orbegozo 2014 |
Geen origineel onderzoek: beschrijft de CRYSTAL trial, Annane, 2013 (journal club) |
|
Finfer 2015 |
Beschrijvende review |
|
Cortes 2014 |
Geen origineel onderzoek: beschrijft de CRYSTAL trial, Annane, 2013 (journal club) |
|
Banks 2014 |
Review van één paper (appraisal) |
|
Myburgh 2013 |
Beschrijvende review |
|
Finfer 2013 |
Beschrijvende review |
|
Bagshaw 2013 |
Geen origineel onderzoek: beschrijft twee andere trials/commentary |
|
Annane 2013 |
Wordt meegenomen via andere geincludeerde systematische review |
|
McIntyre 2012 |
Wordt meegenomen via andere geincludeerde systematische review |
|
Dubin 2010 |
Wordt meegenomen via andere geincludeerde systematische review |
|
Singh 2009 |
Beschrijvende review |
|
Wagner 2008 |
Geen origineel onderzoek: Editorial |
|
Xun Fang 2008 |
Voldoet niet aan PICO: geen relevante uitkomstmaten (cardiac function) |
|
Thomas 2008 |
Geen origineel onderzoek: Commentaar |
|
Fang 2008 |
Dubbelpublicatie |
|
Kreimeier 2002 |
Geen origineel onderzoek: Commentaar |
|
Bagshaw 2006 |
Beschrijvende review/editorial |
|
Molnar 2004 |
Vodloet niet aan PICO: geen relevante uiktomstmaten (ITBVI, cardiac index, |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-01-2020
Beoordeeld op geldigheid : 26-03-2020
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Type resuscitatievloeistof |
NIV |
2020 |
2025 |
Eens in de vijf jaar |
NIV |
- |
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De ontwikkeling van deze richtlijn wordt gefaseerd doorlopen en opgeleverd. Op dit moment wordt alleen Sepsis fase 1 opgeleverd. Later wordt het ontwikkeltraject voor Sepsis fase 1 uitgebreid met fase 2 en 3. Er wordt naar gestreefd om de gehele richtlijn in 2021 af te ronden.
In fase 1 zijn de thema’s vroege herkenning, diagnostiek en eerste behandeling (vloeistofrecusatie en zuurstoftoediening) reeds behandeld.
In het vervolgtraject komen fase 2 en 3 aan bod en worden samengevoegd tot één richtlijn. Deze omvatten de volgende thema’s:
- Fase 2 (behandeling): vasopressoren en/of inotropica, nierfunctievervangende therapie, transfusiebeleid, sedatiemethode en delier.
- Fase 3 (nazorg en aandacht voor langetermijngevolgen voor de patiënt): (vroeg)mobilisatie, voeding, aandacht voor langetermijneffecten, revalidatie, voorlichting en begeleiding van patiënt en/of naasten.
Aan het einde van het gehele traject wordt er een overkoepelende gezamenlijke module over de organisatie van zorg/randvoorwaarden opgeleverd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een discipline overstijgende evidence-based richtlijn te ontwikkelen, gericht op de vroegtijdige herkenning, diagnose, (initiële) behandeling, monitoring, nazorg en revalidatie van patiënten met (dreigende) sepsis.
Met deze richtlijn kan de kwaliteit van de sepsiszorg worden verbeterd en gewaarborgd, met als doel minder sepsis gerelateerde morbiditeit en mortaliteit.
Doelgroep
Deze richtlijn wordt geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met (dreigende) sepsis in de ziekenhuiszorg.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met sepsis te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht NVIC
- Drs. A. Klijn, AIOS Spoedeisende geneeskunde, Westfriesgasthuis te Hoorn, NVSHA
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. D. Snijders, longarts, Spaarne Gasthuis te Haarlem en te Hoofddorp, NVALT
- Dr. A.K. van der Bij, arts-microbioloog, Diakonessenhuis te Utrecht, NVMM
- I. Nutma, patiëntenvertegenwoordiger (Stichting Family and Patient Centered Intensive Care (FCIC))/ IC connect
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-SEH
- M. Hoogendoorn, kwaliteitsmedewerker Vakgroep Anesthesiologie & Intensive Care, Isala, beleidsmedewerker Raad van Bestuur, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, senior onderzoeker Sector Verplegingswetenschap afdeling Interne Geneeskunde en senior onderzoeker Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Prof. dr. D. van de Beek, neuroloog, Amsterdam UMC locatie AMC te Amsterdam, NVN
- Drs. O.J.D. Snieders, uroloog, Diakonessenhuis, te Utrecht/Zeist/Doorn en St. Antonius ziekenhuis, te Utrecht/Nieuwegein, NVU
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten (voorzitter) |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede, Medisch Hoofd IC, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald:
|
Participatie als onderzoeker in lC sepsis trials (b.v. AKPA-ART 123 trombomoduline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau lnteractie dat voor vele wetenschappelijke verenigingen congressen organiseert. Bestaande activiteiten rond sepsis lopen al meer dan 10 jaar en door de richtlijn zullen deze niet wijzigen.
|
Geen actie |
|
S. Sankatsing |
internist-infectioloog/internist-acute geneeskunde in het Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van Internist Infectiologen (NVII)
Lid Commissie Richtlijnen Nederlandse Internisten Vereniging (NIV) |
Geen |
Geen actie |
|
M. de Regt |
Internist Acute Geneekunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam (sinds april 2019, daarvoor in UMCU) |
Geen |
Geen |
Geen actie |
|
L. Derde |
Intensivist UMC Utrecht |
Co-lead WP5 PREPARE Lid NVVM influenza richtlijn Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia) Voorzitter van de Clinical Training Committee (CTC) van ESICM. Faculty ESICM masterclass sepsis and severe infections. |
Betrokken bij onderzoek dat door EU wordt gefinancierd: 1. Co-lead van WP5 PREPARE project (EU FP7 funded): doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC 2. Lid International Trial Steering Committee, European Regional Management Committee en diverse domein-specifieke werkgroepen van REMAP-CAP. REMAP-CAP is de internationale overkoepelende studie waarvan PREPARE-WP5 het Europese deel is. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Op moment van tekenen is er geen industrie-betrokkenheid. |
Geen actie |
|
A. Klijn |
AIOS SEG in het Dijklander Ziekenhuis te Hoorn |
Buitengewoon lid richtlijnen commissie van de NVSHA, onbetaald. |
Geen |
Geen actie |
|
R. Schellaars |
intensivist, Ziekenhuis Gelderse Vallei, Ede |
bestuurslid SIC-NVA |
Geen |
Geen actie |
|
R. Wilting |
chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen actie |
|
D. Snijders |
longarts, medisch manager vakgroep longziekten Spaarne Gasthuis |
Docent Inholland, opleiding EHLH verpleegkundige, vergoeding. Lid richtlijn bronchiëctasieën NVALT, vergoeding. |
Geen |
Geen actie |
|
A. van der Bij |
Arts-microbioloog, werkzaam bij het Diakonessenhuis/Medisch Specialistisch Bedrijf Domstad (MSBD) Utrecht |
voorzitter van de Commissie Kwaliteitsbevordering van de NVMM. |
Geen |
Geen actie |
|
I. Nutma |
- Ex-patiënt, voormalig verpleegkundige, auteur van Septische shock en Sepsis en daarna. - Ervarings-professional. Eigenaar van Sepsis en daarna. - Mede-initiatiefnemer van de website www.opeenicliggen.nl; overgegaan in icconnect.nl
|
- Werkzaamheden op het gebied van voorlichting (Lezingen, lessen, workshops), begeleiding (huisbezoek, telefonische consulten) en advisering (bij onderzoek, richtlijnen, etc.) geschieden, betaald. - Mede-initiatiefnemer van de website opeenicliggen.nl, inmiddels overgegaan in de website icconnect.nl, onbetaald -Lid werkgroep ervaringsdeskundigen FCIC/IC-connect tot jan. 2019, onbetaald - beheerder (sinds ’17) online sepsis- lotgenotenplatform, onbetaald - organisator Sepsis Lotgenoten Dag, (vanaf 2018), onbetaald |
Geen |
Geen actie |
|
V. Bon |
Verpleegkundig Specialist SEH (18 uur/week) OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam (12uur/week) |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen actie |
|
M. Hoogendoorn |
Kwaliteitsmedewerker Vakgroep Anesthsesiologie & Intensive Care, Isala, Zwolle (0,5 FTE) Beleidsmedewerker Raad van Bestuur, Isala, Zwolle (0,5 FTE) |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen actie |
|
E. Ista |
universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
universitair Docent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijne V&VN, Utrecht (onbetaald) |
|
Geen actie |
|
R. Jansen |
100% dienstverband als klinisch geriater Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amsteracademie voor verschillende verpleegkundigen opleidingen (betaald). |
Honoraria van Bayer, Boehringer en BMS voor houden lezingen, webTV, etc over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen actie |
|
D. van de Beek |
Neuroloog, Amsterdam UMC, locatie AMC |
Consultancy GSK malaria vaccin (betaald aan werkgever, AMC) |
Geen |
Geen actie |
|
O. Snieders |
functioneel uroloog maatschap Urologen voor U (diakonessenhuis utrecht/zeist/doorn en st. antonius ziekenhuis utrecht/nieuwegein) |
lid calamiteiten onderzoeksgroep (COG) diakonessenhuis (betaald) penningmeester regiomaatschap (onbetaald) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
|
M. Ruiter |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afgevaardigde patiëntvertegenwoordiger in de werkgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Paitent Centered Intensive Care/ IC connect, Sepsis en daarna, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen, Dutch Acute Medicine via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vond.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk-of-bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk-of-biastabellen. De gebruikte risk-of-biasinstrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk-of-bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module toekomstige module Randvoorwaarden. Die wordt ontwikkeld bij de richtlijn Sepsis fase 2 en 3.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken en er zijn al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk zoals de huidige indicator vroege herkenning sepsis in de basisset 2019.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
PICO 1 en 2
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – oktober 2018
|
1 exp SEPSIS/ or (Sepsis or sepses or septic*).ti,ab. (196845) 2 exp Fluid Therapy/ or (crystalloid* or fluid* or saline or (ringer adj2 lactate) or (hartmann adj2 solutation) or nacl or plasma* or hypertonic or isotonic).ti,ab. (1465600) 3 exp *Resuscitation/ or resuscitation*.ti. (59120) 4 1 and 2 and 3 (687) 5 limit 4 to (english language and yr="2000 -Current") (528) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (373549) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1801756) 8 5 and 6 (37) 9 5 and 7 (149) 10 9 not 8 (119) 11 8 or 10 (156)
= 156 |
286 |
|
Embase (Elsevier) |
('sepsis'/exp OR sepsis:ti,ab OR sepses:ti,ab OR septic*:ti,ab) AND ('crystalloid'/exp OR 'fluid therapy'/exp OR crystalloid*:ti,ab OR fluid*:ti,ab OR saline:ti,ab OR ((ringer* NEAR/2 lactate):ti,ab) OR ((hartmann* NEAR/2 solution):ti,ab) OR nacl:ti,ab OR plasma*:ti,ab OR hypertonic:ti,ab OR isotonic:ti,ab) AND ('resuscitation'/exp/mj OR resuscitation*:ti) AND (2000-2018)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematic Reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 37
Randomized Controlled Trials: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 188
= 225 |
PICO 3
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – oktober 2018
|
1 exp SEPSIS/ or (Sepsis or sepses or septic*).ti,ab. (196845) 2 exp Hydroxyethyl Starch Derivatives/ or (hes or haes or hetastarch* or hydroxyethyl starch* or hydroxy-ethylated starch* or hespan).ti,ab. (8157) 3 exp *Resuscitation/ or resuscitation*.ti. (59120) 4 1 and 2 and 3 (93) 5 limit 4 to (english language and yr="2000 -Current") (79) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (373549) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1801756) 8 5 and 6 (13) 9 5 and 7 (38) 10 9 not 8 (26) 11 8 or 10 (39) = 39 |
72 |
|
Embase (Elsevier) |
('sepsis'/exp OR sepsis:ti,ab OR sepses:ti,ab OR septic*:ti,ab) AND ('hetastarch'/exp OR hes:ti,ab OR haes:ti,ab OR hetastarch*:ti,ab OR 'hydroxyethyl starch*':ti,ab OR 'hydroxy-ethylated starch*':ti,ab OR hespan:ti,ab) AND ('resuscitation'/exp/mj OR resuscitation*:ti) AND (2000-2018)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematic Reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 15
Randomized Controlled Trials: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 45
= 60 |
