Sedatie: toediening
Uitgangsvraag
Wat is de optimale toedieningswijze voor patiënten met sepsis, continue infusie of interruptie?
Aanbeveling
Overweeg dagelijks of een sedatie-interruptie mogelijk is bij patiënten met sepsis die een diep sedatieniveau hebben om oversedatie te voorkomen.
Streef naar een zo licht mogelijk sedatieniveau bij patiënten met sepsis, bij voorkeur op basis van een sedatiescore.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van dagelijkse interruptie van sedatie ten opzichte van continue toediening van sedatie. De bewijskracht van de cruciale uitkomstmaten mortaliteit en ventilatieduur was zeer laag door indirectheid van het bewijs, inconsistentie in de resultaten en beperkte onderzoekspopulatie. Het is daarom op basis van de cruciale uitkomstmaten onduidelijk of continue of onderbroken toediening van sedatie de voorkeur verdient voor patiënten met sepsis. Er ligt hier een kennislacune.
Bij de belangrijke uitkomstmaten IC-verblijfsduur, ziekenhuisverblijfsduur en incidentie van delier leken er geen verschillen te zijn tussen continue en onderbroken toediening van sedatie. Het was door de zeer lage bewijskracht onduidelijk of er een verschil was in complicaties (onbedoeld verwijderen van endotracheale tube en katheters, krijgen van een tracheotomie). Op basis van de literatuur is er derhalve geen voorkeur voor een van beide behandelstrategieën.
De review van Burry uit 2014 is echter gedateerd. In de afgelopen jaren is de praktijk van sedatie van bijna alle IC-patiënten veranderd, ten gunste van sedatie op geleide van sedatiescores zoals de Richmond-Agitation Sedation Scale (RASS). In de internationale PADIS-richtlijn wordt gestreefd naar een RASS van -2 tot +1 (of een equivalent wanneer een andere schaal wordt gebruikt), dit wordt gezien als lichte sedatie in de geëvalueerde studies (Devlin, 2018).
Bij sedatiescore-gestuurde sedatie, is interruptie niet altijd nodig, de continue sedatie kan zo nodig worden aangepast. Zeer diepe sedatie komt nog maar zelden voor bij IC-patiënten, enkele uitzonderingen zoals bijvoorbeeld patiënten met verhoogde intracraniële druk na trauma daargelaten.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De voorkeur van de patiënt voor deze interventies is niet onderzocht en onbekend. Goede voorlichting en communicatie over behandeldoelen, voor- en nadelen, risico’s en verwacht resultaat is belangrijk om een goede afweging te maken voor patiënten en naasten. Van dagelijks onderbreken van de sedatie en/of het zo licht mogelijk sederen is in IC-patiënten, inclusief IC-patiënten met sepsis, aangetoond dat het de beademingsduur en de verblijfsduur op de IC verkort. Het is waarschijnlijk om aan te nemen dat dit voor alle patiënten met sepsis opgaat. Dit is een belangrijke uitkomst voor patiënten.
In het algemeen dient zoveel mogelijk gestreefd te worden naar geen tot een licht sedatieniveau, zodat de patiënt mee kan werken aan zijn/haar herstel, met derhalve minder ICU-acquired weakness en betere communicatie met zorgverlener en familie, conform de internationale PADIS-richtlijn (Devlin, 2018).
Ook het voorkomen van post intensive care syndrome (PICS) is een belangrijke uitkomstmaat voor patiënten. Er is mogelijk een associatie tussen het toepassen van de ABCDEF-bundel, waar een lichter sedatie niveau een onderdeel van is, en de preventie van PICS in IC-patiënten (Rawal, 2017).
Kosten (middelenbeslag)
Kosten spelen geen belangrijke rol in de besluitvorming rondom het wel of niet toepassen van sedatie-interruptie.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen bijzonderheden ten aanzien van de aanvaardbaarheid, haalbaarheid of implementatie. De aanbeveling wordt al grotendeels gevolgd in de praktijk.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de beschikbare literatuur kan geen sterke aanbeveling worden gedaan ten aanzien van de keuze tussen continue sedatie of dagelijkse onderbreking. In de afgelopen jaren is de praktijk ten aanzien van sedatie veranderd, waarbij er steeds meer gebruik gemaakt wordt van sedatiescores zoals bijvoorbeeld de RASS. Wanneer gestreefd wordt naar een licht sedatieniveau, is de kans op oversedatie gering. Het gunstige effect van sedatie-interruptie kan grotendeels worden verklaard door het voorkomen van oversedatie. Bij streven naar een lichter sedatieniveau zal dit effect kleiner worden of verdwijnen.
Het is aannemelijk dat de nadelen van oversedatie voor ernstig zieke IC-patiënten, te weten langere beademings- en verblijfsduur en hoger risico op post-intensive care syndrome (PICS), ook van toepassing zijn voor patiënten met sepsis. Er zijn geen aanwijzingen dat er nadelige gevolgen zijn van lichtere sedatie.
Onderbouwing
Achtergrond
Sedatie en pijnstilling zijn een belangrijk onderdeel van de behandeling van patiënten met sepsis opgenomen op de intensive care (IC). Het wordt toegediend om pijn, discomfort, angst en agitatie te verlichten, bescherming te bieden tegen stressvolle en pijnlijke momenten, procedures mogelijk te maken, nachtelijke slaap te bevorderen en eventueel amnesie te induceren.
Sedativa worden vaak per continue infusie toegediend. Een risico hiervan is stapeling en daardoor te diepe sedatie, bijvoorbeeld door een veranderde nier- of leverfunctie. Stapeling van sedatie kan leiden tot een verlengde beademingsduur en hierdoor mogelijk tot verhoogde morbiditeit.
In de laatste jaren is het steeds meer gebruikelijk geworden om patiënten te sederen op geleide van een sedatie score, zoals bijvoorbeeld de Richmond Agitation-Sedation Scale (RASS). Hiermee wordt het niveau van sedatie of agitatie van de patiënt beschreven op een schaal van +4 tot -5, waarbij 0 kalm en alert is. Er is sprake van een diep sedatieniveau bij RASS -4 (geen reactie op aanspreken, enige beweging op aanraken/pijnprikkel)). Er wordt van een licht sedatieniveau gesproken bij RASS -2 (kortdurend (minder dan 10 seconden) wakker worden en oogcontact maken op aanspreken).
De werkgroep vroeg zich af of een geprotocolleerde benadering van sedatie van patiënten met sepsis (bijvoorbeeld met sedatie interruptie of streef sedatiediepte) beter zou zijn dan een niet geprotocolleerde benadering.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Het is onduidelijk of onderbroken sedatie (interruptie) een effect heeft ten opzichte van continue sedatie op mortaliteit bij patiënten met sepsis.
Bronnen: (Burry, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk of onderbroken sedatie (interruptie) een effect heeft ten opzichte van continue sedatie op de duur van mechanische ventilatie bij patiënten met sepsis.
Bronnen: (Burry, 2014) |
|
Laag GRADE |
Dagelijkse interruptie van sedatie lijkt geen klinisch relevant effect te hebben ten opzichte van continue sedatie op de intensive-careverblijfsduur bij patiënten met sepsis.
Bronnen: (Burry, 2014) |
|
Laag GRADE |
Dagelijkse interruptie van sedatie lijkt geen klinisch relevant effect te hebben ten opzichte van continue sedatie op de ziekenhuisverblijfsduur bij patiënten met sepsis.
Bronnen: (Burry, 2014) |
|
Laag GRADE |
Dagelijkse interruptie van sedatie lijkt geen klinisch relevant effect te hebben ten opzichte van continue sedatie op het ontwikkelen van een delier in patiënten met sepsis.
Bronnen: (Burry, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk of dagelijkse interruptie van sedatie een effect heeft ten opzichte van continue sedatie op de incidentie van adverse events (onbedoeld verwijderen van de endotracheale tube of katheters, noodzaak tot het verrichten van een tracheotomie) in patiënten met sepsis.
Bronnen: (Burry, 2014) |
Samenvatting literatuur
Beschrijving studies
Burry (2014) beschrijft een Cochrane systematische review met meta-analyse welke de duur van invasieve mechanische ventilatie onderzocht in kritisch zieke volwassen patiënten die behandeld werden door middel van intraveneuze sedatie met dagelijkse interruptie. Daarnaast werd onderzocht of sedatie met dagelijkse interruptie invloed had op de mortaliteit, verblijfsduur op de intensive care of in het ziekenhuis en adverse events. Er werd gezocht naar relevante literatuur tot februari 2014 in verschillende databases (the Cochrane Central Register of Controlled Trials (CENTRAL) (The Cochrane Library 2014, Issue 1); MEDLINE (OvidSP); EMBASE (OvidSP); CINAHL (EBSCOhost); Latin American and Caribbean Health Sciences Literature (LILACS); Web of Science Citation Index; Database of Abstracts of Reviews of Effects (DARE); the Health Technology Assessment Database (HTA Database); trial registration websites; en referentielijsten van relevante artikelen). Randomized controlled trials (RCT’s) welke het effect van sedatie met dagelijkse interruptie vergeleek met sedatie zonder dagelijkse interruptie in patiënten ≥ 16 jaar die behandeld werden met invasieve mechanische ventilatie en sedatie in een intensive care setting werden geïncludeerd.
In de review van Burry (2014) werden negen RCT’s geïncludeerd welke het effect van sedatie met interruptie onderzochten. Sedatie met dagelijkse interruptie hield bij alle studies in dat een continue sedatie werd onderbroken totdat de patiënt wakker was en in staat was om simpele commando’s op te volgen. Eén trial paste een maximale interruptie toe van zes uur. In de ander studies werd de duur van de interruptie niet geprotocolleerd. Voor de controlegroep hanteerden vier studies ‘usual sedation practices’ waarbij de uitvoer van de sedatie werd overgelaten aan de discretie van het team en gebruikten vijf studies een vast protocol. Twee studies pasten dit vaste protocol ook toe op de experimentele groep. In totaal participeerde 1282 volwassen patiënten in de RCT’s. De studies die werden beoordeeld met een lage risk of bias, hoewel in de meeste van de geïncludeerde studies geen blindering van patiënten en/of behandelaar kon plaatsvinden. Twee studies includeerden alle ‘medische’ IC-patiënten en de overige zeven studies includeerden ook chirurgische en trauma IC-patiënten.
Mortaliteit
De review van Burry (2014) includeerde negen studies met in totaal 1282 kritisch zieke participanten die het effect van sedatie met dagelijkse interruptie op mortaliteit hebben gemeten. Het gepoolde effect betrof een risk ratio (95% CI) van 0,88 (0,75 tot 1,05) in het voordeel van sedatie met dagelijkse interruptie. Burry onderzocht het effect op verschillende typen mortaliteit (IC-mortaliteit, 28-daagse mortaliteit en ziekenhuismortaliteit). De gepoolde resultaten worden getoond in figuur 7. De kleinere kans op mortaliteit bij sedatie met dagelijkse interruptie werd door de werkgroep als klinisch relevant beoordeeld.
Figuur 7 Mortaliteit bij sedatie met versus zonder interruptie in kritisch zieke patiënten

df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid), tegenstrijdige resultaten (inconsistentie) en de beperkte onderzoekspopulatie (imprecisie).
Duur van mechanische ventilatie
De review van Burry (2014) includeerde negen studies met in totaal 1282 kritisch zieke participanten die het effect van sedatie met dagelijkse interruptie op de duur van mechanische ventilatie hebben gemeten. Het gepoolde effect betrof een gemiddeld verschil (95% CI) van -0,14 (-0,30 tot 0,02) log dagen (zie figuur 8), en werd op basis van niet getransformeerde data -1.04 (-4,17 tot 2,09) dagen klinisch relevant geacht in het voordeel van sedatie met dagelijkse interruptie. Op basis van een sensitiviteitsanalyse concludeerde Burry (2014) dat conclusies naar aanleiding van log-getransformeerde data niet verschilde van niet log-getransformeerde data.
Figuur 8 Duur van mechanische ventilatie in dagen (log-getransformeerd) bij sedatie met versus zonder interruptie in kritisch zieke patiënten

df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat duur van mechanische ventilatie is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid), tegenstrijdige resultaten (inconsistentie) en de kleine onderzoekspopulatie (imprecisie).
Intensive-careverblijfsduur
De review van Burry (2014) includeerde negen studies met in totaal 1282 kritisch zieke participanten die het effect van sedatie met dagelijkse interruptie op de duur van IC-opname hebben gemeten. Het gepoolde effect betrof een gemiddeld verschil (95% CI) van -0,10 (-0,22 tot 0,03) log dagen (zie figuur 9) en werd op basis van niet getransformeerde data -0,85 (-2,42 tot 0,72) dagen niet klinisch relevant geacht. Op basis van een sensitiviteitsanalyse concludeerde Burry (2014) dat conclusies naar aanleiding van log-getransformeerde data niet verschilde van niet log-getransformeerde data.
Figuur 9 Duur van IC-opname in dagen (log-getransformeerd) bij sedatie met versus zonder interruptie in kritisch zieke patiënten

df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat IC-verblijfsduur is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met één niveau verlaagd vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid) en met één niveau vanwege de kleine onderzoekspopulatie (imprecisie). De bewijskracht komt daarmee op laag.
Ziekenhuisverblijfsduur
De review van Burry (2014) includeerde acht studies met in totaal 1232 kritisch zieke participanten die het effect van sedatie met dagelijkse interruptie op de duur van ziekenhuisopname hebben gemeten. Het gepoolde effect betrof een gemiddeld verschil (95% CI) van -0,06 (-0,20 tot 0,08) log (zie figuur 10) en werd op basis van niet getransformeerde data -0,46 (-4,00 tot 3,09) dagen niet klinisch relevant geacht. Op basis van een sensitiviteitsanalyse concludeerde Burry (2014) dat conclusies naar aanleiding van log-getransformeerde data niet verschilde van niet log-getransformeerde data.
Figuur 10 Duur van ziekenhuisopname in dagen (log-getransformeerd) bij sedatie met versus zonder interruptie in kritisch zieke patiënten

df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ziekenhuisverblijfsduur is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met één niveau verlaagd vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid) en met één niveau vanwege de kleine onderzoekspopulatie (imprecisie). De bewijskracht komt daarmee op laag.
Delier
De review van Burry (2014) includeerde drie studies met in totaal 818 kritisch zieke patiënten die het effect van sedatie met dagelijkse interruptie op het krijgen van een delier hebben gemeten. Het gepoolde effect betrof een risk ratio (95% CI) van 1,02 (0,91 tot 1,13) in het nadeel van sedatie met dagelijkse interruptie. Het gepoolde resultaat wordt getoond in figuur 11. Het verschil in kans op een delier bij sedatie met dagelijkse interruptie werd door de werkgroep niet als klinisch relevant beoordeeld.
In deze richtlijn is ook een aparte module over medicamenteuze behandeling en preventie van delier[MR1] opgenomen. In de literatuuranalyse van de betreffende module werden studies geïncludeerd die delier beschreven als primaire of belangrijke uitkomstmaat.
In de analyse van delier bij diverse sedatieprotocollen in de huidige analyse is delier beschreven als complicatie. Door het verschil in vraagstelling zijn de geïncludeerde studies tussen de beide modules niet gelijk en daarmee zijn ook de conclusies enigszins verschillend.
Figuur 11 Delier bij sedatie met versus zonder interruptie in kritisch zieke patiënten
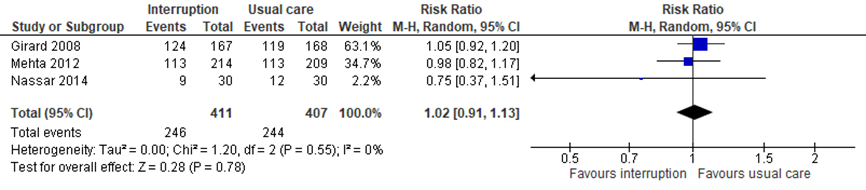
df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat delier is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met één niveau verlaagd vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid) en met één niveau vanwege de kleine onderzoekspopulatie (imprecisie). De bewijskracht komt daarmee op laag.
Complicaties
Burry (2014) beschreef diverse complicaties, weergegeven in figuur 12. De review includeerde zes studies met in totaal 1108 kritisch zieke patiënten die het effect van sedatie met dagelijkse interruptie op het onbedoeld verwijderen van de endotracheale tube hebben bepaald. Het gepoolde effect betrof een risk ratio (95% CI) van 1.07 (0,55 tot 2,12) in het nadeel van sedatie met dagelijkse interruptie. De grotere kans op het onbedoeld verwijderen van de endotracheale tube bij sedatie met dagelijkse interruptie werd door de werkgroep niet als klinisch relevant beoordeeld.
Daarnaast includeerde Burry (2014) vier studies met in totaal 676 kritisch zieke patiënten die het effect van sedatie met dagelijkse interruptie op het onbedoeld verwijderen van katheters hebben onderzocht. Het gepoolde effect betrof een risk ratio (95% CI) van 1,48 (0,76 tot 2,90) in het nadeel van sedatie met dagelijkse interruptie. De grotere kans op het onbedoeld verwijderen van katheters bij sedatie met dagelijkse interruptie werd door de werkgroep wel als klinisch relevant beoordeeld.
Ook beschreef Burry (2014) tracheotomie als complicatie in zes studies met in totaal 1061 kritisch zieke patiënten bij sedatie met en zonder interruptie. Het gepoolde effect betrof een risk ratio (95% CI) van 0,73 (0,57 tot 0,92) in het voordeel van sedatie met dagelijkse interruptie. Het verschil werd door de werkgroep wel als klinisch relevant beoordeeld. Patiënten die sedatie met interruptie kregen, hadden gemiddeld een kleinere kans op het krijgen van een tracheostoma dan patiënten in de groep die continue sedatie kreeg.
Samen genomen is het RR op adverse events in deze studies 0,83 met een 95% BI van 0,65 tot 1,07.
Figuur 12 Adverse events bij sedatie met versus zonder interruptie in kritisch zieke patiënten
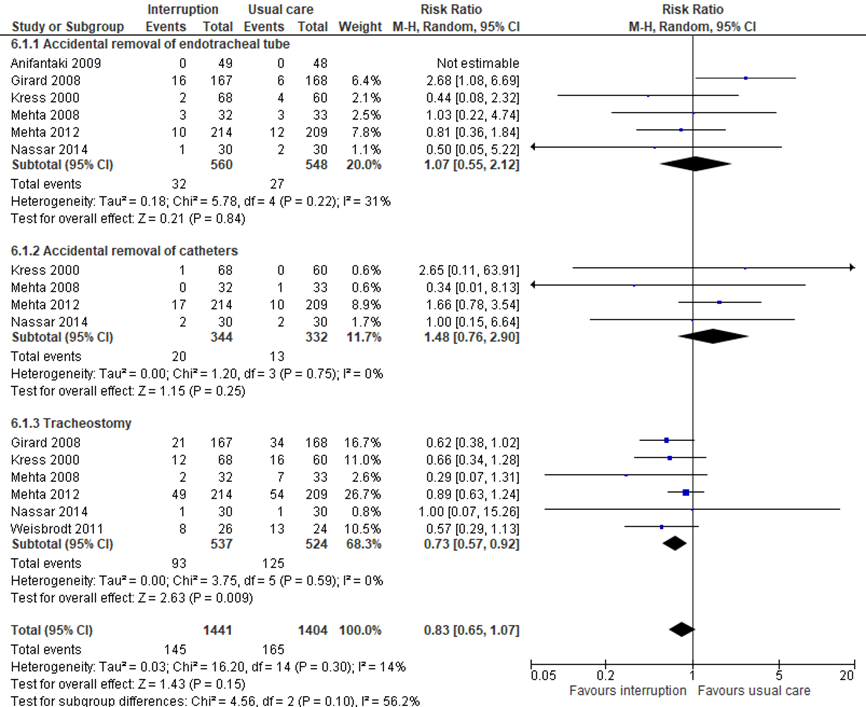
df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Z: p-waarde van gepoold effect
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat adverse events is gebaseerd op gerandomiseerd onderzoek en start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege geïncludeerde patiënten zonder sepsis (bias ten gevolge van indirectheid), tegenstrijdige resultaten (inconsistentie) en vanwege de beperkte onderzoekspopulatie (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van sedatie met interruptie vergeleken met sedatie zonder interruptie bij patiënten met sepsis?
P: volwassen patiënten met sepsis of septische shock;
I: sedatie met interruptie;
C: continue sedatie;
O: mortaliteit, duur mechanische ventilatie, intensive-careverblijfsduur, ziekenhuisverblijfsduur, delier, sedatie-gerelateerde adverse events.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en duur mechanische ventilatie voor de besluitvorming cruciale uitkomstmaten; en opnameduur, delier en sedatie gerelateerde adverse events voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde de grens van 3% als een klinisch (patiënt) relevant verschil voor mortaliteit (gebaseerd op de SDD-trial van de Smet, 2009), en 25% voor de overige dichotome uitkomstmaten. Voor verblijfsduur op de IC, duur van ventilatie en ventilatievrije dagen werd 1 dag als klinisch relevant verschil gedefinieerd, voor ziekenhuisverblijfsduur 2 dagen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 18 september 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerd onderzoek (RCT’s) vanaf 1989. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Omdat niet duidelijk was of er artikelen gevonden zouden worden in een sepsispopulatie, is de populatie uitgebreid naar ernstig zieke patiënten en patiënten op de intensive care (IC). De screening van de systematische reviews in de literatuurzoekactie leverde 49 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews of RCT’s waarin de effecten van een sedatieprotocol met interruptie werd vergeleken met een sedatieprotocol zonder interruptie in patiënten met sepsis of IC-patiënten met betrekking tot mortaliteit, duur mechanische ventilatie, opnameduur, delirium, sedatie gerelateerde adverse events en sedatiediepte (RASS). Op basis van titel en abstract werden in eerste instantie tien studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens negen studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en één studie (systematische review) definitief geselecteerd. Verdere screening van RCT’s na publicatie van de review leverde geen additionele treffers op.
Resultaten
Eén onderzoek (Burry, 2014) is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabel. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabel.
Referenties
- Burry, L., Rose, L., McCullagh, I. J., Fergusson, D. A., Ferguson, N. D., & Mehta, S. (2014). Daily sedation interruption versus no daily sedation interruption for critically ill adult patients requiring invasive mechanical ventilation. Cochrane Database of Systematic Reviews, (7).
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Devlin, J. W., Skrobik, Y., Gélinas, C., Needham, D. M., Slooter, A. J., Pandharipande, P. P., ... & Balas, M. C. (2018). Executive summary: clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Critical care medicine, 46(9), 1532-1548.
- Rawal, G., Yadav, S., & Kumar, R. (2017). Post-intensive Care Syndrome: an Overview. Journal of translational internal medicine, 5(2), 90–92. https://doi.org/10.1515/jtim-2016-0016.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: efficacy sedation interruption protocol
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Burry, 2014 |
SR and meta-analysis of RCTs
Literature search up to February 2014
A: Anifantaki, 2009 B: de Wit, 2008 C: Girard, 2008 D: Kress, 2000 E: Mehta, 2008 F: Mehta, 2012 G: Nassar, 2014 H: Weisbrodt, 2011 I: Yilmaz, 2010
Study design: A: RCT, parallel
Setting and Country: A: Single medical-surgical ICU, Greece B: Single, closed medical ICU, United States C: Multicentre, closed ICU, United States D: Single, open medical ICU, United States E: Multicentre, closed medical-surgical ICU, Canada F: multicentre, closed ICU, Canada and United States G: single medical-surgical ICU, South America H: Multicentre, mixed medical-surgical-trauma ICU, Australia I: single, hospital ICU, Turkey
Source of funding and conflicts of interest: Funding: Canadian Society of Hospital Pharmacists, Canada
|
Inclusion criteria SR: - RCT - adult patients (≥16 years of age) - any type of invasive mechanical ventilation and sedation in an intensive care setting - comparing usual sedation practice existing in the ICU (as stated by the authors) that did incorporate DSI - outcome: total duration of invasive mechanical ventilation, mortality, length of stay, time to first extubation, number of patients experiencing adverse events, total sedative/analgesic doses, quality of life
Exclusion criteria SR: - quasi-randomized and non-randomized studies
9 studies included
Important patient characteristics at baseline:
N, mean age A: mean ± SD C: 48, 56.1 ± 21.1 I: 49, 52.1 ± 21.3 B: mean (95%CI) I: 36, 52 (47.4, 56.5) C: median (IQR) C: 168, 64(57,75) D: median (IQR) C: 60, 61 (40,74) E: median (IQR) C: 57.9 (42.6, 67.0) I: 61.4 (52.4, 75.5) F: median (IQR) C: 209, 60 (49,70) I: 214, 57 (46,70) G: not reported H: mean (95%CI) I: mean (SD) I: 25, 44.76 (18.04)
Sex: A: B: C: 47.4% Male C: D: C: 43,3% Male I: 50% Male E: C: 61% Male I: 41% Male F: I: 56.5% Male G: not reported H: C: 71% Male I: 54% Male I: C: 65% Male I: 60% Male
Apache II I: 17.4 ± 6.8 B: median (IQR) I: 26 (22.9, 28.8) C: median (IQR) D: median C: 22 (16,26) I: 20 (15,25) E: mean (SD) C: 27.7 (8.4) F: median I: 24.0 (18,28) G: not reported H: mean (95%CI) I: mean(SD) C: 19.88 (7.51) I: (18.00 (5.33)
Groups comparable at baseline? A: yes B: not reported C: yes D: yes E: yes F: not reported G: not reported H: not reported |
Describe intervention:
A: daily interruption B: daily interruption C: paired sedation and ventilator weaning protocol D: daily interruption E: daily interruption F: daily interruption G: daily interruption H: daily interruption I: daily interruption
|
A: usual care (continuous intravenous infusion to achieve a 3 to 5 score on the Ramsay sedation SCALE unless the patient needed deeper sedation) B: usual care (according to algorithm locally developed and based on Brook the algorithm developped by Brook et al. C: usual care (according to each study center intensive care units usual practice of care) D: usual care E: RN directed protocol F: nurse-directed protocol G: intermittent sedation H: usual care I: nursing implemented sedation protocol
|
End-point of follow-up:
A: not reported B: not reported C: not reported D: not reported E: not reported F: not reported G: not reported H: not reported I: not reported
For how many participants were no complete outcome data available? (intervention/control) A: not reported B: not reported C: not reported D: not reported E: 0/0 F: not reported G: not reported H: not reported I: not reported
|
ICU mortality risk ratio (95%CI) E: 1.03 (0.57-1.87) G:1.71 (0.78-3.75) H:0.58 (0.22-1.52)
Pooled effect (random effects: 0.96 (95% CI 0.77 to 1.21) favoring DSI Heterogeneity (I2): 0%
28-day mortality
hospital mortality
hospital mortality
Duration of mechanical ventilation A:0.16 (-0.18-0.50) C:-0.30 (-0.47- -0.13) D:-0.49 (-0.73 - -0.25) E: 0.06 (-0.45 – 0.57) F: -0.13 (-0.29 – 0.03) G: 0.27 (-0.14-0.68) H: -0.08 (-0.55 – 0.39) I: -0.41 (-0.76 - -0.06)
Pooled effect (random effects: -0.14 (95% CI -0.30 to 0.02) favoring DSI Heterogeneity (I2): 61%
ICU length of stay mean difference logdays (95%CI) A:0.01 (-0.27-0.29) B:0.12 (-0.22-0.46) C:-0.09 (-0.26 – 0.08) E: 0.06 (-0.38 – 0.50) F: -0.08 (-0.24 – 0.08) G:-0.15 (-0.59 – 0.29) H:-0.04 (-0.44 – 0.36) I:-0.12 (-0.43 – 0.19)
Pooled effect (random effects: -0.10 (95% CI -0.22 to 0.03) favoring DSI Heterogeneity (I2): 45%
Length of hospital stay mean difference logdays (95%CI) A:0.36 (0.01 – 0.71) B:0.12 (-0.22 – 0.46) C:-.009 (-0.26 – 0.08) D:-0.24 (-0.53 – 0.05) E:0.06 (-0.43 – 0.55) F:-0.21 (-0.41 - -0.01) G:-0.24 (-0.76 – 0.22) H:0.04 (-0.45 – 0.53)
Pooled effect (random effects: -0.06 (95% CI -0.20 to 0.08) favoring DSI Heterogeneity (I2): 45%
Delirium risk ratio (95%CI) C: 1.05 (0.92 – 1.20) G: 0.75 (0.37 – 1.51)
Pooled effect (random effects: 1.02 (95% CI 0.91 to 1.13) favouring non DSI Heterogeneity (I2): 0%
Accidental removal of endotracheal tube risk ratio (95%CI) C: 2.68 (1.08 – 6.69) G: 0.50 (0.05-5.22)
Pooled effect (random effects: 1.07 (95% CI 0.55 to 2.12) favouring non DSI Heterogeneity (I2): 31%
Accidental removal of catheters
Pooled effect (random effects: 1.48 (95% CI 0.76 to 2.90) favouring non DSI Heterogeneity (I2): 0%
Tracheosotomy risk ratio (95%CI) C: 0.62 (0.38 – 1.02) F: 0.89 (0.63 – 1.24) G: 1.00 (0.29-1.13) 0.73 (95% CI 0.57 to 0.92) favouring DSI Heterogeneity (I2): 0%
Depth of sedation Not reported
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question:
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
‘Quality of evidence was moderate and indicated imprecision in the effect astimates a the overall results only marginally crossed the no-effect line. The results are based upon a small number of studies that were heterogeneous in terms of methods, the patients studied and clinical management.’
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question Sensitivity analysis performed for unlogged data:
No trial included in the analysis met de definition of high risk of bias (two or more domains scored as high risk of bias), so no further sensitivity analysis for high risk of bias were performed.
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroup analysis)
- no difference in subgroup analysis for duration of mechanical ventilation with standardized spontaneous breathing trials or usual care
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Burry, 2014 |
Yes |
Yes |
Yes
|
Yes |
Not applicable |
Yes |
Yes |
No |
No (not reported for individual studies) |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Shetty, 2018 |
BIS monitoring |
|
Aitken, 2018 |
Protocol versus usual care |
|
Nassar, 2016 |
Systematische review, maar Cochrane review beschikbaar |
|
Aitken, 2016 |
Protocol versus usual care |
|
Xiaojuan, 2015 |
Editorial |
|
Minhas, 2015 |
Protocol versus usual care |
|
Aitken, 2015 |
Protocol versus usual care |
|
Chen, 2014 |
Systematische review, recentere Cochrane review beschikbaar |
|
Augustes, 2011 |
Systematische review, recentere Cochrane review beschikbaar |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://classic.clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1989 – september 2019
|
1 exp SEPSIS/ or exp Intensive Care Units/ or exp Critical Illness/ or (Sepsis or sepses or septic* or sirs or icu* or intensive care or critical care or critically ill* or critical ill*).ti,ab,kw. (404977) 2 ((exp conscious sedation/ or exp deep sedation/) and (protocol* or interrupt* or algorithm*).ti,ab,kw.) or (sedat* adj6 (protocol* or interrupt* or algorithm*)).ti,ab,kw. (1517) 3 1 and 2 (650) 4 limit 3 to (english language and yr="1989 -Current") (575) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (411368) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1896300) 7 4 and 5 (48) 8 (4 and 6) not 7 (185) 9 7 or 8 (233)
= 233 |
333 |
|
Embase (Elsevier) |
('sepsis'/exp OR sepsis:ti,ab OR sepses:ti,ab OR septic*:ti,ab OR 'critically ill patient'/exp OR 'intensive care unit'/exp OR icu*:ti,ab OR 'intensive care':ti,ab OR 'critical care':ti,ab OR 'critically ill*':ti,ab OR 'critical ill*':ti,ab) AND ('sedation'/exp/mj AND (protocol*:ti,ab OR interrupt*:ti,ab OR algorithm*:ti,ab) OR ((sedat* NEAR/6 (protocol* OR interrupt* OR algorithm*)):ti,ab)) AND (1989-2019)/py AND (english)/lim NOT 'conference abstract'/it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 52
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 224 = 276 |
