Parameters om vochttoediening te sturen bij sepsis
Uitgangsvraag
Op welke (hemodynamische) parameter(s) kun je het beste de vochttoediening (dosering/duur) sturen in patiënten met (verdenking op) sepsis?
De uitgangsvraag omvat de volgende deelvragen:
- Microcirculatoire en cellulaire parameters versus standaard zorg/ andere parameters
- Early Goal-Directed Therapy (EGDT) versus standaard zorg/ andere parameters
- Gemiddelde arteriële bloeddruk (MAP) versus standaard zorg/ andere parameters
- Overige hemodynamische parameters versus standaard zorg/ andere parameters
Aanbeveling
Start met (minimaal) 30 ml/kg (op basis van ideaal lichaamsgewicht) kristalloïde vloeistof intraveneus in de eerste drie uur bij patiënten met (verdenking op) sepsis en overweeg hierbij de eerste 500 ml kristalloïde vloeistof intraveneus in de eerste 10 tot 30 minuten toe te dienen bij patiënten met (verdenking op) septische shock (zie module ‘Type resuscitatievloeistof’).
Evalueer het effect van de vloeistoftherapie binnen een uur na het starten.
Meet zo snel mogelijk lactaat bij verdenking op sepsis.
Meet lactaat tenminste elke 6 uur, maar niet vaker dan elke 2 uur bij patiënten met (verdenking op) sepsis of septische shock totdat er geen klinische vraag meer is omtrent het geven van vloeistof of het lactaat is genormaliseerd (< 2,0 mmol/l).
Gebruik bij voorkeur geen andere parameters dan lactaat in aanvulling op standaardzorg om de vloeistoftoediening van patiënten met (verdenking op) sepsis of septische shock te sturen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In deze richtlijn is onderzocht welke (hemodynamische) parameters het best gebruikt kunnen worden om de vochttoediening aan patiënten met (verdenking op) sepsis te sturen. Hierbij is mortaliteit als cruciale uitkomstmaat gekozen. Studies met de totale hoeveelheid toegediend vocht als uitkomstmaat zijn niet meegenomen, omdat dit als onderdeel of resultaat van de interventie wordt gezien.
Het is belangrijk om te beseffen dat de vergeleken interventies en de daaruit volgende acties niet op zichzelf staan: de onderzochte hemodynamische parameters vormden vaak een onderdeel van een set van meetwaardes die de therapie sturen, zoals bijvoorbeeld bloeddruk en urineproductie. De therapeutische interventies die voortvloeiden uit deze metingen waren daarnaast niet gelimiteerd tot vochttoediening en konden ook bestaan uit het starten of aanpassen van de dosis van inotropica of vasopressoren.
Lactaat-gestuurde therapie vermindert de mortaliteit, vergeleken met S(c)vO2 en vergeleken met EGDT (figuur 1). De werkgroep beschouwt dit als ongeveer vergelijkbare conclusies, omdat het meten van S(c)vO2 eigenlijk de essentie is waarin EGDT van de huidige standaardzorg verschilt (zie tabel 1).
De voordelen van het sturen van therapie op lactaat zijn groot. De parameter is gemakkelijk en weinig invasief te meten. Daardoor kan lactaat ook op alle afdelingen in het ziekenhuis (in de Nederlandse situatie) worden gemeten. De bepaling kan gecombineerd worden met andere klinisch chemische bepalingen die bij opname of tijdens de behandeling van patiënten moeten worden verricht. Mogelijk wordt ook de IC-opnameduur korter vergeleken met standaard zorg of EGDT als lactaat-gestuurde therapie wordt gebruikt (figuur 2).
Overigens kan lactaat ook gebruikt worden als onderdeel van de definitie van septische shock, om patiënten met een hoog risico om te overlijden in het ziekenhuis (ongeveer 40%) te identificeren. Hiervoor wordt een afkapwaarde van 2 mmol/l gebruikt in de literatuur (Singer, 2016).
In de studies wordt een daling van het lactaat van tussen de 10% en 50% in zes uur gebruikt, in combinatie met basisgegevens als urineproductie en bloeddruk. De werkgroep kan geen advies geven over welke daling de meeste mortaliteitswinst geeft en beschouwt dit als een kennislacune. De werkgroep adviseert om, naar analogie van studies, lactaat in combinatie met andere parameters te gebruiken om de vloeistoftherapie te sturen.
Het voordeel van PtcO2 ten opzichte van DO2 legt de werkgroep vooralsnog naast zich neer. Dit is vanwege de beperkte bewijsvoering (één studie), de keuze van het domein (alle patiënten kregen een arteria pulmonalis katheter) en de beschikbaarheid van minder invasieve, goedkope alternatieven zoals lactaat. Er is geen bewijs (maar ook geen literatuur) over het effect van PtcO2 ten opzichte van standaard zorg of lactaat-gestuurde behandeling. De werkgroep ziet dit als een kennislacune. Tot er literatuur beschikbaar komt om de plaats van PtcO2 (en DO2) ten opzichte van de huidige standaard zorg te bepalen kan de werkgroep deze strategie dus niet aanbevelen.
Voor EGDT geldt dat het analyseren van studies lastig is. Dat komt omdat de definitie van wat EGDT is, verschilt tussen studies. Daarnaast combineert EGDT zowel een meetstrategie als een behandelstrategie.
Voor patiënten met een hoge mortaliteit lijkt EGDT de mortaliteit te verminderen (referentie Simpson en figuur 3). Echter, waarschijnlijk weerspiegelt het verschil in mortaliteit een verbetering van standaardzorg in de tijd, aangezien de drie studies met een hoge mortaliteit tussen 2001 en 2010 zijn gepubliceerd, en de drie studies met lage mortaliteit uit 2014 en 2015 komen (figuur 4) en de patiënten in alle studies ongeveer even ziek waren.
De werkgroep volgt daarom de laatste drie grote gerandomiseerde trials van hoge kwaliteit (ProCESS, 2014; ARISE, 2014; ProMISe, 2015) en de individuele patiënt data meta-analyse (IPDMA) die de studies samenvoegde (Rowan, 2017). Deze trials reflecteren het meest de huidige standaardzorg in landen vergelijkbaar met Nederland en de huidige definitie van EGDT. Naast het ontbreken van een voordeel van EGDT, was er in deze Individual Patient Data MetaAnalysis (IPDMA) ook sprake van nadelen voor patiënten (langer verblijf op IC, meer cardiovasculaire ondersteuning) en hogere kosten. In deze IPDMA was er ook voor de patiënten met ernstiger shock (en dus hoger risico op mortaliteit) geen voordeel van EGDT.
Bloeddruk, op de IC meestal gemeten als MAP, is een basisparameter die in de Nederlandse situatie gemakkelijk gemeten kan worden. Arterielijnsystemen, die een continue, invasieve, bloeddruk meten, kunnen de parameter vrijwel real-time op een monitor weergeven. Indien de bloeddruk niet-invasief wordt gemeten (niet-invasieve bloeddruk, NIBD) kan de MAP gemakkelijk worden berekend (2x diastolische + systole bloeddruk)/3 in mmHg). Bloeddruk is ook een parameter die al lang kan worden gemeten en van oudsher (ook) voor optimalisatie van vloeistoftoediening wordt gebruikt. Naar welke waarde gestreefd moet worden is minder duidelijk. Wel is het zo dat, hoe meer middelen moeten worden gebruikt om de bloeddruk te verhogen (vocht, vasopressie), hoe meer kans de patiënt heeft om complicaties van deze behandelingen op te lopen.
In deze analyse werd één studie meegenomen die verschillende MAP-streefwaarden vergeleek. Omdat streven naar een MAP van 80 tot 85 mmHg geen voordeel had boven streven naar 65 tot 70 mmHg is de aanbeveling van de werkgroep te streven naar lagere (minst belastende) waarde. Overigens moet vermeld worden dat de bereikte MAP in deze groep lag tussen de 70 en 75 mmHg; of de uitkomsten anders zouden zijn als de streefwaarden wel waren bereikt, kunnen geen uitspraken over worden gedaan. Wanneer een patiënt met (verdenking op) sepsis duidelijk anders is dan de in deze studie geïncludeerde patiënten kan natuurlijk van deze regel worden afgeweken.
Voor alle overige parameters die vloeistoftoediening kunnen sturen werd geen effect op mortaliteit gevonden (figuur 6). Daarbij moet gezegd worden dat veel van deze studies te klein zijn om een statistisch en klinisch significant verschil te kunnen aantonen en dat alleen RCT’s en systematische reviews zijn geïncludeerd. Daarbij werden parameters vaak ook met elkaar vergeleken in plaats van met standaardzorg, hetgeen de interpretatie bemoeilijkt. Het bundelen van verschillende parameters werd niet zinvol geacht.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het doel van de behandeling voor de patiënt is ten eerste de sepsis te overleven. Gelukkig is er de laatste jaren ook aandacht voor aspecten van de kwaliteit van dit overleven. Enerzijds is het belangrijk de behandeling zo weinig belastend als mogelijk te maken; anderzijds willen patiënten hun ziekte episode met zo min mogelijk restverschijnselen overleven. Dit geldt zowel voor fysieke restverschijnselen (bijvoorbeeld dialyse afhankelijkheid, verlies van ledematen) als voor cognitieve en mentale consequenties.
Tegen deze achtergrond is het logisch te streven zoveel vocht te geven als nodig is, maar niet meer dan dat (belasting van de behandeling).
De parameters waarop vochttoediening wordt gestuurd moeten liefst zo min mogelijk invasief zijn. Ook is het voor de patiënt voordelig als deze parameters gemakkelijk en snel, op zoveel mogelijk afdelingen in het ziekenhuis en op de SEH, gemeten en vervolgd kunnen worden. Indien er geen voordeel is van agressievere behandeling (zoals bij het streven naar een hogere MAP) moet de lagere streefwaarde worden gekozen.
Kosten (middelenbeslag)
De werkgroep beschouwt het gebruik van lactaat als parameter om de therapie van sepsispatiënten in het ziekenhuis (in aanvulling op standaardzorg) te sturen als niet kostbaar, omdat de bepaling de totale kosten van de behandeling nauwelijks beïnvloedt. Als na de initiële resuscitatie volgens de SSC richtlijn (Rhodes, 2017) het lactaat gedurende 48 uur elke 6 uur bepaald zou worden kost dat circa 80 euro per patiënt. Omdat bij de meeste patiënten de respons op therapie al eerder zal plaatsvinden zijn de kosten vrijwel zeker lager. Bovendien zijn de kosten van deze bepaling veel lager dan veel, meer invasieve en gecompliceerde, metingen die in het kader van deze richtlijn onderzocht zijn. Hoewel er geen formele kosteneffectiviteit studie beschikbaar is ziet de werkgroep de kosten van deze bepaling niet als belemmering voor implementatie.
Aanvaardbaarheid voor de overige relevante stakeholders
De werkgroep ziet geen morele of ethische bezwaren tegen het gebruik van lactaat als parameter om therapie mede op te sturen. Wel wil de werkgroep expliciet maken dat lactaatmeting niet als zinvol wordt beschouwd als de klinische situatie van de patiënt gestabiliseerd is en er geen onderliggende klinische vraag meer is en/of het lactaat is genormaliseerd (< 2 mmol/l).
Haalbaarheid en implementatie
Er is geen procesevaluatie beschikbaar over dit onderwerp. De werkgroep ziet wel als bezwaar dat er soms binnen minder dan zes uren noodzaak is tot evalueren van de noodzaak tot geven van vloeistoftherapie bij patiënten met sepsis. Hoewel hierover geen data beschikbaar zijn, adviseert de werkgroep om zo nodig het interval tussen lactaat metingen te verkleinen (expert opinion). De werkgroep adviseert om in elk geval niet binnen twee uur opnieuw een lactaatmeting, met als doel de vloeistoftherapie te sturen, te verrichten (expert opinion). Deze aanbevelingen passen ook binnen de aanbevelingen van de SSC richtlijn (Rhodes, 2017), die wereldwijd als veldnorm kan worden beschouwd. Er kunnen andere redenen zijn voor bepaling binnen twee uur, die buiten het bestek van deze richtlijn vallen.
Bij patiënten bij wie het lactaat bij een meting al onder de 2 mmol/l is, acht de werkgroep het niet mogelijk om deze parameter te gebruiken om de vochttoediening te optimaliseren. Hoe de vochttoediening bij deze patiënten het best gestuurd kan worden is een kennislacune.
De werkgroep adviseert om het lactaat indien mogelijk arterieel te meten. Dit is ook conform de meetmethode in de geanalyseerde studies. Uit observationele studies is wel bekend dat het lactaat, indien het onder de 2 mmol/l is, goed correleert tussen arteriële en veneuze afnames. Bij een lactaat dat hoger is wordt de correlatie slechter (Theerawit, 2018; Datta, 2018) De werkgroep realiseert zich echter dat het soms niet (direct) mogelijk is om een arterieel lactaat te meten. In dat geval geeft de werkgroep de voorkeur aan het vlot afnemen van een veneus lactaat, boven het later of niet afnemen van een arterieel lactaat. Zo kan in elke geval de trend worden gevolgd en een indicatie verkregen worden van het lactaat.
Aanbeveling -1-
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep adviseert, in overeenstemming met de internationale SSC (Rhodes, 2017), om in de initiële resuscitatie fase te starten met 30 ml/kg (gebalanceerde) kristalloïden intraveneus in de eerste drie uur (Rhodes, 2017; ProCESS, 2014; ARISE, 2014; ProMISe, 2015). De werkgroep van deze richtlijn onderschrijft de kennislacune en heeft daarom besloten zich bij genoemd advies aan te sluiten. In aanvulling hierop wordt, op basis van expert opinion, geadviseerd de eerste 500 ml kristalloïden in de eerste 10 tot 30 minuten te geven bij patiënten met septische shock (zie module ‘Type resuscitatievloeistof’).
Aanbeveling-2
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep beschouwt het vroeg bepalen van een initieel lactaat bij patiënten in het ziekenhuis die verdacht worden van sepsis of septische shock als belangrijk, omdat hiermee vroege identificatie van patiënten met een hoge voorspelde mortaliteit mogelijk is. De parameter is gemakkelijker te meten. Lactaat (veneus of arterieel) kan ook op alle afdelingen in het ziekenhuis (in de Nederlandse situatie) worden gemeten. De bepaling kan gecombineerd worden met andere klinisch chemische bepalingen die bij opname of tijdens de behandeling van patiënten moeten worden verricht. Het is van belang te benoemen dat lactaat altijd gebruikt wordt in aanvulling op basale hemodynamische parameters die onderdeel zijn van standaardzorg. Het kan ook bij genormaliseerd lactaat nodig zijn de patiënt te vullen en bij verhoogd lactaat te stoppen met vullen, maar in dat geval draagt lactaatmeting niet (meer) bij aan de sturing daarvan. Lactaatmeting om andere redenen kan nuttig zijn, maar valt buiten het bestek van deze richtlijn.
Aanbeveling-3
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep ziet de huidige studies als onvoldoende om andere parameters dan lactaat te adviseren om de vloeistoftoediening van patiënten met (verdenking op) sepsis of septische shock te sturen, en ziet dit als een kennislacune. De werkgroep gaat ervan uit dat basale hemodynamische parameters (zoals MAP, of andere hemodynamische, microcirculatoire of cellulaire parameters) die onderdeel zijn van standaardzorg, altijd meegewogen worden in de beslisvorming.
Onderbouwing
Achtergrond
Verbetering van weefseloxygenatie en -perfusie door het tijdig toedienen van vocht, eventueel in combinatie met vasopressoren en inotropica, is een van de hoekstenen van de huidige behandeling van (verdenking op) sepsis. Hoewel vloeistofresuscitatie wereldwijd als een vast onderdeel van de behandeling van sepsis wordt beschouwd (Surviving Sepsis campaign (SSC): Rhodes (2017); NICE guideline (NG51): Tavaré (2017), is er geen goed wetenschappelijk bewijs dat deze praktijk ondersteunt. Naar verwachting zal dit bewijs er, onder andere om ethische redenen, ook niet snel komen.
Op basis van observationele data lijkt het in ieder geval gerechtvaardigd om bij patiënten met (verdenking op) sepsis te streven naar een snel herstel van euvolemie door het geven van vocht (ProCESS, 2014; ARISE, 2014; ProMISe, 2015). Hoe snel en hoe lang het vocht gegeven dient te worden en daarmee de cumulatieve hoeveelheid die nodig is om dit doel te bereiken, is echter niet eenduidig. Dit is afhankelijk van complexe, individuele en interacterende factoren zoals het stadium van sepsis en de hemodynamische status bij presentatie, de medische voorgeschiedenis en lichaamsbouw, het verlies van vocht enzovoorts. Waar men exact naar moet streven en hoe men de parameters dan moet monitoren is niet duidelijk. Er lijkt geen “one size fits all” benadering te zijn. Daarnaast zijn er ook aanwijzingen dat men na de initiële resuscitatiefase, wanneer de patiënt stabiliseert of niet meer op vochttoediening reageert, een restrictiever vochtbeleid moet voeren. Met name bij sepsispatiënten is er bewijs dat een langdurig positieve vochtbalans geassocieerd is met een slechtere prognose (Acheampong, 2015; Brotfain, 2016; Mitchell, 2015; de Oliveira, 2015).
Bij gebrek aan gecontroleerde studies, maar gesteund door observationele data uit verschillende internationale trials adviseert de SSC-richtlijn (Rhodes, 2017) om in de initiële resuscitatiefase indicatief te starten met 30 ml/kg kristalloïden intraveneus in de eerste drie uur (Rhodes, 2017; ProCESS, 2014; ARISE, 2014; ProMISe, 2015). De werkgroep van deze richtlijn onderschrijft de kennislacune en heeft daarom besloten zich bij genoemd advies aan te sluiten. In aanvulling hierop wordt, op basis van expert opinion, geadviseerd de eerste 500 ml (gebalanceerde) kristalloïden in de eerste 10 tot 30 minuten te geven (zie module ‘Type resuscitatievloeistof’).
Sommige patiënten met sepsis of septische shock zullen meer vloeistof nodig hebben dan hierboven geadviseerd, andere patiënten met (driegende) sepsis mogelijk minder. Daarom dienen bovenstaande adviezen slechts als uitgangsadvies en zal per patiënt de optimale snelheid, duur en cumulatieve vloeistofdosis moeten worden bepaald op basis van verschillende (hemodynamische) parameters.
In deze module wordt via een systematische analyse van wetenschappelijke literatuur onderzocht op welke (hemodynamische) parameter(s) toediening van vocht het beste gestuurd kan worden in patiënten met (verdenking op) sepsis om de prognose te verbeteren. Hierbij worden slechts de verschillende methodes met elkaar vergeleken. De nagestreefde doelen per methode staan, waar mogelijk, beschreven in de evidencetabellen. In een poging deze brede vraag te structureren is de interventie onderverdeeld in vier brede arbitraire categorieën, te weten: vochttoediening gestuurd op parameters van microcirculatoire en cellulaire parameters, volgens een early goal directed therapy (EGDT) protocol, op de MAP, of op overige hemodynamische parameters.
Conclusies / Summary of Findings
Microcirculatoire en cellulaire parameters: lactaat- versus ScvO2-gestuurde therapie
1.1 Mortaliteit
|
Redelijk GRADE |
Lactaatgestuurde therapie resulteert waarschijnlijk in een lagere mortaliteit dan ScvO2-gestuurde therapie in patiënten met sepsis, ernstige sepsis of septische shock.
Bronnen: (Jones, 2010; Puskarich, 2012; Tian, 2012; Yu, 2013; Wang, 2014; Lyu, 2015; Zhou, 2017) |
1.2 Verblijfsduur ziekenhuis/IC
|
Laag GRADE |
Lactaatgestuurde therapie vermindert mogelijk de verblijfsduur op de IC ten opzichte van ScvO2-gestuurde therapie in patiënten met sepsis, ernstige sepsis of septische shock.
Bronnen: (Jones, 2010; Tian, 2012; Yu, 2013; Wang, 2014; Lyu, 2015; Zhou, 2017) |
|
Zeer laag GRADE |
Het is onduidelijk of lactaatgestuurde therapie de verblijfsduur in het ziekenhuis vermindert ten opzichte van ScvO2-gestuurde therapie in patiënten met sepsis, ernstige sepsis of septische shock.
Bronnen: (Jones, 2010; Yu, 2013) |
Microcirculatie: skeletspieroxygenatie
1.3 Mortaliteit
|
Laag GRADE |
Er is mogelijk geen toegevoegde waarde van sturing op skeletspieroxygenatie om mortaliteit te beperken in patiënten met ernstige sepsis of septische shock.
Bronnen: (Nardi, 2013; Nardi, 2018) |
1.4 Verblijfsduur IC
|
Laag GRADE |
Er is mogelijk geen toegevoegde waarde van sturing op skeletspieroxygenatie om verblijfsduur op de IC te beperken in patiënten met ernstige sepsis of septische shock.
Bronnen: (Nardi, 2013) |
Microcirculatie: v-a CO2/a-v O2-verschil versus ScvO2
1.6 Mortaliteit
|
Laag GRADE |
Er is mogelijk geen verschil in mortaliteit tussen behandeling gestuurd op veno-arterieel CO2/arterieel-centraal veneus zuurstofverschil en behandeling gestuurd op ScvO2 in patiënten met ernstige sepsis of septische shock.
Bronnen: (Su, 2018) |
1.7 Verblijfsduur ziekenhuis/IC
|
Laag GRADE |
Er is mogelijk geen verschil in verblijfsduur in het ziekenhuis of op de IC tussen behandeling gestuurd op veno-arterieel CO2/arterieel-centraal veneus zuurstofverschil en behandeling gestuurd op ScvO2 in patiënten met sepsis, ernstige sepsis of septische shock.
Bronnen: (Su, 2018) |
Microcirculatoire en cellulaire parameters: PtcO2 versus DO2
1.8 Mortaliteit
|
Zeer laag GRADE |
We zijn onzeker of behandeling gestuurd op PtcO2 mortaliteit kan verminderen vergeleken met behandeling gestuurd op DO2 in beademde IC-patiënten met ernstige sepsis of septische shock.
Bronnen: Yu, 2007. |
1.9 Verblijfsduur ziekenhuis/IC
|
Zeer laag GRADE |
We zijn onzeker over het verschil in verblijfsduur in het ziekenhuis of op de IC tussen behandeling gestuurd op PtcO2 en behandeling gestuurd op DO2 in beademde IC-patiënten met ernstige sepsis of septische shock.
Bronnen: (Yu, 2007) |
EGDT versus standaard zorg
2.1 Mortaliteit
|
Redelijk GRADE |
EGDT resulteert waarschijnlijk in een kleine, mogelijk onbelangrijke vermindering van mortaliteit ten opzichte van standaardzorg in patiënten met ernstige sepsis of septische shock.
Bronnen: (Tuchschmidt, 1992; Yu, 1993; Hayes, 1994; Gattinoni, 1995; Alía, 1999; Rivers, 2001; Wang, 2006; Lin, 2006; Chen, 2007; Yan, 2010; EDGT group, 2010; ARISE, 2014; Lu, 2014; Andrews, 2014; ProCESS, 2014; ProMISe, 2015) |
|
Hoog GRADE |
EGDT resulteert niet in een vermindering van mortaliteit ten opzichte van de huidige* standaard zorg in patiënten met ernstige sepsis of septische shock.
* Op basis van verschil in mortaliteit bij dezelfde ziekte-ernst, worden studies verricht vanaf de start van ondergenoemde bronnen als ‘huidige standaard zorg’ beschouwd.
Bronnen: (ARISE, 2014; ProCESS, 2014; ProMISe, 2015) |
2.2 Verblijfsduur in ziekenhuis of op IC
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in verblijfsduur in het ziekenhuis of op de IC tussen EGDT en standaardzorg in patiënten met ernstige sepsis of septische shock.
Bronnen: (Rivers, 2001; Jones, 2010; ARISE, 2014; ProCESS, 2014; ProMISe, 2015) |
Lactaat- versus EGDT-gestuurde therapie
2.1 Mortaliteit
|
Laag GRADE |
Lactaatgestuurde therapie zou mortaliteit kunnen verminderen ten opzichte van EGDT in patiënten met ernstige sepsis of septische shock.
Bronnen: (Jones, 2010; Jansen, 2010; Tian, 2012; Yu, 2013; Wang, 2014) |
MAP
3.1 Mortaliteit
|
Laag GRADE |
Er is mogelijk geen verschil in mortaliteit na 28 dagen tussen behandeling gestuurd op hogere MAP (80 tot 85 mmHg) en behandeling gestuurd op lagere MAP (> 65 mmHg) in IC-patiënten met septische shock.
Bronnen: (Asfar, 2014) |
|
Redelijk GRADE |
Behandeling gestuurd op een hogere MAP vermindert mortaliteit na 90 dagen waarschijnlijk niet vergeleken met behandeling gestuurd op lage MAP in IC-patiënten met septische shock.
Bronnen: (Asfar, 2014) |
3.2 Verblijfsduur IC
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in verblijfsduur op de IC tussen behandeling gestuurd op hogere MAP en behandeling gestuurd op lage MAP in IC-patiënten met septische shock.
Bronnen: (Asfar, 2014) |
Diverse hemodynamische parameters
4.1 Mortaliteit
|
Laag GRADE |
Therapie gestuurd op VCI-CI lijkt de mortaliteit niet te verminderen ten opzichte van standaardzorg, EGDT of sturing op de centraal veneuze druk.
Bronnen: (Chen, 2005; Lanspa, 2018; Garg, 2016) |
|
Laag GRADE |
Therapieën gestuurd op de eind-diastolische druk of preload lijken mortaliteit niet te verminderen ten opzichte van sturing op centraal veneuze druk.
Bronnen: (Yu, 2017; Richard, 2015) |
|
Laag GRADE |
Therapie gestuurd op het hartminuutvolume lijkt de mortaliteit niet te verminderen ten opzichte van EGDT.
Bronnen: (Lu, 2015) |
|
Laag GRADE |
Therapie gestuurd op waarden van een PiCCO-katheter lijkt de mortaliteit niet te verminderen ten opzichte van sturing op de wiggedruk (PCWP).
Bronnen: (Trof, 2012) |
4.2 Verblijfsduur in ziekenhuis of op IC
|
Zeer laag GRADE |
Het is onduidelijk of therapieën gestuurd op extravasculair longwater, eind-diastolische druk of preload de verblijfsduur op de IC verminderen ten opzichte van sturing op centraal veneuze druk.
Bronnen: (Yao, 2017; Richard, 2015; Yu, 2017) |
|
Zeer laag GRADE |
Het is onduidelijk of therapie gestuurd op het hartminuutvolume gemeten met een PiCCO-katheter de verblijfsduur op de IC kan verminderen ten opzichte van EGDT.
Bronnen: (Lu, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk of therapie gestuurd op parameters van een PiCCO-katheter de verblijfsduur in het ziekenhuis of op de IC kan verminderen ten opzichte van sturing op PCWP.
Bronnen: (Trof, 2012) |
|
Zeer laag GRADE |
Het is onduidelijk of therapie gestuurd op maagtonometrie mortaliteit kan verminderen ten opzichte van sturing op cardiac index.
Bronnen: (Palizas, 2009) |
Samenvatting literatuur
Beschrijving studies
De drie reviews uit de eerste search (Lu, 2018; Zhang, 2017; Chen, 2017) beschreven grotendeels dezelfde artikelen. Daarin zijn 21 EGDT RCT’s geanalyseerd, gepubliceerd van 1992 tot en met 2015, met een totaal van 6144 patiënten. De reviews van Jiang (2016), Coccolini (2016) en Angus (2015) uit de tweede search gaven inzicht in de verblijfsduur in ziekenhuis/IC bij EGDT versus standaard zorg. Simpson (2016) beschreef een aantal studies die EGDT onderzochten; en maakte daarbij onderscheid tussen studies met hoge en lage mortaliteit in de controlegroep. In de systematische review van Pan (2019) worden lactaat- en centraal veneuze zuurstofsaturatie (ScvO2)-gestuurde behandeling vergeleken in zeven studies met in totaal 328 patiënten.
Asfar (2014) vergeleek in de SEPSISPAM-trial behandeling gestuurd op hoge versus lage MAP in 776 patiënten met septische shock. Als uitkomstmaten werden mortaliteit, verblijfsduur op IC en toegediend volume beschreven. Chen (2015) bestudeerde in een gerandomiseerde pilotstudie het effect van geminimaliseerde vloeistoftoediening bij patiënten met septische shock in 82 patiënten. Mortaliteit en toegediend volume waren de beschreven uitkomstmaten. Garg (2016) vergeleek in een gerandomiseerde pilotstudie sturing op samenvallen van de vena cava inferior (VCI) (collapsibility index, CI) met sturing op centraal veneuze druk (CVD) bij 36 patiënten met verdenking op sepsis, waarbij mortaliteit de primaire uitkomstmaat was. Kuan (2016) vergeleek in 122 patiënten met verdenking op sepsis sturing op basis van niet-invasieve meting van cardiac output en passief heffen van de benen (passive leg raise, PLR) en beschreef lactaatklaring, mortaliteit en verblijfsduur in ziekenhuis/IC in deze RCT. Lanspa (2018) vergeleek bij 30 patiënten met septische shock in een gerandomiseerde pilotstudie de mortaliteit tussen een groep gestuurd op VCI-CI bepaald met echocardiografie en een controlegroep met behandeling volgens EGDT. Lu (2015) bestudeerde in een RCT het effect van het toevoegen van pulse-indicated continuous cardiac output (PiCCO) aan EGDT op ziekenhuis- en IC-mortaliteit in 105 patiënten met septische shock. Nardi onderzocht de toegevoegde waarde van verbeterde skeletspieroxygenatie in een pilot (2013) en een RCT (2018). In de pilot werden mortaliteit, verblijfsduur op de IC en toegediend volume beschreven bij 30 patiënten met (dreigende) sepsis. In de RCT bij 103 patiënten met sepsis of septische shock werden mortaliteit, verslechtering van orgaanfunctie, en duur van ventilatie en vasopressortherapie beschreven. Palizas (2009) vergeleek bij 130 patiënten met septische shock de behandeling gestuurd op de pH van het maagslijmvlies met een cardiac index-gestuurde behandeling. In de RCT van Richard (2015) werd preload-gestuurde vochttoediening vergeleken met sturing op centraal veneuze druk (CVD) bij patiënten met septische shock (30 per groep), met de uitkomstmaten mortaliteit en IC-verblijfsduur. Su (2018) onderzocht mortaliteit en ziekenhuis/IC verblijfsduur bij patiënten met sepsis die behandeld werden volgens een P(v-a)CO2/C(a-v)O2 streefwaarde vergeleken met veneuze zuurstofsaturatie (ScvO2) gestuurde behandeling (114 patiënten per groep). In de RCT van Trof (2012) werd behandeling van patiënten met septische en niet-septische shock gebaseerd op monitoring met een transpulmonaire thermodilutie (PiCCO) katheter of een Swan-Ganz katheter. Bij de eerste werd gestuurd op extravasculaire longwater index (ELWI) en globale eind-diastolische volume index (GEDVI), bij de tweede op pulmonale wiggedruk (pulmonary capillary wedge pressure, PCWP). Alleen resultaten van de sepsispatiënten (respectievelijk 34 en 38 patiënten) werden geanalyseerd, met als uitkomstmaten ziekenhuis en IC-verblijfsduur en mortaliteit. Yao (2017) vergeleek bij patiënten met septische shock de behandeling gestuurd op ELWI en intra-thoracale bloedvolume index (ITBI) versus met CVD-gestuurde behandeling (44 patiënten per groep), en beschreef daarbij de verblijfsduur op de IC en de hoeveelheid toegediend volume. In de RCT van Yu (2007) werd sturing op transcutane partiële zuurstofdruk (PtcO2) vergeleken met sturing op zuurstofaanbod aan de weefsels (DO2) bij 69 patiënten met ernstige sepsis of septische shock, met als uitkomstmaten mortaliteit en verblijfsduur in het ziekenhuis of de IC. In de studie van Yu (2017) zijn COPD-patiënten met septische shock onderzocht, waarbij sturing op de globale eind-diastolische volume index (GEDVI, 34 patiënten) is vergeleken met sturing op de CVD (37 patiënten). Ook hier werden mortaliteit en verblijfsduur in het ziekenhuis of de IC als uitkomstmaten beschreven.
Resultaten
De resultaten van de verschillende studies zijn weergegeven per type interventie (sturing op microcirculatoire en cellulaire parameters, EGDT, MAP of overige (hemodynamische) parameters) en vervolgens per uitkomstmaat. Per type interventie is de bewijskracht beschreven.
1. Microcirculatoire en cellulaire parameters
Uit de literatuur kwamen verschillende behandelstrategieën naar voren die gebaseerd zijn op microcirculatoire en cellulaire parameters.
Lactaat versus ScvO2
1.1 Uitkomstmaat: Mortaliteit (cruciaal)
In de recente systematische review van Pan (2019) zijn zeven studies beschreven die het verschil in mortaliteit (all-cause mortality) tussen een lactaatgestuurde behandeling (early lactate clearance guided therapy, 652 patiënten) en een ScvO2-behandeling (649 patiënten) onderzoeken bij patiënten met sepsis, ernstige sepsis of septische shock. De mortaliteit (na 28 dagen (vier studies), na 60 dagen (één studie) en bij ziekenhuisontslag (twee studies) was significant lager in eerstgenoemde situatie, met een relatief risico (risk ratio, RR) van 0,68, met een 95% betrouwbaarheidsinterval (BI) van 0,57 tot 0,82, zoals weergegeven in figuur 1. Dit verschil is klinisch relevant.
Figuur 1 Mortaliteit bij lactaat- versus ScvO2-gestuurde behandeling
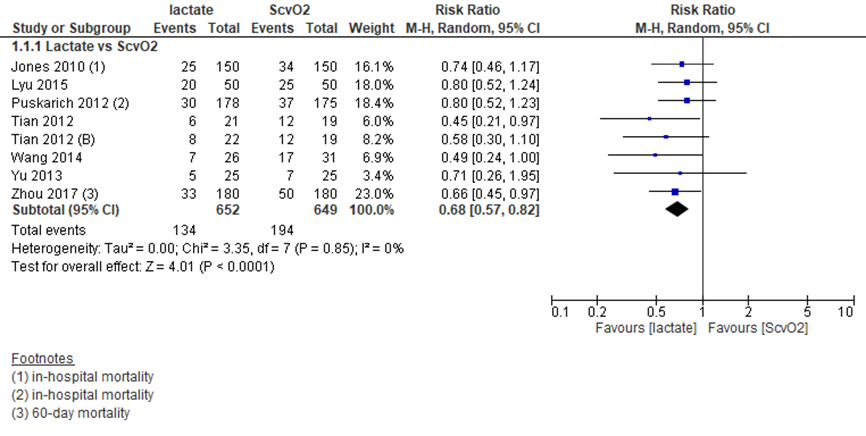
ScvO2: centraal veneuze zuurstofsaturatie; Z: p-waarde van gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Mortaliteit na 28 dagen, tenzij anders aangegeven
1.2 Uitkomstmaat: verblijfsduur in ziekenhuis/IC (belangrijk)
Bij de vergelijking van het effect van lactaat-gestuurde en ScvO2-gestuurde behandeling van 350 patiënten met sepsis of septische shock op verblijfsduur in het ziekenhuis, werd een gemiddeld verschil van -2,09 (95% BI -6,65 tot 2,48) dagen gevonden in het voordeel van lactaat (figuur 2). Dit verschil is niet statistisch significant. Voor verblijfsduur op de IC was het gemiddeld verschil -1,64 dagen (met een 95% BI van -3,23 tot -0,05) in het voordeel van lactaat-gestuurde therapie. Dit verschil, gebaseerd op 6 studies met in totaal 948 patiënten met sepsis of septische shock, is statistisch significant en klinisch relevant.
Figuur 2 Ziekenhuis/IC verblijfsduur (in dagen) bij lactaat- versus ScvO2-gestuurde behandeling
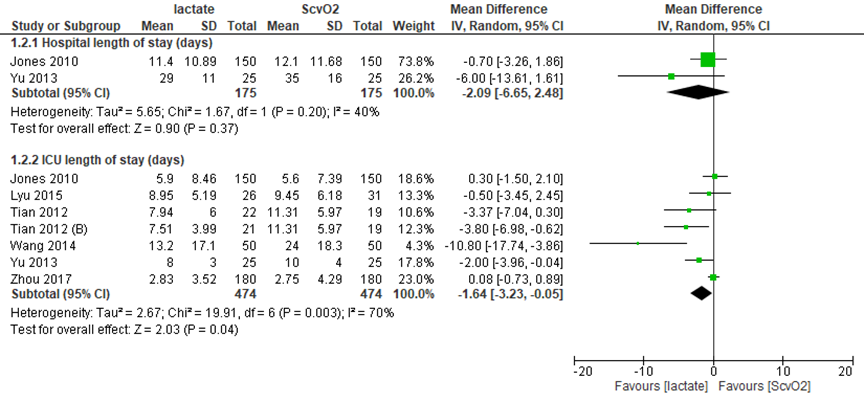
ScvO2: centraal veneuze zuurstofsaturatie; Z: p-waarde van gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor alle uitkomstmaten is gebaseerd op RCT’s en start derhalve hoog. Voor de uitkomstmaat mortaliteit is de bewijskracht is met één niveau verlaagd naar redelijk vanwege de beperkte populatieomvang (imprecisie).
De uitkomstmaat verblijfsduur op de IC is afgewaardeerd met twee niveaus tot laag vanwege een beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie). De uitkomstmaat verblijfsduur in het ziekenhuis is afgewaardeerd met drie niveaus naar zeer laag wegens beperkte populatieomvang en overschrijding van de grenzen van klinische relevantie (beide imprecisie), en wegens het risico op publicatiebias.
Skeletspieroxygenatie
In een pilotstudie (Nardi, 2013) en een daaropvolgende RCT (Nardi, 2018) is onderzocht wat de toegevoegde waarde is van sturing van behandeling op basis van skeletspieroxygenatie (door infraroodspectroscopie) in ten minste twee spieren ten opzichte van controlebehandeling volgens de richtlijnen van de SSC 2004 (Dellinger, 2004) bij patiënten die met ernstige sepsis of septische shock op de IC werden opgenomen.
1.3 Uitkomstmaat: Mortaliteit (cruciaal)
In de pilotstudie, met in beide groepen 15 patiënten, werd een RR op mortaliteit na 28 dagen gevonden van 1,38 in het voordeel van de controlegroep (95% BI 0,29 tot 6,60), en een RR op mortaliteit gedurende ziekenhuisverblijf van 1,83 in het voordeel van de controlebehandeling (95% BI 0,39 tot 8,57) maar deze verschillen waren niet statistisch significant. Ook in de RCT was er geen statistisch significant verschil in mortaliteit tussen de experimentele groep (N=54) en de controlegroep (N=49) na 30 dagen (RR 1,04; 95% BI 0,45 tot 2,40). Wanneer data uit de pilot en RCT gepoold worden weergegeven, wordt een RR op mortaliteit na 28/30 dagen gevonden van 1,07 met een 95% BI van 0,64 tot 1,79. Dit is niet significant.
1.4 Uitkomstmaat: verblijfsduur op de IC (belangrijk)
De verblijfsduur op IC had een gemiddeld verschil van -4,50 dagen (95% BI -25,1 tot 16,1) in het voordeel van de experimentele behandeling. Dit is een zeer breed betrouwbaarheidsinterval en geen statistisch significant verschil.
Bewijskracht van de literatuur
De bewijskracht voor alle uitkomstmaten is gebaseerd op RCT’s en start derhalve hoog, maar is afgewaardeerd met twee niveaus tot laag vanwege een beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie).
v-a CO2/a-v O2-verschil versus ScvO2
1.5 Uitkomstmaat: Mortaliteit (cruciaal)
In de RCT van Su (2018) werd behandeling gestuurd op veno-arterieel CO2/arterieel-centraal veneus zuurstofverschil vergeleken met behandeling gestuurd op ScvO2 bij IC-patiënten met ernstige sepsis of septische shock. Dit gaf geen significant verschil in mortaliteit na 28 en na 60 dagen, met een RR van 1,28 (95% BI 0,81 tot 2,02) in het voordeel van ScvO2, bij in totaal 228 patiënten.
1.6 Uitkomstmaat: verblijfsduur in ziekenhuis/IC (belangrijk)
Verblijfsduur in het ziekenhuis en op de IC waren niet significant verschillend tussen de groepen: voor verblijfsduur in het ziekenhuis werd een gemiddeld verschil van 2,00 dagen (95% BI -2,71 tot 6,71) gevonden, voor IC 1,00 dag (95% BI -1,04 tot 3,04) in het voordeel van sturing op v-a CO2/a-v O2-verschil.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten mortaliteit en verblijfsduur in ziekenhuis/IC is gebaseerd op RCT’s en start derhalve hoog. Er is afgewaardeerd met twee niveaus tot laag vanwege een beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie).
PtcO2 versus DO2
1.7 Uitkomstmaat: Mortaliteit (cruciaal)
De RCT van Yu (2007) vergeleek sturing op transcutaneous oxygen tension (PtcO2) versus sturing op “oxygen delivery” (zuurstofafgifte, DO2) in 69 IC-patiënten met ernstige sepsis en septische shock die een arteria pulmonalis katheter kregen, waarbij een lagere mortaliteit werd gevonden in de PtcO2 groep, met een RR van 0.32 (95% BI 0,13 tot 0,81).
1.8 Uitkomstmaat: verblijfsduur in ziekenhuis/IC (belangrijk)
Het relatieve verschil in verblijf in het ziekenhuis was -8,00 dagen (95% BI -23,25 tot 7,25) en op de IC -2,00 dagen (95% BI -9,22 tot 5,22) in het voordeel van PtcO2. Gezien de zeer brede betrouwbaarheidsintervallen waren deze verschillen niet significant (Yu, 2007).
Bewijskracht van de literatuur
De bewijskracht voor alle uitkomstmaten is gebaseerd op RCT’s en start derhalve hoog, maar is afgewaardeerd met drie niveaus tot zeer laag vanwege beperkingen in de onderzoeksopzet (risico op bias), vanwege een beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie).
2. Early-Goal-Directed-Therapy (EGDT)
EGDT is in zeer veel studies beschreven, waarbij het belangrijk is op te merken dat zowel de definities van EGDT als van standaard zorg in de loop der tijd veranderd zijn. In tabel 1 is een overzicht gemaakt van de verschillende gehanteerde parameters en hun streefwaarden die binnen de studies als EGDT werden gerapporteerd. Zoals in het overzicht te zien is, zijn in verschillende studies zeer verschillende definities gebruikt. Sinds de studie van Rivers uit 2001 zijn de parameters eenduidiger geworden en zijn veelal de streefwaarden ScvO2 ≥70%, CVD 8 tot 12 mm Hg, MAP ≥ 65 mm Hg (en/of systolische bloeddruk (SBD) ≥ 90 mm Hg), urineproductie ≥ 0,5 mL/kg/h gehanteerd, maar nog steeds met een zekere variatie in gevolgde parameters.
Tabel 1 Parameters en streefwaarden gehanteerd als EGDT
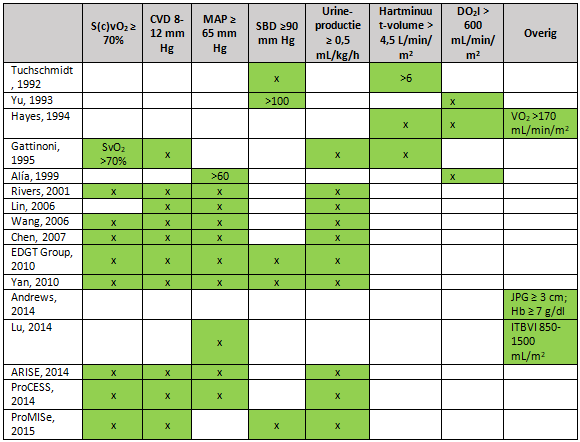
CVD: centraal veneuze druk; DO2I: weefselzuurstofaanbod index; Hb: hemoglobine; ITBVI: intrathoracale bloedvolume index; JPG: jugulaire polsgolf; MAP: gemiddelde arteriële bloeddruk; SBD: systolische bloeddruk; ScvO2: centraal veneuze zuurstofsaturatie; SvO2: Gemengd veneuze zuurstofsaturatie; VO2: zuurstofopname
2.1. Uitkomstmaat: Mortaliteit (cruciaal)
In 21 studies werd het effect van EGDT onderzocht vergeleken met andere zorg. Bij in totaal 6144 patiënten met ernstige sepsis of septische shock werd een gepoold RR van 0,97 (95% BI van 0,85 tot 1,11) gevonden in het voordeel van EGDT. Dit verschil was niet significant. De statistische heterogeniteit was met 66% hoog.
Naar de analyse van Lu (2018) is onderscheid gemaakt in EGDT versus standaard zorg en EGDT versus lactaatgestuurde therapie. Eerstgenoemde vergelijking, met zestien studies van in totaal 5540 patiënten, had een RR van 0,88 (95% BI 0,78 tot 1,00) in het voordeel van EGDT, met nog altijd een hoge statistische heterogeniteit van 60%. Dit verschil was niet klinisch relevant (Tuchschmidt, 1992; Yu, 1993; Hayes, 1994; Gattinoni, 1995; Alía, 1999; Rivers, 2001; Wang, 2006; Lin, 2006; Chen, 2007; Yan, 2010; EDGT-group, 2010; ARISE, 2014; Lu, 2014; Andrews, 2014; ProCESS, 2014; ProMISe, 2015). Vijf studies met in totaal 604 patiënten vergeleken EGDT met lactaatgestuurde therapie, waarbij een RR van 1,60 (95% BI 1,24 tot 2,06) werd gevonden in het voordeel van lactaat gestuurde behandeling, met een statistische heterogeniteit van 0%, zoals weergeven in figuur 3. Dit was een klinisch relevant verschil (Jones, 2010; Jansen, 2010; Tian, 2012; Yu, 2013; Wang, 2014).
Figuur 3 Mortaliteit bij EGDT versus standaard zorg of lactaatgestuurde therapie
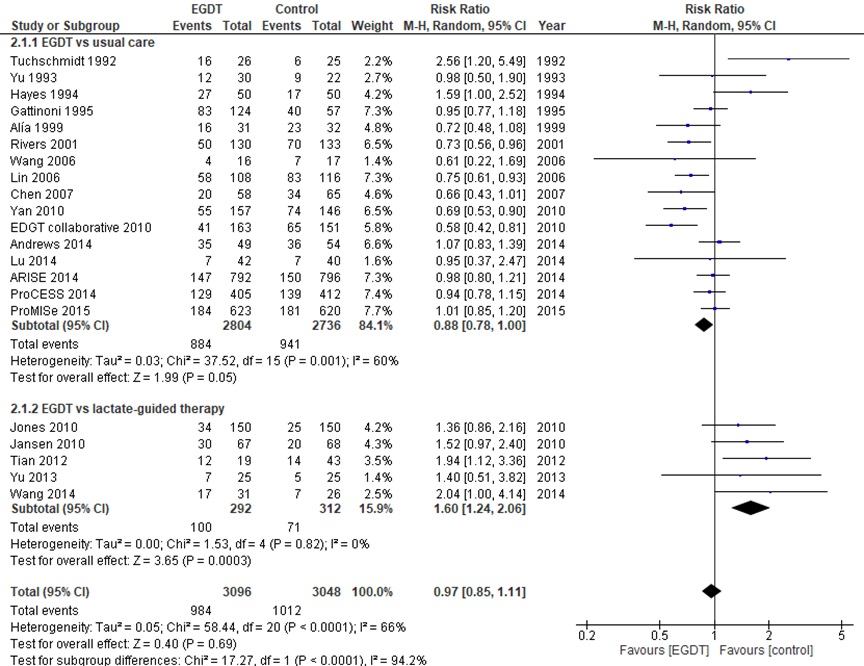
EGDT: Early Goal-Directed Therapy; Z: p-waarde van gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
In de systematische review van Simpson (2012) is een subgroepanalyse uitgevoerd op basis van mortaliteit in de controlegroep (standaard zorg). In beide subgroepen komt de heterogeniteit daarmee op 0% uit, dus dit lijkt een goede verklaring te vormen voor de variatie in uitkomsten tussen de studies. Zoals weergegeven in tabel 1 zijn de gebruikte streefwaarden tussen de studies vergelijkbaar. Waarschijnlijk weerspiegelt het verschil een verbetering van standaardzorg in de tijd, aangezien de drie studies met een hoge mortaliteit tussen 2001 en 2010 zijn gepubliceerd, en de drie studies met lage mortaliteit uit 2014 en 2015 komen (figuur 4) en de patiënten in alle studies ongeveer even ziek op basis van ziekte-ernst scores waren. Daarnaast is in de werkgroep besproken of een behandeling op de spoedeisende hulp versus de IC een deel van de verschillen in uitkomsten zou kunnen verklaren. In de studies is echter niet duidelijk beschreven waar de behandeling plaatsvindt. Bovendien is het bekend dat er verschillen zijn in criteria voor behandeling op IC tussen landen en zorginstellingen. Er is besloten dit niet verder uit te werken.
Figuur 4 Mortaliteit bij EGDT versus standaard zorg, gesplitst per controlegroep mortaliteit
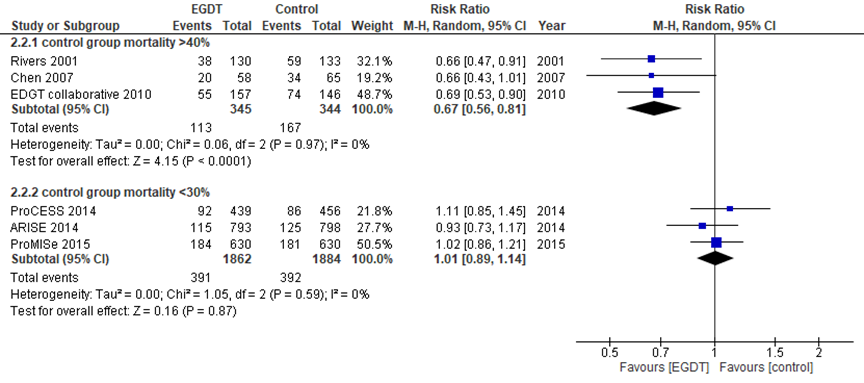
EGDT: Early Goal-Directed Therapy; Z: p-waarde van gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
2.2 Uitkomstmaat: verblijfsduur in ziekenhuis/IC (belangrijk)
Naast mortaliteit is een aantal secundaire uitkomstmaten geanalyseerd. Op basis van vier studies (Rivers, 2001; ARISE, 2014; ProCESS, 2014; ProMISe, 2015) verschilde verblijfsduur in het ziekenhuis of op de IC niet tussen behandeling volgens EGDT of standaard zorg, zoals weergegeven in figuur 5. Verblijfsduur in het ziekenhuis gaf een gemiddeld verschil van 0,04 dagen, met een 95% BI van -0,43 tot 0,52 (totaal 3458 patiënten). Ook verblijf op de IC was niet verschillend, met een gemiddeld verschil van -0,02 dagen, met een 95% BI van -0,47 tot 0,43 (totaal 3876 patiënten).
Figuur 5 Verblijfsduur (in dagen) in ziekenhuis of op IC bij EGDT versus andere zorg
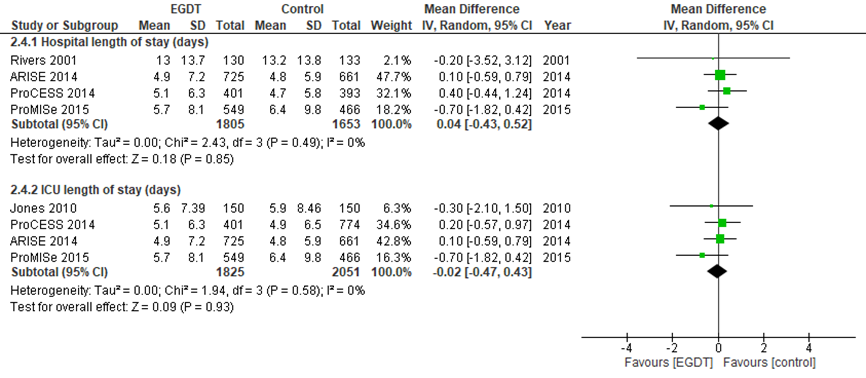
EGDT: Early Goal-Directed Therapy; IC: intensive care; Z: p-waarde van gepoolde effect; df: vrijheidsgraden; I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten is gebaseerd op gerandomiseerd onderzoek en start derhalve hoog. Voor de vergelijking tussen EGDT en standaard zorg werd met één niveau verlaagd naar redelijk voor tegenstrijdige resultaten (inconsistentie). De vergelijking tussen EGDT en lactaat-gestuurde therapie is met twee niveaus verlaagd naar laag gezien beperkingen in de onderzoeksopzet (risk of bias) en de beperkte populatieomvang (imprecisie).
De uitkomstmaat verblijfsduur in ziekenhuis en IC is met één niveau verlaagd naar redelijk gezien de beperkte populatieomvang (imprecisie).
3. MAP
De studie van Asfar (2014) vergeleek verschillende streefwaarden voor de MAP: een hoge waarde van 80 tot 85 mmHg versus een lage waarde van 65 tot 70 mmHg bij patiënten met septische shock op de IC (388 patiënten per groep). Hierbij werden geen significante verschillen gevonden in mortaliteit en IC-verblijfsduur. Belangrijk is dat de geobserveerde waarden in beide groepen hoger waren dan de genoemde streefwaarden (85 tot 90 mmHg versus 70 tot 75 mmHg).
3.1. Uitkomstmaat: Mortaliteit (cruciaal)
De mortaliteit op 28 en 90 dagen was niet verschillend tussen de hoge en de lage MAP-groep (388 patiënten per groep). Op 28 dagen was het RR 1,08 (95% BI 0,89 tot 1,30) in het voordeel van lage MAP, op 90 dagen was dit 1,04 (95% BI 0,88 tot 1,22).
3.2 Uitkomstmaat: verblijfsduur op IC (belangrijk)
De verblijfsduur op de IC was gelijk tussen de hoge en lage MAP-groep, met een betrouwbaarheidsinterval van -1,31 tot 1,31 dagen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten is gebaseerd op RCT’s en start derhalve hoog. Er is afgewaardeerd met twee niveaus tot laag vanwege een beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie) voor de uitkomstmaten mortaliteit na 28 dagen en toegediend volume. Voor de uitkomstmaten mortaliteit op 90 dagen en verblijfsduur op de IC is met één niveau afgewaardeerd tot redelijk vanwege de beperkte populatieomvang.
4. Vergelijking van diverse hemodynamische parameters
Een aantal studies met beperkte populatiegrootte vergeleek het effect van sturing op overige parameters met elkaar of met standaard zorg of EGDT. Er waren geen zinvolle combinaties te maken, dus de resultaten zijn alleen afzonderlijk beschreven. Voor de leesbaarheid zijn de resultaten beschreven per uitkomstmaat.
Figuur 6 Mortaliteit bij diverse hemodynamische streefwaarden
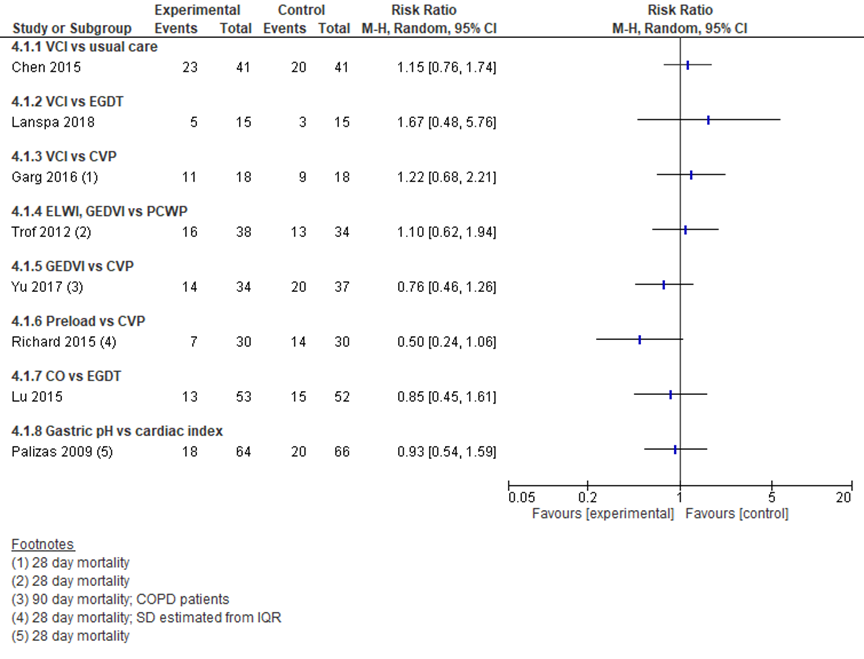
CO: hartminuutvolume; CVP: centraal veneuze druk; EGDT: Early-Goal-Directed-Therapy; ELWI: extravasculair longwater index; GEDVI: globaal eind diastolische volume index; IVC: vena cava inferior collapsibiliteit; PCWP: pulmonale capillaire wiggedruk
4.1 Uitkomstmaat: Mortaliteit (cruciaal)
In figuur 6 is de mortaliteit van de afzonderlijke studies weergegeven. Geen van de verschillen waren statistisch significant. Bij een strategie van Chen (2015) om vloeistoftoediening te minimaliseren ten opzichte van standaardzorg bij 82 patiënten met septische shock op de IC, werd de vloeistofresponsiviteit getest door middel van de PLR of op basis van klinisch geïndiceerde vloeistoftoediening. Wanneer patiënten in de interventiegroep niet (meer) vloeistof-responsief waren, werd vloeistofminimalisatie toegepast, waarbij continu infuus werd geconcentreerd, onderhoudstoediening werd gestopt, en oplossingsmiddelen en -vloeistoffen werden geminimaliseerd. Er werd in deze studie een RR op mortaliteit na 28 dagen gevonden van 1,15 (95% BI 0,76 tot 1,74) in het voordeel van standaardzorg. In een studie van Lanspa (2018) werd een behandelstrategie op basis van echocardiografie vergeleken met EGDT bij volwassenen met septische shock op de IC, met vijftien patiënten per groep. Gedurende 6 uur werd in de interventiegroep ieder uur VCI-CI en myocarddisfunctie bepaald met echocardiografie. De resultaten werden vergeleken met een groep die volgens EGDT werd behandeld. Mortaliteit na 28 dagen was niet significant verschillend met een RR van 1,67 in het voordeel van EGDT (95% BI van 0,48 tot 5,76). Garg (2016) vergeleek, bij beademde patiënten op de IC, behandeling gebaseerd op VCI-CI en CVD, waarbij een RR op mortaliteit na 28 dagen van 1,22 werd gevonden, met een 95% BI van 0,68 tot 2,21 (totaal 36 patiënten). De studie van Trof (2012) bij 72 beademde patiënten met septische shock op de IC vond een RR op mortaliteit na 28 dagen van 1,10 en een 95% BI van 0,62 tot 1,94 bij de vergelijking tussen behandeling gestuurd op EVLW/GEDVI en op PCWP. GEDVI-gestuurde behandeling had een RR van 0,76 (95% BI 0,46 tot 1,26) ten opzichte van behandeling gebaseerd op CVD in de studie van Yu (2017), maar in deze studie bij 71 COPD-patiënten met septische shock op de IC werd mortaliteit gemeten na 90 dagen. De IC-mortaliteit (RR) in dezelfde studie was 0,76 (95% BI 0,33 tot 1,78). Lu (2015) bestudeerde bij 105 patiënten met ernstige sepsis of septische shock een mogelijke verbetering van volumeresuscitatie volgens EGDT door het continu volgen van cardiac output (met een PiCCO katheter), en vulling werd gestuurd op een ITBVI-streefwaarde tussen 850 en 1000 mL/m2. Vergeleken met EGDT waren er niet-significante afnames in ziekenhuismortaliteit (RR 0,85; 95% BI 0,45 tot 1,61) en IC-mortaliteit (RR 0,83; 95% BI 0,41 tot 1,68). Richard (2015) vond bij 60 patiënten met septische shock op de IC een RR op mortaliteit na 28 dagen van 0,50 met een 95% BI van 0,24 tot 1,06 bij de vergelijking van polsdrukvariatie (pulse pressure variation, PPV) versus CVD-gestuurde behandeling van septische shock. Ten slotte vond Palizas (2009) geen verschil in mortaliteit tussen behandeling gestuurd op maagtonometrie en behandeling gestuurd op cardiac index (RR 0,93; 95% BI van 0,54 tot 1,59) bij patiënten met septische shock op de IC.
4.2 Uitkomstmaat: verblijfsduur in ziekenhuis/IC (belangrijk)
Slechts een studie beschreef de verblijfsduur in het ziekenhuis. Trof (2012) vond een gemiddeld verschil van 2,00 dagen (95% BI -9,68 tot 13,68) in het voordeel van PCWP ten opzichte van EVLW. Het gemiddeld verschil in verblijfsduur op de IC in deze studie was -4,00 (95% BI -9,47 tot 1,47) in het voordeel van EVLW. Deze verschillen waren niet significant en de betrouwbaarheidsintervallen zeer groot. Yao (2017) vond een gemiddeld verschil van -4,04 dagen (95% BI -5,19 tot -2,89) in het voordeel van ELWI-gestuurde behandeling vergeleken met CVD-gestuurde behandeling. Dit verschil is statistisch significant. Yu (2017) vond bij de vergelijking tussen GEDVI- en CVD-gestuurde behandeling een statistisch significant gemiddeld verschil van -3,90 dagen (95% BI -4,83 tot -2,97) in het voordeel van GEDVI. In de studie van Richard (2015) werd een RR gerapporteerd van 4,00 dagen in het voordeel van CVD ten opzichte van PPV-gestuurde behandeling (95% BI van -2,77 tot 10,77), maar dit verschil was niet significant. In de studie van Lu (2015) werd naast mortaliteit ook de verblijfsduur op de IC beschreven. Een verschil van 2,4 dagen (95% BI 1,29 tot 3,51) werd gevonden in het voordeel van de PiCCO-groep, een statistisch significant verschil. De IC-verblijfsduur van de afzonderlijke studies is weergegeven in figuur 7.
Figuur 7 Verblijfsduur (in dagen) op de IC bij diverse hemodynamische parameters
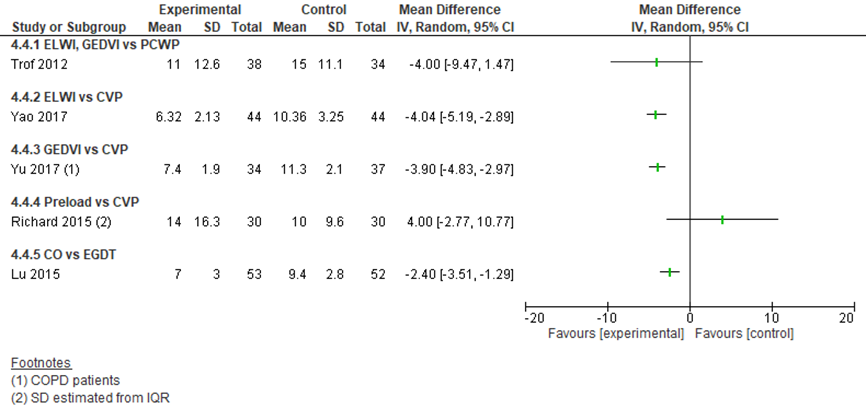
CO: hartminuutvolume; CVP: centraal veneuze druk; EGDT: Early Goal-Directed Therapy; ELWI: extravasculair longwater index; GEDVI: globaal eind-diastolische volume index; IVC: vena cava inferior collapsibiliteit; PCWP: pulmonale capillaire wiggedruk
Bewijskracht van de literatuur
Voor alle afzonderlijke vergelijkingen van overige hemodynamische waarden is de bewijskracht voor de alle uitkomstmaten gebaseerd op RCT’s, en start derhalve hoog. Voor de uitkomstmaat mortaliteit is de bewijskracht met twee niveaus verlaagd naar laag vanwege de zeer beperkte populatieomvang (imprecisie). De uitkomstmaten verblijfsduur in ziekenhuis of op IC zijn met drie niveaus verlaagd naar zeer laag vanwege de zeer beperkte populatieomvang (imprecisie) en vanwege beperkingen in de studieopzet (risk of bias).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patienten van 18 jaar en ouder met verdenking op sepsis in het ziekenhuis;
I: (1) vochttoediening gestuurd op parameters van microcirculatoire en cellulaire parameters;
(2) vochttoediening volgens een EGDT-protocol;
(3) vochttoediening gestuurd op de MAP;
(4) vochttoediening gestuurd op verschillende hemodynamische parameters.
C: standaard zorg of een andere interventie genoemd onder ‘I’;
O: 28d, 30d en 90d mortaliteit, verblijfsduur in het ziekenhuis of op de intensive care (IC).
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming cruciale uitkomstmaat, en verblijfsduur in het ziekenhuis of op de IC voor de besluitvorming belangrijke uitkomstmaten.
Verblijfsduur in het ziekenhuis of op de IC wordt deels bepaald door andere factoren dan de ernst van ziekte. Niet-medische factoren zoals beschikbaarheid van een step-down bed, de lokale logistiek en afspraken tussen afdelingen in een ziekenhuis bepalen mede bovenstaande uitkomsten. Om deze redenen beschouwt de werkgroep bovenstaande uitkomstmaten wel als belangrijk maar ook als deels subjectief.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen, maar sloot aan bij de door GRADE aangegeven standaardgrenzen (RR < 0,75 of > 1,25).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 20 november 2018 met relevante zoektermen gezocht naar relevante Engelstalige literatuur over de interventie EGDT bij sepsis en septische shock, gepubliceerd vanaf 2000. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Studies werden geselecteerd op basis van titel en abstract op relevantie voor de PICO. Drie systematische reviews werden geselecteerd en geanalyseerd. Vervolgens werd op 19 maart 2019 breder gezocht naar Engelstalige artikelen vanaf 2000 over de interventies “EGDT”, “microcirculation”, ”dynamic” en/of “static” “parameter”/”measure” bij (mogelijke) sepsis of septische shock. Van de 921 gevonden artikelen zijn 69 geselecteerd op basis van titel en abstract. Daarvan zijn zes systematische reviews en vijftien RCT’s op basis van de volledige tekst geselecteerd en geanalyseerd.
Resultaten
Negen systematische reviews en vijftien RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van het risico op bias van de afzonderlijke reviews en RCT’s is opgenomen in de risk-of-biastabellen.
Referenties
- Acheampong, A., & Vincent, J. L. (2015). A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit Care, 19, 251. doi:10.1186/s13054-015-0970-1.
- Andrews, B., Semler, M. W., Muchemwa, L., Kelly, P., Lakhi, S., Heimburger, D. C., Bernard, G. R. (2017). Effect of an early resuscitation protocol on in-hospital mortality among adults with sepsis and hypotension: A randomized clinical trial. JAMA - Journal of the American Medical Association, 318(13), 1233-1240.
- Angus, D. C., Barnato, A. E., Bell, D., Bellomo, R., Chong, C. R., Coats, T. J., Young, J. D. (2015). A systematic review and meta-analysis of early goal-directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Medicine, 41(9), 1549-1560.
- ARISE Investigators, Peake, S. L., Delaney, A., Bailey, M., Bellomo, R., Williams, P. (2014). Goal-directed resuscitation for patients with early septic shock. N Engl J Med, 371(16), 1496-1506. doi:10.1056/NEJMoa1404380.
- Asfar, P., Meziani, F., Hamel, J.-F., Grelon, F., Megarbane, B., Anguel, N., Investigators, S. (2014). High versus low blood-pressure target in patients with septic shock. N Engl J Med, 370(17), 1583-1593. doi:10.1056/NEJMoa1312173.
- Brotfain, E., Koyfman, L., Toledano, R., Borer, A., Fucs, L., Galante, O., Klein, M. (2016). Positive fluid balance as a major predictor of clinical outcome of patients with sepsis/septic shock after ICU discharge. Am J Emerg Med, 34(11), 2122-2126. doi:10.1016/j.ajem.2016.07.058.
- Chen, C., & Kollef, M. H. (2015). Targeted Fluid Minimization Following Initial Resuscitation in Septic Shock: A Pilot Study. Chest, 148(6), 1462-1469. doi:10.1378/chest.15-1525.
- Chen, X., Zhu, W., Tan, J., Nie, H., Liu, L., Yan, D., Sun, X. (2017). Early outcome of early-goal directed therapy for patients with sepsis or septic shock: a systematic review and meta-analysis of randomized controlled trials. Oncotarget, 8(16), 27510-27519. doi:10.18632/oncotarget.15550.
- Cioccari, L., Luethi, N., Weber, U., Hilton, A., Takala, J., & Bellomo, R. (2016). The native cardiac output in human sepsis: a systematic review. Critical care and resuscitation : journal of the Australasian Academy of Critical Care Medicine, 18(3), 148-156.
- Coccolini, F., Sartelli, M., Catena, F., Ceresoli, M., Montori, G., & Ansaloni, L. (2016). Early goal-directed treatment versus standard care in management of early septic shock: Meta-analysis of randomized trials. Journal of Trauma and Acute Care Surgery, 81(5), 971-978.
- Datta, D., Grahamslaw, J., Gray, A. J., Graham, C., & Walker, C. A. (2018). Lactate - Arterial and Venous Agreement in Sepsis: a prospective observational study. Eur J Emerg Med, 25(2), 85-91. doi:10.1097/mej.0000000000000437.
- de Oliveira, F. S. V., Freitas, F. G. R., Ferreira, E. M., de Castro, I., Bafi, A. T., de Azevedo, L. C. P., & Machado, F. R. (2015). Positive fluid balance as a prognostic factor for mortality and acute kidney injury in severe sepsis and septic shock. J Crit Care, 30(1), 97-101. doi:10.1016/j.jcrc.2014.09.002.
- Dellinger, R. P., Carlet, J. M., Masur, H., Gerlach, H., Calandra, T., Cohen, J., . . . Committee, S. S. C. M. G. (2004). Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Crit Care Med, 32(3), 858-873. doi:10.1097/01.ccm.0000117317.18092.e4.
- Garg, M., Sen, J., Goyal, S., & Chaudhry, D. (2016). Comparative evaluation of central venous pressure and sonographic inferior vena cava variability in assessing fluid responsiveness in septic shock. Indian J Crit Care Med, 20(12), 708-713. doi:10.4103/0972-5229.195706.
- Jiang, L., Zhang, M., Jiang, S., & Ma, Y. (2016). Early goal-directed resuscitation for patients with severe sepsis and septic shock: a meta-analysis and trial sequential analysis. Scandinavian journal of trauma, resuscitation and emergency medicine, 24, 23.
- Kuan, W. S., Ibrahim, I., Leong, B. S. H., Jain, S., Lu, Q., Cheung, Y. B., & Mahadevan, M. (2016). Emergency Department Management of Sepsis Patients: A Randomized, Goal-Oriented, Noninvasive Sepsis Trial. Annals of Emergency Medicine, 67(3), 367-378.
- Lanspa, M. J., Burk, R. E., Wilson, E. L., Hirshberg, E. L., Grissom, C. K., & Brown, S. M. (2018). Echocardiogram-guided resuscitation versus early goal-directed therapy in the treatment of septic shock: A randomized, controlled, feasibility trial. Journal of Intensive Care, 6(1).
- Lu, N.-F., Zheng, R.-Q., Lin, H., Shao, J., Yu, J.-Q., & Yang, D.-G. (2015). Improved sepsis bundles in the treatment of septic shock: a prospective clinical study. Am J Emerg Med, 33(8), 1045-1049. doi:10.1016/j.ajem.2015.04.031.
- Lu, Y., Zhang, H., Teng, F., Xia, W. J., Sun, G. X., & Wen, A. Q. (2018). Early Goal-Directed Therapy in Severe Sepsis and Septic Shock: A Meta-Analysis and Trial Sequential Analysis of Randomized Controlled Trials. Journal of Intensive Care Medicine, 33(5), 296-309.
- Nardi, O., Polito, A., Aboab, J., Colin, G., Maxime, V., Clair, B., . . . Annane, D. (2013). StO₂ guided early resuscitation in subjects with severe sepsis or septic shock: a pilot randomised trial. J Clin Monit Comput, 27(3), 215-221. doi:10.1007/s10877-013-9432-y.
- Nardi, O., Zavala, E., Martin, C., Nanas, S., Scheeren, T., Polito, A., . . . Annane, D. (2018). Targeting skeletal muscle tissue oxygenation (StO2) in adults with severe sepsis and septic shock: A randomised controlled trial (OTO-StS Study). BMJ Open, 8(3).
- Palizas, F., Dubin, A., Regueira, T., Bruhn, A., Knobel, E., Lazzeri, S., . . . Hernández, G. (2009). Gastric tonometry versus cardiac index as resuscitation goals in septic shock: a multicenter, randomized, controlled trial. Crit Care, 13(2), R44. doi:10.1186/cc7767.
- Pan, J., Peng, M., Liao, C., Hu, X., Wang, A., & Li, X. (2019). Relative efficacy and safety of early lactate clearance-guided therapy resuscitation in patients with sepsis: A meta-analysis. Medicine, 98(8), e14453.
- ProCESS Investigators, Yealy, D. M., Kellum, J. A., Huang, D. T., Barnato, A. E., Weissfeld, L. A., Angus, D. C. (2014). A randomized trial of protocol-based care for early septic shock. N Engl J Med, 370(18), 1683-1693. doi:10.1056/NEJMoa1401602.
- ProMISe Investigators, Mouncey, P. R., Osborn, T. M., Power, G. S., Harrison, D. A., Sadique, M. Z., Grieve, R. D., Rowan, K. M. (2015). Protocolised Management In Sepsis (ProMISe): a multicentre randomised controlled trial of the clinical effectiveness and cost-effectiveness of early, goal-directed, protocolised resuscitation for emerging septic shock. Health Technol Assess, 19(97), i-xxv, 1-150. doi:10.3310/hta19970.
- Rhodes, A., Evans, L. E., Alhazzani, W., Levy, M. M., Antonelli, M., Ferrer, R., . . . Dellinger, R. P. (2017). Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med, 43(3), 304-377. doi:10.1007/s00134-017-4683-6.
- Richard, J.-C., Bayle, F., Bourdin, G., Leray, V., Debord, S., Delannoy, B., . . . Guerin, C. (2015). Preload dependence indices to titrate volume expansion during septic shock: a randomized controlled trial. Crit Care, 19, 5. doi:10.1186/s13054-014-0734-3.
- Simpson, S. Q., Gaines, M., Hussein, Y., & Badgett, R. G. (2016). Early goal-directed therapy for severe sepsis and septic shock: A living systematic review. Journal of Critical Care, 36, 43-48.
- Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., . . . Angus, D. C. (2016). The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA, 315(8), 801-810. doi:10.1001/jama.2016.0287
- Su, L., Tang, B., Liu, Y., Zhou, G., Guo, Q., He, W., Long, Y. (2018). P(v-a)CO2/C(a-v)O2-directed resuscitation does not improve prognosis compared with SvO2 in severe sepsis and septic shock: A prospective multicenter randomized controlled clinical study. Journal of Critical Care, 48, 314-320.
- Tavaré, A., & O'Flynn, N. (2017). Recognition, diagnosis, and early management of sepsis: NICE guideline. Br J Gen Pract, 67(657), 185-186. doi:10.3399/bjgp17X690401.
- Theerawit, P., Na Petvicharn, C., Tangsujaritvijit, V., & Sutherasan, Y. (2018). The Correlation Between Arterial Lactate and Venous Lactate in Patients With Sepsis and Septic Shock. J Intensive Care Med, 33(2), 116-120. doi:10.1177/0885066616663169.
- Trof, R. J., Beishuizen, A., Cornet, A. D., de Wit, R. J., Girbes, A. R., & Groeneveld, A. B. (2012). Volume-limited versus pressure-limited hemodynamic management in septic and nonseptic shock. Crit Care Med, 40(4), 1177-1185. doi:10.1097/CCM.0b013e31823bc5f9.
- Yao, Y., Guan, Y., Zhuang, Y., Liu, W., Cui, J., & Sun, Y. (2017). Effects of fluid resuscitation under the guidance of PICCO on the immune function and inflammatory mediator in patients with septic shock. Biomedical Research (India), 28(22), 9722-9725.
- Yu, J., Zheng, R., Lin, H., Chen, Q., Shao, J., & Wang, D. (2017). Global end-diastolic volume index versus CVP goal-directed fluid resuscitation for COPD patients with septic shock: a randomized controlled trial. American Journal of Emergency Medicine, 35(1), 101-105.
- Yu, M., Chapital, A., Ho, H. C., Wang, J., & Takanishi, D., Jr. (2007). A prospective randomized trial comparing oxygen delivery versus transcutaneous pressure of oxygen values as resuscitative goals. Shock, 27(6), 615-622. doi:10.1097/shk.0b013e31802f0295.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Which hemodynamic goals should be pursued in the treatment of severe sepsis or septic shock?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Pan, 2019
|
SR and meta-analysis of RCTs
Literature search up to February 2018
A: Jones, 2010 B: Lyu, 2015 C: Puskarich, 2012 D: Tian, 2012 E: Wang 2014 F: Yu, 2013 G: Zhou 2017
Study design: RCT
Setting and Country: Central South University Xiangya Hospital, Changsha, Hunan China
Source of funding: This work is partially supported by grants from The Provincial Science Foundation of Hunan
Conflicts of interest: The authors report no conflicts of interests. |
Inclusion criteria SR: 1. adults with sepsis, severe sepsis, or septic shock 2. studies comparing combined lactate clearance-guided therapy with ScvO2-guided therapy 3. sufficient data available to calculate an relative ratio (RR) or mean difference (MD) with the 95% confidence interval 4. outcome measures that included mortality incidences.
Exclusion criteria SR: N.A.
7 studies included
Total N (intervention/ control): A: 300 (150/150) B: 100 (50/50) C: 353 (178/175) D: 62 (43/19) E: 57 (26/31) F: 50(25/25) G: 360 (180/180)
Age and sex were not reported in SR. |
Goals in lactate (LC) group:
A: LC>10%/6 h; UP >0.5 mL/kg/h; MAP>65mmHg B: LC>10%/6 h; UP >0.5 mL/kg/h; MAP>65mmHg C: LC>10%/6 h D: LC>10%/6 h OR LC >30%/6 h; UP>0.5 mL/kg/h; MAP>65mmHg E: LC >50%/6 h; UP >0.5 mL/kg/h; MAP >65mmHg F: LC>10%/6 h; UP >0.5 mL/kg/h; MAP>65mmHg G: LC>30%/6h; CVP >8mmHg; MAP>65mmHg
|
Goals in ScvO2>70% (control) group: A: ScvO2>70%; UP>0.5 mL/kg/h; MAP>65mmHg B: ScvO2>70%; UP>0.5 mL/kg/h; MAP>65mmHg C: ScvO2>70% D: ScvO2 >70%; UP >0.5 mL/kg/h; MAP >65mmHg
E: ScvO2>70%; UP>0.5 mL/kg/h; MAP>65mmHg F: ScvO2>70%; UP>0.5 mL/kg/h; MAP>65mmHg G: ScvO2>70%; CVP >8mmHg; MAP>65mmHg
|
End-point of follow-up:
A: in-hospital mortality B: 28-day mortality C: in-hospital mortality D: 28-day mortality E: 28-day mortality F: 28-day mortality G: 60-day mortality
For how many participants were no complete outcome data available? (intervention/control) Unclear.
Loss-to-follow-up: Not reported |
1. In-hospital mortality (primary outcome). Risk ratio (95% CI): A: 0.74 (0.46, 1.09) B: 0.71 (0.47, 1.09) C: 0.80 (0.52, 1.23) D (1): 0.45 (0.21, 0.97) D (2): 0.58 (0.30, 1.10) E: 0.49 (0.24, 1.00) F: 0.71 (0.26, 1.95) G: 0.66 (0.45, 0.97)
Pooled effect (random effects model): 0.68 (0.56, 0.82) favouring LC. Heterogeneity (I2): 0%
2. Hospital length of stay Mean difference (95% CI): A: -0.70 (-3.26, 1.86) F: -6.00 (-13.61, 1.61)
Pooled effect (random effects model): -1.24 (-3.66, 1.19) favouring LC. Heterogeneity (I2): 40%
3. ICU length of stay Mean difference (95% CI): A: 0.30 (-1.50, 2.10) B: -0.50 (-3.45, 2.45) D (1): -3.37 (-7.04, 0.30) D (2): -3.80 (6.98, -0.62) E: -10.80 (-17.74, -3.86) F:-2.00 (-3.96, -0.04) G: 0.08 (-3.23, -0.05)
Pooled effect (random effects model): -1.64 (-3.23, -0.05) favouring LC. Heterogeneity (I2): 70% |
|
|
Lu, 2018
|
SR and meta-analysis of RCTs
Literature search up to February 2016
EGDT versus usual care A: Rivers, 2001 B: Lin, 2006 C: Chen, 2007 D: Yan, 2010 E: Andrews, 2014 F: ARISE, 2014 G: ProCESS, 2014 H: ProMISe, 2015
EGDT versus lactate clearance–guided therapy I: Jansen, 2010 J: Jones, 2010 K: Tian, 2012 L: Yu, 2013 M: Wang, 2014
Study design: RCT
Setting and Country: Department of Blood Transfusion, Research Institute of Surgery, Daping Hospital, Third Military Medical University, Chongqing, China
Source of funding and conflicts of interest: The author(s) received no financial support for the research, authorship, and/or publication of this article.
The author(s) declared no potential conflicts of interest with respect to the research, authorship, and/or publication of this article. |
Inclusion criteria SR: 1. study population comprised adult patients with severe sepsis or septic shock; 2. intervention group received a 6-hour protocol of EGDT; 3. comparison group received usual care or lactate clearance–guided therapy.
Exclusion criteria SR: N.A.
13 studies included
N, condition, care unit, mean age, sex A: 263, severe sepsis 47.1%, septic shock 52.9%, ED, age 67.1 ± 17.4, 50.8% male B: 224, septic shock, ICU, age 67.2 ± 15.0, 59.3% male C: 123, severe sepsis, ICU, age 51.3 ± 16.8, 66.2% male D: 303, severe sepsis/septic shock, ICU, age 68.9 ± 15.6, 75.2% male E: 103, severe sepsis, ED, age 35.2 ± 1.3, 52.8% male F: 1588, septic shock, ED, age 62.7 ± 16.4, 60.2% male G: 817, septic shock, ED, age 60 ± 16.4, 52.8% male H: 1243, septic shock, ED, age 66.4 ± 14.6, 57% male
I: 135, severe sepsis 51.1%, septic shock 48.9%, ICU, age 62.0 ± 18.0, 62% male J: 300, severe sepsis 18.4%, septic shock 81.6%, ED, age 61.6 ± 17.6, 53% male K: 62, Septic shock, ICU, 46.2 ± 16.3, sex not reported L: 50, severe sepsis 31%, septic shock 69%, ICU, age 59.0 ± 18.0, 76% male M: 57, septic shock, ICU, age 52.0 ± 19.0, 61.3% male.
Groups were comparable at baseline. |
Goals in EGDT group:
A: ScvO2 ≥ 70%, CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5, mL/kg/h B: CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h C: ScvO2 ≥ 70%, CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h D: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h E: JVP ≥ 3 cm, MAP ≥ 65 mm Hg, Hb ≥ 7 g/dl F: ScvO2 ≥ 70%, CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h G: ScvO2 ≥ 70%, CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h H: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h
I: SaO2 ≥ 92%, CVP 8-12 mm Hg, MAP 65-90 mm Hg, HR < 100/min, UO ≥ 0.5 mL/kg/h, Hb ≥7 g/dl J: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h K: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h L: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h M: ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h
|
Goals in control group:
A: CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h B: usual care
C: CVP 8-12 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h D: CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h
E: usual care
F: usual care
G: usual care
H: usual care
I: LC ≥ 20%, SaO2 ≥ 92%, CVP 8-12 mm Hg, MAP 65-90 mm Hg, HR < 100/min, UO ≥ 0.5 mL/kg/h, Hb ≥ 7 g/dl J: LC ≥ 20%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/ kg/h K: LC ≥ 10% or 30%, ScvO2 ≥ 70%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/ kg/h L: LC ≥ 10%, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/ kg/h M: Lactate <2 mmol/L, CVP 8-12 mm Hg, SBP ≥ 90 mm Hg, MAP ≥ 65 mm Hg, UO ≥ 0.5 mL/kg/h
|
End-point of follow-up:
A: 60 days B: hospital discharge C: ICU discharge D: ICU discharge E: 28 days F: 90 days G: 90 days H: 90 days
I: Hospital discharge J: Hospital discharge K: 28 days L: 28 days M: 28 days
For how many participants were no complete outcome data available? (intervention/control) No incomplete data.
Loss-to-follow-up: Not reported |
1. all-cause mortality at final follow-up. (primary outcome) Risk ratio (95% CI): A: 0.73 (0.56-0.96) B: 0.75 (0.61-0.93) C: 0.66 (0.43-1.01) D: 0.69 (0.53-0.90) E: 1.07 (0.83-1.39) F: 0.98 (0.80-1.21) G: 0.94 (0.78-1.15) H: 1.10 (0.85-1.20)
Pooled effect (random effects model): 0.87 (0.77-0.98) favouring EGDT. Heterogeneity (I2): 55%
Differentiating per care unit: In ICU 0.72 (0.62-0.84) favouring EGDT. Heterogeneity (I2): 0% In ED 0.96 (0.86-1.06) favouring EGDT. Heterogeneity (I2): 21%
I: 1.52 (0.97-2.40) J: 1.36 (0.86-2.16) K: 1.94 (1.12-3.36) L: 1.40 (0.51-3.82) M: 2.04 (1.00-4.14)
Pooled effect (random effects model): 1.60 (1.24-2.06) favouring lactate-guided therapy. Heterogeneity (I2): 0%
Differentiating per care unit: In ICU 1.71 (1.27-2.31) favouring lactate-guided. Heterogeneity (I2): 0% In ED 1.36 (0.86-2.16) favouring lactate-guided (only 1 study).
2. Total volume of intravenous fluid in the first 6 hours. Mean difference (95% CI): A: 1.48 (0.82-2.14) F: 0.25 (0.11-0.39) G: 0.53 (0.27-0.78) H: 0.20 (0.05-0.35)
Pooled effect (random effects model): 0.44 (0.18-0.71) favouring usual care. Heterogeneity (I2): 83%
3. Red-cell transfusion Risk ratio (95% CI): A: 3.15 (2.19-4.51) F: 1.94 (1.43-2.64) G: 1.77 (1.20-2.60) H: 2.30 (1.44-3.67) Pooled effect (random effects model): 2.22 (1.72-2.88) favouring usual care. Heterogeneity (I2): 47%
4. Vasopressor infusion Risk ratio (95% CI): A: 0.92 (0.63-1.35) F: 1.15 (1.07-1.24) G: 1.25 (1.09-1.42) H: 1.14 (1.02-1.28) Pooled effect (random effects model): 1.16 (1.10-1.23) favouring usual care. Heterogeneity (I2): 0%
5. Dobutamine use Risk ratio (95% CI): A: 18.42 (2.49-135.95) F: 5.58 (3.72-9.19) G: 7.27 (2.88-18.39) H: 4.72 (3.08-7.23) Pooled effect (random effects model): 5.45 (4.14-7.41) favouring usual care. Heterogeneity (I2): 0% |
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
Chen, 2017 |
SR and meta-analysis of RCTs
Literature search up to August 2016
A: Tuchschmidt, 1992 B: Yu, 1993 C: Hayes, 1994 D: Gattinoni, 1995 E: Alía, 1999 F: Wang, 2006 G: The EDGT Collaborative Group, 2010 H: Lu, 2014
Study design: RCT
Setting and Country: Sichuan University, Chengdu, Sichuang; Jiangxi University of Traditional Chinese Medicine, Nanchang, Jiangxi; Third Military Medical University, Chongqing, China
Source of funding and conflicts of interest: This research was supported by the Foundation of the Health and Family Planning Commission Research Project of Jiangxi Province (grant no. 530096).
The authors declare no potential conflicts of interest. |
Inclusion criteria: 1. Adult patients with severe sepsis and septic shock, treating with EGDT methods; 2. We used the standard EGDT, which was defined as a protocol resuscitation in accord with achieving specific therapeutic results in terms of CVP (8-12mmHg), MAP (65-90mmHg), UO (≥0.5ml/kg/h), and continuous monitoring to keep ScvO2 (≥70%). 3. Usual care or other protocols were adopted in the control group based on the included trials. 4. We set the primary outcome measure as all-cause mortality at the early period for patient treatment during hospitalization (hospital or ICU mortality). All-cause mortality was defined as the time from the trial randomization to death from any cause.
Exclusion criteria: Non-RCTs or conference abstracts
17 studies were included. (10 were overlapping with SR Lu, 2018)
N, condition, care unit (age and sex not described) A: 51, septic shock, ICU B: 52, septic shock, ICU C: 100, septic shock, ICU D: 181, septic shock, ICU E: 63, septic shock, ICU F: 33, septic shock, ICU G: 314, severe sepsis and septic shock, ICU H: 82, septic shock, ICU |
Goals in EGDT group:
A: CI>6 L/min/m2, SBP>90 mm Hg B: DO2I>600 mL/min/m2, SBP>100 mm Hg C: CI>4.5 L/min/m2, DO2I>600 mL/min/m2, VO2>170 mL/min/m2 D: CI>4.5 L/min/m2 or SvO2>70%, MBP>65 mm Hg, CVP 8–12 mm Hg, UO>0.5 mL/kg/hr E: DO2I>600 mL/min/m2, MBP>60 mm Hg F: CVP 8–12 mm Hg, MAP>65 mm Hg, ScvO2>70%, UO>0.5 mL/kg/hr G: CVP 8–12 mm Hg, MAP>65 mm Hg, SBP>90mmHg, UO>0.5 mL/kg/hr, ScvO2>70% H: ITBVI 850-1500 mL/m2, MAP≥65 mmHg
|
Goals in control group:
A: CI>3 L/min/m2, SBP>90 mm Hg B: DO2I 450–550 mL/min/m2
C: Usual care
D: CI 2.5–3.5 L/min/m2, MBP>65 mm Hg, CVP 8–12 mm Hg, UO>0.5 mL/kg/hr
E: DO2I>330 mL/min/m2, MBP>60 mm Hg F: Usual care
G: CVP 8–12 mm Hg, MAP >65 mm Hg, SBP>90mmHg, UO>0.5 mL/kg/hr
H: CVP 8–12 mm Hg, MAP >65 mm Hg, ScvO2>70%, UO>0.5 mL/kg/hr
|
End-point of follow-up:
A: hospital discharge B: 30 days C: hospital discharge D: 180 days E: ICU discharge F: 14 days G: 28 days H: hospital discharge
Loss-to-follow-up: Not reported |
Hospital/ICU mortality at final follow-up (primary outcome) Risk ratio (95% CI): A: 2.56 (1.20-5.49) B: 1.00 (0.51-1.94) C: 1.59 (1.00-2.52) D: 0.95 (0.77-1.17) E: 0.72 (0.48-1.08) F: 0.61 (0.22-1.69) G: 0.58 (0.42-0.81) H: 0.95 (0.37-2.47)
Pooled effect (random effects model): 0.96 (0.71-1.30) favouring EGDT. Heterogeneity (I2): 68%
|
|
|
Jiang, 2016 |
SR and meta-analysis of RCTs
Literature search up to April 2015
A: ARISE, 2014 B: ProCESS, 2014 C: ProMISe, 2015
Study design: RCT
Setting and Country: Several institutes in Italy
Source of funding and conflicts of interest: none declared |
Inclusion criteria: 1. Patients with severe sepsis or septic shock. 2. EGDT versus usual care
Exclusion criteria: Not reported
4 studies were included, 3 of which were overlapping with other SRs.
Details of the included studies are described under the SR by Lu, 2018 |
Details of the included studies are described under the SR by Lu, 2018 |
Details of the included studies are described under the SR by Lu, 2018 |
Details of the included studies are described under the SR by Lu, 2018 |
Hospital length of stay Mean difference (95% CI):
A: 0.10 (-0.59-0.79) B: 0.40 (-0.44-1.24) C: -0.70 (-1.82-0.42)
Pooled effect: see below |
|
|
Coccolini, 2016 |
SR and meta-analysis of RCTs
Literature search up to 2016
A: Rivers, 2001 B: ARISE, 2014 C: ProCESS, 2014 D: ProMISe, 2015
Study design: RCT
Setting and Country: Several institutes in Italy
Source of funding and conflicts of interest: none declared |
Inclusion criteria: Studies analyzing patients with early septic shock randomly assigned to receive either EGDT or standard care.
Exclusion criteria: Not reported
4 studies were included, 3 of which were overlapping with other SRs.
Details of the included study are described under the SR by Lu, 2018 |
Details of the included study are described under the SR by Lu, 2018 |
Details of the included study are described under the SR by Lu, 2018 |
Details of the included study are described under the SR by Lu, 2018 |
Hospital length of stay Mean difference (95% CI): -0.50 (-1.39-0.39)
Pooled effect (random effects model) including Jiang, 2016: 0.04 (-0.43-0.52) favouring usual care. Heterogeneity (I2): 0%
|
|
|
Angus, 2015 |
SR and meta-analysis of RCTs
Literature search up to 2016
A: ARISE, 2014 B: ProCESS, 2014 C: ProMISe, 2015 D: Jones, 2010
Study design: RCT
Setting and Country: Multi-center from USA, UK, Australia
Source of funding and conflicts of interest: none declared |
Inclusion criteria: RCTs conducted in adult or paediatric patient populations with septic shock that compared EGDT with either usual care or another resuscitation strategy that did not incorporate EGDT.
Exclusion criteria: Studies reporting only physiological end-points, solely descriptive or non-randomised and any studies published before 2000.
11 studies were included
Details of the relevant included study are described under the SR by Lu, 2018 |
Details of the studies are described under the SR by Lu, 2018 |
Details of the studies are described under the SR by Lu, 2018 |
Details of the studies are described under the SR by Lu, 2018 |
ICU length of stay Mean difference (95% CI):
A: 0.10 (-0.59-0.79) B: 0.20 (-0.57-0.97) C: -0.70 (-1.82-0.42) D: -0.30 (-2.10-1.50))
Pooled effect (random effects model): -0.02 (-0.47-0.43) favouring EGDT. Heterogeneity (I2): 0% |
|
|
Simpson, 2016 |
SR and meta-analysis of RCTs
Literature search up to May 2015
A: Rivers, 2001 B: Chen, 2007 C: EGDT collaborative, 2010 D: ProCESS, 2014 E: ARISE, 2014 F: ProMISe, 2015
Study design: RCT
Setting and Country: OpenMetaAnalysis from Kansas University School of Medicine – Wichita, Kansas, USA
Source of funding and conflicts of interest: This project was supported by the Department of Internal Medicine at the Kansas University School of Medicine – Wichita
Conflict of interest: not specified. |
Inclusion criteria: We included trials that randomly allocated patients to EGDT. We required EGDT to include goals for central venous pressure and central venous oxygen saturation (ScvO2) and for goals to be completed within 6 hours. We did not require blinding of participants.
Exclusion criteria: None.
6 studies were included
Details of the studies are described under the SRs by Lu, 2018 and Chen, 2017 |
Details of the studies are described under the SRs by Lu, 2018 and Chen, 2017 |
Details of the studies are described under the SRs by Lu, 2018 and Chen, 2017 |
Details of the studies are described under the SRs by Lu, 2018 and Chen, 2017 |
Mortality Subgroups were made based on mortality in the control group (values were slightly different than in other SRs).
RR (95% CI) with >40% mortality in the control group: A: 0.66 (0.47-0.91) B: 066 (0.43-1.01) C: 0.69 (0.53-0.90)
Pooled, random effects model: 0.67 (0.56-0.81) favouring EGDT. Heterogeneity (I2): 0%
RR (95% CI) with <30% mortality in the control group: D: 1.11 (0.85-1.45) E: 0.93 (0.73-1.17) F: 1.02 (0.86-1.21)
Pooled, random effects model: 1.01 (0.89-1.14) Heterogeneity (I2): 0%
Pooled effect total: 0.85 (0.71-1.02) favouring EGDT Heterogeneity (I2): 64% |
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: Which hemodynamic goals should be pursued in the treatment of severe sepsis or septic shock?
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk-of-bias-tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Research question: Which hemodynamic goals should be pursued in the treatment of severe sepsis or septic shock?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Pan, 2019 |
yes |
yes |
yes |
unclear |
N.A. |
yes |
yes |
Yes |
unclear |
|
Lu, 2018 |
yes |
yes |
yes |
yes |
N.A. |
yes |
yes |
unclear |
yes |
|
Chen, 2017 |
yes |
yes |
yes |
unclear |
N.A. |
yes |
yes |
Yes, there was no significant funnel plot asymmetry. |
yes |
|
Jiang, 2016 |
yes |
yes |
yes |
yes |
N.A. |
yes |
yes |
The number of included studies was too small to perform publication bias examination. |
unclear |
|
Coccolini, 2016 |
yes |
yes |
yes |
yes |
N.A. |
yes |
yes |
Significant publication biases were not recognized as shown by the symmetry of the funnel plots. |
unclear |
|
Angus, 2015 |
yes |
yes |
yes |
yes |
N.A. |
yes |
yes |
Formal assessment could not be performed due to the small number of included studies.. |
unclear |
|
Simpson, 2016 |
yes |
yes |
no |
no |
N.A. |
yes |
yes |
unclear |
unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Which hemodynamic goals should be pursued in the treatment of severe sepsis or septic shock?
|
Study reference
|
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Asfar, 2014 |
Randomization was performed with the use of a computer-generated assignment sequence in a centralized, blinded fashion and was stratified according to whether patients had chronic hypertension |
unlikely |
unlikely |
likely |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
|
Chen, 2015 |
Patients were randomized to either standard (control) therapy or TFM therapy |
unlikely |
unlikely |
unlikely |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
|
Garg, 2016 |
Randomization was done by envelope method. |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
|
Kuan 2016 |
Blocked randomization, with randomly permutated block sizes of 4 and 6, was performed by investigators or research coordinators at the site through a Web randomization system at the Singapore Clinical Research Institute, which was not involved in patient enrollment and assessment. Before patient enrollment, a randomization list was generated with a validated SAS program (SAS Institute, Inc., Cary, NC) and then uploaded to the randomization system. |
unlikely |
unlikely |
Unlikely, clinicians in the ward and ICU were blinded to the patients’ enrollment in either group. |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
|
Lanspa, 2018 |
Randomization was performed using random permuted blocks (2, 4, or 6 patients). |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
|
Lu, 2015 |
Not described |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
unclear |
|
Nardi, 2013 |
The computer-generated randomisation list was provided by an independent statistician. Allocation concealment was guaranteed using sealed opaque envelopes containing the treatment arm. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Nardi, 2018 |
Randomisation (1:1 ratio) was stratified according to the study centre and balanced by blocks of 4 using a computerised random number generator list provided by an independent statistician. Sequentially numbered, sealed and opaque envelopes were used. Each envelope was assigned to a patient and opened only after the investigator wrote the patient’s information on it and faxed the signed inclusion sheet with the patient’s randomisation details to the coordinating centre. |
unlikely |
unlikely |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
unlikely |
|
Palizas, 2009 |
Randomization was done by the central coordinator center. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Richard, 2015 |
Patients were randomized with a computer-generated list using a 1:1 ratio. The allocation sequence was generated and concealed from the enrolling physician in sequentially numbered, opaque, and sealed envelopes, by a co-author who did not participate in the assessment of patient eligibility for the study. |
unlikely |
unlikely |
unlikely |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
|
Su, 2018 |
Patients were divided in groups in accordance with randomization envelopes from the central coordination. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Trof, 2012 |
Randomization was done by the sealed envelope method after meeting eligibility criteria. The randomization was stratified per center for sepsis versus. nonsepsis (no blocks were used). |
unlikely |
unlikely |
unlikely |
unlikely |
Unlikely, registered trial |
unlikely |
unlikely |
|
Yao, 2017 |
Not specified |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unclear |
unclear |
|
Yu, 2007 |
Not specified |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
|
Yu, 2017 |
Patients were randomly assigned to study/control group using a random number table. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Chamberlain, 2011 |
Meta-analyse van observationele studies |
|
Cioccari, 2016 |
Geen relevante uitkomstmaten |
|
Dellinger, 2013 |
Internationale richtlijnen |
|
Gu, 2015 |
Overlap met andere SRs |
|
Jozwiak, 2018 |
Opiniestuk |
|
Kern, 2002 |
Niet uitsluitend sepsispatiënten |
|
Kramer, 2015 |
Geen relevante uitkomstmaten |
|
Lang, 2017 |
Overlap met andere SRs |
|
Lu, 2016 |
Meta-analyse van overwegend observationele studies |
|
Magder, 2016 |
Narratieve review |
|
Meyer, 2017 |
Commentaarstuk |
|
Nguyen, 2016 |
Overlap met andere SRs |
|
Osborn, 2017 |
Geen relevante uitkomstmaten |
|
Reid, 2013 |
Narratieve review |
|
Rhodes, 2004 |
Narratieve review |
|
Rocha, 2015 |
Narratieve review |
|
Rowan, 2017 |
Geen relevante uitkomstmaten |
|
Rusconi, 2015 |
Overlap met andere SRs |
|
Tseng, 2015 |
Geen relevante uitkomstmaten |
|
Vincent, 2004 |
Narratieve review |
|
Winters, 2016 |
Data niet bruikbaar weergegeven |
|
Xu, 2016 |
Overlap met andere SRs |
|
Yu, 2016 |
Overlap met andere SRs |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-01-2020
Beoordeeld op geldigheid : 26-03-2020
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
|
NIV |
2020 |
2025 |
Eens in vijf jaar |
NIV |
Grote trials over parameters om te sturen specifiek in sepsis populatie. |
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De ontwikkeling van deze richtlijn wordt gefaseerd doorlopen en opgeleverd. Op dit moment wordt alleen Sepsis fase 1 opgeleverd. Later wordt het ontwikkeltraject voor Sepsis fase 1 uitgebreid met fase 2 en 3. Er wordt naar gestreefd om de gehele richtlijn in 2021 af te ronden.
In fase 1 zijn de thema’s vroege herkenning, diagnostiek en eerste behandeling (vloeistofrecusatie en zuurstoftoediening) reeds behandeld.
In het vervolgtraject komen fase 2 en 3 aan bod en worden samengevoegd tot één richtlijn. Deze omvatten de volgende thema’s:
- Fase 2 (behandeling): vasopressoren en/of inotropica, nierfunctievervangende therapie, transfusiebeleid, sedatiemethode en delier.
- Fase 3 (nazorg en aandacht voor langetermijngevolgen voor de patiënt): (vroeg)mobilisatie, voeding, aandacht voor langetermijneffecten, revalidatie, voorlichting en begeleiding van patiënt en/of naasten.
Aan het einde van het gehele traject wordt er een overkoepelende gezamenlijke module over de organisatie van zorg/randvoorwaarden opgeleverd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een discipline overstijgende evidence-based richtlijn te ontwikkelen, gericht op de vroegtijdige herkenning, diagnose, (initiële) behandeling, monitoring, nazorg en revalidatie van patiënten met (dreigende) sepsis.
Met deze richtlijn kan de kwaliteit van de sepsiszorg worden verbeterd en gewaarborgd, met als doel minder sepsis gerelateerde morbiditeit en mortaliteit.
Doelgroep
Deze richtlijn wordt geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor volwassen patiënten met (dreigende) sepsis in de ziekenhuiszorg.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met sepsis te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht NVIC
- Drs. A. Klijn, AIOS Spoedeisende geneeskunde, Westfriesgasthuis te Hoorn, NVSHA
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. D. Snijders, longarts, Spaarne Gasthuis te Haarlem en te Hoofddorp, NVALT
- Dr. A.K. van der Bij, arts-microbioloog, Diakonessenhuis te Utrecht, NVMM
- I. Nutma, patiëntenvertegenwoordiger (Stichting Family and Patient Centered Intensive Care (FCIC))/ IC connect
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-SEH
- M. Hoogendoorn, kwaliteitsmedewerker Vakgroep Anesthesiologie & Intensive Care, Isala, beleidsmedewerker Raad van Bestuur, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, senior onderzoeker Sector Verplegingswetenschap afdeling Interne Geneeskunde en senior onderzoeker Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Prof. dr. D. van de Beek, neuroloog, Amsterdam UMC locatie AMC te Amsterdam, NVN
- Drs. O.J.D. Snieders, uroloog, Diakonessenhuis, te Utrecht/Zeist/Doorn en St. Antonius ziekenhuis, te Utrecht/Nieuwegein, NVU
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten (voorzitter) |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede, Medisch Hoofd IC, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald:
|
Participatie als onderzoeker in lC sepsis trials (b.v. AKPA-ART 123 trombomoduline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau lnteractie dat voor vele wetenschappelijke verenigingen congressen organiseert. Bestaande activiteiten rond sepsis lopen al meer dan 10 jaar en door de richtlijn zullen deze niet wijzigen.
|
Geen actie |
|
S. Sankatsing |
internist-infectioloog/internist-acute geneeskunde in het Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van Internist Infectiologen (NVII)
Lid Commissie Richtlijnen Nederlandse Internisten Vereniging (NIV) |
Geen |
Geen actie |
|
M. de Regt |
Internist Acute Geneekunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam (sinds april 2019, daarvoor in UMCU) |
Geen |
Geen |
Geen actie |
|
L. Derde |
Intensivist UMC Utrecht |
Co-lead WP5 PREPARE Lid NVVM influenza richtlijn Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia) Voorzitter van de Clinical Training Committee (CTC) van ESICM. Faculty ESICM masterclass sepsis and severe infections. |
Betrokken bij onderzoek dat door EU wordt gefinancierd: 1. Co-lead van WP5 PREPARE project (EU FP7 funded): doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC 2. Lid International Trial Steering Committee, European Regional Management Committee en diverse domein-specifieke werkgroepen van REMAP-CAP. REMAP-CAP is de internationale overkoepelende studie waarvan PREPARE-WP5 het Europese deel is. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Op moment van tekenen is er geen industrie-betrokkenheid. |
Geen actie |
|
A. Klijn |
AIOS SEG in het Dijklander Ziekenhuis te Hoorn |
Buitengewoon lid richtlijnen commissie van de NVSHA, onbetaald. |
Geen |
Geen actie |
|
R. Schellaars |
intensivist, Ziekenhuis Gelderse Vallei, Ede |
bestuurslid SIC-NVA |
Geen |
Geen actie |
|
R. Wilting |
chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen actie |
|
D. Snijders |
longarts, medisch manager vakgroep longziekten Spaarne Gasthuis |
Docent Inholland, opleiding EHLH verpleegkundige, vergoeding. Lid richtlijn bronchiëctasieën NVALT, vergoeding. |
Geen |
Geen actie |
|
A. van der Bij |
Arts-microbioloog, werkzaam bij het Diakonessenhuis/Medisch Specialistisch Bedrijf Domstad (MSBD) Utrecht |
voorzitter van de Commissie Kwaliteitsbevordering van de NVMM. |
Geen |
Geen actie |
|
I. Nutma |
- Ex-patiënt, voormalig verpleegkundige, auteur van Septische shock en Sepsis en daarna. - Ervarings-professional. Eigenaar van Sepsis en daarna. - Mede-initiatiefnemer van de website www.opeenicliggen.nl; overgegaan in icconnect.nl
|
- Werkzaamheden op het gebied van voorlichting (Lezingen, lessen, workshops), begeleiding (huisbezoek, telefonische consulten) en advisering (bij onderzoek, richtlijnen, etc.) geschieden, betaald. - Mede-initiatiefnemer van de website opeenicliggen.nl, inmiddels overgegaan in de website icconnect.nl, onbetaald -Lid werkgroep ervaringsdeskundigen FCIC/IC-connect tot jan. 2019, onbetaald - beheerder (sinds ’17) online sepsis- lotgenotenplatform, onbetaald - organisator Sepsis Lotgenoten Dag, (vanaf 2018), onbetaald |
Geen |
Geen actie |
|
V. Bon |
Verpleegkundig Specialist SEH (18 uur/week) OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam (12uur/week) |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen actie |
|
M. Hoogendoorn |
Kwaliteitsmedewerker Vakgroep Anesthsesiologie & Intensive Care, Isala, Zwolle (0,5 FTE) Beleidsmedewerker Raad van Bestuur, Isala, Zwolle (0,5 FTE) |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen actie |
|
E. Ista |
universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
universitair Docent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijne V&VN, Utrecht (onbetaald) |
|
Geen actie |
|
R. Jansen |
100% dienstverband als klinisch geriater Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amsteracademie voor verschillende verpleegkundigen opleidingen (betaald). |
Honoraria van Bayer, Boehringer en BMS voor houden lezingen, webTV, etc over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen actie |
|
D. van de Beek |
Neuroloog, Amsterdam UMC, locatie AMC |
Consultancy GSK malaria vaccin (betaald aan werkgever, AMC) |
Geen |
Geen actie |
|
O. Snieders |
functioneel uroloog maatschap Urologen voor U (diakonessenhuis utrecht/zeist/doorn en st. antonius ziekenhuis utrecht/nieuwegein) |
lid calamiteiten onderzoeksgroep (COG) diakonessenhuis (betaald) penningmeester regiomaatschap (onbetaald) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
|
M. Ruiter |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afgevaardigde patiëntvertegenwoordiger in de werkgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Paitent Centered Intensive Care/ IC connect, Sepsis en daarna, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen, Dutch Acute Medicine via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vond.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk-of-bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk-of-biastabellen. De gebruikte risk-of-biasinstrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk-of-bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module toekomstige module Randvoorwaarden. Die wordt ontwikkeld bij de richtlijn Sepsis fase 2 en 3.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat er of geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken en er zijn al voldoende ondersteunende maatregelen actief zijn in de zorgpraktijk zoals de huidige indicator vroege herkenning sepsis in de basisset 2019.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – maart 2019
|
1 exp *SEPSIS/ or (sepsis or sepses or septic*).ti,ab,kw. (174553) 2 exp *Fluid Therapy/ or exp Crystalloid Solutions/ or exp Colloids/ or exp Albumins/ or exp Starch/ or exp Gelatin/ or exp Dextrans/ or (crystalloid* or colloid* or saline or (ringer* adj2 lactate) or (hartmann* adj solution) or nacl or hypertonic or albumin or starch or hydroxyethylstarch or hes or haes or tetrastarch or gelatin or gelofusin* or 'volume expander' or dextrans).ti,ab,kw. or fluid*.ti. or exp *Resuscitation/ or resuscitat*.ti,ab,kw. (925562) 3 exp *Hemodynamics/ or exp Microcirculation/ or exp Early Goal-Directed Therapy/ or ((hemodynamic adj2 parameter*) or (microcirculat* or lactate or 'venous oxygen saturat*' or 'bas-excess' or 'early goal-directed' or egdt)).ti,ab,kw. or ((dynamic or statistic) adj2 (measure* or parameter*)).ti,ab,kw. or ('fluid responsiveness' or 'heart-lung interaction*' or 'intravascular volume' or 'end expirator*' or 'pulse pressure variat*' or 'systolic pressure variat*' or 'stroke volume variat*' or 'aortic flow velocit*' or distensibilit* or 'inferior vena cava' or 'passive leg-raising' or 'fluid challenge*' or 'extra lung water' or 'extravascular lung water' or 'global end-diastolic' or 'vena cava inferior' or 'mean arterial pressure' or 'heart rate' or 'urine output' or mentation or 'central venous pressure' or 'capillary wedge pressure').ti,ab,kw. (550600) 4 1 and 2 and 3 (3048) 5 limit 4 to (english language and yr="2000 -Current") (2080) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (386177) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3144519) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1839391) 9 5 and 6 (67) 10 5 and 8 (437) 11 10 not 9 (401) 12 5 and 7 (827) 13 12 not 9 not 11 (616) 14 9 or 11 or 13 (1084)
= 1084 |
1363 |
|
Embase (Elsevier) |
('sepsis'/exp/mj OR sepsis:ti,ab OR sepses:ti,ab OR septic*:ti,ab)
AND ('crystalloid'/exp/mj OR 'fluid therapy'/exp/mj OR 'colloid'/exp/mj OR 'albumin'/exp/mj OR 'starch'/exp OR 'hetastarch'/exp OR 'tetrastarch'/exp OR 'gelatin'/exp OR 'gelatin succinate'/exp OR 'dextran'/exp OR fluid*:ti OR crystalloid*:ti,ab OR colloid*:ab,ti OR saline:ti,ab OR ((ringer* NEAR/2 lactate):ti,ab) OR ((hartmann* NEAR/2 solution):ti,ab) OR nacl:ti,ab OR hypertonic:ti,ab OR albumin:ab,ti OR starch:ab,ti OR hydroxyethylstarch:ab,ti OR hes:ab,ti OR haes:ab,ti OR tetrastarch:ab,ti OR gelatin:ab,ti OR gelofusin*:ab,ti OR 'volume expander':ab,ti OR dextrans:ab,ti) OR ('fluid resuscitation'/exp/mj OR 'resuscitation'/exp/mj OR resuscitat*:ab,ti)
AND ('hemodynamic parameters'/exp/mj OR ((hemodynamic NEAR/2 parameter*):ab,ti) OR 'microcirculation'/exp/mj OR microcirculat*:ab,ti OR lactate:ab,ti OR 'venous oxygen saturation'/exp OR 'venous oxygen saturat*':ab,ti OR 'bas excess':ab,ti OR 'early goal-directed therapy'/exp OR 'early goal-directed':ti,ab OR egdt:ti,ab OR (((dynamic OR statistic) NEAR/2 (measure* OR parameter*)):ab,ti) OR 'fluid responsiveness':ab,ti OR 'heart-lung interaction*':ab,ti OR 'intravascular volume':ab,ti OR 'end expirator*':ab,ti OR 'pulse pressure variat*':ab,ti OR 'systolic pressure variat*':ab,ti OR 'stroke volume variat*':ab,ti OR 'aortic flow velocit*':ab,ti OR distensibilit*:ab,ti OR 'inferior vena cava':ab,ti OR 'passive leg-raising':ab,ti OR 'fluid challenge*':ab,ti OR 'extra lung water':ab,ti OR 'extravascular lung water':ab,ti OR 'global end-diastolic':ab,ti OR 'vena cava inferior':ab,ti OR 'mean arterial pressure':ab,ti OR 'heart rate':ab,ti OR 'urine output':ab,ti OR mentation:ab,ti OR 'central venous pressure':ab,ti OR 'capillary wedge pressure':ab,ti)
AND (english)/lim AND (2000-2019)/py NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 1002 |
