Nierfunctievervangende therapie: timing
Uitgangsvraag
Wat is de optimale timing om te beginnen met nierfunctievervangende therapie bij patiënten met septische acute nierschade?
Aanbeveling
Start niet direct met nierfunctievervangende therapie bij septische AKI, tenzij er sprake is van levensbedreigende overvulling, hyperkaliëmie of metabole acidose refractair voor conservatieve behandeling.
Overweeg nierfunctievervangende therapie indien AKI persisteert ondanks de behandeling van sepsis resulterend in metabole ontregeling en/of ernstige diureticaresistente overvulling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
RRT kan op een aantal manieren worden uitgevoerd en tot op heden is niet duidelijk wat de optimale starttijd is. Er is daarom literatuuronderzoek verricht naar de optimale starttijd (timing) van RRT.
De vergelijking tussen vroege en late start van RRT is beschreven in twee gerandomiseerde trials in een sepsispopulatie. Vroege start van RRT lijkt geen klinisch relevante verbeteringen te geven voor patiënten met sepsis in de cruciale uitkomstmaten mortaliteit en herstel van nierfunctie, noch in ziekenhuis en IC-verblijfsduur.
Het is belangrijk om te beseffen dat acute indicatie voor RRT een exclusiecriterium was in deze studies: refractaire hyperkaliëmie en/of refractaire metabole acidose en/of refractaire overvulling met pulmonaal oedeem (Barbar, 2018; Gaudry, 2018). Het eenduidige advies van de KDIGO-richtlijn (KDIGO, 2011) is ook om bij AKI direct RRT te starten wanneer hyperkaliëmie, metabole acidose of overvulling niet reageren op conservatieve maatregelen en een gevaar vormen voor de patiënt (KDIGO, 2011). Beide studies hebben dus onderzocht of in afwezigheid van levensbedreigende RRT start criteria vroege behandeling beter is dan late behandeling.
Een ander belangrijk aspect van timing is de definiëring van vroeg en laat. In de Cochrane review van Fayad (2018) werden 5 RCT’s geïncludeerd waarin vroege en late start van RRT werden vergeleken in totaal 1084 ernstig zieke patiënten (sepsis, maar ook niet sepsis). Een eenduidig voordeel voor vroege behandeling werd niet aangetoond, maar vergelijking van de studies werd bemoeilijkt door het toepassen van verschillende definities voor vroeg en laat. Bij het definiëren van vroeg en laat maakt men de laatste jaren vaak gebruik van een van de AKI consensus classificatiesystemen (zie figuur). In de studies van Barbar (2018) en Gaudry (2018) werden respectievelijk RIFLEfailure en KDIGOstadium-3 gebruikt als vergelijkbaar uitgangspunt om te randomiseren in vroege of late start van RRT. In de studie van Barbar (2018) moest de vroege groep binnen 12 uur starten en bij Gaudry (2018) binnen 6 uur. De late groep startte bij Barbar (2018) na 48 uur tenzij spontaan herstel van nierfunctie optrad of eerdere start van RRT noodzakelijk werd geacht op basis van de eerder beschreven levensbedreigende RRT start criteria. In de studie van Gaudry (2018) werd in de late groep gestart bij tenminste één van de volgende criteria: ≥ 72 uur oligurie of anurie; serum ureum > 40 mmol/L; levensbedreigende RRT start criteria.
De pathofysiologie van septische AKI en niet-septische AKI verschillen (Bellomo, 2017), en dientengevolge misschien ook het effect van timing van RRT. In de Cochrane review werd niet specifiek gekeken naar septische AKI. Een potentieel voordeel van vroege RRT bij septische AKI is het uitspoelen van septische mediatoren en het bevorderen van homeostase (vocht, elektrolyten, zuur-base), terwijl een potentieel nadeel het uitspoelen van antibiotica is, resulterend in niet-therapeutische spiegels (Lewis, 2014). In de studies van Barbar (2018) en Gaudry (2018) wordt niet expliciet vermeld of antibioticadoseringen werden aangepast bij het starten van RRT. Wel is gekeken naar het effect van timing op de cumulatieve vochtbalans. In de studie van Gaudry (2018) was de cumulatieve vochtbalans niet verschillend op dag 2 en dag 7 tussen beide behandelgroepen. In de studie van Barbar (2018) werd geen verschil gezien tussen de groepen wat betreft de vochtbalans in de 24 uur voor randomisatie, 48 uur na randomisatie en op dag 7. Deze studies suggereren dat vocht onttrekken niet mogelijk is in de vroege fase van septische AKI en hemodynamische instabiliteit en dat vroeg starten van CVVH de vochtbalans dus niet bevordert.
Een nadeel van vroege behandeling is dat eventueel spontaan herstel van de nierfunctie niet wordt herkend en de patiënt onterecht wordt blootgesteld aan de potentiële complicaties van een centraal veneuze katheter en extra-corporele circulatie. In de studie van Gaudry (2018) was bij 45% van de patiënten RRT-behandeling niet nodig en dit had geen nadelig effect op mortaliteit, maar resulteerde wel in een significant sneller herstel van voldoende urine output. In de studie van Barbar (2018) was bij 38% van de patiënten RRT niet nodig zonder verschil in mortaliteit tussen vroege en late behandeling. In beide studies resulteerde late behandeling ook in een significant hoger aantal RRT-vrije dagen (het aantal dagen levend en zonder RRT op dag 28 na randomiseren). Barbar beschrijft ook de duur van RRT. Deze was significant lager in de late groep, maar dit lijkt medebepaald doordat een deel van de patiënten helemaal geen RRT kreeg.
Voor timing van de behandeling is de totale bewijskracht, de laagste bewijskracht voor de cruciale uitkomstmaten, laag. Hier ligt een kennislacune. Er is geen duidelijke richting in de effecten tussen vroege en late start van behandeling in patiënten met AKI en sepsis zonder levensbedreigende indicatie voor RRT. Er is meer onderzoek nodig, om uitsluitsel te krijgen of vroege start van RRT klinisch relevante voordelige effecten heeft. Recent zijn de resultaten van de STARRT-AKI gepubliceerd (STARRT-AKI investigators, 2020). In deze grote multinationale RCT (15 landen, 168 zienhuizen) met inclusie van 2927 patiënten met KDIGO-stadium 2 of 3 AKI (septisch en niet-septische AKI) werden patiënten gerandomiseerd in een vroege behandeling (binnen 12 uur na voldoen inclusie) of standaard behandeling (start RRT op basis van conventionele criteria of als AKI > 72 uur aanhield). Ook in deze studie werd geen survival voordeel gevonden, ook niet in de sepsis subgroep. Opvallend was wel dat in de vroege behandel strategie persisterende RRT behoefte op dag 90 hoger was dan in de standaard behandeling groep (10,4% versus 6,0%) hetgeen mogelijk een gevolg is van RRT gerelateerde schade (‘artifial kidney induced kidney injury’). Vooralsnog lijkt het dus gerechtvaardigd om in patiënten die nog niet voldoen aan de acute levensbedreigende criteria voor RRT af te wachten en niet ‘preventief’ te starten met RRT.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De voorkeur van de patiënt voor deze interventies is niet onderzocht en onbekend. Goede voorlichting en communicatie over behandeldoelen, voor- en nadelen, risico’s en verwacht resultaat is belangrijk om een goede afweging te maken voor patiënten en naasten. RRT is niet een ‘baat het niet dan schaadt het niet behandeling’, maar is een invasieve behandeling die de patiënt blootstelt aan een hoger risico op bloedingen, onderdoseren van antibiotica, verlies van nutriënten en katheter gerelateerde infectieuze en niet-infectieuze complicaties. Tevens wordt het mobiliseren van de patiënt vaak bemoeilijkt.
Bij een vroege behandelstrategie bestaat de mogelijkheid dat een patiënt onnodig wordt blootgesteld aan de RRT risico’s. Het is dus aannemelijk dat patiënten bij afwezig voordeel op morbiditeit en mortaliteit niet de voorkeur geven aan vroege behandeling.
Kosten (middelenbeslag)
RRT is een kostbare behandeling. Bij de late behandelstrategie blijkt een aanzienlijk deel van de patiënten spontaan te herstellen zonder dat dit resulteert in een langere verblijfsduur of hogere mortaliteit. Hoewel er in de studies geen kosten bate analyse gedaan zijn lijkt het aannemelijk dat vroege behandeling leidt tot hogere kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Late behandeling geeft tijd om het klinisch beloop te evalueren en om indien nodig in een meer electieve setting een dialysekatheter in te brengen. Tevens resulteert late behandeling in minder RRT-behandelingen waardoor er minder apparatuur en personeel noodzakelijk is.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In patiënten met septische AKI en waarbij geen sprake is van een levensbedreigende aan AKI gerelateerde overvulling, hyperkaliëmie of metabole acidose werd in twee gerandomiseerde studies geen voordeel gezien van vroeg starten (dat wil zeggen binnen 6 tot 12 uur) ten opzichte van laat (48 tot 72 uur) na voldoen AKI stadium 3 criteria. In de late groep bleek bij bijna een kwart van de patiënten AKI spontaan te herstellen. Vroege behandeling lijkt dus te resulteren in “overbehandeling“ bij een deel van de patiënten. RRT is invasief, niet zonder risico’s en tevens een dure behandeling.
Een belangrijk aspect voor timing van RRT welke niet in de studies wordt meegenomen is het betrekken van de overige orgaanschade en comorbiditeit. Dit vraagt om een meer individuele benadering van timing van RRT.
Onderbouwing
Achtergrond
Acute nierschade (acute kidney injury, AKI) is de moderne term voor een plotseling verslechterende nierfunctie en wordt geclassificeerd volgens de KDIGO (voorheen RIFLE en AKIN) consensus classificatie. Bij septische AKI treedt de acute verslechtering van de nierfunctie op als gevolg van sepsis. Logischerwijs beschrijft septische AKI een syndroom waarbij voldaan wordt aan de consensus definities van zowel sepsis als AKI (Bellomo, 2017). Een deel van de patiënten met septische AKI behoeft nierfunctievervangende therapie (renal replacement therapy, RRT), hetgeen geassocieerd is met een hoge morbiditeit, mortaliteit en zorgkosten.
Het is momenteel onduidelijk of het vroeg starten van RRT, dus vóór het optreden van aan AKI gerelateerde complicaties, van invloed is op de klinische uitkomsten van patiënten met sepsis.
Conclusies
|
Laag GRADE |
Late start van nierfunctievervangende therapie lijkt mortaliteit op 28 dagen te verminderen ten opzichte van vroege start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria. Mortaliteit op 60 tot 90 dagen lijkt niet verschillend tussen vroege en late start.
Bronnen: (Barbar, 2018; Gaudry, 2018) |
|
Redelijk GRADE |
Vroege start van nierfunctievervangende therapie bespoedigt herstel van nierfunctie waarschijnlijk niet ten opzichte van een late start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018; Gaudry, 2018) |
|
Laag GRADE |
Vroege start van nierfunctievervangende therapie lijkt intensive care verblijfsduur niet te verminderen ten opzichte van late start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018; Gaudry, 2018) |
|
Laag GRADE |
Vroege start van nierfunctievervangende therapie lijkt ziekenhuisverblijfsduur niet te verminderen ten opzichte van late start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018; Gaudry, 2018.) |
|
Laag GRADE |
Vroege start van nierfunctievervangende therapie lijkt de duur van behandeling te verlengen ten opzichte van late start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018) |
|
Redelijk GRADE |
Late start van nierfunctievervangende therapie resulteert waarschijnlijk in een groter aantal RRT-vrije dagen ten opzichte van vroege start bij septische AKI in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018; Gaudry, 2018) |
|
Redelijk GRADE |
Late start van nierfunctievervangende therapie vermindert waarschijnlijk het aantal behandelde septische AKI-patiënten ten opzichte van een vroege start in afwezigheid van acute levensbedreigende startcriteria.
Bronnen: (Barbar, 2018; Gaudry, 2018) |
Samenvatting literatuur
Twee publicaties zijn gebruikt voor de literatuuranalyse van deelvraag 2, de optimale timing van RRT bij septische AKI. De AKI consensus criteria RIFLEfailure of KDIGOstadium-3 (tabel 7.5) werden gebruikt als uitgangspunt om te randomiseren in vroege of late start van RRT. Ten eerste bestudeerde Barbar (2018) vroege en late RRT in een gerandomiseerde, gecontroleerde open-label multicenter studie (IDEAL-ICU) bij volwassen patiënten met septische shock (Bone criteria, Bone 1992) en AKI-RIFLEFailure. In de vroege behandelingsgroep werd RRT (intermitterend of continu) gestart binnen 12 na constatering van AKI-RIFLEFailure, terwijl in de late groep RRT na 48 uur werd gestart, tenzij spontaan herstel van nierfunctie optrad of eerdere start van RRT noodzakelijk werd geacht op basis van vooraf vastgestelde criteria. De studie van Gaudry (2018) is een posthoc-analyse van de eerder gepubliceerde prospectieve gerandomiseerde open-label multicenter AKIKI trial (Gaudry, 2016) in patiënten met sepsis (Sepsis-3 criteria, Singer 2016) en AKI-KDIGOstadium-3. In deze analyse werd vroege start van RRT (intermitterend of continu) vergeleken met late start, met 174 patiënten per groep. Vroege start was gedefinieerd als binnen 6 uur na vaststelling van AKI KDIGOstadium-3. Late behandeling werd gestart wanneer na 72 uur nog steeds sprake was van oligurie of anurie en/of serum ureum > 40 mmol/L en/of refractaire hyperkaliëmie en/of metabole acidose met pH < 7,15, en of diuretica refractaire overvulling met pulmonaal oedeem en beademingsproblemen.
Tabel 5 RIFLE, KDIGO en AKIN criteria
|
|
Serum creatinine |
Urine output |
||
|
|
RIFLE |
KDIGO |
AKIN |
|
|
AKI Definitie |
SCr toename ≥50% binnen 7 dagen |
SCr toename ≥26,5 µmol/l binnen 48u of ≥50% binnen 7 dagen |
SCr toename ≥50% of ≥26,5 µmol/l binnen 48u |
< 0.5 mL/kg/u gedurende 6u |
|
RIFLE-risk KDIGO stage 1 AKIN stage 1 |
SCr toename ≥50% or GFR afname >25% |
SCr toename ≥26,5 µmol/l binnen 48u of ≥50% binnen 7 dagen |
SCr toename ≥50% of ≥26,5 µmol/l |
< 0.5 mL/kg/u gedurende 6 h |
|
RIFLE-injury KDIGO stage 2 AKIN stage 2 |
SCr toename ≥100% of GFR afname >50% |
SCr toename ≥100% |
SCr toename ≥100% |
< 0.5 mL/kg/u gedurende 12u |
|
RIFLE-failure KDIGO stage 3 AKIN stage 3 |
SCr toename ≥200% of GFR afname >75% of SCr ≥353,6 μmol/L (met acute toename ≥44,2 μmol/L) |
SCr toename ≥200% of SCr ≥353,6 μmol/L of RRT nodig |
SCr toename ≥200% of SCr ≥353,6 μmol/L (met acute toename ≥44,2 μmol/L) of RRT nodig |
< 0.3 mL/kg/u gedurende 24u of anuria gedurende 12u |
|
RIFLE-loss |
RRT nodig >4 weken |
|
|
|
|
RIFLE-end stage |
RRT nodig >3 maanden |
|
|
|
AKIN, Acute Kidney Injury Network; KDIGO, GFR, glomerular filtration rate; Kidney Disease Improving Global Outcome; RIFLE, risk of renal failure, injury to the kidney, failure of kidney function, loss of kidney function, and end-stage renal failure; RRT, renal replacement therapy. SCr, serum creatinine; Bron: Tsai (2017)
Resultaten
Mortaliteit
Barbar (2018) beschreef mortaliteit op 28 en 90 dagen, Gaudry (2018) op 28 en 60 dagen, zoals weergegeven in figuur 7.6. Op 28 dagen werd een gepoold relatief risico (RR) van 1,04 gevonden, met een 95% betrouwbaarheidsinterval (BI) van 0,89 tot 1,21, een klinisch relevant verschil in het voordeel van late start van RRT. Op 60 dagen vond Gaudry (2018) een RR van 0,97 (95% BI 0,79 tot 1,18), op 90 dagen rapporteerde Barbar (2018) een RR van 1,06 (95% BI van 0,90 tot 1,25).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met 2 niveaus afgewaardeerd tot laag vanwege de beperkte populatieomvang en overschrijding van de grenzen van klinische relevantie (beide imprecisie).
Figuur 7.6 Mortaliteit bij vroege versus late start van RRT
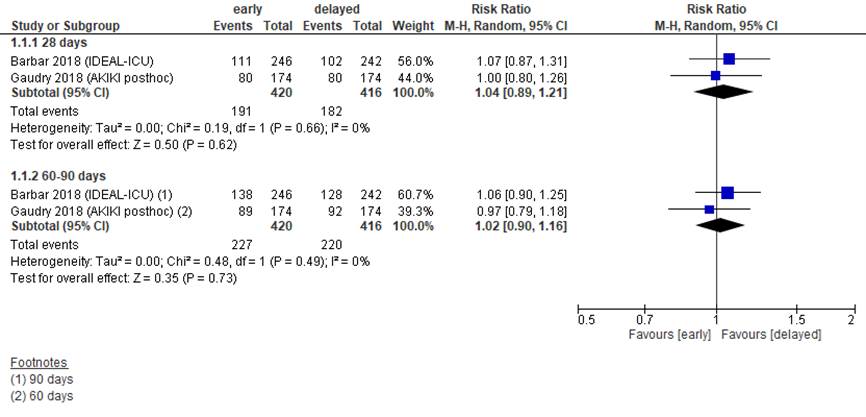
Mortaliteit (relatief risico) bij patiënten met sepsis. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Barbar, 2018; Gaudry, 2018
Herstel van nierfunctie
Gaudry (2018) en Barbar (2018) beschreven afhankelijkheid van RRT als uitkomstmaat. In de huidige analyse is herstel van nierfunctie daarvan afgeleid, zoals weergegeven in figuur 7.7. Het gepoolde RR op 28 dagen was 0,97 (95% BI 0,91 tot 1,04). Gaudry (2018) rapporteerde na 60 dagen een RR van 1,02 (95% BI 0,98 tot 1,07), Barbar (2018) vond een vergelijkbare waarde na 90 dagen met 1,01 (95% BI 0,97 tot 1,05).
Figuur 7 Herstel van nierfunctie bij vroege versus late start van RRT
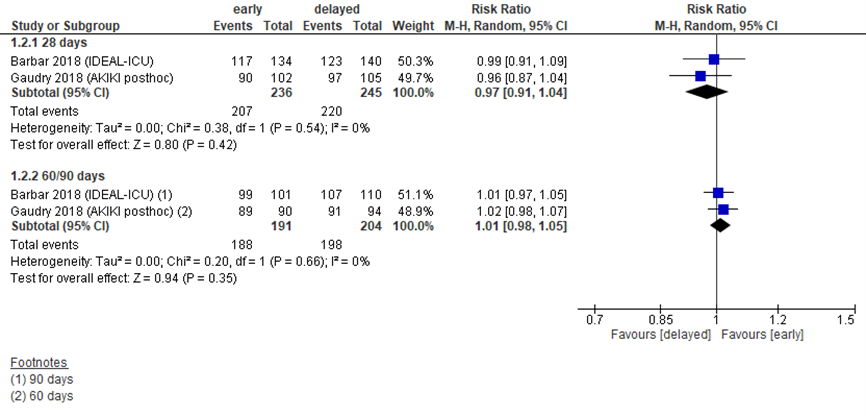
Herstel van nierfunctie (relatief risico) bij overlevende patiënten met sepsis. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Barbar, 2018; Gaudry, 2018
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat herstel van nierfunctie is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met 1 niveau afgewaardeerd tot redelijk vanwege de beperkte populatieomvang (imprecisie).
Intensive-careverblijfsduur
Verblijfsduur op de IC is beschreven in de beide studies bij in totaal 676 patiënten met sepsis, zoals weergeven in figuur 7.8. Het gemiddeld verschil was -0,04 dagen (95% BI -1,71 tot 1,63). Dit verschil is niet significant of klinisch relevant.
Ziekenhuisverblijfsduur
Het gemiddeld verschil in ziekenhuisverblijfsduur was 4,33 dagen in het voordeel van vroege start, met een 95% BI van -11,57 tot 2,91. Dit is een klinisch relevant, verschil, maar niet statistisch significant.
Figuur 8 IC- en ziekenhuisverblijfsduur bij vroege versus late start van RRT
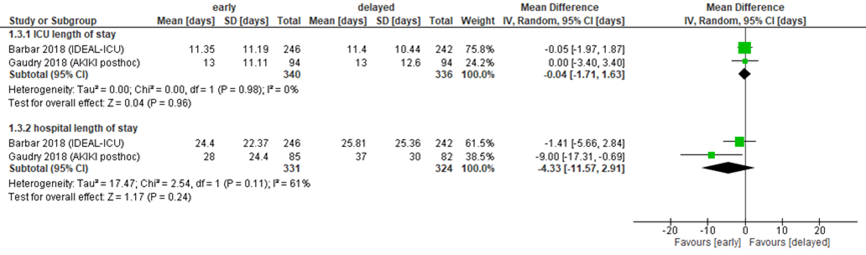
Verblijfsduur (gemiddeld verschil) van patiënten met sepsis in dagen. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Barbar, 2018; Gaudry, 2018
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten ziekenhuisverblijfsduur en IC-verblijfsduur is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is in beide gevallen met 2 niveaus afgewaardeerd tot laag vanwege de beperkte populatieomvang en vanwege overschrijding van de grenzen van klinische relevantie (beide imprecisie).
Duur van RRT
In de RCT van Barbar (2018) was behandelingsduur langer in de vroege groep, met een mediaan behandelingsduur van 4 dagen in de vroege groep (IQR 2 tot 8, N=246) versus 2 dagen in de late groep (IQR 0 tot 6, N=242). De duur van RRT werd niet direct beschreven door Gaudry (2018). Wel werd in beide studies het aantal RRT-vrije dagen beschreven (figuur 7.9). Er werd bij in totaal 836 patiënten een gepoold gemiddeld verschil gevonden van 4,43 dagen in het voordeel van late start van RRT (95% BI -6,92 tot -1,92). Dit verschil is klinisch relevant.
Figuur 9 Aantal RRT-vrije dagen bij vroege versus late start van RRT
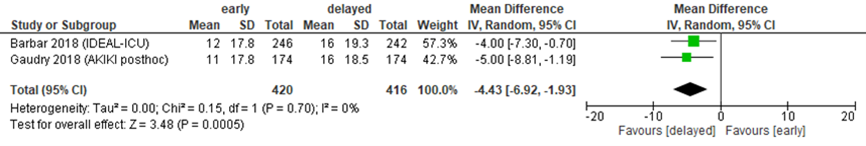
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Barbar, 2018; Gaudry, 2018
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten duur van RRT en aantal RRT-vrije dagen is gebaseerd op gerandomiseerde trials en start daarom op hoog. Voor duur van RRT is met 2 niveaus afgewaardeerd tot laag vanwege de beperkte populatieomvang en overschrijding van de grenzen van klinische besluitvorming (beide imprecisie). Voor RRT-vrije dagen is met 1 niveau afgewaardeerd tot redelijk vanwege de beperkte populatieomvang (imprecisie).
Behandeling met RRT
In beide studies werd beschreven hoeveel patiënten daadwerkelijk behandeld werden met RRT, zie figuur 10. Het gepoolde RR op behandeling was 1,68 in het voordeel van late start van behandeling, een klinisch relevant verschil (95% BI 1,46 tot 1,94, N=636).
Figuur 10 Behandeling met RRT bij vroege versus late start van RRT
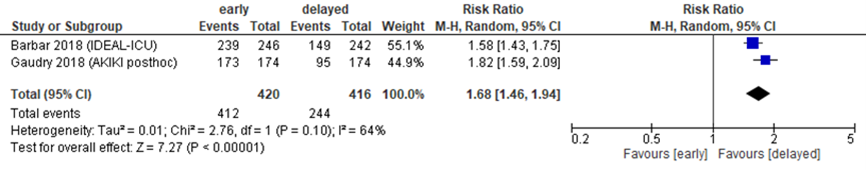
Relatief risico op behandeling met RRT. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Barbar, 2018; Gaudry, 2018
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat behandeling met RRT is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met 1 niveau afgewaardeerd tot redelijk vanwege de beperkte populatieomvang (imprecisie).
Zoeken en selecteren
Om deze vraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Deelvraag 2: Timing
Wat is de optimale timing om te beginnen met RRT bij patiënten met septische AKI?
P: volwassen patiënten met septische AKI;
I: vroege RRT;
C: late/standaard RRT;
O: mortaliteit, herstel van nierfunctie, intensive-careverblijfsduur, ziekenhuisverblijfsduur, duur van RRT, wel/niet ontvangen van RRT.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en herstel van nierfunctie voor de besluitvorming cruciale uitkomstmaten; en intensive-careverblijfsduur, ziekenhuisverblijfsduur en duur van RRT voor de besluitvorming belangrijke uitkomstmaten. Daarnaast werd voor de deze deelvraag het wel of niet ontvangen van RRT als belangrijke uitkomstmaat gezien.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde de grens van 3% als een klinisch (patiënt) relevant verschil voor mortaliteit (gebaseerd op de SDD-trial van de Smet, 2009), en 25% voor de overige dichotome uitkomstmaten. Voor verblijfsduur op de intensive care (IC), duur van RRT en RRT-vrije dagen werd 1 dag als klinisch relevant verschil gedefinieerd, voor ziekhuisverblijfsduur 2 dagen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 28 augustus 2019 met relevante zoektermen gezocht naar literatuur voor deelvraag 1, 2 en 3. Omdat er weinig literatuur beschikbaar is over RRT, is de populatie uit de PICO uitgebreid met ernstig zieke IC-patiënten. Wanneer voldoende studies beschikbaar waren om een deelvraag te beantwoorden in een sepsispopulatie, dan werden IC-studies geëxcludeerd.
De literatuur-zoekactie leverde 521 treffers op. Op basis van titel en abstract werden voor deelvraag 2 in eerste instantie 16 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 studies definitief geselecteerd.
Resultaten
In de literatuuranalyse van deelvraag 2 (timing van RRT) zijn twee artikelen opgenomen, een originele multicenter RCT en een posthoc-analyse van een multicenter RCT. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Barbar SD, Clere-Jehl R, Bourredjem A, Hernu R, Montini F, Bruyère R, Lebert C, Bohé J, Badie J, Eraldi JP, Rigaud JP, Levy B, Siami S, Louis G, Bouadma L, Constantin JM, Mercier E, Klouche K, du Cheyron D, Piton G, Annane D, Jaber S, van der Linden T, Blasco G, Mira JP, Schwebel C, Chimot L, Guiot P, Nay MA, Meziani F, Helms J, Roger C, Louart B, Trusson R, Dargent A, Binquet C, Quenot JP; IDEAL-ICU Trial Investigators and the CRICS TRIGGERSEP Network. Timing of Renal-Replacement Therapy in Patients with Acute Kidney Injury and Sepsis. N Engl J Med. 2018 Oct 11;379(15):1431-1442. doi: 10.1056/NEJMoa1803213. PubMed PMID: 30304656.
- Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, Bagshaw SM, Glassford NJ, Lankadeva Y, Vaara ST, Schneider A. Acute kidney injury in sepsis. Intensive Care Med. 2017 Jun;43(6):816-828. doi: 10.1007/s00134-017-4755-7. Epub 2017 Mar 31. Review. PubMed PMID: 28364303.
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Fayad AII, Buamscha DG, Ciapponi A. Timing of renal replacement therapy initiation for acute kidney injury. Cochrane Database Syst Rev. 2018 Dec 18;12:CD010612. doi: 10.1002/14651858.CD010612.pub2. PubMed PMID: 30560582; PubMed Central PMCID: PMC6517263.
- Gaudry S, Hajage D, Schortgen F, Martin-Lefevre L, Verney C, Pons B, Boulet E, Boyer A, Chevrel G, Lerolle N, Carpentier D, de Prost N, Lautrette A, Bretagnol A, Mayaux J, Nseir S, Megarbane B, Thirion M, Forel JM, Maizel J, Yonis H, Markowicz P, Thiery G, Tubach F, Ricard JD, Dreyfuss D. Timing of Renal Support and Outcome of Septic Shock and Acute Respiratory Distress Syndrome. A Post Hoc Analysis of the AKIKI Randomized Clinical Trial. Am J Respir Crit Care Med. 2018 Jul 1;198(1):58-66. doi: 10.1164/rccm.201706-1255OC. PubMed PMID: 29351007.
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int. 2012;2:124-138.Lewis SJ, Mueller BA. Antibiotic dosing in critically ill patients receiving CRRT: underdosing is overprevalent. Semin Dial. 2014 Sep-Oct;27(5):441-5. doi: 10.1111/sdi.12203. PubMed PMID: 25204875.
- Lewis SJ, Mueller BA. Antibiotic dosing in critically ill patients receiving CRRT: underdosing is overprevalent. Semin Dial. 2014 Sep-Oct;27(5):441-5. doi: 10.1111/sdi.12203. PMID: 25204875.
- STARRT-AKI Investigators; Canadian Critical Care Trials Group; Australian and New Zealand Intensive Care Society Clinical Trials Group; United Kingdom Critical Care Research Group; Canadian Nephrology Trials Network; Irish Critical Care Trials Group, Bagshaw SM, Wald R, Adhikari NKJ, Bellomo R, da Costa BR, Dreyfuss D, Du B, Gallagher MP, Gaudry S, Hoste EA, Lamontagne F, Joannidis M, Landoni G, Liu KD, McAuley DF, McGuinness SP, Neyra JA, Nichol AD, Ostermann M, Palevsky PM, Pettilä V, Quenot JP, Qiu H, Rochwerg B, Schneider AG, Smith OM, Thomé F, Thorpe KE, Vaara S, Weir M, Wang AY, Young P, Zarbock A. Timing of Initiation of Renal-Replacement Therapy in Acute Kidney Injury. N Engl J Med. 2020 Jul 16;383(3):240-251. doi: 10.1056/NEJMoa2000741. Erratum in: N Engl J Med. 2020 Jul 15;: PMID: 32668114.
- Tsai TY, Chien H, Tsai FC, Pan HC, Yang HY, Lee SY, Hsu HH, Fang JT, Yang CW, Chen YC. Comparison of RIFLE, AKIN, and KDIGO classifications for assessing prognosis of patients on extracorporeal membrane oxygenation. J Formos Med Assoc. 2017 Nov;116(11):844-851. doi: 10.1016/j.jfma.2017.08.004. Epub 2017 Sep 2. PubMed PMID: 28874330.
Evidence tabellen
Evidence tables for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question 2: What is the optimal timing of renal replacement therapy in patients with septic shock and acute renal failure?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Barbar, 2018
(IDEAL-ICU trial) |
Type of study: RCT
Setting and country: Multicenter, 29 ICUs, France
Funding and conflicts of interest: Supported by a grant (A00519-34) from the Programme Hospitalier de Recherche Clinique National, funded by the French Ministry of Health.
Dr. Jaber reports receiving consulting fees from Dräger Medical, Fisher and Paykel, and Xenios; and Dr. Roger, receiving travel support from MSD and Pfizer. No other potential conflict of interest relevant to this article was reported. |
Inclusion criteria: Patients 18 years of age or older, were admitted to the ICU in the early phase of septic shock (within 48 hours after the start of vasopressor therapy), and had acute kidney injury meeting at least one of the following criteria for the failure stage of the RIFLE classification: oliguria (urine output <0.3 ml per kilogram of body weight per hour for ≥24 hours), anuria for 12 hours or more, or a serum creatinine level 3 times the baseline level (or ≥4 mg per deciliter (≥350 μmol per liter) accompanied by a rapid increase of ≥0.5 mg per deciliter (≥44 μmol per liter)).
Exclusion criteria: Patients requiring emergency renal-replacement therapy before randomization
N total at baseline: Intervention: 246 Control: 242
Age ± SD: I: 69.3±11.6 C: 68.7±12.8
Sex (% male): I: 58 C: 46
SOFA: I: 12.2±2.9 C: 12.4±2.9
Groups were comparable at baseline |
In the early-strategy group, renal-replacement therapy was initiated within 12 hours after documentation of failure-stage acute kidney injury. |
Renal-replacement therapy was initiated in the delayed group 48 hours after the diagnosis of acute kidney injury.
unless - RRT was started earlier due to any one of the following conditions included in the criteria for emergency renal-replacement therapy: hyperkalemia (potassium level >6.5 mmol per liter), metabolic acidosis (pH <7.15), or fluid overload (extravascular fluid overload that was refractory to diuretics, with pulmonary edema). - RRT was no longer necessary due to spontaneous renal recovery occurred (defined as a decrease in creatinine level and a return of spontaneous urine output to >1000 ml per 24 hours (or >2000 ml per 24 hours in patients receiving diuretics)) |
Length of follow-up: 180 days
Loss-to-follow-up: Intervention: 7/246 did not receive RRT - 2 died - 1 had catheter insertion failure - 4 had spontaneous recovery 239/246 received RRT 134/239 that did receive RRT died
Control: 93/242 did not receive RRT - 21 died - 70 had spontaneous recovery - 2 did not receive RRT for other reasons. 149/242 received RRT - 41 started RRT before 48 hours, of which 28 died - 108 underwent RRT after 48 hours, of which 59 died.
Incomplete outcome data: Intervention: 7/246 (3%)
Control: 4/242 (2%) |
Mortality (90 days, primary outcome) Early start: 138/239 (58%) Late start: 128/238 (54%) P=0.38
Mortality (28 days) Early start: 111/242 (45%) Late start: 102/2242 (42%) P=0.48
Mortality (180 days) Early start: 143/236 (61%) Late start: 134/235 (57%) P=0.37
Median duration (days) of RRT Early start: 4 (IQR 2-8) Late start: 2 (IQR 0-6) P<0.001
Median length of ICU stay (of survivors) Early start: 12 (IQR 8-21) Late start: 12 (IQR 8-21) P=0.88
Median length of hospital stay (of survivors) Early start: 22 (IQR 9.0-38.0) Late start: 21 (IQR 10.0-42.5) P=0.53
Recovery of renal function (described as the opposite, “dependence on renal-replacement therapy among survivors” at day 28) Early start: 117/134 (87%) Late start: 123/140 (88%) P=0.89
RRT-free days 28 days after randimization median (IQR) Early start 12 (1-25) Late start 16 (2-28) P=0.006
Patients who received RRT Early start 239/246 (97%) Late start 149/242 (62%) P<0.001
Adverse events potentially related to AKI or RRT Fluid balance in the first 7 days after enrolment;
The need for emergency RRT in the delayed strategy group |
RRT included IHD, SLED, CVVHD, CVVH or CVVHDF) and could move from one technique to another depending on the needs of the patients, typically the continuous technique in the acute phase, relayed by intermittent techniques after stabilization.
For continuous techniques treatment had to provide treatmet continuously, change membranes every 72 hours, recommended dose 25 ml/kg/h
Intermittent techniques blood flow 150-250 ml/min, dialysate flow rate of 300-500 ml/min, a high concentration of sodium in the dialysate (150 mmol/L) and temperature dialysate 350C. session 4-6 h at least every 48 hours or more often to achieve optimal metabolic control (urea <30 mmol/L, stable salt and water balance). Biocompatible membranes Anticoagulation: unfractioned heparin, low molecular weight heparin, regional citrate anticoagulation. |
|
Gaudry, 2018
(AKIKI trial posthoc analysis) |
Type of study: RCT posthoc analysis
Setting and country: Multicenter, 31 ICUs, France
Funding and conflicts of interest: Supported by a grant from the Programme Hospitalier de Recherche Clinique National, 2012 (AOM12456), funded by the French Ministry of Health. Dr. Gaudry reports receiving grant support from Xenios; Dr. Boyer, receiving lecture fees from Merck Sharp and Dohme and travel support from Gilead Sciences and Pfizer; Dr. Lerolle, receiving fees for congress participation from Eli Lilly and Baxter; Dr. Ricard, receiving travel support from Fisher and Paykel Healthcare; and Dr. Dreyfuss, receiving honoraria from INSERM–Transfert. No other potential conflict of interest relevant to this article was reported. |
Inclusion criteria: Patients 18 years of age or older, admitted to the ICU with acute kidney injury that was compatible with a diagnosis of acute tubular necrosis in the context of ischemic or toxic injury and were receiving invasive mechanical ventilation, catecholamine infusion (epinephrine or norepinephrine), or both; KDIGO stage 3 acute kidney injury
Exclusion criteria: Blood urea nitrogen level higher than 112 mg per deciliter (40 mmol per liter), a serum potassium concentration greater than 6 mmol per liter (or greater than 5.5 mmol per liter despite medical treatment), a pH below 7.15 in the context of either pure metabolic acidosis (partial pressure of arterial carbon dioxide (Paco2) below 35 mm Hg) or mixed acidosis (Paco2 of 50 mm Hg or more without the possibility of increasing alveolar ventilation), and acute pulmonary edema due to fluid overload responsible for severe hypoxemia requiring an oxygen flow rate greater than 5 liters per minute to maintain a peripheral capillary oxygen saturation (Spo2) greater than 95% or requiring a fraction of inspired oxygen (Fio2) greater than 50% in patients receiving mechanical ventilation and despite diuretic therapy.
N total at baseline: Intervention: 174 Control: 174
Age ± SD: I: 67±13 C: 68±12
Sex (% male): I: 65; C: 61
SOFA: I: 11.6±3.0 C: 11.5±3.2
SAPS3: I: 75±14 C: 76±14
Groups were comparable at baseline. |
In the early-strategy group, renal-replacement therapy was initiated as soon as possible after randomization in order for it to be started within 6 hours after documentation of stage 3 acute kidney injury. |
In the delayed-strategy group, renal-replacement therapy was initiated if one of the laboratory abnormalities defined under exclusion criteria developed or if oliguria or anuria lasted for more than 72 hours after randomization. |
Length of follow-up: 60 days
Loss-to-follow-up: Not specified
Incomplete outcome data: Not specified |
Mortality (60 days, primary endpoint) Early 89/174 Delayed 92/174 RR 0.97 (0.79, 1.18)
Hazard ratios: No sepsis 1.44 (95% CI, 0.85–2.46); Sepsis 0.81 (95% CI, 0.49–1.33); Septic shock 1.01 (95% CI, 0.76–1.36); test for interaction P =0.27
Mortality 28 days Early 80/174 Delayed 80/174 RR 1.00 (0.80, 1.26)
RRT dependence Day 28 Early 12/102 (12%) Delayed 8/105 (8%) P=0.31
Day 60 Early 1/90 (3%) Delayed 3/94 (3%) P=0.62
Length of ICU stay (days) Median (IQR) in survivors Early 13 (9-24) Delayed 13 (8-25) P=0.74
Length of hospital stay (days) Median (IQR) in survivors Early 28 (18-51) Delayed 37 (21-52) P=0.43
RRT-free days median (IQR) Early start 11 (1-25) Late start 16 (4-29) P<0.001
Patients who received RRT Early start 173/174 (99%) Late start 95/174 (55%) P<0.001 |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
Research question 2: What is the optimal timing of renal replacement therapy in patients with septic shock and acute renal failure?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Barbar, 2018 |
Randomization was performed by means of an online response system, with the use of Tenalea software (FormsVision BV), during the first 48 hours of septic shock after acute kidney injury was determined to be at the failure stage of the RIFLE classification. Randomization was performed on the basis of a minimization technique with stratification according to center, age, Sepsis-related Organ Failure Assessment (SOFA) score site, and type of infection. Patients were randomly assigned to the early-strategy group or the delayed-strategy group in a 1:1 ratio. |
Unclear |
Unlikely
Outcomes unlikely to be affected by lack of blinding for patients |
Likely
Not blinded. |
unclear |
unlikely |
unlikely |
unlikely |
|
Gaudry, 2018 |
In the AKIKI trial, the randomization list was computer-generated, balanced by blocks of variable and undisclosed size and stratified according to center. Patients were randomly assigned in a 1:1 ratio to either early initiation of renal-replacement therapy or delayed initiation of renal-replacement therapy. |
unlikely |
Unlikely
Outcomes unlikely to be affected by lack of blinding for patients |
Likely
Not blinded. |
unclear |
unlikely |
unlikely |
unclear |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-09-2022
Laatst geautoriseerd : 05-10-2022
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://classic.clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
