Nierfunctievervangende therapie: modaliteit
Uitgangsvraag
Wat is de optimale modaliteit van nierfunctievervangende therapie bij patiënten met septische acute nierschade?
Aanbeveling
Beschouw intermitterende hemodialyse en continue nierfunctievervangende therapie als complementaire behandelingen voor patiënten met sepsis.
Geef de voorkeur aan continue nierfunctievervangende therapie bij hemodynamisch instabiele patiënten met sepsis.
Overweeg intermitterende hemodialyse bij patiënten met sepsis met een contra-indicatie voor systemische antistolling en waarbij continue nierfunctievervangende therapie met regionale citraat antistolling niet uitvoerbaar is.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
RRT kan intermitterend (IHD) en continu (CRRT) op een aantal manieren worden uitgevoerd. In tegenstelling tot bijvoorbeeld Franse en Duitse IC’s wordt op de Nederlandse IC’s vrijwel uitsluitend CRRT toegepast. Tot op heden is niet duidelijk wat de optimale behandelmethode is. Er is daarom literatuuronderzoek verricht naar de optimale modaliteit.
IHD versus CRRT is een oude discussie. Er zijn geen goede studies die hebben kunnen aantonen dat de ene techniek beter is dan de andere. Beide technieken zijn over de jaren steeds verder verbeterd en de wereldwijde consensus is dat beide technieken complementair zijn. De theoretische voordelen van CRRT ten opzichte van IHD zijn samengevat in tabel 4. De vergelijking tussen continue en intermitterende RRT is niet specifiek beschreven bij patiënten met sepsis, maar wel bij ernstig zieke patiënten op de IC. Bij analyse van deze studies blijkt bij de meerderheid van de patiënten ook sprake van sepsis (65%) met of zonder shock. In deze studies waren er geen klinisch relevante verschillen in herstel van nierfunctie tussen beide modaliteiten. Door de zeer lage bewijskracht konden de cruciale uitkomstmaat mortaliteit en de uitkomstmaten IC-/ziekenhuisverblijfsduur en duur van nierfunctievervangende therapie geen richting geven aan de besluitvorming.
Tabel 4 Vergelijking van voor- en nadelen tussen CRRT en IHD
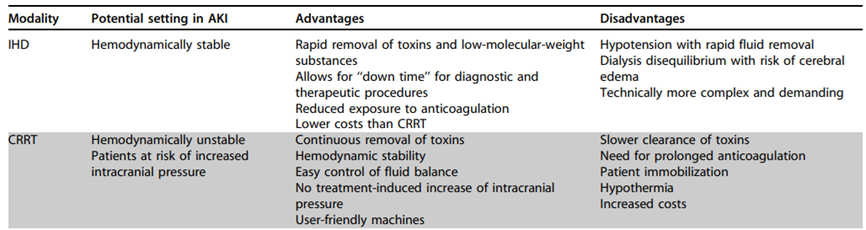
Bron: Kidney International Supplements (2012) 2, 89–115
Het is belangrijk om te beseffen dat de meeste studies inmiddels meer dan 15 jaar oud zijn en dat geen van de studies voldaan hebben aan de powerberekening. De meest recente studie includeerde patiënten van jan 2002 tot oktober 2007 (Schefold, 2014). Alle studies hadden problemen met het includeren van patiënten waardoor alle studies ‘underpowered’ zijn. De grootste studie is de multicenter studie van Vinsonneau (2006) waarin ondanks deelname van 21 ziekenhuizen in 4 jaar tijd slechts 359 patiënten werden geïncludeerd. Verder valt op dat er cross-over optreedt tussen de modaliteiten in de eerste dagen na randomisatie (Vinsonneau, 2006; Schefold, 2014; Lins, 2009). De belangrijkste reden om te switchen van IHD naar CRRT was hemodynamische instabiliteit. De belangrijkste reden om te switchen van CRRT naar IHD was recidiverend stollen van hemofilter of contra-indicatie voor systemische antistolling bij ernstig gestoorde stolling of diepe trombocytopenie. Visonneau (2006) beschrijft in zijn studie speciale maatregelen voor het optimaliseren van hemodynamische stabiliteit tijdens IHD: dialysaat met hoge natrium concentratie (150 mmol/L) en lage temperatuur (35oC), isovolemisch aansluiten (NaCl 0,9%) en dialyse sessies van gemiddeld 5 uur. Opvallend is dat in de gerandomiseerde studies over timing en dosis van RRT vaak beiden technieken door elkaar heen worden gebruikt. Dit geldt ook voor de twee multicenter gerandomiseerde studies over septische AKI en timing van RRT (Barbar, 2018; Gaudry, 2018). In de studie van Barbar (2018) kreeg 37% uitsluitend CRRT, 27% uitsluitend IHD en 16% een combinatie van beide technieken. In de studie van Gaudry (2018) kreeg 37% uitsluitend CRRT, 39% uitsluitend IHD en 25% een combinatie van beide technieken. De keuze van de techniek werd overgelaten aan de behandelend arts.
Voor modaliteit van behandeling is de totale bewijskracht, de laagste bewijskracht voor de cruciale uitkomstmaten, laag. Uit de literatuur komt geen voorkeur van een van beide modaliteiten naar voren. Hier ligt een kennislacune. Op basis van de beschreven cross-over in de studies lijkt bij hemodynamisch instabiele patiënten continue RRT beter verdragen te worden en intermitterende behandeling het voordeel te hebben dat deze behandeling zonder continue systemische antistolling uitgevoerd kan worden. Hierbij dient opgemerkt te worden dat deze studies dateren van voor de continue RRT met regionale citraat-antistolling. De keuze voor een van beide modaliteiten zou daarom gebaseerd moeten worden op andere overwegingen zoals de voor- en nadelen beschreven in tabel 7.4 in relatie tot de specifieke patiënt. Chronische dialysepatiënten met sepsis zijn niet onderzocht, maar het is aannemelijk dat de aanbevelingen ook voor deze populatie van toepassing zijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De waarden en voorkeuren van patiënten ten aanzien van continue RRT ten opzichte van IHD zijn niet onderzocht en onbekend. Goede voorlichting en communicatie over behandeldoelen, voor- en nadelen, risico’s en verwacht resultaat is belangrijk om een goede afweging te maken voor patiënten en naasten.
Tijdens continue RRT kan het mobiliseren van patiënt bemoeilijkt worden door het optreden van drukalarmen van het extracorporale circuit, in het bijzonder wanneer de dialysekatheter in de v. femoralis is ingebracht. Dit kan ertoe leiden dat hierdoor de patiënt bedgebonden is en niet in de stoel gemobiliseerd kan worden. Het is dus aannemelijk dat patiënten bij afwezigheid van voordeel op morbiditeit of mortaliteit niet de voorkeur geven aan continue behandeling.
Kosten (middelenbeslag)
Over het algemeen wordt aangenomen dat CRRT duurder is dan IHD. Deze aanname is gebaseerd op oudere observationele studies. Voor IHD zijn de materiaalkosten lager aangezien de dialyse machines ook buiten de IC worden gebruikt en de kosten van dialyse vloeistof aanzienlijk lager is dan de CRRT-substitutievloeistof. Wanneer CRRT wordt uitgevoerd door het IC-personeel zal dit wellicht in personele kosten lager zijn dan IHD waarbij per dialyse behandeling een dialyse verpleegkundige nodig is. Verder zijn er aanwijzingen dat IHD in de acute fase van AKI resulteert in meer chronische dialyse op lange termijn, waarmee een eventuele kostenbesparing van IHD versus CRRT weer wegvalt (Bellomo, 2014; James, 2011).
Aanvaardbaarheid, haalbaarheid en implementatie
CRRT wordt uitgevoerd door de intensive care-verpleegkundige en dit kan gecombineerd worden met andere taken. IHD wordt uitgevoerd door een dialyseverpleegkundige. Tijdens IHD op de IC kan de dialyseverpleegkundige geen andere taken doen. Een IHD-behandeling op de IC is dus een niet efficiënte belasting voor het dialysepersoneel.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
IHD versus CRRT is een oude discussie. Er zijn geen goede studies die hebben kunnen aantonen dat de ene techniek beter is dan de andere. Beide technieken zijn over de jaren steeds verder verbeterd en de wereldwijde consensus is dat beide technieken complementair zijn. Het inzetten van IHD of CRRT wordt niet alleen bepaald door patiënt factoren (bijvoorbeeld shock) maar ook door organisatorische factoren (machines, personeel).
Opvallend in de studies is dat bij hemodynamisch instabiele patiënten IHD werd omgezet in CRRT indien IHD niet werd verdagen, en dat CRRT werd omgezet in IHD bij ernstige contra-indicatie voor systemische antistolling, en geen mogelijkheid om CRRT met regionale citraat antistolling.
Onderbouwing
Achtergrond
Acute nierschade (acute kidney injury, AKI) is de moderne term voor een plotseling verslechterende nierfunctie en wordt geclassificeerd volgens de KDIGO (voorheen RIFLE en AKIN) consensus classificatie. Bij septische AKI treedt de acute verslechtering van de nierfunctie op als gevolg van sepsis. Logischerwijs beschrijft septische AKI een syndroom waarbij voldaan wordt aan de consensus definities van zowel sepsis als AKI (Bellomo, 2017). Een deel van de patiënten met septische AKI behoeft nierfunctievervangende therapie (renal replacement therapy, RRT), hetgeen geassocieerd is met een hoge morbiditeit, mortaliteit en zorgkosten. RRT kan intermitterend (IHD) en continu (CRRT) worden uitgevoerd. CRRT wordt alleen op de IC toegepast, onafhankelijk van dialysemedewerkers. In Nederland wordt op de IC’s vrijwel uitsluitend CRRT toegepast. In andere landen (bijvoorbeeld Duitsland en Frankrijk) wordt op de IC veelvuldig IHD toegepast. Het is momenteel nog onduidelijk of RRT-modaliteit van invloed is op de klinische uitkomsten van patiënten met sepsis.
Conclusies / Summary of Findings
|
GRADE |
Het is onduidelijk of continue nierfunctievervangende therapie effect heeft op ziekenhuismortaliteit ten opzichte van intermitterende nierfunctievervangende therapie bij patiënten met septische AKI.
Bronnen: (Rabindranath, 2007; Lins, 2009; Schefold, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk of continue nierfunctievervangende therapie effect heeft op intensive-caremortaliteit ten opzichte van intermitterende nierfunctievervangende therapie bij patiënten met septische AKI.
Bronnen: (Rabindranath, 2007; Lins, 2009; Schefold, 2014) |
|
Laag GRADE |
Er lijkt geen verschil te zijn in herstel van nierfunctie tussen continue nierfunctievervangende therapie en intermitterende nierfunctievervangende therapie bij patiënten met septische AKI.
Bronnen: (Rabindranath, 2007; Lins, 2009; Schefold, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk of continue nierfunctievervangende therapie effect heeft op intensive-careverblijfsduur ten opzichte van intermitterende nierfunctievervangende therapie bij patiënten met septische AKI.
Bronnen: (Lins, 2009; Schefold, 2014.) |
|
Zeer laag GRADE |
Het is onduidelijk of continue nierfunctievervangende therapie effect heeft op ziekenhuisverblijfsduur ten opzichte van intermitterende nierfunctievervangende therapie bij patiënten met septische AKI.
Bronnen: (Lins, 2009; Schefold, 2014.) |
|
Zeer laag GRADE |
Het is onduidelijk of de continue modaliteit effect heeft op duur van nierfunctievervangende therapie ten opzichte van de intermitterende modaliteit bij patiënten met septische AKI.
Bronnen: (Schefold, 2014) |
Samenvatting literatuur
Drie publicaties zijn gebruikt voor de literatuuranalyse van deelvraag 1, modaliteit. Een directe vergelijking tussen continue en intermitterende RRT werd niet gevonden in een sepsispopulatie. Er is daarom uitgebreid naar ernstig zieke patiënten met AKI. In de Cochrane review van Rabindranath (2007) werden continue en intermitterende RRT vergeleken bij volwassenen met AKI. Mortaliteit, herstel van nierfunctie en verblijfsduur in ziekenhuis of IC werden hierin beschreven op basis van 15 trials met in totaal 1550 patiënten. Studies uit deze SR waarbij patiëntinclusie was afgesloten voor het jaar 2000 werden niet meegenomen in de analyse, zodat 3 RCT’s overbleven: Gasparovic, 2003; Uehlinger, 2005; Visonneau, 2006. Daarnaast onderzocht Lins (2009) het verschil tussen de 2 modaliteiten bij ernstig zieke volwassenen met acuut nierfalen die waren opgenomen op de IC. In totaal werden 316 patiënten gerandomiseerd; de meerderheid van de geïncludeerde patiënten (65%) had sepsis. Schefold (2014) randomiseerde 252 ernstig zieke patiënten met AKI in de CONVINT-trial. Ook in deze studie had de meerderheid van de patiënten (> 65%) ernstige sepsis/septische shock.
Resultaten
Mortaliteit
In de SR van Rabindranath (2007) werd mortaliteit apart beschreven als ziekenhuis- en IC-mortaliteit. Lins (2009) en Schefold (2014) rapporteerden alleen ziekenhuismortaliteit. Bij 593 patiënten die continue RRT (CRRT) ondergingen en 564 patiënten die intermitterende hemodialyse (IHD) ondergingen in 5 studies werd voor ziekenhuismortaliteit een RR van 0,97 gevonden (95% BI van 0,88 tot 1,06). Voor IC-mortaliteit werd in 2 studies bij 90 patiënten met CRRT versus 65 patiënten met IHD een RR gevonden van 0,94 (95% BI van 0,67 tot 1,33). Deze verschillen waren niet klinisch relevant (figuur 1).
Figuur 1 Mortaliteit bij continue versus intermitterende RRT
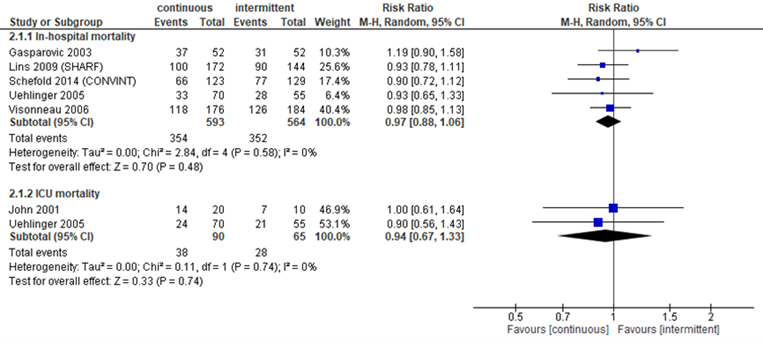
Mortaliteit (relatief risico) van ernstig zieke patiënten in dagen. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Rabindranath, 2007; Lins, 2009; Schefold, 2014
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op gerandomiseerde trials en start daarom op hoog. Voor zowel ziekenhuis- als IC-mortaliteit is de bewijskracht met 3 niveaus afgewaardeerd tot zeer laag vanwege de extrapoleerbaarheid (indirectheid), de beperkte populatieomvang en overschrijding van de grenzen van klinische relevantie (beide imprecisie).
Herstel van nierfunctie
Herstel van nierfunctie (figuur 2) werd gerapporteerd in 3 studies bij 166 patiënten met CRRT en 134 patiënten met IHD. Bij elkaar genomen werd geen verschil gevonden met een RR van 1,03 (95% BI 0,96 tot 1,12).
Figuur 2 Herstel van nierfunctie bij continue versus intermitterende RRT
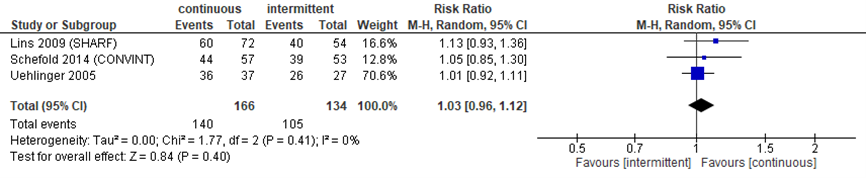
Herstel van nierfunctie (relatief risico) bij ernstig zieke patiënten in dagen. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Rabindranath, 2007; Lins, 2009; Schefold, 2014
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat herstel van nierfunctie is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met 2 niveaus afgewaardeerd tot laag vanwege de beperkte populatieomvang (imprecisie) en vanwege de extrapoleerbaarheid (indirectheid).
Verblijfsduur op de IC
Verblijfsduur op de IC werd gerapporteerd in de RCT’s van Lins (2009) en Schefold (2014). Bij in totaal 294 versus 272 patiënten werd een gemiddeld verschil gevonden van 0,62 dagen, met een 95% BI van -3,11 tot 4,35, zoals weergegeven in figuur 7.3.
Verblijfsduur in het ziekenhuis
Ook voor verblijfsduur in het ziekenhuis werd in dezelfde studies geen significant verschil gevonden met een gemiddeld verschil van 3,31 dagen in het voordeel van IHD, met een 95% BI van -2,91 tot 9,52 (figuur 3).
Figuur 3 IC- en ziekenhuisverblijfsduur bij continue versus intermitterende RRT
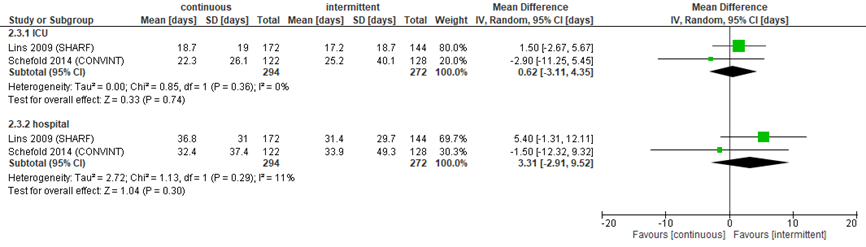
Verblijfsduur (gemiddeld verschil) van ernstig zieke patiënten in dagen. Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Lins, 2009; Schefold, 2014
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten IC-verblijfsduur en ziekenhuisverblijfsduur is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is in beide gevallen met 3 niveaus afgewaardeerd tot zeer laag vanwege de beperkte populatieomvang, de extrapoleerbaarheid (indirectheid) en vanwege overschrijding van de grenzen van klinische relevantie (imprecisie).
Duur van RRT
Slechts een studie beschreef de duur van RRT bij continue versus intermitterende RRT. Schefold (2014) rapporteerde 13,7±17,9 dagen voor continue RRT bij 122 patiënten, en 17,2±37,1 dagen bij 128 patiënten met intermitterende RRT. Dit resulteerde in een gemiddeld verschil van -3,50 in het voordeel van continue RRT, met een 95% betrouwbaarheidsinterval van -10,67 tot 3,67.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat duur van RRT is gebaseerd op gerandomiseerde trials en start daarom op hoog. Er is met 3 niveaus afgewaardeerd tot zeer laag vanwege de extrapoleerbaarheid (indirectheid omdat de studies ook patiënten zonder sepsis beschreven), de beperkte populatieomvang en overschrijding van de grenzen van klinische relevantie (beide imprecisie).
Zoeken en selecteren
Om deze vraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de optimale modaliteit van RRT bij patiënten met septische AKI?
P: volwassen patiënten met septische AKI;
I: continue RRT;
C: intermitterende RRT;
O: mortaliteit, herstel van nierfunctie, intensive-careverblijfsduur, ziekenhuisverblijfsduur, duur van RRT.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit en herstel van nierfunctie voor de besluitvorming cruciale uitkomstmaten; en intensive-careverblijfsduur, ziekenhuisverblijfsduur en duur van RRT voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde de grens van 3% als een klinisch (patiënt) relevant verschil voor mortaliteit (gebaseerd op de SDD-trial van de Smet, 2009), en 25% voor de overige dichotome uitkomstmaten. Voor verblijfsduur op de intensive care (IC), duur van RRT en RRT-vrije dagen werd 1 dag als klinisch relevant verschil gedefinieerd, voor ziekhuisverblijfsduur 2 dagen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 28 augustus 2019 met relevante zoektermen gezocht naar literatuur voor deelvraag 1, 2 en 3. Omdat er weinig literatuur beschikbaar is over RRT, is de populatie uit de PICO uitgebreid met ernstig zieke IC-patiënten. Wanneer voldoende studies beschikbaar waren om een deelvraag te beantwoorden in een sepsispopulatie, dan werden alleen sepsis studies geïncludeerd.
De literatuur-zoekactie leverde 521 treffers op. Op basis van titel en abstract werden voor deelvraag 1 op basis van titel en abstract 9 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 6 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 3 studies definitief geselecteerd.
Resultaten
In de literatuuranalyse van deelvraag 1 (RRT-modaliteit) zijn twee RCT’s en een systematische review van RCT’s opgenomen over continue versus intermitterende RRT bij ernstig zieke patiënten op de IC, waaronder patiënten met sepsis en septische shock.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Barbar SD, Clere-Jehl R, Bourredjem A, Hernu R, Montini F, Bruyère R, Lebert C, Bohé J, Badie J, Eraldi JP, Rigaud JP, Levy B, Siami S, Louis G, Bouadma L, Constantin JM, Mercier E, Klouche K, du Cheyron D, Piton G, Annane D, Jaber S, van der Linden T, Blasco G, Mira JP, Schwebel C, Chimot L, Guiot P, Nay MA, Meziani F, Helms J, Roger C, Louart B, Trusson R, Dargent A, Binquet C, Quenot JP; IDEAL-ICU Trial Investigators and the CRICS TRIGGERSEP Network. Timing of Renal-Replacement Therapy in Patients with Acute Kidney Injury and Sepsis. N Engl J Med. 2018 Oct 11;379(15):1431-1442. doi: 10.1056/NEJMoa1803213. PubMed PMID: 30304656.
- Bellomo R, Schneider AG. The real cost of conventional hemodialysis in critically ill patients*. Crit Care Med. 2014;42(4):990-991. doi:10.1097/CCM.0000000000000076.
- Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, Bagshaw SM, Glassford NJ, Lankadeva Y, Vaara ST, Schneider A. Acute kidney injury in sepsis. Intensive Care Med. 2017 Jun;43(6):816-828. doi: 10.1007/s00134-017-4755-7. Epub 2017 Mar 31. Review. PubMed PMID: 28364303.
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Gasparović V, Filipović-Grcić I, Merkler M, Pisl Z. Continuous renal replacement therapy (CRRT) or intermittent hemodialysis (IHD)--what is the procedure of choice in critically ill patients? Ren Fail. 2003 Sep;25(5):855-62. PubMed PMID: 14575293.
- Gaudry S, Hajage D, Schortgen F, Martin-Lefevre L, Verney C, Pons B, Boulet E, Boyer A, Chevrel G, Lerolle N, Carpentier D, de Prost N, Lautrette A, Bretagnol A, Mayaux J, Nseir S, Megarbane B, Thirion M, Forel JM, Maizel J, Yonis H, Markowicz P, Thiery G, Tubach F, Ricard JD, Dreyfuss D. Timing of Renal Support and Outcome of Septic Shock and Acute Respiratory Distress Syndrome. A Post Hoc Analysis of the AKIKI Randomized Clinical Trial. Am J Respir Crit Care Med. 2018 Jul 1;198(1):58-66. doi: 10.1164/rccm.201706-1255OC. PubMed PMID: 29351007.
- James, M. T., Tonelli, M., & Alberta Kidney Disease Network. Financial aspects of renal replacement therapy in acute kidney injury. In Seminars in dialysis 2011;24(2):215-219). Oxford, UK: Blackwell Publishing Ltd.
- James M, Bouchard J, Ho J, Klarenbach S, LaFrance JP, Rigatto C, Wald R, Zappitelli M, Pannu N. Canadian Society of Nephrology commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury. Am J Kidney Dis. 2013 May;61(5):673-85. doi: 10.1053/j.ajkd.2013.02.350. Epub 2013 Mar 19. PMID: 23518195.
- Lins RL, Elseviers MM, Van der Niepen P, Hoste E, Malbrain ML, Damas P, Devriendt J; SHARF investigators. Intermittent versus continuous renal replacement therapy for acute kidney injury patients admitted to the intensive care unit: results of a randomized clinical trial. Nephrol Dial Transplant. 2009 Feb;24(2):512-8. doi: 10.1093/ndt/gfn560. Epub 2008 Oct 14. PubMed PMID: 18854418.
- Rabindranath K, Adams J, Macleod AM, Muirhead N. Intermittent versus continuous renal replacement therapy for acute renal failure in adults. Cochrane Database Syst Rev. 2007 Jul 18;(3):CD003773. Review. PubMed PMID: 17636735.
- Schefold JC, von Haehling S, Pschowski R, Bender T, Berkmann C, Briegel S, Hasper D, Jörres A. The effect of continuous versus intermittent renal replacement therapy on the outcome of critically ill patients with acute renal failure (CONVINT): a prospective randomized controlled trial. Crit Care. 2014 Jan 10;18(1):R11. doi: 10.1186/cc13188. PubMed PMID: 24405734; PubMed Central PMCID: PMC4056033.
- Uehlinger DE, Jakob SM, Ferrari P, Eichelberger M, Huynh-Do U, Marti HP, Mohaupt MG, Vogt B, Rothen HU, Regli B, Takala J, Frey FJ. Comparison of continuous and intermittent renal replacement therapy for acute renal failure. Nephrol Dial Transplant. 2005 Aug;20(8):1630-7. Epub 2005 May 10. PubMed PMID: 15886217.
- Vinsonneau C, Camus C, Combes A, Costa de Beauregard MA, Klouche K, Boulain T, Pallot JL, Chiche JD, Taupin P, Landais P, Dhainaut JF; Hemodiafe Study Group. Continuous venovenous haemodiafiltration versus intermittent haemodialysis for acute renal failure in patients with multiple-organ dysfunction syndrome: a multicentre randomised trial. Lancet. 2006 Jul 29;368(9533):379-85. PubMed PMID: 16876666.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question 1: What is the optimal modality of renal replacement therapy in patients with septic AKI?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Rabindranath, 2007 |
SR and meta-analysis of RCTs
Literature search up to October, 2006
A: Augustine, 2004 B: Gasparovic, 2003 C: Mehta, 2001 D: Noble, 2006 E: Uehlinger, 2005 F: Visonneau, 2006 G: John, 2001
Study design: RCT
Setting and Country: A: University teaching hospital, USA B: University hospital, Croatia C: Multicentre trial, USA D: University teaching hospital, UK E: ICU in the University Hospital of Berne, Switzerland F: Multicentre, France G: University teaching hospital, Germany
Source of funding and conflicts of interest: Funding not reported. No potential conflict of interest to declare. |
Inclusion criteria SR: Randomised controlled trials (RCTs - either parallel or crossover design) in which patients have been allocated to treatment with IRRT or CRRT for ARF and reporting outcomes of interest to this review; All adult patients (≥ 18 years) requiring RRT for ARF were considered eligible for inclusion. It was planned that if there are sufficient number of studies subgroup analysis according to varying degrees of comorbidity will also be undertaken.
Exclusion criteria SR: RCTs in which allocation to treatment was obtained by alternation, use of alternate medical records, date of birth or other predictable methods; studies of peritoneal dialysis were not considered in this review.
7 studies published after 2000 were included in the analysis
Population: N total, CRRT, IRRT A: 80, 40, 40 B: 104, 52, 52 C: 166, 84, 82 D: 94, 54, 40 E: 129, 70, 55 F: 360, 176, 184 G: 30, 20, 10
Participants A: age 61y, 68% male, surgery 65% B: Sepsis 77%, mean APACHE II 20.9, mean SOFA 10.4 C: Age 55y, 65% male, APACHE II 24, APACHE III 92, surgery 27%. D: Age 53y, 75% male, surgical 49%, sepsis 58%. E: Age 67y, 67% male, sepsis 47%, SAPS score 55. F: Age 65y, 73% male, SAPS II score 64.5, 62% sepsis. G: All patients had septic shock; age 62y, 87% male, APACHE II 33.5. |
CRRT was defined as any form of RRT (HD, HF, HDF, UF) that was intended to run on a continuous basis until recovery of renal function occurred.
A: CVVHD; Low-flux polysulfone membrane; Blood flow rate: 200 mL/min; Dialysate flow varied according to dry weight; Bicarbonate dialysate: 35 mEq/L; Anticoagulation: Heparin; Dose adjusted to achieve weekly Kt/V of 3.6. B: CVVHF; First 33 patients had low volume HF (18 mL/kg/h) and the next had high volume HF (35 mL/kg/h); using polysulfone membrane. C: CAVHDF in the first two years followed by CVVHDF in the following years; Polysulfone or polyacrylonitrile membranes; Blood flow: 100 mL/min; Dialysate flow rate: 16.7 mL/min; Ultrafiltration rate: 400-800 mL/h; Anticoagulation: Heparin, citrate or saline flushes; At least 25 hours treatment was considered necessary as satisfactory intervention period. D: CHD via a Scribner shunt or venous dialysis catheter; Bicarbonate dialysate; Blood flow: 150 mL/min; Dialysate flow:300-500 mL/min; Dialysis membranes: Fresenius polysulfone. E: CVVHDF; Membrane: AN69 high-flux hemofilter; Blood flow: 100-180 mL/min; Standard lactate-buffered fluid was used as dialysate and a substitute at a combined rate of 2000 mL/h; Fluids given in a predilution fashion. F: CVVHDF; Blood flow: >/= 120 mL/min; Dialysate flow: >/= 500 mL/h; Ultrafiltration flow> >/= 1000 mL/h; Membrane: Polyacrylonitrile. G: CVVHF; High-flux polysulfone membranes Fluid removal was between 1.2-1.8 L/24 h; Vasopressor support increased during RRT to maintain MAP not lower than 20% of baseline; Blood flow: 250 mL/min; Ultrafiltration rate: 2 L/h; Fluids rewarmed to 37C and infused post-dilutionally. |
IRRT was defined as any form of RRT (haemodialysis (HD), haemofiltration (HF), haemodiafiltration (HDF), isolated ultrafiltration (UF)) prescribed for a period of < 24 hours within any 24 hour period.
A: IHD 3 times/week; Low-flux polysulfone; Blood flow rate: 300 mL/min; Dialysate flow: 500 mL/min; Duration of HD varied to achieve weekly Kt/V of 3.6. B: IHD; 3-4 hour treatments; Blood flow: 200-250 mL/min; Dialysate flow: 500 mL/min; Membrane: polysulfone, most frequently without heparin. C: IHD using bicarbonate dialysate; Dialysate flow rate: 500 mL/min; Blood flow rate: 200-300 mL/min; Both cellulose and synthetic membranes were used; At least 2 sessions of at least 3 hours each was necessary for considering as successful intervention. D: IHD; Cuprophane membranes for 4 h/d every day E: IHD; Membrane: Polysulfone; Blood flow: 150-300 mL/min; Bicarbonate buffered dialysate was used; Ultrafiltration rate: 250-1000 mL/h; Usual HD session lasted for 3-4 hours. F: Blood flow: >/= 250 mL/min; Dialysate flow: 500 mL/min; To achieve optimum haemodynamic stability a high sodium concentration (150 mmol/L) dialysate at a low temperature (35°C) was used; Therapy was started simultaneously connecting to the catheter both lines of the circuit filled with 0·9% saline (isovolemic connection), be applied for at least 4 h, and be given every 48 h if anuria or oliguria were present. In other cases, the frequency was defined to maintain a urea concentration of less than 40 mmol/L; Membrane: Polyacrylonitrile. G: IHD; Low-flux polysulfone membranes for 4 hours; Fluid removal was between 1.2-1.8 L/24 h; Vasopressor support increased during RRT to maintain MAP not lower than 20% of baseline; Blood flow: 250 mL/min; Bicarbonate-based dialysate. |
End-point of follow-up: A: death or hospital discharge B: 21 days C: death or hospital discharge D: death or hospital discharge E: death or hospital discharge F: 90 days G: 24 hours
For how many participants were no complete outcome data available? A: 0/80 B: 0/104 C: 0/166 D: 0/94 E: 0/129 F: 0/360 G: 0/30
|
In-hospital mortality A: CRRT 27/40; IRRT 28/40 B: CRRT 37/52; IRRT 31/52 C: CRRT 55/84; IRRT 39/82 D: CRRT 43/54; IRRT 34/40 E: CRRT 33/70; IRRT 28/55 F: CRRT 118/176; IRRT 126/184 Pooled RR (random effects model): 1.03 (95% CI 0.92, 1.16) Heterogeneity (I2): 33%
ICU mortality G: CRRT 14/20; IRRT 7/10 C: CRRT 50/84; IRRT 34/82 D: CRRT 43/54; IRRT 34/40 E: CRRT 24/70; IRRT 21/55 Pooled RR (random effects model): 1.06 (95% CI 0.83, 1.35) Heterogeneity (I2): 53%
Recovery of renal function A: CRRT 5/13; IRRT 4/12 C: CRRT 25/29; IRRT 40/43 E: CRRT 36/37; IRRT 26/27 Pooled RR (random effects model): 0.99 (95% CI 0.92, 1.07) Heterogeneity (I2): 0%
Length of ICU stay Mean±SD, in days A: CRRT 35.8±20.5, n=13; IRRT 41.9±30.1, n=12 |
John (2001) is the only study a septic shock population. Due to the limited population size, analysis is extended to ICU/critically ill population.
Studies that completed patient inclusion before 2000 were excluded from the literature analysis. |
Evidence tables for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question 1: What is the optimal modality of renal replacement therapy in patients with septic shock and acute renal failure?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Lins, 2008
(SHARF4, NCT 00322933) |
Type of study: RCT
Setting and country: Belgian multicentre trial in hospitals with at least 600 beds, a centre for the treatment of endstage kidney disease patients, a multipurpose ICU with at least 12 beds, at least 30 patients with AKI treated with RRT during the past year and regular use of both intermittent and continuous techniques.
Funding and conflicts of interest: Sources of funding not specified. The authors declare no conflict of interest. |
Inclusion criteria: Adult AKI patients with a serum creatinine >2 mg/dL (177 µmol/L) that were consecutively admitted in the participating centres, with the need for RRT, as decided by the attending physician.
Exclusion criteria: Pre-existing chronic renal disease, defined as a serum creatinine >1.5 mg/dL (133 µmol/L) or with the clearly reduced kidney size on ultrasound.
N total at baseline: IRRT: 144 CRRT: 172
Age (range): IRRT: 67 (20-96) CRRT: 65 (18-89)
Sex (% male): IRRT: 58 CRRT: 60
APACHE II: IRRT: 27.1±11.5 CRRT: 26.3±11.2
SOFA 0: IRRT:10.8±3.4 CRRT: 10.7±3.4
Groups were comparable at baseline |
For IRRT, a central venous access, a biocompatible membrane (polysulfone or AN 69) and bicarbonate dialysate were used. Daily dialysis was performed during 4–6 h per session with a blood flow of 100–300 mL/min and a dialysate flow of 300–500 mL/min. |
For CRRT, a central venous access, a biocompatible membrane (polysulfone or AN 69) and post-dilution continuous veno-venous haemofiltration (CVVH) were used. It was continued during 24 h/day with a blood flow rate of 100–250 mL/min, an ultrafiltration rate of 1–2 L/h and either lactate or bicarbonate solutions were used.
For both modalities, anticoagulation was performed according to the centre practice, either with unfractionated heparin, low molecular weight heparin or citrate.
Treatment continued daily during at least 3 consecutive days. Thereafter treatment could be continued according to the needs of the patients. |
Length of follow-up: Death or hospital discharge.
Loss-to-follow-up: None
Incomplete outcome data: Not reported |
Hospital mortality IRRT 62.5% CRRT 58.1% P=0.430
Renal recovery CKD stage 1-2 IRRT 29.8% CRRT 28.8%
CKD stage 3 IRRT 29.8% CRRT 28.8%
CKD stage 4 IRRT 14.9% CRRT 25.5%
CKD stage 5 IRRT 25.5% CRRT 16.9% P=0.474
Hospital length of stay IRRT 31.4±29.7 CRRT 36.8±31.0 P=0.345
ICU length of stay IRRT 17.2±18.7 CRRT 18.7±19.0 P=0.510 |
205 (65%) patients sepsis In deze groep mortaliteit 70,5% IRRT en 64% CRRT
Underpowered: Recruitment of patients ended before the required sample size was reached. (407 patients per treatment group according to power calculation)
Of the 650 eligle patients 124 patients (37%) were excluded for medical reasons (coagulation disturbances and haemodynamic instability)
Cross-over during first 3 days: from IRRT to CRRT in 11 patients because of haemodynamic instability. Cross-over from CRRT to IRRT in 12 patients because of coagulation problems
No information on delivered dose and cumulative fluidbalance |
|
Schefold, 2014
(CONVINT trial) |
Type of study: RCT
Setting and country: Single center, university hospital Berlin, Germany.
Funding and conflicts of interest: The authors declare that they have no conflict of interest, financially or otherwise, to disclose. |
Inclusion criteria: Adult patients with AKI requiring RRT treated at the medical intensive care units. Need for RRT was defined as presence of at least one of the following criteria: (a) clinical symptoms of uremia; (b) persisting oliguria or anuria despite adequate fluid management; (c) fluid overload not responding to diuretic treatment; (d) blood urea nitrogen (BUN) levels >100 mg/dl (35 mmol/L) or creatinine clearance <0.1 ml/ kg of body weight/min; (e) severe metabolic acidosis (pH <7.2) not responding to conventional treatment; and (f) hyperkalemia not responding to conservative treatment.
Exclusion criteria: (a) preexisting chronic renal failure with serum creatinine >3 mg/dl (265 µmol/L) or patients receiving chronic dialysis; (b) kidney-transplant recipients; (c) patients not requiring ICU treatment; (d) denial of written informed consent.
N total at baseline: Intervention: 128 Control: 122
Age mean ± SD: I: 60.8±13.4 C: 62.3±14.5
Sex (% male): I: 63 C: 62
APACHE II I: 28.5±7.9 C: 28.8±9.6
SAPS II I: 66.1±18.1 C: 63.8±17.6
SOFA: I: 13.2±3.9 C: 13.0±4.0
Sepsis-induced ARF: I: 66.4% C: 69.7%
Groups were comparable at baseline |
Standard treatment dose was daily IHD with 4 hours of hemodialysis at a blood flow of 200 to 250 ml/min. A dialysate flow at 500 ml/min, volumetric UF-control, water purified by reverse osmosis, and bicarbonate dialysate was used. |
Postdilutional CVVH (BM11/BM14; Baxter Medical, Deerfield, IL, USA, or Multifiltrate, Fresenius Medical Care, Bad Homburg, Germany) was applied 24 hours daily by using a polysulfone synthetic membrane, blood flow of 200 ml/min, prescribed filtration rate of 35 ml/ kg of body weight/hour, by using bicarbonate-buffered substitution fluids.
General treatment target in both groups was absence of any criteria for acute RRT and a target-time-averaged serum urea of 100 to 150 mg/dl every 72 hours (mean pre + post + pre in IHD; not intended as an outcome measure).
CVVH membranes were exchanged every 24 hours in patients with severe sepsis/septic shock. In all other patients, membranes were exchanged every 48 hours. |
Length of follow-up: Death or hospital discharge
Loss-to-follow-up: None reported
Incomplete outcome data: Not reported |
Hospital mortality IHD 60.3% CVVH 54.6% P=0.72
14-day mortality IHD 43.6% CVVH 37.8% P=0.63
30-day mortality IHD 52.4% CVVH 45.4% P=0.60
Renal recovery (60 days) IHD 73.6% CVVH 77.2% P=0.90
Hospital length of stay (days) IHD 33.9±49.3 CVVH 32.4±37.4 P=0.79
ICU length of stay (days) IHD 25.2±40.1 CVVH 22.3±26.1 P=0.50
Duration of RRT (days) IHD 17.2±37.1 CVVH 13.7±17.9 P=0.35
Dialysis free days IHD: 4.2 ± 9.6 CVVH: 3.1 ± 9.0 P=0.38
Number of patients on RRT (% of survivors) at day 21 IHD: 20 (32.3%) CVVH: 20 (29.9%) P=0.97
At day 60 IHD: 14 (26.4%) CVVH: 13 (22.8%) P=0.90 |
Underpowered: power calculation 200 patients per arm. Sample size 125 patients per arm
Major reasons for development of AKI was severe sepsis/septic shock (both groups > 65% of study patients at baseline)
Crossover: From IHD to CVVH 25 (19,5%) for hemodynamic instability and/or significant fluid overload From CVVH to IHD 56 (45,9%) for repeated filter clotting, metabolic reasons, coagulation disbalance, desired mobilization of study patient. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question 1: What is the optimal modality of renal replacement therapy in patients with septic shock and acute renal failure?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Rabindrabath, 2007 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question 1: What is the optimal modality of renal replacement therapy in patients with septic shock and acute renal failure?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Lins, 2008 |
Separately for each participating centre, the choice of RRT treatment modality was randomized within each stratum of the SHARF score. Stratified block randomization was achieved within the electronic case report form(CRF) using a computer-generated sequence of random numbers. If the investigator decided not to randomize, the program was electronically blocked until he completed the reason for non-randomization. |
Unclear |
unlikely |
Likely
Not blinded. |
unclear |
unlikely |
unlikely |
unlikely |
|
Schefold, 2014 |
Patients were allocated to the respective study groups at study day 0 (day of randomization; 1). To assure concealment of allocation, an independent external telephone (computer-based) randomization procedure provided by the Department of Biometry and Medical Documentation, University of Ulm, Ulm, Germany, was used (permutated blocks of four). |
Unclear |
unlikely |
Likely
Not blinded. |
unclear |
unlikely |
unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://classic.clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
