B2. Gonorroe
Aanbeveling
Zie onderbouwing en samenvattingskaart (link)
Onderbouwing
Achtergrond
B2.1 Algemeen
Gonorroe is een seksueel overdraagbare aandoening (soa) en wordt soms ook wel druiper genoemd. De verwekker Neisseria gonorrhoeae (Ng) ofwel de gonokok werd in 1879 aangetoond door Neisser en in 1882 voor het eerst gekweekt door Leistikov. Voor de komst van antibiotica was deze soa slecht te behandelen. Aanvankelijk waren de gonokokken gevoelig voor vele antibiotica. Langzamerhand ontstond toenemende hoge resistentie door chromosomale mutaties en plasmiden met resistentiegenen.
Samenvatting literatuur
B2.2 Ziekte
B2.2.1 Verwekker
De bacterie Ng is een gramnegatieve, nietbeweeglijke en nietsporenvormende diplokok. In Nederland varieerde de resistentie tegen penicilline de afgelopen jaren tussen de 10 en 20% (onder andere wegens penicillinasevormende gonokokkenstammen) (Van den Broek, 2016). Resistentie tegen tetracyclines en chinolonen was hoger en lag boven de 30%. Resistentie tegen derde generatie cefalosporines is nog zeldzaam, al zijn in diverse landen al patiënten met klinisch resistente derde generatie cefalosporines beschreven (De Vries, 2009; Monfort, 2009; Koedijk, 2010; Ison 2010; Unemo, 2010; Unemo, 2011; Unemo, 2012). De afgelopen jaren zijn er echter, behalve sporadische infecties met dergelijke resistente Ng, geen meldingen geweest van uitbraken of verdere verspreiding. In Nederland zijn nog geen goed gedocumenteerde stammen met resistentie tegen ceftriaxon gekweekt. Desalniettemin bestaat er een reëel risico dat in de toekomst ook deze groep antibiotica niet meer als eerste keus kan worden ingezet.
B2.2.2 Pathogenese
Gonokokken invaderen de epitheelcellen van slijmvliezen waarmee ze in contact komen. De pili van de gonokok bewerkstelligen aanhechting aan slijmvliezen van de tractus urogenitalis (vaak urethra of cervixslijmvlies) gevolgd door opname van gonokokken in deze epitheelcellen.
Gonokokken vermenigvuldigen zich vervolgens intracellulair. Na ongeveer 2 à 3 dagen komen de bacteriën vrij in de submucosale weefsels. Op de plaats van de infectie verzamelen zich polymorfonucleaire granulocyten. Dit kan leiden tot kleine abcessen in de submucosa, met exsudaat en pusvorming. In sommige gevallen kan de bacterie zich direct of via de bloedbaan verplaatsen naar andere delen van het lichaam en aldus complicaties veroorzaken.
B2.2.3 Incubatieperiode
De incubatieperiode duurt doorgaans 2 dagen tot 3 weken (gemiddeld 5 dagen) (Korenromp, 2002). Na transmissie ontstaan bij mannen klinische symptomen van urogenitale gonorroe, bij 95% binnen 21 dagen. De langst beschreven incubatietijd bedroeg 57 dagen (Sherrard, 1996). Bij vrouwen bestaan hier geen gegevens over; wel is beschreven dat geïnfecteerde vrouwen 180 dagen na een risicocontact asymptomatisch bleven (Nielsen, 1975). Bij een groot deel (3060%) van vrouwen met urogenitale gonorroe en bij de meerderheid van orofaryngeale en rectale gonorroe (7090%) blijft de infectie asymptomatisch (Morris, 2006).
B2.2.4 Ziekteverschijnselen
Bij de vrouw
Bij 3060% van de vrouwen met urogenitale gonorroe treden nauwelijks of geen klachten op. Als er bij de vrouw klachten optreden, gaat het meestal om een toegenomen hoeveelheid vaginale afscheiding. Andere verschijnselen zijn tussentijds bloedverlies, pijn en branderigheid bij het plassen (dysurie). Complicaties bij de vrouw zijn bartholinitis en PID.
PID is de meest voorkomende complicatie van onbehandelde urogenitale gonorroe. PID is een verzamelnaam van infecties in het kleine bekken, zoals endometritis, salpingitis, tubaovarieel abces en zelfs peritonitis (zie module A4). Het is niet bekend hoe vaak een PID voorkomt na een onbehandelde gonorroe. Salpingitis komt voor bij ongeveer 10% van de vrouwen met een onbehandelde gonorroe. Vrouwen met een PID kunnen klagen over pijn in de onderbuik, abnormale vaginale afscheiding, koorts en onregelmatige menstruaties. PID bij gonorroe kan ook symptoomloos verlopen en in een aantal gevallen op langere termijn leiden tot complicaties als verminderde vruchtbaarheid en buitenbaarmoederlijke zwangerschappen.
In Nederland wordt tegenwoordig het merendeel van de PID veroorzaakt door Chlamydia trachomatis (Ct) en/of door een combinatie van aerobe en anaerobe bacteriën. Recent onderzoek in Australië liet zien dat slechts 2% van de PIDdiagnoses geassocieerd was met gonorroe (en 14% met Ct) (Goller, 2016).
Bij de man
Bij de man staat urethritis op de voorgrond. Urethritisklachten ontstaan meestal binnen enkele dagen na de transmissie. De klachten bestaan uit een branderig gevoel, pijn bij het plassen en een veelal pussende afscheiding, die gering maar ook heel hevig kan zijn (‘druiper’).
Complicaties bij de man zijn epididymitis, prostatitis en (bij chronische urethrale infectie) urethrale stricturen. Bij de man verloopt circa 10% van de urogenitale infecties asymptomatisch (Jungmann, 2004; Kent, 2005), maar bij rectale infecties kan dit oplopen tot 85% (Kent, 2005).
Middels onder andere (auto)inoculatie kan gonorroe een acute conjunctivitis veroorzaken met purulente uitvloed, pseudomembranen en gezwollen lymfeklieren. Onbehandeld kan het snel een keratitis tot gevolg hebben soms gevolgd door een corneaperforatie.
Bij neonaten
Bij neonaten kan een conjunctivitis ontstaan door besmetting met gonokokken tijdens passage door het geboortekanaal. Deze ontstaat sneller dan een infectie met Chlamydia trachomatis, meestal 3 dagen na de geboorte. Ook hier is onbehandeld het beeld snel progressief tot een keratitis met ulcus en perforatie tot gevolg.
Bij man en vrouw
Anale en faryngeale infecties kunnen zowel bij mannens als bij vrouwen voorkomen. Symptomen van anale infectie zijn irritatie, jeuk en soms slijmerige afscheiding. Bij infectie van de keel is meestal sprake van geen of weinig uitgesproken klachten (Morris, 2006). Soms is er sprake van purulente faryngitis (Wiesner, 1973).
Zowel bij de man als bij de vrouw komt het een enkele keer voor dat gonokokken in de bloedbaan terecht komen (bacteriëmie) en een gegeneraliseerde infectie veroorzaken. De gonokokken kunnen dan op andere plaatsen in het lichaam terecht komen en daar een ontsteking veroorzaken. Voorbeelden hiervan zijn een septische artritis, een zeer pijnlijke (meestal verspringende) polyartralgie in de extremiteiten, sepsis, endocarditis of meningitis.
Een andere ernstige, maar zeldzame complicatie van gonorroe is perihepatitis (syndroom van FitzHughCurtis), een ontsteking van het leverkapsel die voornamelijk bij vrouwen voorkomt. Deze complicatie gaat gepaard met pijn in de rechterbovenbuik, koorts en verhoogde leverenzymen in het bloed.
B2.2.5 Immuniteit
Een eerder doorgemaakte infectie met Nginfectie resulteert niet in bescherming tegen herinfectie. Lokale antistoffen tegen Ng zijn wel gevonden in het slijmvliesepitheel, waardoor aanhechting van gonokokken mogelijk wordt verhinderd, maar de antistoffen verdwijnen zodra de infectie is verdwenen. Systemische antistoffen worden ook gevonden, maar deze blijken niet of slechts tijdelijk en partieel tegen herinfectie te beschermen. Infecties met gonokokken zijn doorgaans lokaal, maar sommige stammen kunnen een gegeneraliseerde infectie veroorzaken. Ook deze gegeneraliseerde infecties resulteren niet in blijvende bescherming en immuniteit.
B2.3 Besmetting
B2.3.1 Reservoir
Alleen de mens.
B2.3.2 Besmettingsweg
Besmetting vindt plaats via seksueel contact waarbij slijmvliezen met elkaar in aanraking komen. De belangrijkste verspreidingsweg is genitaal contact, te weten penisvagina (genitogenitaal contact) en penisanus (genitoanaal contact). De besmetting kan zowel via insertief als receptief contact plaatsvinden. Anale infectie met gonorroe kan ook ontstaan door geïnfecteerde genitale secreta en hoeft niet altijd door anale seks te worden veroorzaakt. Ook is de verspreiding via de handen (bij vingeren en aftrekken) mogelijk. Bij orogenitaal contact is eveneens transmissie mogelijk. Daarnaast is infectie van de ogen door contact met infectieuze genitale secreta ook mogelijk.
Een tweede besmettingsweg is van moeder op kind. Tijdens de vaginale baring kan het kind worden geïnfecteerd. Meestal gaat het dan om een conjunctivitis gonorrhoïca.
Ng infecteert in de meeste gevallen eerst het epitheel van de tractus urogenitalis. Primaire infectie van het rectum, de keel en, bij perinatale transmissie, de ogen van de pasgeborene komt minder frequent voor. Bij volwassenen kan ook door overbrenging via bijvoorbeeld de vingers conjunctivitis ontstaan.
B2.3.3 Besmettelijke periode
Gonorroe is tijdens de incubatietijd al besmettelijk (zie paragraaf B2.2.3). De besmettelijkheid is voorbij 24 uur na het einde van behandeling met antibiotica waarvoor de stam gevoelig is.
Het is onduidelijk of de mate van besmettelijkheid bij een asymptomatische infectie anders is dan bij een infectie waarbij zich wel klachten voordoen.
B2.3.4 Besmettelijkheid
De transmissiekans is afhankelijk van de plaats van infectie en van het aantal seksuele contacten, maar is bij gonorroe over het algemeen hoog (Lycke, 1980).
Het transmissierisico bij eenmalig onbeschermd vaginaal seksueel contact is met behulp van een model geschat op 20% van vrouw naar man en op 50% van man naar vrouw. Voor MSM werd het risico van urethraal naar rectaal op 80% geschat, van urethraal naar farynx op 60%. Van rectaal naar urethra werd uitgegaan van 2% risico, van farynx naar urethra 8% (Hui, 2015). Bij meer seksuele contacten met dezelfde partner zullen deze kansen toenemen tot ongeveer 50% bij vrouw naar man en 90% bij man naar vrouw.
Buiten het lichaam is de bacterie slechts kort levensvatbaar, onder andere door de grote gevoeligheid voor uitdroging. Dit is van belang bij het transport van voor kweek aangeboden materialen.
B2.4 Diagnostiek
B2.4.1 Klinische diagnostiek
Zie paragraaf B2.2.4.
B2.4.2 Microbiologische diagnostiek
- Nucleïnezuuramplificatietest (NAAT)
- Kweek (plus resistentiebepaling)
- Eswab als afnamemethode
- Grampreparaat of methyleenblauwkleuring (alleen bij mannen, sneldiagnostiek).
NAAT van de eerstestraals urine is de eerste keus om urogenitale gonorroe bij mannen uit te sluiten. Als alternatief kan gekozen worden voor NAAT van een urethrauitstrijk. De tweede keus is een kweek van de urethra. Bij MSM dient routinematig op 3 locaties getest te worden (urethra, orofarynx en rectaal).
Bij vrouwen is de eerste keus NAAT van hetzij materiaal van de cervix plus de urethra (swab door onderzoeker) hetzij van materiaal diepvaginaal door de patiënte zelf afgenomen (zelfswab) (Hoebe, 2006). De zelfswab heeft de voorkeur, vanwege de patiëntvriendelijkheid. In een vergelijking bleek dat de sensitiviteit van de NAAT op materiaal van de diepvaginaal afgenomen wattenstok voor Ng 100% was, terwijl die van de endocervixswab 95% bedroeg (Fang, 2008). Schachter et al. vinden bij gebruik van een aptima assay een sensitiviteit van 96% bij beide materialen (Schachter, 2005). De mogelijk tweede keus bij vrouwen is een kweek of een NAAT van eerstestraals urine. Bij vrouwen wordt diagnostiek op eerstestraals urine echter als minder sensitief beschouwd en daarom ontraden (Bignell, 2011; Cook, 2005). Bij zwangeren met verdenking op gonorroe en bij patiënten met PID dient altijd materiaal afgenomen te worden voor een NAAT (bij voorkeur diepvaginaal).
Bij anamnestische blootstelling (passief anale en/of orale seks) en/of klachten wordt zowel bij mannen als bij vrouwen een uitstrijk van keel en/of proctum en/of conjunctiva voor NAAT afgenomen (Moncada, 2009). De tweede keus is een kweek.
De sensitiviteit van de NAAT is hoger dan van de kweek, waarbij het wel uitmaakt welke NAAT op welk materiaal wordt gebruikt (Luyt, 2005; Schachter, 2008). De specificiteit van de huidige generatie NAAT ligt bij urogenitale monsters hoog en benadert voor sommige NAATtesten de 100% (Masek, 2009; Maze, 2011). Bij aanhoudende klachten na behandeling is het opnieuw afnemen van een NAAT in de eerste 3 weken na behandeling niet zinvol, omdat met name DNA nog steeds aanwezig kan zijn, zonder dat dit uitsluitsel geeft over al dan niet persisteren van de infectie. Voor specifieke NAATtesten kan dit afwijken; raadpleeg hiervoor eventueel de artsmicrobioloog van het laboratorium.
Commerciële NAATtesten zijn doorgaans gevalideerd voor urogenitale materialen. Wanneer deze testen door laboratoria ook voor diagnostiek op proctum en keeluitstrijken gebruikt worden, is het de verantwoordelijkheid van het uitvoerend laboratorium om te valideren of een confirmatietest na een uitgevoerde NAAT nog noodzakelijk is. Schachter et al. (2008) beschrijven een specificiteit van de Strand Displacement Assay (BD) en de Aptima Combo 2 (Genprobe) voor deze materialen van meer dan 99%. Maar ook bij een specificiteit van meer dan 99% kunnen toch foutpositieve resultaten voorkomen (afhankelijk van de in het laboratorium gebruikte NAAT). Bij een lage a priori kans en grote consequenties van een positief testresultaat (bijvoorbeeld bij verdenking op seksueel misbruik bij kinderen) kan een confirmatietest toch zeer wenselijk zijn.
Een kweek op Ng met resistentiebepaling dient in elk geval te worden verricht bij aanhoudende klachten na behandeling. In het licht van de toenemende frequentie van voor derde generatie cefalosporine verminderd gevoelige Ngstammen (zie paragraaf B2.6.2) verdient het aanbeveling om bij elke patiënt met door NAAT aangetoonde gonorroe ook te kweken voor resistentiebepaling. Dit geldt met name voor hoogrisicopatiënten, zoals MSM, swingers, sekswerkers, klanten van sekswerkers en heteroseksuelen met wisselende partners. In Nederland bestaat een continue landelijke resistentiesurveillance onder het acroniem GRAS (gonokokkenresistentie tegen antibioticasurveillance). Ruim 80% van de soacentra participeerde in 2015 in een GRASsurveillance. Hoewel het aantal gonorroediagnoses in de soacentra de afgelopen jaren is gestegen tot bijna 5400 in 2015, is het aantal infecties met een resistentiepatroon stabiel gebleven op circa 1500 diagnoses per jaar, minder dan 30% van alle gediagnosticeerde gonorroe (Van den Broek, 2016). Optimaal is dat het afgenomen materiaal bij 4 °C getransporteerd en bewaard wordt in een medium speciaal voor het vervoer van gonokokken bij voorkeur binnen 24 uur in het microbiologisch laboratorium wordt verwerkt, omdat bij langere transporttijden de gevoeligheid van de kweek drastisch afneemt (Wind, 2015). Bij aanhoudende klachten na behandeling is het opnieuw afnemen van een NAAT in de eerste 3 weken na behandeling niet zinvol, omdat met name DNA nog steeds aanwezig kan zijn zonder dat dit uitsluitsel geeft over al dan niet persisteren van de infectie. Voor specifieke NAATtesten kan dit afwijken; raadpleeg hiervoor eventueel de artsmicrobioloog van het laboratorium. Indien de transporttijd naar het laboratorium langer is dan 6 uur kan ook naast materiaal voor NAAT een extra wattenstok afgenomen worden en verzonden worden in eswabmedium. Het is ook mogelijk een eswab in vers geloosde urine te dopen en daarna in eswabmedium te transporteren. Afhankelijk van transporttijd (24 of 48 uur) en materiaal (urines betere resultaten dan rectale en cervicale uitstrijken) is de sensitiviteit van een binnen 48 uur ingezette kweek nog 5090% (Wind, 2015). Hiermee is er geen rationale meer om geen kweek te verrichten bij alle symptomatische Ng en alle aangetoonde Ng bij een hoogrisicopatiënt die gezien worden bij de soacentra en in de 2e lijn en kan het afnemen van een kweek als standaard worden beschouwd.
Het is ook mogelijk een eswab af te nemen en een deel van het materiaal te testen in een NAAT en, indien positief, ook te kweken. Deze methode is niet voor alle NAATtesten gevalideerd en de gevoeligheid van deze methode kan lager zijn dan bij gebruik van het door de fabrikant geleverde afnamemedium (Wind, 2015).
Grampreparaat of methyleenblauwkleuring van urine of urethraswab bij mannen met urethraal ecoulement toont intracellulaire (gramnegatieve) diplokokken in neutrofiele granulocyten en heeft in dergelijke gevallen een goede sensitiviteit. Bij vrouwen daarentegen heeft het directe preparaat van cervicale of vaginale materialen een geringe sensitiviteit en specificiteit voor de diagnostiek van gonorroe. Het gebruik ervan wordt daarom afgeraden bij vrouwen. Ook bij anale secreten hebben gram en methyleenblauwpreparaten een geringe sensitiviteit en specificiteit.
Bij gedissemineerde gonorroe is kweek en/of NAAT van pustels, bloed, synoviale vloeistof of liquor geïndiceerd.
Wanneer men bij een persoon gonorroe wil uitsluiten na een risicocontact, moet men rekening houden met de incubatietijd; in deze windowperiode is een valsnegatieve uitslag mogelijk. Het is onbekend of na een contact de NAAT voor Ng al positief wordt voordat er klachten ontstaan. Een andere vraag is hoe lang gonorroe asymptomatisch kan persisteren met positieve testen. Voor de praktijk geldt: wanneer het risicocontact langer geleden is en de persoon nog geen klachten heeft, is het zinvol om tot 2 maanden na dit contact te testen op asymptomatische urogenitale gonorroe bij mannen en tot 6 maanden na het risicocontact op asymptomatische urogenitale gonorroe bij vrouwen en op orofaryngeale en rectale gonorroe.
Serologische bepalingen bij de diagnostiek van een infectie met Ng zijn niet zinvol.
Er zijn (onder andere via internet) ook commerciële zelf/sneltesten beschikbaar die thuis kunnen worden afgenomen en dan óf naar een erkend laboratorium moeten worden gestuurd voor diagnostiek (thuisafnametesten) óf direct thuis kunnen worden afgelezen (zelftesten). De betrouwbaarheid hiervan is vooralsnog onvoldoende gevalideerd. Soa Aids Nederland werkt aan een publiek toegankelijke testwijzer waarbij zowel soathuisafnametesten als soazelftesten tegen een vaste set criteria worden getoetst.
B2.4.3 Overige diagnostiek
Er zijn geen andere zinvolle testen behulpzaam bij het stellen van de diagnose.
B2.5 Risicogroepen
B2.5.1 Verhoogde kans op infectie
Risicogroepen zijn personen met wisselende onbeschermde seksuele contacten, mannen die seks hebben met mannen (MSM), migranten, sekswerkers en klanten van sekswerkers.
B2.5.2 Verhoogde kans op ernstig beloop
Bij instrumentele intrauteriene ingrepen, waarbij de cervixbarrière wordt doorbroken (abortus, plaatsing van een spiraaltje), is het risico verhoogd op het opstijgen van een cervicale Nginfectie en complicaties. Infectie tijdens de zwangerschap kan resulteren in een septische abortus, chorioamnionitis, te vroeg gebroken vliezen en postpartumendometritis.
B2.6 Epidemiologie
B2.6.1 Verspreiding in de wereld
Van de jaarlijks 357 miljoen nieuwgevonden soainfecties betreffen 87 miljoen gevallen van gonorroe (WHO, 2016). In 2013 werden in Europa 53.000 infecties gerapporteerd aan ECDC (waarvan 60% door het Verenigd Koninkrijk waar gonorroe meldingsplichtig is). Gonorroe werd in Europa 3 keer zo vaak bij mannen gediagnosticeerd. Bijna de helft van alle Europese infecties werd bij MSM gevonden. Na een afname tot 2008 is het aantal nieuwe diagnoses tot 2013 met 79% gestegen. Die stijging hangt overigens ook deels samen met een toename van het aantal testen bij hoogrisicogroepen. De resistentie tegen cefixime in Europa blijft stabiel terwijl resistentie tegen ceftriaxon vooralsnog uiterst zeldzaam blijft. Het aantal ceftriaxonresistente isolaten in Europa was 10 in 2011, 3 in 2012, en 7 in 2013, op een jaarlijks getest aantal van rond de 2000 monsters (ECDC, 2015). Er is ook daarna geen toename meer van resistentie tegen ceftriaxon gemeld, maar de rapportage van latere jaren is nog niet definitief.
In de huidige CDC, BASHH en IUSTIrichtlijnen wordt als eerstelijns therapie een combinatie van ceftriaxon en azitromycine aanbevolen. Doordat circa 10% van alle gonokokken resistent is tegen azitromycine, is het niet verwonderlijk dat er regelmatig berichten zijn uit het buitenland van Ng die resistent zijn tegen een dergelijke eerstelijns behandeling, waarbij dan vrijwel steeds alleen gedoeld wordt op azitromycineresistentie; dubbelresistente stammen zijn nog nooit beschreven (Chisholm, 2016). In het Verenigd Koninkrijk is dit wel vastgesteld bij een heteroseksuele man na een reis naar Japan. In eerste instantie was gonorroe gevoelig voor azitromycine en ceftriaxon, maar na behandeling met 500 mg ceftriaxon en 1 gr azitromycine werd een dubbelresistente stam uit de farynx gekweekt. Klaring trad op na behandeling met een dubbele dosis van beide antibiotica (Fifer, 2015). Uit mathematische modellering blijkt dat bij reeds aanwezige resistentie tegen azitromycine (zoals in Nederland) het routinematig gaan voorschrijven van combinatietherapie het ontstaan van multidrugresistentie niet substantieel zal vertragen.
B2.6.2 Voorkomen in Nederland
Naast de 5400 gonorroeinfecties die inmiddels jaarlijks bij de soacentra worden opgespoord, worden elk jaar naar schatting ook nog eens 60007000 gonorroeinfecties door huisartsen gevonden (Van den Broek, 2016).
Van 1984 tot 1999 is in Nederland het aantal nieuwe gevallen van gonorroe sterk gedaald. Dit wordt wel in verband gebracht met een verandering van het seksueel gedrag ten gevolge van de hivepidemie (Cairo, 2001). Na 1994 stabiliseerde de incidentie gedurende een aantal jaren op een lager niveau. De aantallen infecties die gevonden worden bij de soacentra nemen sinds 1999 jaarlijks toe, mede door het versterkte testbeleid. Vanaf 2004 was er een lichte daling van het aantal gonorroediagnoses te zien binnen de soacentra, maar net als in de rest van Europa steeg het aantal gevallen weer sinds 2008. Ook in Nederland wordt gonorroe vaker bij mannen vastgesteld. De verhouding manvrouw is ongeveer 4:1, vooral door de hoge frequentie bij MSM. In 2015 werd 68% van de in totaal 5391 diagnoses in de soacentra gesteld bij MSM (Van den Broek, 2016). Bij MSM steeg zowel het absolute aantal opgespoorde gevallen van gonorroe als het percentage positieve testen in de periode 20082015.
Resistentieontwikkeling in Nederland
Tot nu toe wist Ng na kortere of langere tijd resistentie te ontwikkelen tegen alle gebruikte antibiotica (Koedijk, 2010; Peerbooms, 2001; Van Dam, 2014). Daarom is het zeer wel mogelijk dat het slechts een kwestie van tijd is eer ook resistentie tegen het enige nog empirisch effectief te gebruiken middel (ceftriaxon) ontstaat (ECDC, 2015; Unemo, 2012; Ohnishi, 2011).
In Nederland wordt resistentieontwikkeling sinds 2006 systematisch in kaart gebracht bij de soapoliklinieken via GRAS (Hofstraat, 2016). Hieruit blijkt dat er in Nederland nog geen resistentie tegen ceftriaxon is vastgesteld, al worden er wel minder gevoelige stammen aangetroffen. Therapiefalen na gebruik van ceftriaxon is in Nederland nog niet gerapporteerd, echter eerder wel in Europa in Noorwegen en Zweden (Unemo, 2010; Unemo, 2011). De resistentie tegen ciprofloxacine die in Nederland in 2009 rond de 50% lag is inmiddels gedaald tot rond de 25%. Resistentie tegen azitromycine stijgt geleidelijk (figuur B21).
Omdat het afkappunt voor azitromycine waarop een stam als gevoelig of resistent wordt beoordeeld zoals vastgesteld door het European Committee on Antimicrobial Susceptibility Testing (EUCAST) binnen de verdeling van de MICs (minimum inhibitory concentratie) van natuurlijk voorkomende stammen ligt, kunnen aanzienlijke schommelingen in resistentie optreden tussen verschillende jaren en zijn resultaten van verschillende laboratoria ook niet goed vergelijkbaar. Er zijn relatief veel stammen met een MIC rond het afkappunt. De continue toename van de MIC over de tijd ondersteunt echter de observatie dat gonorroe (ook) in Nederland verminderd gevoelig aan het worden is voor azitromycine (Hofstraat, 2016), waarmee het eventuele inzetten van azitromycine als reservemiddel weinig opportuun is.
Zolang er geen alternatief middel beschikbaar is, is vroegopsporing van eventuele verminderd gevoelige en resistente stammen essentieel om verspreiding te voorkomen en tijd te winnen. Het is van belang dat de winst in de bestrijding van gonorroe behaald door de snelle en sensitieve NAATdiagnostiek niet verloren gaat door het niet meer beschikbaar zijn van kweken voor gevoeligheidsbepalingen waardoor resistentie pas na verspreiding zal blijken. Het ontbreken van kweken is met name een risico bij asymptomatische infecties bij hoogrisicopatiënten. Faryngale infecties geven het hoogste risico op resistentievorming (Weinstock, 2009; Tapsall, 2009; Unemo, 2010; Unemo, 2011; Unemo, 2012; Chen, 2013; Read, 2013; Golparian, 2014). Asymptomatische NAATpositieve patiënten komen niet altijd terug en bij diegenen die enige tijd na een positieve NAAT wel terugkomen, is de kans op een positieve kweek kleiner.
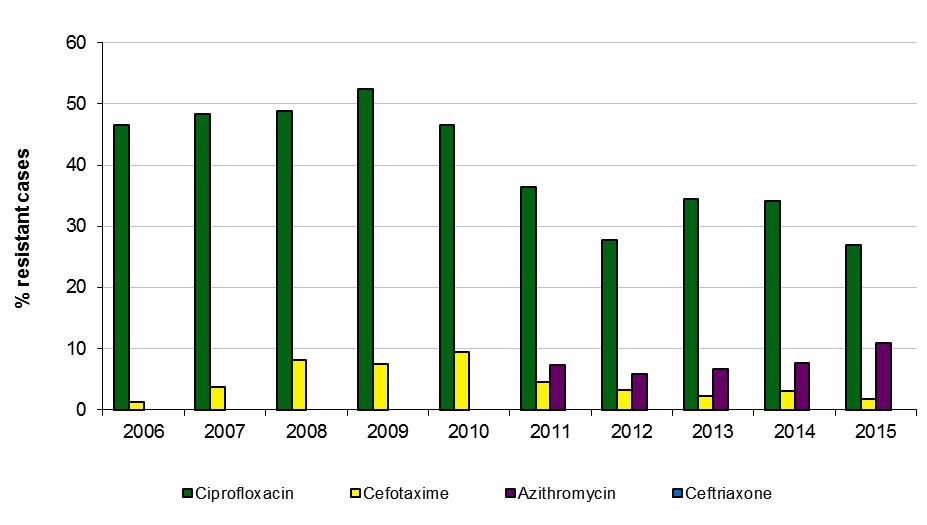
Figuur B21. Resistentie van gonokokken, gekweekt in Nederland, voor verschillende antibiotica, met gebruik van de EUCASTgrenswaarden 2008-2017. De gevoeligheid voor ceftriaxon en azithromycine wordt getest sinds 2011. Bron: Sexually transmitted Infections in the Netherlands in 2017 (RIVM, 2018).
B2.7 Preventie
B2.7.1 Immunisatie
Een vaccin tegen gonorroe is niet beschikbaar.
B2.7.2 Algemene preventieve maatregelen
Vermijden van onveilig seksueel contact ofwel vermijden dat geïnfecteerde urethrale, vaginale of anale excreten van de ene partner in aanraking komt met het slijmvlies van de andere partner.
Seksuele overdracht van gonorroe kan sterk worden verminderd door het gebruik van condooms en/of beflapjes. Verschillende factoren kunnen van invloed zijn op het al dan niet gebruiken van een condoom (attitude, gedrag, vaardigheden). Het is van belang om deze te bespreken tijdens counseling (zie module C4).
B2.7.3 Desinfectie
Niet van toepassing.
B2.8 Maatregelen
B2.8.1 Meldingsplicht
De meldingsplicht van gonorroe is per 1 april 1999 vervallen. Tot die tijd werden jaarlijks omstreeks 1200 gevallen gemeld. Sinds december 2008 geldt voor alle artsen een meldplicht aan de GGD als zij een voor hun praktijk ongewoon aantal gevallen gonorroe vaststellen, als die een gevaar vormen voor de volksgezondheid (Wet Publieke Gezondheid, Hfdst V, paragraaf 2, Artikel 21.3).
B2.8.2 Contactonderzoek en partnerwaarschuwing
Zie voor dit onderdeel module C4. Bij een man met symptomatische gonorroe vindt partnerwaarschuwing plaats van alle seksuele partners in de 46 weken voorafgaand aan de klachten. Bij asymptomatische gonorroe worden alle sekspartners tot 6 maanden terug gewaarschuwd.
Indien alleen een waarschijnlijkheidsdiagnose gesteld is, maar er wel met behandeling wordt begonnen, moet worden aangeraden wel de huidige partner(s), maar nog niet de vorige partner(s) te waarschuwen en daarmee te wachten tot de definitieve diagnose bekend is (zie ook module A1). Als duidelijk is dat de infectie al langer bestaat, wordt zo mogelijk verder teruggegaan in de tijd.
Bij mannen met asymptomatische gonorroe en bij vrouwen worden alle partners van de laatste 6 maanden gewaarschuwd. Het meegeven (en toelichten hoe te gebruiken) van zogenaamde contactstroken en schriftelijk informatiemateriaal kan ondersteunend zijn bij het waarschuwen van partner(s).
In een vervolgafspraak kan worden nagegaan of de partner(s) gewaarschuwd zijn (zie ook module C4).
B2.8.3 Maatregelen ten aanzien van patiënt en contacten
Bij een adequate therapie is het risico van overdracht waarschijnlijk binnen 24 uur verdwenen, maar over het algemeen wordt geadviseerd tot een week na de behandeling geen seksueel contact te hebben. Om ‘pingponginfecties’ te voorkomen moet(en) ook de seksuele partner(s) onderzocht, getest en behandeld worden. Indien dit advies niet kan worden opgevolgd, wordt aangeraden in elk geval een condoom (of bij beffen een beflapje) te gebruiken, ook als de partner gelijktijdig wordt behandeld (zie voor partnerbehandeling module C4).
B2.8.4 Overige maatregelen
Voorlichting
Het is van belang dat er zo snel mogelijk een gesprek wordt gehouden met de cliënt en voorlichting wordt gegeven over de besmettingsweg, de besmettelijke periode, de besmettelijkheid, behandeling en preventie. Daarnaast is het belangrijk om gedragsverandering te ondersteunen door counseling. Motivational interviewing kan hierbij een goed hulpmiddel zijn.
Inschakelen van andere instanties
Ter ondersteuning van bron en contactopsporing kan een beroep op de lokale GGD worden gedaan.
B2.9 Behandeling
B2.9.1 Primaire behandeling
Geadviseerd wordt om behandeling te starten als een van de onderstaande diagnostische testen positief is:
- een positieve amplificatietest (NAAT);
- een positieve kweek;
- een positief grampreparaat/methyleenblauwkleuring bij mannen (cave foutpositieve testuitslag ten gevolge van aanwezigheid van andere Neisseriaceae) (Leeman, 1996).
Behandeling kan eveneens worden gestart na afname van materiaal voor diagnostiek bij:
- syndroommanagement (behandeling instellen op basis van klachten);
- vaste seksuele partners (met onbeschermd seksueel contact) van patiënten met gonorroe;
- patiënten waarbij een conjunctivitis aanwezig is met vermoeden dat de cornea is aangedaan; deze patiënten dienen tevens verwezen te worden naar een oogarts voor gespecialiseerde behandeling.
Aanbevolen behandeling van gonorroe
Bij een klinisch verdachte gonorroe met positief grampreparaat:
- ceftriaxon 500 mg i.m., eenmalig (Ison, 2004; Bignell, 2011); poeder (500 mg) voor i.m. injectie oplossen in 2 ml lidocaïnehydrochloride 10 mg/ml (1%) oplossing (pijnpreventie).
Relatieve contraindicaties: allergie voor cefalosporines of anafylactische reactie op penicilline. Volgens de literatuur is het risico op kruisreacties bij cefalosporines van de derde en vierde generaties (waaronder ceftriaxon) verwaarloosbaar bij personen, die penicillineallergie hebben (Campagna, 2012; Pichichero, 2014). Bij een allergie voor lidocaïne, deze achterwege laten. Bij zwangeren kan lidocaïne veilig gebruikt worden.
Diverse recente Europese en VSrichtlijnen bevelen een combinatie van cefalosporine en azitromycine aan als eerste keuze voor de behandeling van ongecompliceerde gonorroe (Bignell, 2012; Lancaster, 2015;CDC, 2015). Voor deze herziening van de richtlijn zijn de argumenten hiervoor opnieuw gewogen, mede in het licht van de Nederlandse data (zie paragraaf B2.6.2) en wederom is deze combinatietherapie niet overgenomen als primaire keus vanwege:
- het vooralsnog uitblijven van gerapporteerde ceftriaxonresistentie en/of therapiefalen na ceftriaxonbehandeling in Nederland;
- het gebrek aan bewijs dat combinatietherapie effectief is voor de behandeling van ceftriaxonresistente gonorroe;
- het gebrek aan bewijs dat combinatietherapie effectief is in het vertragen of voorkomen van de verspreiding van gonorroeresistentie; en
- de al relatief hoge resistentie tegen azitromycine in Nederland (al jaren boven de 5% die WHO als afkappunt hanteert om een middel niet meer empirisch in te zetten) (zie figuur B21). Dit wordt ook ondersteund door uitkomsten van wiskundige modellering van de dynamiek van Ng (Xiridou, 2015).
Alternatieve behandeling van gonorroe
Alleen op geleide gevoeligheidsbepaling (kweek), bijvoorbeeld:
- ciprofloxacine 500 mg p.o., eenmalig; of:
- amoxicilline 3000 mg p.o., eenmalig.
Tweede keuze bij absolute contraindicatie voor ceftriaxon i.m. en ontbreken van resistentiepatroon van de stam:
- azitromycine, 2000 mg p.o., eenmalig (4 tabletten van 500 mg).
Hoewel deze behandeling in het verleden bewezen effectief was (Handsfield, 1994) is intussen resistentie voor azitromycine en therapiefalen beschreven. In Nederland lag het resistentiepercentage in 2015 rond de 10% en het is niet onaannemelijk dat dit verder toeneemt. Daarnaast zijn de gastrointestinale bijwerkingen bij deze dosering aanzienlijk groter dan na een dosering van 1 g, maar deze laatste dosering is niet bewezen effectief. Na orale behandeling met azitromycine is een controle middels NAAT 4 tot 6 weken na behandeling geïndiceerd.
In de meest recente IUSTI/WHOrichtlijn worden als alternatieve therapie bij ceftriaxon therapiefalen de volgende combinaties geadviseerd (Bignell, 2012):
- ceftriaxon 1000 mg i.m., eenmalig; en: azitromycine 2000 mg p.o., eenmalig;
- gentamicine 240 mg i.m., eenmalig; en: azitromycine 2000 mg p.o., eenmalig;
- spectinomycine (in Nederland op dit moment niet leverbaar) 2000 mg i.m., eenmalig; en: azitromycine 2000 mg p.o., eenmalig.
Voor alle 3 genoemde combinaties is op dit moment geen evidence over de effectiviteit voorhanden. Indien een kweek beschikbaar is, kan een antibioticum geselecteerd worden waar Ng nog wel gevoelig voor zou moeten zijn.
Behandeling van kinderen
Behandeling voor gonorroe bij kinderen kan worden overwogen als er een verhoogd risico voor infectie bestaat, bijvoorbeeld bij seksueel misbruik waarbij de dader mogelijk besmet is, als testen niet kunnen worden gedaan of worden geweigerd, als niet wordt verwacht dat het kind terugkomt voor behandeling, of als tijdens de followup klachten zijn ontstaan (Woods, 2005).
De behandeling van prepuberale kinderen in geval van gonorroe met vulvovaginitis bestaat uit:
- ceftriaxon 50 mg/kg i.m., eenmalig, maximaal 500 mg (zie Kinderformularium).
Bij gedissemineerde gonorroe geldt:
- ceftriaxon 50 mg/kg/24 uur i.v., gedurende 7 dagen.
Behandeling in bijzondere situaties (bij bewezen Ng infectie):
1. Faryngeale Nginfectie:
- 1e keus: ceftriaxon 500 mg i.m., eenmalig;
- 2e keus: ciprofloxacine 500 mg p.o., eenmalig als op basis van kweek chinolonengevoelig.
2. Nginfectie bij borstvoeding of zwangerschap:
- 1e keus: ceftriaxon 500 mg i.m., eenmalig;
- alternatief: op geleide gevoeligheidsbepaling (kweek), bijvoorbeeld amoxicilline 3000 mg p.o. (tetracyclines en chinolonen vermijden), eenmalig.
3. Anafylaxie voor penicilline (contraindicatie voor eerste en tweede generatie cefalosporines (Campagna, 2012; Pichichero, 2014):
- ciprofloxacine 500 mg p.o., eenmalig (alleen bij door kweek bewezen gevoeligheid);
- azitromycine 2000 mg p.o., eenmalig 4 tabletten van 500 mg (met nacontrole, zie boven)
4. Ophthalmia neonatorum door Nginfectie:
- 1e keus: ceftriaxon 50 mg/kg i.v. of i.m. (max. 125 mg);
- 2e keus: cefotaxim 100 mg/kg eenmalig i.m of i.v.
5. Gonokokkenconjunctivitis bij volwassenen:
- ceftriaxon 500 mg i.m., eenmalig;
- lokale ooglidhygiëne.
6. Gegeneraliseerde infectie (bacteriёmie):
- ceftriaxon 1000 mg i.m. of i.v., om de 24 uur gedurende 7 dagen; bij klinische verbetering en bewezen gevoeligheid voor ciprofloxacin kan overgegaan worden op ciprofloxacin 2 dd 500 mg na 48 uur.
Voor behandelingsadviezen ten aanzien van ‘syndromic management’ van de man met urethritisklachten (dysurie en/of exsudaat) bij een eerste visite, zie module A1.
B2.9.2 Nacontrole
Controle na behandeling is niet nodig indien behandeld is volgens de eerste keus standaardbehandeling (ceftriaxon i.m.).
Controle is wel geïndiceerd:
- na elke alternatieve behandeling van gonorroe en behandeling die niet conform bovenstaande richtlijn is geschied;
- bij persisterende klachten, (in dit geval ook kweek afnemen!);
- bij reexpositie aan onbehandelde bron (in dat geval ook testen op andere soa’s).
Uit oogpunt van monitoring van optredende resistentie is er op soapoliklinieken wel een plaats voor het controleren na behandeling van faryngeale gonorroe, omdat de behandeling daarvan minder effectief is dan de behandeling van ongecompliceerde anogenitale gonorroe. Er bestaat literatuur over het falen van cefixim (en ook bij cefuroximaxetil) p.o. bij faryngeale gonorroe (Unemo, 2010) zelfs over het falen van ceftriaxon 250 mg en 500 mg daarbij, terwijl 1000 mg i.v. wel effectief was (Unemo, 2011). Geadviseerd wordt bij het falen van de behandeling van faryngeale gonorroe met hogere doses ceftriaxon te behandelen en tests of cure te herhalen tot deze negatief worden.
De controletest dient indien NAATonderzoek plaatsvindt minimaal 14 dagen na het beëindigen van de behandeling plaats te vinden. Hananta et al. beschrijven dat 36 van de 781 patiënten (4,6%) persisterende gonorroe hadden na behandeling bij een test of cure van 8 dagen (IQR 7-12 dagen). Bij een test of cure van 15-28 dagen was dit 1,0% (Hananta 2017). Kweekonderzoek met resistentiebepaling bij persisterende klachten kan al 12 dagen na het beëindigen van de behandeling gedaan worden.
Bij syndromale behandeling van gonorroe (op basis van evidente klachten of direct diagnostiek) wordt soms een mogelijke Ctinfectie wel al meebehandeld. Voorkeursbehandeling daarvoor is 1000 mg azitromycine eenmalig (zie verder module B1). Er is geen bewijs dat dit nuttig is bij een negatieve NAAT voor Ct.
Als algemene richtlijn: vanaf 24 uur na einde van de behandeling is een patiënt met gonorroe niet meer infectieus. Daarna behoeft de patiënt geen beschermende maatregelen tegen overdracht meer te nemen. Om partnerbehandeling mogelijk te maken kan een langere periode noodzakelijk zijn (zie verder paragraaf B2.8).
Referenties
- Bignell C, Fitzgerald M. UK national guideline for the management of gonorrhoea in adults, 2011. Int J STD AIDS 2011; 22: 541547. https://www.bashh.org/guidelines.
- Bignell C, Unemo M. 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Revision date: 1 November 2012. IUTSI, 2012. https://www.iusti.org/regions/europe/pdf/2012/Gonorrhoea_2012.pdf.
- Cairo I. Gegevens dermatologische SOApoliklinieken 19912000. SOA bulletin 2001: 22(2): 46.
- Campagna JD, Bond MC, Schabelman E, Hayes BD. The use of cephalosporins in penicillinallergic patients: a literature review. J Emerg Med 2012; 42: 612620.
- CDC. Gonoccocal infections. In: 2015 Sexually transmitted diseases treatment guidelines. Centers for Disease Control and Prevention, 2015. https://www.cdc.gov/std/tg2015/gonorrhea.htm.
- Chisholm SA, Wilson J, Alexander S, Tripodo F, AlShahib A, Schaefer U, Lythgow K, Fifer H. An outbreak of highlevel azithromycin resistant Neisseria gonorrhoeae in England. Sex Transm Infect 2016; 92: 365367.
- Chen MY, Stevens K, Tideman R, Zaia A, Tomita T, Fairley CK, Lahra M, Whiley D, Hogg G. Failure of 500 mg of ceftriaxone to eradicate pharyngeal gonorrhoea, Australia. J Antimicrob Chemother 2013; 68: 14451447.
- Cook RL, Hutchinson SL, Ostergaard L, Braithwaite RS, Ness RB. Systemic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoea. Ann Intern Med 2005; 142: 914925.
- De Vries HJ, van der Helm JJ, Schim van der Loeff MF, van Dam AP. Multidrugresistant Neisseria gonorrhoeae with reduced cefotaxim susceptibility is increasingly common in men who have sex with men, Amsterdam, The Netherlands. Euro Surveill 2009; 14: pii:19330.
- ECDC. Sexually transmitted infections in Europe 2013. ECDC surveillance report. European Center for Disease Prevention and Control, 2015.
- Fang J, Husman C, DeSilva L, Chang R, Peralta L. Evaluation of selfcollected vaginal swab, first voided urine and endocervical swab specimens for the detection of Chlamydia trachomatis and Neisseria gobnorrhoeae in adolescent females. J Pediatr Adolesc Gynecol 2008; 21: 355360.
- Fifer H, Natarajan U, Jones L, Alexander S, Hughes G, Golparian D, Unemo M. Failure of dual antimicrobial therapy in treatment of Gonorrhea. N Engl J Med 2016; 374: 25042506.
- Goller JL, De Livera AM, Fairley CK, Guy RJ3, Bradshaw CS, Chen MY, Simpson JA, Hocking JS. Population attributable fraction of pelvic inflammatory disease associated with chlamydia and gonorrhoea: a crosssectional analysis of Australian sexual health clinic data. Sex Transm Infect 2016. pii: sextrans2015052195 doi: 10.1136/sextrans2015052195.
- Golparian D, Ohlsson A, Janson H, Lidbrink P, Richter T, Ekelund O, Fredlund H, Unemo M. Four treatment failures of pharyngeal gonorrhoea with ceftriaxone (500 mg) or cefotaxime (500 mg), Sweden, 2013 and 2014. Euro Surveill 2014; 19: pii:20862.
- Hananta IPY, De Vries HJC, van Dam AP, Van Rooijen MS, Soebono H, Van der Loeff MFS. Sex Transm Infect 2017;93:467471.
- Handsfield HH, Dalu ZA, Martin DH, Douglas JM Jr, McCarty JM, Schlossberg D. Multicenter trial of singledose azithromycin vs. ceftriaxone in the treatment of uncomplicated gonorrhoea: Azithromycin Gonorrhea Study Group. Sex Transm Dis 1994; 21: 107111.
- Hoebe JPA, Rademaker CW, Brouwers EEHG et al. Acceptability of self taken vaginal swabs and firstcatch urine samples for the diagnosis urogenital Chlamydia trachomatis and Neisseria gonorrhoeae with an amplified DNA assay in young women attending a public health sexually transmitted disease clinic. Sex Transm Dis 2006; 33: 491495.
- Hofstraat S, van Benthem B, van Dam A, Linde I. Trends en determinanten van resistentie van Neisseria gonorrhoeae in Nederland. NVMM 2016; 24: 6974.
- Hui B, Fairley CK, Chen M, Grulich A, Hocking J, Prestage G, Walker S, Law M, Regan D. Oral and anal sex are key to sustaining gonorrhoea at endemic levels in MSM populations: a mathematical model. Sex Transm Dis 2015; 91: 365-369.
- Ison CA, Mouton JW, Jones K, Fenton KA, Livermore DM. Which cephalosporin for gonorrhoea? Sex Transm Inf 2004; 80: 386368.
- Ison CA, Hussey J, Sankar KN, Evans J, Alexander S. Gonorrhoea treatment failures to cefixime and azithromycin in England, 2010. Euro Surveill 2011; 16: pii:19833.
- Jungmann E, Ison C, Martin IM, Fenton KA. Gonorrhoea in young heterosexuals attending urban STD clinics in Britain: a crosssectional survey. Int J STD AIDS 2004; 15: 243248.
- Kent CK, Chaw JK, Wong W, et al. Prevalence of rectal, urethral, and pharyngeal chlamydia and gonorrhea detected in 2 clinical settings among men who have sex with men: San Francisco, California, 2003. Clin Infect Dis 2005; 41: 6774.
- Koedijk FDH, van Veen MG, de Neeling AJ, Linde GB, van der Sande MAB. Increasing trend in gonococcal resistance to ciprofloxacin in The Netherlands, 20068. Sex Transm Infect 2010; 86: 4145.
- Korenromp EL, Sudaryo MK, de Vlas SJ, Gray RH, Sewankambo NK, Serwadda D, Wawer MJ, Habbema JD. What proportion of episodes of gonorrhoea and chlamydia becomes symptomatic? Int J STD AIDS 2002; 13: 91101.
- Lancaster JW, Mahoney MV, Mandal S, Lawrence KR. Update on treatment options for gonococcal infections. Pharmacotherapy 2015; 35: 856868.
- Leeman FWJ, van Voorst Vader PC van, Mulder JG, Tensen A. Besmetting met anogenitale meningokokken. SOAbulletin 1996; 17: 1820.
- Lycke E, Lowhagen GB, Hallhagen G, Johanisson G, Ramstedt K. The risk of transmission of genital Chlamydia trachomatis infection is less than that of genital Neisseria gonorrhoea infection. Sex Transm Dis 1980; 7: 610.
- Mandell GL, Bennett JE, Dolin R. Mandell, Douglas, and Bennett's principles and practice of infectious diseases. 8th Edition. Elsevier Churchill Livingstone, 2015.
- Masek BJ, Arora N, Quinn N, Aumakhan B, Holden J, Hardick A, Agreda P, Barnes M, Gaydos CA. Performance of three nucleic acid amplification tests for detection of Chlamydia trachomatis and Neisseria gonorrhoeae by use of selfcollected vaginal swabs obtained via an Internetbased screening program. J Clin Microbiol 2009; 47: 16631667.
- Maze MJ, Young S, Creighton J, Anderson T, Werno A. Nucleic acid amplification of the opa gene for detection of Neisseria gonorrhoeae: experience from a diagnostic laboratory. J Clin Microbiol 2011; 49: 11281129.
- Moncada J, Schachter J, Liska S, Shayevich C, Klausner JD. Evaluation of selfcollected glans and rectal swabs from men who have sex with men for detection of Chlamydia trachomatis and Neisseria gonorrhoeae by use of nucleic acid amplification tests. J Clin Microbiol 2009; 47: 16571662.
- Monfort L, Caro V, Devaux Z, Delannoy AS, Brisse S, Sednaoui P. First Neisseria gonorrhoeae genotyping analysis in France: identification of a strain cluster with reduced susceptibility to ceftriaxone. J Clin Microbiol 2009; 47: 35403545.
- Morris SR, Klausner JD, Buchbinder SP, Wheeler SL, Koblin B, Coates T, Chesney M, Colfax GN. Prevalence and incidence of pharyngeal gonorrhea in a longitudinal sample of men who have sex with men: the EXPLORE study. Clin Infect Dis 2006; 43: 12841289.
- Nielsen R, Søndergaard J. Asymptomatic male and female gonorrhoea. Acta Derm Venereol 1975; 55: 499501.
- Ohnishi M, Saika T, Hoshina S, Iwasaku K, Nakayama S, Watanabe H, Kitawaki J. Ceftriaxoneresistant Neisseria gonorrhoeae, Japan. Emerg Infect Dis 2011; 17: 148149.
- Ohnishi M, Golparian D, Shimuta K, Saika T, Hoshina S, Iwasaku K, Nakayama S, Kitawaki J, Unemo M. Is Neisseria gonorrhoeae initiating a future era of untreatable gonorrhea?: detailed characterization of the first strain with highlevel resistance to ceftriaxone. Antimicrob Agents Chemother 2011; 55: 35383545.
- Peerbooms PGH, Spaargaren J, Fennam JSA, Cairo I, Coutinho RA. Toename van chinolonresistentie bij Neisseria gonorrhoeae in Amsterdam. Ned Tijdschrift Geneeskd 2001; 145: 18991900.
- Pichichero ME, Zagursky R. Penicillin and cephalosporin allergy. Ann Allergy Asthma Immunol 2014; 112: 404412.
- Read PJ, Limnios EA, McNulty A, Whiley D, Lahra MMl. One confirmed and one suspected case of pharyngeal gonorrhoea treatment failure following 500 mg ceftriaxone in Sydney, Australia. Sex Health 2013; 10: 460462.
- Schachter J, Chernessky MA, Willis DE, Fine PM, Martin DH, Fuller D, Jordan JA, Janda W, Hook EW. Vaginal swabs are the specimens of choice when screening for Chlamydia trachomatis and Neisseria gonorrhoeae: results from a multicenter evaluation of the Aptima Assays for both infections. Sex Transm Dis 2005; 32: 725728.
- Schachter J, Moncada J, Liska S, Shayevich C, Klausner JD. Nucleic acid amplification tests in the diagnosis of chlamydial and gonococcal infections of the orofarynx and rectum in men who have sex with men. Sex Transm Dis 2008; 35: 637642.
- Sherrard J, Barlow D. Gonorrhoea in men: clinical and diagnostic aspects. Genitourin Med 1996; 72: 422426.
- Tapsall J, Read P, Carmody C, Bourne C, Ray S, Limnios A, Sloots T, Whiley D. Two cases of failed ceftriaxone treatment in pharyngeal gonorrhoea verified by molecular microbiological methods. J Med Microbiol 2009; 58: 683687.
- Unemo M, Golparian D, Syversen G, Vestrheim DF, Moi H. Two cases of verified clinical failures using internationally recommended firstline cefixime for gonorrhoea treatment, Norway, 2010. Euro Surveill 2010; 15: pii:19721.
- Unemo M, Golparian D, Hestner A. Ceftriaxone treatment failure of pharyngeal gonorrhoea verified by international recommendations, Sweden, July 2010. Euro Surveill 2011; 16: pii:19792.
- Unemo M, Golparian D, Potocnik M, Jeverica S. Treatment failure of pharyngeal gonorrhoea with internationally recommended firstline ceftriaxone verified in Slovenia, September 2011. Euro Surveill 2012; 17: pii:20200.
- Unemo M, Golparian D, Nicholas R, Ohnishi M, Gallay A, Sednaoui P. Highlevel cefixime and ceftriaxoneresistant Neisseria gonorrhoeae in France: novel penA mosaic allele in a successful international clone causes treatment failure. Antimicrob Agents Chemother 2012; 56: 12731280.
- Unemo M, Nicholas RA. Emergence of multidrugresistant, extensively drugresistant and untreatable gonorrhoea. Future Microbiol 2012; 7: 14011422.
- Van Dam AP, van Ogtrop ML, Golparian D, Mehrtens J, de Vries HJ, Unemo M. Verified clinical failure with cefotaxime 1 g for treatment of gonorrhoea in the Netherlands: a case report. Sex Transm Infect 2014; 90: 513514.
- Van den Broek IVF, van Aar F, van Oeffelen AAM, Woestenberg PJ, Heijne JCM, den Daas C, Hofstraat SHI, Hoenderboom BM, van Wees D, van Sighem Al, Nielen MMJ, van Benthem BHB. Sexually transmitted infections in the Netherlands in 2015. RIVM Rapport 2015-0026. Rijksinstituut voor Volksgezondheid en Milieu, 2016. http://www.rivm.nl/Documenten_en_publicaties/Wetenschappelijk/Rapporten/2016/juni/Sexually_transmitted_infections_in_the_Netherlands_in_2015.
- Weinstock H, Workowski KA. Pharyngeal gonorrhea: an important reservoir of infection? Clin Infect Dis 2009; 49: 17981800.
- Wiesner PJ, Tronca E, Bonin P, Pedersen AH, Holmes KK. Clinical spectrum of gonococcal pharyngitis. N Engl J Med 1973; 288: 181185.
- Wind CM, de Vries HJ, Schim van der Loeff MF, Unemo M, van Dam AP. Successful combination of nucleic acid amplification test diagnostics and targeted deferred Neisseria gonorrhoeae culture. J Clin Microbiol 2015; 53: 18841890.
- Woods CR. Gonococcal infections in neonates and young children. Semin Pediatr Infect Dis 2005; 16: 258270.
- WHO. Guidelines for the treatment of Neisseria gonorrhoeae. World Health Organization, 2016.
- Xiridou M, Soetens LC, Koedijk FD, van der Sande MAB, Wallinga J. Public health measures to control the spread of antimicrobial resistance in Neisseria gonorrhoeae in men who have sex with men. Epidemiol Infect 2015; 143: 15751584.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 25-02-2019
Laatst geautoriseerd : 25-02-2019
Geplande herbeoordeling :
Een richtlijn heeft alleen zeggingskracht als op continue basis onderhoud plaatsvindt, op grond van systematische monitoring van zowel de medisch wetenschappelijke literatuur als praktijkgegevens en door gebruikers van de richtlijn aangeleverde commentaren. Voor deze richtlijn is afgesproken periodiek de literatuur te bekijken om nieuwe ontwikkelingen te volgen. Bij essentiële ontwikkelingen kan besloten worden om de gehele richtlijnwerkgroep bij elkaar te roepen, de richtlijn aan te passen en deze onder de belanghebbenden te verspreiden.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn doet aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering en is gericht op het vaststellen van goed medisch handelen.
Doelgroep
Soa’s zijn bij uitstek een multidisciplinair onderwerp. Zo kunnen clinici zoals dermatologen, gynaecologen, urologen, kinderartsen, internisten, neurologen, oogartsen, reumatologen en huisartsen geconfronteerd worden met soagerelateerde klachten en hulpvragen. Daarnaast is specifieke diagnostische expertise aanwezig bij medisch microbiologen en zijn de publieke gezondheidszorg en infectiepreventie-gerelateerde aspecten het werkterrein van de GGD. Tevens kan seksuologische of psychologische problematiek, zoals seksverslaving en identiteitsproblemen, een verhoogd risico op een soa opleveren. De richtlijn is bestemd voor leden van de desbetreffende medische en verpleegkundige beroepsgroepen. Voor patiënten kan algemene en specifieke informatie omtrent de meeste soa’s gevonden worden via www.thuisarts.nl of Soa Aids Nederland (www.soaaids.nl). Hier zijn ook patiëntenfolders en voorlichtingsmateriaal te bestellen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een werkgroep samengesteld, bestaande uit een vertegenwoordiging van dermatologen, gynaecologen, artsenmicrobioloog, huisartsen, internisten, kinderartsen, een oogarts, artsen maatschappij en gezondheid, een neuroloog en een uroloog. Daarnaast zijn er leden aangeschoven van buiten de curatiefmedische sector, zoals van het RIVM, V&VN en Soa Aids Nederland. Verder nam een patiëntvertegenwoordiger van de Hiv Vereniging Nederland deel. Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en nietacademische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. De conceptversie van de richtlijn is voor commentaar ook toegestuurd aan de Nederlandse Vereniging voor Reumatologie, de Nederlandse Vereniging voor Cardiologie, de Nederlandse Vereniging van MaagDarmLeverartsen en de Nederlandse Vereniging voor KeelNeusOorheelkunde en Heelkunde van het HoofdHalsgebied. Bij een volgende versie van de richtlijn kan overwogen worden de werkgroep uit te breiden met meer aanpalende specialismen.
Werkgroep herziening 2018
|
Naam |
Functie |
Affiliatie |
Vertegenwoordiging |
|
prof. dr. H.J.C. de Vries |
Dermatoloog, voorzitter werkgroep |
AMC, GGD Amsterdam |
NVDV |
|
dr. A.P. van Dam |
Artsmicrobioloog, medevoorzitter werkgroep |
OLVG |
NVMM |
|
dr. C.J. Bax |
Gynaecoloog |
AMC |
NVOG |
|
prof. dr. J.E.A.M. van Bergen |
Huisarts, epidemioloog, public health arts |
Soa Aids Nederland |
Soa Aids Nederland / NHG |
|
drs. Y.Y. Chung |
Artsonderzoeker richtlijnontwikkeling |
NVDV |
NVDV |
|
drs. N.H. ten Dam-van Loon |
Oogarts |
UMC Utrecht |
NOG |
|
dr. J.J.E. van Everdingen |
Directeur NVDV |
NVDV |
NVDV |
|
K. Geelen |
Coördinator beleid en kwaliteit richtlijnontwikkeling |
NVDV |
NVDV |
|
dr. H. Götz |
Arts Maatschappij en Gezondheid, Infectieziektebestrijding |
GGD Rotterdam-Rijnmond |
NVIB / WASS |
|
drs. E. Hoornenborg |
Internist-infectioloog |
GGD |
NVHB |
|
drs. A.G.W van Hulzen |
Verpleegkundig specialist |
Isala |
V&VN |
|
dr. S.H. Kardaun |
Dermatoloog |
UMC Groningen |
NVDV |
|
dr. E. Lanjouw |
Dermatoloog |
VUmc |
NVDV |
|
dr. E. van Leeuwen |
Gynaecoloog |
AMC |
NVOG |
|
drs. B. Meijer |
Uroloog |
Flevoziekenhuis |
NVU |
|
J. Moorlag |
Patiëntvertegenwoordiger |
Poz and Proud, Hiv Vereniging |
Hiv Vereniging |
|
T. Oomen |
Beleidsadviseur / sociaal verpleegkundige (n.p.) |
RIVM |
RIVM |
|
dr. P.M. Oostvogel |
Arts-microbioloog |
Streeklaboratorium GGD Amsterdam |
GGD Amsterdam |
|
prof dr. P. Portegies |
Neuroloog |
OLVG, AMC |
NVN |
|
dr. K.D. Quint |
Dermatoloog |
LUMC |
NVDV |
|
dr. B.J.A. Rijnders |
Internist |
Erasmus MC |
NVHB |
|
dr. G.I.J.G. Rours |
Kinderarts, klinisch epidemioloog |
Erasmus MC |
NVK |
|
drs. A.A.J. van der Sande |
Arts-onderzoeker richtlijnontwikkeling |
NVDV |
NVDV |
|
dr. M.A.B. van der Sande |
Arts-epidemioloog |
RIVM |
RIVM |
|
dr. H.J. Scherpbier |
Kinderarts |
AMC, Emma kinderziekenhuis |
NVK |
|
dr. M. Schim van der Loeff |
Arts-epidemioloog |
AMC/ GGD Amsterdam |
GGD Amsterdam |
|
dr. V. Sigurdsson |
Dermatoloog |
UMC Utrecht |
NVDV |
|
drs. R. Soetekouw |
Internist |
Spaarne Gasthuis |
NIV |
|
dr. J. van Steenbergen |
Arts-epidemioloog |
RIVM |
RIVM |
|
drs. A.H. Teeuw |
Kinderarts sociale pediatrie |
AMC |
NVK |
|
dr. H.T. Tjhie |
Arts-microbioloog |
Stichting PAMM |
NVMM |
|
dr. C. E. Vergunst |
Dermatoloog |
GGD Amsterdam |
NVDV |
|
drs. L. Verlee |
Huisarts / wetenschappelijk medewerker |
NHG |
NHG |
Werkgroep versie 2012
|
Naam |
Functie |
Affiliatie |
Vertegenwoordiging |
|
prof. dr. H.J.C. de Vries |
Dermatoloog, voorzitter werkgroep |
AMC, GGD Amsterdam |
NVDV |
|
prof. dr. G.J.J. van Doornum |
Arts-microbioloog |
AMC |
NVMM |
|
dr. C.J. Bax |
Gynaecoloog |
AMC |
NVOG |
|
prof. dr. J.E.A.M. van Bergen |
Huisarts, epidemioloog, public health arts |
Soa Aids Nederland |
Soa Aids Nederland |
|
drs. J. de Bes |
Arts-onderzoeker richtlijnontwikkeling |
NVDV |
NDVD |
|
dr. A.P. van Dam |
Arts-microbioloog |
OLVG |
NVMM |
|
dr. J.J.E. van Everdingen |
Directeur NVDV |
NVDV |
NVDV |
|
dr. H. Götz |
Arts infectieziekten |
GGD Rotterdam-Rijnmond |
GGD |
|
drs. A.G.W van Hulzen |
Verpleegkundig specialist |
Isala klinieken |
V&VN |
|
dr. S.H. Kardaun |
Dermatoloog |
UMC Groningen |
NVDV |
|
dr. E. Lanjouw |
AIOS dermatologie |
Erasmus MC |
NVDV |
|
dr. E. van Leeuwen |
Gynaecoloog |
AMC |
NVOG |
|
drs. M.T.W. Lock |
Uroloog |
UMC Utrecht |
NVU |
|
prof dr. P. Portegies |
Neuroloog |
OLVG Amsterdam, AMC |
NVN |
|
dr. K.D. Quint |
AIOS dermatologie |
LUMC |
NVDV |
|
dr. B.J.A. Rijnders |
Internist |
Erasmus MC |
NVHB |
|
Kinderarts, klinisch epidemioloog |
Erasmus MC |
NVK |
|
|
dr. M.A.B. van der Sande |
Arts-epidemioloog |
RIVM |
RIVM |
|
dhr. L. Schenk |
Patiëntvertegenwoordiger |
Poz and Proud, Hiv vereniging |
Hiv Vereniging |
|
dr. H.J. Scherpbier |
Kinderarts |
AMC, Emma kinderziekenhuis |
NVK |
|
dr. V. Sigurdsson |
Dermatoloog |
UMC Utrecht |
NVDV |
|
drs. R. Soetekouw |
Internist |
Kennemer Gasthuis |
NIV |
|
dr. J. van Steenbergen |
Arts-epidemioloog |
RIVM |
RIVM |
|
dr. H.T. Tjhie |
Arts-microbioloog |
Stichting PAMM |
NVMM |
|
drs. L. Verlee |
Huisarts / wetenschappelijk medewerker |
NHG |
NHG |
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal in de specifieke vaktijdschriften aandacht worden besteed aan de richtlijn.
Werkwijze
De werkgroep werkte in 2016 aan een conceptrichtlijntekst, gebaseerd op de 2012 versie. De werkgroepleden werden verdeeld in subgroepen die zich elk bogen over een module. Via een algemene search en controle van referenties is bruikbare literatuur die na 2012 is gepubliceerd, verzameld. De werkgroepleden hebben de literatuur beoordeeld op inhoud en kwaliteit. Bij het tot stand komen van de 2012 versie bleek de bewijskracht voor de beantwoording van de toenmalig geformuleerde uitgangsvragen teleurstellend (er kwamen geen adviezen met een bewijskracht boven niveau 4 uit). De richtlijn is daarom hoofdzakelijk gebaseerd op de mening van de werkgroep na uitvoerige discussie, aanvullend gericht literatuuronderzoek en de hierboven genoemde eerder gepubliceerde richtlijnen. De teksten werden tijdens subgroepvergaderingen en een tweedaagse plenaire bijeenkomst besproken en na verwerking van de commentaren geaccordeerd. Er is getracht om de samenhang en afstemming tussen de richtlijnen die door de verschillende echelons worden gebruikt te versterken. Als basistekst is uitgegaan van de soarichtlijnen van het LCI die eerder door de in Nederland aanwezige deelexperts zijn samengesteld.
De uiteindelijke teksten vormden samen de conceptrichtlijn die in 2017 aan alle betrokken beroepsverenigingen en instanties werd aangeboden. Tevens werd men in staat gesteld om via websites van de desbetreffende verenigingen commentaar op de richtlijn te geven. De commentaren zijn in deze definitieve versie van de richtlijn verwerkt.
De update 2019 op de richtlijn is tot stand gekomen op basis van commentaar op de vorige versie (2018), en evaluatie door de werkgroep. Er zijn geen substantiële wijzigingen aangebracht, maar storende fouten zoals in doseringen zijn gecorrigeerd en verduidelijkingen zijn waar nodig aangebracht.
Wetenschappelijke bewijsvoering
De aanbevelingen uit deze richtlijn zijn, voor zover mogelijk, gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Daarbij ligt de nadruk op de diagnostiek en de behandeling. Een literatuuronderzoek werd verricht via PubMed vanaf het jaar 2000 met gebruikmaking van relevante zoektermen. Na screening op titel en samenvatting werden de studies ingedeeld volgens de criteria van mate van bewijs. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing in de richtlijn staan vermeld. Daar waar geen gepubliceerd bewijs voorhanden was, is gebruik gemaakt van expert opinies zoals deze tijdens de retraite in september 2016 en later werden geformuleerd. Daarnaast is additioneel literatuuronderzoek gedaan, dat per module wordt vermeld. Een belangrijk hulpdocument ter ondersteuning van de wetenschappelijke bewijsvoering vormden de Evidence Papers for the CDC Sexually Transmitted Diseases Treatment Guidelines, gepubliceerd als supplement van het tijdschrift Clinical Infectious Diseases (supplement 8 van 15 december 2015), alsmede de 2016 herziening van de WHOrichtlijnen.
Begripsbepaling
Seksueel overdraagbare aandoeningen (soa's) behoren tot de infectieziekten die onze voortdurende aandacht behoeven. Omdat veel soa’s asymptomatisch verlopen, en er dus eigenlijk ook geen zichtbare aandoening is, gaat soms de voorkeur uit om, in navolging van de term sexually transmitted infections uit de Engelstalige literatuur, te spreken van seksueel overdraagbare infecties (SOI) (Van der Bij, 2016). In deze richtlijn wordt gesproken van soa, omdat deze term in het algemeen taalgebruik gangbaar is en om zo verwarring te voorkomen. Waar in de richtlijn ‘patiënt’ wordt gebruikt, kan ook aan ‘cliënt’ gedacht worden.
In de huidige versie van deze richtlijn is ervoor gekozen de in Nederland meest voorkomende soagerelateerde syndromen in deel A te behandelen: urethritis, fluor vaginalis en vaginitis, epididymitis, pelvic inflammatory disease, balanitis, proctitis en genitale ulcera. In deel B worden de in Nederland meest voorkomende soa’s per specifieke verwekker behandeld: Chlamydia trachomatis (chlamydiainfectie inclusief lymphogranuloma venereum), Neisseria gonorhoeae (gonorroe), Treponema pallidum (syfilis), herpessimplexvirus (herpes genitalis), humaanpapillomavirus (condylomata acuminata), Sarcoptes scabiei (scabiës) en Mycoplasma genitalium. De behandeling van hepatitis B, hepatitis C en hiv is buiten beschouwing gelaten omdat hiervoor al uitgebreide richtlijnen voor de 2e lijn zijn beschreven door de desbetreffende wetenschappelijke verenigingen, respectievelijk de Nederlandse Vereniging van MaagDarmLeverartsen (NVMDL) en de Nederlandse Vereniging van HIV Behandelaren (NVHB). Omdat aanpalende specialisten patiënten met verhoogd risico op deze infecties wel zien, is het voor hen wel van belang deze te herkennen en te diagnosticeren voor verwijzing naar een aangewezen behandelaar. In deel C tot slot zijn 4 procedurele modules opgenomen omtrent het soaconsult, soa in relatie tot hiv, hepatitis C, AIN, PreP, PEP (bij MSM en hoogrisicogroepen), soascreening bij (een vermoeden op) seksueel misbruik bij kinderen en partnerwaarschuwing. Dit vanwege de relevantie in het kader van de soabestrijding in de 2e lijn. De richtlijn pretendeert niet compleet te zijn, maar geeft hopelijk een handvat voor de clinicuspracticus werkzaam in de 2e lijn voor het handelen in relatie de in Nederland meest voorkomende soa’s.
Risicogroepen
Soa’s worden veelal overgebracht door slijmvliesslijmvliescontact tussen 2 personen, maar de overdracht kan ook op een andere wijze tot stand komen. Het oplopen van een soa hangt in hoge mate af van iemands seksueel risicogedrag. Seks met meerdere partners is een bekende risicofactor, zeker als seksuele relaties elkaar in de tijd overlappen en er geen condoom wordt gebruikt. Seks voor geld of goederen, recreatief drugsgebruik en seks met partners die zijn ontmoet via internet (datingsites en chatboxen) zijn eveneens geassocieerd met een verhoogd risico op een soa. Bij een patiënt met een hulpvraag of klachten met betrekking tot een soa kan de (seksuele) anamnese uitsluitsel geven over het gelopen risico. Dit vereist dat de hulpverlener beschikt over gesprekstechnieken om op een heldere manier en zonder gêne over seks met de betrokkene te praten.
Risicogroepen voor het oplopen van een soa veranderen in de tijd. Zo werden tot de jaren zeventig van de vorige eeuw vaak zeelieden gezien op soapoliklinieken. Zeelieden hadden destijds een relatief groter risico op een soa door wisselende seksuele contacten tijdens het passagieren in havens als schepen werden gelost en geladen. Huidige risicogroepen zijn onder meer jongeren en jongvolwassenen die nog maar kort seksueel actief zijn. In deze levensfase zijn er vaker wisselende seksuele contacten en kan er sprake zijn van onervarenheid met veilige seks. Dit leidt ertoe dat in deze leeftijdsgroep relatief vaker urogenitale chlamydiainfecties worden aangetroffen. Mannen die seks hebben met mannen (MSM) vormen een andere groep waarbij op basis van epidemiologische gegevens vaker soa’s worden gediagnosticeerd.
Het begrip MSM vereist een nadere toelichting. Voor een goede inschatting van gelopen risico op een soa is niet zozeer iemands seksuele identiteit/genderidentiteit (o.m. homoseksueel, heteroseksueel georiënteerd) van belang. Een getrouwde, zich als monogaam heteroseksueel identificerende man kan buiten zijn vaste relatie ook seks hebben met mannen en vrouwen en daarmee een verhoogd risico lopen op een soa. Als hiernaar niet specifiek wordt gevraagd (‘Hebt u seks met mannen en/of met vrouwen?’), kan relevante informatie omtrent risicogedrag worden gemist. In dezelfde trant wordt er gesproken over mannen die seks hebben met vrouwen (MSV), vrouwen die seks hebben met mannen (VSM) en vrouwen die seks hebben met vrouwen (VSV).
Epidemiologische ontwikkelingen
Na een duidelijke daling van het aantal gerapporteerde soa’s in de jaren tachtig en het begin van de jaren negentig steeg het aantal soa’s in het begin van de 21e eeuw. Sindsdien is het aantal geregistreerde testen elk jaar toegenomen. Daarbij is het vindpercentage voor chlamydiainfecties in 1e lijn en soacentra de laatste jaren gestegen. Het aantal nieuwe hivdiagnoses onder MSM is de afgelopen jaren gedaald; de syfilis en gonorroeincidentie zijn echter toegenomen in deze risicogroep.
Bij het presenteren van epidemiologische cijfers is het van groot belang te vermelden op welke populatie deze betrekking hebben. De Nederlandse prevalentiecijfers in de literatuur hebben vaak betrekking op bezoekers van aan de GGD verbonden soapoliklinieken (recent op veel plaatsen omgedoopt tot centra seksuele gezondheid). Dit is per definitie een groep patiënten met een verhoogd risico op soa’s en de cijfers vormen dan ook geen representatieve afspiegeling van het voorkomen van soa’s in de gehele populatie. De cijfers van soapoliklinieken/centra seksuele gezondheid zijn in het bijzonder relevant omdat zij: 1) inzicht verschaffen in epidemiologische veranderingen in de tijd; en 2) veel patiënten uit de hoogrisicopopulaties zien.
Meldingsplicht
De volgende infecties die in deze richtlijn aan bod komen zijn meldingsplichtig: hepatitis B, acute hepatitis C en shigellose. De meldingsplicht is geregeld in de Wet publieke gezondheid (2008), artikel 21:
- De arts die bij een door hem onderzocht persoon een ziektebeeld vaststelt met een volgens de stand van de wetenschap onbekende oorzaak, waarbij een gegrond vermoeden bestaat van besmettelijkheid en ernstig gevaar voor de volksgezondheid, meldt dit onverwijld aan de gemeentelijke gezondheidsdienst.
- De arts die een voor zijn praktijk ongewoon aantal gevallen vaststelt van een infectieziekte, niet behorend tot groep A, B1, B2 of C, die een gevaar vormt voor de volksgezondheid, meldt dit binnen 24 uur aan de gemeentelijke gezondheidsdienst.
Zie voor meer informatie:
- http://wetten.overheid.nl/BWBR0024705/2016-08-01#HoofdstukV
- http://www.rivm.nl/Onderwerpen/W/Wet_publieke_gezondheid
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer bewust van de richtlijn wordt afgeweken, moet dit echter worden beargumenteerd en gedocumenteerd, en waar nodig in overleg met de patiënt worden gedaan.
Literatuur
- Van der Bij AK, de Vries HJC. Seksueel overdraagbare infecties. In: Hoepelman AIM, Kroes ACM, Sauerwein RW, Verbrugh HA. Microbiologie en infectieziekten. Vierde herziene druk. Bohn Stafleu Van Loghum, 2016.
- RIVM. Update thermometer seksuele gezondheid. Update november 2016. Rijksinstituut voor Volksgezondheid en Milieu, 2016. http://www.rivm.nl/Documenten_en_publicaties/Algemeen_Actueel/Brochures/Infectieziekten/Update_thermometer_seksuele_gezondheid.

