Risicofactoren
Uitgangsvraag
Welke patiënten komen in aanmerking voor aanvullend onderzoek ten behoeve van het opstellen van het behandelplan voor de procedure met PSA?
Aanbeveling
Evalueer voorafgaand aan PSA ten minste de volgende gezondheidsaspecten van de patiënt:
- aanwezigheid van systemische aandoeningen;
- ernst van eventuele systemische aandoeningen;
- factoren/aandoeningen die de kans op aspiratie kunnen verhogen;
- medicatiegebruik en intoxicaties;
- risico op of aanwezigheid van OSAS en CSAS en eventueel ingezette behandelingen;
- zwangerschap en bijbehorende amenorroeduur;
- afwijkingen die (kap-)beademing of intubatie kunnen bemoeilijken;
- spier- of zenuwaandoeningen met uitvalsverschijnselen in de tractus respiratorius.
Leg anesthesiologische pre-procedurele adviezen vast in het lokale PSA protocol, of voorzie in anesthesiologische consultatie, voor de behandeling van patiënten die bekend zijn met één of meer van de volgende punten:
- een ernstige systemische aandoening (zoals gedefinieerd in de reeds gebruikelijke ASA classificatie);
- OSAS of CSAS;
- een zwangerschap (afhankelijk van de amenorroeduur die is vastgelegd in een lokaal protocol);
- afwijkingen die (kap-)beademing of intubatie kunnen bemoeilijken;
- spier- of zenuwaandoeningen met uitvalsverschijnselen in de tractus respiratorius.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuuronderzoek verricht naar de prestatie van (multivariabele) modellen welke (de kans op) complicaties en mortaliteit tijdens of na procedurele sedatie en analgesie voorspellen. Er werden geen modellen gevonden die mortaliteit bij procedurele sedatie en analgesie voorspellen. Wel werden er drie gevalideerde modellen gevonden die complicaties tijdens procedurele sedatie en analgesie voorspellen. Vanwege een zeer lage bewijskracht kan geen uitspraak worden gedaan over de prestatie van het SCOPE scoringssysteem dat op basis van de factoren leeftijd, indicatie, geslacht, historie van psychiatrische klachten, gebruik van thuismedicatie en de aanwezigheid van een ‘fellow’ bij de procedure de kans op moeilijke sedatie/noodzakelijke hoge dosering bij het uitvoeren van een oesophagogastroduodenoscopie met intraveneuze toediening van fentanyl, meperidine en midazolam voorspelt. Ook kan geen uitspraak worden gedaan over de prestatie van het SCOPE scoringsysteem dat op basis van de factoren leeftijd, indicatie, geslacht, body mass index, tabaksgebruik en thuismedicatie de kans op moeilijke sedatie/noodzakelijke hoge dosering bij het uitvoeren van een colonoscopie met intraveneuze toediening van fentanyl, meperidine en midazolam voorspelt en kan geen uitspraak worden gedaan over de prestatie van een ‘artificical neural network’ model dat op basis van de factoren ‘body mass index’, snurken en nekomtrek hypoxemie voorspelt. De zeer lage bewijskracht wordt voornamelijk veroorzaakt door beperkingen in de studieopzet ten aanzien van de ontwikkeling van de modellen en het ontbreken van externe validatie van de modellen. De werkgroep concludeert dan ook dat er een kennislacune bestaat omtrent het bestaan van beslissingsmodellen welke op basis van risicofactoren complicaties en mortaliteit tijdens of na procedurele sedatie en analgesie kunnen voorspellen.
In de literatuuranalyse zijn enkele niet gevalideerde modellen beschreven die de associatie tussen complicaties tijdens procedurele sedatie en analgesie en een combinatie van risicofactoren beschrijven. Het vertrouwen in een goede prestatie van deze modellen ten aanzien van de voorspellende waarde is echter zeer laag vanwege het ontbreken van zowel interne als externe validatie. Daardoor kunnen geen consequenties worden verbonden aan de uitkomsten van deze modellen.
Gezien vanuit de gedachte dat PSA een continuüm is dat verloopt tussen volledig bewustzijn met normale homeostase en algehele anesthesie ligt het in de rede om, ondanks het gebrek aan goede studies, de voor algehele anesthesie gekende risicofactoren in meer of mindere mate in beschouwing te nemen voorafgaand aan PSA. Helaas zijn er geen goede studies die de mate waarin de risicofactoren moeten worden meegewogen vaststellen. Voor algehele anesthesie zijn er wel gegevens beschikbaar die kunnen dienen als basis voor de overwegingen. De werkroep baseert zich daarom op consensus en expert opinion.
Er is in de literatuur indirect bewijs voor de rol die enkele patiëntgebonden risicofactoren zouden kunnen spelen bij het ontstaan van complicaties tijdens PSA. Daarnaast zijn er (patho-) fysiologische processen bekend die, in combinatie met de voor PSA gebruikte middelen, afhankelijk van de ernst van de pathologie en de gebruikte dosering, tot risico’s kunnen leiden. Hieronder vallen onder andere: ernstige systemische aandoeningen, aandoeningen die tot een functionele beperking leiden, gebruik van medicatie met interacties met de te gebruiken PSA-middelen, zwangerschap, OSAS, CSAS, spier/zenuwaandoeningen, gecompliceerde PSA in de voorgeschiedenis.
Hier horen ook patiënten met verstandelijke beperking bij. Reflux komt voor bij bijna 50% van de mensen met een ernstige verstandelijke beperking, wat het risico op aspiratie verhoogt (NVAVG, 2014). Er is sprake van veelvuldig gebruik van medicatie met relevante interacties (benzodiazepines, antipsychotica, anti-epileptica), anatomische afwijkingen in het hoofdhalsgebied of scoliose met mogelijk bemoeilijkte kapbeademing en intubatie en/of beperkte pulmonale reserves, cardiale problemen en hypotonie. Ook zijn er specifieke syndromen, die een onafhankelijke risicofactor kunnen zijn bij toepassing van PSA/narcose bij patiënten met verstandelijke beperking.
Patiënten met factoren in een van deze groepen verdienen speciale aandacht voorafgaand aan PSA.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten verwachten tijdens hun procedure adequate PSA die zo veilig mogelijk is. Risico’s van een medische behandeling kunnen in veel gevallen worden beperkt door het correct stellen van de indicatie, het vaststellen van de bijbehorende contra-indicaties en risicofactoren en het treffen van de juiste voorzorgsmaatregelen
Tegenover de wens om veilig een behandeling te ondergaan is het voor patiënten ook waardevol niet belast te worden met consultaties en onderzoeken. Een volledige pre-procedureel consult zoals gebruikelijk is voorafgaand aan een behandeling onder algehele anesthesie zal voor veel behandelingen onder PSA het doel voorbijschieten. De verstoring van de homeostase is denkbaar minder bij lichtere vormen van sedatie, wat maakt dat er minder rekening gehouden zou hoeven worden met eventuele functionele reserves van de patiënt. De beoogde sedatiediepte en de omstandigheden waaronder de PSA plaats zal vinden zullen dan wel moeten worden meegewogen bij de uitgebreidheid van het pre procedurele onderzoek. Uiteraard moeten eventuele vragen van de patiënt, zoals hoe het verlagen van het bewustzijn gebeurt, wat de patiënt mogelijk nog kan voelen of waarop die nog kan reageren worden beantwoord voorafgaand aan PSA.
Kosten (middelenbeslag)
Het is niet mogelijk om over de volle breedte een inschatting te maken van de kosten van deze interventie. Een goed ingericht zorgproces waarbij de pre procedurele onderzoeken zijn afgestemd op de beoogde patiëntenpopulatie, de beoogde sedatiediepte, de omstandigheden tijdens de PSA en de personele bezetting zal echter naar verwachting niet meer kosten dan wat momenteel in Nederland als billijk wordt gezien met betrekking tot de mogelijkheden om risico’s op complicaties te verkleinen. De werkgroep erkent hierbij dat gezien het onbekend zijn van de invloed van deze factoren er nog geen getalsmatige afweging gemaakt kan worden.
Aanvaardbaarheid, haalbaarheid en implementatie
Problemen met betrekking tot de aanvaardbaarheid zullen naar alle waarschijnlijkheid vooral liggen binnen het inrichten van het zorgproces. Een goede inschatting van de pre-procedurele risico’s kost tijd, personele inzet en mogelijk aanvullend onderzoek. Het ontbreken van getalsmatig bewijs voor de invloed van risicofactoren kan, aangezien het hier een veiligheidskwestie betreft, echter niet gezien worden als het bewijs voor het ontbreken van deze invloed. Zorgverleners zullen binnen de hieronder gestelde aanbevelingen zelf hun zorgproces veilig moeten inrichten. Kennis en expertise in de vorm van advies vanuit het anesthesiologisch vakgebied is hierbij noodzakelijk.
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op fysiologische en farmacologische gronden zijn enkele ziekteprocessen aan te wijzen die redelijkerwijs verwacht kunnen worden van invloed te zijn op de risico’s tijdens PSA. Zorgverleners moeten voorafgaand aan PSA ten eerste vaststellen of deze ziekteprocessen aanwezig zijn en ten tweede in hoeverre ze een rol spelen bij de geplande behandeling.
Aanbeveling-2
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
De hierboven beschreven ziekteprocessen zijn binnen het anesthesiologisch vakgebied gekend om hun invloed op de risico’s bij het uitvoeren van verscheidene vormen van anesthesie. De anesthesioloog is toegerust met kennis en vaardigheden om deze risico’s in te schatten en te beperken. Vaak kan een PSA ook bij patiënten met een van die ziekteprocessen worden uitgevoerd met aanvaardbare risico’s, ook wanneer deze behandeling niet door een anesthesioloog wordt uitgevoerd. De werkgroep acht het echter aan te raden om voor de behandeling van deze patiënten wel anesthesiologisch advies in te winnen. Dit kan in de vorm van een formeel consult maar ook door in samenwerking met een afdeling anesthesiologie vast te leggen hoe en door wie de behandeling wordt uitgevoerd. Op lokaal niveau kunnen hierover afspraken gemaakt worden over de genoemde patiëntengroepen. De betrokkenheid van een anesthesioloog bij dit advies kan dus variëren van een advies over patiëntengroepen in het PSA-protocol tot een pre-procedureel consult door een anesthesioloog. Het is aan de zorgverlener zelf om per patiënt en behandeling de juiste keuze te maken.
Onderbouwing
Achtergrond
PSA is een risicovolle handeling. Het is onbekend welke patiëntgebonden risicofactoren een rol spelen tijdens PSA. Daarmee is het ook onbekend welke patiëntgebonden risicofactoren tijdens de pre-procedurele evaluatie moeten worden geïnventariseerd om een behandelplan op te kunnen stellen.
Het is gebruikelijk om patiënten voorafgaand aan PSA te screenen op basis van de preoperatieve evaluatie zoals gebruikt voorafgaand aan ingrepen onder (loco)-regionale of algehele anesthesie. Het is onduidelijk of deze evaluatie ook van toepassing is op patiënten die PSA ondergaan. Er lijkt een grote mate van praktijkvariatie te zijn ontstaan door deze onduidelijkheid. Het is denkbaar dat patiënten die anxiolyse of lichte sedatie ondergaan een andere evaluatie dienen te ondergaan dan patiënten die een matige tot diepe sedatie ondergaan. Welke patiënten een klinisch diagnostisch onderzoek moeten ondergaan voorafgaand aan PSA is ook onbekend; hetzelfde geldt voor aanvullend onderzoek. Voor PSA wegen sommige risicofactoren mogelijk zwaarder of lichter dan voor ingrepen onder algehele anesthesie of onder (loco)-regionale anesthesie.
Conclusies / Summary of Findings
Mortality
|
- GRADE |
No evidence was found regarding the effect of different predictive factors on mortality in patient undergoing procedural sedation and analgesia.
Sources: none |
Complications
|
Very low GRADE |
The evidence is very uncertain about the performance the SCOPE scoring system (including factors age, indication, psychiatric history, home medication and fellow presence during procedure) predicting the risk of difficult sedation in patients undergoing oesophagogastroduodenoscopy and receiving intravenous fentanyl, meperidine and midazolam acceptable.
Sources: Braunstein, 2014 |
|
Very low GRADE |
The evidence is very uncertain about the performance the SCOPE scoring system (including factors age, indication, body mass index, tobacco use and home medication) predicting the risk of difficult sedation in patients undergoing colonoscopy and receiving intravenous fentanyl, meperidine and midazolam acceptable.
Sources: Braunstein, 2014 |
|
Very low GRADE |
The evidence is very uncertain about the performance of an artificial neural network model (including factors body mass index, habitual snoring and neck circumference) to predict hypoxemia in patients undergoing endoscopy and receiving propofol alone or with low-dose etomidate.
Sources: Geng, 2019 |
Samenvatting literatuur
Description of studies
Validated models
Braunstein (2014) presented a Stratifying Clinical Outcomes Prior to Endoscopy (SCOPE) scoring system predicting difficult sedation/high sedation requirement during oesophagogastroduodenoscopy (OGD) or colonoscopy. The scoring system for OGD was based on a multivariable logistic regression model developed on data of 13711 patients (mean age 57.4 years, SD 17.4; male 43.6%; prevalence of difficult sedation/high sedation requirement 12.4%) extracted from a prospectively filled database. Results were validated with subsequent cohorts from the same database (compared derivation cohort: n=10001, with validation cohort: n=620). The scoring system for colonoscopy was based on a multivariable logistic regression model developed on data of 21763 patients (mean age 60.8 years, SD 12.7; male 44.0%; prevalence of difficult sedation/high sedation requirement 10.6%) extracted from a prospectively filled database. Results were validated with subsequent cohorts from the same database (compared derivation cohort: n=16120, with validation cohort: n=960). All patients (OGD and colonoscopy) received intravenous fentanyl, meperidine and midazolam in various combinations.
Note that the multivariable logistic regression models reported in this study included one procedure determinant (presence of a fellow during the procedure). However, because this factor was not included in the developed SCOPE scoring system (colonoscopy) or had only small impact (OGD), this factor might be determined before the start of the procedure and the models were very relevant for the research question, we decided to include this study in the literature analysis.
Geng (2019) reported an internally validated model predicting hypoxemia during routine gastroscopy and/or colonoscopy. The model was developed by a three-layer 3-3-1 feedforward backpropagation artificial neural network (ANN) analysis on prospectively collected data of 220 patients (mean age 50 years, SD 12; male 60.9%; only gastroscopy 11.4%, only colonoscopy 18.6%, combined 70.0%; prevalence of hypoxemia: 10%). Patients were sedated with propofol alone or with low-dose etomidate.
Unvalidated models
Cote (2010), Helhammer (2018) and Perez-Cuadrado-Robles (2016) presented multivariable models describing associations of patient characteristics and complications during the procedure. Details of the presented models are shown in Table 1.
Table 1: Studies reporting unvalidated models
|
Study |
Population |
N (% events) |
Analysis method |
Outcome |
|
Cote, 2010; |
Patients undergoing endoscopic retrograde cholangiopancreatographyor endoscopic ultrasound; propofol alone or in combination with low-dose benzodiazepine and/or opiate. |
N=231 (Patients requiring airway maneuver: 12.1% |
An adjusted RR was calculated using the Mantel–Haenszel stratification method. |
- Any airway maneuver - Any sedation related complication - Hypoxemia
|
|
Helhammer, 2018; |
Percutaneous mitral valve repair with the MitraClip; continuous administration of propofol (2%) through a central venous catheter placed in the left femoral vein over a 7F sheath. All patients received local anaesthesia with 10 ml of 0.2% lidocaine administered subcutaneously at the femoral access site. Catecholamines (norepinephrine at a dose of 5 mg/50 ml) and saline were available if needed. All patients received 2–3 mg midazolam 30 min prior to the procedure as well as 0.5 mg of atropine when starting the procedure. |
N=69 |
Multivariate logistic regression analysis was used to correlate variables with a difficult or simple DS. Patient variables included in the multivariable model consisted of those with a p-value < 0.1 in the correlation analysis (Spearman’s rank correlation). |
Complex deep sedation |
|
Perez-Cuadrado-Robles. 2016; |
Endoscopic retrograde cholangiopancreatography; Patients received intravenous propofol as a single agent, fentanyl/midazolam or propofol combined with a small induction dose of midazolam as balanced propofol sedation. |
N=189 |
Multivariable logistic regression analysis was used to determine independent risk factors for difficult sedation using a backward selection method. The model was adjusted for age, sex and ASA score (ASA I-II and III-IV categories) |
Difficult sedation |
Results
Mortality during or after procedural sedation and analgesia
No studies reporting models predicting mortality during or after procedural sedation and analgesia are included in this literature analysis.
Complications during or after procedural sedation and analgesia
Validated models
Difficult sedation/high sedation requirement in patients undergoing Oesophagogastroduodenoscopy (OGD) and receiving received intravenous fentanyl, meperidine and midazolam:
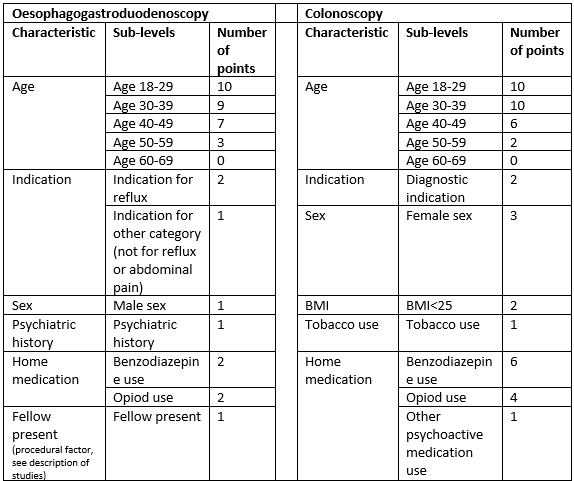
Braunstein (2014) presented a scoring system (SCOPE) including six relevant factors to predict risk of difficult sedation/high sedation requirement in patients undergoing OGD (see table 2). The proportions of patients having difficult sedation/requiring high sedation did not statistically differ (p>0.05) between the derivation and (internal) validation cohort (see table 3), but confidence intervals of proportions were not reported. The performance of the underlying model (see evidence table) was reported by a calculated area under the curve of 0.679. The working group classified the performance of this model as not acceptable.
Difficult sedation/high sedation requirement in patients undergoing colonoscopy and receiving received intravenous fentanyl, meperidine and midazolam:
Braunstein (2014) presented a scoring system (SCOPE) including six relevant factors to predict risk of difficult sedation/high sedation requirement in patients undergoing colonoscopy (see table 2). The proportions of patients having difficult sedation/requiring high sedation did not statistically differ (p>0.05) between the derivation and (internal) validation cohort (see table 3), but confidence intervals of proportions were not reported. The performance of the underlying model (see evidence table) was reported by a calculated area under the curve of 0.648. The working group classified the performance of this model as not acceptable.
Table 2: SCOPE scoring system for predicting risk of difficult sedation/high sedation requirement oesophagogastroduodenoscopy and colonoscopy
Table 3: Validation of the SCOPE scoring system predicting risk of difficult sedation/high sedation requirement for oesophagogastroduodenoscopy and colonoscopy
|
Derivation cohort |
|
Validation cohort |
||||
|
Class (sum of points) |
N (total) |
Proportion meeting outcome |
|
Class (sum of points) |
N (total) |
Proportion meeting outcome (validation cohort) |
|
Oesophagogastroduodenoscopy |
Oesophagogastroduodenoscopy |
|||||
|
I: 0-4 |
3961 |
8.5% |
I: 0-4 |
278 |
9.4% |
|
|
II: 5-7 |
1719 |
13.6% |
II: 5-7 |
129 |
20.2% |
|
|
III: 8-10 |
2340 |
20.6% |
III: 8-10 |
128 |
25.8% |
|
|
VI: 11-13 |
1903 |
25.8% |
VI: 11-13 |
82 |
30.4% |
|
|
V: 14+ |
78 |
34.6% |
V: 14+ |
3 |
66.6% |
|
|
Total |
10001 |
15.7% |
Total |
620 |
18.1% |
|
|
Colonoscopy |
Colonoscopy |
|||||
|
I: 0-5 |
8967 |
8.3% |
I: 0-5 |
578 |
9.3% |
|
|
II: 6-10 |
4575 |
14.1% |
II: 6-10 |
253 |
17.8% |
|
|
III: 10-15 |
1942 |
21.9% |
III: 10-15 |
96 |
17.7% |
|
|
VI: 16-19 |
580 |
28.6% |
VI: 16-19 |
31 |
29.0% |
|
|
V: 20+ |
56 |
53.6% |
V: 20+ |
2 |
100% |
|
|
Total |
16 |
12.5% |
Total |
960 |
13.2% |
|
Hypoxemia in patients undergoing endoscopy and receiving propofol alone or with low-dose etomidate:
Geng (2019) presented artificial neural network (ANN) model including three relevant factors (body mass index, habitual snoring and neck circumference) to predict hypoxemia in patients undergoing endoscopy. A five-fold cross validation (internal) was performed to prevent overtraining of the model. No effect sizes of the included factors were reported (see evidence table for univariate analysis). The performance scores of the model are presented in table 4. The working group classified the performance of this model performance as excellent.
Table 4: Performance of ANN model predicting hypoxemia in patients undergoing endoscopy
| Performance measure | ANN-model (n=220) |
| AUC (95%CI) | 0.80 ± 0.04 |
| Sensitivity | 14% |
| Specificity | 98% |
| Positive prediction value | 50% |
| Negative prediction value | 91% |
| Diagnostic accuracy (hypoxemia was predicted if the output was greater than or equal to 0.5) | 90% |
Unvalidated models
Cote (2010), Helhammer (2018) and Perez-Cuadrado-Robles (2016) presented multivariable models describing associations of patient characteristics and complications during the procedure. Details of the presented models are shown in Table 5.
Table 5: unvalidated models predicting complications during procedural sedation and analgesia
|
Study |
Outcome |
Predictors: |
Performance |
|
Cote (2010); N=231
|
Any airway maneuver |
STOP-BANG: |
Not reported |
|
Any sedation related complication |
STOP-BANG: |
Not reported |
|
|
Hypoxemia |
STOP-BANG: |
Not reported |
|
|
Helhammer (2018); N=68 |
Complex deep sedation |
BMI: OSAS: B: 1.680 (0.160 to 17.644) LV function: B: 0.969 (0.891 to 1.036) |
Univariate model as only BMI was statistically significant in the multivariable model:
BMI cut-off Sensitivity: 73%
BMI cut-off 35 kg/m2: |
|
Perez-Cuadro_Robles; (2016) N=189 |
Difficult sedation |
Model 1) OR 2.674 Consumption of opioids: (1.017 to 3.991)
Model 2) OR 2.323 Consumption of opioids: (1.251 to 4529) Age, sex, ASA score: OR not reported |
Not reported |
Level of evidence of the literature
As no comparable models were found (including similar procedures and outcome measures) models were graded individually.
Mortality during or after procedural sedation and analgesia
No level of evidence could be determined as no studies reporting models predicting mortality during or after procedural sedation and analgesia are included in this literature analysis.
Complications during or after procedural sedation and analgesia
Difficult sedation/high sedation requirement in patients undergoing oesophagogastroduodenoscopy (OGD) and receiving received intravenous fentanyl, meperidine and midazolam
The level of evidence regarding the outcome measure started at high and was downgraded to very low because of risk of bias (two levels, see evidence table), indirectness (one level, no external validation).
Difficult sedation/high sedation requirement in patients undergoing colonoscopy and receiving received intravenous fentanyl, meperidine and midazolam
The level of evidence regarding the outcome measure started at high and was downgraded to very low because of risk of bias (two levels, see evidence table) and indirectness (one level, no external validation).
Hypoxemia in patients undergoing endoscopy and receiving propofol alone or with low-dose etomidate
The level of evidence regarding the outcome measure started at high and was downgraded to very low because of risk of bias (one level, see evidence table), indirectness (one level, no external validation) and imprecision (only one study with relatively low numbers of patients and events).
Zoeken en selecteren
Preferably a systematic review of the literature measuring the effect of using a clinical decision model to decide whether clinical diagnostic evaluation has to be performed, compared to standard care, on the number of complications and mortality.
As such research is very rare and the working group did not expect to find such studies, a systematic review of the literature was performed to answer the following question: Which combination of patient characteristics predicts complications or mortality in patients undergoing procedural sedation analgesia?
P: Patients undergoing procedural sedation and analgesia.
I: Prediction model:
Outcome: mortality (for each procedure, within 30 days), complications (for each procedure, within 30 days).
Factors, at least one of the following: age, sex, ASA, physical status, comorbidity, BMI, OSAS, COPD, cardiovascular disease (coronary heart disease: previous CABG, PCI, myocardial infarction; heart failure; atrial fibrillation, having pacemaker or ICD), diabetes.
C: Other prediction model or no comparison
O: Model performance (discrimination parameters like area under the curve, sensitivity, specificity, predictive value).
T: Pre-procedure.
S: Preoperative screening (hospital, zelfstandige behandelcentrum, OK/buiten OK/functieafdeling).
Relevant outcome measures
The guideline development group considered area under the receiver operating characteristic (AUC) as a critical outcome measure for decision making and sensitivity, specificity and predictive values as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the performance of the included models as follows:
0.7≤AUC<0.8: acceptable,
0.8≤AUC<0.9: excellent,
AUC≥0.9: outstanding.
Prognostic research: Study design and hierarchy
When reviewing literature, there is a hierarchy in quality of individual studies. Preferably, the effectiveness of a clinical decision model is evaluated in a clinical trial. Unfortunately, these studies are very rare. If not available, studies in which prediction models are developed and validated in other samples of the target population (external validation) are preferred as there is more confidence in the results of these studies compared to studies that are not externally validated. Most samples do not completely reflect the characteristics of the total population, resulting in deviated associations, possibly having consequences for conclusions. Studies validating prediction models internally (e.g. bootstrapping or cross validation) can be used to answer the first research question as well, but downgrading the level of evidence is obvious due to risk of bias and/or indirectness as it is not clear whether models perform sufficiently in target populations. The confidence in the results of unvalidated prediction models is very low. Therefore, such models will not be graded. This is also applicable for association models. The risk factors identified from such models can be used to inform patients about the elevated risk on complications during procedural sedation and analgesia, however they are less suitable to be used in clinical decision making.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 2 February 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 3803 hits. Studies were selected based on the following criteria:
- Being a systematic review, randomized controlled trial (RCT) or observational study (cohort study).
- Reporting multivariable longitudinal association model or prediction model with outcome (mortality or complications periprocedural or within 30 days) as dependent variable and independent variables (patient characteristics) determined before the start of the procedure.
- Models do not take independent variables into account that were determined after the start of the procedure.
34 studies were initially selected based on title and abstract screening. After reading the full text, 29 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included. From these studies, only two studies reported validated models.
Results
A total of five studies was included in the analysis of the literature. Important study characteristics and results from two studies (Braunstein, 2014; Geng, 2019) are summarized in the evidence tables. The assessment of the risk of bias from those two studies is summarized in the risk of bias tables. Results of three other studies (Cote, 2010; Helhammer, 2018; Perez-Cuadrado-Robles, 2016) were not included in evidence and risk of bias tables and were not graded, as the reported models were not validated.
Referenties
- Braunstein, E. D., Rosenberg, R., Gress, F., Green, P. H., & Lebwohl, B. (2014). Development and validation of a clinical prediction score (the SCOPE score) to predict sedation outcomes in patients undergoing endoscopic procedures. Alimentary pharmacology & therapeutics, 40(1), 72-82. https://doi-org.saz.idm.oclc.org/10.1111/apt.12786
- Coté, G. A., Hovis, C. E., Hovis, R. M., Waldbaum, L., Early, D. S., Edmundowicz, S. A., Azar, R. R., Mullady, D. K., & Jonnalagadda, S. S. (2010). A screening instrument for sleep apnea predicts airway maneuvers in patients undergoing advanced endoscopic procedures. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 8(8), 660-665.e1. https://doi-org.saz.idm.oclc.org/10.1016/j.cgh.2010.05.015
- Geng, W., Tang, H., Sharma, A., Zhao, Y., Yan, Y., & Hong, W. (2019). An artificial neural network model for prediction of hypoxemia during sedation for gastrointestinal endoscopy. The Journal of international medical research, 47(5), 2097-2103. https://doi-org.saz.idm.oclc.org/10.1177/0300060519834459
- Hellhammer, K., Afzal, S., Tigges, R., Spieker, M., Rassaf, T., Zeus, T., Westenfeld, R., Kelm, M., & Horn, P. (2018). High body mass index is a risk factor for difficult deep sedation in percutaneous mitral valve repair. PloS one, 13(1), e0190590. https://doi-org.saz.idm.oclc.org/10.1371/journal.pone.0190590
- Pérez-Cuadrado Robles, E., González Ramírez, A., Lancho Seco, Á., Martí Marqués, E., Dacal Rivas, A., Castro Ortiz, E., González Soler, R., Álvarez Suárez, B., Tardáguila García, D., López Baz, A., Fernández López, A., & López Roses, L. (2016). Safety and risk factors for difficult endoscopist-directed ERCP sedation in daily practice: a hospital-based case-control study. Revista espanola de enfermedades digestivas : organo oficial de la Sociedad Espanola de Patologia Digestiva, 108(5), 240-245. https://doi-org.saz.idm.oclc.org/10.17235/reed.2016.4206/2016
- NVAVG (2014) Zorgaanbod van de AVG. Available from: https://nvavg.nl/wp-content/uploads/2014/03/Zorgaanbod-van-de-AVG-digitale-versie-website.pdf
Evidence tabellen
Evidence table for prediction modelling studies (based on CHARMS checklist)
|
Study reference |
Study characteristics |
Patient characteristics |
Candidate predictors |
Model development, performance and evaluation
|
Outcome measures and results |
Comments Interpretation of model |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Geng, 2019 |
Source of data1 and date: prospective cohort
Setting/ number of centres and country: Single centre: First Affiliated Hospital of Wenzhou Medical University
Funding and conflicts of interest: Funidng: This work was partly supported by the National Natural Science Foundation of China (81774109), Zhejiang Provincial Department of Education (Y201839270) and Wenzhou Science and Technology Plan Project (Y20180508). Delcaration of interest: None |
Recruitment method2: Not reported Inclusion criteria: - Between 5 July 2017 and 31 July 2017. - American Society of Anaesthesiologists (ASA) physical status I-III - Undergoing routine gastroscopy and/or colonoscopy examination.
Exclusion criteria: - Therapeutic endoscopy. - prior gastric or colonic resection - inadequate bowel preparation - severe pulmonary diseases before data collection - ASA class 4 or higher - lack of complete data availability
Treatment received? Routine gastroscopy and/or colonoscopy examination; 3L/min oxygen via a nasal cannula; propofol alone or with low-dose etomidate (deep sedation)
Participants: N=220
Mean age ± SD: 50±12 years
Sex: % M / % F 60.9% males
Other important characteristics:
Type of procedure (%): Only gastroscopy: 11.4% Only colonoscopy: 18.6% Combination: 70.0%
BMI (kg/m2):
Habitual snoring (N%): No hypoxemia: (67 (33.8%) P=0.006
Neck circumference (cm): Hypoxemia: 37.5 ± 2.8 No hypoxemia: 35.3 ± 4.0 P=0.014 |
Describe candidate predictors3 and method and timing of measurement:
Predictor 1: BMI Recorded for endoscopy; method not described.
Predictor 2: Habitual snoring Recorded for endoscopy (yes or no); defined as snoring on more than 3 nights a week.
Predictor 3: Neck circumference Recorded for endoscopy; method not described.
Number of participants with any missing value4? N (%): 0/not reported (excluded by forehand)
How were missing data handled5? Participants excluded
|
Development Modelling method6: A three-layered ANN model with three hidden nodes and a back propagation circuit was constructed. A five-fold cross validation was performed to prevent overtraining. The ANN was trained with maximum iterations of 500 and 10 tours. The overfit penalty was set at 0.001 and a convergence criterion of 0.00001 was selected. The ANN output was transformed to the range 0–1; hypoxemia was predicted if the output was greater than or equal to 0.5.
Performance Calibration measures7 and 95%CI: Using the prevalence value of hypoxemia (10% in this study) as the pre-test probability, a Fagan plot (Figure 3) indicated that the ANN model was clinically informative as it increased the probability of hypoxemia classification up to 50% when positive and lowered the probability to 9% when negative.
Discrimination measures8 and 95%CI: AUC: 0.80 ± 0.04
Classification measures9: Sensitivity: 14% Specificity: 98% Positive likelihood ratio: 9.00 Negative likelihood ratio: 0.88 Positive prediction value: 50% Negative prediction value: 91% Diagnostic accuracy: 90%
Evaluation Method for testing model performance10: internal validation
|
Type of outcome: single/combined?
Definition and method for measurement of outcome: Hypoxemia during endoscopy; a pulse oximetry reading <90% for any duration during the endoscopy procedure.
Endpoint or duration of follow-up: No follow-up (endpoint during procedure)
Number of events/outcomes: 22 (10%)
RESULTS Multivariable model11: Not reported
Alternative presentation of final model12: Univariate analysis:
|
Interpretation: An ANN model comprising BMI, habitual snoring and neck circumference was useful for prediction of hypoxemia during sedation for routine gastrointestinal endoscopy.
Comparison with other studies? No, first study. BMI: 0.74 ± 0.05; p<0.001 Habitual snoring: 0.65 ± 0.06; p<0.001 Neck circumference: 0.68 ± 0.05; p<0.001
Generalizability? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Braunstein, 2014 |
Source of data1 and date: retrospective
Setting/ number of centres and country:
Funding and conflicts of interest: Eric Braunstein is supported by the Columbia University College of Physicians and Surgeons Scholarly Projects Program Friedman Grant |
Recruitment method2: Extracted from electronic endoscopy record system. The database was queried between 1 October 2006 to 31 March 2013.
Inclusion criteria: - patients undergoing oesophagogastroduodenoscopy (OGD) or colonoscopy (if patient had more than one of each type of exam performed during the time period, only the first was included in the analysis)
Exclusion criteria: - procedures that were performed utilizing anaesthesia services for sedation - procedures in which diphenhydramine was administered
Treatment received? Oesophagogastroduodenoscopy (OGD) or colonoscopy. Patients received intravenous fentanyl, meperidine and midazolam in various combinations.
Participants: N= Mean age ± SD: Colonoscopy: 60.8 ± 12.7
Sex: % M / % F
|
Describe candidate predictors3 and method and timing of measurement:
Predictor 1: Age
Predictor 2: Sex Collected from the electronic endoscopy database.
Predictor 3: BMI Calculated from self-reported height and weight according to the formula BMI = weight/height2; divided into six groups
Predictor 4: Indication Because some procedures had more than one indication listed, and the study design necessitated a single indication for each procedure, the indication for the purposes of the study was assigned hierarchically. For OGD, in the order of priority for indication was acute gastrointestinal (GI) bleeding, abdominal pain, reflux/oesophagitis/Barrett’s surveillance and then other. For colonoscopy, in the order of priority was acute GI bleeding, diagnostic/other (including abdominal pain and nonacute bleeding), surveillance and then screening.
Predictor 5: Current or prior tobacco (vs. never) Collected from the electronic endoscopy database and routinely performed pre-procedure patient interview.
Predictor 6: Self-reported psych hx (vs. no psych hx) (a diagnosis of depression, anxiety disorders, or other psychiatric diagnoses) necessitated psychiatric history being studied as a binary variable.
Predictor 7: Home medications (vs. nonuse) Patient home medication use was obtained from the endoscopy database, and patients were classified as taking opioids, benzodiazepines and other psychoactive medications (anti-depressants and anti-psychotics). This was done by searching each patient’s medication list for a series of generic and brand names of the above classes of medications .
Predictor 8: In-patient admission status (vs. out-patient) Collected from the electronic endoscopy database.
Predictor 9: GI Fellow present during procedure (vs. not present)
Number of participants with any missing value4? N (%): Tobacco use: 14.2% Psychiatric history: 15.3% Medication use: 6%
How were missing data handled5? Not reported. |
Development Modelling method6: Multivariate logistic regression models. Variables that were found to meet statistical significance in logistic regression with the primary endpoint were retained and used to develop clinical prediction scores following the method outlined by Sullivan. Beta-coefficients from the logistic regression model were scaled and rounded to develop a point system for each procedure type.
Performance Calibration measures7 and 95%CI: Not reported
Discrimination measures8 and 95%CI: ROC: Colonoscopy: 0.648
Classification measures9: Not reported
Evaluation Method for testing model performance10: internal: system, the endoscopy database was queried for OGDs and colonoscopies performed during a subsequent time period: 1 April 2013 to 30 September 2013. These additional data were used to validate the clinical prediction scores by similarly calculating the prevalence of difficult sedation/high sedation requirement in each risk class. Test characteristics for each procedure type and risk class were compared between the derivation and validation cohorts using chi-square and Fisher exact tests.
|
Type of outcome: single/combined?
Definition and method for measurement of outcome:
Endpoint or duration of follow-up: No follow-up (endpoint during procedure)
Number of events/outcomes: OGD: 1704 (12.4%) Colonoscopy: 2299 (10.6%)
RESULTS Multivariable model11: OGD:
Colonoscopy:
Alternative presentation of final model12: Stratifying Clinical Outcomes Prior to Endoscopy (SCOPE) scoring system
OGD:
Class (proportions meeting primary outcome derivation/validation cohort): * Proportions meeting the primary outcome were not significantly different in the derivation and validation cohorts (P > 0.05)
Colonoscopy:
Class (proportions meeting primary outcome derivation/validation cohort): I: 0-5 (8.3%/9.3%) IV: 16-19 (28.6%/29.0%) V: 20+ (53.6%/100%) * Proportions meeting the primary outcome were not significantly different in the derivation and validation cohorts (P > 0.05)
An online SCOPE score calculator has been developed and is available at the following URL: http://www.columbia.edu/~bl114/scope
|
Interpretation: “we have identified several risk factors for difficult sedation for endoscopic procedures and developed a clinical prediction score, the SCOPE score, which can be used to risk-stratify patients for agitation or high sedation requirement. ”
Comparison with other studies? -
Generalizability? who received anaesthesiologist-administered sedation were not included in the analysis. Over the study period, approximately 12.5% of procedures were performed utilizing anaesthesia services, including patients with cardiovascular or other comorbidities that mandated additional monitoring. “ |
Table of quality assessment – prediction modelling studies
(The criteria used in this checklist are based on PROBASTA version 15/05/2019)
|
Study reference (first author, year of publication)
Classification1
|
Participant selection 1) Appropriate data sources?2 2) Appropriate in- and exclusion?
Risk of bias: low/high/unclear |
Predictors 1) Assessed similar for all participants? 2) Assessed without knowledge of outcome? 3) Available at time the model is intended to be used?
Risk of bias: low/high/unclear |
Outcome 1) Pre-specified or standard outcome definition? 2) Predictors excluded from definition? 3) Assessed similar for all participants? 4) Assessed without knowledge of predictors? 5) Time interval between predictor and outcome measurement appropriate?
Risk of bias: low/high/unclear |
Analysis 1) Reasonable number of participants with event/outcome? 2) All enrolled participants included in analysis? 3) Missing data handled appropriately? 4) No selection of predictors based on univariate analysis? 5) Relevant model performance measures evaluated appropriately?3 6) Accounted for model overfitting4 and optimism? 7) Predictors and weights correspond to results from multivariate analysis?
Risk of bias: low/high/unclear |
Overall judgment
High risk of bias: at least one domain judged to be at high risk of bias.
Model development only: high risk of bias.
Risk of bias: low/high/unclear |
|
Geng, 2019
Development of model only |
Unclear
(Unclear whether consecutive participants were enrolled.)
|
Unclear, probably low
(Recorded before endoscopy, but methods for recording were not clearly defined. However measurements are probably standard measurements.) |
Unclear, probably high
(Methods for recording were not clearly defined, but are probably standard measurements. However, assessor might be aware of BMI and neck circumference.) |
High
(Relatively low number of patients with event/outcome; patients with missing data were excluded; selection based on univariate analysis; builded model was not presented.) |
High risk of bias |
|
Braunstein, 2014 |
Low
(Retrospective study with data selected from an electronic database (assuming to be filled prospectively) with clear in- and exclusion criteria.) |
Low
(Data recorded from routine interviews, prior to intervention. Note that GI fellow present cannot be known before executing the procedure, but this variable had only low impact on the total score.) |
High
(Methods were clearly defined. Assessor of outcome might be aware of BMI, age end sex.)
|
High
It is unknown how missing data was handled and whether participants with missing data were included in the analysis. No account for model overfitting was described. |
High risk of bias |
A Wolff RF, Moons KGM, Riley RD, Whiting PF, Westwood M, Collins GS, Reitsma JB, Kleijnen J, Mallett S; PROBAST Group. PROBAST: A Tool to Assess the Risk of Bias and Applicability of Prediction Model Studies. Ann Intern Med. 20191;170(1):51-58. doi: 10.7326/M18-1376. PubMed PMID: 30596875.
1 Development of model only / Development and external validation of model / External validation of model
2 Cohort, RCT or nested case-control study
3 E.g. calibration (total O:E ratio; expected outcome probabilities versus observed outcome frequencies) and discrimination (range 0.5 (no discriminative ability) to 1.0 (perfect discriminative ability)
4 Overfitting: for low ORs the predicted probability is too low, for high ORs the predicted probability is too high. Correcting is possible with shrinkage.
Exclusietabel
|
Author and year |
Reason for exclusion |
|
Taylor 2011 |
wrong timing (procedureal factors included) |
|
Nagels 2014 |
univariate analysis |
|
Jacques 2011 |
wrong timing (procedureal factors included) |
|
Cho 2020 |
wrong timing (procedureal factors included) |
|
Ma 2007 |
wrong timing (procedureal factors included) |
|
Wehrmann 2008 |
wrong timing (procedureal factors included) |
|
Cha 2013 |
wrong timing (procedureal factors included) |
|
Hung 2016 |
wrong timing (procedureal factors included) |
|
Choi 2020 |
wrong timing (procedureal factors included) |
|
Feng 2019 |
full-tekst not available |
|
Banno 2018 |
cross-sectional study design |
|
Aikawa 2020 |
wrong timing (procedureal factors included) |
|
Muller 2004 |
wrong timing (procedureal factors included) |
|
Yoshikawa 2013 |
wrong timing (procedureal factors included) |
|
Tae 2014 |
wrong timing (procedureal factors included) |
|
Gokhale 2016 |
wrong timing (procedureal factors included) |
|
Gemma 2016 |
wrong timing (procedureal factors included) |
|
Cho 2019 |
wrong timing (procedureal factors included) |
|
Conway 2019 |
wrong timing (procedureal factors included) |
|
Taipale 2009 |
wrong timing (procedureal factors included) |
|
Luzon-Solanas 2018 |
Spanish language |
|
Kuypers 2011 |
wrong timing (procedureal factors included) |
|
Jirapinyo 2014 |
wrong outcome (sedation doses) |
|
Jones 2018 |
univariate analysis |
|
Garrido 2014 |
wrong patient & outcome |
|
Teipel 2018 |
wrong timing (follow-up factors included) |
|
Karamnov 2017 |
wrong timing (procedureal factors included) |
|
Khoi 2015 |
wrong timing (procedureal factors included) |
|
Green 2015 |
comparison PSA vs no PSA |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 23-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij volwassen patiënten.
Werkgroep
- Prof. dr. B. Preckel (voorzitter), anesthesioloog, Amsterdam UMC locatie AMC, NVA
- dr. C.R.M. Barends, anesthesioloog, UMCG, NVA
- L.R.M. Braam, BSc. Sedatie Praktijk Specialist, Catharina Ziekenhuis, NVAM
- drs. R. Brethouwer, abortusarts, Beahuis & Bloemenhovekliniek Heemstede, NGvA
- dr. J.M. van Dantzig, cardioloog, Catharina Ziekenhuis, NVVC
- drs. V.A.A. Heldens, anesthesioloog, Maxima MC, NVA
-
dr. C. Heringhaus, SEH-arts/anesthesioloog, LUMC (t/m 12-2022), Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ (vanaf 01-2023), NVSHA
- T. Jonkergouw, MA. Adviseur Patiëntbelang, Patiëntenfederatie Nederland (tot april 2023)
- Broere, M. Junior beleidsadviseur, Patiëntenfederatie Nederland (vanaf april 2023)
- dr. M. Klemt-Kropp, MDL-arts, Noordwest Ziekenhuisgroep, NVMDL
- drs. B.M.F. van der Leeuw, anesthesioloog, Albert Schweitzer ziekenhuis, NVA
- S. Reumkens, MSc. Physician Assistant, Diakonessenhuis, NAPA
Klankbordgroep
- drs. T.E.A. Geeraedts, radioloog, Erasmus MC, NVvR
- drs. J. Friederich, gynaecoloog, Noordwest Ziekenhuisgroep, NVOG
- dr. E.H.F.M. van der Heijden, longarts, Radboud UMC, NVALT
- drs. J. de Hoog, oogarts, Amsterdam UMC locatie AMC, NOG
- drs. A. Kanninga, arts voor verstandelijk gehandicapten, Cordaan, NVAVG
- drs. H.W.N. van der Pas, tandarts, UMC Utrecht, VMBZ
- dr. ir. C. van Pul, klinisch fysicus, Maxima MC, NVKF
- dr. R.J. Robijn, MDL-arts, Rijnstate, NVMDL
- drs. W.S. Segers, klinisch Geriater, Catharina Ziekenhuis, NVKG
- Prof. dr. A. Visser, hoogleraar geriatrische tandheelkunde, UMCG en Radboud UMC, KNMT
Met ondersteuning van:
- dr. L. Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten
- drs. I. van Dusseldorp, senior literatuurspecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Preckel |
Anesthesioloog, hoogleraar anesthesiologie (in het bijzonder veiligheid in het perioperatieve proces) Amsterdam Universitair Medische Centra locatie AMC |
Onbetaalde nevenwerkzaamheden – commissie-werkzaamheden:
Lid Patient Safety and Quality Committee of the European Society of Anesthesiologists;
Lid Patient Safety Committee van de World Federation of Societies of Anesthesiologists;
Lid Raad Wetenschap en Innovatie van de Federatie Medisch Specialisten FMS;
Lid Commissie Wetenschap & Innovatie van de Nederlandse Vereniging voor Anesthesiologie NVA
Representative Council European Association of Cardiothoracic Anesthesiology and Intensive Care (EACTAIC)
Hoger leidinggevend personeel (penningmeester) van de “Stichting ter bevordering van de wetenschap en opleiding in de anesthesiologie”;
|
Research grants: European Society of Anesthesiology and Intensive Care ESAIC ZonMw NovoNordisk Netherland
Advisory board Sensium Healthcare United Kingdom
Geen van de gemelde belangen heeft relatie met het onderwerp van het advies/de richtlijn
|
Geen actie vereist |
|
Barends |
Anesthesioloog in het Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie vereist |
|
Braam |
Sedatiepraktijkspecialist Catharina Ziekenhuis Eindhoven |
Lid sedatie commissie NVAM (onbetaald) |
Geen |
Geen actie vereist |
|
Brethouwer |
Abortusarts te Beahuis & Bloemenhovekliniek (0,56 fte) en SAA (0,22 fte), Medisch coördinator Beahuis&Bloemenhovekliniek (0,33 fte) |
Penningmeester van het Nederlands Genootschap van Abortusartsen (onbetaald) Voorzitter landelijke werkgroep PSA van het NGvA (onbetaald) Bestuurslid van FIAPAC, een Europese abortus organisatie (onbetaald) |
Geen |
Geen actie vereist |
|
Broere |
Junior beleidsadviseur Patiëntenbelang - fulltime |
geen |
geen |
Geen actie vereist |
|
van Dantzig |
Cardioloog vrij gevestigd, Catharina Ziekenhuis 100% |
Lid Plenaire Visitatie Commissie NVVC (onbetaald) |
Op onze afdeling wordt extern gefinancierd onderzoek uitgevoerd maar niet op het gebied van de werkgroep. |
Geen actie vereist |
|
Heldens |
Anesthesioloog Maxima MC |
Geen |
Geen |
Geen actie vereist |
|
Heringhaus |
Vanaf 01-2023 Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ
t/m 12-2022 SEH-arts KNMG |
Trainingen voor verschillende onderwerpen gerelateerd aan acute zorg, hyperbare geneeskunde, PSA |
Geen |
Geen actie vereist |
|
Jonkergouw |
Junior beleidsadviseur - Patiëntenfederatie Nederland - 32 tot 36 uur per week |
Vrijwilliger activiteiten - Diabetes Vereniging Nederland - Zeer incidenteel |
Geen |
Geen actie vereist |
|
Klemt-Kropp |
MDL-arts, Noordwest Ziekenhuisgroep Alkmaar - Schagen - Den Helder (0.9 fte) |
Secretaris Concilium Gastroenterologicum, NVMDL tot 11 april 2022 (niet betaald) Voorzitter PSA commissie NVMDL (niet betaald) Docent Teach the Teacher AUMC en Noordwest Ziekenhuisgroep cursussen voor aios en medisch specialisten (betaalde functie, ongeveer 40 Std. per jaar)
Voorzitter Stichting MDL Holland-Noord (KvK 56261225) vanaf okt. 2012 t/m 31-12-2019. De stichting heeft in de laatste 3 jaar grants ontvangen van de farmaceutische industrie en van de farmaceutische industrie gesponsorde onderzoeken gefaciliteerd:
1. Ondersteuning optimalisering van zorg voor IBD-patiënten. Therapeutic drugmonitoring en PROMs bij patiënten met IBD. Zorgverbetertraject. PhD student, looptijd van 2015 tot op heden. Tot 2018 grant van Dr. Falk Pharma. vanaf 2018 grant van Janssen Cilag Geen relatie met sedatie 2.Retrieval of patients chronically infected with Hepatitis B or Hepatitis C in Northern Holland. Afgesloten 2018. Project gefinancierd met grant van Gilead. Geen relatie met sedatie 3. SIPI. Screening op Infectieuze aandoeningen in Penitentiaire Inrichtingen. Project gefinancierd met grants van AbbVie, MSD en Gilead. Project begin 2019 afgesloten. Geen relatie met sedatie 4. 3DUTCH trial. Een observationeel onderzoek naar de effectiviteit van een behandeling van chronische hepatitis C met een combinatie van de antivirale middelen ombitasvir - paritaprevir /ritonavir, ± dasabuvir, ± ribavirine. Sponsor AbbVie. Studie afgesloten Jan. 2018 Geen relatie met sedatie 5. Remsima switch IFX9501 - An open-label, multicenter, non- inferiority monitoring program to investigate the quality of life, efficacy and safety in subjects with Crohn’s Disease (CD), Ulcerative Colitis (UC) in stable remission after switching from Remicade® (infliximab) to Remsima® (infliximab biosimilar) L016-048. Sponsor: Munipharma. Afgelsoten augustus 2018. Geen relatie met sedatie 6. NASH - NN9931-4296 Investigation of efficacy and safety of three dose levels of subcutaneous semaglutide once daily versus placebo in subjects with non-alcoholic steatohepatitis L016-061. Sponsor NovoNordisk. Studie afgesloten Feb. 2020. Geen relatie met sedatie 7. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Induction Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 305). SHD-647-305. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 8. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Maintenance Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 307). SHD-647-307. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 9. Estimating the prevalence of advanced liver fibrosis in a population cohort in care in Northern-Holland with the use of the non-invasive FIB-4 index. Grant van Gilead. Onderzoek afgesloten sept. 2019. Geen relatie met sedatie |
Incidenteel deelname aan advisory boards van de farmaceutische industrie (Gilead, Janssen Cilag, AbbVie: (hepatologische onderwerpen, vooral hepatitis C) Incidenteel voordrachten tijdens symposia gesponsord van de farmaceutische industrie (Gilead, AbbVie)
|
Geen actie vereist; meeste studies afgerond; nr. 1,7,8 lopen. Sponsoren (Dr. Falk Pharma & Shire) hebben geen relatie met sedatie. |
|
Reumkens |
Physician Assistant Anesthesiologie Radboud UMC |
Voorzitter vakgroep PA Anesthesiologie NAPA |
Geen |
Geen actie vereist |
|
Van der Leeuw |
Anesthesioloog |
Geen |
Geen |
Geen actie vereist |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Robijn |
Mdl arts rijnstate ziekenhuis Arnhem |
Geen |
Geen |
Geen actie vereist |
|
Van der Heijden |
Longarts |
Voormalig Secretaris Sectie Interventie longziekten NVALT (onbezoldigd)
Lid Board of National Delegates European Association of Bronchology and International Pulmonology (namens NL, onbezoldigd)
|
Buiten het veld van deze richtlijn heeft mijn afdeling de afgelopen 3 jaar vergoedingen ontvangen voor de volgende activiteiten: - unrestricted research grants: Pentax Medical Europe, Philips, Astra Zeneca, Johnson&Johnson. - adviseur / consultant: Pentax Medical, Philips IGT, Johnson&Johnson. - spreker: Pentax Medical. |
Geen actie vereist |
|
Van der Pas |
Tandarts, UMC Utrecht |
Commissielid Horace Wells van de KNMT, stimulatie van de intercollegiale samenwerking bij tandheelkundige behandeling van bijzondere zorggroepen met farmacologische ondersteuning. Onbetaald. Voormalig commissielid Bijzondere Zorggroepen van de KNMT, toegankelijkheid van mondzorg voor kwetsbare zorggroep. Betaald via vacatiegelden. Gastdocent opleiding mondzorgkunde HU. Lezing mondzorg aan mensen met een verstandelijke beperking. Betaald. Gastdocent opleiding verpleegkundig-specialist GGZ. Lezing mondzorg in de geestelijke gezondheidszorg Betaald. Cursusleider lichte sedatie in de mondzorg, BT Academy. Meerdaagse cursus voor tandartsen en mondhygienisten om zich te bekwamen in lichte sedatie, m.n. training in de inhalatiesedatie met lachgas-zuurstof mengsel middels titratietechniek. Betaald. |
Geen |
Geen actie vereist |
|
De Hoog |
Oogarts in Amsterdam UMC (0,2 fte.) en Retina Operatie Centrum Amstelveen (0,4 fte.). Medisch manager Retina Operatie Centrum (0,2 fte.) |
Voorzitter Werkgroep Vitreoretinale Chirurgie Nederland (onbetaald) Lid redactieraad vaktijdschrift 'De Oogarts', uitgave van BPM-medica (onbezoldigd) Medeorganisator Eilanddagen (bijscholing uveïtis voor oogartsen, onbetaald) |
Geen |
Geen actie vereist |
|
Geeraedts |
Interventieradioloog Afdeling Radiologie en Nucleaire geneeskunde Erasmus Medisch Centrum, Rotterdam |
Geen |
Geen |
Geen actie vereist |
|
Van Pul |
Klinisch fysicus in Maxima Medisch Centrum |
Universitair Hoofd Docent aan de Technische Universiteit van Eindhoven (0,2 fte). Daar supervisor van PhD studenten bij HTSM (NWO-TTW gesubsidieerd) project waaraan ook een industriële partner deelneemt (https://www.nwo.nl/projecten/15345-0).
|
Geen |
Geen actie vereist |
|
Friederich |
Gynaecoloog NWZ Den Helder, Algemeen gynaecoloog met als aandachtsgebieden benigne gynaecologie, minimaal invasieve chirurgie en bekkenbodemproblematiek |
Vicevoorzitter calamiteitencommissie NVZ lid klachtencommissie NWZ Den Helder |
Geen |
Geen actie vereist |
|
Segers |
Klinisch geriater, St. Jans Gasthuis, Weert
|
Klinisch farmacoloog in opleiding, Catharina ziekenhuis, Eindhoven Onbetaald |
Geen |
Geen actie vereist |
|
Kanninga |
Arts Verstandelijk Gehandicapten (arts VG) bij Cordaan Amsterdam Anesthesioloog niet praktiserend |
Geen |
Geen |
Geen actie vereist |
|
Visser |
Hoogleraar geriatrische tandheelkunde fulltime (1 fte) - Afdeling Gerodontologie, Centrum voor Tandheelkunde en Mondzorgkunde, Universitair Medisch Centrum Groningen, Rijksuniversiteit Groningen, Nederland - Afdeling Gerodontologie, Faculteit Tandheelkunde, Radboud UMC, Radboud Universiteit Nijmegen, Nederland |
Geen |
Geen |
Geen actie vereist |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. Aanvullend heeft een afgevaardigde van de Patiëntenfederatie Nederland deelgenomen in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming gedaan of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie ook het hiervoor gebruikte stroomschema dat als uitgangspunt voor de beoordeling is gebruikt).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn. Een overzicht van uitkomsten van de kwalitatieve raming met bijbehorende toelichting vindt u in onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Risicofactoren |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Obstetrie en Gynaecologie, Nederlandse Vereniging voor Cardiologie, de Nederlandse Vereniging van Maag-Darm-Leverartsen, de Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied, de Nederlandse Vereniging voor Intensive Care, de Nederlandse Internisten Vereniging, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, het Nederlands Genootschap van Abortusartsen, de Nederlandse Vereniging van Anesthesiemedewerkers, de Verpleegkundigen & Verzorgenden Nederland, de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie, de Vereniging Mondzorg voor Bijzondere Zorggroepen, Stichting Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd en de Vereniging van Artsen voor Verstandelijk Gehandicapten via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.