Expiratoire CO2 monitoring
Uitgangsvraag
Wat is de plaats van expiratoire CO2 monitoring tijdens PSA, het post procedurele transport en in de verkoeverperiode?
Aanbeveling
Gebruik geen capnografie voor intentionele anxiolyse/lichte sedatie.
Overweeg het gebruik van capnografie voor intentionele matige tot diepe sedatie bij:
- moeilijk visueel controleerbare patiënten;
- hoog-risico patiënten (ASA III en hoger).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de effecten van capnografie monitoring tijdens procedurele sedatie en/of analgesie (PSA) en in de ontwaakfase.
Veiligheid van PSA was gedefinieerd als cruciale uitkomstmaat. Op basis van de literatuur kan geconcludeerd worden dat milde en ernstige hypoxemie mogelijk minder vaak voorkomt wanneer patiënten worden gemonitord met capnografie ten opzichte van standaard monitoring. Er is geen bewijs gevonden dat capnografie monitoring een effect heeft op vermindering van de incidentie van apneu ten opzichte van standaard monitoring tijdens PSA.
Voor de belangrijke uitkomstmaten kwaliteit en effectiviteit van PSA, evenals voor de tevredenheid van de patiënt is bewijskracht zeer laag, waardoor voor deze uitkomstmaten geen richting kan worden geven aan de besluitvorming.
PSA veroorzaakt een vermindering van het bewustzijn en pijnbeleving bij een medische verrichting en verhoogt het patiëntcomfort. Er is een gering risico op sedatie gerelateerde complicaties. Dit risico is afhankelijk van het sedatieniveau en behelst vooral hypoxie veroorzaakt door hypoventilatie en/of ademwegobstructie. Tevens komen hartritmestoornissen en hypotensie voor. Klinische observatie van de ventilatie en de circulatie tijdens PSA is onvoldoende en er heerst brede consensus dat standaard monitoring van een patiënt tijdens sedatie, maar ook in de ontwaakfase na PSA, bestaat uit continue pulsoximetrie en automatische bloedrukmeting.
Capnografie kan, vooral bij patiënten na preoxygenatie voorafgaand aan de start van de sedatie, insufficiënte ademhaling eerder detecteren dan pulsoximetrie en zou daarom meerwaarde kunnen hebben bij de monitoring tijdens PSA. Met name bij de combinatie van matige tot diepe sedatie bij hoog risicopatiënten en een hoge kans op ademdepressie, of bij onvoldoende mogelijkheden voor klinische observatie van een patiënt, is capnografie aan te bevelen. Als hoog risicopatiënten worden in het algemeen patiënten met een ASA physical status van III en hoger beschouwd. Bij intentioneel lichte sedatie/anxiolyse blijft capnografie zonder meerwaarde. Ook bij zeer korte ingrepen (enkele minuten) onder intentioneel matige tot diepe sedatie heeft de capnografie geen toegevoegde waarde bij het detecteren van klinisch relevante hypoxemie.
Met de capnografie wordt uitgeademde kooldioxide gemeten en als grafiek in golfvorm per respiratiecyclus weergegeven. De meting wordt gebruikt voor de detectie van trends in het niveau van uitgeademde kooldioxide. Capnografie vermindert zowel milde alsook ernstige hypoxemie bij patiënten die PSA ondergaan (Saunders, 2017; Brady, 2017; Ishiwata, 2018; Lin, 2017; Peverling-Oberlag, 2020). Met capnografie is er een geringere kans op de noodzaak voor tijdelijke ademondersteuning bij hypoxemie met masker en ambu (Li, 2018), alhoewel deze incidenten niet in alle studies uniform gedefinieerd zijn. De incidentie van apnoe wordt echter door capnografie niet verminderd. Er zijn geen studies die onderzochten of het toevoegen van capnografie bij de monitoring een effect heeft op harde eindpunten zoals morbiditeit en mortaliteit die primair relevant zijn bij onderzoeken naar patiëntveiligheid van medische procedures. Tevens is er onvoldoende bewijs dat tijdelijke hypoxemie tijdens sedatie ernstige lange termijn complicaties kan veroorzaken, maar het is ook niet helemaal uitgesloten dat dit impact zou kunnen hebben op het resultaat van een behandeling (Ehrenfeld, 2010). Zo is de opnameduur bij patiënten met tijdelijke hypoxemie tijdens narcose perioperatief significant langer dan die van patiënten zonder deze ongewenste gebeurtenis (Durham, 2014). De impact van hypoxemie episoden tijdens PSA op het behandelresultaat zou belangrijk kunnen zijn, maar moet nog nader bepaald worden. Er is geen effect van capnografie aangetoond op verbetering van de effectiviteit van PSA of verhoging van patiëntcomfort. Als maat voor de effectiviteit van de PSA is in de studies de totale propofol dosis gebruikt. De verschillen tussen de groepen met of zonder capnografie waren minimaal (5%) en het is onduidelijk wat de relevantie van een geringere propofol dosis is bij de beoordeling van de effectiviteit van PSA (Li 2018, Peveling-Oberlag 2020).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Cruciaal voor de patiënt is een zo veilig mogelijke sedatie. Echter, een patiënt is niet gebaat bij monitoring en genereren van meetwaarden die zonder klinische consequenties blijven en de veiligheid van een procedure niet significant verhogen; een ‘kunst om de kunst’, of monitoring omdat het mogelijk is. Het plaatsen van meetapparatuur, zoals een nasale canule voor de capnografie of de aanwezigheid van ecg-elektrodes bij de voorbereiding van of in de ontwaakfase na PSA veroorzaakt zeker geen significante bijwerkingen, maar kan door sommige patiënten als onaangenaam worden ervaren. Onnodige monitoring bij PSA verhoogt de kosten voor zorginstellingen en kan zelfs invloed hebben op de kostencalculatie van zorgverzekeraars.
Kosten (middelenbeslag)
Aanschaf en onderhoud van capnografie-apparatuur, de noodzakelijke bijscholing en eventueel extra technische hulpmiddelen (zoals programma’s voor machinaal leren) vergen extra personeel inzet en kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen onderzoek gedaan naar de haalbaarheid van algemeen
gebruik van capnografie en de kosten hiervan ten opzichte van de theoretische verbetering van de veiligheid van de PSA. Het is aannemelijk dat inzet van extra monitoring zou kunnen leiden tot vertraging van de gehele procedure PSA, vooral door aan- en afsluiten en testen van de apparatuur.
Aanvullende overwegingen
De interpretatie van capnografie is moeilijk. Deze is gebaseerd op de visuele analyse van de grafische curve door een zorgverlener. Er is significante variabiliteit bij de interpretatie van afwijkende capnografiecurves en bij de definitie van een normale uitgangswaarde. De juiste interpretatie van capnografiecurves vergt extra bijscholing en ervaring. In de praktijk wordt tegenwoordig onderzoek gedaan of machinaal leren de nauwkeurigheid van interpretatie kan verbeteren. Ten aanzien van de matige meerwaarde van capnografie als aanvullende monitoring bij anxiolyse/lichte sedatie en de geringe incidentie van klinisch relevante, ernstige hypoxemie tijdens lichte PSA zonder duidelijke vermindering van cruciale uitkomstmaten met betrekking tot de patiëntveiligheid lijkt standaardgebruik van capnografie bij anxiolyse/lichte sedatie niet gerechtvaardigd (Mohr, 2018). Wel is er een mogelijke meerwaarde bij intentionele matige tot diepe sedatie bij moeilijk visueel te controleren patiënten. In deze situatie valt aanvullende monitoring met capnografie te overwegen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er zijn geen data die het voordeel van routinematig gebruik van capnografie bewijzen. Ten aanzien van de extra kosten voor capnografie, de moeilijke interpretatie van de capnografie curve en de matige meerwaarde voor de veiligheid van PSA geeft de werkgroep volgende aanbevelingen.
Onderbouwing
Achtergrond
In de vorige richtlijn werd beschreven dat capnografie in de toekomst een belangrijkere plaats in zou kunnen nemen bij vroege detectie van ademdepressies en luchtwegobstructie. Dit dient met de huidige ervaring en beschikbare literatuur opnieuw onderzocht te worden.
Conclusies / Summary of Findings
Safety
|
Moderate GRADE |
It is likely that capnography monitoring results in a lower incidence of mild hypoxemia compared to standard monitoring in patients undergoing PSA.
Sources: Brady, 2017; Ishiwata, 2018; Lin, 2017; Peverling-Oberlag, 2020; Saunders, 2017; |
|
Moderate GRADE |
It is likely that capnography monitoring results in a lower incidence of severe hypoxemia compared to standard monitoring in patients undergoing PSA.
Sources: Brady, 2017; Ishiwata, 2018; Peverling-Oberlag, 2020; Saunders, 2017 |
|
Moderate GRADE |
It is likely that capnography monitoring has no effect on the incidence of apnoea compared to standard monitoring in patients undergoing PSA.
Sources: Li, 2018; Peverling-Oberlag, 2020; Saunders 2017 |
Quality & effectiveness PSA
|
Very low GRADE |
It is unclear whether capnography monitoring results in a better procedural success rate compared to standard monitoring in patients undergoing PSA.
Sources: Peveling-Oberlag, 2020 |
|
Very low GRADE |
It is unclear whether capnography monitoring results in a different dose of sedation drugs compared to standard monitoring in patients undergoing PSA.
Sources: Li, 2018; Lin 2017; Peveling-Oberlag, 2020 |
Patient satisfaction
|
Very low GRADE |
It is unclear whether capnography monitoring results in higher patient satisfaction compared to standard monitoring in patients undergoing PSA.
Sources: Ishiwata, 2018; Li, 2018; Lin 2017 |
Samenvatting literatuur
Summary of literature
1. Capnography monitoring
Description of studies
Saunders (2017) conducted a systemic review and meta-analysis investigating the effect of capnography monitoring on sedation-related adverse events during PSA administered for ambulatory surgery relative to visual assessment and pulse oximetry alone. Saunders (2017) covers the literature until January 2015 and searches were conducted in Literature searches were conducted in PubMed, the Cochrane Library and EMBASE. Saunders (2017) included only randomized controlled trials in patients receiving sedation during ambulatory surgery and in which visual assessment of ventilation and pulse oximetry monitoring (control) was compared with control plus capnography (intervention). In total, 13 RCTs were included that reported on 14 patient groups (one study by Meta (2016), provided separate data on colonoscopy and esophagogastroduodenoscopy), with a total of 5475 patients undergoing sedation. Assessment of article quality was conducted on a study (as opposed to outcome) level using a modified Jadad score. The Jadad score assesses studies based on their design (randomised and blinded) and their reporting (all patients accounted for) and included additional data on endpoint definitions, patient population, hospital location at which patients underwent sedation and the staff responsible for monitoring. In line with the Jadad score, items related to trial design could score up to twice as highly as items relating to trial reporting. The reporting of the inclusion/exclusion criteria and endpoint definitions scored one point each, and reporting the location of sedation, and the monitoring staff scored half-point each, making the maximal score 8 (high quality) and minimum score 0 (low quality).
Brady (2017) conducted an RCT assessing if adding capnography to standard monitoring during conscious sedation with midazolam would decrease the incidence of hypoxaemia. All patients received standard monitoring and capnography but were randomised to whether staff could view the capnography data (intervention) or were blinded to it (control). In total, 97 patients (mean age 31.5±12.5 years, 36% male, BMI 24.4±4.2 kg/m2) were randomized to the control group and 93 patients (mean age 31.2±12.7 years, 26% male, BMI 24.5±3.7 kg/m2) were randomized to the intervention group. Outcomes were any occurrence of hypoxemia (defined as oxygen saturation (SpO2) ≤94% of any duration) and the degree of hypoxemia.
Ishiwata (2017) conducted an RCT which determines the benefit of additional EtCO2 monitoring in reducing the incidence of hypoxemia during flexible bronchoscopy (FB) in patients under sedation. Patients undergoing FB under moderate sedation without tracheal intubation were randomly assigned to receive standard monitoring including pulse oximetry (Control) or additional capnography monitoring (Intervention). Bronchoscopy examiners for the only capnography group were informed of apnoea events by alarms and display of the capnography monitor. In total, 94 patients (mean age 66.2±13.4 years, 63% male, BMI 22.1±3.8 kg/m2) were randomized to the control group and 91 patients (mean age 67.1±11.0 years, 61% male, BMI 22.3±3.8 kg/m2) were randomized to the intervention group. Outcomes were incidence of hypoxemia (defined as SpO2 ≤90%), duration of hypoxemia, incidence of severe hypoxemia (SpO2 < 85%), lowest SpO2 value, incidence of bradycardia and hypotension as complications, interventions against apnoea or hypoxemia episodes, and patient tolerance to FB. Patient tolerance to FB was measured by a questionnaire including a visual analogue scale using a horizontal 100-mm-long line between 0 for no discomfort and 100 for worst possible discomfort.
Peveling-Oberlag (2020) conducted an RCT which investigates the number of episodes of hypoxemia during percutaneous endoscopic gastrostomy (PEG) placement with propofol sedation comparing standard monitoring (control) versus standard monitoring with additional capnography surveillance (intervention). Patients were prospectively randomized in a 1:1 ration to either the standard monitoring group or the capnography group. Capnography was performed for all patients but was blinded for the endoscopic team in the standard monitoring group. In total, 74 patients (mean age 66.8±11.5 years, 68% male, BMI 23.9±5.7 kg/m2) were randomized to the control group and 73 patients (mean age 65.4±12.7 years, 66% male, BMI 23.4±4.7 kg/m2) were randomized to the intervention group. Outcomes were incidence of hypoxemia (defined as SpO2 ≤90% for 15 seconds or more), incidence of severe hypoxemia (SpO2 ≤85%, regardless of duration), episodes of apnoea (EtCO2 at 0 mmHg for > 10 s), bradypnea (respiratory rate < 5/min), incidence of hypotension (systolic blood pressure <100mmHg), incidence of hypertension (systolic blood pressure > 140 mmHg), incidence of bradycardia (heart rate < 50 beats/min), and periprocedural mortality.
Li (2018) conducted an RCT which investigates evaluate whether EtCO2 monitoring decreases the incidences of CO2 retention and apnoeic events in propofol-based sedation. Women were randomly (aged 18 to 65 years, ASA physical status 1 or 2) who were scheduled for breast lumpectomy were allocated randomly to receive either standard monitoring (control) or standard monitoring and EtCO2 monitoring (intervention). In total, 94 patients (mean age 40.2±14.2 years, BMI 21.4±2.8 kg/m2) were randomized to the control group and 94 patients (mean age 43.1±11.1 years, BMI 21.3±2.9 kg/m2) were randomized to the intervention group. Outcomes were incidence of CO2 retention, the number of actions taken to restore ventilation, the variation in incidence of retention of carbon dioxide, the incidences of apnoea, hypotension, bradycardia and other adverse events, propofol and sufentanil doses, duration of sedation and patient satisfaction (numerical analogue scale with 1 being the minimum and 10 the maximum).
Lin (2017) conducted an RCT which investigates if hypoventilation during induction of bronchoscopic sedation and starting bronchoscopy following hypoventilation, may decrease hypoxemia. Patients were randomized to capnography guided induction (intervention) or to sedation scale guided induction (control). In total, 55 patients (mean age 61.9±12.1 years, 52.5% male, BMI 23.3±3.7 kg/m2) were randomized to the control group and 59 patients (mean age 59.1±11.1 years, 52.7% male, BMI 23.2±3.2 kg/m2) were randomized to the intervention group. Outcomes were incidence of hypoxemia (defined as SpO2 ≤90%), hypoventilation during induction of FB sedation, bronchoscopy and sedative outcomes, patient perception and tolerance about FB.
Results
Safety
Mild hypoxemia
Five studies reported on mild hypoxemia (Saunders, 2017; Brady, 2017; Ishiwata, 2018; Lin, 2017; Peverling-Oberlag, 2020). Four of these studies were published after the systematic review by Saunders (2017) and were used to update the meta-analysis.
Saunders (2017) included 13 RCTs (14 patient groups) that reported mild hypoxemia and found 506/2705 (18.7%) events in the capnography group and 676/2755 (24.5%) events in the control group. The pooled RR was 0.77 (95% CI 0.67 to 0.89) in favour of the capnography group.
Brady (2017) found that 34.4% of patients in the capnography group experienced mild hypoxemia (defined as SpO2 <95%) compared to 39.2% in the control group. The RR was 0.8 (95% CI 0.60 to 1.28) in favour of the capnography group.
Ishiwata (2018) found that mild hypoxemia (defined as SpO2 <90%), was observed in 27 patients (29%) in the capnography group and 42 patients (46%) in the control group. The RR was 0.61 (95% CI 0.42 to 0.92) in favour of the intervention group.
Peveling-Oberlag (2020) found that mild hypoxemia (defined as SpO2 < 90%) occurred less often in the capnography group (28%) compared with the standard monitoring group (57%). the RR was 0.48 (95% CI 0.32 to 0.85) in favour of the capnography group.
Lin (2017) found that 47.2% of patients in the capnography group experienced hypoxemia events compared to 49.2% in the control group. The RR was 0.96 (95% CI 0.66 to 1.41) in favour of the capnography group.
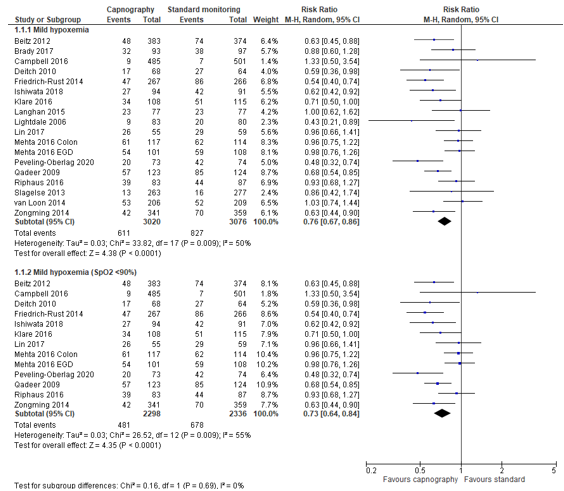
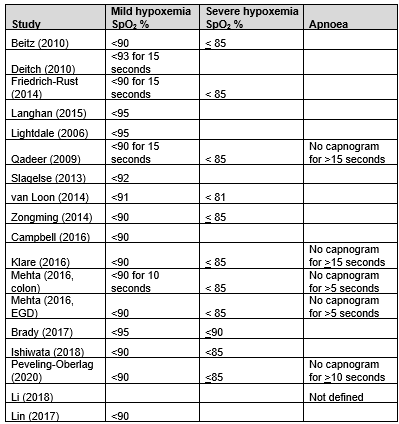
In summary, there were 17 studies (18 patient groups) that reported mild hypoxemia, but definitions for mild hypoxemia varied from an oxygen saturation (SpO2) of <95% to <90% for ≥15 s (Table 1). The pooled RR was 0.76 (95% CI 0.67 to 0.86; Figure 1) in favour of the capnography group. This is a clinically relevant difference. Including only studies with equivalent definitions of mild hypoxemia (SpO2 <90%; 12 studies; 13 patient groups) did not affect outcomes (RR 0.73; 95% CI 0.64 to 0.84; Figure 1)
Figure 1. Forest plot showing the comparison between capnography monitoring relative to standard monitoring for mild hypoxemia. Pooled risk ratio, random effects model.
Table 1. Endpoint definitions within included studies.
Severe hypoxemia
Four studies reported on severe hypoxemia (Brady, 2017; Ishiwata, 2018; Peverling-Oberlag, 2020; Saunders, 2017). Three of these studies were published after the systematic review by Saunders (2017) and were used to update the meta-analysis.
Saunders (2017) included seven RCTs (eight patient groups) that reported severe hypoxemia. and found 109/1646 (6.6%) events in the capnography group and 192/1669 (11.5%) events in the control group. The pooled RR was 0.59 (95% CI 0.43 to 0.81) in favour of the capnography group.
Brady (2017) found that the proportion of patients who experienced severe hypoxemia (defined as SpO2 < 90%) was 11.8% in the capnography was and 8.3% in the control. The RR was 1.43 (95% CI 0.60 to 3.41) in favour of the control group.
Ishiwata (2018) found that severe hypoxemia (defined as SpO2 < 85%), was observed in 16/94 patients (17%) in the capnography group and 29/91 patients (32%) in the control group. The RR was 0.53 (95% CI 0.31 to 0.91) in favour of the capnography group.
Peveling-Oberlag (2020) found that severe hypoxemia (defined as SpO2 < 85%) occurred less often in the capnography group (20%) compared with the standard monitoring group (41%). The RR was 0.49 (95% CI 0.29, 0.83) in favour of the capnography group.
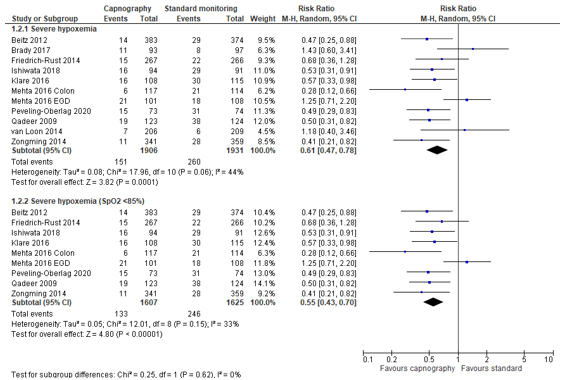
In summary, there were 10 studies (11 patient groups) that reported severe hypoxemia, but definitions for severe hypoxemia varied from SpO2 of < 80% to < 85% (Table 1). The pooled RR was 0.61 (95% CI 0.47 to 0.78; Figure 2) in favour of the capnography group. This is a clinically relevant difference. Including only studies with equivalent definitions of severe hypoxemia (SpO2 <85%; eight studies; nine patient groups) did not affect outcomes (RR 0.55; 95% CI 0.43 to 0.70; Figure 2).
Figure 2. Forest plot showing the comparison between capnography monitoring relative to standard monitoring for severe hypoxemia. Pooled mean risk ratio, random effects model.
Apnea
Three studies reported on apnoea (Saunders 2017, Li, 2018; Peverling-Oberlag, 2020). Two of these studies were published after the systematic review by Saunders (2017) and were used to update the meta-analysis.
Saunders (2017) included five studies (six patient groups) that reported apnoea and found 289/615 (47%) events in the capnography group and 270/628 (43%) events in the control group. The pooled RR was 1.17 (95% CI 0.72 to 1.89) in favour of the control group. This is not a clinically relevant difference.
Peveling-Oberlag (2020) found that apnoea, was observed in 61/73 patients (84%) in the capnography group and 65/74 patients (90%) in the control group. The RR was 0.95 (95% CI 0.83 to 1.09) in favour of the capnography group.
Li (2018) found that apnoea occurred in 0% the capnography monitoring and 10% of standard monitoring group. The RR was 0.05 (95% CI 0.00 to 0.89) in favour of the capnography group.
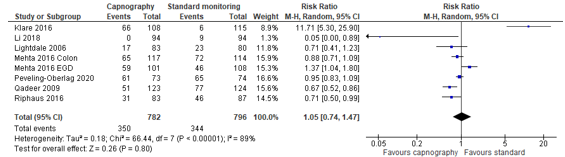
In summary, there were seven studies (eight patient groups) that reported comparable apnoea endpoints (Table 1). The pooled RR was 1.05 (95% CI 0.74 to 1.47; Figure 3) in favour of the control group. This is not a clinically relevant difference.
Figure 3. Forest plot showing the comparison between capnography monitoring relative to standard monitoring for apnoea. Pooled mean risk ratio, random effects model.
Quality & effectiveness of PSA
Success of procedure
Only one study reported on success of the procedure. Peveling-Oberlag (2020) found that successful PEG placement, was observed in 69 patients (94%) in the capnography group and 66 patients (89%) in the control group. The RR was 1.06 (95% CI 0.96 to 1.17) in favour of the capnography group. This is not a clinically relevant difference.
Sedation dose
Three studies examined the propofol dose used for sedation (Peveling-Oberlag, 2020; Li, 2018; Lin, 2017)
Peveling-Oberlag (2020) found that the propofol dose (±SD) was 209±90 mg in the capnography group and 202±85 mg in the control group. The mean difference was -7.00 mg (95% CI-21.31 to 35.31) in favour of the control group.
Li (2018) found that the propofol dose (±SD) was 211±57.3 mg in the capnography group and 202±63.7 mg in the control group. The mean difference was -9.00 mg (95% CI -8.32 to 26.32) in favour of the control group.
Lin (2017) found that the propofol dose (±SD) was 115.1±63.2 mg in the capnography group and 106.0±39.9 mg in the control group. The mean difference was -9.10 mg (95% CI -28.66 to 10.46) in favour of the control group.
Patient satisfaction
Patient satisfaction was measured in three studies. (Ishiwata, 2018; Li, 2018; Lin 2017) using a questionnaire after the procedure was completed.
Ishiwata (2018) measured discomfort by a questionnaire including a visual analogue scale (VAS) using a horizontal 100-mm-long line between 0 for no discomfort and 100 for worst possible discomfort. A total of 78 patients answered the questionnaire after FB. There were no clinically relevant differences between the capnography group (mean VAS=21mm) and standard monitoring group (mean VAS=30mm) regarding FB-associated discomfort. Ishiwata (2018) also found no clinically relevant differences in consent for re-examination by FB between the capnography group (n=33; 83%) and the standard monitoring group (n=28; 74%; RR 1.14; 95% CI 0.76 to 1.72).
Li (2018) measured patient satisfaction with sedation on a numerical analogue scale (1 being the minimum and 10 the maximum level of satisfaction) and found that patient satisfaction scores were the same in the two groups (8.5±1.0 vs. 8.5±1.2; P=1.0)
Lin (2017) measured patient satisfaction by a questionnaire of patient outcomes. The questionnaire included reactions to nebulized anesthetic inhalation and the stimulation caused by the scope insertion and procedure-related symptoms during FB including cough, dyspnea, and pain, and the global tolerance to the entire procedure. The questionnaire was designed on a 100-mm visual analogue scale (VAS, 0: no bother, 100: worst intolerable). One patient from the capnography group did not answer the questionnaire. Lin (2017) found no difference between the capnography and control group in mean VAS of discomfort for local spray (8.9±17.1 vs. 8.3±15.4; RD -0.6; 95% CI -6.66 to 5.56), bronchoscopic insertion (3.2±5.3 vs. 6.2±16.7; RD 3.0; 95% CI -1.71 to 7.71), cough (2.5±7.5 vs. 2.1±3.9; RD -0.40; 95% CI -2.60 to 1.8), dyspnea (1.7±3.2 vs. 1.4±2.5; RD -0.30; 95% CI -1.37 to 0.77), pain (1.8±3.5 vs. 1.4±2.5; RD -0.40; 95% CI -1.53 to 0.73), global tolerance (4.9±12.2 vs. 6.9±13.8; RD 2.00; 95% CI -2.87 to 6.87).
Lin (2017) also found that the answer of ‘definitely yes’ for willingness to return for the second FB when needed, is significantly higher in the capnography group (n=50; 92.6%) than in the control group (n=43; 72.9%; RR 1.27; 95% CI 1.07 to 1.51). However, there was no difference if the number of subjects answering ‘possibly yes or definitely yes’ for willingness to return for FB were compared between the capnography group (n=51; 94.4%) and the control group (n=52; 88.1%; RR 1.05; 95% CI 0.93 to 1.19).
Level of evidence of the literature
The level of evidence regarding the outcome measure ‘safety’ came from RCTs and started as high. The level of evidence was downgraded by 1 level because of risk of bias (inadequate blinding; -1) resulting in a moderate level of evidence.
The level of evidence regarding the outcome measures ‘quality and effectiveness’ and ‘patient satisfaction’ came from RCTs and started as high. The level of evidence was downgraded by 3 levels because of risk of bias (inadequate blinding; -1) and imprecision (wide 95% confidence interval crossing border for clinical relevance, or only one study reporting the outcome; -2) resulting in a very low level of evidence and imprecision.
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question:
What is the (in-)effectiveness of monitoring for expiratory CO2 during PSA, for the safety, quality and efficiency of PSA, and patient satisfaction, compared to no monitoring of CO2 in patients undergoing PSA?
PICO
P: patients undergoing PSA
I: PSA using standard monitoring plus capnography (end-tidal CO2 monitoring)
C: PSA using standard monitoring without CO2
O: safety, quality and efficiency of PSA, patient satisfaction
Relevant outcome measures
The guideline development group considered safety as a critical outcome measure for decision making. As a measure for safety we consider the change of frequency of sedation-related adverse events due to extra monitoring; and quality and effectiveness, and patient satisfaction as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the GRADE standard limit of 25% difference for dichotomous outcomes (RR <0.8 or >1.25) and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
PICO: (in) effectiveness of monitoring for expiratory CO2 during PSA.
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from the 1st of January 2005 until the 26th of January 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 192 hits. Studies were selected based on the following criteria: systematic reviews (with meta-analyses) and randomized controlled trials (RCT), investigating the effect of capnography monitoring on the safety, quality, and efficiency of sedation relative to visual assessment and pulse oximetry alone. Twenty-seven studies were initially selected based on title and abstract screening. After reading the full text, 21 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 6 studies were included.
Results
One systemic review was included in the analysis of literature and reported on the effect of capnography monitoring on sedation-related adverse events during procedural sedation and analgesia (PSA) administered for ambulatory surgery relative to visual assessment and pulse oximetry alone (Saunders, 2017). Saunders (2017) included 13 RCTs identified by a systematic search. Five RCTs were included in the analysis of literature of which four reported on the benefit of additional end-tidal CO2 monitoring (EtCO2) in reducing the incidence of hypoxemia during flexible bronchoscopy (FB) in patients under sedation (Brady, 2017; Ishiwata, 2018; Lin, 2017; Peveling-Oberlag, 2020), one RCT reported on whether EtCO2 monitoring decreases the incidences of CO2 retention and apnoeic events in propofol-based sedation (Li, 2018).
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Brady, P., Iohom, G., O'Halloran, K. D., McCreary, C., & Cronin, M. (2017). Microstream capnography during conscious sedation with midazolam for oral surgery: a randomised controlled trial. BDJ open, 3, 17019. https://doi-org.saz.idm.oclc.org/10.1038/bdjopen.2017.19
- Dunham CM, Hileman BM, Hutchinson AE, Chance EA, Huang GS. Perioperative hypoxemia is common with horizontal positioning during general anesthesia and is associated with major adverse outcomes: a retrospective study of consecutive patients. BMC Anesthesiol. 2014 Jun 9;14:43. doi: 10.1186/1471-2253-14-43. PMID: 24940115; PMCID: PMC4061099.
- Ishiwata, T., Tsushima, K., Terada, J., Fujie, M., Abe, M., Ikari, J., Kawata, N., Tada, Y., & Tatsumi, K. (2018). Efficacy of End-Tidal Capnography Monitoring during Flexible Bronchoscopy in Nonintubated Patients under Sedation: A Randomized Controlled Study. Respiration; international review of thoracic diseases, 96(4), 355-362. https://doi-org.saz.idm.oclc.org/10.1159/000489888
- Li, M., Liu, Z., Lin, F., Wang, H., Niu, X., Ge, X., Fu, S., Fang, L., & Li, C. (2018). End-tidal carbon dioxide monitoring improves patient safety during propofol-based sedation for breast lumpectomy: A randomised controlled trial. European journal of anaesthesiology, 35(11), 848-855. https://doi-org.saz.idm.oclc.org/10.1097/EJA.0000000000000859
- Lin, T. Y., Fang, Y. F., Huang, S. H., Wang, T. Y., Kuo, C. H., Wu, H. T., Kuo, H. P., & Lo, Y. L. (2017). Capnography monitoring the hypoventilation during the induction of bronchoscopic sedation: A randomized controlled trial. Scientific reports, 7(1), 8685. https://doi-org.saz.idm.oclc.org/10.1038/s41598-017-09082-8
- Mohr, N. M., Stoltze, A., Ahmed, A., Kiscaden, E., & Shane, D. (2018). Using continuous quantitative capnography for emergency department procedural sedation: a systematic review and cost-effectiveness analysis. Internal and emergency medicine, 13(1), 75-85. https://doi-org.saz.idm.oclc.org/10.1007/s11739-016-1587-3
- Peveling-Oberhag, J., Michael, F., Tal, A., Welsch, C., Vermehren, J., Farnik, H., Grammatikos, G., Lange, C., Walter, D., Blumenstein, I., Filmann, N., Herrmann, E., Albert, J., Zeuzem, S., Bojunga, J., & Friedrich-Rust, M. (2020). Capnography monitoring of non-anesthesiologist provided sedation during percutaneous endoscopic gastrostomy placement: A prospective, controlled, randomized trial. Journal of gastroenterology and hepatology, 35(3), 401-407. https://doi-org.saz.idm.oclc.org/10.1111/jgh.14760
- Saunders, R., Struys, M., Pollock, R. F., Mestek, M., & Lightdale, J. R. (2017). Patient safety during procedural sedation using capnography monitoring: a systematic review and meta-analysis. BMJ open, 7(6), e013402. https://doi-org.saz.idm.oclc.org/10.1136/bmjopen-2016-013402
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Saunders, 2017
|
SR and meta-analysis of RCTs
Literature search between 1 January 1995 and 15 January 2017
A: Betiz, 2012 B: Deitch, 2010 C: Friederich-Rust, 2012 D: Langhan, 2015 E: Lightdale, 2006 F: Qadeer, 2009 G: Slagelse, 2013 H: van Loon, 2014 I: Zongming 2014 J: Campbell, 2016 K: Klare, 2016 L: Mehta, 2016 M: Mehta, 2016 N: Riphause, 2017
Study design: RCT (A,-N)
Setting and Country: A: Colonoscopy, Germany B: Emergency department, USA C: Colonoscopy, Germany D: Pediatric emergency department USA E: Endoscopy, USA F: endoscopic retrograde cholangiopancreatography/endoscopic ultrasonography USA G: Endoscopy, Denmark H: Gynaecology, Netherlands I: Abortion, China J: Emergency department,Canada K: Endoscopic retrograde cholangiopancreatography, Germany L: Colonoscopy, USA M: esophagogastroduodenoscopy;, USA N: endoscopic ultrasonography, Germany
Source of funding and conflicts of interest: Not reported for the individual studies
|
Inclusion criteria SR: Randomised, controlled trials in patients receiving sedation during ambulatory surgery and in which visual assessment of ventilation and pulse oximetry monitoring (control) was compared with control plus capnography.
Exclusion criteria SR: Non-human studies, studies other than RCTs, Does not include capnography as intervention. Includes fewer than 40 patients per arm.
13 studies included in meta-analysis
Important patient characteristics at baseline:
n Control/n Intervention, Oxygen A: 375/383, 2 L/min B: 64/68, 3 L/min C: 266/267, 2 L/min D: 77/77, none E: 80/83, 2 L/min F: 124/123, none G: 277/263, 2-3 L/min H: 209/206, none I: 359/341, 3 L/min J: 501/485, 98/7% received oxygen K: 117/121, 2 L/min L: 114/117, none M: 108/101, none N: 87/83, 2 L/min
Groups comparable at baseline? Yes |
Describe intervention A-N: pulse oximetry + Capnography
|
Describe control A-N: pulse oximetry
|
End-point of follow-up A-N: No follow-up
For how many participants were no complete outcome data available? (intervention/control) A-N: not described in SR
|
Outcome
Mild hypoxemia, RR (95% CI) 0.77 (0.67, 0.89)
Severe hypoxemia, RR (95% CI) 0.59 (0.43, 0.81)
Apnea, RR (95% CI) 1.17 (0.72, 1.89)
|
Facultative: The authors conclude that consistent evidence of decreased respiratory compromise when capnography monitoring is used during PSA. Moreover they conclude that the analysis identified a statistically significant and clinically meaningful reduction in mild and severe oxygen hypoxemia, as well as in assisted ventilation.
|
2. Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies cohort studies, case-control studies, case series)1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Brady, 2017
(NCT01949012) |
Type of study: parallel group, randomised controlled trial
Setting and country: Hospital, Ireland
Funding and conflicts of interest: Funded through the Irish Health Research Board (grant number HPF-2013-458).
Covidien provided the study monitor.
No conflicts of interest |
Inclusion criteria: patients aged between 14 years and 62 years attending for minor oral surgery procedures ranging from single tooth removal to the surgical removal of impacted wisdom teeth.
Exclusion criteria: patients with ASA classes III–V, body mass index >35 kg/m2 and patients who refused or were unable to give informed consent.
N total at baseline: Total: 198 Intervention:99 Control: 99
Important prognostic factors2: Intervention/Control
age (SD): 31.2 (12.7)/31.5 (12.4)
Female; n(%) 69 (74)/62 (64%)
Male; n(%) 24 (26%)/35 (36%)
Alcohol drinker; n(%) 59 (63%)/52 (54%)
Smoker; n(%) 24 (26%)/26 (27%)
ASA classification; n(%) I: 65 (70%)/61 (63%) II: 28 (30%)/36 (37%)
BMI (kg/m2), (SD) 24.5 (3.7)/24.4 (4.2)
EtCO2 (mm Hg), (SD) 37.6 (3.8)?36.4 (4.1)
Respiratory rate (per min), (SD) 17.9 (4.6)/17.3 (4.5)
SpO2; % (SD) 99.1 (1.2)/99.2 (1.2)
Groups comparable at baseline? Yes
|
Describe intervention:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen viewable (unblinded) by all staff and the principal investigator |
Describe control:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen blinded by all staff and the principal investigator |
Length of follow-up: No follow-up
Incomplete outcome data: Control group Lost due to technical failure (n = 2)
Intervention group Lost due to technical failure (n = 6)
|
Outcome measures and effect size
Moderate hypoxemia; RR (95% CI) 0.8 (0.60 to 1.28)
Severe hypoxemia; OR (95% CI) 1.43 (0.60 to 3.41)
|
The authors conclude that unable to confirm an additive role for capnography to prevent hypoxaemia during conscious sedation with midazolam (monotherapy) in ASA I and II patients not routinely administered supplemental oxygen.
RoB: Randomisation was in blocks of varying length (two, four or six). Subjects were randomly assigned by the research nurse via sequentially numbered, sealed, opaque envelopes in a 1:1 ratio into the control or intervention group.
|
|
Ishiwata, 2018
(UMIN000023633) |
Type of study: parallel group, randomised controlled trial
Setting and country: Hospital, Japan
Funding and conflicts of interest: Funded through grants from the Japanese Foundation for Research and Promotion of Endoscopy
Covidien provided the study monitor.
No conflicts of interest |
Inclusion criteria: age above 20 years; undergoing flexible bronchosopy (FB) using sedatives for moderate sedation, in accordance with the American Society of Anesthesiologists (ASA) definition of sedation
Exclusion criteria: ASA physical status ≥IV, severe sleep apnea syndrome (apnea-hypopnea index > 40), undergoing FB without the use of sedatives, undergoing bronchoalveolar lavage, or undergoing therapeutic bronchoscopy such as bronchial dilation, stent insertion, or laser therapy.
N total at baseline: Total: 206 Intervention:103 Control: 103
Important prognostic factors2: Intervention/Control
Age (mean ± SD), years 67.1±11.0/66.2±13.4
Male sex, n (%) 57 (61)/57 (63)
Body mass index (mean ± SD) 22.3±3.7/22.1±3.8
Smoking (current and ex), n (%) 56 (60)/58 (64)
Regular narcotics, n (%) 15 (16)/18 (20)
Alcohol abuse, n (%) 10 (11)/6 (7)
Liver disease, n (%) 8 (9)/8 (9)
Renal disease, n (%) 25 (27)/19 (21)
COPD, n (%) 16 (17)/15 (16)
ILD, n (%) 9 (10)/8 (9)
SAS, n (%) 0 (0)/1 (1)
ASA physical status classification, n (%) 1: 7 (7)/8 (9) 2: 84 (89)/81 (89) 3: 3 (3)/2 (2)
Lung mass; n(%) 55 (59)/52 (57)
Pulmonary infiltrates; n(%) 9 (10)/9 (10)
Suspected ILD; n(%) 7 (7)/5 (5)
Endobronchial evaluation; n(%) 4 (4)/5 (5)
Lymph nodes evaluation; n(%) 19 (20)/20 (22)
TBB and brushing with GS; n(%) 65 (69)/59 (65)
Brushing; n(%) 1 (1)/3 (3)
TBB; n(%) 8 (9)/9 (10)
EBB; n(%) 1(1)/4 (4)
EBUS-TBNA; n(%) 19 (20)/19 (21)
Heart rate (mean ± SD), beats/min 75.8±12.6 77/0±14.2 0.557
Systolic blood pressure (mean ± SD), mm Hg 127.1±18.9/126.0±18.8
Oxygen saturation (mean ± SD), % 96.9±1.5/96.8±1.5
Initial amount of midazolam (mean ± SD), mg 2.1±0.8/2.2±0.9 Total amount of midazolam (mean ± SD), mg 2.9±1.5/3.0±1.4
Initial amount of pethidine (mean ± SD), mg 20.8±4.5/21.2±5.3
Total amount of pethidine (mean ± SD), mg 30.9±6.7/31.3±7.2
Procedure time (mean ± SD), min 28.3±11.3/27.4±11.6
Groups comparable at baseline? Yes
|
Describe intervention:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen viewable (unblinded) by all staff and the principal investigator |
Describe control:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen blinded by all staff and the principal investigator |
Length of follow-up: No follow-up
Incomplete outcome data: Control group Protocol violation (n = 4) Incomplete vital sign data (n = 8)
Intervention group Protocol violation (n = 4) Incomplete vital sign data (n = 5)
|
Outcome measures and effect size
Mild hypoxemia; RR (95%) 0.61 (0.42 to 0.92)
Severe hypoxemia; RR (95%) 0.53 (0.31 to 0.91)
|
The authors together with standard monitoring, end-tidal capnographic monitoring could reduce the incidence and duration of hypoxemia during FB in sedated non- intubated patients.
RoB: Patients were randomly assigned with a 1: 1 ratio using permuted block randomization with a block size of two. The bronchoscopy team members were not informed whether patients were assigned to the capnography or the control group until the day of bronchoscopy. |
|
Peveling-Oberlag, 2020 |
Type of study: parallel group, randomised controlled trial
Setting and country: Hospital, Germany
Funding and conflicts of interest: The Company Medtronic, USA provided the capnography monitor (Capnostream™ 20) and mouthpieces for capnographic measurements. There was no additional funding.
No conflicts of interest |
Inclusion criteria: age ≥ 18 years and ability to give written informed consent.
Exclusion criteria: ASA class 4 or 5, unable to give informed consent themselves or by the appointed legal guardian, pregnant or breastfeeding women, contraindication for PEG placement, allergic to propofol, peanuts, soya products, chicken egg protein, or sulfite.
N total at baseline: Total: 150 Intervention:75 Control: 75
Important prognostic factors2: Intervention/Control
Indication for PEG n (%) Oncological: 57 (77)/56 (77) Neurological: 13 (18)/16 (22) Other: 4 (5)/1 (1)
PEG method, n(%) Pull technique:68 (92)/67 (92) Push technique: 6 (8)/6 (8)
ASA classification, n(%) 1: 0 (0)/0 (0) 2: 53 (72)/56 (77) 3: 21 (28)/17 (23)
Tracheostoma, n (%) 16 (22)/12 (16)
Male sex, n (%) 50 (68)/48 (66)
Male sex, n (%) 50 (68)/48 (66)
Cardiovascular disease, n (%) 24 (32)/27 (37)
Pulmonary disease, n (%) 16 (22)/22 (31)
BMI, average ± SD 23.95 ± 5.65/23.44 ± 4.71
SpO2; mean ± SD 97.91 ± 2.43/97.78 ± 2.27
Systolic blood pressure, mean ± SD 143.68 ± 24.11/143.99 ± 29.07
Diastolic blood pressure 75.31 ± 11.37/78.07 ± 12.05
Heart rate, mean ± SD 79.43 ± 15.02/77.49 ± 14.80
Respiratory rate, mean ± SD 18.05 ± 5.32/19.11 ± 10.28
Groups comparable at baseline? Yes
|
Describe intervention:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen viewable (unblinded) by all staff and the principal investigator |
Describe control:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen blinded by all staff and the principal investigator |
Length of follow-up: No follow-up
Incomplete outcome data: Control group Lost due to technical failure (n = 2)
Intervention group Preintervention oxygen saturation below 90 (n = 1) Lockjaw prevented use of mouthpiece (n = 1)
|
Outcome measures and effect size
Mild hypoxemia; RR (95% CI) 0.48 (0.32 to 0.85)
Severe hypoxemia; RR (95%) 0.49 (0.29, 0.83)
Incidence apnea; RR (95% CI) 0.95 (0.83 to 1.09)
Sedation dose; MD (95% CI) 7.00 mg (-21.31 to 35.31) |
The authors conclude that respiratory complications of sedation during PEG placement are frequent events. Moreover, the conclude that capnography is able to detect imminent hypoxemia at an early time point allowing for early intervention and consecutively the avoidance of mild and severe hypoxemia.
RoB: Patients were randomly assigned (1:1 ratio). Blockwise randomization was stratified according to the following criteria: (i) ASA class 1, 2, or 3, (ii) PEG method (either push or pull method), (iii) presence of head and neck cancer, and (iv) patients with or without tracheostoma.
|
|
Li, 2018
(ChiCTR-INR-17011537) |
Type of study: parallel group, randomised controlled trial
Setting and country: Hospital, China
Funding and conflicts of interest: Funded through the National Natural Science Foundation of China (81600921), Natural Science Foundation of Shanghai (16ZR1426400), Shanghai Health and Family Planning Committee (20154Y0011), the Xinchen Youth anaesthesiologists Foundation.
No conflicts of interest |
Inclusion criteria: patients aged 18 to 65 years and scheduled for lumpectomy under deep sedation
Exclusion criteria: ASA class 3 to 5; inability to provide informed consent, severe pulmonary disease, sleep apnoea syndrome, a history of allergy to sufentanil, propofol, soya beans or egg protein, BMI >35 kg/m2, Mallampati score 4.
N total at baseline: Total: 188 Intervention:94 Control: 94
Important prognostic factors2: Intervention/Control
Age (years), mean±SD 43.1±11./ 40.2±14.2
BMI (kgm2), mean±SD 21.3±2.9/21.4±2.8
ASA physical status, n(%) 1: 33 (35%)/34 (36%) 2: 61 (65%).60 (64%)
Modified Mallampati score, n(%) 1: 32 (34.0%)/29 (30.9%) 2: 33 (35.1%)/34 (36.2%) 3: 29 (30.9%)/31 (33.0%)
Sedation time (min), mean±SD 30.6±3.7/31.0±5.5
Baseline oxygen saturation (%), mean±SD 98.61.5/98.8±1.5
Baseline PaCO2 (kPa), mean±SD 4.77±0.29/4.71±0.21
Baseline pH, mean±SD 7.42±0.03/7.43±0.04
Total propofol dose (mg), mean±SD 211±57.3/202±63.7
Groups comparable at baseline? Yes
|
Describe intervention:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen viewable (unblinded) by all staff and the principal investigator |
Describe control:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen blinded by all staff and the principal investigator |
Length of follow-up: No follow-up
Incomplete outcome data: No incomplete data
|
Outcome measures and effect size
Mild hypoxemia; RR (95% CI) 0.96 (0.66 to 1.41)
Incidence apnea; RR (95% CI) 0.05 (0.00 to 0.89)
Sedation dose; MD (95% CI) -9.00 mg (-8.32 to 26.32) |
The authors conclude that addition of EtCO2 monitoring during propofol-based sedation for breast lumpectomy can reduce the incidence of CO2 retention and hypoxaemia by early recognition of apnoea. Moreover, considering the ease of use and lower cost of EtCO2 monitoring, it should be added as a ‘must-have’ when providing deeper levels of sedation
RoB: The participants were randomised in a double-blind fashion and in a 1 : 1 ratio using a computerized randomization strategy. The strategy itself is not specified.
|
|
Lin, 2017
(NCT02848118) |
Type of study: parallel group, randomised controlled trial
Setting and country: Hospital, Taiwan
Funding and conflicts of interest: Funded through supported by the Chang-Gung Memorial Hospital (grant no. MRPG3E0431, CMRPG3E0432).
No conflict of interest |
Inclusion criteria: patients who were >18 years of age and undergoing elective flexible bronchoscopy (FB).
Exclusion criteria: <18 years, ASA class 4 or 5, Mallampati score of 4, severe sleep apnoea, forced expiratory vital capacity (FVC) < 15 ml/kg body weight, forced expiratory volume in one second (FEV1) < 1000 ml, or FEV1/FVC < 35%, neurologic disorders or other conditions contributing to difficulty in assessing response, BMI >42 in males or >35 in females, pregnancy
N total at baseline: Total: 124 Intervention:64 Control: 60
Important prognostic factors2:
Age, mean (SD) 59.1 (11.1)/61.9 (12.1)
ASA, mean (range) 2 (1–3)/2 (1–3)
Male, n (%) 29 (52.7)/31 (52.5)
BMI, mean (SD) 23.2 (3.2)/23.3 (3.7)
Mallampati score (range) 2 (1–3)/2 (1–3)
Outpatient, n (%) 45 (81.8)/44 (74.6) |
Describe intervention:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen viewable (unblinded) by all staff and the principal investigator |
Describe control:
Patients randomized to monitoring by pulse oximetry and capnography with the capnography screen blinded by all staff and the principal investigator |
Length of follow-up: No follow-up
Incomplete outcome data: Control group Blockage of infusion line (n = 1) Protocol violation (n = 2) Induction ce>3.4ug/ml (n = 2)
Intervention group Capnographm disfunction (n = 1) Protocol violation (n = 2) O2 canula dislocation (n = 1)
|
Outcome measures and effect size
Mild hypoxemia; RR (95% CI) 0.96 (0.66 to 1.41)
Sedation dose; MD (95% CI) -9.10 mg (-28.66 to 10.46)
Intervention/control
Wakefulness during FB, n (%) Yes to hearing something 3 (5.6)/5 (8.5) Yes to seeing something 2 (3.7)/3 (5.1) Yes to be awake 5 (9.1)/5 (8.5)
VAS# of discomfort about FB, mm (mean ± SD) Local spray 8.9 (17.1)/8.3 (15.4) Bronchoscope insertion 3.2 (5.3)/6.2 (16.7) Cough 2.5 (7.5)/2.1 (3.9) Dyspnea 1.7 (3.2)/1.4 (2.5) Pain 1.8 (3.5)/1.4 (2.5) Global tolerance 4.9 (12.2)/6.9 (13.8)
Willingness of return to FB, n (%) Definitely not 0/0 Possibly not 1 (1.9)/3 (5.1) Not sure 2 (3.7)/4 (6.8) Possibly yes 1 (1.9)/9 (15.3) Definitely yes 50 (92.6)/43 (72.9) Possibly yes + definitely yes 51 (94.4)/52 (88.1)
Patients’ discomfort in the view of bronchoscopists, VAS, mm (mean ± SD) Dyspnea 13.7 (18.0)/15.0 (19.2) Cough 25.2 (28.7)/28.6 (28.2) Global cooperation 23.5 (27.7)/22.3 (26.7) |
The authors conclude that significant hypoventilation occurred during the induction of sedation and starting bronchoscopy following hypoventilation may decrease hypoxemia without compromising patient tolerance
RoB: Eligible enrolled patients were randomised by a predetermined random computer code into the study group or the control group in a 1:1 ratio, assisted by the research assistant. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors (potential) confounders
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
3. Risk of bias table for systematic reviews of RCTs and observational studies.
|
|
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Saunders, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear1 |
1 Potential conflicts of interest are not reported for the individual studies.
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
4. Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Brady, 2017
|
Randomisation was in blocks of varying length (two, four or six). Subjects were randomly assigned by the research nurse via sequentially numbered, sealed, opaque envelopes in a 1:1 ratio into the control or intervention group.
|
Unlikely The randomisation choice was concealed from the teams until after enrolment |
Unclear Not mentioned if participants remained blinded to treatment allocation. . |
Likely The randomisation choice was concealed from the teams until after enrolment. Treatment allocation was unblinded after randomisation since it was part of the treatment procedure. |
Unclear Unclear if outcome assessor remained blinded. |
Unlikely The trial was registered at ClinicalTrials.gov under identifier NCT01949012 |
Unlikely Minimal loss of participants after randomization in both study arms.
|
Unlikely No mention of ITT-analysis but minimal loss of participants after randomisation. |
|
Ishiwata, 2018 |
Patients were randomly assigned with a 1: 1 ratio using permuted block randomization with a block size of two. The bronchoscopy team members were not informed whether patients were assigned to the capnography or the control group until the day of bronchoscopy. |
Unlikely The randomisation choice was concealed from the teams until after enrolment |
Unclear Not mentioned if participants remained blinded to treatment allocation. |
Likely The bronchoscopy team members were not informed whether patients were assigned to the capnography or the control group until the day of bronchoscopy. |
Unclear Unclear if outcome assessor remained blinded. |
Unlikely This study was registered at the University Hospital Medical Information Network Clinical Trial Registration (UMIN-CTR), Japan (registration No.:UMIN000023633) |
Unlikely Minimal loss of participants after randomization in both study arms.
|
Unlikely No mention of ITT-analysis but minimal loss of participants after randomisation. |
|
Peveling-Oberlag |
Patients were randomly assigned (1:1 ratio). Blockwise randomization was stratified according to the following criteria: (i) ASA class 1, 2, or 3, (ii) PEG method (either push or pull method), (iii) presence of head and neck cancer, and (iv) patients with or without tracheostoma. |
Unlikely The randomisation choice was concealed from the teams . |
Unclear Not mentioned if participants remained blinded to treatment allocation. |
Unlikely A person well acquainted with the capnography system who was not involved with the PEG procedure monitored the technical performance of the capnography.
|
Unclear Unclear if outcome assessor remained blinded. |
Unlikely There is no discrepancy in outcomes recorded and those mentioned in the paper. The trial itself was, however, not registered. |
Unlikely Minimal loss of participants after randomization in both study arms.
|
Unlikely No mention of ITT-analysis but minimal loss of participants after randomisation. |
|
Li, 2018 |
The participants were randomised in a double-blind fashion and in a 1 : 1 ratio using a computerized randomization strategy. |
Unlikely
Group allocation was concealed using opaque envelopes. The surgeons could not influence the group allocation process |
Unclear Not mentioned if participants remained blinded to treatment allocation. |
Unclear Unclear if allocation was unblinded prior to procedure. |
Unclear Unclear if outcome assessor remained blinded. |
Unlikely The study was registered prior to patient enrolment at http://www.chictr.org.cn (identifier ChiCTR-INR-17011537). |
Unlikely Minimal loss of participants after randomization in both study arms.
|
Unlikely No mention of ITT-analysis but minimal loss of participants after randomisation. |
|
Lin, 2017 |
Eligible enrolled patients were randomised by a predetermined random computer code into the study group or the control group in a 1:1 ratio, assisted by the research assistant. |
Unclear
Unclear if randomization was blinded. |
Unclear Not mentioned if participants remained blinded to treatment allocation. |
Unlikely Two screens, one inside and one outside the bronchoscopic room, displayed parameters, including capnography, in real time. The capnography was blinded to investigators by masking the screen inside the bronchoscopic room, if patients were randomized to the control group. |
Unclear Unclear if outcome assessor remained blinded. |
Unlikely The trial was registered at ClinicalTrials.gov under identifier NCT02848118 |
Unlikely Minimal loss of participants after randomization in both study arms.
|
Unlikely No mention of ITT-analysis but minimal loss of participants after randomisation. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Waugh, 2011 |
Saunders, 2017 is a more recent SR covering the same literature. |
|
Conway, 2016 |
Saunders, 2017 is a more recent SR covering the same literature. |
|
Dwedney, 2017 |
Includes observational studies |
|
Wall, 2017 |
Saunders, 2017 is a more recent SR covering the same literature. |
|
Kim, 2018 |
Saunders, 2017 is of better quality |
|
Parker, 2018 |
Saunders, 2017 is of better quality |
|
Askar,2020 |
Does not include pooled meta-analysis |
|
Cacho, 2010 |
Does not meet PICO |
|
Sivilotti, 2010 |
Does not meet PICO |
|
Schlag, 2013 |
Does not meet PICO |
|
Adams, 2015 |
Observational study |
|
Prathanvanich, 2015 |
Observational study |
|
Barnett, 2016 |
Observational study |
|
Takaya, 2017 |
Does not meet PICO |
|
Oba, 2019 |
Observational study |
|
Burton, 2006 |
Observational study |
|
Mensour, 2006 |
Observational study |
|
Ishiwata, 2017 |
Observational study |
|
Jopling, 2017 |
Observational study |
|
Weimer, 2018 |
Observational study |
|
Applegate, 2016 |
Does not meet PICO |
|
Hinkelbein, 2018 |
Does not meet PICO |
|
Bhalla, 2006 |
Does not meet PICO |
|
Froelich, 2006 |
Does not meet PICO |
|
Williams, 2007 |
Does not meet PICO |
|
Yetkin, 2007 |
Does not meet PICO |
|
Adams, 2008 |
Does not meet PICO |
|
Fanning, 2008 |
Does not meet PICO |
|
Applegate, 2016 |
Does not meet PICO |
|
Cubiella Fernandez, 2005 |
Article not in Dutch or English |
|
ZIppi, 2008 |
Article not in Dutch or English |
|
Zippi, 2008 |
Article not in Dutch or English |
|
Riphaus, 2010 |
Does not meet PICO |
|
Kloesel, 2011 |
I does not meet PICO |
|
Pérez-Cuadrado-Robles, 2016 |
Does not meet PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 23-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij volwassen patiënten.
Werkgroep
- Prof. dr. B. Preckel (voorzitter), anesthesioloog, Amsterdam UMC locatie AMC, NVA
- dr. C.R.M. Barends, anesthesioloog, UMCG, NVA
- L.R.M. Braam, BSc. Sedatie Praktijk Specialist, Catharina Ziekenhuis, NVAM
- drs. R. Brethouwer, abortusarts, Beahuis & Bloemenhovekliniek Heemstede, NGvA
- dr. J.M. van Dantzig, cardioloog, Catharina Ziekenhuis, NVVC
- drs. V.A.A. Heldens, anesthesioloog, Maxima MC, NVA
-
dr. C. Heringhaus, SEH-arts/anesthesioloog, LUMC (t/m 12-2022), Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ (vanaf 01-2023), NVSHA
- T. Jonkergouw, MA. Adviseur Patiëntbelang, Patiëntenfederatie Nederland (tot april 2023)
- Broere, M. Junior beleidsadviseur, Patiëntenfederatie Nederland (vanaf april 2023)
- dr. M. Klemt-Kropp, MDL-arts, Noordwest Ziekenhuisgroep, NVMDL
- drs. B.M.F. van der Leeuw, anesthesioloog, Albert Schweitzer ziekenhuis, NVA
- S. Reumkens, MSc. Physician Assistant, Diakonessenhuis, NAPA
Klankbordgroep
- drs. T.E.A. Geeraedts, radioloog, Erasmus MC, NVvR
- drs. J. Friederich, gynaecoloog, Noordwest Ziekenhuisgroep, NVOG
- dr. E.H.F.M. van der Heijden, longarts, Radboud UMC, NVALT
- drs. J. de Hoog, oogarts, Amsterdam UMC locatie AMC, NOG
- drs. A. Kanninga, arts voor verstandelijk gehandicapten, Cordaan, NVAVG
- drs. H.W.N. van der Pas, tandarts, UMC Utrecht, VMBZ
- dr. ir. C. van Pul, klinisch fysicus, Maxima MC, NVKF
- dr. R.J. Robijn, MDL-arts, Rijnstate, NVMDL
- drs. W.S. Segers, klinisch Geriater, Catharina Ziekenhuis, NVKG
- Prof. dr. A. Visser, hoogleraar geriatrische tandheelkunde, UMCG en Radboud UMC, KNMT
Met ondersteuning van:
- dr. L. Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten
- drs. I. van Dusseldorp, senior literatuurspecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Preckel |
Anesthesioloog, hoogleraar anesthesiologie (in het bijzonder veiligheid in het perioperatieve proces) Amsterdam Universitair Medische Centra locatie AMC |
Onbetaalde nevenwerkzaamheden – commissie-werkzaamheden:
Lid Patient Safety and Quality Committee of the European Society of Anesthesiologists;
Lid Patient Safety Committee van de World Federation of Societies of Anesthesiologists;
Lid Raad Wetenschap en Innovatie van de Federatie Medisch Specialisten FMS;
Lid Commissie Wetenschap & Innovatie van de Nederlandse Vereniging voor Anesthesiologie NVA
Representative Council European Association of Cardiothoracic Anesthesiology and Intensive Care (EACTAIC)
Hoger leidinggevend personeel (penningmeester) van de “Stichting ter bevordering van de wetenschap en opleiding in de anesthesiologie”;
|
Research grants: European Society of Anesthesiology and Intensive Care ESAIC ZonMw NovoNordisk Netherland
Advisory board Sensium Healthcare United Kingdom
Geen van de gemelde belangen heeft relatie met het onderwerp van het advies/de richtlijn
|
Geen actie vereist |
|
Barends |
Anesthesioloog in het Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie vereist |
|
Braam |
Sedatiepraktijkspecialist Catharina Ziekenhuis Eindhoven |
Lid sedatie commissie NVAM (onbetaald) |
Geen |
Geen actie vereist |
|
Brethouwer |
Abortusarts te Beahuis & Bloemenhovekliniek (0,56 fte) en SAA (0,22 fte), Medisch coördinator Beahuis&Bloemenhovekliniek (0,33 fte) |
Penningmeester van het Nederlands Genootschap van Abortusartsen (onbetaald) Voorzitter landelijke werkgroep PSA van het NGvA (onbetaald) Bestuurslid van FIAPAC, een Europese abortus organisatie (onbetaald) |
Geen |
Geen actie vereist |
|
Broere |
Junior beleidsadviseur Patiëntenbelang - fulltime |
geen |
geen |
Geen actie vereist |
|
van Dantzig |
Cardioloog vrij gevestigd, Catharina Ziekenhuis 100% |
Lid Plenaire Visitatie Commissie NVVC (onbetaald) |
Op onze afdeling wordt extern gefinancierd onderzoek uitgevoerd maar niet op het gebied van de werkgroep. |
Geen actie vereist |
|
Heldens |
Anesthesioloog Maxima MC |
Geen |
Geen |
Geen actie vereist |
|
Heringhaus |
Vanaf 01-2023 Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ
t/m 12-2022 SEH-arts KNMG |
Trainingen voor verschillende onderwerpen gerelateerd aan acute zorg, hyperbare geneeskunde, PSA |
Geen |
Geen actie vereist |
|
Jonkergouw |
Junior beleidsadviseur - Patiëntenfederatie Nederland - 32 tot 36 uur per week |
Vrijwilliger activiteiten - Diabetes Vereniging Nederland - Zeer incidenteel |
Geen |
Geen actie vereist |
|
Klemt-Kropp |
MDL-arts, Noordwest Ziekenhuisgroep Alkmaar - Schagen - Den Helder (0.9 fte) |
Secretaris Concilium Gastroenterologicum, NVMDL tot 11 april 2022 (niet betaald) Voorzitter PSA commissie NVMDL (niet betaald) Docent Teach the Teacher AUMC en Noordwest Ziekenhuisgroep cursussen voor aios en medisch specialisten (betaalde functie, ongeveer 40 Std. per jaar)
Voorzitter Stichting MDL Holland-Noord (KvK 56261225) vanaf okt. 2012 t/m 31-12-2019. De stichting heeft in de laatste 3 jaar grants ontvangen van de farmaceutische industrie en van de farmaceutische industrie gesponsorde onderzoeken gefaciliteerd:
1. Ondersteuning optimalisering van zorg voor IBD-patiënten. Therapeutic drugmonitoring en PROMs bij patiënten met IBD. Zorgverbetertraject. PhD student, looptijd van 2015 tot op heden. Tot 2018 grant van Dr. Falk Pharma. vanaf 2018 grant van Janssen Cilag Geen relatie met sedatie 2.Retrieval of patients chronically infected with Hepatitis B or Hepatitis C in Northern Holland. Afgesloten 2018. Project gefinancierd met grant van Gilead. Geen relatie met sedatie 3. SIPI. Screening op Infectieuze aandoeningen in Penitentiaire Inrichtingen. Project gefinancierd met grants van AbbVie, MSD en Gilead. Project begin 2019 afgesloten. Geen relatie met sedatie 4. 3DUTCH trial. Een observationeel onderzoek naar de effectiviteit van een behandeling van chronische hepatitis C met een combinatie van de antivirale middelen ombitasvir - paritaprevir /ritonavir, ± dasabuvir, ± ribavirine. Sponsor AbbVie. Studie afgesloten Jan. 2018 Geen relatie met sedatie 5. Remsima switch IFX9501 - An open-label, multicenter, non- inferiority monitoring program to investigate the quality of life, efficacy and safety in subjects with Crohn’s Disease (CD), Ulcerative Colitis (UC) in stable remission after switching from Remicade® (infliximab) to Remsima® (infliximab biosimilar) L016-048. Sponsor: Munipharma. Afgelsoten augustus 2018. Geen relatie met sedatie 6. NASH - NN9931-4296 Investigation of efficacy and safety of three dose levels of subcutaneous semaglutide once daily versus placebo in subjects with non-alcoholic steatohepatitis L016-061. Sponsor NovoNordisk. Studie afgesloten Feb. 2020. Geen relatie met sedatie 7. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Induction Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 305). SHD-647-305. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 8. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Maintenance Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 307). SHD-647-307. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 9. Estimating the prevalence of advanced liver fibrosis in a population cohort in care in Northern-Holland with the use of the non-invasive FIB-4 index. Grant van Gilead. Onderzoek afgesloten sept. 2019. Geen relatie met sedatie |
Incidenteel deelname aan advisory boards van de farmaceutische industrie (Gilead, Janssen Cilag, AbbVie: (hepatologische onderwerpen, vooral hepatitis C) Incidenteel voordrachten tijdens symposia gesponsord van de farmaceutische industrie (Gilead, AbbVie)
|
Geen actie vereist; meeste studies afgerond; nr. 1,7,8 lopen. Sponsoren (Dr. Falk Pharma & Shire) hebben geen relatie met sedatie. |
|
Reumkens |
Physician Assistant Anesthesiologie Radboud UMC |
Voorzitter vakgroep PA Anesthesiologie NAPA |
Geen |
Geen actie vereist |
|
Van der Leeuw |
Anesthesioloog |
Geen |
Geen |
Geen actie vereist |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Robijn |
Mdl arts rijnstate ziekenhuis Arnhem |
Geen |
Geen |
Geen actie vereist |
|
Van der Heijden |
Longarts |
Voormalig Secretaris Sectie Interventie longziekten NVALT (onbezoldigd)
Lid Board of National Delegates European Association of Bronchology and International Pulmonology (namens NL, onbezoldigd)
|
Buiten het veld van deze richtlijn heeft mijn afdeling de afgelopen 3 jaar vergoedingen ontvangen voor de volgende activiteiten: - unrestricted research grants: Pentax Medical Europe, Philips, Astra Zeneca, Johnson&Johnson. - adviseur / consultant: Pentax Medical, Philips IGT, Johnson&Johnson. - spreker: Pentax Medical. |
Geen actie vereist |
|
Van der Pas |
Tandarts, UMC Utrecht |
Commissielid Horace Wells van de KNMT, stimulatie van de intercollegiale samenwerking bij tandheelkundige behandeling van bijzondere zorggroepen met farmacologische ondersteuning. Onbetaald. Voormalig commissielid Bijzondere Zorggroepen van de KNMT, toegankelijkheid van mondzorg voor kwetsbare zorggroep. Betaald via vacatiegelden. Gastdocent opleiding mondzorgkunde HU. Lezing mondzorg aan mensen met een verstandelijke beperking. Betaald. Gastdocent opleiding verpleegkundig-specialist GGZ. Lezing mondzorg in de geestelijke gezondheidszorg Betaald. Cursusleider lichte sedatie in de mondzorg, BT Academy. Meerdaagse cursus voor tandartsen en mondhygienisten om zich te bekwamen in lichte sedatie, m.n. training in de inhalatiesedatie met lachgas-zuurstof mengsel middels titratietechniek. Betaald. |
Geen |
Geen actie vereist |
|
De Hoog |
Oogarts in Amsterdam UMC (0,2 fte.) en Retina Operatie Centrum Amstelveen (0,4 fte.). Medisch manager Retina Operatie Centrum (0,2 fte.) |
Voorzitter Werkgroep Vitreoretinale Chirurgie Nederland (onbetaald) Lid redactieraad vaktijdschrift 'De Oogarts', uitgave van BPM-medica (onbezoldigd) Medeorganisator Eilanddagen (bijscholing uveïtis voor oogartsen, onbetaald) |
Geen |
Geen actie vereist |
|
Geeraedts |
Interventieradioloog Afdeling Radiologie en Nucleaire geneeskunde Erasmus Medisch Centrum, Rotterdam |
Geen |
Geen |
Geen actie vereist |
|
Van Pul |
Klinisch fysicus in Maxima Medisch Centrum |
Universitair Hoofd Docent aan de Technische Universiteit van Eindhoven (0,2 fte). Daar supervisor van PhD studenten bij HTSM (NWO-TTW gesubsidieerd) project waaraan ook een industriële partner deelneemt (https://www.nwo.nl/projecten/15345-0).
|
Geen |
Geen actie vereist |
|
Friederich |
Gynaecoloog NWZ Den Helder, Algemeen gynaecoloog met als aandachtsgebieden benigne gynaecologie, minimaal invasieve chirurgie en bekkenbodemproblematiek |
Vicevoorzitter calamiteitencommissie NVZ lid klachtencommissie NWZ Den Helder |
Geen |
Geen actie vereist |
|
Segers |
Klinisch geriater, St. Jans Gasthuis, Weert
|
Klinisch farmacoloog in opleiding, Catharina ziekenhuis, Eindhoven Onbetaald |
Geen |
Geen actie vereist |
|
Kanninga |
Arts Verstandelijk Gehandicapten (arts VG) bij Cordaan Amsterdam Anesthesioloog niet praktiserend |
Geen |
Geen |
Geen actie vereist |
|
Visser |
Hoogleraar geriatrische tandheelkunde fulltime (1 fte) - Afdeling Gerodontologie, Centrum voor Tandheelkunde en Mondzorgkunde, Universitair Medisch Centrum Groningen, Rijksuniversiteit Groningen, Nederland - Afdeling Gerodontologie, Faculteit Tandheelkunde, Radboud UMC, Radboud Universiteit Nijmegen, Nederland |
Geen |
Geen |
Geen actie vereist |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. Aanvullend heeft een afgevaardigde van de Patiëntenfederatie Nederland deelgenomen in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming gedaan of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie ook het hiervoor gebruikte stroomschema dat als uitgangspunt voor de beoordeling is gebruikt).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn. Een overzicht van uitkomsten van de kwalitatieve raming met bijbehorende toelichting vindt u in onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Submodule Expiratoire CO2 monitoring |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Obstetrie en Gynaecologie, Nederlandse Vereniging voor Cardiologie, de Nederlandse Vereniging van Maag-Darm-Leverartsen, de Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied, de Nederlandse Vereniging voor Intensive Care, de Nederlandse Internisten Vereniging, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, het Nederlands Genootschap van Abortusartsen, de Nederlandse Vereniging van Anesthesiemedewerkers, de Verpleegkundigen & Verzorgenden Nederland, de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie, de Vereniging Mondzorg voor Bijzondere Zorggroepen, Stichting Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd en de Vereniging van Artsen voor Verstandelijk Gehandicapten via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.