Etomidaat
Uitgangsvraag
Wat is de plaats van etomidaat bij procedurele sedatie en analgesie bij volwassenen buiten de OK?
Aanbeveling
Gebruik etomidaat alleen bij zeer korte procedures, waarbij de hemodynamiek zo stabiel mogelijk dient te blijven.
Gebruik etomidaat als eenmalige bolus. Het is geen middel om te herhalen of om als onderhoud te gebruiken.
Wees bekend met de werking en de bijwerkingen van de etomidaat, met name de onderdrukking van de bijnierschors.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van procedurele sedatie (PSA) met etomidaat in vergelijking met sedatie met propofol op de veiligheid en patiënttevredenheid bij patiënten die PSA ondergaan.
Veiligheid van PSA was gedefinieerd als cruciale uitkomstmaat. Op basis van het literatuuronderzoek kan worden geconcludeerd dat complicaties, zoals hypotensie, zuurstof desaturatie minder vaak lijken voor te komen indien patiënten sedatie ondergaan met etomidaat in vergelijking met sedatie met propofol. Echter, er lijkt weinig tot geen verschil te zijn in mortaliteit tussen sedatie met etomidaat of propofol. De bewijskracht voor hypotensie, zuurstof desaturatie en mortaliteit was laag. Sedatie met etomidaat leidt mogelijk wel tot meer apneu dan wanneer procedurele sedatie plaatsvindt met propofol. De bewijskracht hiervoor was laag.
Voor de belangrijke uitkomstmaten patiënttevredenheid en tevredenheid van de zorgverlener is de bewijskracht laag en er lijkt voor deze uitkomsten geen verschil te zijn tussen sedatie met etomidaat in vergelijking met propofol.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Etomidaat is een sedativum wat met enige regelmaat gebruikt wordt op de operatiekamers en op de intensive care. Het is een middel dat als groot voordeel heeft dat er minder bloeddrukdaling optreedt als het gegeven wordt. Het wordt voornamelijk gebruikt als inductiemiddel, dus om patiënten onder narcose of diepe sedatie te brengen, als onderhoud van deze sedatie/narcose wordt het niet gebruikt.
Een nadeel van etomidaat is dat het een verlaging geeft van de cortisolspiegel door bijnierschorsonderdrukking, hiermee dient men bij gebruik rekening te houden.
Een ander nadeel wat niet genoemd wordt in de literatuurstudie is dat het een hogere kans geeft op misselijkheid en braken en er bestaat een kans dat bij de patiënt myoclonieën optreden na injecteren van de etomidaat. De sedatiesdeskundige moet overwegen deze bijwerkingen onderdeel te maken van het beslismoment met de patient (Samen Beslissen), waarbij een uitgebreide uitleg over alle bijwerkingen van specifiek gebruikte medicijnen het doel voorbij kan schieten.
Kosten (middelenbeslag)
Met betrekking tot de kosten zijn er geen belangrijke verschillen te noemen tussen het gebruik van propofol of etomidaat. Propofol is een middel dat vele malen meer gebruikt wordt in de anesthesiepraktijk en is altijd beschikbaar.
Aanvaardbaarheid, haalbaarheid en implementatie
Etomidaat is beschikbaar in iedere anesthesiepraktijk, echter het gebruik van etomidaat in de reguliere anesthesiepraktijk is vooral op indicatie. Propofol is een middel waar veel meer mee gewerkt wordt en wat ook gebruikt kan worden als herhalingsbolus of als continue toediening. Doordat de ervaring met propofol vele malen groter is lijkt dit de voorkeur te hebben als sedatiemiddel bij procedures onder sedatie. Echter bij patiënten met een matige cardiovasculaire toestand (hypotensie, shock) waarbij men maar een kortdurende sedatie nastreeft is etomidaat een middel wat zeker gebruikt kan worden. Etomidaat is een middel dat veel in de cardiologiepraktijk gebruikt wordt wanneer sedatie gewenst is bij instabiele hemodynamiek door hartritmestoornissen. De gebruiker dient wel op de hoogte te zijn, zoals geldt voor ieder medicijn, van de eventuele bijwerkingen en contra indicaties.
Rationale van de Aanbeveling
Etomidaat is een middel dat met enige regelmaat gebruikt wordt op de operatiekamer, spoedeisende hulp of intensive care om patiënten onder narcose te brengen. Het is een middel dat weinig cardiovasculaire effecten laat zien bij inductie en daarom veelgebruikt bij hemodynamisch instabiele patiënten. Het heeft als nadeel dat het meer klachten geeft van misselijkheid en braken en het geeft bijnierschorsonderdrukking en daardoor verlaging van de cortisolspiegel.
In de sedatiepraktijk wordt het gebruikt omdat het minder negatieve effecten heeft op de bloeddruk. Het kan echter niet gebruikt worden als herhalingsbolus of als onderhoud. Het is dus voorbehouden voor korte ingrepen, zoals cardioversies.
Onderbouwing
Achtergrond
In de sedatiepraktijk wordt voornamelijk gewerkt met sedativa zoals propofol en midazolam. Echter, er zijn nog meer sedativa, ieder met eigen voor- en nadelen. Etomidaat beïnvloedt het cardiovasculaire system niet of nauwelijks. Maar is er meerwaarde bij het gebruik van etomidaat in de sedatiepraktijk?
Conclusies / Summary of Findings
Safety
Hypotension
|
Low GRADE |
Procedural sedation with etomidate may result in a reduction of hypotension when compared with procedural sedation with propofol.
Source: Lewis (2015) (Broch Porcar, 1999); Kim (2017). |
Apnoea
|
Low GRADE |
Procedural sedation with etomidate may result in an increase of apnoea when compared with procedural sedation with propofol.
Source: Lewis (2015) (Broch Porcar, 1999; Canessa, 1991; Coll-Vinent, 2003; Hullander, 1993; Kick, 1996; Munoz, 2002); Kim (2017). |
Oxygen desaturation
|
Low GRADE |
Procedural sedation with etomidate may result in a reduction of oxygen desaturation when compared with procedural sedation with propofol.
Source: Massaeli (2020) (Miner, 2007); Kim (2017). |
Mortality
|
Low GRADE |
Procedural sedation with etomidate may result in little to no difference in mortality when compared with procedural sedation with propofol.
Source: Kim (2017). |
Patient satisfaction
|
Low GRADE |
Procedural sedation with etomidate may result in little to no difference in mortality when compared with procedural sedation with propofol.
Source: Kim (2017). |
Care provider satisfaction
|
Low GRADE |
Procedural sedation with etomidate may result in little to no difference in mortality when compared with procedural sedation with propofol.
Source: Kim (2017). |
Samenvatting literatuur
Description of studies
The systematic review of Lewis (2015) aimed to compare the safety, effectiveness and adverse events associated with various anaesthetic or sedative agents used in direct current cardioversion for cardiac arrhythmia in both elective and emergency settings. Lewis (2015) included studies that: (1) were performed in participants aged sixteen years or older who were undergoing elective or emergency electrical cardioversion with the use of sedation or anaesthesia with or without supplemental analgesia; (2) trials examined a mixed participant population such as some participants younger than sixteen years or (3) some participants undergoing additional procedures, only of the results pertaining to our population were reported separately; and (4) studies that compared different drugs between or within the above groups, or different doses of the same agent. Trials of cardioversion that took place during other procedures or operations were excluded. The study of Lewis (2015) searched the Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE via Ovid (from 1946 to March 2014), EMBASE via Ovid (from 1974 to March 2014), and the cumulative Index to Nursing and Allied health Literature (CINAHL) via ABSCO. They also searched trial registers such as www.clinicaltrials.gov and the Current Controlled Clinical Trials website (http://www.controlled-trials.com/) for ongoing trials. In total, 23 RCTs, including 1250 participants were included in the study. For the purpose of this guideline, seven of these trials compared etomidate with propofol, involving 279 patients, and were eligible for inclusion (Broch Porcar, 1999; Canessa, 1991; Coll-Vinent, 2003; Herregods, 2003; Kick, 1996; Munoz, 2002; Hullander, 1993). One study had a crossover study design (Herregods, 2003), while the other six trials had a parallel study design. The Cochrane ‘Risk of bias’ tool was used to assess the quality of the study design and the extent of potential bias. The reported outcome measure in the study was complications (hypotension and apnoea).
The systematic review of Massaeli (2020) aimed to compare the efficacy of sedatives applied for procedural sedation and analgesia in emergency departments. Massaeli (2020) included studies with (1) a clear description of the treatment protocol; (2) provision of objective results and measurements, and (3) publications in English language. Studies that investigated subjects under fourteen years of age, with insufficient data, included animal samples, examinated medications other than midazolam, etomidate, propofol, fentanyl, ketamine, and ketofol for procedural sedation and analgesia; and studies with sample sizes smaller than 40 were excluded. The study of Massaeli (2020) searched in four electronic databases, including Google Scholar, PubMed, Web of Science, MEDLINE, Scopus, and EMBASE up to 2019. In total, 35 RCTs, including 4041 participants, were included in the study. For the purpose of this guideline, three of these trials compared etomidate with propofol, involving 354 patients, and were eligible for inclusion (Desai, 2015; Miner, 2007; Song, 2015). However, Song (2015) did not report relevant outcome measures and was therefore excluded from this review. Both included RCTs had a parallel study design. The Cochrane Collaboration tool was used the assess the risk of bias in the included trials. The reported outcome measure in the study was complications (respiratory adverse events and oxygen desaturation).
The randomized, double-blinded, prospective controlled trial of Kim (2017) compared the safety profiles including the proportion of patients with any cardiopulmonary adverse event and efficacy of sedation between etomidate and propofol targeted for deep sedation in patients undergoing endoscopic ultrasonography. In total, 128 patients were randomized into two groups. The patients in the intervention group (n=64) received an initial 0.1 mg/kg (0.05 mL/kg) etomidate bolus administered intravenously, followed by titration with 0.05 mg/kg (0.025 mL/kg) boluses. The patients in the control group (n=64) received an initial 0.5 mg/kg (0.05 mL/kg) propofol bolus administered intravenously, followed by titration with 0.25 mg/kg (0.025 mL/kg) boluses. For both groups, additional intravenous boluses of each medication were administered every 60 seconds until the patient fell asleep. The reported outcome measures in the study were complications (minor and major adverse events) patient satisfaction, and satisfaction of care provider.
Results
Safety
Hypotension
The outcome measure hypotension was reported in two studies (Broch Porcar, 1999; Kim, 2017). The study of Broch Porcar (1999) (Lewis, 2015) defined hypotension as more than 20% decrease in systolic blood pressure or more than 20 mmHg fall in systolic blood pressure to less than 100 mmHg or the need for fluid intervention. Kim (2017) defined hypotension as a systolic blood pressure of less than 90 mmHg.
The mean drop in arterial blood pressure in the study of Broch Porcar (1991) (Lewis, 2015) in the intervention group (n=13) was 0.3 (8.0) mmHg, compared to 24.0 (8.0) in the control group (n=13). This resulted in a mean difference (MD) of -23.70 (95% CI -29.85 to -17.55), in favor of the intervention group. This was considered as a clinically relevant difference.
The incidence of hypotension in the study of Kim (2017) in the intervention group was 0/64 (0%), compared to 2/64 (3.12%) in the control group. This resulted in a relative risk (RR) of 0.20 (95% CI 0.01 to 4.09), in favor of the intervention group. This is considered as a clinically relevant difference.
Apnoea
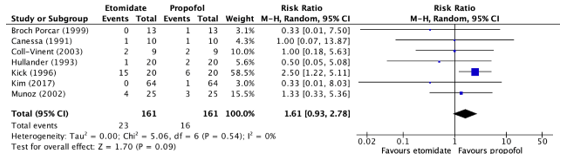
The outcome measure apnoea was reported in seven studies (Broch Porcar, 1999; Canessa, 1991; Coll-Vinent, 2003; Kick, 1996; Kim, 2017; Munoz, 2002; Hullander, 1993). The results were pooled in a meta-analysis. The pooled incidence of apnoea in the intervention group was 23/161 (14.3%), compared to 16/161 (9.9%) in the control group. This resulted in a pooled relative risk (RR) of 1.61 (95% CI 0.93 to 2.78), in favor of the control group. This was considered as a clinically relevant difference.
Figure 1. Forest plot showing the comparison between sedation using etomidate relative to sedation using propofol for desaturation. Pooled risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
Oxygen desaturation
The outcome measure oxygen desaturation was reported in two studies (Kim, 2017; Miner, 2007).
The incidence of oxygen desaturation in the study of Kim (2017) in the intervention group was 4/64 (6.25%), compared to 20/64 (31.25%) in the control group. This resulted in a relative risk (RR) of 0.20 (95% CI 0.07 to 0.55), in favor of the intervention group. This was considered as a clinically relevant difference.
The incidence of oxygen desaturation in the study of Miner (2007) in the intervention group was 10/105 (9.5%), compared to 46/109 (42.4%). This resulted in a relative risk (RR) of 0.23 (95% CI 0.12 to 0.42), in favor of the intervention group. This was considered as a clinically relevant difference.
Mortality
The outcome measure mortality was reported in one study (Kim, 2017).
The incidence of mortality in the study of Kim (2017) in both the intervention and control group was 0/64 (0%). A relative risk ratio could not be calculated as the number of events in both groups was zero. This was not considered as a clinically relevant difference.
Patient satisfaction
The outcome measure patient satisfaction was reported in one study. The trial of Kim (2017) measured patient satisfaction by using a ten centimeter visual analog scale ranging from 0 (worst procedure) to 10 (absolutely satisfied). The mean (SD) patient satisfaction score in the intervention group was 9.20 (1.03), compared to 8.87 (1.13) in the control group. This resulted in a mean difference (MD) of 0.33 (95% CI -0.04 to 0.70), in favor of the intervention group. This was not considered as a clinically relevant difference.
Care provider satisfaction
The outcome measure care provider satisfaction was reported in one study. The trial of Kim (2017) measured care provider satisfaction by using a ten centimeter visual analog scale ranging from 0 (worst procedure) to 10 (absolutely satisfied). The mean (SD) care provider satisfaction score for the intervention group was 8.42 (2.07), compared to 7.73 (1.70) for the control group. This resulted in a mean difference (MD) of 0.69 (95% CI 0.03 to 1.35), in favor of the intervention group. This was not considered as a clinically relevant difference.
Level of evidence of the literature
Safety
Hypotension
The level of evidence regarding the outcome measure hypotension comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding of patients and personnel in the studies (risk of bias, -1) and the wide confidence interval crossing the boundaries of clinical relevance. (imprecision, -1). The level of evidence was low.
Apnoea
The level of evidence regarding the outcome measure apnoea comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of a lack of blinding of patients and personnel in the studies (risk of bias, -1), conflicting results (inconsistency, -1). The level of evidence is low.
Oxygen desaturation
The level of evidence regarding the outcome measure oxygen desaturation comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding of patients in the study of Kim (2017) (risk of bias, -1) and the small number of included patients (imprecision, -1). The level of evidence is low.
Mortality
The level of evidence regarding the outcome measure mortality comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of the small number of events (imprecision, -1). The level of evidence is moderate.
Patient satisfaction
The level of evidence regarding the outcome measure patient satisfaction comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding of patients in the study of Kim (2017) (risk of bias, -1) and the small number of included patients (imprecision, -1). The level of evidence is low.
Care provider satisfaction
The level of evidence regarding the outcome measure care provider satisfaction comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of a lack of blinding of patients in the study of Kim (2017) (risk of bias, -1) and the small number of included patients (imprecision, -1). The level of evidence is low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of sedation with etomidate compared to propofol on complications, patient satisfaction, and caregiver satisfaction in adult patients undergoing PSA outside the operating room?
P: Patients undergoing procedural sedation and analgesia
I: Etomidate only
C: Propofol only
O: Complications, patient satisfaction, and satisfaction of care provider
Relevant outcome measures
The guideline development group considered safety (complications, such as hypotension apnoea, oxygen desaturation, and mortality) as a critical outcome measure for decision making; and patient satisfaction and satisfaction of care provider as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a threshold of 10% for continuous outcome measures and 25% threshold in relative risk (RR) for dichotomous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 22nd of July 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 119 hits. Studies were selected based on the following criteria: systematic reviews and randomized controlled trials regarding the effect of sedation with etomidate in adult outpatients undergoing procedural sedation and analgesia. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, twelve studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Broch Porcar, M. J., Valentin Segura, V., Murcia Llacer, B., & Bartual Lopez, E. (1999). Comparative assessment of etomidate, propofol and midazolam in elective cardioversion. MEDICINA INTENSIVA, 23, 209-215.
- Canessa R, Lema G, Urzúa J, Dagnino J, Concha M. Anesthesia for elective cardioversion: a comparison of four anesthetic agents. J Cardiothorac Vasc Anesth. 1991 Dec;5(6):566-8. doi: 10.1016/1053-0770(91)90007-g. PMID: 1768820.
- Coll-Vinent B, Sala X, Fernández C, Bragulat E, Espinosa G, Miró O, Millá J, Sánchez M. Sedation for cardioversion in the emergency department: analysis of effectiveness in four protocols. Ann Emerg Med. 2003 Dec;42(6):767-72. doi: 10.1016/s0196-0644(03)00510-9. PMID: 14634601.
- Herregods LL, Bossuyt GP, De Baerdemaeker LE, Moerman AT, Struys MM, Den Blauwen NM, Tavernier RM, Mortier E. Ambulatory electrical external cardioversion with propofol or etomidate. J Clin Anesth. 2003 Mar;15(2):91-6. doi: 10.1016/s0952-8180(02)00520-2. PMID: 12719046.
- Hullander RM, Leivers D, Wingler K. A comparison of propofol and etomidate for cardioversion. Anesth Analg. 1993 Oct;77(4):690-4. doi: 10.1213/00000539-199310000-00006. PMID: 8214650.
- Kick O, Böhrer H, Motsch J, Kessler J, Conradi R, Martin E. Etomidat versus Propofol zur Anästhesie bei ambulanter Kardioversion [Etomidate versus propofol for anesthesia in ambulatory cardioversion]. Anasthesiol Intensivmed Notfallmed Schmerzther. 1996 Jun;31(5):288-92. German. doi: 10.1055/s-2007-995922. PMID: 8767241.
- Kim MG, Park SW, Kim JH, Lee J, Kae SH, Jang HJ, Koh DH, Choi MH. Etomidate versus propofol sedation for complex upper endoscopic procedures: a prospective double-blinded randomized controlled trial. Gastrointest Endosc. 2017 Sep;86(3):452-461. doi: 10.1016/j.gie.2017.02.033. Epub 2017 Mar 8. PMID: 28284883.
- Lewis SR, Nicholson A, Reed SS, Kenth JJ, Alderson P, Smith AF. Anaesthetic and sedative agents used for electrical cardioversion. Cochrane Database Syst Rev. 2015 Mar 22;2015(3):CD010824. doi: 10.1002/14651858.CD010824.pub2. PMID: 25803543; PMCID: PMC6353050.
- Massaeli, M., Nasouhi, S., Motallebzadeh, A., & Shahabian, M. (2020). Midazolam, Etomidate, Propofol, Fentanyl, Ketamine, and Propofol/Ketamine for Procedural Sedation and Analgesia Among Adults in the Emergency Departments: A Systematic Review. Shiraz E-Medical Journal, 21(9).
- Miner JR, Danahy M, Moch A, Biros M. Randomized clinical trial of etomidate versus propofol for procedural sedation in the emergency department. Ann Emerg Med. 2007 Jan;49(1):15-22. doi: 10.1016/j.annemergmed.2006.06.042. Epub 2006 Sep 25. PMID: 16997421.
- Munoz Martinez T, Castedo Gonzalez JF, Castaneda Saiz A, Dudagoitia Otaolea JL, Poveda Hernandez Y, Iribarren Diarasarri S. Sedation for electrical cardioversion. A comparison of low doses of propofol and etomidate. [Spanish]. Medicina Intensiva 2002; Vol. 26, issue 3: 98-103.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Lewis (2015) |
SR and meta-analysis of RCTs
Literature search up to March 2014.
Study design: RCT parallel and one cross-over design (Herregods 2003)
Setting and Country: Not reported. Source of funding and conflicts of interest: Not reported.
|
Inclusion criteria SR:
Exclusion criteria SR:
Seven studies included
Important patient characteristics at baseline:
N
Sex, M/F: B: 14/8 C: 19/6 E: 28/13 G: 27/13 Others: not reported.
|
Describe intervention:
|
Describe control:
|
End-point of follow-up: Not reported.
For how many participants were no complete outcome data available? None.
|
Outcome measure: hypotension (complications) defined as drop in arterial pressure, mean (SD) A I: 0.3 (8.0) C: 24.0 (8.0)
Effect measure: mean difference [95% CI]: A: MD -23.70 (95% CI -29.85 to -17.55)
Pooled effect (random effects model): MD -23.70 (95% CI -29.85 to -17.55) favoring etomidate Heterogeneity (I2): not applicable
Outcome measure: apnoea, n/N (%) A In: 0/13 (0%) Con: 1/13 (7.7%)
B In: 1/10 (10.0%) Con: 1/10 (10.0%)
C In: 2/9 (22.2%) Con: 2/9 (22.2%)
E In: 15/20 (75.0%) Con: 6/20 (30.0%)
F In: 4/25 (16.0%) Con: 3/25 (12.0%)
In: 1/20 (5.0%) Con: 2/20 (10.0%)
Effect measure: RR [95% CI]: A: RR not estimable B: RR 1.00 (95% CI 0.07 to 13.87) C: RR 1.00 (95% CI 0.18 to 5.63) E: RR 1.13 (95% CI 0.66 to 1.91) F: RR 1.33 (95% CI 0.33 to 5.36) G: RR 0.50 (95% CI 0.05 to 5.08
Pooled effect (random effects model): RR 1.69 (95% CI 0.97 to 2.94) favoring propofol Heterogeneity (I2): 0%
|
Remarks
Author’s conclusion: Whilst we did not combine results from included studies, and as data on adverse events were limited, it is our opinion that at present, there is no evidence to indicate that current anaesthetic practice for cardioversion should change.
|
|
Massaeli (2020) |
SR and meta-analysis of RCTs
Literature search up to 2019
Study design: RCT parallel
Setting and Country: Emergency department.
Source of funding and conflicts of interest: The authors declared no conflicts of interest. The study received no funds or financial supports.
|
Inclusion criteria SR:
Exclusion criteria SR:
Three studies included
Important patient characteristics at baseline:
N
Sex, M/F:
Groups comparable at baseline? Yes |
Describe intervention:
|
Describe control:
|
End-point of follow-up: Not reported.
For how many participants were no complete outcome data available? None.
|
Outcome measure: complications defined as respiratory adverse events, n/N (%)
Effect measure: RR [95% CI]: A In: 5/30 (16.7%) Con: 10/30 (33.3%)
B In: 36/105 (34.3%) Con: 46/109 (42.2%)
Pooled effect (random effects model) RR 0.77 [95% CI 0.56 to 1.06] favoring etomidate. Heterogeneity (I2): 0%
Outcome measure: complications defined as oxygen desaturation, n/N (%) B In: 10/105 Con: 10/109 (9.2%)
Effect measure: RR [95% CI]: B: RR 1.04 (95% CI 0.45 to 2.39)
|
Remarks
Author’s conclusion:
|
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Kim (2017) |
Type of study: Randomized, double-blinded, prospective study.
Setting and country: Hospital.
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: N=128 Intervention: N=64 Control: N=64
Important prognostic factors2: age (SD): I: 54.17 (14.47) C: 49.83 (16.91) P=0.121
Sex: I: 29/64 (45.31%) M C: 33/64 (51.56%) M P=0.596
Groups comparable at baseline? Yes.
|
Describe intervention (treatment/procedure/test):
Initial 0.1 mg/kg etomidate (0.05 mL/kg) bolus administered intravenously, followed by titration with 0.05 mg/kg (0.025 mL/kg) boluses.
|
Describe control (treatment/procedure/test):
Initial 0.5 mg/kg propofol (0.05 mL/kg) bolus administered intravenously, followed by titration with 0.25 mg/kg boluses. |
Length of follow-up: Not reported.
Loss-to-follow-up: None.
Incomplete outcome data: None.
|
Outcome measure: adverse events
Major adverse events Endotracheal intubation, n/N (%) I: 0/64 (0%) C: 0/64 (0%)
Permanent neurologic impairment, n/N (%) I: 0/64 (0%) C: 0/64 (0%)
Mortality, n/N (%) I: 0/64 (0%) C: 0/64 (0%)
Minor adverse events All cardiopulmonary adverse events, n/N (%) I: 22/64 (34.8%) C: 33/64 (51/56%) P=0.074
Oxygen desaturation, n/N (%) I:4/64 (6.25%) C: 20/64 (31.25%) P=0.001
Respiratory depression, n/N (%) I: 5/64 (7.81%) C: 21/64 (32.81%) P=0.001
Apnea, n/N (%) I: 0/64 (0%) C: 1/64 (1.56%) P=1.000
Hypotension, n/N (%) I: 0/64 (0%) C: 3/64 (4.69%) P=0.243
Arrhythmia, n/N (%) I: 0/64 (0%) C: 2/64 (3.12%) P=0.476
Bradycardia, n/N (%) I: 10/64 (15.62%) C: 12/64 (18.75%) P=0.815
Tachycardia, n/N (%) I: 13/64 (20.31%) C: 15/64 (23.44%) P=0.831
Severe coughing, n/N (%) I: 9/64 (14.06%) C: 19/64 (29.69%) P=0.054
Needs for restraint, n/N (%) I: 5/64 (7.81%) C: 23/64 (35.94%) P<0.001
Myoclonus, n/N (%) I: 22/64 (34.37%) C: 8/64 (12.50%) P=0.012
Outcome measure: satisfaction score of patients, mean (SD) I: 9.20 (1.03) C: 8.87 (1.13) P=0.087
Outcome measure: satisfaction score of endoscopist, mean (SD) I: 8.42 (2.07) C: 7.73 (1.70) P=0.042
|
Author’s conclusion In conclusion, we demonstrated that etomidate resulted in fewer respiratory depression events and had a better sedative efficacy (at least equal or better sedation quality, and greater patient cooperation) than propofol, but was more frequently associated with myoclonus and increased intra- or post-operative blood pressure. Finally, with a lower rate of respiratory depression while providing deeper sedation, etomidate may be particularly useful in endoscopy centers where an Anesthesiologist is unavailable during the endoscopic procedure.
|
Quality assessment
Systematic reviews
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Lewis (2015) |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Massaeli (2020) |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Randomized controlled trials
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Kim (2017) |
Definitely yes;
Reason: Patients who met the inclusion criteria were randomly assigned to either the etomidate group or the propofol group.
|
Definitely yes;
Reason: Randomization was performed using a computer-generated randomization list. The allocation was concealed and kept in a sealed envelope, and the patients and the endoscopists were blinded to the randomization modality. Because etomidate and propofol were administered as milk-like aqueous solutions, they were unable to be identified.
|
Probably yes;
Reason: The allocation was concealed and kept in a sealed envelope, and the patients and the endoscopists were blinded to the randomization modality. However, there was a possibility of an incomplete blindness which was attributed to the predominant adverse events of each medication such as myoclonus or respiratory depression although we made an effort for blindness to treatment randomization, thus this possibility might have influenced even the results to a certain extent.
|
Definitely yes;
Reason: almost equal in both groups. |
Definitely yes;
Reason: all predefined outcome measures were reported. |
No information
Reason: - |
Low
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Choi (2018) |
Studies in SR included in SR of Lewis (2015). |
|
Liu (2021) |
Does not match PICO |
|
Kalogridaki (2011) |
Does not match PICO |
|
Desai (2015) |
Does not match PICO |
|
Xiao (2018) |
Does not match PICO |
|
Adinehmehr (2019) |
Does not match PICO |
|
Park (2018) |
Does not match PICO |
|
Zhou (2016) |
Does not match PICO |
|
Miner (2007) |
Matches PICO but the study is already included in the SR of Massaeli (2019) |
|
Bellolio (2016) |
Does not match PICO |
|
Toklu (2009) |
Does not match PICO |
|
Tanabe (2007) |
Wrong outcome measures |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 23-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij volwassen patiënten.
Werkgroep
- Prof. dr. B. Preckel (voorzitter), anesthesioloog, Amsterdam UMC locatie AMC, NVA
- dr. C.R.M. Barends, anesthesioloog, UMCG, NVA
- L.R.M. Braam, BSc. Sedatie Praktijk Specialist, Catharina Ziekenhuis, NVAM
- drs. R. Brethouwer, abortusarts, Beahuis & Bloemenhovekliniek Heemstede, NGvA
- dr. J.M. van Dantzig, cardioloog, Catharina Ziekenhuis, NVVC
- drs. V.A.A. Heldens, anesthesioloog, Maxima MC, NVA
-
dr. C. Heringhaus, SEH-arts/anesthesioloog, LUMC (t/m 12-2022), Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ (vanaf 01-2023), NVSHA
- T. Jonkergouw, MA. Adviseur Patiëntbelang, Patiëntenfederatie Nederland (tot april 2023)
- Broere, M. Junior beleidsadviseur, Patiëntenfederatie Nederland (vanaf april 2023)
- dr. M. Klemt-Kropp, MDL-arts, Noordwest Ziekenhuisgroep, NVMDL
- drs. B.M.F. van der Leeuw, anesthesioloog, Albert Schweitzer ziekenhuis, NVA
- S. Reumkens, MSc. Physician Assistant, Diakonessenhuis, NAPA
Klankbordgroep
- drs. T.E.A. Geeraedts, radioloog, Erasmus MC, NVvR
- drs. J. Friederich, gynaecoloog, Noordwest Ziekenhuisgroep, NVOG
- dr. E.H.F.M. van der Heijden, longarts, Radboud UMC, NVALT
- drs. J. de Hoog, oogarts, Amsterdam UMC locatie AMC, NOG
- drs. A. Kanninga, arts voor verstandelijk gehandicapten, Cordaan, NVAVG
- drs. H.W.N. van der Pas, tandarts, UMC Utrecht, VMBZ
- dr. ir. C. van Pul, klinisch fysicus, Maxima MC, NVKF
- dr. R.J. Robijn, MDL-arts, Rijnstate, NVMDL
- drs. W.S. Segers, klinisch Geriater, Catharina Ziekenhuis, NVKG
- Prof. dr. A. Visser, hoogleraar geriatrische tandheelkunde, UMCG en Radboud UMC, KNMT
Met ondersteuning van:
- dr. L. Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten
- drs. I. van Dusseldorp, senior literatuurspecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Preckel |
Anesthesioloog, hoogleraar anesthesiologie (in het bijzonder veiligheid in het perioperatieve proces) Amsterdam Universitair Medische Centra locatie AMC |
Onbetaalde nevenwerkzaamheden – commissie-werkzaamheden:
Lid Patient Safety and Quality Committee of the European Society of Anesthesiologists;
Lid Patient Safety Committee van de World Federation of Societies of Anesthesiologists;
Lid Raad Wetenschap en Innovatie van de Federatie Medisch Specialisten FMS;
Lid Commissie Wetenschap & Innovatie van de Nederlandse Vereniging voor Anesthesiologie NVA
Representative Council European Association of Cardiothoracic Anesthesiology and Intensive Care (EACTAIC)
Hoger leidinggevend personeel (penningmeester) van de “Stichting ter bevordering van de wetenschap en opleiding in de anesthesiologie”;
|
Research grants: European Society of Anesthesiology and Intensive Care ESAIC ZonMw NovoNordisk Netherland
Advisory board Sensium Healthcare United Kingdom
Geen van de gemelde belangen heeft relatie met het onderwerp van het advies/de richtlijn
|
Geen actie vereist |
|
Barends |
Anesthesioloog in het Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie vereist |
|
Braam |
Sedatiepraktijkspecialist Catharina Ziekenhuis Eindhoven |
Lid sedatie commissie NVAM (onbetaald) |
Geen |
Geen actie vereist |
|
Brethouwer |
Abortusarts te Beahuis & Bloemenhovekliniek (0,56 fte) en SAA (0,22 fte), Medisch coördinator Beahuis&Bloemenhovekliniek (0,33 fte) |
Penningmeester van het Nederlands Genootschap van Abortusartsen (onbetaald) Voorzitter landelijke werkgroep PSA van het NGvA (onbetaald) Bestuurslid van FIAPAC, een Europese abortus organisatie (onbetaald) |
Geen |
Geen actie vereist |
|
Broere |
Junior beleidsadviseur Patiëntenbelang - fulltime |
geen |
geen |
Geen actie vereist |
|
van Dantzig |
Cardioloog vrij gevestigd, Catharina Ziekenhuis 100% |
Lid Plenaire Visitatie Commissie NVVC (onbetaald) |
Op onze afdeling wordt extern gefinancierd onderzoek uitgevoerd maar niet op het gebied van de werkgroep. |
Geen actie vereist |
|
Heldens |
Anesthesioloog Maxima MC |
Geen |
Geen |
Geen actie vereist |
|
Heringhaus |
Vanaf 01-2023 Medisch manager Hyperbare Zuurstoftherapie Goes, MCHZ
t/m 12-2022 SEH-arts KNMG |
Trainingen voor verschillende onderwerpen gerelateerd aan acute zorg, hyperbare geneeskunde, PSA |
Geen |
Geen actie vereist |
|
Jonkergouw |
Junior beleidsadviseur - Patiëntenfederatie Nederland - 32 tot 36 uur per week |
Vrijwilliger activiteiten - Diabetes Vereniging Nederland - Zeer incidenteel |
Geen |
Geen actie vereist |
|
Klemt-Kropp |
MDL-arts, Noordwest Ziekenhuisgroep Alkmaar - Schagen - Den Helder (0.9 fte) |
Secretaris Concilium Gastroenterologicum, NVMDL tot 11 april 2022 (niet betaald) Voorzitter PSA commissie NVMDL (niet betaald) Docent Teach the Teacher AUMC en Noordwest Ziekenhuisgroep cursussen voor aios en medisch specialisten (betaalde functie, ongeveer 40 Std. per jaar)
Voorzitter Stichting MDL Holland-Noord (KvK 56261225) vanaf okt. 2012 t/m 31-12-2019. De stichting heeft in de laatste 3 jaar grants ontvangen van de farmaceutische industrie en van de farmaceutische industrie gesponsorde onderzoeken gefaciliteerd:
1. Ondersteuning optimalisering van zorg voor IBD-patiënten. Therapeutic drugmonitoring en PROMs bij patiënten met IBD. Zorgverbetertraject. PhD student, looptijd van 2015 tot op heden. Tot 2018 grant van Dr. Falk Pharma. vanaf 2018 grant van Janssen Cilag Geen relatie met sedatie 2.Retrieval of patients chronically infected with Hepatitis B or Hepatitis C in Northern Holland. Afgesloten 2018. Project gefinancierd met grant van Gilead. Geen relatie met sedatie 3. SIPI. Screening op Infectieuze aandoeningen in Penitentiaire Inrichtingen. Project gefinancierd met grants van AbbVie, MSD en Gilead. Project begin 2019 afgesloten. Geen relatie met sedatie 4. 3DUTCH trial. Een observationeel onderzoek naar de effectiviteit van een behandeling van chronische hepatitis C met een combinatie van de antivirale middelen ombitasvir - paritaprevir /ritonavir, ± dasabuvir, ± ribavirine. Sponsor AbbVie. Studie afgesloten Jan. 2018 Geen relatie met sedatie 5. Remsima switch IFX9501 - An open-label, multicenter, non- inferiority monitoring program to investigate the quality of life, efficacy and safety in subjects with Crohn’s Disease (CD), Ulcerative Colitis (UC) in stable remission after switching from Remicade® (infliximab) to Remsima® (infliximab biosimilar) L016-048. Sponsor: Munipharma. Afgelsoten augustus 2018. Geen relatie met sedatie 6. NASH - NN9931-4296 Investigation of efficacy and safety of three dose levels of subcutaneous semaglutide once daily versus placebo in subjects with non-alcoholic steatohepatitis L016-061. Sponsor NovoNordisk. Studie afgesloten Feb. 2020. Geen relatie met sedatie 7. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Induction Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 305). SHD-647-305. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 8. Randomized, Double-blind, Placebo-controlled, Parallel-group Efficacy and Safety Study of SHP647 as Maintenance Therapy in Subjects with Moderate to Severe Crohn's Disease (CARMEN CD 307). SHD-647-307. Sponsor Shire. Studie loopt sinds 2019. Geen relatie met sedatie 9. Estimating the prevalence of advanced liver fibrosis in a population cohort in care in Northern-Holland with the use of the non-invasive FIB-4 index. Grant van Gilead. Onderzoek afgesloten sept. 2019. Geen relatie met sedatie |
Incidenteel deelname aan advisory boards van de farmaceutische industrie (Gilead, Janssen Cilag, AbbVie: (hepatologische onderwerpen, vooral hepatitis C) Incidenteel voordrachten tijdens symposia gesponsord van de farmaceutische industrie (Gilead, AbbVie)
|
Geen actie vereist; meeste studies afgerond; nr. 1,7,8 lopen. Sponsoren (Dr. Falk Pharma & Shire) hebben geen relatie met sedatie. |
|
Reumkens |
Physician Assistant Anesthesiologie Radboud UMC |
Voorzitter vakgroep PA Anesthesiologie NAPA |
Geen |
Geen actie vereist |
|
Van der Leeuw |
Anesthesioloog |
Geen |
Geen |
Geen actie vereist |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Robijn |
Mdl arts rijnstate ziekenhuis Arnhem |
Geen |
Geen |
Geen actie vereist |
|
Van der Heijden |
Longarts |
Voormalig Secretaris Sectie Interventie longziekten NVALT (onbezoldigd)
Lid Board of National Delegates European Association of Bronchology and International Pulmonology (namens NL, onbezoldigd)
|
Buiten het veld van deze richtlijn heeft mijn afdeling de afgelopen 3 jaar vergoedingen ontvangen voor de volgende activiteiten: - unrestricted research grants: Pentax Medical Europe, Philips, Astra Zeneca, Johnson&Johnson. - adviseur / consultant: Pentax Medical, Philips IGT, Johnson&Johnson. - spreker: Pentax Medical. |
Geen actie vereist |
|
Van der Pas |
Tandarts, UMC Utrecht |
Commissielid Horace Wells van de KNMT, stimulatie van de intercollegiale samenwerking bij tandheelkundige behandeling van bijzondere zorggroepen met farmacologische ondersteuning. Onbetaald. Voormalig commissielid Bijzondere Zorggroepen van de KNMT, toegankelijkheid van mondzorg voor kwetsbare zorggroep. Betaald via vacatiegelden. Gastdocent opleiding mondzorgkunde HU. Lezing mondzorg aan mensen met een verstandelijke beperking. Betaald. Gastdocent opleiding verpleegkundig-specialist GGZ. Lezing mondzorg in de geestelijke gezondheidszorg Betaald. Cursusleider lichte sedatie in de mondzorg, BT Academy. Meerdaagse cursus voor tandartsen en mondhygienisten om zich te bekwamen in lichte sedatie, m.n. training in de inhalatiesedatie met lachgas-zuurstof mengsel middels titratietechniek. Betaald. |
Geen |
Geen actie vereist |
|
De Hoog |
Oogarts in Amsterdam UMC (0,2 fte.) en Retina Operatie Centrum Amstelveen (0,4 fte.). Medisch manager Retina Operatie Centrum (0,2 fte.) |
Voorzitter Werkgroep Vitreoretinale Chirurgie Nederland (onbetaald) Lid redactieraad vaktijdschrift 'De Oogarts', uitgave van BPM-medica (onbezoldigd) Medeorganisator Eilanddagen (bijscholing uveïtis voor oogartsen, onbetaald) |
Geen |
Geen actie vereist |
|
Geeraedts |
Interventieradioloog Afdeling Radiologie en Nucleaire geneeskunde Erasmus Medisch Centrum, Rotterdam |
Geen |
Geen |
Geen actie vereist |
|
Van Pul |
Klinisch fysicus in Maxima Medisch Centrum |
Universitair Hoofd Docent aan de Technische Universiteit van Eindhoven (0,2 fte). Daar supervisor van PhD studenten bij HTSM (NWO-TTW gesubsidieerd) project waaraan ook een industriële partner deelneemt (https://www.nwo.nl/projecten/15345-0).
|
Geen |
Geen actie vereist |
|
Friederich |
Gynaecoloog NWZ Den Helder, Algemeen gynaecoloog met als aandachtsgebieden benigne gynaecologie, minimaal invasieve chirurgie en bekkenbodemproblematiek |
Vicevoorzitter calamiteitencommissie NVZ lid klachtencommissie NWZ Den Helder |
Geen |
Geen actie vereist |
|
Segers |
Klinisch geriater, St. Jans Gasthuis, Weert
|
Klinisch farmacoloog in opleiding, Catharina ziekenhuis, Eindhoven Onbetaald |
Geen |
Geen actie vereist |
|
Kanninga |
Arts Verstandelijk Gehandicapten (arts VG) bij Cordaan Amsterdam Anesthesioloog niet praktiserend |
Geen |
Geen |
Geen actie vereist |
|
Visser |
Hoogleraar geriatrische tandheelkunde fulltime (1 fte) - Afdeling Gerodontologie, Centrum voor Tandheelkunde en Mondzorgkunde, Universitair Medisch Centrum Groningen, Rijksuniversiteit Groningen, Nederland - Afdeling Gerodontologie, Faculteit Tandheelkunde, Radboud UMC, Radboud Universiteit Nijmegen, Nederland |
Geen |
Geen |
Geen actie vereist |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. Aanvullend heeft een afgevaardigde van de Patiëntenfederatie Nederland deelgenomen in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming gedaan of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie ook het hiervoor gebruikte stroomschema dat als uitgangspunt voor de beoordeling is gebruikt).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn. Een overzicht van uitkomsten van de kwalitatieve raming met bijbehorende toelichting vindt u in onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Submodule Etomidaat |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Obstetrie en Gynaecologie, Nederlandse Vereniging voor Cardiologie, de Nederlandse Vereniging van Maag-Darm-Leverartsen, de Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied, de Nederlandse Vereniging voor Intensive Care, de Nederlandse Internisten Vereniging, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, het Nederlands Genootschap van Abortusartsen, de Nederlandse Vereniging van Anesthesiemedewerkers, de Verpleegkundigen & Verzorgenden Nederland, de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie, de Vereniging Mondzorg voor Bijzondere Zorggroepen, Stichting Kind & Ziekenhuis, Inspectie Gezondheidszorg en Jeugd en de Vereniging van Artsen voor Verstandelijk Gehandicapten via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.