Nuchter zijn voor PSA
Uitgangsvraag
Welke mate van nuchter zijn is nodig voor PSA, rekening houdend met patiëntkarakteristieken (zoals leeftijd, ASA-klasse, comorbiditeit, comedicatie), de beoogde sedatietechniek en de geplande procedure?
Aanbeveling
Anxiolyse / lichte PSA
Tijdens PSA die anxiolyse of een licht sedatieniveau beoogt, zijn geen bijzondere voorzorgsmaatregelen nodig ten aanzien van het verminderen van de kans op aspiratie. Enige vorm van nuchterheid voor vaste of vloeibare inname is niet nodig.
Matige / diepe PSA
I: Heroverweeg in de lokale sedatiecommissie de nuchterheidsvoorschriften voor matige tot diepe PSA bij kinderen in nauw overleg met de afdeling anesthesiologie. Stel samen een werkwijze op waarbij de mogelijkheden (zie hieronder bij II) tot een liberaal nuchterbeleid voor kinderen die een procedure met matige tot diepe PSA moeten ondergaan optimaal worden benut.
II: Weeg risicofactoren met betrekking tot kans op aspiratie tijdens PSA waarbij een matig tot diep sedatieniveau beoogd wordt, middels een pre-sedatie assessment en stratificeer (punt 1) en hanteer bijpassende nuchterheidsregels (punt 2) als volgt:
1. Stratificeer patiëntgebonden én proceduregebonden risicofactoren in een van de drie onderstaande groepen (verwaarloosbaar, mild of matig verhoogd risico op aspiratie):
A. Factoren passend bij een verwaarloosbaar risico op aspiratie
Patiëntgebonden risicofactoren
-
-
Geen risicofactoren zoals hieronder beschreven bij 1.B of 1.C
-
Proceduregebonden risicofactoren
-
-
Geen risicofactoren zoals hieronder beschreven bij 1.B of 1.C
-
B. Factoren passend bij een mild verhoogd risico op aspiratie
Patiëntgebonden risicofactoren
-
-
Lichte systemische aandoening (ASA 2)
-
Gematigde obesitas (bij kinderen vanaf 85ste tot 95ste percentiel voor Body Mass Index, gebaseerd op leeftijd en geslacht)
-
Leeftijd 12 maanden of jonger
-
Hiatus hernia (anatomische gastro-oesofageale reflux)
-
-
Endoscopie via nasale/orale route */**
-
Bronchoscopie **
-
Diepe sedatie met propofol
C. Factoren passend bij een matig verhoogd risico op aspiratie
Patiëntgebonden risicofactoren
-
-
Ernstige systemische ziekte met ernstige beperking (ASA 3) of bedreiging voor het dagelijks leven (ASA 4)
-
Ernstige obesitas (bij kinderen vanaf 95ste percentiel voor Body Mass Index, gebaseerd op leeftijd en geslacht)
-
Luchtwegafwijkingen (zoals micrognatie, macroglossie, laryngomalacie)
-
Hyperemesis, oesophagusafwijkingen (zoals gastroparese, achalasie, atresie, stricturen, tracheo-oesophageale fistel), darmobstructie (zoals ileus, pseudo-obstructie, pylorusstenose, invaginatie)
-
-
Verwachte behoefte aan een vorm van beademing (zoals masker-en-ballonbeademing, slaapapneu-masker) of ander geavanceerd luchtwegmanagement (zoals nasale of orale guedel, larynxmasker)
2. Verzorg matige tot diepe PSA voor electieve procedures als de patiënt voldoet aan onderstaande nuchterheidsstatus voor vast en vloeibaar voedsel:
A. Bij een verwaarloosbaar risico op aspiratie (hanteer de 2-0-0 regel)
-
-
Tot 2 uren tevoren: vast voedsel, zuigelingenvoeding, zuivel
-
Tot vertrek naar de PSA-locatie: borstvoeding / moedermelk
-
Tot vertrek naar de PSA-locatie: helder vloeibaar
-
B. Bij een mild verhoogd risico op aspiratie (hanteer de 4-2-0 regel)
-
-
Tot 4 uren tevoren: vast voedsel, zuigelingenvoeding, zuivel
-
Tot 2 uren tevoren: borstvoeding / moedermelk
-
Tot vertrek naar de PSA-locatie: helder vloeibaar
-
C. Bij matig verhoogd risico op aspiratie (hanteer de 6-4-1 regel***)
Verwijs naar of overleg met een (kinder-)anesthesioloog of PSA-specialist.
Matige tot diepe PSA bij dringende of spoedeisende procedures:
A. Bij verwaarloosbaar risico op aspiratie:
-
-
Stel de procedure niet uit omwille van de eventueel te korte nuchterheidstijd.
-
B. Bij mild verhoogd risico op aspiratie:
-
-
Stel de procedure niet uit omwille van de eventueel te korte nuchterheidstijd.
-
C. Bij matig verhoogd risico op aspiratie:
-
-
Overleg met/verwijs altijd naar een (kinder)anesthesioloog. Alleen indien anesthesiologische ondersteuning niet mogelijk is: overweeg PSA te verrichten met uitsluitend esketamine als sedativum.
-
* Voor een electieve gastroduodenoscopie of colonoscopie zal een MDL-arts doorgaans een nuchterheidsregime voorschrijven met als doel een lege maag of colon.
** Overleg op lokaal niveau (sedatiecommissie) met de discipline die de PSA of algehele anesthesie voor deze procedures verzorgt en maak lokale afspraken m.b.t. het te hanteren nuchterheidsbeleid.
*** In overleg met de afdeling anesthesiologie kan de lokale sedatiecommissie beslissen om deze regel te versoepelen tot een 6-4-0 regel
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van een prospectieve observationele studie (Chumpitazi, 2018) is het niet duidelijk of een kortere periode van nuchter zijn voor PSA tot langere opnameduur of meer complicaties leidt. In de studie werden verschillende middelen gebruikt om PSA uit te voeren (ketamine, midazolam, en andere niet gespecificeerde middelen). De bewijskracht is zeer laag.
Naast het beschikbare directe bewijs werden ook twee recent gepubliceerde consensus guidelines geraadpleegd:
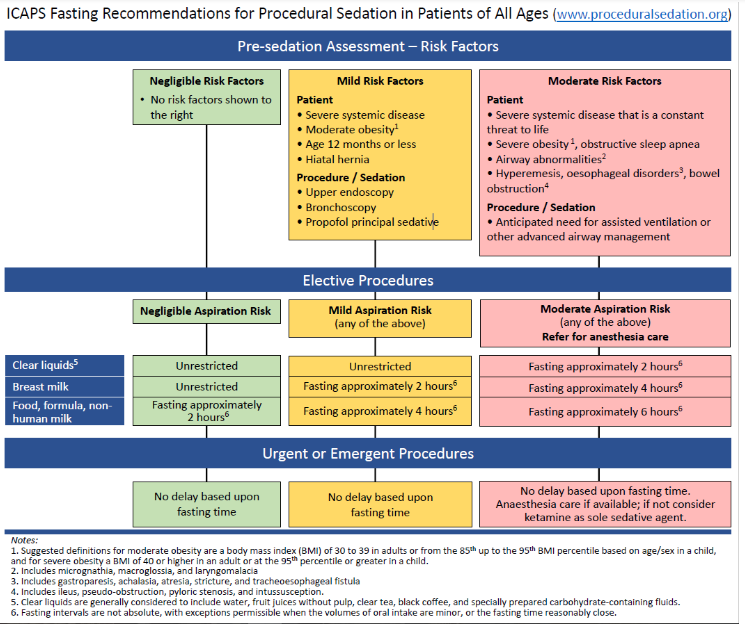
Het multidisciplinaire International Committee for the Advancement of Procedural Sedation (ICAPS) publiceerde in 2020 de eerste specifieke aanbevelingen ten aanzien van nuchterheid en aspiratiepreventie in het kader van PSA bij kinderen en volwassenen. (Green, 2020) Op basis van een uitgebreide literatuurstudie aan de hand van 6 klinische uitgangsvragen, wordt geconcludeerd dat aspiratie bij PSA minder vaak voorkomt dan tijdens algehele anesthesie, omdat deze procedures vaak kort zijn, luchtwegreflexen intact blijven, er minder luchtwegmanipulatie plaatsvindt en er over het algemeen geen emetogene medicatie (bijvoorbeeld inhalatie anesthetica) gebruikt worden. Ook wordt vastgesteld dat klassieke nuchterheidsregels niet leiden tot verminderde maagvulling of tot een verlaagd aspiratierisico, maar wel geassocieerd zijn met meer onaangename bijwerkingen zoals verhoogde prikkelbaarheid, dehydratie, hypoglykemie en bij kinderen tot verhoogde kans op falen van het sedatieplan. Daarmee is de (theoretische) basis voor minder stringente regels voor nuchter blijven voor PSA redelijk. In een internationale, multidisciplinaire consensus richtlijn, die tot stand kwam via een Delphi proces, komen de auteurs vervolgens tot aanbevelingen voor zowel volwassenen als kinderen. De richtlijn hanteert een algoritme dat de risico’s voor aspiratie stratificeert op basis van de patiëntkarakteristieken, de soort procedure, de sedatietechniek en de mate van urgentie (electief versus dringend). Het algoritme genereert 3 risicocategorieën en formuleert een bijpassend advies ten aanzien van de wenselijke mate van nuchterheid. (zie Figuur hieronder, www.proceduralsedation.org)
De European Society of Anaesthesiology and Intensive Care (ESAIC) publiceerde in 2022 haar nieuwe richtlijn ten aanzien van pre-operatieve nuchterheid en preventie van aspiratie bij kinderen die anesthesie moeten ondergaan (Frykholm, 2022). Op basis van 6 uitgangsvragen werd de literatuur onderzocht. Bij een gebrek aan voldoende RCT’s werden ook quasi-randomized, observationele en retrospectieve studies meegenomen. De GRADE methodologie werd gebruikt om de kwaliteit te beoordelen van de geïncludeerde evidence. De uiteindelijke aanbevelingen kwamen tot stand via een Delphi proces. In totaal worden 26 aanbevelingen en suggesties gedaan.
Ook deze richtlijn waarschuwt voor de nadelige effecten van te lang nuchter zijn en stelt vast dat er geen duidelijk verband is tussen mate van nuchterheid en risico op aspiratie. De richtlijn beveelt aan om kinderen die electieve ingrepen ondergaan, tot 1 uur voor inductie van algehele anesthesie helder vloeibaar vocht te laten innemen (water met/zonder suiker, vruchtensap zonder pulp, thee of koffie zonder melk). Tevens stelt de richtlijn de overweging voor dat een lichte maaltijd (vast voedsel en/of niet heldere vloeistoffen) tot 4 uur voor start van algehele anesthesie waarschijnlijk acceptabel is (Frykholm, 2022).
Het (op enkele punten) verkorten van de periode voor nuchter blijven voor algehele anesthesie door ESAIC ondersteunt het verkorten van de periode voor nuchter blijven voor PSA zoals Green 2020 voorstaat.
Een bijzondere situatie doet zich voor bij PSA op basis van lachgas. Het gebruik van lachgas verhoogt de kans op misselijkheid en braken. De gerapporteerde incidentie van braken varieert van 2,4% (Tsze, 2016) tot 5,7% (bij gebruik van een concentratie van 70%; Babl, 2008). Toch hoeven deze kinderen in het algemeen niet nuchter te zijn. De kans op aspiratie tijdens deze vorm van PSA is immers zeer klein. Dat heeft te maken met het slechts lichte sedatieniveau en het behoud van luchtwegreflexen. In de hele literatuur is slechts 1 casus beschreven van een laryngospasme met aspiratie tijdens een sedatie met lachgas. Het ging daarbij om een kind van 16 maanden dat via een continue flow een lachgasconcentratie van 70% inhaleerde en daarbij onbedoeld in een diep sedatieniveau terecht kwam. (Babl, 2015). Deze situatie wijkt in belangrijke mate af van de manier waarop in Nederland PSA met lachgas bij kinderen wordt toegepast: via een on-demand klep die door een professional wordt vastgehouden, meestal kinderen ouder dan 3-4 jaar en met een lachgasconcentratie van meestal 50%. Hierbij is het zeer onwaarschijnlijk dat een kind een onverwacht diep sedatieniveau bereikt of dat de luchtwegreflexen verminderd zullen zijn. Bij het gebruik van lachgas onafhankelijk van de wijze van toediening (on-demand of via continue flow) zal de professional continu de inhalatie van lachgas en ademhaling en luchtweg monitoren en daarbij in continue interactie staan met het kind dat hiervoor bovendien ook coöperatief moet zijn.
Bij de combinatie van lachgas met intranasale fentanyl wordt de kans op braken hoger, met gerapporteerde incidenties van 4-30% (Hoeffe, 2017; Seith, 2012; Fauteux-Lamarre, 2020; Hoeffe, 2022). Deze studies rapporteren vooral kinderen die zeer pijnlijke procedures op een SEH ondergingen. De studies waarbij gebruik werd gemaakt van lachgas 70% vonden de hoogste incidentie van braken. De recente retrospectieve studie van Hoeffe et al (2022), waarbij de lachgasconcentratie 50% was, vermeldt een incidentie van slechts 4% braken. In deze studies (met in totaal bijna 1000 geïncludeerde sedaties) deed zich geen enkel ernstig incident voor en was de incidentie van aspiratie 0%. Premedicatie met een anti-emeticum (ondansetron) lijkt overigens niet te resulteren in een significante daling van de kans op braken. (Fauteux-Lamarre 2020)
De werkgroep meent te kunnen concluderen dat het gebruik van lachgas 50 % toegediend met een on-demand klep en in combinatie met fentanyl intranasaal een hogere kans op braken geeft maar nog steeds een extreem lage kans op aspiratie. Op de SEH wachten tot iemand ‘nuchter’ is zal deze kans niet reëel verder doen dalen. Wel is het zo dat de sedationist voor lachgas-fentanyl aanvullende training moet hebben gehad en moet weten dat de kans op braken reëel is zodat indien nodig adequaat kan worden gehandeld. Indien een kind tijdens PSA met lachgas braakt kan in veel gevallen de sedatie na het braken worden hervat, op voorwaarde dat er nog steeds sprake is van een veilige en comfortabele situatie.
Voor een electieve PSA met lachgas (al dan niet in combinatie met intranasale fentanyl) dient een kind evenmin nuchter te zijn. Vanuit comfort-overwegingen en gezien de kans op misselijkheid of braken is het wel aan te raden dat een kind niet net voorafgaand aan een PSA met lachgas heeft gegeten.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Van kind en ouders/verzorgers mag men verwachten dat zij zullen kiezen voor een behandeling die zo min mogelijk discomfort geeft. Zij zullen er van uit gaan dat de door de professional aangedragen methoden/interventies voldoende veilig zijn om de kans op welk risico dan ook te minimaliseren.
Er zijn vele voordelen als kinderen langer naar eigen behoefte mogen eten en/of drinken vergeleken met de geldende regels voor nuchter blijven. Zij zullen dit als minder belastend ervaren, minder last hebben van honger en zich daardoor fitter voelen. Daarnaast is er minder kans op hypoglykemie en/of dehydratie met bijbehorend klachtenpatroon. Ouders/verzorgers zullen het verkort nuchter houden van hun kind voor een procedure als minder stressvol ervaren.
Voor subgroepen zoals neonaten en jonge kinderen bestaat er een sterke wens tot niet (lang) nuchter blijven. Nuchter moeten blijven zorgt bij een deel van hen voor onrust en/of huilen. Dit gedrag is juist ongewenst omdat zij zich in zo’n situatie minder goed laten voorbereiden en/of begeleiden waardoor er mogelijk een hogere dosis medicatie nodig kan zijn en er zelfs een toegenomen kans is op falen van de PSA.
Kinderen met een verstoorde glucosehuishouding zijn beter af wanneer het nuchter zijn zo kort mogelijk duurt. Voor een deel van hen zal daarmee de noodzaak tot bijvoorbeeld toediening van glucose middels infuus of neusmaagsonde ter overbrugging van de nuchter periode vermeden kunnen worden.
Kosten (middelenbeslag)
Minder strenge regels voor nuchter blijven ten behoeve van PSA zal bij kinderen waarschijnlijk voor meer bereidwilligheid zorgen om het daadwerkelijk vol te houden. Bij electieve PSA is er daardoor minder kans op afwijzen voor de procedure vanwege eventueel niet voldoende nuchter zijn. Het verliezen van een (kostbare) reservering, inclusief het daarvoor geplande personeel, kan daarmee voorkomen worden. Bij niet electieve zorg, zoals op een SEH, zorgen minder stringente regels in het kader van nuchter blijven voor snellere doorlooptijden.
Aanvaardbaarheid, haalbaarheid en implementatie
Paradigmaverschuiving
Traditionele adviezen ten aanzien van nuchterheid in het kader van een algehele anesthesie (en later overgenomen voor PSA) zijn ingegeven vanuit de angst voor mogelijke pulmonale aspiratie van maaginhoud en werden lange tijd als een onbetwistbare en zelfs dogmatische veiligheidsvoorzorg beschouwd. Hoewel voor de effectiviteit van de klassieke adviezen amper wetenschappelijke onderbouwing bestaat, kunnen de nieuwe aanbevelingen wel degelijk tot debat leiden omdat ze een paradigmaverschuiving inhouden. Deze is hoofdzakelijk gebaseerd op de in 2020 gepubliceerde aanbevelingen van het International Committee for the Advancement of Procedural Sedation (ICAPS), de allereerste aanbevelingen die specifiek voor de context van PSA zijn opgesteld (Green, 2020). Op basis van een uitgebreide studie van de literatuur en interdisciplinaire consensus, stelt het ICAPS een beduidend liberaler beleid voor waarbij nuchterheidstijden gebaseerd zijn op een gestructureerde risicostratificatie. Concreet betekent dit dat in de meerderheid van de PSA gevallen veel kortere nuchterheidstijden zullen gelden dan bij toepassing van de klassieke 6-4-2 regel.
Ook binnen de kinderanesthesie zien we een gelijkaardige paradigma verschuiving. De recente ESAIC richtlijn (Frykholm, 2022) pleit eveneens voor een liberaler beleid waarbij gestreefd wordt naar een zo kort mogelijke periode van nuchterheid. In Nederland heeft dit op meerdere plaatsen al geleid tot het aanpassen van de nuchterheidsregels (6-4-0), waarbij bijvoorbeeld kinderen helder vloeibare drank kunnen innemen tot kort voor de aanvang van algehele anesthesie. Gezien deze ontwikkelingen is het volgens de werkgroep zeer aannemelijk dat voor de nieuwe aanbevelingen uiteindelijk ook draagvlak zal bestaan.
Toch zullen de vernieuwde aanbevelingen vereisen dat betrokkenen bij PSA zich verdiepen in de rationale ervan en vervolgens hun eigen werkwijze aanpassen.
Gepersonaliseerd nuchterheidsbeleid
Het waar mogelijk verkorten van de nuchterperiode voor PSA geeft de mogelijkheid tot een op het kind individueel afgestemd advies. Deze benadering is geschikt voor alle patiëntengroepen en zal ertoe leiden dat veel meer mensen niet onnodig lang nuchter blijven.
Complexer beleid als gevolg van een individuele risicostratificatie
De traditionele richtlijn (6-4-2) voor vasten voor PSA had het voordeel van eenduidigheid. De nieuwe aanbevelingen, die gebaseerd zijn op de risicostratificatie van Green, 2020, resulteren in een minder uniforme praktijk. Deze hogere mate van complexiteit zou een hindernis kunnen zijn bij de implementatie in de praktijk omdat het overwegen van alle risicofactoren meer tijd in beslag neemt en tot meer variatie in praktijk leidt. Deze mogelijke nadelen wegen volgens de werkgroep niet op tegen de voordelen die de nieuwe aanbevelingen inhouden voor de kwaliteit van PSA.
PSA versus algehele anesthesie
Er zal in ziekenhuizen waarschijnlijk een omslag in denken nodig zijn om het verschil in aanbevelingen voor nuchter zijn voor PSA dan wel algehele anesthesie te implementeren.
Het invoeren van op PSA toegespitste specifieke aanbevelingen voor nuchter zijn is haalbaar met de herziening van deze richtlijn. Daarnaast is het nodig bekendheid te geven aan deze vernieuwde aanbevelingen middels symposia en andere onderwijsmomenten.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventie(s)
Tijdens PSA die anxiolyse of een licht sedatieniveau beoogt, blijft het bewustzijn grotendeels intact, blijven luchtwegreflexen intact en is de kans op aspiratie niet toegenomen.
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventie(s)
Er is weinig tot geen bewijs dat voor PSA met een matig tot diep sedatieniveau als streefdoel, een kortere nuchterheidstijd aanleiding geeft tot meer kans op aspiratie en/of langer verblijf in het ziekenhuis. Ondanks de zeer lage bewijskracht voor de uitkomsten van de onderzochte PICO, is er wel een internationale multidisciplinaire consensus, gebaseerd op systematische literatuuranalyse, aangaande nuchter blijven voor PSA bij volwassenen en kinderen. Op basis van deze consensus zijn aanbevelingen opgesteld.
Onderbouwing
Achtergrond
In de huidige praktijk wordt een deel van de kinderen die PSA ondergaan nuchter gehouden in verband met een mogelijke reductie van risico op pulmonale aspiratie van maaginhoud. Dit sluit aan bij de aanbevelingen uit 2012 die stellen dat de mate van nuchterheid afhankelijk is van het beoogde sedatieniveau:
-
Bij anxiolyse of lichte sedatie, hoeven kinderen die geen specifieke risicokenmerken hebben niet nuchter te zijn omdat bij hen de beschermende luchtwegreflexen intact blijven.
-
Matige of diepe sedatie kan luchtwegreflexen compromitteren en daarom gelden dezelfde aanbevelingen als degene die destijds golden voor kinderen die algehele anesthesie ondergaan, de zogenaamde 6-4-2 regel: 6 uren nuchter zijn voor vast voedsel of melk, 4 uren voor moedermelk en 2 uren voor helder vloeibaar.
De geldigheid van deze nuchterheidsregels in het kader van een PSA staat onder druk omdat betwijfeld wordt of ze inderdaad leiden tot een verlaging van een a priori zeer lage kans op aspiratie. Bovendien bestaan er aanwijzingen dat deze regels interfereren met de kwaliteit van PSA. In spoedeisende situaties is volgens de huidige richtlijn een deel van de kinderen die voor matige of diepe PSA in aanmerking komen niet lang genoeg nuchter, terwijl een procedure wel geïndiceerd is. Nuchter zijn blijkt bij kinderen ook geassocieerd met een hogere mate van preprocedurele stress en met een hogere kans op falen van een PSA. (Referentie: Green et al. Anaesthesia 2020; 75:374-385.)
In 2019 is op basis van literatuuronderzoek het protocol “SKA Nuchterbeleid bij kinderen (Januari 2019)” door de Sectie Kinderanesthesiologie (SKA) van de NVA opgesteld waardoor kinderen tot vlak voor de operatie helder vloeibaar mogen drinken met een afgesproken maximale hoeveelheid.
Dit protocol NVA-richtlijn spreekt zich evenwel niet expliciet uit over nuchter blijven voor PSA. Het advies uit het protocol “SKA Nuchterbeleid bij kinderen 2019” is in 2022 in aangepaste vorm overgenomen voor operaties bij kinderen onder algehele anesthesie in de Richtlijn Perioperatief voedingsbeleid van de FMS (geïnitieerd door NVA en NVvH). Daarbij worden enkele voorbehouden gemaakt bij kinderen met ernstig vertraagde maagontlediging of aanwijzingen voor verhoogde kans op regurgitatie. In deze laatste richtlijn zal m.b.t. nuchterbeleid voor PSA bij kinderen het advies uit voorliggende herziene Richtlijn PSA bij kinderen worden overgenomen.
De werkgroep is in algemene zin van mening dat in geval van PSA waarbij gestreefd wordt naar een matig tot diep sedatieniveau er minder strenge eisen kunnen worden gesteld aan de nuchterheidstatus dan voor nuchter blijven in het kader van algehele anesthesie. Het gaat immers om een geselecteerde patiëntenpopulatie waarbij kinderen met verhoogde kans op noodzaak tot luchtwegmanipulatie zoals jaw thrust, mayo canule plaatsing of positieve drukbeademing met masker en ballon worden uitgesloten. De procedure is vaak kort en weinig invasief. Het gebruik van een PSA-techniek impliceert een keuze en toepassing van medicatie waarbij het behoud van spontane ademhaling en het zoveel mogelijk vermijden van noodzaak tot gebruik van luchtwegmanoeuvres, luchtwegmanagement (mayo canule etc.) en positieve druk beademing voorop staan.
Gezien de noodzaak voor specifieke aanbevelingen is er een systematische literatuuranalyse gedaan naar de mate van nuchter zijn die nodig is voor PSA bij niet-premature neonaten en niet ernstig zieke kinderen van 0 tot 18 jaar.
Conclusies / Summary of Findings
Adverse events
|
Very low GRADE |
It is uncertain whether shortened fasting procedures result in more adverse events compared with standard fasting procedures in children who undergo procedural sedation and analgesia. Sources: Chumpitazi, 2018. |
Length of stay
|
Very low GRADE |
It is uncertain whether shortened fasting procedures result in longer length of stay at the emergency department compared with standard fasting procedures in children who undergo procedural sedation and analgesia. Sources: Chumpitazi, 2018. |
Samenvatting literatuur
Description of studies
Chumpitazi (2018) conducted a prospective cohort study of pediatric patients undergoing procedural sedation and analgesia (PSA) in the emergency department of an urban, tertiary care children’s’ hospital emergency center. Chumpitazi (2018) compared shortened fasting time defined as less than six hours from last solid food intake (N=716) versus standard fasting defined as equal or more than six hours from last solid food intake (N=1472). In total, 2188 patients with available fasting data were included in the study. PSA was achieved with ketamine only (85%), ketamine and midazolam (7%), ketamine and others (3%) or other substances excluding ketamine (5%). Sedation level was not reported. The study reported the following outcome measures: adverse events (such as persistent oxygen desaturation to <93% on pulse oximetry and requiring supplemental oxygen or airway repositioning, bronchospasm, apnea, seizure, dizziness, hiccups, laryngospasm, stridor, arrhythmia, hypotension, rash, vomiting, aspiration, and behavioral reaction or any of the events recorded in the patient record) and emergency department length of stay (hours).
Results
Adverse events
Vomiting
The study of Chumpitazi (2018) reported the odds-ratio (OR) for vomiting for patients who underwent shortened fasting times compared with patients who underwent standard fasting times.
-
The OR for vomiting in the study of Chumpitazi (2018) was OR= 1.18 (95% CI= 0.75 to 1.84), in favor of the patients who underwent standard fasting times. This is not considered as a clinically (for the patient) important difference.
The study of Chumpitazi (2018) reported the adjusted odds-ratio (aOR) for vomiting adjusted for age ≥ 12 years and medication type and dose for patients who underwent shortened fasting times compared with patients who underwent standard fasting times.
-
The aOR for vomiting in the study of Chumpitazi (2018) was aOR= 1.14 (95% CI= 0.74 to 1.75), in favour of the patients who underwent standard fasting times. This is not considered as a clinically (for the patient) important difference.
The study of Chumpitazi (2018) reported the adjusted odds-ratio (aOR) for vomiting in patients who were deeply sedated with ketamine and underwent shortened fasting times compared with patients who underwent standard fasting times.
-
The aOR for vomiting in the study of Chumpitazi (2018) was aOR= 0.20 (95% CI= 0.03 to 1.44), in favour of the shortened fasting times. This is considered as a clinically (for the patient) important difference.
Length of stay
The study of Chumpitazi (2018) reported the length of stay at the emergency department (hours) in patients who underwent shortened fasting times compared with patients who underwent standard fasting times.
-
The median length of stay at the emergency department in the study of Chumpitazi (2018) was 7.0 (interquartile range 4.7 to 10.8) hours for patients who underwent shortened fasting times. The median length of stay at the emergency department was 7.6 (interquartile range 5.2 to 11.1) hours for patients who underwent standard fasting times. This is not considered as a clinically (for the patient) important difference.
Level of evidence of the literature
The level of evidence regarding the outcome measure length of stay started low, as the evidence originated from an observational study. The level of evidence was downgraded by one level because of the small number of patients in the study (imprecision). The level of evidence was very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What degree of fasting is required for PSA, taking into account patient characteristics (such as age, ASA class, comorbidities, comedications), the intended sedation technique, and the planned procedure?
| P (patiënts): | patients aged between 0 and 18 who underwent PSA. |
| I (intervention): | fasting before PSA according to the 6-4-1, 6-4-0, 4-2-0 or 2-0-0 policy. |
| C (control): | fasting before PSA according to the 6-4-2 policy (current policy). |
| O (outcome): | safety, efficacy, patient-centeredness, cost-effectiveness. |
Relevant outcome measures
The guideline development group considered safety and efficacy as critical outcome measures for decision making; and patient-centeredness and cost-effectiveness as important outcome measures for decision making.
For all outcome measures, the default thresholds proposed by the international GRADE working group were used: a 25 % difference in relative risk (RR) for dichotomous outcomes, and 0.5 standard deviations (SD) for continuous outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until February 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 314 hits. Studies were selected based on the following criteria: systematic review of RCTs or observational studies. Five studies were initially selected based on title and abstract screening. After reading the full text, four studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Babl FE, Oakley E, Seaman C, Barnett P, Sharwood LN. High-concentration nitrous oxide for procedural sedation in children: adverse events and depth of sedation. Pediatrics. 2008 Mar;121(3):e528-32. doi: 10.1542/peds.2007-1044. PMID: 18310173.
- Babl FE, Grindlay J, Barrett MJ. Laryngospasm With Apparent Aspiration During Sedation With Nitrous Oxide. Ann Emerg Med. 2015 Nov;66(5):475-8. doi: 10.1016/j.annemergmed.2015.04.029. Epub 2015 May 21. PMID: 26003005.
- Chumpitazi, C. E., Camp, E. A., Bhamidipati, D. R., Montillo, A. M., Caviness, A. C., Mayorquin, L., & Pereira, F. A. (2018). Shortened preprocedural fasting in the pediatric emergency department.?The American journal of emergency medicine,?36(9), 1577-1580.
- Fauteux-Lamarre E, McCarthy M, Quinn N, Davidson A, Legge D, Lee KJ, Palmer GM, Babl FE, Hopper SM. Oral Ondansetron to Reduce Vomiting in Children Receiving Intranasal Fentanyl and Inhaled Nitrous Oxide for Procedural Sedation and Analgesia: A Randomized Controlled Trial. Ann Emerg Med. 2020 Jun;75(6):735-743. doi: 10.1016/j.annemergmed.2019.11.019. Epub 2020 Jan 24. PMID: 31983494.
- Frykholm, P., Disma, N., Kranke, P., & Afshari, A. (2022). The rationale for the recommendations of the European Paediatric Fasting Guideline: Improving paediatric anaesthesia and perioperative medicine. European Journal of Anaesthesiology| EJA, 39(1), 1-3.
- Green, S. M., Leroy, P. L., Roback, M. G., Irwin, M. G., Andolfatto, G., Babl, F. E., ... & International Committee for the Advancement of Procedural Sedation. (2020). An international multidisciplinary consensus statement on fasting before procedural sedation in adults and children. Anaesthesia, 75(3), 374-385.
- Hoeffe J, Doyon Trottier E, Bailey B, Shellshear D, Lagacé M, Sutter C, Grimard G, Cook R, Babl FE. Intranasal fentanyl and inhaled nitrous oxide for fracture reduction: The FAN observational study. Am J Emerg Med. 2017 May;35(5):710-715. doi: 10.1016/j.ajem.2017.01.004. Epub 2017 Jan 5. PMID: 28190665.
- Hoeffe J, Vogel RG, Ammann RA. Pediatric Sedation and Analgesia Outside the Operating Room: Combining Intranasal Fentanyl and Inhaled Nitrous Oxide. J Pediatr Pharmacol Ther. 2022;27(5):436-442. doi: 10.5863/1551-6776-27.5.436. Epub 2022 Jul 6. PMID: 35845565; PMCID: PMC9268112.
- Seith RW, Theophilos T, Babl FE. Intranasal fentanyl and high-concentration inhaled nitrous oxide for procedural sedation: a prospective observational pilot study of adverse events and depth of sedation. Acad Emerg Med. 2012 Jan;19(1):31-6. doi: 10.1111/j.1553-2712.2011.01241.x. Erratum in: Acad Emerg Med. 2012 Feb;19(2):238. PMID: 22251190.
- Tsze DS, Mallory MD, Cravero JP. Practice Patterns and Adverse Events of Nitrous Oxide Sedation and Analgesia: A Report from the Pediatric Sedation Research Consortium. J Pediatr. 2016 Feb;169:260-5.e2. doi: 10.1016/j.jpeds.2015.10.019. Epub 2015 Nov 5. PMID: 26547401.
Evidence tabellen
Evidence tables
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Chumpitazi, 2018 |
Type of study: Prospective cohort study
Setting and country: Urban, tertiary care children’s hospital emergency center
Funding: This research did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors.
Conflicts of interest: None.
|
Inclusion criteria: Not described.
Exclusion criteria: Not described.
N total at baseline: Intervention: N=716 Control: N=1472
Important prognostic factors2: Age, median (IQR) I: 4.1 (2.0 to 8.0) C: 4.0 (2.0 to 7.0) P=0.01
Sex, n/N.(%): I:292/716 (40.8%) F C: 647/1472 (44%) F P=0.17
Weight, median (IQR) I: 18.7 kg (13.0 to 30.0) C: 17.0 kg (13.0 to 25.4) P=0.004
Groups comparable at baseline? Baseline characteristics were quite similar between groups. Significant differences were found between groups for age and weight, yet those differences were not clinically relevant
|
Describe intervention
PSA: Shortened fasting time
Defined as <6 hours from last solid food intake
|
Describe control
PSA: standard fasting time
Defined as >6 hours from last solid food intake >6 hours
|
Length of follow-up: -
|
Outcomes
Vomiting and a shortened fasting time of less than six hours, OR (95% CI): OR= 1.18 (95% CI= 0.75 to 1.84) P=0.44 aOR= 1.14 (95% CI= 0.74 to 1.75)
When considering any adverse event as an outcome, there was no significant association as a function of fasting times: aOR= 1.33 (95% CI= 0.92 to 1.92)
When ketamine was not administered, the odds of vomiting were reduced by 80% while controlling for shortened fasting time: aOR (95% CI= 0.03 to 1.44)
Emergency department length of stay (hours), median (IQR): I: 7.0 (4.7 to 10.8) C: 7.6 (5.2 to 11.1)
*Patients with and without fasting data were very similar. The only difference was found in de emergency department length of stay which was 1.3 hours less (95% CI= 0.38 to 2.22; P<0.001) in the group with the documented fasting. à median (IQR) I: 7.4 (5.0 to 11.0) C: 8.7 (5.8 to 14.1). |
Remarks: Procedures performed Shortened fast group:
Procedures performed Standard fast group:
Author’s conclusion The transition to shortened NPO guidelines did not result in increased vomiting. Patients in the shortened fasting group did have a decreased ED length of stay.
|
Risk of bias tables
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?
(unlikely/likely/unclear) |
|
Chumpitazi, 2018 |
Unlikely
“prospective cohort study of pediatric patients undergoing PSA in the ED of an urban, tertiary care children's hospital emergency center with an approximate annual volume of 85,000 patients.”
|
Unlikely
“Too few patients fell into the age b1 year category (4 patients), ASA class III category (4 patients), or received an initial ketamine dose ≥2.5 mg/kg (4 patients), and total dose ≥5.0 mg/kg (1 patient). Thus, age ≥ 12 years and medication type and dose were used in the adjusted binary logistic regression modeling however there was little difference between the unadjusted and adjusted effect estimates for shortened fasting time and emesis.”
|
Unlikely
Primary outcome was defined as vomiting during or after the procedure |
Unlikely
“Given a relatively low incidence of the primary outcome reported in the literature, published risk factors known to increase vomiting were chosen a priori according to the literature. These potential confounders were evaluated when enough patients were present in each risk category.”
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Malia (2019) |
Does not answer PICO – wrong I and C |
|
Green (2020) |
Wrong publication type – consensus statement |
|
Sharma (2011) |
Does not answer PICO – wrong I and C |
|
Coté (2019) |
Wrong publication type – guideline/narrative review |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Nuchter zijn voor PSA |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.