Niet-farmacologische technieken
Uitgangsvraag
Wat is de rol van niet-farmacologische (psychologische en fysieke) technieken voor PSA bij kinderen?
Deze uitgangsvraag bevat de volgende subvragen:
-
Wat is de rol van niet-farmacologische (psychologische) technieken voor PSA bij kinderen?
-
Wat is de rol van niet-farmacologische (fysieke) technieken voor PSA bij kinderen?
Aanbeveling
Zet niet-farmacologische technieken doelmatig en doelgericht in, op elk moment van het proces en passend bij de individuele voorkeuren, kenmerken en eerdere ervaringen van het kind.
Zorg bij PSA dat de kennis en vaardigheden aanwezig zijn om het fysieke, emotionele en psychische welzijn van het kind te waarborgen, zowel voor, tijdens als na afloop van een procedure, zoals beschreven in de Rights Based Standards. De hoofdbehandelaar en sedationist zijn verantwoordelijk voor de omgeving, interprofessionele afstemming en rolverdeling (zie hiervoor de generieke module over verantwoordelijkheden in de richtlijn PSA bij volwassenen).
Maak indien nodig gebruik van de expertise van de medisch pedagogisch zorgverlener (MPZ). Voor sommige kinderen geldt dat PSA alleen maar gepland kan worden wanneer de medisch pedagogisch zorgverlener beschikbaar is.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de conclusies uit de literatuursamenvatting voor de uitkomstmaat pijn lijkt de kwaliteit van het bewijs onvoldoende om conclusies te kunnen trekken over de effecten van het gebruik van psychologische en/of fysieke interventies. Dit geldt ook voor de uitkomstmaten angst en procedureel succes. De kwaliteit van het bewijs is voor alle uitkomsten zeer laag, dit is met name het gevolg van kleine studies, grote heterogeniteit in zowel de interventies, controle-interventies en de resultaten. Het ligt voor de hand dat gestandaardiseerde interventies mogelijk heterogene effecten hebben, afhankelijk van de context en van de voorkeuren van de patiënt. Daarnaast zijn de aantallen patiënten laag. Er zijn geen studies gevonden die de patiëntvoorkeuren of PROM’s als uitkomstmaat hebben gerapporteerd. In het algemeen kan de literatuursamenvatting daarom geen richting geven aan de besluitvorming omtrent de onderzochte interventies.
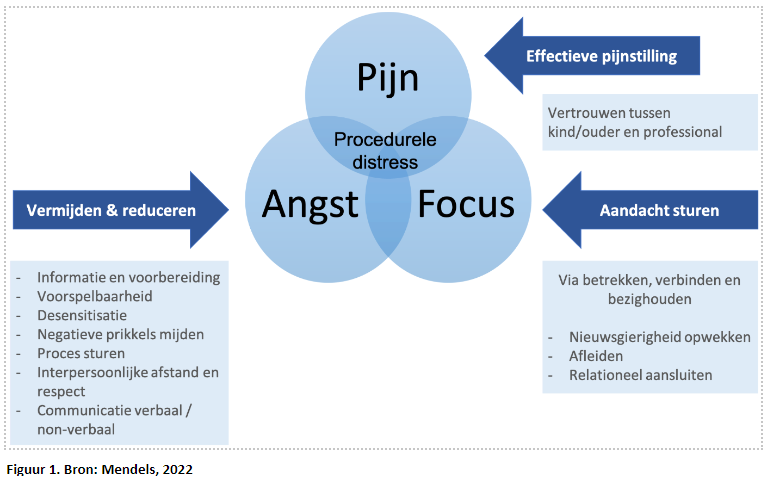
Het ondergaan van een medische procedure kan voor kinderen een angstige en stresserende aangelegenheid zijn. PSA kan uitkomst bieden, maar is op zichzelf geen garantie voor een comfortabele ervaring. De zogenaamde procedurele distress die door kinderen wordt ervaren, kan worden beschouwd als een samenspel tussen de angst voor de procedure, de pijn die erbij gepaard gaat en focus hierop (Baxter, 2013). Procedurele distress als multifactorieel fenomeen vraagt daarom ook om een multimodale aanpak.
De inzet van niet-farmacologische technieken bij PSA wordt om deze reden beschouwd als een essentiële voorwaarde om te komen tot een succesvolle, comfortabele ervaring voor het kind waarbij naast de fysieke veiligheid ook de psychologische veiligheid geborgd blijft.
De term “niet-farmacologie” is een parapluterm voor een zeer grote verscheidenheid aan technieken die ieder verschillende (en soms zelfs wisselende) onderliggende werkzame mechanismen/elementen kunnen bevatten. Het opblazen van een ballon kan bijvoorbeeld een fysieke (ontspannings-)respons teweegbrengen, maar ook werkzaam zijn als afleiding of het effect geven van een positieve verwachting. Met name het zelf kiezen voor een strategie kan zorgen voor een gevoel van controle en autonomie en daarmee leiden tot een afname van angst (Birnie, 2019; Koller, 2012). De niet-farmacologische strategieën die worden ingezet dienen dan ook passend te zijn bij het doel wat men wil bereiken. Grof gezegd kan onderscheid gemaakt worden tussen technieken die gericht zijn op angstreductie en technieken die de aandacht van het kind sturen en verleggen (zie figuur 1).
Naast de grote variatie in beschikbare technieken, bestaat er een minstens zo grote variatie aan kindfactoren waaronder variaties in ontwikkelingsniveau, psychopathologie, temperament, coping, individuele voorkeuren, mate van angst en eerdere ervaringen. Gemiddelde effecten uit literatuurstudies zijn hierdoor beperkt toepasbaar op het individu. De uitdaging en de sleutel ligt in het identificeren van de aanleg, voorgeschiedenis en voorkeuren van het kind. Het zorgvuldig kunnen triëren, inschatten en individualiseren van de best passende niet-farmacologische strategieën is dan ook een onmisbare niet te onderschatten professionele competentie (Koller, 2012). De medisch pedagogisch zorgverlener (MPZ) kan hier een belangrijke rol in vervullen. Evenals ouders die een belangrijke bron van informatie kunnen zijn. Hoe complexer het kind is, hoe meer relevant de informatie van ouders/verzorgers is om de juiste strategie te kunnen bepalen.
Zorgprofessionals die PSA uitvoeren, dienen te beschikken over een grote variatie aan niet-farmacologische technieken en in staat te zijn deze doelmatig toe te passen en individualiseren naar gelang de behoeften van het kind, en zo nodig aan te passen wanneer de situatie daarom lijkt te vragen.
Daarnaast is het effect van de niet-farmacologische technieken afhankelijk van het vermogen van de professional om een connectie te maken met het kind en ouders en een setting van vertrouwen te creëren. Binnen deze setting ontstaat co-creatie en komen de gezamenlijk gekozen niet-farmacologische strategieën optimaal tot hun recht. Het is zinvol om het plan van te voren zorgvuldig te doorlopen met ouder(s)/verzorgers en de betrokken zorgprofessionals.
Tot slot verdient de rol van de ouder/verzorger hier expliciet benoemd te worden. Ouders/verzorgers zijn immers expert over hun eigen kind en kunnen waardevolle ideeën hebben over welke niet-farmacologische strategieën effectief zouden kunnen zijn. Echter, met betrekking tot de aanwezigheid van ouders/verzorgers tijdens medische procedures is bekend dat de aanwezigheid op zichzelf niet leidt tot een aantoonbare vermindering van angst of verhoging van medewerking van het kind. Een angstige ouder/verzorger heeft daarentegen wel degelijk een negatief effect op de gemoedstoestand van het kind. Afwezigheid van ouders is echter niet gewenst. Het voorlichten en coachen van ouders/verzorgers om op een kalme ondersteunende manier aanwezig te zijn, het aanleren van voorbereidende en/of afleidende strategieën dient daarom mee te worden genomen in het plan van aanpak. (Bevan 1990, Manyande 2015).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het vermijden van pijn en angst bij kinderen dient evenzo belangrijk te zijn als de medische verrichting zelf. Kinderen hebben ook bij medisch handelen recht op de beste zorg. Zoals ‘Artikel 9’ beschrijft van het Handvest Kind & Zorg: Zieke kinderen worden beschermd tegen onnodige behandelingen en onderzoeken en maatregelen worden genomen om pijn, lichamelijk ongemak en emotionele spanningen te voorkomen dan wel te verlichten (art.3,12,17 VRK).
Voor het kind is het (op korte termijn) van belang dat de procedure zo comfortabel mogelijk verloopt, met zo min mogelijk angst, pijn en stress gepaard gaat en dat psychotrauma wordt voorkomen. Op lange termijn is het doel om het vertrouwen van het kind in de zorg(verleners) te behouden en daarmee zorgmijding en onderbehandeling te voorkomen.
Subgroepen die in het bijzonder kwetsbaar zijn en gebaat zijn bij goede ervaringen zijn langdurig of chronisch zieke kinderen, kinderen met psychopathologie en/of een ontwikkelingsachterstand of communicatieve beperking. Tegelijk vormt deze subgroep voor de professional een uitdaging omdat voorbereiding, afstemming met ouders/verzorgers en professionals onderling een vereiste is en niet alle niet-farmacologische technieken even effectief zullen zijn.
Het is van groot belang in het voorbereidende proces en tijdens interventies steeds bewust te zijn van samen beslissen met zowel kind als ouders/verzorgers volgens de geldende WGBO regels. Naast dat kinderen het recht hebben om samen met ouders en zorgprofessional te beslissen blijkt uit onderzoek dat het positieve effecten voor het kind heeft. Het Samen Beslissen heeft volgens Coyne en Harder (2011) voor kinderen als positief effect dat zij meer bereid zijn om mee te werken bij een behandeling, pijnlijke behandelingen geduldiger ondergaan, minder boosheid ervaren, beter om kunnen gaan met het begrijpen van hun ziekte en behandeling en beter herstellen.
Kosten (middelenbeslag)
Niet-farmacologische technieken brengen op zichzelf weinig kosten met zich mee. Directe (personele) kosten zijn er in de vorm van tijd en aandacht tijdens, voorafgaand aan en na de interventie. Indirecte kosten zijn verbonden aan het opleiden en deskundig maken van personeel.
In de Rights Based Standards (Bray, 2021) wordt beschreven dat kinderen het recht hebben om verzorgd te worden door professionals die beschikken over de juiste kennis en vaardigheden om hun fysieke, emotionele en psychische welzijn te waarborgen, zowel voor, tijdens als na afloop van een procedure. Naast deze ethische en humane aspecten, zorgt het voorkomen van angst en psychotrauma voor een belangrijke kostenbesparing op de daarbij benodigde intensieve en soms langdurige psychologische behandelingen om deze gevolgen terug te dringen (met alle impact op het hele leven van het kind en gezin). Tevens zal een positieve ervaring voor het kind ook leiden tot behoud van vertrouwen in de zorg/zorgverlener. Dit kan worden beschouwd als een duurzame uitkomstmaat, omdat er aanwijzingen zijn dat dit leidt tot een betere arts-patiëntrelatie, betere behandeluitkomsten (bij een coöperatieve patiënt), kortere herstelperioden, minder mislukte procedures, minder vermijding van zorg of no-shows, en een goede medewerking bij volgende ingrepen.
Aanvaardbaarheid, haalbaarheid en implementatie
Met betrekking tot implementatie is het opleiden en competent maken van professionals om hen de juiste kennis, attitudes, vaardigheden en technieken aan te leren van belang. Dit vraagt tijd (leerproces) en brengt kosten met zich mee.
Bij voorkeur zijn zowel de zorgprofessionals die de PSA uitvoeren, als de zorgprofessionals die de procedure uitvoeren bekwaam en in staat om tussen meerdere scenario’s te schakelen.
Het waarborgen van continuïteit van deze zorg verdient tevens aandacht bij implementatie; in de avonden of weekenden, op verschillende afdelingen, bij afwezigheid van medisch pedagogische zorg (MPZ).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Vanuit humaan perspectief hebben kinderen recht op de beste zorg (internationaal verdrag rechten van het kind).
Onderbouwing
Achtergrond
Rondom medische procedures bij kinderen wordt veelvuldig gebruik gemaakt van niet-farmacologische technieken. Bekende voorbeelden hiervan zijn voorbereiden en informeren, afleiding door middel van fysiek of digitaal spel en het doelgericht verleggen van de focus door middel van suggestie, visuele technieken, focustaal en/of hypnotische technieken. Fysieke technieken (bijvoorbeeld vibratie al dan niet in combinatie met lokaal koelen) is intussen een veelgebruikte methode voor lokale pijnstilling. Ook het doelgericht inzetten van de ouders/verzorgers, het streven naar comfortabele posities en processen en het doseren van zintuigelijke prikkels kunnen worden beschouwd als niet-farmacologische onderdelen van een beleid gericht op comfort.
Hoewel voor sommige van deze technieken wetenschappelijk bewijs bestaat, is het onduidelijk hoe deze technieken het best in de praktijk kunnen worden toegepast.
Vast staat dat vele niet-farmacologische technieken inconsistent worden ingezet. Zo blijken sommige technieken (bijvoorbeeld toegepast door de medisch pedagogisch zorgverlener) alleen tijdens kantoortijden inzetbaar te zijn. Andere technieken zoals Virtual Reality, digitale projecties en focustaal worden tegenwoordig door velen omarmd, terwijl de wetenschappelijke onderbouwing voor gebruik op de kinderleeftijd nog beperkt is en ze niet op alle leeftijden en voor alle kinderen even effectief blijken. Niet-farmacologische technieken hebben een sterk wisselende effectiviteit afhankelijk van voor wie en door wie ze worden toegepast. Het zijn met andere woorden methodes waarvan het succes sterk contextueel wordt bepaald. Precies deze ideale context is tot op heden amper onderwerp van onderzoek geweest.
Het is onduidelijk hoe niet-farmacologische technieken het beste in de dagelijkse werkprocessen kunnen worden ingezet, hoe de individueel best passende methode kan worden gekozen en welke deskundigheden medische en verpleegkundige zorgprofessionals nodig hebben om ze in te bouwen in hun procedurele processen.
Ten slotte is het concept ‘niet-farmacologische techniek’ een betrekkelijk betekenisloos containerbegrip waaronder zeer uiteenlopende cognitieve, psychologische, communicatieve en fysieke methodes worden verstaan. Dit maakt het onmogelijk om over ‘niet-farmacologie’ een eenduidige literatuurstudie te verrichten, laat staan een zinnige aanbeveling te formuleren. Beter zou zijn om deze methodes te gaan ordenen volgens het therapeutisch doel dat ze nastreven.
Er worden landelijk veel verschillende niet-farmacologische middelen aangeboden op het gebied van PSA bij kinderen. Dit betreft psychologische en fysieke technieken of een combinatie daarvan. Onduidelijk is welke dit zijn en of het effect hiervan werkelijk een positieve uitkomst heeft voor de kinderen en hun omgeving. En welk uitvoeringsplan het beste past bij het toepassen van de techniek. Wanneer en op welk moment niet-farmacologische middelen wel of niet worden aangeboden is ook verschillend.
De niet-farmacologische technieken zijn volop in ontwikkeling en er worden veel nieuwe initiatieven genomen op dit gebied. Op dit moment is echter te weinig duidelijk welke niet-farmacologische technieken bewezen en van meerwaarde zijn bij de PSA van kinderen. Er is hier geen duidelijke landelijke richtlijn over.
Conclusies / Summary of Findings
Sub question 1
|
Very low GRADE |
The evidence is very uncertain about the effect of distraction on pain during a medical procedure when compared with standard care in pediatric patients.
Sources: Lambert, 2020; Birnie, 2018 |
|
Very low GRADE |
The evidence is very uncertain about the effect of distraction on distress when compared with standard care in pediatric patients.
Sources: Lambert, 2020; Birnie, 2018; Riddell, 2015; Manyande, 2015 |
|
Very low GRADE |
The evidence is very uncertain about the effect of distraction on procedural success when compared with standard care in pediatric patients.
Sources: Manyande, 2015 |
Sub question 2
|
Very low GRADE |
The evidence is very uncertain about the effect of vibratory stimulation on pain during needle related procedures when compared to standard care in pediatric patients.
Sources: Ueki, 2019 |
|
Very low GRADE |
The evidence is very uncertain about the effect of vibratory stimulation on anxiety when compared to standard care in pediatric patients.
Sources: Ueki, 2019 |
|
Very low GRADE |
The evidence is very uncertain about the effect of vibratory stimulation on procedural success when compared with standard care in pediatric patients.
Sources: Ueki, 2019 |
|
Very low GRADE |
The evidence is very uncertain about the effect of swaddling and holding in an upright position on observed pain when compared with standard care in neonatal patients.
Sources: Morrow, 2010 |
Samenvatting literatuur
Sub question 1
Preparation/information, distraction (e.g. guided imagery, breathing exercises, videos, video games, virtual reality), hypnosis, focused language, and relaxation techniques are psychological interventions used to assist in reducing pain, anxiety, distress, and increasing patient satisfaction during and around a potentially painful procedure. From a systematic literature search, four systematic reviews were selected based on full-text (Lambert 2020, Riddell 2015, Birnie 2018, Manyande 2015). These reviews included studies with participants aged 0 to 19 years.
Lambert et al (2020) performed a systematic review and meta-analysis to estimate the effect of virtual reality (VR) distraction on pain, compared with no distraction or non-VR distraction during various painful procedures in children and adolescents aged 4 to 18 years. This review included seventeen randomised controlled trials (RCTs). This study reported self-reported pain, and child satisfaction with the VR intervention as outcomes. In general, no or small beneficial effects of VR interventions were found, and in some participants, nausea and motion sickness due to the intervention were reported. The evidence reported in this study is of low to very low quality, mostly due to a high risk of bias for not blinding participants, caregivers and observers to the allocation of the intervention, and serious imprecision or indirectness. The results from this review are presented in Table 2.
Riddell et al (2015) performed a systematic review and meta-analysis of RCTs to estimate the effects of various forms of patient distraction during a vaccine injection compared to “control” conditions on patient distress. Studies in infants aged 0 to 3 years were included in this review. The evidence was of very low quality due to no blinding with regard to the intervention, imprecision due to small samples, and indirectness. For one type of intervention (directed video), a beneficial effect was reported. No significant effects were reported for other interventions. The results from this review are summarised in Table 2.
Birnie et al (2018) performed a systematic review that included RCTs to estimate the effects of distraction, cognitive behavioral therapy and hypnosis on pain (self-reported and observer-reported) and distress during needle-related procedures in children and adolescents aged 2 to 19. Nine studies used cartoons or a movie as distraction method, eight used listening to music or a story, three used an interactive handheld computer or video games, three used distraction cards, two used virtual reality, two used playing with a toy, two used parent distraction, one used a medical clown, one used squeezing a ball, and five used a combination or selection of different distractors. In general, the study found beneficial effects of these interventions on pain and distress. The evidence was of very low or low quality, as studies had a high risk of bias due to lack of blinding and concealment of allocation, were inconsistent and imprecise. The results from this review are summarized in Table 2.
Manyande et al (2015) performed a systematic review of RCTs to estimate the effect of (video, video game, or two or one parent) distraction on anxiety and co-operation during induction of anesthesia in children and adolescents aged 0 to 18. The review found a beneficial effect of all forms of distraction on anxiety and co-operation during the procedure, compared to no video distraction, or presence of one or no parents. The evidence was of very low quality because of high risk of bias (selection bias and lack of blinding), and imprecision. The results from this review are summarized in Table 2.
Of note is the finding that parental presence in subgroup of anxious parents had a negative effect on child anxiety, while presence of calm parents had no effect.
Table 2 is presented in the tables section.
Conclusions
The review of Lambert et al (2020) concluded that due to the very low quality of the included studies, it was difficult to assess the real advantages and disadvantages of virtual reality distraction methods to reduce pain in children in various healthcare situations. Moreover, because of the large variety in study methods and reported outcome measures, it was not possible to pool the results on many outcomes.
The review of Riddell et al (2015) concluded that studies that investigated the effects of directed video, and directed and nondirected toy distraction were of low to very low quality. Therefore no definitive conclusions could be formulated on the benefits and disadvantages of these interventions on distress in children.
The review of Birnie et al (2018) concluded that although the quality of the evidence was low to very low, moderate to large effects ranging from SMD -0.56 (95% CI: -0.78 to -0.33) for the effect of distraction on self-reported pain to SMD -0.82 (95% CI: -1.45 to 0.18) for the effect of distraction on self-reported distress were found in favour of distraction.
The review of Manyande et al (2015) concluded that there is no evidence that the presence of one or more parents during the induction of anaesthesia is beneficial to decrease anxiety of the child.
Level of evidence of the literature
The level of evidence regarding the outcome measure pain was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (broad confidence intervals), and publication bias.
The level of evidence regarding the outcome measure anxiety was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (broad confidence intervals), and publication bias.
The level of evidence regarding the outcome measure procedural success was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (low number of included patients), and publication bias.
Sub question 2
Different physical interventions are used to achieve procedural analgesia, e.g. cooling, vibration, or holding an infant in a certain position. From a systematic literature search, two studies were included: one systematic review (Ueki 2019), and one randomised controlled trial (Morrow, 2010). Both investigated the effects of physical interventions on pain, and Ueki also investigated the outcomes anxiety and success rate of the first venipuncture. Morrow et al included neonates, while Ueki et al included studies that included infants and children aged 15 days to 18 years.
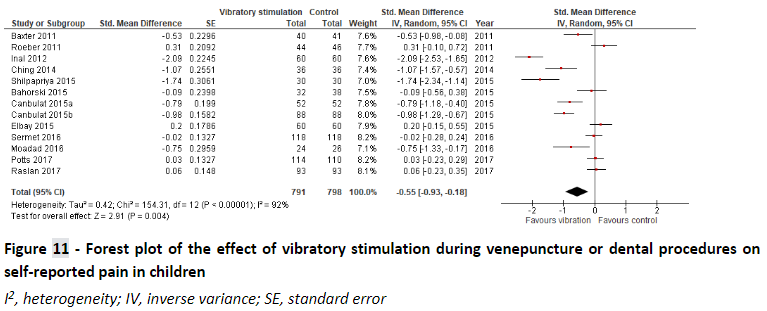
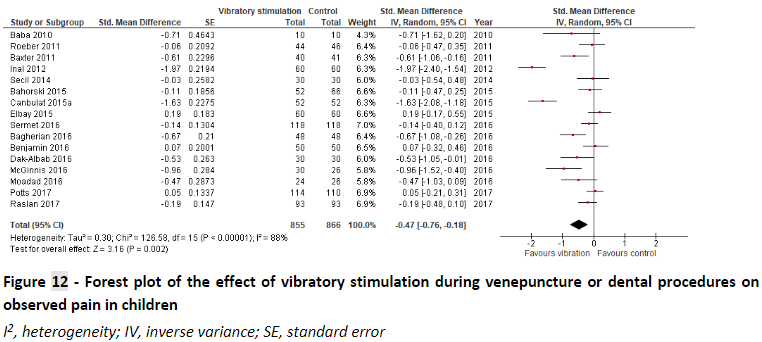
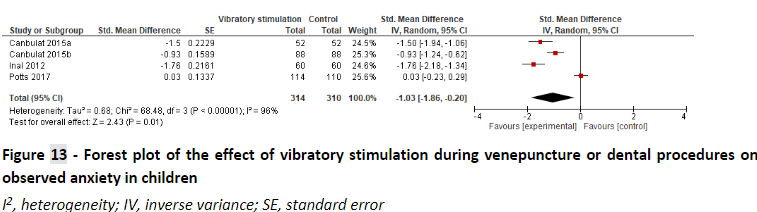
Ueki et al. (2019) performed a systematic review to analyze the effect of vibratory stimulation as a pain reducing measurement for needle-related procedures (NRP) on pediatric patients. They searched MEDLINE, CINAHL, Embase, Cochrane Central Register of Controlled Trials and Igaku Chuo Zasshi for published trials and searched Clinical-Trials.gov, EU Clinical Trials Register, UMIN Clinical Trials Registry and OpenGrey for unpublished studies. Included were studies that included pediatric participants up to 18 years old with any condition who were undergoing an NRP. NPR’s existed of puncture, injection, and IV catheter insertion. They did not have any exclusion criteria. They included 21 RCT studies for a total of 1717 patients of which 8 studies were cross-over studies. It should be noted that on several occasions, results presented in this review were incorrectly adopted from the underlying clinical trials. Therefore in this summary, the meta-analyses were repeated using results that were retrieved from the original studies as much as possible.
Morrow et al. (2010) executed a RCT study to examine the pain-reducing effect of swaddling and holding the newborn pediatric patient in an upright position during heel-lance procedures compared to the standard care position. They included neonates in a tertiary hospital who would undergo a standard total serum bilirubin (TSB) procedure. Excluded from the study were neonates admitted to the NICU, diagnosed with hyperbilirubinemia and other medical complications, and infants delivered by diabetic mothers. They included 42 patients in total; 22 in the intervention group and 20 in the control group. Group assignment was randomized on the basis of the last digit of the infants patient number.
Results
Ueki et al. (2019) performed a meta-analysis to determine the effect of vibratory stimulation on self-rated pain score (SRPS), observer-rated pain score (ORPS), observer-rated anxiety (ORA), and success rate of first venipuncture (SRFV). Pooled effects are shown below:
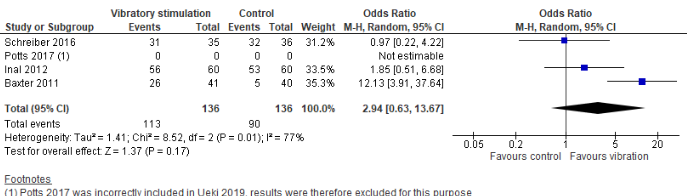
None of the trials was blinded, as it could be observed whether a device was used or not. A sub-analysis using a turned on device as intervention group and turned off device as control group gave the following results:
Table 1 – Pooled effect measures of a vibrating and/or cooling device to prevent pain and discomfort in children undergoing a needle-related procedure
|
Outcome |
Number of studies included |
Pooled SMD (RE) |
CI 95% |
I2 |
p-value |
|
SRPS |
5 |
-0.07 |
-0.43 to 0.28 |
83.2% |
0.02 |
|
ORPS |
5 |
-0.16 |
-0.40 to 0.07 |
59% |
0.17 |
CI, confidence interval; I2, heterogeneity; ORPS, observer-rated pain score; RE, random-effects; SMD, standardized mean difference; SRPS, self-reported pain score
There is no significant evidence for a relevant effect of vibratory stimulation as a pain-reducing intervention.
Morrow et al. (2010) found that swaddling a neonate and holding them in an upright position during a heel-lance procedure gave a mean Neonatal Inventory Pain Scale (NIPS) score of 1.3 (SD 0.9), while the control group had a mean score of 2.7 (SD 1.3). The performed t-test (-4.48) showed this difference was statistically significant (P<0.001). While the study’s results are in favor of this intervention, the duality of the intervention as well as the small sample size reduces their claim of clinical significance. It should be noted that due to the position the infant is held in during the intervention in the intervention position, arm movement could be obscured from observation. Arm movement is part of the NIPS score, the results are likely biased in the direction of a beneficial effect of the intervention.
Level of evidence of the literature
The level of evidence regarding the outcome measure self-reported pain was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency), imprecision (confidence interval crossed minimal clinically important difference), and publication bias.
The level of evidence regarding the outcome measure observed pain was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (confidence interval crossed minimal clinically important difference), and publication bias.
The level of evidence regarding the outcome measure observed anxiety was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (low number of included patients), and publication bias.
The level of evidence regarding the outcome measure procedural success was downgraded by three levels because of study limitations (risk of bias: intervention not blinded); conflicting results (inconsistency); indirectness; imprecision (confidence interval crossed null), and publication bias.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
-
Wat zijn de (on)gunstige effecten van niet-farmacologische psychologische interventies tijdens of voorafgaand aan een procedure bij kinderen die een pijnlijke procedure (zullen) ondergaan?
-
Wat zijn de (on)gunstige effecten van niet-farmacologische fysieke interventies tijdens of voorafgaand aan een procedure bij kinderen die een procedure (zullen) ondergaan?
| P: | Kinderen 0-18 jaar die een procedure ondergaan |
| I: | Psychologische interventies |
| C: | Usual care, placebo |
| O: | Efficacy, Procedural success, Comfort measured by a scale /Patient satisfaction/PROM |
PICO 2
| P: | Kinderen 0-18 jaar die een procedure ondergaan |
| I: | Fysieke interventies |
| C: | Usual care, placebo |
| O: | Efficacy, Procedural success, Comfort measured by a scale /Patient satisfaction/PROM |
Relevant outcome measures
The guideline development group considered comfort measured by a scale (pain/anxiety), efficacy, and procedural success as crucial outcome measures for decision making, and patient satisfaction/PROM as an important outcome measure.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Referenties
- Bevan JC, Johnston C, Haig MJ, Tousignant G, Lucy S, Kirnon V, Assimes IK, Carranza R. Preoperative parental anxiety predicts behavioural and emotional responses to induction of anaesthesia in children. Can J Anaesth. 1990 Mar;37(2):177-82. doi: 10.1007/BF03005466. PMID: 2311148.
- Birnie KA, Noel M, Chambers CT, Uman LS, Parker JA. Psychological interventions for needle-related procedural pain and distress in children and adolescents. Cochrane Database Syst Rev. 2018 Oct 4;10(10):CD005179. doi: 10.1002/14651858.CD005179.pub4. PMID: 30284240; PMCID: PMC6517234.
- Getting It Right First Time and Every Time; Re-Thinking Children's Rights when They Have a Clinical Procedure. J Pediatr Nurs. 2021 Nov-Dec;61:A10-A12. doi: 10.1016/j.pedn.2021.11.017. PMID: 34872648.
- Koller D, Goldman RD. Distraction techniques for children undergoing procedures: a critical review of pediatric research. J Pediatr Nurs. 2012 Dec;27(6):652-81. doi: 10.1016/j.pedn.2011.08.001. Epub 2011 Oct 13. PMID: 21925588.
- Lambert V, Boylan P, Boran L, Hicks P, Kirubakaran R, Devane D, Matthews A. Virtual reality distraction for acute pain in children. Cochrane Database Syst Rev. 2020 Oct 22;10(10):CD010686. doi: 10.1002/14651858.CD010686.pub2. PMID: 33089901; PMCID: PMC8094164.
- Manyande A, Cyna AM, Yip P, Chooi C, Middleton P. Non-pharmacological interventions for assisting the induction of anaesthesia in children. Cochrane Database Syst Rev. 2015 Jul 14;2015(7):CD006447. doi: 10.1002/14651858.CD006447.pub3. PMID: 26171895; PMCID: PMC8935979.
- Mendels W, Zirar-Vroegindeweij A, Waagenaar G, Versteegh J, Leroy P. Kindgerichte zorg bij medische verrichtingen. Huisarts en wetenschap. 2022 (9)
- Morrow C, Hidinger A, Wilkinson-Faulk D. Reducing neonatal pain during routine heel lance procedures. MCN Am J Matern Child Nurs. 2010 Nov-Dec;35(6):346-54; quiz 354-6. doi: 10.1097/NMC.0b013e3181f4fc53. PMID: 20926970.
- Pillai Riddell R, Taddio A, McMurtry CM, Chambers C, Shah V, Noel M; HELPinKIDS Team. Psychological Interventions for Vaccine Injections in Young Children 0 to 3 Years: Systematic Review of Randomized Controlled Trials and Quasi-Randomized Controlled Trials. Clin J Pain. 2015 Oct;31(10 Suppl):S64-71. doi: 10.1097/AJP.0000000000000279. PMID: 26201014; PMCID: PMC4900410.
- Ueki S, Yamagami Y, Makimoto K. Effectiveness of vibratory stimulation on needle-related procedural pain in children: a systematic review. JBI Database System Rev Implement Rep. 2019 Jul;17(7):1428-1463. doi: 10.11124/JBISRIR-2017-003890. PMID: 31021972.
Evidence tabellen
Psychological interventions
Table 2 – Summary of studies included in the systematic reviews of
| Review | ID | author | year | N | mean age | sex | intervention | control | follow-up | incomplete outcome | outcome 1 | effect measure 1 (95ci) | outcome 2 | effect measure 2 (95ci) | outcome 3 | effect measure 3 (95ci) | outcome 4 | effect measure 4 (95ci) | Comment |
| Birnie 2018 | A | Aydin | 2017 | 200 | 9.01 ± 2.35 y | 116m 84f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FACES) | -0.43 [95% CI: -0.75 , -0.11] | Observer-report pain (FACES) | -0.33 [95% CI: -0.56 , -0.10] | Observer-report distress (CFS) | -0.22 [95% CI: -0.45 , 0.00] | |||
| Birnie 2018 | B | Balan | 2009 | 100 | 7.96 ± 2.18 y | 55m 45f | Music distraction | Analgesic cream | After procedure | Unclear whether incomplete data was addressed | Self-report pain (VAS-score) | -2.52 [95% CI: -3.05 , -1.99] | Observer-report pain (VAS) | -2.49 [95% CI: -3.02 , -1.96] | |||||
| Birnie 2018 | C | Bellieni | 2006 | 69 | 7 to 12y | 33m 36f | Mother or video distraction | No distraction | After procedure | No missing data | Self-report pain (Oucher Pain Rating Scale) | -0.50 [95% CI: -1.01 , 0.00] | Parent-report pain (Oucher Pain Rating Scale) | -0.21 [95% CI: -0.71 , 0.29] | |||||
| Birnie 2018 | D | Beran | 2013 | 57 | 6.87 ± 1.34 y | 30m 27f | CBT-combined | Self-report pain (FPS-R) | After procedure | Observer-report pain (FPS-R) | Self-reported pain | -0.50 [95% CI: -1.03 , 0.03] | Observer-reported pain | -0.57 [95% CI: -0.88 , -0.27] | Behavioral measures- Distress | -0.87 [95% CI: -1.42 , -0.33] | |||
| Birnie 2018 | D | Beran | 2013 | 57 | 6.87 ± 1.34 y | 30m 27f | Robot distraction | Toy distraction | After procedure | No missing data | Self-report pain (FPS-R) | -0.64 [95% CI: -1.03 , -0.25] | |||||||
| Birnie 2018 | E | Bisignano | 2006 | 30 | 11.4y | 15m 15f | CBT-combined | Self-report pain (Children’s Pain Self-Report) | After procedure | Self-report distress (Fear SR) | Self-reported pain | 0.40 [95% CI: -0.32 , 1.13] | Self-reported distress | -0.46 [95% CI: -1.19 , 0.27] | Observer-reported distress | 0.54 [95% CI: -0.21 , 1.29] | Behavioral measures- Distress | 0.39 [95% CI: -0.35 , 1.13] | |
| Birnie 2018 | E | Bisignano | 2006 | 30 | 11.4y | 15m 15f | Explanation | Standard care (may also include distraction) | Missing data, no reason addressed | Self-report pain (Children’s Pain Self-Report) | -0.02 [95% CI: -0.41 , 0.36] | ||||||||
| Birnie 2018 | F | Blount | 1992 | 60 | 5y ± 10m | 32m 28f | CBT-combined | Standard care (may also include distraction) | After procedure | No missing data | Observer-report distress (VAS) | -1.03 [95% CI: -1.57 , -0.49] | |||||||
| Birnie 2018 | G | Caprilli | 2007 | 108 | 6.67y ± 3.19 (intervention); 7.07y ± 3.47 (control) | 52m 56f | Music distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -0.49 [95% CI: -0.87 , -0.11] | |||||||
| Birnie 2018 | H | Cassidy | 2002 | 62 | 5y | 28m 34f | Audiovisual distraction | Standard care (may also include distraction) | After procedure | Missing data, no reason addressed | Self-report pain (FPS) | -0.40 [95% CI: -0.92 , 0.12] | Observed pain (CHEOPS) | 0.16 [95% CI: -0.38 , 0.71] | Parent-reported anxiety (VAS) | ||||
| Birnie 2018 | I | Cavender | 2004 | 43 | 7.88 ± 1.74 y | 19m 24f | CBT-combined | Self-report pain (Wong and Baker Scale) | After procedure | Self-reported fear (GFS) | Self-reported pain | -0.25 [95% CI: -0.85 , 0.35] | Self-reported distress | -0.32 [95% CI: -0.92 , 0.29] | Observer-reported distress | -0.70 [95% CI: -1.32 , -0.08] | Behavioral measures- Distress | -0.32 [95% CI: -0.92 , 0.29] | |
| Birnie 2018 | I | Cavender | 2004 | 43 | 7.88 ± 1.74 y | 19m 24f | Parental positioning and distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | 0.31 [95% CI: -0.28 , 0.91] | |||||||
| Birnie 2018 | J | Chen | 1999 | 50 | 7.3 ± 3.7 y | 33m 17f | CBT-combined | Placebo therapy+support+encouragement | After procedure | Missing non-differential | Self-report pain (VAS-score) | not reported | Observer-report pain (VAS) | not reported | Self-report distress (VAS) | not reported | Observer-report distress (VAS) | not reported | |
| Birnie 2018 | K | Cohen | 2015 | 90 | 4.8 years ± 9.7 months | 44m 46f | CBT-combined | Self-report pain (FPS-R) | After procedure | Observer-report pain (VAS) | Self-reported pain | 1.12 [95% CI: 0.57 , 1.67] | Observer-reported pain | -0.31 [95% CI: -0.67 , 0.05] | Observed distress | -0.23 [95% CI: -0.53 , 0.06] | Behavioral measures- Distress | -0.06 [95% CI: -0.35 , 0.24] | |
| Birnie 2018 | K | Cohen | 2015 | 90 | 4.8 years ± 9.7 months | 44m 46f | Distraction | parent education or standard care | After procedure | No missing data | Self-report pain (FPS-R) | 0.17 [95% CI: -0.34 , 0.67] | Observer-report pain (VAS) | -0.31 [95% CI: -0.67 , 0.05] | Observed distress | -0.77 [95% CI: -1.16 , -0.38] | |||
| Birnie 2018 | L | Crevatin | 2016 | 200 | 4 to 13y | 98m 102f | Computer distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R or Numerical rating scale) | 0.07 [95% CI: -0.21 , 0.34] | |||||||
| Birnie 2018 | M | Ebrahimpour | 2015 | 30 | 3 to 12y | 15m 15f | Explanation | Standard care (may also include distraction) | After procedure | No missing data | Observer distress (OSBD-R) | -0.45 [95% CI: -1.18 , 0.27] | |||||||
| Birnie 2018 | N | Eland | 1981 | 40 | 4.9 to 5.9y | 20m 20f | Suggestion | No explanation | After procedure | No missing data | Self-report pain (color scale) | -0.65 [95% CI: -1.56 , 0.25] | |||||||
| Birnie 2018 | O | Fanurik | 2000 | 160 | 2 to 16y | 80m 80f | Distraction | Standard care (may also include distraction) | After procedure | Missing non-differential | Self-report pain (VAS-score) | -0.17 [95% CI: -0.55 , 0.20] | Self-report anxiety (VAS) | 0.02 [95% CI: -0.35 , 0.38] | |||||
| Birnie 2018 | P | Fowler-Kerry | 1987 | 200 | 5.5y | 100m 100f | CBT-combined | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (4-point VAS) | 0.40 [95% CI: -0.32 , 1.13] | |||||||
| Birnie 2018 | P | Fowler-Kerry | 1987 | 200 | 5.5y | 100m 100f | CBT-combined | Self-report pain (4-point VAS) | After procedure | Self-reported pain | -0.64 [95% CI: -1.03 , -0.25] | ||||||||
| Birnie 2018 | P | Fowler-Kerry | 1987 | 200 | 5.5y | 100m 100f | Suggestion and distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (4-point VAS) | -0.17 [95% CI: -0.55 , 0.21] | |||||||
| Birnie 2018 | Q | Gold | 2006 | 20 | 10.2y | 12m 8f | VR distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | -0.13 [95% CI: -1.01 , 0.75] | |||||||
| Birnie 2018 | R | Gonzalez | 1993 | 28 | 3 to 7y | 21m 21f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Oucher Pain Rating Scale) | -0.27 [95% CI: -1.02 , 0.47] | Observer distress (Modified Frankl Behaviour Rating Scale) | -0.70 [95% CI: -1.47 , 0.06] | |||||
| Birnie 2018 | S | Goodenough | 1997 | 117 | 3.5 to 17.7y | 73m 44f | Suggestion | Standard care (may also include distraction) | After procedure | Incomplete data addressed | Self-report pain (FPS) | 0.05 [95% CI: -0.39 , 0.50] | |||||||
| Birnie 2018 | T | Gupta | 2006 | 75 | 6 to 12y | 44m 31f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS-score) | -1.30 [95% CI: -1.92 , -0.69] | |||||||
| Birnie 2018 | T | Gupta | 2006 | 75 | 6 to 12y | 44m 31f | Breathing technique | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS-score) | -2.07 [95% CI: -2.77 , -1.38] | |||||||
| Birnie 2018 | U | Harrison | 1991 | 100 | 8.4y | 51m 49f | Explanation | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (VAS-score) | not reported | Observer-report pain (VAS-score) | not reported | |||||
| Birnie 2018 | U | Harrison | 1991 | 100 | 8.4y | 51m 49f | Preparation and distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (VAS-score) | -0.70 [95% CI: -1.11 , -0.30] | Observer-report pain (VAS-score) | -0.77 [95% CI: -1.18 , -0.37] | Observer-report distress (VAS-score) | ||||
| Birnie 2018 | V | Huet | 2011 | 29 | 5 to 12y | 16m 13f | Hypnosis | Standard care (may also include distraction) | After procedure | Missing non-differential | Observer-report pain (MOPS) | -1.01 [95% CI: -1.79 , -0.23] | |||||||
| Birnie 2018 | W | Inal | 2012 | 123 | 9.36 ± 1.96y | 62m 61f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | -1.44 [95% CI: -1.84 , -1.04] | Observer-report pain (FPS-R) | -1.35 [95% CI: -1.63 , -1.07] | Observer-report distress (CAPS) | -1.97 [95% CI: -2.28 , -1.67] | |||
| Birnie 2018 | X | Jeffs | 2007 | 27 | 14.06 ± 2.31 y | 17m 15f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (APPT) | 0.30 [95% CI: -0.53 , 1.13] | numbers don't add up | ||||||
| Birnie 2018 | Y | Kamath | 2013 | 160 | 4 to 10y | 85m 75f | CBT-combined | Self-report pain (FPS-R) | After procedure | Observer-report pain (TPPPS) | Self-reported pain | -0.02 [95% CI: -0.41 , 0.36] | Observer-reported pain | -1.52 [95% CI: -2.12 , -0.92] | |||||
| Birnie 2018 | Y | Kamath | 2013 | 160 | 4 to 10y | 85m 75f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | -2.21 [95% CI: -3.37 , -1.05] | |||||||
| Birnie 2018 | Z | Katz | 1987 | 36 | 8.3 ± 1.68 y | 24m 12f | Hypnosis | Distraction | After procedure | No missing data | Self-report pain (VAS-score) | 0.09 [95% CI: -0.57 , 0.74] | Self-report anxiety (VAS) | -0.24 [95% CI: -0.89 , 0.42] | Observer report distress | -0.20 [95% CI: -0.86 , 0.45] | |||
| Birnie 2018 | AA | Kleiber | 2001 | 44 | 4 to 7y | 11m 33f | CBT-combined | Self-report pain (Oucher Pain Rating Scale) | After procedure | Observer distress (PPQ-R) | Self-reported pain | 0.31 [95% CI: -0.28 , 0.91] | Observer-reported distress | 0.22 [95% CI: -0.38 , 0.81] | Behavioral measures- Distress | -0.11 [95% CI: -0.70 , 0.48] | |||
| Birnie 2018 | AA | Kleiber | 2001 | 44 | 4 to 7y | 11m 33f | Parent coaching and distraction | Standard care (may also include distraction) | After procedure | Incomplete data addressed | Self-report pain (Oucher Pain Rating Scale) | 0.09 [95% CI: -0.08 , 0.27] | |||||||
| Birnie 2018 | AB | Kristjansdottir | 2010 | 118 | 14 ± 0.18y | 63m 55f | Music distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS-score) | -0.04 [95% CI: -0.43 , 0.34] | |||||||
| Birnie 2018 | AC | Kuttner | 1987 | 25 | 3 to 6y | not reported | Distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Observer-report distress (5-point scale) | 0.89 [95% CI: -0.15 , 1.93] | |||||||
| Birnie 2018 | AD | Liossi | 1999 | 30 | 8 ± 2.5 y | 17m 13f | CBT-combined | Self-report pain (Wong and Baker Scale) | After procedure | Self-report distress (Wong and Baker Scale) | Self-reported pain | -2.21 [95% CI: -3.37 , -1.05] | Self-reported distress | -1.24 [95% CI: -2.22 , -0.27] | Behavioral measures- Distress | -1.08 [95% CI: -2.03 , -0.12] | |||
| Birnie 2018 | AD | Liossi | 1999 | 30 | 8 ± 2.5 y | 17m 13f | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -2.65 [95% CI: -3.92 , -1.39] | Self-report distress (Wong and Baker Scale) | -4.12 [95% CI: -5.79 , -2.45] | Observer report distress | -1.74 [95% CI: -2.80 , -0.68] | |||
| Birnie 2018 | AE | Liossi | 2003 | 60 | 8.73 ± 2.86 y | not reported | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -2.07 [95% CI: -2.73 , -1.41] | Self-report distress (Wong and Baker Scale) | -2.43 [95% CI: -3.13 , -1.73] | Observer report distress | -1.40 [95% CI: -2.00 , -0.81] | |||
| Birnie 2018 | AF | Liossi | 2006 | 45 | 8.84 ± 2.86 y | 23m 22f | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -1.46 [95% CI: -2.28 , -0.64] | Self-report distress (Wong and Baker Scale) | -2.45 [95% CI: -3.43 , -1.47] | Observer report distress | -1.92 [95% CI: -2.80 , -1.03] | |||
| Birnie 2018 | AG | Liossi | 2009 | 30 | 8.5 ± 2.21 y | 14m 16f | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | -1.18 [95% CI: -1.97 , -0.40] | Self-report distress (VAS scale) | -3.89 [95% CI: -5.16 , -2.61] | Observer report distress | -1.56 [95% CI: -2.39 , -0.73] | |||
| Birnie 2018 | AH | Luthy | 2013 | 54 | 5.2 ± 3.4 y | 32m 36f | Video distraction | Standard care (may also include distraction) | After procedure | No missing data | Observer report pain (Wong and Baker FACES) | 0.14 [95% CI: -0.42 , 0.71] | Observer report distress (0-5 scale) | 0.00 [95% CI: -0.56 , 0.56] | |||||
| Birnie 2018 | AI | McCarthy | 2010 | 542 | 6.95 ± 1.90 y | 280m 262f | CBT-combined | Observer report distress (single item question) | After procedure | Observer report distress (OSBD-R) | Self-reported pain | 0.09 [95% CI: -0.08 , 0.27] | Observer-reported distress | -0.06 [95% CI: -0.23 , 0.10] | % change in salivary cortisol | -3.14 [95% CI: -3.52 , -2.76] | |||
| Birnie 2018 | AI | McCarthy | 2010 | 542 | 6.95 ± 1.90 y | 280m 262f | Parent coaching and distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Observer report distress (single item question) | -0.20 [95% CI: -0.84 , 0.45] | Observer report distress (OSBD-R) | -0.02 [95% CI: -0.19 , 0.15] | |||||
| Birnie 2018 | AJ | Meiri | 2016 | 60 | 5.3 ± 2.5 y | 53m 47f | Distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (10 FACES) | -0.32 [95% CI: -0.81 , 0.16] | Observer-report pain (VAS-score) | -0.84 [95% CI: -1.19 , -0.48] | Observed anxiety (VAS-scale) | -1.37 [95% CI: -1.91 , -0.83] | |||
| Birnie 2018 | AK | Miguez-Navarro | 2016 | 140 | 3 to 11y | 81m 59f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -1.19 [95% CI: -1.55 , -0.83] | Self-report distress (Groninger Distress Scale) | -1.27 [95% CI: -1.63 , -0.90] | |||||
| Birnie 2018 | AL | Miller | 2016 | 98 | 6.73 ± 2.71 y | 48m 50f | CBT-combined | Standard care (may also include distraction) | After procedure | No missing data | Self-reported pain | -0.30 [95% CI: -0.94 , 0.33] | Observer-report pain (VAS-score) | -0.98 [95% CI: -1.65 , -0.31] | Observer-report pain (FLACC) | 0.23 [95% CI: -0.40 , 0.86] | |||
| Birnie 2018 | AL | Miller | 2016 | 98 | 6.73 ± 2.71 y | 48m 50f | Preparation and distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -0.02 [95% CI: -0.65 , 0.61] | Observer-report pain (VAS-score) | -0.83 [95% CI: -1.38 , -0.27] | Observer-report pain (FLACC) | -0.87 [95% CI: -1.43 , -0.31] | |||
| Birnie 2018 | AM | Minute | 2012 | 97 | 4 to 10y | 49m 48f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | 0.06 [95% CI: -0.34 , 0.45] | Observer-report pain (FLACC) | -0.24 [95% CI: -0.64 , 0.16] | |||||
| Birnie 2018 | AN | Mutlu | 2015 | 88 | 9 to 12y | 48m 40f | Distraction | Standard care (may also include distraction) | After procedure | Missing non-differential | Self-report pain (FPS-R) | ||||||||
| Birnie 2018 | AN | Mutlu | 2015 | 88 | 9 to 12y | 48m 40f | Breathing technique | Standard care (may also include distraction) | After procedure | Missing non-differential | Self-report pain (FPS-R) | -1.56 [95% CI: -2.04 , -1.08] | |||||||
| Birnie 2018 | AO | Nguyen | 2010 | 40 | 7 to 12y | 25m 15f | Music distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (NRS 0-100 scale) | -1.46 [95% CI: -2.16 , -0.75] | Spielberger State-Trait Anxiety Inventory | -1.44 [95% CI: -2.14 , -0.73] | |||||
| Birnie 2018 | AP | Nilsson | 2015 | 37 | 11 to 12y | 0m 37f | CBT-combined | Self-report pain (color scale) | After procedure | Self-report distress (0-10) | Self-reported pain | -0.20 [95% CI: -0.84 , 0.45] | Self-reported distress | 0.23 [95% CI: -0.43 , 0.89] | Cortisol | -0.17 [95% CI: -0.83 , 0.49] | |||
| Birnie 2018 | AP | Nilsson | 2015 | 37 | 11 to 12y | 0m 37f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (color scale) | -2.20 [95% CI: -3.03 , -1.36] | Self-report distress (0-10) | -0.38 [95% CI: -0.92 , 0.16] | |||||
| Birnie 2018 | AQ | Noguchi | 2006 | 62 | 4.55 ± 0.65 y | 37m 25f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | -0.07 [95% CI: -0.60 , 0.46] | Observer distress (OSBD-R) | -0.21 [95% CI: -0.75 , 0.32] | |||||
| Birnie 2018 | AR | Oliveira | 2017 | 40 | 8.72 ± 1.80 y | 16m 24f | Audiovisual distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | -1.98 [95% CI: -2.52 , -1.44] | |||||||
| Birnie 2018 | AS | Pourmovahed | 2013 | 100 | 9.45 ± 2.80 y | 58m 42f | Breathing technique | Standard care (may also include distraction) | After procedure | Incomplete data addressed | Self-report pain (Wong and Baker Scale) | -0.54 [95% CI: -0.94 , -0.14] | |||||||
| Birnie 2018 | AT | Press | 2003 | 94 | 6 to 16y | 57m 37f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | -0.40 [95% CI: -0.81 , 0.01] | Observer-report pain (VAS scale) | 0.07 [95% CI: -0.33 , 0.48] | |||||
| Birnie 2018 | AU | Ramírez-Carrasco | 2017 | 40 | 90 ± 17.15 m | 16m 24f | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Observer-report pain (FLACC) | 0.20 [95% CI: -0.42 , 0.83] | |||||||
| Birnie 2018 | AV | Rimon | 2016 | 53 | 2 to 15y | 21m 32f | CBT-combined | Self-report pain (FPS-R) | After procedure | Self-report pain (VAS scale) | Self-reported pain | -2.20 [95% CI: -3.03 , -1.36] | Cortisol | -0.13 [95% CI: -0.78 , 0.53] | |||||
| Birnie 2018 | AV | Rimon | 2016 | 53 | 2 to 15y | 21m 32f | Medical clown | Standard care (may also include distraction) | After procedure | Incomplete data addressed | Self-report pain (FPS-R) | -0.34 [95% CI: -0.62 , -0.07] | |||||||
| Birnie 2018 | AW | Sahiner | 2016 | 120 | 9.1 ± 1.6 y | 63m 57f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -0.42 [95% CI: -0.86 , 0.02] | Observer-report pain (Wong and Baker Scale) | -0.29 [95% CI: -0.60 , 0.03] | |||||
| Birnie 2018 | AW | Sahiner | 2016 | 120 | 9.1 ± 1.6 y | 63m 57f | Breathing technique | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -0.07 [95% CI: -0.58 , 0.44] | |||||||
| Birnie 2018 | AX | Sander Wint | 2002 | 30 | 10 to 19y | 16m 14f | VR distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | -0.29 [95% CI: -1.02 , 0.43] | |||||||
| Birnie 2018 | AY | Sinha | 2006 | 240 | 6 to 18y | 120m 120f | Distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (FPS-R) | -0.16 [95% CI: -0.42 , 0.09] | Self-report anxiety (STAIC) | -0.70 [95% CI: -1.06 , -0.35] | Observer report anxiety (VAS) | -0.36 [95% CI: -0.62 , -0.11] | |||
| Birnie 2018 | AZ | Tak | 2006 | 40 | 3 to 12y | 25m 15f | Distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (Oucher Pain Rating Scale) | 0.45 [95% CI: -0.17 , 1.08] | Groningen Distress Scale (GDS) | -0.16 [95% CI: -0.78 , 0.46] | |||||
| Birnie 2018 | AZ | Tak | 2006 | 40 | 3 to 12y | 25m 15f | Preparation and distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (Oucher Pain Rating Scale) | 0.30 [95% CI: -0.24 , 0.84] | |||||||
| Birnie 2018 | BA | Tyc | 1997 | 55 | 6.3 - 18.6 y | 28m 27f | CBT-combined | Standard care (may also include distraction) | After procedure | No missing data | Self-reported distress | -0.15 [95% CI: -0.67 , 0.38] | Observer-report distress (VAS scale) | -0.39 [95% CI: -0.92 , 0.14] | Behavioral measures- Distress | -0.45 [95% CI: -0.98 , 0.09] | |||
| Birnie 2018 | BB | Vessey | 1994 | 100 | 7y 4m ± 3.3m | 62m 38f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (Wong and Baker Scale) | -0.61 [95% CI: -1.02 , -0.21] | Observed pain (CHEOPS) | -0.39 [95% CI: -0.79 , 0.00] | |||||
| Birnie 2018 | BC | Vosoghi | 2010 | 72 | 3 to 6y | 37m 35f | Distraction | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Self-report pain (Oucher Pain Rating Scale) | -1.99 [95% CI: -2.55 , -1.42] | |||||||
| Birnie 2018 | BD | Wang | 2008 | 200 | 8 to 9 y | 98m 102f | CBT-combined | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | 1.12 [95% CI: 0.57 , 1.67] | |||||||
| Birnie 2018 | BD | Wang | 2008 | 200 | 8 to 9 y | 98m 102f | CBT-combined | Self-report pain (VAS scale) | After procedure | Self-reported pain | -0.34 [95% CI: -0.62 , -0.07] | ||||||||
| Birnie 2018 | BD | Wang | 2008 | 200 | 8 to 9 y | 98m 102f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (VAS scale) | -0.28 [95% CI: -0.56 , 0.00] | |||||||
| Birnie 2018 | BE | Windich-Biermeier | 2007 | 50 | 10.5 ± 3.8 y | 27m 23f | CBT-combined | Self-report pain (CAS) | After procedure | Self-reported fear (GFS) | Self-reported pain | -0.33 [95% CI: -0.89 , 0.23] | Self-reported distress | -0.18 [95% CI: -0.74 , 0.38] | |||||
| Birnie 2018 | BE | Windich-Biermeier | 2007 | 50 | 10.5 ± 3.8 y | 27m 23f | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (CAS) | -0.33 [95% CI: -0.89 , 0.23] | |||||||
| Birnie 2018 | BF | Yinger | 2016 | 58 | 56.6 ± 6.7 m | 27m 31f | CBT-combined | Standard care (may also include distraction) | After procedure | Missing non-differential | Observer-report pain (UCLA Pain Assessment tool) | -0.49 [95% CI: -1.03 , 0.04] | Observer-report distress (7-point scale) | 1.00 [95% CI: 0.45 , 1.55] | Behavioral measures- Distress | -0.88 [95% CI: -1.43 , -0.33] | |||
| Birnie 2018 | BG | Zieger | 2013 | 120 | 6 to 12y | 60m 60f | Explanation | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | not reported | Observed pain (FLACC) | not reported | |||||
| Birnie 2018 | BG | Zieger | 2013 | 120 | 6 to 12y | 60m 60f | Preparation and distraction | Standard care (may also include distraction) | After procedure | No missing data | Self-report pain (FPS-R) | -0.18 [95% CI: -0.54 , 0.18] | Observed pain (FLACC) | 0.07 [95% CI: -0.29 , 0.43] | |||||
| Lambert 2020 | A | Atzori | 2018 | 15 | 7 to 17y | 10m 5f | VR (immersive) distraction | No distraction | After procedure | 2 withdrew | Pain (VAS-score) | MD -1.60, 95% CI -3.24 to 0.04 | Nausea | Not reported | |||||
| Lambert 2020 | C | Chan | 2019 | 129 | 4 to 11y | 74m 55f | VR (immersive) distraction | Non-VR distraction | After procedure | Missing <10% | Self-report pain | MD -1.39; 95% CI, -2.68 to -0.11 | Caregiver's reported distress | Number of needle attempts | |||||
| Lambert 2020 | B | Chan | 2019 | 123 | 4 to 11y | 67m 56f | VR (immersive) distraction | Non-VR distraction | After procedure | Missing <10% | Self-report pain | MD -1.78; 95% CI, -3.24 to -0.32 | Caregiver's reported distress | Number of needle attempts | |||||
| Lambert 2020 | D | Chen | 2019 | 136 | 7 to 12y | 77m 59f | VR (immersive) distraction | No distraction | Five minutes post procedure | Missing <10% | Self-report pain | MD -1.00, 95% CI -1.90 to -0.10 | Observed pain | MD -1.03, 95% CI -1.88 to -0.18 | Self-reported fear | MD -0.46, 95% CI -0.90 to -0.02 | |||
| Lambert 2020 | E | Das | 2005 | 9 | 5 to 16y | 6m 3f | VR (immersive) distraction | No distraction | After procedure | Missing >10% | Self-report pain (VAS-score) | Mean 4.1, SD 2.9 | Observed anxiety | Not reported | |||||
| Lambert 2020 | F | Dumoulin | 2019 | 59 | 8 to 17y | 38m 21f | VR (immersive) distraction | Non-VR distraction | 15 minutes after procedure | No missing data | Self-report pain (VAS-score) | MD -13.68, 95% CI -29.64 to 2.28 | Satisfaction questionnaire | 0.00, 95% CI -11.19 to 11.19) | Nausea (side effects) | not significant | |||
| Lambert 2020 | G | Gerceker | 2018 | 121 | 7 to 12y | 61m 60f | VR (immersive) distraction | 1. Non-VR distraction 2. no distraction | 5 minutes after procedure | Missing 21% | Self-report pain (Faces Pain Rating Scale) | MD -0.50 (95% CI -0.59 to -0.41) | Observed pain (Faces Pain Rating Scale) | MD -0.50 (95% CI -0.59 to -0.41) | |||||
| Lambert 2020 | H | Gold | 2006 | 20 | 8 to 12y | 12m 8f | VR (immersive) distraction | No distraction | following IV placement | No missing data | Self-report pain (Faces Pain Rating Scale) | MD -0.60 (95% CI -2.47 to 1.27) | Childhood Anxiety Sensitivity Index | Not reported | Satisfaction (with pain management) | not reported | |||
| Lambert 2020 | I | Hoffman | 2019 | 48 | 6 to 17y | 34m 14f | VR (immersive) distraction | No distraction | After procedure | No missing data | Self-report pain (GRS) | MD -3.42 (95% CI -4.47 to -2.37) | Satisfaction questionnaire | Not reported | Nausea (side effects) | less than one on 10 point scale | |||
| Lambert 2020 | J | Hua | 2015 | 65 | 4 to 16y | 31m 34f | VR (immersive) distraction | Non-VR distraction | After procedure | No missing data | Self-report pain (Faces Pain Rating Scale) | MD -1.77 (95% CI -2.74 to -0.80) | Observed pain (VAS) | MD -1.90 (95% CI -3.23 to -0.57) | Duration procedure | not reported | |||
| Lambert 2020 | K | Jeffs | 2014 | 28 | 10 to 17y | 19m 9f | VR (semi-immersive) distraction | 1. Non-VR distraction 2. no distraction | post-procdure | Missing >10% | Self-report pain (Adolescent Pediatric Pain Tool) | MD 21.20, 95% CI -8.31 to 50.71 | |||||||
| Lambert 2020 | L | Kipping | 2012 | 41 | 11 to 17y | 28m 13f | VR (immersive) distraction | Non-VR distraction | After procedure | No missing data | Self-report pain (VAS-score) | MD -1.77, 95% CI -2.74 to -0.80 | Observed pain (FLACC) | no difference | Nausea (side effects) | no difference | |||
| Lambert 2020 | M | Koushali | 2017 | 40 | 7 to 12y | 26m 14f | VR (immersive) distraction | No distraction | Immediately after procedure | No missing data | Self-report pain (Wong and Baker Scale) | MD -2.90, 95% CI -3.57 to -2.23 | |||||||
| Lambert 2020 | N | Nilsson | 2009 | 42 | 5 to 18y | 25m 17f | VR (non-immersive) distraction | No distraction | 3-5 minutes after procedure | Missing <10% | Self-report pain (CAS and FAS) | MD 0.54, 95% CI -0.32 to 1.40; | Observed pain (FLACC) | MD 0.10, 95% CI -0.22 to 0.42 | |||||
| Lambert 2020 | O | Schmitt | 2011 | 53 | 6 to 18y | 43m 10f | VR (immersive) distraction | Non-VR distraction | Immediately after procedure | No missing data | Self-report pain (GRS) | MD -14.33, 95% CI -25.42 to -3.24 | |||||||
| Lambert 2020 | P | Walther-Larsen | 2019 | 59 | 7 to 16y | 52m 7f | VR (immersive) distraction | Non-VR distraction | 15 minutes after procedure | Missing <10% | Self-report pain (VAS-score) | no difference | Self-report satisfaction (VAS-score) | no difference | |||||
| Lambert 2020 | Q | Wolitzky | 2005 | 20 | 7 to 14y | 12m 8f | VR (immersive) distraction | No distraction | Immediately after procedure | Missing <10% | Observed pain (CHEOPS) | MD -3.40, 95% CI -5.01 to -1.79 | Self-report anxiety (VAS-score) | no difference | Pulse rate | ||||
| Manyande 2015 | A | Akinci | 2008 | 100 | 2 to 10y | not reported | Parental distraction | No parent present | After procedure | No missing data | Observer-report distress | MD 0 [95% CI: -0.39,0.39] | |||||||
| Manyande 2015 | B | Arai | 2007 | 60 | 1 to 3y | not reported | Parental distraction | No parent present | After procedure | Unclear whether incomplete data was addressed | Outcome in parent | na | |||||||
| Manyande 2015 | C | Berghmans | 2012 | 120 | 6m to 16y | not reported | Parental distraction | No parent present | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | D | Bevan | 1990 | 134 | 2 to 10y | not reported | Parental distraction | No parent present | After procedure | Unclear whether incomplete data was addressed | Observer-report distress | MD 0 [95% CI: -0.34,0.34] | |||||||
| Manyande 2015 | E | Calipel | 2005 | 50 | 2 to 11y | not reported | Hypnosis | Standard care (may also include distraction) | After procedure | No missing data | Observer-report distress | MD 0.59 [95% CI: 0.33,1.04] | |||||||
| Manyande 2015 | F | Campbell | 2005 | 198 | 3 to 10y | not reported | Preparation and distraction | Standard care (may also include distraction) | After procedure | 15% missing data | no effect measure | ||||||||
| Manyande 2015 | G | Fernandes | 2010 | 70 | 5 to 10y | 53m 17f | Parental distraction | No parent present | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | H | Golan | 2009 | 65 | 3 to 8y | not reported | Parental distraction | No parent present | After procedure | No missing data | Observer-report distress | MD -12.7 [95% CI: -21.67,-3.73] | |||||||
| Manyande 2015 | I | Kain | 1996b | 84 | 1 to 6y | not reported | Parental distraction | No parent present | After procedure | <10% missing data | Outcome in parent | na | Time to induction | MD -0.2[95% CI: -0.65,0.25] | |||||
| Manyande 2015 | J | Kain | 1998 | 93 | 2 to 8 y | not reported | Parental distraction | No parent present | After procedure | Unclear whether incomplete data was addressed | Co-operation | MD 12.47 [95% CI: 0.72,216.2] | Time to induction | MD -1.7[95% CI: -2.28,-1.12] | |||||
| Manyande 2015 | K | Kain | 2000 | 103 | 2 to 8y | not reported | Parental distraction | No parent present | After procedure | Unclear whether incomplete data was addressed | Outcome in parent | na | |||||||
| Manyande 2015 | L | Kain | 2001 | 70 | 2 to 7y | not reported | Music distraction | Standard care (may also include distraction) | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | M | Kain | 2003 | 80 | about 5 y | not reported | Parental distraction | No parent present | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | N | Kain | 2004 | 123 | 3 to 7y | not reported | Music distraction | Standard care (may also include distraction) | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | O | Kain | 2007 | 308 | 2 to 10y | not reported | Parental distraction | No parent present | After procedure | <10% missing data | Observer-report distress | MD -0.08[95% CI: -0.36,0.21] | |||||||
| Manyande 2015 | P | Kain | 2009 | 61 | not reported | not reported | Parental distraction | One parent present | After procedure | <10% missing data | Co-operation | MD 1.88[95% CI: 0.61,5.72] | |||||||
| Manyande 2015 | Q | Kazak | 2010 | 60 | 2 to 6y | not reported | Parental distraction | No parent present | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | R | MacLaren | 2008 | 112 | 2 to 7y | not reported | Explanation | Standard care (may also include distraction) | After procedure | <10% missing data | Observer-report distress | MD 6.44 [95% CI: 0.78,53.23] | |||||||
| Manyande 2015 | S | McEwen | 2007 | 122 | not reported | not reported | Explanation (parents) | Standard care (may also include distraction) | After procedure | Unclear whether incomplete data was addressed | Outcome in parent | na | |||||||
| Manyande 2015 | T | Meisel | 2009 | 61 | 3 to 12y | not reported | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Outcome in parent | na | |||||||
| Manyande 2015 | U | Mifflin | 2012 | 89 | 2 to 10y | not reported | Distraction | Standard care (may also include distraction) | After procedure | <2% missing data | Outcome in parent | na | |||||||
| Manyande 2015 | V | Palermo | 2000 | 83 | 1 to 12m | not reported | Parental distraction | No parent present | After procedure | >10% missing data, possibly differential | Observer-report distress | MD 0.4 [95% CI: -0.07,0.86] | |||||||
| Manyande 2015 | W | Patel | 2006 | 112 | 4 to 12y | not reported | Distraction | Standard care (may also include distraction) | After procedure | No missing data | Observer-report distress | MD -9.8 [95% CI: -19.42,-0.18] | |||||||
| Manyande 2015 | X | Vagnoli | 2005 | 40 | 5 to 12y | not reported | Distraction | parental presence | After procedure | No missing data | Observer-report distress | MD -30.75[95% CI: -46.36,-15.14] | |||||||
| Manyande 2015 | Y | Vagnoli | 2010 | 75 | 5 to 12y | not reported | Distraction | One parent present | After procedure | No missing data | Observer-report distress | MD -32.24[95% CI: -44.5,-19.98] | |||||||
| Manyande 2015 | Z | Wang | 2004 | 67 | 2 to 7y | not reported | Acupunture | "Sham" acupuncture | No missing data | Observer-report distress | MD -17 [95% CI: -30.51,-3.49] | ||||||||
| Manyande 2015 | AA | Wright | 2010 | 61 | 3 to 6y | not reported | Parental distraction | No parent present | No missing data | Observer-report distress | MD 0.05 [95% CI: -0.45,0.56] | ||||||||
| Manyande 2015 | AB | Zuwala | 2001 | 80 | 10m to 10y | not reported | Explanation | Standard care (may also include distraction) | No missing data | Outcome in parent | na | ||||||||
| Riddell 2015 | I | Basiri-Moghadam | 2014 | 50 | 4m | not reported | Toy distraction | 1. Lidocaine cream 2. Standard care | not reported | Incomplete data addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | A | Cohen | 2002 | 90 | 2m to 3y | not reported | Video and toy distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (MBPS) | 1. Video distraction: SMD -0.68 [95% CI, -1.04 to -0.32] in favour of distraction 2. Toy distraction SMD -0.47 [95% CI, -0.91 to -0.02] in favour of distraction 3. Nondirected toy distraction SMD -0.93 [95% CI, -1.86 to -0.00] in favour of toy distraction |
|||||||
| Riddell 2015 | B | Cohen | 2006 | 84 | 12 to 18m | not reported | Distraction | 1. Lidocaine cream 2. Standard care | not reported | Incomplete data not addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | C | Cohen | 2006 | 136 | 1 to 21m | not reported | Video distraction | Standard care (may also include distraction) | not reported | Incomplete data not addressed | Distress (MAISD) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | E | Cramer-Berness | 2005 | 117 | 2 to 24m | not reported | Toy or tickling distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | F | Cramer-Berness | 2005 | 123 | 2 to 24m | not reported | Toy distraction or supportive care by parent | Standard care (may also include distraction) | not reported | Unclear whether incomplete data was addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | D | Gedam | 2013 | 350 | 12 to 30m | not reported | Video and toy distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (FLACC) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | G | Hillgrove-Stuart | 2013 | 99 | 12 to 20m | not reported | Toy distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | J | Ozdemir | 2012 | 120 | 2m | not reported | Toy or music distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (MBPS) | See comment in Cohen 2002 | |||||||
| Riddell 2015 | H | Singh | 2012 | 90 | 1 to 3y | not reported | Toy or music distraction | Standard care (may also include distraction) | not reported | Incomplete data addressed | Distress (FLACC modified) | See comment in Cohen 2002 |
Physiological interventions
Randomized controlled trials
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Morrow 2010 |
Type of study:
RCT
Setting and country: Tertiary hospital in the USA.
Funding and conflicts of interest:
Authors declare no conflicts of interest |
Inclusion criteria: Newborn infants born after at least 37 weeks of pregnancy, who were clinically stable and qualified for a total serum bilirubin (TSB) procedure. Exclusion criteria: “Infants who were admitted to the NICU, neonates born to diabetic mothers, those previously diagnosed with hyperbilirubinemia, as well as infants with other medical complications.”
N total at baseline: Intervention: 22 Control: 20
Important prognostic factors2: Gestational age ± SD: I: 39.45 (1.14) C: 38.77 (1.51)
Sex: I: 50% M C: 41.1% M
Weight: I: 3371.77 (417.96) C: 3546.88 (340.85)
Apgar at 1 min: I: 8.45 (0.65) C: 8.66 (0.47)
Vaginal birth: I: 77.2% C: 76.4%
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Infants were swaddled and held upright during the procedure (90 degrees).
|
Describe control (treatment/procedure/test):
Infants received standard care (30 degrees). |
Length of follow-up:
Experimental: 2 minutes 17 seconds (SD = 59)
Control: 2 minutes 47 seconds (SD = 85) Loss-to-follow-up:
N.A.
Incomplete outcome data:
N.A.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain (Neonatal Inventory Pain Scale).
Mean (SD) I: 1.3 (0.9) C: 2.7 (1.3)
t-test = -4.48 p<0.001 |
Conclusion from the author:
The RCT showed that swaddling the infant while holding it in an upright position significantly decreases the painscore compared to holing the infant in a standard care position during heel lance procedures. |
Notes:
-
Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
-
Provide data per treatment group on the most important prognostic factors ((potential) confounders)
-
For case-control studies, provide sufficient detail on the procedure used to match cases and controls
-
For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Systematic reviews
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ueki, 2019
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis
Literature search up to October, 2017
21 studies included A: Aminabadi, 2008 B: Baba, 2010 C: Baxter, 2011 D: Roeber, 2011 E: Inal, 2012 F: Ching, 2014 G: Secil, 2014 H: Shilpapriya, 2015 I: Canbulat, 2015a J: Canbulat, 2015b K: Elbay, 2015 L: Bahorski, 2015 M: Moadad, 2016 N: Benjamin, 2016 O: Schreiber, 2016 P: McGinnis, 2016 Q: Dak-Albab, 2016 R: Bagherian, 2016 S: Sermet, 2016 T: Potts, 2017 U: Raslan, 2017 .....
Study design: 21 RCT (8 Crossover RCT B,F,H,K,Q,R,S,U)
Setting and Country: Clinics/Hospitals. USA, Turkey, India, Italy, Iran and Syria,
Source of funding and conflicts of interest: C: Author is developer of the Buzzy device D, P, R: funded by industry.
|
Inclusion criteria SR: Children with any condition undergoing a needle-related procedure (NRP).
Exclusion criteria SR: -
21 studies included
Important patient characteristics at baseline: 1717 paediatric patients ranging from 15 days to 18 years of age
N, mean age A: n=52, 4.72 years B: n=20, 37 weeks C: n=81, 9.97 years D: n=90, 5.66 years E: n=120, 9.3 years F: n=72, 14 years G: n=60, N.A. H: n=60, 7.5 years I: n=104, 7 years J: n=176, 8.43 years K: n=120, 8.32 years L: n=118, N.A. M: n=50, 8.7 years N: n=100, N.A. O: n=71, 9 years P: n=56, N.A. Q: n=60, N.A. R: n=96, 5.94 years S: n=236, 7.31 years T: n=224, 8.17 years U: n=186, 8.2 years
….
Sex: Not specified |
Describe intervention:
A: Topical anesthetic agent and vibration of the injection site by a finger B: Hitachi Magic Wand With Wonder wand C: BUZZY D: Vibraject E: BUZZY F: Topical Anesthetic gel and DentalVibe G: VAD H: DentalVibe I: BUZZY J: BUZZY K: Topical anesthetic spray and DentalVibe L: BUZZY and topical anesthetic ointment M: BUZZY N: BUZZY without cold pack O: BUZZY P: Norco mini vibrator Q: DentalVibe R: “Cotton roll with topical anesthesia gel remaining in place with a mild vibratory stimulus applied by the left hand during injection lasting around 1 minute.” S: Topical anesthetic and DentalVibe .....
|
Describe control:
A: Topical anesthetic agent without vibration B: Without vibrator C: Normal practice D: Vibraject turned off E: No BUZZY F: Topical Anesthetic gel and DentalVibe turned off G: No VAD H: Topical Anesthesia I: No BUZZY J: No BUZZY K: Topical anesthetic spray and DentalVibe turned off L: Topical anesthetic ointment M: No BUZZY N: No BUZZY O: No Buzzy P: No vibrator Q: Topical analgesia R: “Cotton roll with topical anesthesia gel remaining in place without vibratory stimuli.” S: Topical anesthetic and DentalVibe turned off .....
|
End-point of follow-up:
Not applicable ….
For how many participants were no complete outcome data available? (intervention/control)
O: 1/0 R: 17.5% overall ….
|
Self-rated Pain score - 1
Std. mean difference (95% CI) (IV, Random effect): C: -0.53 (95% CI -0.98 to -0.09) D: 0.31 (95% CI -0.10 to 0.73) E: -2.09 (95% CI -2.53 to -1.64) F: -1.07. (95% CI -1.57 to -0.58) H: -1.74 (95% CI -2.34 to -1.14) I: -0.79 (95% CI -1.18 to -0.39) J: -0.98 (95% CI -1.29 to -0.66) K: 0.20 (95% CI -0.15 to 0.56) L: -0.09 (95% CI -0.56 to 0.38) M: -0.75 (95% CI -1.33 to -0.17) S: -0.02 (95% CI -0.28 to 0.23) T: 0.03 (95% CI -0.23 to 0.29) U: 0.06 (95% CI -0.23 to 0.35)
…
Pooled effect (random effects model): -0.55 (95% CI -0.92 to -0.18) favoring intervention Heterogeneity (I2): 92% P-value = 0.003
Observer-rated pain score - 2
Std. Mean difference (95% CI) (IV, Random effect): B: -0.71 (95% CI -1.62 to 0.20) C: -0.61 (95% CI -1.06 to -0.17) D: -0.06 (95% CI -0.47 to 0.36) E: -1.97 (95% CI -2.40 to -1.53) G: -0.03 (95% CI -0.54 to 0.47) I: -1.63 (95% CI -2.08 to -1.19) K: 0.19 (95% CI -0.17 to 0.54) L: -0.11 (95% CI -0.47 to 0.26) M: -0.47 (95% CI -1.03 to 0.10) N: 0.07 (95% CI -0.33 to 0.46) P: -0.96 (95% CI -1.52 to -0.40) Q: -0.53 (95% CI -1.04 to -0.01) R: -0.67 (95% CI -1.08 to -0.26) S: -0.14 (95% CI -0.40 to 0.12) T: 0.05 (95% CI -0.22 to 0.31) U: -0.19 (95% CI -0.48 to 0.10)
Pooled effect (random effects model): -0.47 (95% CI -0.76 to -0.18) favoring intervention Heterogeneity (I2): 88% P-value = 0.001
Anxiety, by observer-rated outcome measurement - 3.
Mean difference (95% CI) (IV, Random effect): E: -1.76 (95% CI -2.18 to -1.33) I: -1.50 (95% CI -1.93 to -1.06) J: -0.93 (95% CI -1.25 to 0.62) T: 0.03 (95% CI -0.23 to 0.29)
Pooled effect (random effects model): -1.03 (95% CI -1.85 to -0.20) favoring intervention Heterogeneity (I2): 96% P-value = 0.01
Success rate of first venipuncture - 4
Odds Ration (M-H, Random effects, 95% CI): E: 0.54 (95% CI 0.15 to 1.95) O: 0.97 (95% CI 0.22 to 4.22) T: 1.12 (95% CI 0.50 to 2.48) C: 3.14 (95% CI 1.06 to 9.27)
Pooled effect (random effects model): 1.23 (95% CI 0.62 to 2.45) favoring intervention Heterogeneity (I2): 35% P-value = 0.56
|
Facultative:
The funnel plot and Egger’s test showed a possible publication bias for the self-rated pain studies. Excluding studies funded by the industry did not change the direction of results.
Participation bias is possible, as all but three studies excluded critical or chronically sick children.
High level of heterogeneity, possibly due to the differences between usual care as comparison.
Level of evidence: GRADE
Pain, as measured by self-rated outcome measurement, from NRP, is reduced by 0.36 SMD (GRADE level LOW)
Pain, as measured by observer-rated outcome measurement, from NRP, is reduced by 0.34 SMD (GRADE level LOW)
Anxiety, measured by observers using scales, from NRP is reduced by 0.74 SMD (GRADE level LOW)
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses);
When topical anesthesia was used during the intervention as well as during the control, no vibratory stimulation was deemed statistically significant in reducing pain score.
A sub-analysis differentiating between controlgroups with no device and controlgroups with the device turned off, showed that vibrations did not significantly reduce pain score:
Self-rated painscore Device vs. No device Pooled effect (random effects model): -0.94 (95% CI -1.54 to -0.35) favoring intervention Heterogeneity (I2): 90% P-value = 0.002
Device vs. Device turned off Pooled effect (random effects model): -0.07 (95% CI -0.43 to 0.28) favoring intervention Heterogeneity (I2): 81% P-value = 0.68
Observer-rated painscore Device vs. No device Pooled effect (random effects model): -0.72 (95% CI -1.31 to -0.14) favoring intervention Heterogeneity (I2): 91% P-value = 0.02
Device vs. Device turned off Pooled effect (random effects model): -0.16 (95% CI -0.40 to 0.07) favoring intervention Heterogeneity (I2): 59% P-value = 0.17
Heterogeneity: clinical and statistical heterogeneity; The difference in usual care as control group might have contributed to the high heterogeneity. Only topical anaesthesia could be stratified, as there was not enough data on the rest. |
Risk of Bias tables
Psychological interventions
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Aydin 2017 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Balan 2009 |
Well-randomised |
likely |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
|
Bellieni 2006 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Beran 2013 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Beran 2013 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Bisignano 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Bisignano 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
likely |
likely |
|
Blount 1992 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Caprilli 2007 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Cassidy 2002 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Cavender 2004 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Cavender 2004 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Chen 1999 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Cohen 2015 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Cohen 2015 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Crevatin 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Ebrahimpour 2015 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Eland 1981 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Fanurik 2000 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
likely |
unlikely |
|
Fowler-Kerry 1987 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Fowler-Kerry 1987 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Fowler-Kerry 1987 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Gold 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Gonzalez 1993 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Goodenough 1997 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Gupta 2006 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Gupta 2006 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Harrison 1991 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Harrison 1991 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Huet 2011 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Inal 2012 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Jeffs 2007 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Kamath 2013 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Kamath 2013 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Katz 1987 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Kleiber 2001 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Kleiber 2001 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Kristjansdottir 2010 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Kuttner 1987 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Liossi 1999 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Liossi 1999 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Liossi 2003 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Liossi 2006 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Liossi 2009 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Luthy 2013 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
McCarthy2010 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
McCarthy2010 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Meiri 2016 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Miguez-Navarro 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Miller 2016 |
Method unclear |
Unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Miller 2016 |
Method unclear |
Unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Minute 2012 |
Well-randomised |
Unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Mutlu 2015 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Mutlu 2015 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Nguyen 2010 |
UNclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Nilsson 2015 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Nilsson 2015 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Noguchi 2006 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Oliveira 2017 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Pourmovahed 2013 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Press 2003 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Ramírez-Carrasco 2017 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
|
Rimon 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Rimon 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Sahiner 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Sahiner 2016 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Sander Wint 2002 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
likely |
|
Sinha 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Tak 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Tak 2006 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Tyc 1997 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Vessey 1994 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Vosoghi 2010 |
Method unclear |
unclear |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
|
Wang 2008 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
likely |
|
Wang 2008 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Wang 2008 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Windich-Biermeier 2007 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Windich-Biermeier 2007 |
Well-randomised |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Yinger 2016 |
Well-randomised |
likely |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Zieger 2013 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Zieger 2013 |
Method unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
unlikely |
|
Atzori 2018 |
Unclear |
unclear |
likely |
likely |
likely |
unlikely |
Likely |
Unclear |
|
Chan 2019 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Chan 2019 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Chen 2019 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Das 2005 |
Low risk |
|
likely |
likely |
likely |
unlikely |
Likely |
Unclear |
|
Dumoulin 2019 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Gerceker 2018 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Gold 2006 |
Unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Hoffman 2019 |
Low risk |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Hua 2015 |
Low risk |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Jeffs 2014 |
Low risk |
unclear |
likely |
likely |
likely |
Likely |
unlikely |
Unclear |
|
Kipping 2012 |
Low risk |
unlikely |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Koushali 2017 |
Low risk |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Nilsson 2009 |
Unclear |
unclear |
likely |
likely |
likely |
unlikely |
unlikely |
Unclear |
|
Schmitt 2011 |
Low risk |
unclear |
likely |
likely |
likely |
Likely |
unlikely |
Unclear |
|
Walther-Larsen 2019 |
Low risk |
unclear |
likely |
likely |
likely |
Likely |
unlikely |
Unclear |
|
Wolitzky 2005 |
Unclear |
unclear |
likely |
likely |
likely |
Likely |
unlikely |
Unclear |
|
Akinci2008 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Arai2007 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Berghmans2012 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Bevan1990 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Calipel2005 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Campbell2005 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Fernandes2010 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Golan2009 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain1996b |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain1998 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2000 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2001 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2003 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2004 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2007 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kain2009 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Kazak2010 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
MacLaren2008 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
McEwen2007 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Meisel2009 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Mifflin2012 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Palermo2000 |
Low risk |
Likely |
likely |
likely |
likely |
Likely |
unlikely |
unclear |
|
Patel2006 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Vagnoli2005 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Vagnoli2010 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Wang2004 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Wright2010 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Zuwala2001 |
Low risk |
Likely |
likely |
likely |
likely |
unclear |
unlikely |
unclear |
|
Basiri-Moghadam 2014 |
High risk |
Likely |
likely |
likely |
likely |
Unlikely |
Unlikely |
Unlikely |
|
Cohen 2002 |
High risk |
Likely |
likely |
likely |
likely |
Unlikely |
likely |
Unlikely |
|
Cohen 2006 |
High risk |
Likely |
likely |
likely |
likely |
Unlikely |
likely |
Unlikely |
|
Cohen 2006 |
Low risk |
Unlikely |
likely |
likely |
likely |
Unlikely |
likely |
Unlikely |
|
Cramer-Berness 2005 |
Unlcear |
Unclear |
likely |
likely |
likely |
Unlikely |
Unlikely |
Unlikely |
|
Cramer-Berness 2005 |
Unclear |
Unclear |
likely |
likely |
likely |
Unlikely |
Unclear |
Unlikely |
|
Gedam 2013 |
High risk |
Likely |
likely |
likely |
likely |
Likely |
Unlikely |
Unlikely |
|
Hillgrove-Stuart 2013 |
Low risk |
Unlikely |
likely |
likely |
likely |
Likely |
Unlikely |
Unlikely |
|
Ozdemir 2012 |
High risk |
Likely |
likely |
likely |
likely |
Unlikely |
Unlikely |
Likely |
|
Singh 2012 |
High risk |
Likely |
likely |
likely |
likely |
Unlikely |
Unlikely |
Unlikely |
Physical interventions
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Morrow, 2010 |
Definitely yes |
Definitely no |
Probably no
Blinding not possible due to nature of intervention. Patients were neonates. Unclear whether data analysts were blinded, rest were not blinded. |
Definitely yes |
Probably yes |
Probably no
Intervention per figure in paper likely influences score on outcome scale (arm movement limited in intervention position, while this was part of the NIPS scale) |
HIGH |
|
Aminabadi, 2008, 25 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably no |
Probably yes |
HIGH |
|
Baba, 2010, 58 |
Probably yes |
Probably yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no Design susceptible to spillover effect |
HIGH |
|
Baxter, 2011, 21 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no |
HIGH |
|
Roeber, 2011, 55 |
Definitely yes |
Definitely yes |
Definitely yes Video recording |
Probably yes Not reported |
Probably yes |
Probably no |
HIGH |
|
Inal, 2012, 50 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no Standard care nurses not blinded |
HIGH |
|
Ching, 2014, 22 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no
|
HIGH |
|
Secil, 2014, 23 |
Probably no Parents selected coloured paper in order to randomise |
Probably no |
Probably no |
Probably yes Not reported |
Probably no |
Probably yes |
HIGH |
|
Shilpaprya, 2015, 62 |
Probably yes |
Probably yes |
Probably no |
Probably yes Not reported |
Probably yes |
Definitely yes Improbable table of results, improbable methodology. |
HIGH |
|
Canbulat, 2015a, 19 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
HIGH |
|
Canbulat, 2015b, 51 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
HIGH |
|
Elbay, 2015, 52 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
HIGH |
|
Bakhorsi, 2015, 59 |
Probably yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no Outcome assessment unclear and important |
HIGH |
|
Moadad, 2016, 57 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably no Statistical analysis not appropriate |
HIGH |
|
Benjamin, 2016, 53 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
Some concerns |
|
Schreiber, 2016, 18 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes |
Probably no |
Probably yes |
Some concerns |
|
McGinnis, 2016, 24 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
HIGH |
|
Dak-Albab, 2016, 61 |
Probably yes |
Probably yes |
Definitely yes Video recording |
Probably no |
Probably yes |
Probably yes |
HIGH |
|
Bagherian, 2016, 26 |
Definitely yes |
Definitely yes |
Definitely yes |
Probably yes Not reported |
Probably yes |
Probably no |
HIGH |
|
Sermet, 2016, 54 |
Definitely yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
Some concerns |
|
Potts, 2017, 60 |
Probably yes |
Definitely yes |
Probably no |
Probably yes Not reported |
Probably yes |
Probably yes |
Some concerns |
|
Raslan, 2017, 56 |
Definitely yes |
Definitely yes |
Definitely yes Video recording |
Probably yes Not reported |
Probably yes |
Probably yes |
Some concerns |
Table of excluded studies
Psychological interventions
|
Author and year |
Reason for exclusion |
|
Prado, 2019 |
No quantified results |
|
Birnie, 2015 |
Wrong intervention+control |
|
Chambers, 2009 |
Partly same studies included as Riddell 2015 |
|
Eijlers, 2019 |
Not all RCTs. RCTs overlap with Cochrane of Lambert |
|
López-Valverde, 2020 |
Adults included |
|
Birnie, 2014 |
Update in 2018 |
|
Oliveira, 2015 |
Not all RCTs. RCTs overlap with SR of Birnie 2018 |
|
Wente, 2013 |
Wrong intervention |
|
Goettems, 2017 |
Update in Prado 2019 |
|
Lopez-Rodriguez, 2020 |
No effect measures |
|
Thrane, 2013 |
Wrong population |
|
Lauwens, 2020 |
RCTs also included in Lambert 2020 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-08-2024
Beoordeeld op geldigheid : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Niet-farmacologische technieken |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Sub question 1
Algemene informatie
|
Richtlijn: NVA PSA kinderen |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van niet-farmacologische psychologische interventies tijdens of voorafgaand aan een procedure bij kinderen die een pijnlijke procedure (zullen) ondergaan? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 8-4-2021 |
|
Periode: 2009- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Omdat de P in het zoekformulier veel ruis oplevert is in overleg met de adviseur gekozen voor een meer specifieke P. P in zoekformulier: Kinderen 0-18 jaar die een procedure ondergaan P specifieker gedefinieerd: Kinderen met pijn of angst die een medische procedure moeten ondergaan, OF een holistische benadering van kinderen en medische procedures.
Voor deze vraag is met de volgende elementen gezocht:
Knderen EN (angst OF pain OF holistische benadering) EN psychologische interventie EN procedures
Het artikel van Leroy en het artikel van Bice wordt niet gevonden vanwege het studiedesign. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase, Cinahlen Ovid/Medline is op 8 april 2021 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over de (on)gunstige effecten van niet-farmacologische psychologische interventies tijdens of voorafgaand aan een procedure bij kinderen die een pijnlijke procedure (zullen) ondergaan. De literatuurzoekactie leverde 1106 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
CINAHL |
Ontdubbeld |
|
SRs |
220 |
82 |
111 |
298 |
|
RCTs |
445 |
212 |
99 |
559 |
|
Observationele studies |
217 |
37 |
43 |
249 |
|
Overig |
|
|
|
|
|
Totaal |
|
|
|
1106 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#31 |
#25 NOT #24 NOT #23 OBS |
217 |
|
#30 |
#24 NOT #23 RCT |
445 |
|
#29 |
#11 AND #19 |
10 |
|
#28 |
#11 NOT #27 |
3 |
|
#27 |
#11 AND #26 |
8 |
|
#26 |
#23 OR #24 OR #25 |
847 |
|
#25 |
#19 AND #22 |
453 |
|
#24 |
#19 AND #21 |
525 |
|
#23 |
#19 AND #20 SR |
220 |
|
#22 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6457278 |
|
#21 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2551463 |
|
#20 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
554256 |
|
#19 |
#18 AND (1-1-2009)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1479 |
|
#18 |
#12 AND #13 AND #16 AND #17 |
3033 |
|
#17 |
'medical procedures'/exp OR procedure*:ti,ab,kw OR intervention*:ti,ab,kw |
26641409 |
|
#16 |
#14 OR #15 |
1944823 |
|
#15 |
'pain'/exp OR 'holistic nursing'/exp OR 'holistic care'/exp OR pain*:ti,kw OR ache*:ti,kw OR suffering:ti,kw OR anguish*:ti,kw OR holistic*:ti,ab,kw |
1532484 |
|
#14 |
'fear'/exp OR anxious*:ti,kw OR anxiet*:ti,kw OR fear*:ti,kw OR panic*:ti,kw OR dread*:ti,kw OR worry*:ti,kw OR agitation:ti,kw OR agitated:ti,kw OR apprehensi*:ti,kw OR nervous*:ti,kw OR distress*:ti,kw OR catastrophi*:ti,kw OR discomfort*:ti,kw OR stress*:ti,kw |
932943 |
|
#13 |
'neurolinguistic programming'/exp OR 'comfort'/exp OR 'hypnosis'/exp OR 'virtual reality'/exp OR 'guided imagery'/exp OR 'breathing exercise'/exp OR distraction*:ti,kw OR nonpharmacolog*:ti,kw OR 'non pharmacolog*':ti,kw OR (('age appropriate' NEAR/4 (communication OR approach* OR method* OR language OR strateg* OR information OR way)):ti,ab,kw) OR 'blowing bubbles':ti,ab,kw OR nlp:ti,kw OR 'neurolinguistic program*':ti,ab,kw OR comfort:ti,kw OR hypnosis:ti,kw OR 'virtual reality':ti,kw OR 'guided imagery':ti,kw |
84470 |
|
#12 |
infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:de,ti,ab OR paediatric*:de,ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR 'pediatrics'/exp OR 'pediatric patient'/exp |
4341460 |
|
#11 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 |
11 |
|
#10 |
systematic AND review AND 'meta analysis' AND of AND virtual AND reality AND in AND pediatrics AND eijlers |
1 |
|
#9 |
digital AND technology AND distraction AND for AND acute AND pain AND in AND children AND gates AND 2020 |
2 |
|
#8 |
virtual AND reality AND for AND pediatric AND needle AND procedural AND pain AND chan |
1 |
|
#7 |
beyond AND the AND drugs AND leroy AND strategies AND 2016 |
1 |
|
#6 |
psychological AND interventions AND for AND reducing AND pain AND distress AND during AND routine AND childhood AND immunizations |
1 |
|
#5 |
psychological AND interventions AND for AND 'needle related' AND procedural AND pain AND distress AND in AND children AND adolescents AND birnie AND 2018 |
2 |
|
#4 |
holistic AND comfort AND interventions AND for AND pediatric AND procedures AND bice |
1 |
|
#3 |
exploring AND holistic AND comfort AND in AND children AND who AND experience AND a AND clinical AND venipuncture AND procedure |
1 |
|
#2 |
the AND effect AND of AND three AND different AND distraction AND methods AND on AND pain AND anxiety AND in AND children AND sahiner |
0 |
|
#1 |
reducing AND pain AND distress AND related AND to AND needle AND procedures AND in AND children AND with AND cancer AND a AND clinical AND practice AND guideline |
1 |
Ovid/Medline
Search Strategy:
|
# |
Searches |
Results |
|
17 |
15 not 14 not 13 OBS |
37 |
|
16 |
14 not 13 RCT |
212 |
|
15 |
11 and 12 |
108 |
|
14 |
10 and 12 |
260 |
|
13 |
9 and 12 SR |
82 |
|
12 |
8 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
471 |
|
11 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) |
3798468 |
|
10 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2102973 |
|
9 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
488833 |
|
8 |
limit 7 to yr="2009 -Current" |
480 |
|
7 |
1 and 2 and 5 and 6 |
625 |
|
6 |
exp Methods/ or (procedure* or intervention*).ti,ab,kf. |
2747474 |
|
5 |
3 or 4 |
1065803 |
|
4 |
exp pain/ or Holistic Nursing/ or exp Holistic Health/ or pain*.ti,kf. or ache*.ti,kf. or suffering.ti,kf. or anguish*.ti,kf. or holistic*.ti,kf. |
511062 |
|
3 |
exp Fear/ or anxious*.ti,kf. or anxiet*.ti,kf. or fear*.ti,kf. or panic*.ti,kf. or dread*.ti,kf. or worry*.ti,kf. or agitation.ti,kf. or agitated.ti,kf. or apprehensi*.ti,kf. or nervous*.ti,kf. or distress*.ti,kf. or catastrophi*.ti,kf. or discomfort*.ti,kf. or stress*.ti,kf. |
572629 |
|
2 |
exp Neurolinguistic Programming/ or Patient Comfort/ or exp Hypnosis/ or exp Hypnosis, Anesthetic/ or Virtual Reality/ or Imagery, Psychotherapy/ or exp Breathing Exercises/ or distraction*.ti,kf. or nonpharmacolog*.ti,kf. or non pharmacolog*.ti,kf. or (age appropriate adj4 (communication or approach* or method* or language or strateg* or information or way)).ti,kf. or blowing bubbles.ti,kf. or nlp.ti,kf. or neurolinguistic program*.ti,kf. or comfort.ti,kf. or hypnosis.ti,kf. or virtual reality.ti,kf. or guided imagery.ti,kf. |
44745 |
|
1 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2589795 |
Cinahl
|
# |
Query |
Limiters/Expanders |
Results |
|
S10 |
S1 AND S2 AND S5 AND S6 OBS |
Limiters - Published Date: 20090101-20211231; Clinical Queries: Therapy - High Sensitivity, Prognosis - High Sensitivity, Qualitative - Best Balance; Publication Type: Clinical Trial |
44 |
|
S9 |
S1 AND S2 AND S5 AND S6 RCT |
Limiters - Published Date: 20090101-20211231; Clinical Queries: Therapy - High Specificity; Randomized Controlled Trials |
99 |
|
S8 |
S1 AND S2 AND S5 AND S6 SR |
Limiters - Published Date: 20090101-20211231; Publication Type: Meta Analysis, Systematic Review |
111 |
|
S7 |
S1 AND S2 AND S5 AND S6 |
Expanders - Apply equivalent subjects |
1,565 |
|
S6 |
(procedure* OR intervention*) |
Expanders - Apply equivalent subjects |
687,941 |
|
S5 |
S3 OR S4 |
Expanders - Apply equivalent subjects |
841,494 |
|
S4 |
(MH "Pain+") OR (MH "Holistic Nursing") OR (MH "Holistic Care") OR (pain* OR ache* OR suffering OR anguish* OR holistic*) |
Expanders - Apply equivalent subjects |
414,865 |
|
S3 |
(MH "Fear+") OR (anxious* OR anxiet* OR fear* OR panic* OR dread* OR worry* OR agitation OR agitated OR apprehensi* OR nervous* OR distress* OR catastrophiz* OR discomfort* OR stress*) OR ((TI) anxious* OR anxiet* OR fear* OR panic* OR dread* OR worry* OR agitation OR agitated OR apprehensi* OR nervous* OR distress* OR catastrophiz* OR discomfort* OR stress*) |
Expanders - Apply equivalent subjects |
488,034 |
|
S2 |
(MH "Neurolinguistic Programming") OR (MH "Comfort") OR (MH "Hypnosis, Anesthetic") OR (MH "Hypnosis") OR (MH "Virtual Reality") OR (MH "Virtual Reality Exposure Therapy")OR (MH "Guided Imagery") OR (MH "Simple Guided Imagery (Iowa NIC)") OR (MH "Breathing Exercises+") OR (TI "Neurolinguistic Program*") OR (AB "Neurolinguistic Program*") OR (TI "Comfort") OR (AB "Comfort") OR (TI "Hypnosis") OR (AB "Hypnosis") OR (MTI"Virtual Reality") OR (AB "Virtual Reality") OR (TI "Guided Imagery") OR (AB "Guided Imagery") OR (TI "Breathing Exercise*") OR (AB"Breathing Exercise*") OR (TI distraction*) OR (AB distraction*) OR (TI nonpharmacologic*) OR (AB nonpharmacologic) OR (("age appropriate" N4 (communication OR approach* OR method* OR language OR strateg* OR information OR way)) OR ((TI) "blowing bubbles" OR nlpOR "neurolinguistic program*" OR comfort OR hypnosis OR "virtual reality" OR "guided imagery") OR ((AB) "blowing bubbles" OR nlpOR "neurolinguistic program*" OR comfort OR hypnosis OR "virtual reality" OR "guided imagery") |
Expanders - Apply equivalent subjects |
45,807 |
|
S1 |
child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?) |
Expanders - Apply equivalent subjects |
1,368,310 |
Sub question 2
Algemene informatie
|
Richtlijn: NVA PSA kinderen |
|
|
Uitgangsvraag: 16.2 Wat zijn de (on)gunstige effecten van niet-farmacologische fysieke interventies tijdens of voorafgaand aan een procedure bij kinderen die een pijnlijke procedure (zullen) ondergaan? |
|
|
Database(s): Ovid/Medline, Embase, Cinahl |
Datum: 14-4-2021,16-4-2021 |
|
Periode: 2009- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting:
16-4-2021 Vanwege de overlap in de vragen 16.1 en 16.2 wordt besloten om ze bijeen te voegen.
14-4-2021
Omdat in vraag 16.1 ook gezocht is op nonfarmacologisch, comfort en distraction wordt daar in deze zoekopdracht niet naar gezocht.
Er is gezocht met de volgende elementen: kinderen EN fysieke interventies EN (pijn of angst) EN procedures
Vanwege de hoge aantallen is overwogen om het zoekblok van de fysieke interventies te beperken op ti,kw. Helaas werden mogelijk relevante studies daardoor uitgesloten waardoor de strategie breder moest worden opgezet naar ti,ab,kw.
Het trefwoord/title/abstract/keyword Vibration is toegevoegd. NB. De trefwoorden Sucrose, milk of skin to skin zijn niet meegenomen in de terminologie. Indien nodig kunnen ze worden toegevoegd.
Nadat de strategie is uitgevoerd is een vergelijking gemaakt met de psychologische interventies en is te constateren dat er een overlap is van ca. 18%.
Er zijn geen sleutelartikelen aangeleverd voor de fysieke interventie.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase, Ovid/Medline en Cinahl is op 2021 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over niet-farmacologische interventies tijdens of voorafgaand aan een procedure bij kinderen die een pijnlijke procedure (zullen) ondergaan. De literatuurzoekactie leverde 1.584 unieke treffers op. |
|
Zoekopbrengst
|
Fysieke en psychologische interventie 16-4-2021 |
EMBASE |
OVID/MEDLINE |
Cinahl |
Ontdubbeld |
|
SRs |
391 |
182 |
182 |
264 |
|
RCTs |
943 |
481 |
165 |
859 |
|
Observationele studies |
484 |
99 |
81 |
461 |
|
Overig |
|
|
|
|
|
Totaal |
|
|
|
1584 |
|
Fysieke interventie 14-4-2021 |
EMBASE |
OVID/MEDLINE |
Cinahl |
Ontdubbeld |
|
SRs |
171 |
100 |
71 |
224 |
|
RCTs |
498 |
269 |
66 |
592 |
|
Observationele studies |
267 |
62 |
38 |
317 |
|
Overig |
|
|
|
|
|
Totaal |
|
|
|
1133 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#15 |
#12 NOT #11 NOT #10 OBS |
267 |
|
#14 |
#11 NOT #10 RCT |
498 |
|
#13 |
#10 OR #11 OR #12 |
925 |
|
#12 |
#6 AND #9 |
495 |
|
#11 |
#6 AND #8 |
577 |
|
#10 |
#6 AND #7 SR |
171 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6462675 |
|
#8 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2500470 |
|
#7 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
533576 |
|
#6 |
#5 AND (1-1-2009)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1464 |
|
#5 |
#1 AND #2 AND #3 AND #4 |
2955 |
|
#4 |
'temperature stress'/exp OR 'vibration'/exp OR 'patient positioning'/exp OR 'facilitated tucking'/exp OR 'swaddling'/exp OR positioning:ti,ab,kw OR swaddling:ti,ab,kw OR 'facilitated tuck*':ti,ab,kw OR buzzy:ti,ab,kw OR cooling:ti,ab,kw OR distract*:ti,ab,kw OR ((('low stimul*' OR quiet OR ambient OR 'child friendly' OR childfriendly) NEAR/2 (environment OR setting OR room)):ti,ab,kw) OR 'child life specialist*':ti,ab,kw OR vibrati*:ti,ab,kw OR lighting:ti,ab,kw OR 'heat pack':ti,ab,kw OR 'cold pack':ti,ab,kw OR 'dimmed light*':ti,ab,kw OR 'ambient temperature':ti,ab,kw |
364645 |
|
#3 |
'medical procedures'/exp OR procedure*:ti,ab,kw OR intervention*:ti,ab,kw |
26654908 |
|
#2 |
'fear'/exp OR anxious*:ti,kw OR anxiet*:ti,kw OR fear*:ti,kw OR panic*:ti,kw OR dread*:ti,kw OR worry*:ti,kw OR agitation:ti,kw OR agitated:ti,kw OR apprehensi*:ti,kw OR nervous*:ti,kw OR distress*:ti,kw OR catastrophiz*:ti,kw OR discomfort*:ti,kw OR stress*:ti,kw OR 'pain'/exp OR 'holistic nursing'/exp OR 'holistic care'/exp OR pain*:ti,kw OR ache*:ti,kw OR suffering:ti,kw OR anguish*:ti,kw OR holistic*:ti,ab,kw |
2389191 |
|
#1 |
infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:de,ti,ab OR paediatric*:de,ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR 'pediatrics'/exp OR 'pediatric patient'/exp |
4343523 |
Ovid/Medline
|
# |
Searches |
Results |
|
17 |
15 not 14 not 13 OBS |
62 |
|
16 |
14 not 13 RCT |
269 |
|
15 |
11 and 12 |
154 |
|
14 |
10 and 12 |
323 |
|
13 |
9 and 12 SR |
100 |
|
12 |
8 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
604 |
|
11 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) |
3803582 |
|
10 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2105137 |
|
9 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
489888 |
|
8 |
limit 7 to yr="2009 -Current" |
609 |
|
7 |
1 and 2 and 5 and 6 |
812 |
|
6 |
exp Methods/ or (procedure* or intervention*).ti,ab,kf. |
2750317 |
|
5 |
3 or 4 |
1054601 |
|
4 |
exp pain/ or pain*.ti,kf. or ache*.ti,kf. or suffering.ti,kf. or anguish*.ti,kf. |
498844 |
|
3 |
exp Fear/ or anxious*.ti,kf. or anxiet*.ti,kf. or fear*.ti,kf. or panic*.ti,kf. or dread*.ti,kf. or worry*.ti,kf. or agitation.ti,kf. or agitated.ti,kf. or apprehensi*.ti,kf. or nervous*.ti,kf. or distress*.ti,kf. or catastrophi*.ti,kf. or discomfort*.ti,kf. or stress*.ti,kf. |
573420 |
|
2 |
exp Vibration/ or exp Patient Positioning/ or Facilitated Tucking/ or positioning.ti,ab,kf. or swaddling.ti,ab,kf. or facilitated tuck*.ti,ab,kf. or buzzy.ti,ab,kf. or cooling.ti,ab,kf. or distract*.ti,ab,kf. or ((low stimul* or quiet or ambient or child friendly or childfriendly) adj2 (environment or setting or room)).ti,ab,kf. or child life specialist*.ti,ab,kf. or vibrati*.ti,ab,kf. or lighting.ti,ab,kf. or heat pack.ti,ab,kf. or cold pack.ti,ab,kf. or dimmed light*.ti,ab,kf. or ambient temperature.ti,ab,kf. |
249308 |
|
1 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2591996 |
Cinahl
|
# |
Query |
Limiters/Expanders |
Results |
|
S8 |
S1 AND S2 AND S3 AND S4 OBS |
Limiters - Published Date: 20090101-20211231; Clinical Queries: Therapy - High Sensitivity; Publication Type: Clinical Trial, Nursing Interventions, Protocol |
38 |
|
S7 |
S5 NOT S6 SR |
Limiters - Published Date: 20090101-20211231; Publication Type: Meta Analysis, Meta Synthesis, Systematic Review |
71 |
|
S6 |
S1 AND S2 AND S3 AND S4 RCT |
Limiters - Published Date: 20090101-20211231; Clinical Queries: Therapy - High Specificity; Publication Type: Commentary, Editorial, Randomized Controlled Trial |
66 |
|
S5 |
S1 AND S2 AND S3 AND S4 |
Expanders - Apply equivalent subjects |
1,102 |
|
S4 |
(procedure* OR intervention*) |
Expanders - Apply equivalent subjects |
688,394 |
|
S3 |
(MH "Fear+") OR (anxious* OR anxiet* OR fear* OR panic* OR dread* OR worry* OR agitation OR agitated OR apprehensi* OR nervous* OR distress* OR catastrophiz* OR discomfort* OR stress*) OR ((TI) anxious* OR anxiet* OR fear* OR panic* OR dread* OR worry* OR agitation OR agitated OR apprehensi* OR nervous* OR distress* OR catastrophiz* OR discomfort* OR stress*) OR (MH "Pain+") OR (MH "Holistic Nursing") OR (MH "Holistic Care") OR (pain* OR ache* OR suffering OR anguish* OR holistic*) |
Expanders - Apply equivalent subjects |
842,060 |
|
S2 |
(MH "Vibration") OR (MH "Patient Positioning+") OR TI (positioning OR swaddling OR facilitated tuck* OR buzzy OR cooling OR distract* OR ((low stimul* OR quiet OR ambient OR child friendly OR childfriendly) N2 (environment OR setting OR room)) OR child life specialist* OR vibrati* OR lighting OR heat pack OR cold pack OR dimmed light* OR ambient temperature) OR AB (positioning OR swaddling OR facilitated tuck* OR buzzy OR cooling OR distract* OR ((low stimul* OR quiet OR ambient OR child friendly OR childfriendly) N2 (environment OR setting OR room)) OR child life specialist* OR vibrati* OR lighting OR heat pack OR cold pack OR dimmed light* OR ambient temperature) |
Expanders - Apply equivalent subjects |
47,955 |
|
S1 |
child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?) |
Expanders - Apply equivalent subjects |
1,369,115 |