Opioïde of esketamine voor analgesie bij diepe sedatie
Uitgangsvraag
Wat is de optimale bijkomende pijnstilling bij een diepe sedatie (met propofol) bij kinderen?
Aanbeveling
Overweeg het gebruik van esketamine als analgeticum in combinatie met propofol voor PSA als groot belang wordt gehecht aan het zo snel mogelijk bereiken van een situatie van diepe sedatie en analgesie met minimale kans op ademhalings- en hemodynamische depressie.
Overweeg het gebruik van een (ultra) kort werkend opioïde in combinatie met propofol als groot belang wordt gehecht aan een snel ontwaken zonder onrust of verwarring, met name bij oudere kinderen.
Overweeg het gebruik van een (ultra) kort werkend opioïde in combinatie met propofol als de kans groot is dat een procedure langer duurt dan de werking van één gift esketamine.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De literatuur over de voor- en nadelen van het gebruik van een kortwerkend opioïde met propofol vergeleken met ketamine met propofol voor procedurele sedatie en analgesie bij kinderen is beperkt, met drie gerandomiseerde studies die qua studiepopulatie en behandeling sterk verschillen. In totaal zijn 172 patiënten onderzocht, waarbij is gekeken naar de uitkomstmaten respiratoire en hemodynamische depressie, hersteltijd en bijwerkingen. De studiepopulaties waren kinderen die een pijnlijke procedure moesten ondergaan, en die geclassificeerd konden worden als 12-13 jarige ASA I patiënten voor gastroscopie, (Damps, 2019) en 1-3 jarige ASA I of II (Seol, 2015) of 0,5- 5 jarige ASA II of III (Tosun, 2008) patiënten voor brandwondenzorg.
Wat betreft de cruciale uitkomstmaat respiratoire depressie worden over het algemeen geen statistisch significante en klinisch relevante effecten gerapporteerd in de drie studies. Nagenoeg alle effecten lijken in het voordeel te zijn van behandeling met ketamine en propofol. Voor hemodynamische depressie werd er in één van de studies een beperkt hemodynamisch onderdrukkend effect gevonden van een kortwerkend opioïde met propofol vergeleken met ketamine met propofol.
Er werd er in de studie van Tosun (2008) meer onrust en bewegelijkheid van de patiënt waargenomen tijdens de procedure bij gebruik van een kortwerkend opioïd met propofol in vergelijking met ketamine met propofol. Er werd geen verschil gezien in onrust of hallucinaties tijdens ontwaken. Seol (2015) rapporteerde helaas geen cijfers over verwardheid of onrust tijdens het ontwaken. In de studie van Damps (2019) werd meer verwardheid en onrust gezien tijdens ontwaken na gebruik van ketamine en propofol vergeleken met kortwerkend opiaat en propofol. Het is onduidelijk of dit verschil in bijwerkingen veroorzaakt werd door het verschil in studiepopulaties tussen de twee studies. Door de kleine studiepopulaties is het verder niet mogelijk om uitspraken te doen over subgroepen van patiënten.
De bewijskracht van de samengevatte studies is voor de cruciale uitkomstmaten zeer laag (respiratoire depressie) of laag (overige uitkomstmaten). De lage bewijskracht wordt veroorzaakt door de kleine studiepopulaties, tegenstrijdige effectschattingen, of betrouwbaarheidsintervallen die 0 bevatten. Dit zorgt ervoor dat de volledige bewijskracht voor de voor- en nadelen van het gebruik van een kortwerkend opioïd toegevoegd aan propofol bij procedurele sedatie en analgesie bij kinderen, vergeleken met ketamine toegevoegd aan propofol, zeer laag is. Een studie met een hogere bewijskracht zou in elk geval groter moeten zijn en gestandaardiseerde metingen van uitkomstmaten moeten bevatten.
Waarden en voorkeuren van patiënten en hun verzorgers
De patiënt en verzorgers zijn gebaat bij een PSA techniek die betrouwbaar en veilig goede sedatie en pijnstilling verzorgt waarmee de geïndiceerde procedure kan worden uitgevoerd. Technieken die (mits de algemene patiënt toestand dit toelaat) bijdragen aan een sneller ontslag naar huis kunnen een voordeel inhouden voor patiënt en verzorgers. Bijwerkingen zoals hallucinaties, verwarring, misselijkheid en aanhoudende sufheid dragen bij aan een minder comfortabel en mogelijk langer verblijf in het ziekenhuis. Ook zou hierdoor een afkeer voor de PSA of procedure kunnen ontstaan wat behandel- of ziekenhuisontwijking zou kunnen veroorzaken.
Kosten (middelenbeslag)
De kosten van esketamine (€22 voor 10 ml van de 5 mg/ml oplossing) zijn groter dan van equivalente opioïden (alfentanil: €0,68; fentanyl: €0,41; remifentanyl: €4,59) Bron: Farmacotherapeutisch Kompas 2022. Alhoewel dit voor de totale kosten van de behandeling geen groot verschil in zal houden is het wel een bijkomend argument om indien dit verantwoord wordt geacht, te kiezen voor een van de kortwerkende opioïden in plaats van esketamine.
Aanvaardbaarheid, haalbaarheid en implementatie
Het medicament esketamine heeft onder sommige sedationisten een wat negatieve connotatie vanwege het optreden van negatieve psychische bijwerkingen met name na toepassing bij volwassenen. Om dit tegen te gaan werd midazolam geadviseerd. Uit deze literatuurstudie komt naar voren dat deze negatieve emoties bij kinderen niet vaak voorkomen als ketamine wordt gecombineerd met propofolsedatie. Ook misselijkheid en braken na ketamine toediening blijkt mee te vallen mits gecombineerd met propofolsedatie. Esketamine is eenvoudig beschikbaar en wordt vermeld in het kinderformularium voor deze toepassing.
Er zijn geen aanvullende competenties vereist voor de sedationist die bekwaam is in diepe PSA bij kinderen vergeleken met opioid analgesie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de bestudeerde literatuur lijkt er niet een sterk voordeel van het gebruik van een kortwerkend opioïde (fentanyl) versus ketamine als analgeticum aanvullend aan propofol sedatie voor procedurele sedatie en analgesie voor korte pijnlijke procedures zoals brandwondenzorg bij kleine kinderen. Het gebruik van het ultrakortwerkende remifentanil levert mogelijk wel voordelen op vergeleken met ketamine in de vorm van snellere recovery na brandwondenzorg. Ook zijn er aanwijzingen dat bij oudere kinderen korte tijd na toediening van propofol en ketamine agitatie en verwarring tijdens het ontwaken vaker voorkomen dan na toediening van propofol en remifentanil. Daarom heeft het de voorkeur om in deze gevallen ketamine te vermijden en te kiezen voor een kortwerkend sterk opioïde als dit verantwoord wordt geacht. Uit twee studies blijkt een klein maar significant verschil in tijd tot ontwaken na ketamine vergeleken met remifentanil infusie. Als herhaalde giften van ketamine noodzakelijk blijken is het aannemelijk dat dit verschil toeneemt. Ook in dit geval is het indien mogelijk aan te bevelen om te kiezen voor een kortwerkend opioïde in plaats van ketamine als analgeticum aanvullend aan propofol sedatie.
Misselijkheid en braken, dat vaak geassocieerd wordt met het gebruik van ketamine, kwam in deze studies vrijwel niet voor.
In Nederland wordt voor PSA bij kinderen ook veel gebruik gemaakt van het kortwerkend opioïde alfentanil, dat qua werkingsduur tussen remifentanil en fentanyl in zit. Het gebruik van alfentanil analgesie in combinatie met propofol bij kinderen is beschreven als “lichte propofol anesthesie” bij lumbaal puncties en beenmergpuncties voor oncologische behandeling (Von Heijne 2004). Op basis van deze literatuur kan geen uitspraak worden gedaan over het gebruik van alfentanil vergeleken met ketamine als analgeticum tijdens PSA.
In bovengenoemde literatuur en overwegingen wordt uitgegaan van planbare PSA bij patiënten die zich in een cardiorespiratoir stabiele toestand bevinden en nuchter zijn conform de gebruikelijke aanbevelingen. Als sprake is van cardiorespiratoire instabiliteit of verhoogde kans op aspiratie en een acute procedure met PSA is geïndiceerd dan wordt in de internationale literatuur aanbevolen om een ketamine gebaseerde PSA te verzorgen (American Academy of Pediatrics 2019) met als doel een zo laag mogelijke kans op toename van cardiorespiratoire instabiliteit en noodzaak tot masker-ballon beademing.
In de Nederlandse situatie wordt vrijwel enkel het meer potente esketamine gebruikt in plaats van het racemisch mengsel ketamine. Voor intraveneus gebruik van esketamine wordt een halvering van de dosis van racemisch ketamine aanbevolen (Peltoniemi 2016).
De gebruikelijke dosering van esketamine ikv een PSA is een langzame toediening van 0,5-1 mg/kg. De langzame toediening is van belang om apneu/hypoventilatie te vermijden.
Onderbouwing
Achtergrond
Er bestaat praktijkvariatie met betrekking tot het meest optimale regime voor analgesie voor pijnlijke diagnostische of therapeutische procedures bij kinderen.
Uitgaande van procedurele sedatie met propofol kan zowel esketamine als een kortwerkend opioïde worden gebruikt als analgeticum. Beide middelen hebben voor- en nadelen, het is onduidelijk welk werkings- en bijwerkingsprofiel het meest optimaal is in deze setting. In Nederland is hoofdzakelijk het stereoisomeer esketamine beschikbaar. Onderstaande studies zijn allen uitgevoerd met het racemisch mengsel ketamine.
Conclusies / Summary of Findings
|
Low GRADE |
Using a short acting opioid in addition to propofol for procedural sedation and analgesia may result in respiratory depression when compared with ketamine in addition to propofol in children. Sources: Tosun, 2008; Damps, 2019; Seol, 2015 |
|
Low GRADE |
Using a short acting opioid in addition to propofol for procedural sedation and analgesia may result in limited haemodynamic depression when compared with ketamine in addition to propofol in children. Sources: Tosun, 2008; Damps, 2019; Seol, 2015 |
|
Low GRADE |
Using an ultra-short acting opioid (remifentanil) in addition to propofol for procedural sedation and analgesia may result in shorter recovery time when compared with ketamine in addition to propofol in children. Sources: Tosun, 2008; Damps, 2019; Seol, 2015 |
|
Low GRADE |
The evidence suggests that a short acting opioid in addition to propofol for procedural sedation and analgesia does not reduce or increase psychological adverse effects compared to ketamine in addition to propofol in children between 2 and 3 years of age. Sources: Tosun, 2008 |
|
Low GRADE |
The evidence suggests that ketamine in addition to propofol for procedural sedation and analgesia may increase psychomimetic adverse effects compared to a short acting opioid in addition to propofol in children around 12 to 13 years of age. Sources: Damps, 2019 |
Samenvatting literatuur
Description of studies
Tosun (2008) performed a randomised controlled trial to investigate the effect of a short-acting opioid (fentanyl) i.v. in addition to propofol i.v. (PF) in comparison with ketamine i.v. in addition to propofol i.v. (PK) to induce sedation and analgesia during a painful procedure in children aged 5 to 60 months. The study included 32 children with a status classified as ASA II or ASA III with burn wounds and a burn surface area of 5-25%, and requiring burn wound dressing change. After inclusion and randomisation, the children were assigned to one of two study arms, to receive either ketamine or fentanyl in combination with propofol in dosages to induce sufficient sedation and analgesia. The reported outcomes were heart rate, systolic blood pressure, oxygen and carbon dioxide saturation, respiratory rate, total medication doses, sedation score, restlessness, time to recovery, and side effects.
Damps (2019) performed a randomised controlled trial to investigate the effect of a short-acting opioid (remifentanil infusion) i.v. in addition to propofol i.v. (PR) in comparison with ketamine i.v. in addition to propofol i.v. (PK) to induce sedation and analgesia during a painful procedure in children under 16 years of age. The study included 90 children with an ASA I status, who were to undergo general anaesthesia in order to perform elective endoscopy of the upper gastrointestinal tract. After inclusion, the patients were randomised into one of two arms, to receive either ketamine or fentanyl in combination with propofol in dosages to induce sufficient sedation and analgesia. Among reported outcomes were apnoea, desaturation, oxygen and carbon dioxide saturation, heart rate, systolic and diastolic blood pressure, consciousness state when waking up, and adverse events.
Seol (2015) performed a randomised controlled trial to investigate the effect of a short-acting opioid (remifentanil infusion) i.v. in addition to propofol i.v. (PR) in comparison with ketamine i.v. in addition to propofol i.v. (PK) to induce sedation and analgesia during a painful procedure in children between 12 and 36 months of age. The study included 50 children with an ASA I or II status, who were to undergo deep sedation in order to perform the first burn wound dressing change after a skin graft replacement to treat second degree burns over 5-25% of body surface area. After inclusion, the patients were randomised into one of two arms, to receive either ketamine or remifentanil in combination with propofol in dosages to induce sufficient sedation and analgesia. Among reported outcomes were respiratory depression, hypoxia, heart rate and bradycardia, mean arterial pressure, time to recovery, and adverse events: nausea/vomiting.
Results
Tosun (2008) included 32 children with an average age of 24.4 months (standard deviation: 17.4, n=17) in the PK group and 29.5 months (standard deviation: 18.8, n=15) in the PF group. The age, weight and burn surface area did not differ significantly between the study groups. The mean duration of wound care was 22.2 (sd: 7.0; PK) and 24.2 (sd: 1.6; PF) minutes.
Damps (2019) included 90 children with an average age of 13.0 years (standard deviation: 9.0, n=46) in the PK group and 12.0 years (standard deviation: 8.0, n=44) in the PR group. The median duration of gastroscopy was 9 minutes (IQR: 2) in both groups. Age and sex did not differ significantly between the study groups. One patient in the PK group did not finish the study due to failure of the IV after insertion.
Seol (2015) included 50 children with an average age of 19 months (range: 12-36, n=25) in the PK group and 18 months (range: 12-33, n=25) in the PR group. The median duration of the wound dressing procedure was 11.0 minutes (IQR: 10.0-12.5) in the PK group, and 10.5 minutes (IQR: 10.0-12.0) in the PR group. Age, sex, and burn wound surface area did not differ between the study groups.
Respiratory depression
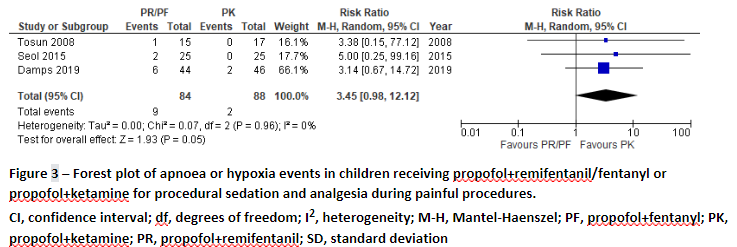
All three studies reported on measures of respiratory depression.
Tosun (2008) reported one case of hypoxia (defined as a pO2<90%) in the PF requiring jaw position adjustment, and zero cases in the PK group.
Damps (2019) reported on cases of apnoea. In the PR group, 6 patients (13.6%) showed apnoea, while in the PK group 2 cases of apnoea were reported (4.3%), which was not significantly different. No significant differences in desaturation, pCO2, and pO2 between the two treatments were found.
Seol (2015) reported on respiratory depression (defined as apnoea >15s or respiratory rate <10 breaths/minute). In the PR group, 2 patients (8%) showed apnoea, while in the PK group 0 cases of apnoea were reported (0%) (p=0.490). One patient in the PR group required assisted ventilation to recover from apnoea.
The data on hypoxia or apnoea events were pooled, and are presented in Figure 1.
Haemodynamic depression
All three studies reported on measures of haemodynamic depression.
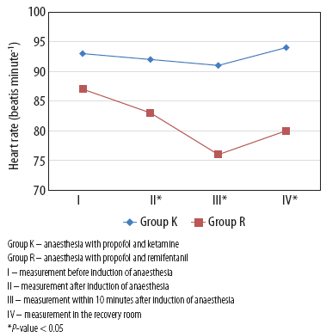
Tosun (2008) reported a decreased heart rate in the PF group compared to the PK group 15 minutes after induction (p<0.05).
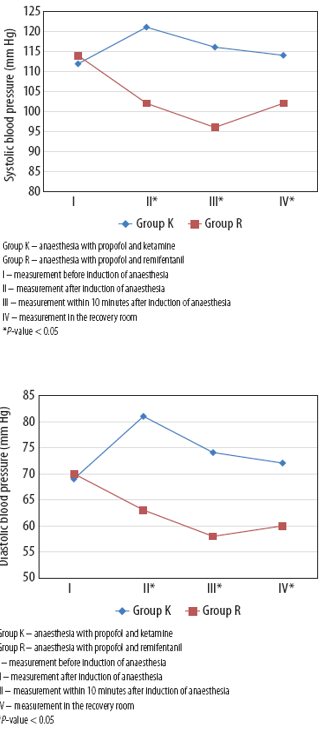
Damps (2019) reported statistically significantly lower heart rate, systolic, and diastolic blood pressure right after induction of anaesthesia, 10 minutes after induction, and during the measurement in the recovery room in the PR group (p<0.05). Of note, independent t-tests were used to analyse heart rate and blood pressure over time, where an ANOVA would be more appropriate.
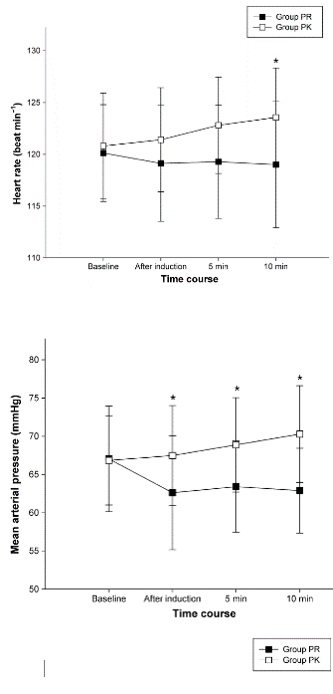
Seol (2015) reported on bradycardia, and mean arterial pressure and heart rate at 4 time points (baseline, after induction, 5 minutes after induction, and 10 minutes after induction. In both study arms, bradycardia was measured in 0 participants. Heart rate started at 120 beats per minute in both groups, it decreased to 119 in the PR group after 10 minutes, and increased to 123 in the PK group (p=0.028) (values approximate, as they were read from the graph). Mean arterial pressure started at 67 in both groups, and was 62.5 at the other time points in the PR group, and increased to 70 in the PK group (p<0.001) (values approximate, as they were read from the graph).
No rescue drugs for hemodynamic instability were administered in these studies.
Due to the difference in timing of outcome measurement and used outcome measures, the results could not be pooled.
Recovery time
Tosun (2008) reported no significant difference in recovery time (defined as time to Steward recovery score of 7): recovery time PK group 5.5 +/- 4.2 and PF group 3.8 +/- 2.6 minutes mean +/- SD, Damps (2019) reported a significant difference in state of consciousness on admission to the recovery room as 70 % of patients in the PK group were unconscious compared to 2 % patients in the PR group. Time to awakening (defined as time from stopping the propofol infusion to opening the eyes) in the PK group was 6 (IQR +/-5 ) versus 4 (IQR +/- 4.5) minutes in the PR group. This difference was statistically significant (p=0.007).
Seol (2015) reported recovery times (define as time to Steward recovery score of 6) of 10.3 minutes (IQR 9.1-11.5) in the PR group, and 22.5 minutes (IQR 20.3-25.6) in the PK group. This difference was statistically significant (p<0.001)
Psychomimetic adverse events
Tosun (2008) reported that during emergence no confusion, agitation, hallucinations, nausea or emesis were observed in either group.
Damps (2019) reported significantly more often confusion and agitation during emergence in the PK group (46%) than in the PR group (9 %). Vomiting occurred in 2 patients (5%) in the PK group and nil in the PR group. According to the parents, the child’s behaviour was not significantly different immediately after anesthesia.
Seol (2015) did not report on psychomimetic adverse events. No nausea or vomiting occurred in either group.
Level of evidence
The evidence for the outcome respiratory depression was downgraded with two levels due to imprecision (95% confidence intervals overlap with the null, two levels).
The evidence for the outcome haemodynamic depression was downgraded with two levels due to contradictory results (inconsistency), 95% confidence intervals overlap with the minimal clinically important difference (one level for imprecision).
The evidence for the outcome recovery time was downgraded with two levels due to contradictory results (inconsistency), low number of patients (one level for imprecision).
The evidence for the outcome psychomimetic adverse effects was downgraded with two levels due to contradictory results (inconsistency) and low number of patients (one level for imprecision).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag :
Wat zijn de (on)gunstige effecten van analgesie met een kortwerkende opiaat in combinatie met diepe PSA met propofol vergeleken met analgesie met ketamine in combinatie met diepe PSA met propofol bij een pijnlijke diagnostische of therapeutische procedure bij kinderen?
| P: | Kinderen 0-18 die een pijnlijke diagnostische en therapeutische procedures ondergaan |
| I: | Diepe sedatie (propofol) + analgesie met kortwerkend opioïde |
| C: | Diepe sedatie (propofol) + analgesie (ketamine) |
| O: | (Verhoogd risico op) respiratoire en hemodynamische depressie, psychomimetische bijwerkingen zoals hallucinaties, langere recoverytijd |
Relevante uitkomstmaten
De werkgroep achtte veiligheid een cruciale uitkomstmaat voor klinische besluitvorming, en bijwerkingen en hersteltijd belangrijke uitkomstmaten voor klinische besluitvorming.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Veiligheid (safety):
-
Respiratoire depressie: meer dan 10% verschil in rescue masker-ballon ventilatie, meer dan 5 % verschil in het gebruik van luchtweg devices (guedel, larynxmasker of intubatie).
-
Hemodynamische depressie: meer dan 10% verschil in gebruik van vasoactieve middelen bij hypotensie
Patientervaring: (comfort scale/patient satisfaction/PROM)
-
Psychomimetische bijwerkingen: meer dan 20% verschil in optreden van agitatie, verwarring, hallucinaties of angst tijdens de verkoeverperiode
-
Misselijkheid en braken
Verkoevertijd (length of stay for recovery): was er meer dan 20 % verschil in tijd tot klaar voor ontslag.
For all other outcome measures, the default thresholds proposed by the international GRADE working group were used: a 25 % difference in relative risk (RR) for dichotomous outcomes, and 0.5 standard deviations (SD) for continuous outcomes.
Zoeken en selecteren (Methode)
In de databases Embase en Ovid/Medline is op 15 november 2021 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over de effecten van analgesie met een kortwerkend opiaat in combinatie met diepe PSA met propofol. De literatuurzoekactie leverde 135 unieke treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review of RCT met fulltext en relevantie voor de PICO. Op basis van titel en abstract werden in eerste instantie 14 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 12 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 2 studies definitief geselecteerd.
Na literatuursamenvatting bleek dat niet alle synoniemen voor de opioïden waren opgenomen in de eerste zoekactie. Daarop is een aanvullende zoekactie gestart met daarin een volledig overzicht van termen: op 5-4-2022 is aanvullend gezocht met de combinatie Fentanyl en Ketamine. Deze zoekactie leverde t.o.v. de vorige zoekactie 116 referenties op. Op basis van titel en abstract werden in eerste instantie 5 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 4 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 1 studie definitief geselecteerd
Resultaten
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- American Academy of Pediatrics; American Academy of Pediatric Dentistry; Coté CJ, Wilson S; Guidelines for Monitoring and Management of Pediatric Patients Before, During, and After Sedation for Diagnostic and Therapeutic Procedures Pediatrics. 2019;143(6):e20191000
- Damps, M., Sto?tny, L., Siemek-Mitela, J., Lekstan, A., Krzych, ?., & Kucewicz-Czech, E. (2019). Comparison of propofol-ketamine versus propofol-remifentanil in children anaesthetized for gastroscopy. Anaesthesiology Intensive Therapy, 51(4), 262-267.
- Peltoniemi, M. A., Hagelberg, N. M., Olkkola, K. T., & Saari, T. I. (2016). Ketamine: a review of clinical pharmacokinetics and pharmacodynamics in anesthesia and pain therapy. Clinical pharmacokinetics, 55(9), 1059-1077.
- Seol, T. K., Lim, J. K., Yoo, E. K., Min, S. W., Kim, C. S., & Hwang, J. Y. (2015). Propofolketamine or propofolremifentanil for deep sedation and analgesia in pediatric patients undergoing burn dressing changes: a randomized clinical trial. Pediatric Anesthesia, 25(6), 560-566.
- Tosun, Z., Esmaoglu, A., & Coruh, A. (2008). Propofolketamine vs propofolfentanyl combinations for deep sedation and analgesia in pediatric patients undergoing burn dressing changes a. Pediatric Anesthesia, 18(1), 43-47.
- Von Heijne M, Bredlöv B, Söderhäll S, Olsson G.L. (2004) Propofol or propofol-alfentanil anesthesia for painful procedures in the pediatric oncology ward. Pediatric Anesthesia, 14, 670-675.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Tosun, 2008 |
Type of study: Randomised controlled trial
Setting and country: burn unit, University hospital in Turkey
Funding and conflicts of interest: Not reported |
Inclusion criteria: ASA II or III, 5-60 months of age, hospitalised with second degree burns
Exclusion criteria: Patients requiring inotropic support or mechanical ventilation
N total at baseline: Intervention: 15 Control: 17
Important prognostic factors2: For example age ± SD: I: 29.5m (18.8) C: 24.4m (17.4)
Sex: I: 53% M C: 59% M
Weight: I: 13.4 kg (2.92) C: 12.4 kg (2.9)
Groups comparable at baseline? Yes
|
Describe intervention (procedure):
1 µg×kg-1 fentanyl (1 ml×10 kg-1) and 1.2 mg×kg-1 propofol for induction
additional dose of propofol (0.5–1 mg×kg-1) if HR or SAP increased >20% during procedure
additional dose of fentanyl (0.5–1 µg×kg-1 if HR or SAP again increased >20% during procedure
|
Describe control (procedure):
1 mg×kg-1 ketamine (1 ml×10 kg-1) and 1.2 mg×kg-1 propofol for induction
additional dose of propofol (0.5–1 mg×kg-1) if HR or SAP increased >20% during procedure
additional dose of ketamine (0.5–1 mg×kg-1 if HR or SAP again increased >20% during procedure
|
Length of follow-up: 2 hours
Loss-to-follow-up: Intervention: 0 (0%)
Control: 0 (0%)
Incomplete outcome data: Intervention: 0 (0%)
Control: 0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Respiratory depression: p<0.05 at 20 min after induction in favour of ketamine
Haemodynamic depression: no significant difference in systolic pressure; p<0.05 at 15 after induction in favour of ketamine
Recovery time: no significant difference
AEs:
|
The authors conclude that ketamine and fentanyl, both in combination with propofol, to achieve procedural sedation and analgesia for painful procedures are equivalent in efficacy. However, fentanyl had a more detrimental risk profile regarding respiratory and circulatory depression, and the side effect of restlessness.
In the discussion, the authors mention that anaesthesia with ketamine in combination with propofol required less restraint than anaesthesia with fentanyl in combination with propofol, which indicates more effective analgesia with ketamine.
Comments by advisor: Blinding well executed, small study, scarce statistical analysis.
|
|
Damps, 2019 |
Type of study: Randomised controlled trial
Setting and country: elective endoscopy of the upper gastrointestinal tract under general anaesthesia, type of hospital not reported, Katowice, Poland
Funding and conflicts of interest: None reported |
Inclusion criteria: Children ASA I status enrolled for elective endoscopy of the upper gastrointestinal tract
Exclusion criteria: Not reported
N total at baseline: Intervention: 44 Control: 47
Important prognostic factors2: For example age ± SD: I: 12.0 years (8.0) C: 13.0 years (9.0)
Sex: I: 31.8% M C: 39.1% M
Groups comparable at baseline? Yes
|
Describe intervention (procedure): Induction:
Maintenance:
If necessary, an additional dose of propofol i.v. 0.5 mg kg-1
|
Describe control (procedure): Induction:
Maintenance:
If necessary, an additional dose of propofol i.v. 0.5 mg kg-1
|
Duration of follow-up: Last measurement in recovery room, timing not specified
Loss-to-follow-up: Intervention: N=0 (0%)
Control: N=1 (2%) Due to failure of IV after insertion
Incomplete outcome data: Intervention: Intervention: N=0 (0%)
Control: N=1 (2%) Due to failure of IV after insertion (same as loss to follow-up)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Respiratory depression:
Haemodynamic depression: Recovery time:
AEs:
|
The authors conclude that both methods of anaesthesia were safe, as no serious complications have occurred. Children receiving ketamine more often successfully underwent the procedure at the first attempt, less often needed an additional dose of propofol, were unconscious for longer, were more often confused after waking up, and less often had heamodynamic depression, compared to children receiving remifentanil.
Comments by advisor: Reasonably sized study, in which the method of induction (bolus vs continuos i.v.) may reduce effect of blinding. The authors’ conclusions that the interventions are equivalent may be too coarse, as there were differences in adverse effects, that may be due to a difference in depth of sedation or analgesia. |
|
Seol, 2015 |
Type of study: Randomised controlled trial
Setting and country: burn dressing changes, type of hospital not reported, Boramae Medical Center, Seoul, Korea
Funding and conflicts of interest: None reported |
Inclusion criteria: Children aged 12 to 36 months with ASA I or II status, second degree burns with an area of 5-25% of body surface area treated by skin graft replacement, scheduled for a first burn wound dressing change
Exclusion criteria: cardiovascular, cerebrovascular, pulmonary, renal or hepatic disease, upper respiratory infection or were at risk of aspiration.
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: For example age (range): I: 18 months (12-33) C: 19 months (12-36)
Sex: I: 48% M C: 48% M
Groups comparable at baseline? Yes
|
Describe intervention (procedure): Induction:
Maintenance:
If necessary, an additional dose of propofol i.v. 1 mg kg-1, or escalation to remifentanil 0.05-0.1 μg kg-1 min-1
|
Describe control (procedure): Induction:
If necessary, an additional dose of propofol i.v. 1 mg kg-1 or escalation to 0.5-1 mg kg-1 ketamine
|
Duration of follow-up: Timing not specified
Loss-to-follow-up: Intervention: N=0 (0%) Control: N=0 (0%)
Incomplete outcome data: Intervention: Intervention: N=0 (0%)
Control: N=0 (0%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Respiratory depression:
Haemodynamic depression:
Recovery time:
|
The authors conclude that both propofol–ketamine and propofol–remifentanil were effective for sedation and analgesia during burn wound dressing changes in children. Propofol combined with remifentanil resulted in faster recovery.
Comments by advisor: In general well performed trial, statistical methods are not always appropriate (Bonferroni correction for time-relates analyses reflects best intentions however). The p-value for hypoxia seems unrealistic as p=1.00 was reported for values that were numerically different. |
Risk of biastabel
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Tosun, 2008 |
Probably yes;
Reason: No information on method of randomisation |
Probably yes;
Reason: No information on method of concealment of allocation. |
Definitely yes;
Reason: Blinding was reported and well executed up till the moment of data analysis. |
Definitely yes;
Reason: No loss to follow-up |
Probably yes
Reason: No preregistration was found, but relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
LOW on all outcomes |
|
Damps, 2019 |
Probably yes; Reason: Randomisation performed by nurse not involved in procedure, a random number table was used |
Probably yes;
Reason: No information on method of concealment of allocation. |
Probably no
Reason: Health care providers not blinded, not clear whether outcome assessors were blinded. Different method of infusion (bolus vs continuous) may breach blinding of endoscopists |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group, and very likely not related to the intervention |
Probably yes
Reason: No preregistration was found, but relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
LOW on all outcomes |
|
Seol, 2015 |
Probably yes; Reason: Randomisation performed by investigator not involved in procedure, a random number table was used |
Probably yes;
Reason: No information on method of concealment of allocation. |
Definitely yes;
Reason: infusion solution was unmarked, patients and healthcare providers likely to be blinded, as well outcome assessors. |
Definitely yes;
Reason: no loss to follow-up |
Probably yes
Reason: No preregistration was found, but relevant outcomes were reported. |
Definitely yes;
Reason: no other problems observed |
LOW on all outcomes |
Exclusietabel
|
Author, year |
Reason exclusion |
|
Van Beek, 2012 |
Wrong combination I/C |
|
Kim, 2019 |
Wrong combination I/C |
|
Bellolio, 2016 |
Wrong combination I/C |
|
Chichakhov, 2010 |
Not in English |
|
Chiaretti, 2011 |
Wrong C: propofol + tramadol (opioid) |
|
Orel, 2015 |
Wrong I: propofol alone |
|
Erden, 2009 |
Narrative review |
|
Akbulut. 2017 |
Wrong combination I/C |
|
Hirsh, 2010 |
Wrong C: midazolam + ketamine |
|
Lago, 2009 |
Wrong C: propofol + remifentanyl |
|
Correia, 2011 |
Wrong scope: procedural pain in the newborn |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Opioïde of esketamine voor analgesie bij diepe sedatie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.