Intranasale esketamine
Uitgangsvraag
Wat is de plaats van intranasale esketamine voor PSA bij pijnlijke procedures bij kinderen?
What is the place of intranasal esketamine for PSA in painful procedures in children?
Aanbeveling
Gebruik geen esketamine intranasaal als monotherapie voor PSA als een matig tot diep sedatieniveau beoogd wordt.
Er kan in de Nederlandse situatie geen aanbeveling worden gedaan voor het gebruik van esketamine intranasaal voor lichte of matig tot diepe PSA tenzij hiervoor geschikte preparaten beschikbaar komen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de Nederlandse situatie wordt bijna alleen het meer potente stereoisomeer esketamine gebruikt in plaats van het racemisch mengsel ketamine. Voor intraveneus gebruik van esketamine wordt een halvering van de dosis van racemisch ketamine aanbevolen (Peltoniemi 2016). Onderstaande studies zijn allen uitgevoerd met het racemisch mengsel ketamine.
Er is literatuuronderzoek uitgevoerd waarbij breed werd gezocht naar de plaats van intranasale esketamine voor PSA bij pijnlijke procedures bij kinderen. Effectiviteit, comfort en veiligheid werden gedefinieerd als cruciale uitkomstmaten. Patiënttevredenheid werd gedefinieerd als belangrijke uitkomstmaat.
Op basis van de resultaten uit het literatuuronderzoek kan worden geconcludeerd dat de bewijskracht op basis van vijf geïncludeerde studies in deze richtlijnmodule erg onzeker is over het effect van intranasale esketamine voor PSA bij pijnlijke procedures bij kinderen.
N.B.: veel van onderstaande studies naar ketamine intranasaal hebben betrekking op tandheelkundige procedures. Dit is gebaseerd op toeval. Er is geen search verricht naar de meest optimale vorm van PSA voor tandheelkundige procedures.
De gebruikte dosering van ketamine in deze studies is zeer heterogeen, variërend van 0,5 tot 6 mg/kg. De biologische beschikbaarheid van ketamine na intranasale toediening is circa 45% (Peltoniemi 2016). Het is weinig aannemelijk dat een relevant effect van het medicament mag worden verwacht bij een intranasale dosering van 0,5 mg/kg (Mehran 2017). Het wordt uit deze studies duidelijk dat geen diep sedatie niveau kan worden bereikt met intranasale ketamine in de gebruikte concentratie binnen een dosis range van 3 tot 6 mg/kg. Het niveau van sedatie, de snelheid van intreden en de effectiviteit van sedatie en analgesie bij gebruik van ketamine intranasaal in de toegepaste dosis is vergelijkbaar met midazolam 0,2-0,4 mg/kg intranasaal.
De cruciale uitkomstmaten comfort en veiligheid werden in geen van de geïncludeerde studies in deze richtlijnmodule gerapporteerd, evenals de belangrijke uitkomstmaat patiënttevredenheid. Wel zijn er aanwijzingen dat de kans op het optreden van vitaal bedreigende incidenten zeer laag is en van dezelfde orde is na ketamine als na midazolam intranasaal. Er is geen patiënt- of oudertevredenheidsmaat gerapporteerd. Op basis van het algemene beeld van het verloop van de PSA sessies in de gerapporteerde studies en het ontbreken van patiënt- of oudertevredenheidsuitkomsten kan de vraag worden gesteld of dit verloop en de uitkomsten acceptabel zijn voor kind en ouder. Dit geldt zo mogelijk nog meer voor angstige of oncoöperatieve kinderen.
De studies zijn allen uitgevoerd met het racemisch mengsel ketamine meestal in de concentratie 50 mg/ml. Het volume dat hiermee moet worden toegediend voor de beoogde dosis (3 tot 5 mg/kg) is in veel patiënten groter dan de hoeveelheid die ineens kan worden opgenomen door de neusmucosa. (0,3-0,4 ml per neusgat). De medicatie werd druppelsgewijs toegediend afwisselend in het ene of andere neusgat. Dit kan compliance problemen opleveren tijdens de periode van toediening.
Alleen in de studie van Bahetwar (2011) werd een klinisch significant verschil gevonden tussen de ketamine (6 mg/kg) groep en midazolam (0,3 mg/kg) groep. Mogelijk is dit het gevolg van de hoge dosis ketamine die werd toegediend in een oplossing van 100 mg/ml. Dit heeft mogelijk geleid tot maximale opname via de neusmucosa en minimale lekkage naar oraal. Het significante verschil is temeer opmerkelijk omdat de dosis midazolam vrij hoog is.
Intranasale ketamine wordt ook vergeleken met dexmedetomidine (1 microgram/kg). Deze dosering dexmedetomidine is voor procedurele sedatie relatief laag. De tijdsduur tot intreden van effect na intranasale toediening van ketamine is korter dan na intranasale toediening van dexmedetomidine. Er zijn in deze studie aanwijzingen dat de kans op slagen van de beoogde procedure (lokale infiltratie en tandheelkundige zorg) groter zijn na dexmedetomidine intranasaal vergeleken met ketamine. De tijd tot herstel naar de uitgangssituatie is korter na ketamine dan na intranasale dexmedetomidine sedatie. Gyanesh (2014) beschrijft een dubbel blind gerandomiseerde studie onder 150 kinderen van 1 tot 10 jaar oud waarbij intranasale ketamine (5 mg/kg), dexmedetomidine (1 µg/kg) of NaCl 0,9% wordt gebruikt als premedicatie voor het plaatsen van een infuus dat aansluitend wordt gebruikt voor diepe sedatie met midazolam en propofol voor een MRI scan. De reactie van de kinderen op infuusplaatsing, de tevredenheid van de persoon die het infuus plaatst en de tevredenheid van de ouders met betrekking tot de “premedicatie” werden gescoord. Géén of mineure reactie op infuusplaatsing werden waargenomen in 75% respectievelijk 80% van de patiënten in de ketamine en dexmedetomidine groep tegenover 19 % in de NaCl 0,9% groep. De tevredenheid van inbrenger van het infuus en ouders was hoog zowel in de ketamine als dexmedetomidine groep. Er waren geen significante verschillen tussen de groep kinderen die ketamine of dexmedetomidine kregen toegediend. Op basis van de bestudeerde literatuur kan geen duidelijke voorkeur worden uitgesproken voor ketamine of dexmedetomidine in de gebruikte dosering.
In alle studies uit de search wordt ketamine vergeleken met midazolam (een puur sedativum zonder analgetisch effect) voor “matig pijnlijke” procedures (infuusplaatsing of lokale infiltratie voor aansluitende tandheelkundige behandeling). Uit een recente meta analyse (Oliveira 2020) naar het gebruik van intranasale racemisch ketamine (1-1,5 mg/kg) voor acute pijnstilling bij kinderen die worden opgenomen op de spoedeisende hulp blijkt dat in deze dosis het analgetisch effect vergelijkbaar is met een dosis intranasaal fentanyl (1,5-2 µg/kg). Bijkomende negatieve effecten kwamen iets meer voor na ketamine dan na fentanyl maar waren mild van aard. Lichte sedatie trad meer op in de ketamine groep (UMSS 1-2). Diepe sedatie (UMSS 3) kwam niet voor. De auteurs geven aan dat intranasaal ketamine als alternatief voor intranasaal fentanyl kan worden overwogen voor acute pijnbestrijding.
Guthrie (2021) beschrijft in een retrospectieve evaluatie bij 196 kinderen op de SEH de toepassing van een doseringsprotocol voor intranasale ketamine (100 mg/ml) waar gebruik gemaakt werd van herhaalde doseringen van intranasale ketamine als onvoldoende sedatieniveau werd bereikt 15 minuten na de eerste gift (doel: comfortabele toestand voor behandeling maar vermijden van matige of diepe sedatie). De primaire uitkomst van de studie was de tevredenheid van de sedationist bij het gebruik van intranasale ketamine tegen pijn, angst en agitatie. De behandelingen waren hoofdzakelijk wondbehandeling (42.9 %) en orthopedische procedures (16,3%). De mediane ketamine dosis was 3,9 mg/kg (Q1 – Q3 3,5-4,1). De over all tevredenheid score (mediaan; Q1-Q3) van de provider was 90/100 (75-100). Comfort van de patient zoals gescoord door de behandelaar (mediaan; Q1-Q3) was 75 / 100 (50-100). Bij 15 patiënten (7,7%) was sprake van een gefaalde PSA met intranasaal ketamine (d.w.z. PSA moest worden voortgezet met intraveneuze middelen), in 6 gevallen ging het daarbij om een orthopedische procedure. Adverse events kwamen niet vaak voor en waren mild van aard (drowsiness 1%, duizeligheid 1%, misselijkheid 1,5%, dysforie 0,5%). Tijd tot ontslag naar huis was korter na PSA met intranasale ketamine vergeleken met een vergelijkbare groep van patiënten die met intraveneuze PSA werd behandeld. (Mean length of stay 237 vs 323 minuten p< 0,001). Data over patiënt of ouder gerapporteerde tevredenheid worden niet gegeven. De techniek wordt aanbevolen vanwege de lage complexiteit (geen infuusplaatsing bij een kind noodzakelijk) en de snellere doorlooptijd op een drukke SEH.
In de Nederlandse situatie wordt vrijwel enkel het meer potente stereoisomeer esketamine gebruikt in plaats van het racemisch mengsel ketamine. Voor intraveneus gebruik van esketamine wordt een halvering van de dosis van racemisch ketamine aanbevolen (Peltoniemi 2016). Het is onbekend of intranasale toediening van esketamine in aangepaste dosis hetzelfde effect heeft als racemisch ketamine. Er vindt echter geen specifiek metabolisme plaats tussen neusmucosa en bloedbaan. Het is derhalve aannemelijk dat geen verschil in effect zal optreden tussen racemisch ketamine en esketamine.
Een praktisch probleem is dat de hoogst beschikbare concentratie van esketamine voor intraveneuze toediening 25 mg/ml bedraagt. Het volume dat van deze oplossing moet worden toegediend is veel groter dan het volume dat kan worden geabsorbeerd door de neusmucosa. Het is onwaarschijnlijk dat door middel van herhaalde toediening van kleine hoeveelheden (Guthrie 2021) dit probleem kan worden omzeild bij toepassing van de 25 mg/kg oplossing. Er is een hooggeconcentreerd esketamine preparaat voor intranasale spray toediening beschikbaar met als indicatie therapie resistente depressie bij volwassenen (Spravato: 14 mg esketamine per puff d.w.z. 28 mg/0,2 ml). Er zijn geen gegevens over toepassing van dit preparaat bij kinderen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het kind en verzorgers zijn gebaat bij een PSA-techniek die op comfortabele wijze, betrouwbaar en veilig goede sedatie en pijnstilling verzorgt waarmee de geïndiceerde procedure kan worden uitgevoerd. Technieken die (mits de algemene patiënttoestand dit toelaat) bijdragen aan een sneller ontslag naar huis kunnen een voordeel inhouden voor kinderen, verzorgers en het ziekenhuis. Bijwerkingen zoals misselijkheid en aanhoudende sufheid dragen bij aan een minder comfortabel en mogelijk langer verblijf in het ziekenhuis. Individuele kinderen verschillen in hun voorkeur ten aanzien van het wakker plaatsen van een infuus en medewerking bij het accepteren van nasaal toegediende medicatie of geschiktheid voor toediening van lachgassedatie via een neus-mond masker. Dit laatste kan van groot belang zijn voor de beleving van de behandeling door het kind en de verzorgers.
Over de effectiviteit en het comfort van PSA met esketamine intranasaal voor pijnlijke procedures is nog veel onduidelijkheid. Een enkele recente retrospectieve studie (Guthrie 2021) lijkt veelbelovend. Of het in Nederland veelgebruikte esketamine even succesvol kan zijn in de beschikbare concentratie is nog onduidelijk. Voor de individuele patiënt waarbij de intranasale route gewenst is voor de uitvoering van lichte PSA voor een pijnlijke procedure kan een getitreerde toediening van esketamine worden voorgesteld aan de patiënt. Bovengenoemde onzekerheden kunnen voor behandelaars (sedationisten) een reden zijn om de optie van intranasale esketamine niet aan de patiënt aan te bieden.
Kosten (middelenbeslag)
Esketamine (10 ml van de 25 mg/ml oplossing) kost momenteel 81 euro. Het is echter onbekend of deze momenteel op de Nederlandse markt beschikbare oplossing (25 mg/ml) voldoende analgetisch en sederend effect heeft bij intranasale toediening. De hooggeconcentreerde esketamine oplossingen voor intranasale spray toediening voor therapie resistente depressie bij volwassenen (Spravato: 14 mg esketamine per puff) kost 200 euro per doseer eenheid van 28 mg.
Het toedienen van intranasale medicatie an sich bij kinderen is een standaard behandeling. In het geval van esketamine intranasaal worden eisen gesteld aan de begeleider conform voorwaarden voor begeleiding naar gelang de beoogde sedatie diepte en kans op adverse events. Behalve monitor apparatuur die op elke faciliteit waar PSA bij kinderen wordt verzorgd beschikbaar is een disposable atomiser voor verstuiving van de medicatie oplossing in de neus vereist, tenzij gebruik wordt gemaakt van de kant en klare Spravato verstuiver.
Echter, er is meer bewijs van effectiviteit en positieve beoordeling door patiënt en ouder nodig alvorens deze techniek structureel zal worden geaccepteerd.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen impact te verwachten op gezondheidsgelijkheid en de toegang tot deze interventie, ook niet voor subgroepen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er zijn aanwijzingen in de literatuur dat toepassing van esketamine intranasaal zinvol kan zijn voor PSA bij “matig pijnlijke” procedures bij kinderen. De literatuur is echter zeer summier. Studies die het effect van esketamine met midazolam of dexmedetomidine intranasaal vergelijken voor infuus plaatsing of lokale infiltratie voor aansluitend tandheelkundige zorg tonen geen klinisch relevante verschillen aan. Een retrospectieve observationele studie beschrijft het succesvol gebruik voor wondzorg en orthopedische procedures op de SEH. Patiëntgerapporteerde ervaringen (o.a. wat betreft comfort tijdens en na de procedure) ontbreken daarbij volledig. In de Nederlandse situatie is geen preparaat beschikbaar dat eenvoudig is toe te dienen en betrouwbaar en voorspelbaar het gewenste sedatie en analgesie niveau veroorzaakt. In bepaalde gevallen zou misschien het wel in Nederland beschikbare Spravato preparaat hier in kunnen voorzien.
Er zijn geen studies die intranasale esketamine met lachgassedatie vergelijken. Het bereiken van diepe sedatie tijdens een procedure is niet mogelijk bij gebruik van de bestudeerde concentraties en doseringen. Dit maakt dat intranasale esketamine waarschijnlijk geen geschikte techniek is voor bijzonder angstige patiënten.
Onderbouwing
Achtergrond
Voor het uitvoeren van PSA voor een kortdurende pijnlijke procedure bij kinderen bestaan verschillende medicamenteuze strategieën. Als geen infuus beschikbaar is zijn de mogelijkheden beperkt. Esketamine kan ook nasaal worden toegediend. De vraag is wat de kwaliteit is van PSA met nasale toediening van esketamine.
Conclusies / Summary of Findings
1. Efficacy (critical outcome measure for decision making)
1.1 Intranasal ketamine versus (intranasal) midazolam
|
Very low GRADE |
The evidence is very uncertain about the effect of administration of intranasal ketamine on efficacy when compared with (intranasal) midazolam in children between 0 to 18 years of age undergoing minor painful procedures. Sources: Poonai (2017) (Abrams, 1993; Bahetwar, 2011; Surendar, 2014); Jafarnejad (2020); Mehran (2017). |
1.2 Intranasal ketamine versus dexmedetomidine
|
Low GRADE |
The efficacy of PSA with intranasal ketamine may be inferior to the efficacy of sedation with intranasal dexmedetomidine in children between 0 to 18 years of age undergoing minor painful procedures. Sources: Poonai (2017) (Surendar (2014). |
2. Comfort (critical); 3. Safety (critical); 4. Patient satisfaction (important)
|
No GRADE |
Because of a lack of data in the included studies of this guideline, it was not possible to draw any conclusions regarding the outcomes comfort, safety, and patient satisfaction in children between 0 and 18 years of age undergoing painful procedures. Sources: - |
Samenvatting literatuur
Description of studies
Poonai (2017) performed a systematic review of randomized and quasi-randomized controlled trials comparing intranasal ketamine to any agent in children aged 0 to 19 years undergoing PSA. Medline, Embase, Web of Science, CINAHL Google Scholar; Cochrane Library were searched till August 2016. For unpublished trials, clinical trial registries, research registries, and industry research databases were searched. All published and unpublished randomized and quasi-randomized trials comparing IN racemic ketamine (alone or in combination) to any agent for children 0 to 19 years undergoing PSA that reported any sedation-related outcome including at least one of: duration, onset, depth, adequacy of sedation to facilitate the procedure, or adverse effects. The primary outcome was the effectiveness of sedation, defined as the proportion of participants whose level of sedation was adequate to facilitate the procedure based on the authors' judgment.
Seven studies were included in the systematic review. For the purpose of this guideline, three studies were included (Abrams, 1993; Bahetwar, 2011; Surendar, 2014). Four of these studies were excluded (Buensenso, 2014; Ghaiari, 2015; Pandey, 2011; Tsze, 2012) for the present literature analysis because the wrong comparison was investigated. The most relevant characteristics and a summary of the results of the underlying clinical trials are presented in Table 1.
Jafarnejad (2020) performed a randomized, parallel, open-labeled clinical trial that investigated the clinical efficacy of sedation and analgesic effects of intranasal ketamine and midazolam in obtaining peripheral intravenous access in children presenting to the emergency department. Jafarnejad (2020) included children over one to ten years of age presenting to the emergency department. Patients with level one triage, parental dissatisfaction, history of drug allergies, history of epilepsy, cystic fibrosis, cerebral palsy, severe underlying diseases, and maxillofacial abnormalities were excluded. No local anesthetic creme was applied. Patients were randomized in two equally distributed groups. The intervention group (n=35) was given 5 mg/kg intranasal racemic ketamine (50 mg/ml) twenty minutes before the procedure. The control group (n=35) followed the same regime but received 0.2 mg/kg intranasal midazolam. To administer the medications, children held their heads back in their parents' arms or sitting and under parental control. To reduce nasal runoff, half of the calculated dose of the medication was slowly poured in each nostril. The reported outcome in the study was efficacy.
Mehran (2017) performed a randomized, cross-over clinical trial that aimed to compare the effects of intranasal ketamine and midazolam on behavior of three- to six-year-old children during injection of local anesthetic and dental treatments. Children showing negative attitude according to Frankel’s category and uncooperative behavior confirmed by at least one dentist were included in the study. Children with upper airway infection or cognitive impairment were excluded. Patients were randomly assigned to receive one of the two drugs intranasally. They either received 0.2 mg/kg intranasal midazolam or 0.5 mg/kg intranasal racemic ketamine in the first treatment session. In the second treatment session, scheduled with a window period of at least one week, the drugs were switched. The reported outcome in the study was efficacy.
Results
1. Efficacy (critical outcome measure for decision making)
1.1 Intranasal ketamine versus (intranasal) midazolam
The efficacy of sedation using intranasal ketamine versus (intranasal) midazolam was reported in three studies retrieved from the systematic review of Poonai (2017) (Abrams, 1993; Bahetwar, 2011; Surendar, 2014) and in two additional randomized controlled trials (Jafarnejad, 2020; Mehran, 2017).
Abrams (1993) compared intranasal droplet administered ketamine to midazolam for local infiltration and dental care in patients aged 17-62 months. They defined efficacy of sedation as depth of sedation measured on a 10-item scale (where 1 is hysterical/untreatable; 5 is ideal sedation: well sedated an cooperative, 6: drowsy, easily aroused, and 10 obtunded and desaturated, requiring airway management assistance).
The median (IQR) score in the intranasal ketamine (3 mg/kg) group (10 patients) was 4 (3 to 6), compared to 4 (2 to 5) in the midazolam (0.4 mg/kg) group (10 patients). This was not considered as a clinically relevant difference. No patient in the ketamine group ended up being deeper sedated than: drowsy, easily aroused. Safety: 1 desaturation to 88 % (whereas > 90 % is considered normal at the altitude of the area where the study was conducted).
Bahetwar (2011) compared intranasal droplet administered ketamine (100 mg/ml solution) to intranasal midazolam (5 mg/ml solution) for dental treatment in children uncooperative for treatment after basic behaviour modification techniques. They defined efficacy of sedation as “successful treatment outcome’’. Sedation level was measured on a 1 to 5 sedation rating scale (where 1 is no sedation; 2 is minimal sedation; 3 is moderate sedation; 4 is deep sedation; and 5 general anesthesia). Adequate sedation level was defined as level 2 or 3. The number of patients with adequate sedation in the ketamine (6 mg/kg) group was 42/45 (93.3%), compared to 38/45 (84.4%) in the midazolam (0.3 mg/kg) group. This resulted in a relative risk ratio (RR) of 0.43 (95% CI 0.12 to 1.55), in favor of the intranasal ketamine (6 mg/kg) group. This was considered as a clinically relevant difference.
Response to treatment was scored on a 1 to 5 rating scale (1 excellent cooperation; 5 resistance and crying, no treatment possible).
Treatment outcome was considered successful if:
-
Response to treatment score of 4 or 5 (satisfactory) and sedation score of 2-3 (adequate)
-
Physiologic parameters remained within 10% of baseline
-
No oxygen desaturation below 90%
-
No physical restraints during the dental procedure
-
No major side effects during or after the sedation sessions.
The number of patients with successful treatment outcome in the ketamine group was 40/42 (89%), compared to 31/38 (69%). This resulted in a risk ratio (RR) of 1.17 (95% CI 0.99 to 1.38) in favor of the ketamine group. This was considered not to be a clinically relevant difference.
Time to onset after ketamine (5.8 (SD 1.8) minutes) was comparable to midazolam (6.8 (SD 1.5) minutes). Recovery time after ketamine (40.0 (SD 3.4) minutes) was longer than after midazolam (31.7 (SD 3.4) minutes) (p< 0.001).
Surendar (2014) compared intranasal droplet administered ketamine (50 mg/ml solution) 5 mg/kg to midazolam 0. 2 mg/kg and dexmedetomidine 1 or 1.5 µg/kg all administered intranasally followed by a nerve block with lidocaine to perform dental care in 4-14 years old fearful or anxious children, unresponsive to basic behavior guidance techniques. Overall sedation level was measured on a 5-item scale (1: no effect, 2: minimal sedation, 3: moderate sedation, 4: deep sedation, 5: general anesthesia). A sedation level of 2 to 3 was considered adequate.
Response to treatment was scored on a 5 – item scale (ease of treatment completion score: 1: prohibitive: no treatment possible; 2: struggling interfering with procedure; 3: crying with minimal disruption to treatment; 4: mild objections without need to interrupt treatment; 5: quiet and cooperative).
A sedation procedure was considered successful if:
-
Physiological parameters remained within 10 % of baseline
Oxygen saturation > 90 % -
Level of sedation adequate (score 2 or 3)
-
Overall behavior was satisfactory (ease of treatment completion score 4 or 5)
-
Use of restraint for dental treatment not required
-
Absence of any adverse event during sedation treatment
Parents were asked to fill in a form on adverse events during the first 24 hours.
The number of patients with adequate sedation level in the ketamine group was 16/21 (76 %), compared to 15/21 (71%) in the midazolam group.
The number of patients with a successful sedation procedure in the intranasal ketamine (5 mg/kg) group was 14/21 (66.7%), compared to 13/21 (61.9%) in the intranasal midazolam (0.2 mg/kg) group. This resulted in a risk ratio of 0.88 (95% CI 0.39 to 1.98), in favor of the intranasal ketamine (5 mg/kg) group. This was not considered a clinically relevant difference.
Jafarnejad (2020) reported the success rate of the procedure. A successful procedure was defined as obtaining an IV line without the use of restraints and with minimal distress (score < 5 on the Observational Scale of Behavioral Distress-Revised).
The number of patients with a successful sedation procedure in the intranasal ketamine (5 mg/kg) group was 29/35 (82.9%), compared to 30/35 (85.7%) in the intranasal midazolam (0.2 mg/kg) group. This resulted in a relative risk ratio (RR) of 1.20 (95% CI 0.40 to 3.57), in favor of the intranasal midazolam (0.2 mg/kg) group. This was not considered as a clinically relevant difference.
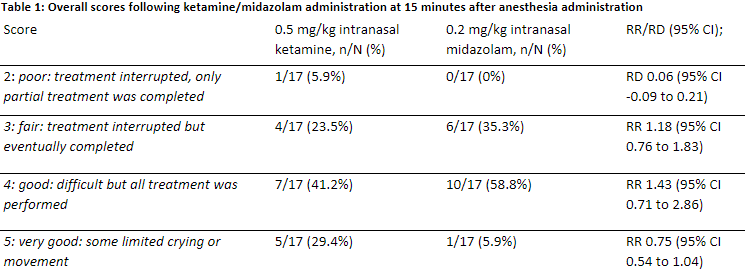
Mehran (2017) compared ketamine 0.5 mg/kg to midazolam 0.2 mg/kg for local anesthesia injection and dental treatment in uncooperative patients. The administration technique (droplets or atomization) is not mentioned. They measured behaviour and sedation level (Houpt score for the assessment of sedation) at several time points. The results are depicted in table 1:
Patients receiving intranasal ketamine showed less movement and cried less during administration compared to intranasal midazolam. When local anesthesia was injected (10 minutes after administration of the intranasal medication), in the midazolam group 64% of patient was awake whereas no patients in the ketamine group were awake at that time point. During the dental treatment there was no difference in wakefulness between groups.
1.2 Intranasal ketamine versus dexmedetomidine
The efficacy of sedation for intranasal ketamine versus dexmedetomidine was reported in one study retrieved from the systematic review of Poonai (2017) (Surendar, 2014). The number of patients with adequate sedation level (score 2-3) in the ketamine group was 16 (76 %), compared to 19 (90.5%) in the dexmedetomidine 1 µg/kg group. This resulted in a risk ratio of 0.84 (95% CI 0.64 to 1.11), which was not considered to be a clinically relevant difference.
Surendar (2014) reported the distribution of the overall success rate of sedation on a 5-item scale.
The number of patients with a successful sedation procedure in the intranasal ketamine (5 mg/kg) group was 14/21 (66.7%), compared to 18/21 (85.7%) in the intranasal dexmedetomidine (1 µg/ kg) group. This resulted in a relative risk ratio of 2.33 (95% CI 0.70 to 7.82), in favor of the intranasal dexmedetomidine (1 µg/ kg) group. This was considered as a clinically relevant difference.
Onset time after ketamine was 11.57 (+/- 2.2) minutes compared to 18 (+/-2.2) minutes after dexmedetomidine. Recovery (time to Aldrete score 9 meaning ready for discharge home) after ketamine was 44.2 (+/- 5.2) minutes compared to 59.8 (+/- 5.8) minutes. Both differences are statistically significant. (p < 0.001)
2. Comfort (critical outcome measure for decision making)
None of the included studies in this guideline reported a clearly defined outcome parameter for comfort in children between the age of 0 to 18 years undergoing a painful procedure with deep sedation.
Surendar (2014) reported an increased intraoperative and postoperative pain score (as measured by FLACC scale) in the midazolam group compared to the ketamine or dexmedetomidine groups.
Surendar (2014) also reported the proportions (satisfactory/unsatisfactory) of the satisfactory behavior score .
The satisfactory behavior in the intranasal ketamine (5 mg/kg) group was 16/21 (76.2%), compared to 15/21 (71.4%) in the intranasal midazolam (0.2 mg/kg) group. This resulted in a relative risk ratio of 0.83 (95% CI 0.30 to 2.31), in favor of the intranasal ketamine (5 mg/kg) group. This was not considered as a clinically relevant difference.
Surendar (2014) also reported the proportions (satisfactory/unsatisfactory) of overall sedations measured on a 5-item scale .
The satisfactory behavior in the intranasal ketamine (5 mg/kg) group was 16/21 (76.2%), compared to 18/21 (85.7 %) in the intranasal dexmedetomidine (1 µg/ kg) group. This resulted in a relative risk ratio of (95% CI to ), in favor of the intranasal dexmedetomidine (1 µg/ kg) group. This was considered as a clinically relevant difference. Vomiting occurred once in the ketamine and once in a dexmedetomidine group.
Mehar (2017) reported nasal discomfort in 38 % and vomiting in 35% of all patients.
3. Safety (critical outcome measure for decision making)
None of the included studies in this guideline reported clearly defined safety outcomes in children between the age of 0 to 18 years undergoing a painful procedure with sedation.
Abrams reported an oxygen desaturation to below 90 % in 2/10 patients in a study conducted at an altitude where 90 % is considered the lower limit of normal oxygen saturation.
Bahetwar reported that all oxygen saturation values remained above 90% and no clinically relevant hemodynamic changes occurred.
Surendar reported that no clinically relevant respiratory or circulatory incidents occurred.
Jafarnejad reported that no respiratory or circulatory problems nor excessive sedation occurred in their study.
Mehar reported that no respiratory or circulatory problems occurred in their study.
4. Patient satisfaction (important outcome measure for decision making)
None of the included studies on intranasal ketamine for painful procedures in this guideline reported on patient satisfaction after the procedure.
Level of evidence of the literature
1. Efficacy (critical outcome measure for decision making)
1.1 Intranasal ketamine versus (intranasal) midazolam - The level of evidence regarding the outcome efficacy of sedation comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by three levels because of unclear allocation of concealment in the studies (risk of bias, -1), heterogeneity in the study results (inconsistency, -1), and the wide confidence intervals crossing the boundaries of clinical relevance (imprecision, -1). The level of evidence is very low.
1.2 Intranasal ketamine versus dexmedetomidine - The level of evidence regarding the outcome efficacy of sedation comes from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of unclear allocation of concealment in the studies (risk of bias, -1) and the wide confidence intervals crossing the boundaries of clinical relevance (imprecision, -1). The level of evidence is low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favourable effects of sedation with intranasal ketamine compared to sedation with nitrous oxide inhalation / nasal midazolam / nasal dexmedetomidine in painful procedures in children?
| P: | Children 0-18 years old undergoing a painful procedure with sedation |
| I: | Intranasal ketamine |
| C: | Nitrous oxide inhalation/midazolam nasal/dexmedetomidine nasal |
| O: | Efficacy, comfort measured with a scale, safety, patient satisfaction. |
Relevant outcome measures
The guideline development group considered efficacy, comfort and safety as critical outcomes for decision making. The outcome patient satisfaction was considered as an important outcome for decision making.
A priori, the working group did not define the outcomes listed above but used the definitions used in the studies.
The working group defined a threshold of 10% for continuous outcomes and a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until (search date). The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 96 hits. Studies were selected based on the following criteria: systematic reviews, randomized controlled trials and observational studies regarding the place of intranasal ketamine for procedural sedation and analgesia in painful procedures in children. Six studies were initially selected based on title and abstract screening. After reading the full text, three studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Guthrie AM, Baum RA, Carter C, Dugan A, Jones L, Tackett T, Bailey AM. Use of Intranasal ketamine in Pediatric Patients in the Emergency Department. Pediatr Emer Care 2021;37: e1001e1007
- Gyanesh P,Haldar R, Srivastava D, Agrawal PM, Tiwari AK, Singh PK. Comparison between intranasal dexmedetomidine and intranasal ketamine as premedication for procedural sedation in children undergoing MRI: a double-blind, randomized, placebo-controlled trial. J Anesth (2014) 28:1218
- Oliveira LJ, Da Silva M, Lee JY, Bellolio F, Homme JL, Anderson JL. Intranasal ketamine for acute pain management in children: A systematic review and meta-analysis. American Journal of Emergency Medicine 38 (2020) 18601866
- Peltoniemi MA, Hagelberg NM, Olkkola KT, Saari TI. Ketamine: A Review of Clinical Pharmacokinetics and Pharmacodynamics in Anesthesia and Pain Therapy. Clin Pharmacokinet (2016) 55:10591077
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Poonai, 2017 |
SR (no meta-analysis) of (quasi) RCTs
Literature search up to August 2016)
A: Abrams, 1993 B: Bahetwar, 2011 C: Buensenso, 2014 D: Ghajari, 2015 E: Pandey, 2011 F: Surendar, 2014 G: Tsze, 2012
Study design: A: parallel RCT B: crossover RCT C: parallel RCT D: crossover RCT E: crossover RCT F: parallel RCT G: parallel RCT
Setting and Country: A: US, dental procedures B: India, dental procedures C: Italy, gastric aspirated D: Iran, dental procedures E: India, dental procedures F: India, dental procedures G: US, laceration repair
Source of funding and conflicts of interest: No funding
|
Inclusion criteria SR: published and unpublished randomized and quasi-randomized trials comparing IN ketamine (alone or in combination) to any agent for children 0 to 19 years undergoing PSA that reported any sedation-related outcome including at least one of: duration, onset, depth, adequacy of sedation to facilitate the procedure, or adverse effects. Studies of both adult and pediatric participants.
Exclusion criteria SR: sub-studies and secondary analyses of previously reported trials, studies of ketamine for psychiatric disorders, studies of IN ketamine for anesthetic premedication, and sub-dissociative dose ketamine
7 studies included in SR, 3 were excluded (C, D, E) due to wrong comparison
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: 30 patients, mean NR (range 17-62 months) B: 45 patients, 4.6 years C: 36 patients, 41.5 months D: 23 patients, mean NR (range 2-6 years) E: 34 patients, 4.4 years F: 84 patients, 7.3 years G: 12 patients, mean NR (range 1-7 years)
Sex: not reported
Groups comparable at baseline? Not reported |
A: IN Ketamine (3 mg/kg) B: IN Ketamine (6 mg/kg) F: IN Ketamine (5 mg/kg) G: IN Ketamine (9 mg/kg) |
A: IN Sufentanil (1 µg/kg and 1.5 µg/kg); IN Midazolam (0.4 mg/kg) B: IN Midazolam (0.3 mg/kg); IN Midazolam; (0.2 mg/kg) F: IN Midazolam (0.2 mg/kg); IN Dexmedetomidine (1 µg/ kg); IN Dexmedetomidine (1.5 µg/kg) G: IN Ketamine (6 mg/kg); IN Ketamine (3 mg/kg)
|
End-point of follow-up: not reported
A: XX days/months/years B: C: D: E: F: G: H: I: ….
For how many participants were no complete outcome data available? Not reported (intervention/control) A: B: C: D: E: F: G: H: I: ….
|
Outcome 1. Efficacy Defined as depth of sedation (10-item scale) A: IN ketamine mean 4 (range 3-6), midazolam 4 (range 2-5), high dose sufentanil 7 (range 2-9), low dose sufentanil 4 (range 3-5) (p = 0.18). Proportions adequately sedated not reported.
Defined as % with adequate sedation on 1-5 scale B: IN ketamine 93% (42/45) IN midazolam 84% (38/45);
Defined as overall “satisfactory” sedation (5-item scale) F: IN ketamine 76% (16/21) IN midazolam 71% (15/21) I desmedetomidine 91% (19/21) IN dexmedetomidine 95% (20/21); NS
Defined as “successful” procedure (5-item scale) F: IN ketamine 67% (14/21) IN midazolam 62% (13/21) I desmedetomidine 81% (17/21) IN dexmedetomidine 86% (18/21); NS
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Jafarnejad (2020) |
Type of study: Randomized, parallel, open-labeled clinical trial.
Setting and country: Emergency departments of Iran University of Medical Sciences.
Funding and conflicts of interest: No grants and no conflicts of interest. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: N=35 Control: N=35
Important prognostic factors: age ± SD: I: 5.22 (1.8) C: 5.11 (1.67) P=0.784
Sex: I: 27.1% M C: 22.9% M P=0.473
Groups comparable at baseline? Yes.
|
Describe intervention (treatment/procedure/test):
Intranasal ketamine (5 mg/kg), twenty minutes before the procedure.
|
Describe control (treatment/procedure/test):
Intranasal midazolam (0.2 mg/kg), twenty minutes before the procedure.
|
Length of follow-up: Not reported.
Loss-to-follow-up: None.
Incomplete outcome data: None.
|
Outcomes
Successful procedure defined as an Observational Score of behavioral Distress-Revised (OSBD-R) below five and no need for physical restraint, regardless of the score, mean (SD) I: 3.51 (1.33) C: 3.46 (0.94) P=0.852
Success rate of the procedure, n/N (%) I: 29/35 (82.9%) C: 30/35 (85.7%) P=0.743
Unsuccessful rate of the procedure, n/N (%) I: 6/35 (17.1%) C: 5/30 (14.3%)
|
Author’s conclusion:
There is no difference in the efficacy of IN ketamine and midazolam in sedation & analgesia before obtaining peripheral IV access in children. Both medications cause acceptable levels of sedation. There is no difference in the overall success rate between the two drugs. In addition, there is no difference between the two drugs regarding their effects on heart rate and oxygen saturation. Based on the result of our study, ketamine seems to be the ideal IN medication for sedation and analgesia before accessing IV line. The dose of 5mg/kg of ketamine seems to have a desirable effect for this purpose. Conducting large-scale studies in order to optimize the gold standard medication for intranasal sedation and analgesia in children in ED will be valuable.
|
|
Mehran (2017) |
Type of study: Cross-over, double-blind clinical trial.
Setting and country:
Funding and conflicts of interest: No information. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Study population: N=17
Important prognostic factors2: age ± SD: 4.5 (0.9) years
Sex: 9 males (52.9%), 8 females (47.1%)
Groups comparable at baseline? Not relevant > cross-over study.
|
Describe intervention (treatment/procedure/test):
0.5 mg/kg ketamine in the first treatment session.
|
Describe control (treatment/procedure/test):
0.2 mg/kg midazolam (scheduled with a window period of at least one week). |
Length of follow-up: Discharge
Loss-to-follow-up: None.
Incomplete outcome data: None.
|
Outcomes
Assessment of sedation defined by the scoring system of Houpt et al.: Overall scale 15 minutes after anesthesia administration
2: poor: treatment interrupted, only partial treatment was completed, n/N (%) I: 1/17 (5.9%) C: 0/17 (0%)
3: fair: treatment interrupted but eventually completed, n/N (%) I: 4/17 (23.5%) C: 6/17 (35.3%)
4: good: difficult but all treatment was performed, n/N (%) I: 7/17 (41.2%) C: 10/17 (58.8%)
5: very good: some limited crying or movement, n/N (%) I: 5/17 (29.4%) C: 1/17 (5.9%)
|
Author’s conclusion:
The results of the present study demonstrated that adequate sedation is induced by both midazolam and ketamine. Ketamine administration produced marginally higher levels of blood pressure and heart rate.
|
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Poonai (2017) |
Yes
Our objectives were to summarize the evidence evaluating IN ketamine versus any comparator for children who require PSA with respect to effectiveness of sedation and analgesia, ease of administration, and adverse effects
|
Yes
Ovid MEDLINE (January 1946 to August 2016); Ovid EMBASE (January 1980 to August 2016); Web of Science (August 2016); Scopus (2016); CINAHL (January 1981 to August 2016); Google Scholar (2016); Cochrane Library (August 2016). For unpublished trials, we searched clinical trial registries, research registries, and industry research databases. Key journals and conference proceedings were hand-searched from 2000 to 2016. We contacted authors for further information and checked reference lists of all included trials. The original search was completed in December 2015 and repeated in August 2016. There were no language restrictions.
|
Yes |
Yes |
Not applicable |
Yes
Outcome-specific ratings using the GRADE system were low or very low.. SOE assessments for risk of bias were downgraded primarily due to insufficient information on randomization, allocation concealment (selection bias), or blinding (performance and detection bias). SOE assessments for consistency were downgraded for all outcomes except analgesia. SOE assessments for directness were downgraded for all outcomes except analgesia due to the use of non-validated instruments. SOE assessments for precision were downgraded for all outcomes except adverse effects due to small sample sizes (n < 200).
|
Yes, however a meta-analysis was precluded due to excessive heterogeneity in outcome measures, study design, comparators, dosing, and indications for sedation.
|
Yes |
Yes
The authors have declared that no competing interests exist.
|
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Abrams (1993) |
Probably yes
Reason: “selected at random and in a double-blinded fashion was administered intranasally.”
|
No information
Reason: - |
Definitely yes
Reason: “Double-blinded fashion.” |
No information
Reason: - |
Definitely no
Reason: |
Definitely yes
Reason: no other biases reported. |
Some concerns
Reason: allocation concealment unclear and selective outcome reporting. |
|
Bahetwar (2011) |
Definitely yes
Reason: “A triple blind, randomized, prospective, 3 stage crossover design was adopted in this study. The drugs used were M (0.3mg/kg), K (6mg/kg) and MK (0.2mg/kg and 4mg/kg respectively). The patients were given all the three drugs/combination on three different visits in a crossover manner. It was a crossover trial hence all the patients received all three drugs. The order in which they were administered was generated using an online randomization generator.”
|
No information
Reason: - |
Definitely yes
Reason: “A triple blind, randomized, prospective, 3 stage crossover design was adopted in this study.” |
No information
Reason: - |
No information
Reason: |
Probably yes
Reason: no other biases reported. |
Some concerns
Reason: unclear allocation concealment |
|
Jafarnejad (2020) |
“The participants were randomly assigned to two groups.Simple randomization was carried out by using RRApp software.”
|
Definitely no
Reason: “Allocation concealment and blinding were not carried out.”
|
Definitely no
Reason: “Allocation concealment and blinding were not carried out.”
|
Definitely yes
Reason: No lost to follow-up reported. |
Probably yes
Reason: all predefined outcome measures were reported. |
Probably yes
Reason: no other biases reported. |
Some concerns
Reason: no allocation concealment and no blinding. |
|
Mehran (2017) |
“children were randomly assigned to receive one of the two drugs intranasally.”
|
No information
Reason: - |
Definitely yes
Reason: Double-blind study. |
Definitely yes
Reason: No lost to follow-up reported. |
Probably yes
Reason: all predefined outcome measures were reported. |
Probably yes
Reason: no other biases reported. |
Low |
|
Surendar (2014) |
Definitely yes
Reason: “The present study was randomized and kept triple blind in order to eliminate all kinds of bias.”
|
No information
Reason: - |
Definitely yes
Reason: Triple blinded study. |
No information
Reason: - |
Probably yes
Reason: all predefined outcome measures were reported. |
Definitely yes
Reason: “The present study was randomized and kept triple blind in order to eliminate all kinds of bias.”
|
Some concerns
Reason: allocation concealment unclear |
|
Tsze (2012) |
Definitely yes
Reason: “Patients were urn randomized by age category to receive 1 of 3 doses.” |
No information
Reason: - |
Definitely yes
Reason: Double blind study |
No information
Reason: |
No information
Reason: |
No information
Reason: |
Some concerns
Reason: no information for several items.
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bahetwar (2011) |
Included in SR of Poonai (2017) |
|
Jafarnejad (2020) |
Wrong C |
|
Mehran (2017) |
Wrong C |
|
Poonai (2020) |
Wrong study design |
|
Surendar (2014) |
Included in SR of Poonai (2017) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Intranasale esketamine |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.