Alpha-2 Agonisten voor Procedurele Sedatie
Uitgangsvraag
Wat zijn de (on)gunstige effecten van het gebruik van de Alfa-2- Agonisten Dexmedetomidine en Clonidine voor PS bij kinderen.
Aanbeveling
Gebruik van de alfa-2-agonisten bij voorkeur dexmedetomidine (intraveneus of intranasaal) omdat, in vergelijking met clonidine, meer evidence bestaat voor het gebruik en omdat de sederende werking (potentie) groter is. Orale clonidine kan een alternatieve optie zijn bij kinderen die geen intranasale medicatie verdragen of waarbij de dexmedetomidine dosis de maximale intranasale absorptiecapaciteit overschrijdt.
Gebruik intranasale of intraveneuze dexmedetomidine in de eerste plaats voor procedurele sedatie tijdens beeldvormend onderzoek waarbij een kind langdurig moet stilliggen (MRI, isotopen onderzoek). Dexmedetomidinesedatie is bij deze procedures een goed alternatief voor diepe sedatie met propofol of algehele anesthesie en een betere (veiliger en effectievere) vorm van sedatie dan het gebruik van chloralhydraat of een benzodiazepine.
Gebruik intranasale dexmedetomidine voor de volgende indicaties:
-
Procedurele sedatie bij elektrofysiologisch onderzoek (EEG, BERA) en niet-pijnlijke onderzoeken (vb. echografie)
-
Procedurele sedatie bij eenvoudige, mild-pijnlijke procedures (vb. technisch eenvoudige bloedafname, infuusplaatsing) mits ook optimale topicale/lokale pijnstilling is toegepast en de verrichting als geheel prikkelarm is.
-
Premedicatie voorafgaand aan een andere vorm van sedatie dan wel anesthesie (zie onder andere UV 6.3)
Gebruik bij voorkeur geen alfa-2 agonisten bij kinderen die een slaapgebonden ademhalingsprobleem hebben, die een gestoorde cardiale geleiding, bradycardie of hypotensie hebben of die medicatie gebruiken die de bloeddruk verlaagt of de hartrfequentie vertraagt.
Zorg bij het gebruik van alfa-2 agonisten altijd voor een prikkelarme omgeving (geluidsarm, gedimd licht, aangename temperatuur) zodat vermeden wordt dat een kind telkens weer wakker wordt.
Houd bij intranasale toediening rekening met het maximaal toedienbaar volume per neusgat en per gift (0,3 ml). Splits zo nodig de totale dosis in aparte giften (max 0,3 ml) mits het kind deze veelvuldige nasale toedieningen verdraagt.
Maak afspraken in de lokale sedatiecommissie over de vraag hoe om te gaan met escape sederende medicatie als dexmedetomidine IN/IV onvoldoende blijkt.
Overweeg bij intranasale toepassing van dexmedetomidine het gebruik van een pulsoximeter om zuurstofsaturatie en hartfrequentie te bewaken totdat het kind weer wakker is. Gebruik een pulsoximeter wel altijd wanneer het kind jonger is dan 1 jaar, wanneer het andere sederende medicatie heeft gekregen, wanneer de ASA-classificatie hoger is dan 2 of wanneer meer dan de gebruikelijke dosering (2-3 microgram/kg) wordt toegediend.
Bewaak bij intraveneuze toepassing van dexmedetomidine altijd de hartfrequentie, de ademhaling, de zuurstofsaturatie en bij voorkeur ook regelmatig de bloeddruk totdat het kind weer wakker is. Stel zo nodig de bloeddrukmeting uit wanneer deze zou kunnen interfereren met de kwaliteit van de sedatie (bijvoorbeeld ontwaken als gevolg van het drukgevoel veroorzaakt door de bloeddrukmeting). Overweeg het gebruik van capnografie indien de kwaliteit van luchtweg en ademhaling niet goed d.m.v. zintuigelijke observatie is te beoordelen (bijvoorbeeld tijdens MRI).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De bewijskracht van de literatuur ten aanzien van het gebruik van dexmedetomidine als mono-sedativum vergeleken met overige sedativa ongeacht de toedieningsvorm en -route bij (pijnlijke) procedures bij kinderen is ten aanzien van de cruciale uitkomstmaat effectiviteit matig tot redelijk te noemen. De onderliggende studies laten geen klinisch relevante verschillen zien op de onderdelen kwaliteit van sedatie, succesvolle sedatie, en tijdsefficiëntie. De kwaliteit van het bewijs is met één level afgewaardeerd vanwege de aanzienlijke heterogeniteit in controle-interventies. Met uitzondering van de systematic review door Fang et al. werden in de overige meta-analyses pijnlijke (vb. IV toegang, hechten snijwond, wondzorg) en niet-pijnlijke (vb. beeldvorming, BERA) procedures geclusterd waarbij niet steeds duidelijk was in welke mate ook sprake was van aanvullende pijnstilling. Ook werden uiteenlopende intranasale doseringen gebruikt, werd vergeleken met heel uiteenlopende sedativa (waaronder chloralhydraat, pentobarbital, midazolam en (es)ketamine) en werd slechts in enkele studies de niet-farmacologische omstandigheden geschetst waarin de dexmedetomidine sedatie plaatsvond. Al deze factoren hebben zeker een invloed op de uiteindelijke resultaten van de meta-analyses. Hierdoor zijn de conclusies van deze meta-analyses moeilijk precies te interpreteren en blijft hun betekenis voor de praktijk onzeker. De beschikbare literatuur duidt erop dat er waarschijnlijk weinig verschil is in de effectiviteit tussen dexmedetomidine en andere sedativa als geheel. Wanneer verder wordt gestratificeerd naar de controle-interventie blijkt dat in vergelijking met chloralhydraat, bij dexmedetomidine de inductie en recoverytijd korter zijn. Bij beeldvormend onderzoek is het succes van een dexmedetomidinesedatie hoger dan van een sedatie met midazolam, mits omstandigheden zo prikkelarm mogelijk zijn. Tijdens behandelingen die met meer prikkels gepaard gaan (vb tandheelkundige verrichtingen of verrichtingen waarbij het kind herhaaldelijk wordt aangeraakt/geprikkeld) geldt het omgekeerde: prikkels kunnen ervoor zorgen dat een kind dat gesedeerd is met dexmedetomidine snel ontwaakt.
Voor het beoordelen van de effectiviteit van dexmedetomidine in vergelijking met die van propofol in het kader van MRI-onderzoek is de bewijskracht van de gevonden meta-analyse (Fang et al. 2017) ten aanzien al met al slechts matig. Hoewel betrouwbare uitspraken mogelijk zijn ten aanzien van sedatie- en recovery tijden (beide langer bij gebruik van dexmedetomidine), laat de gevonden meta-analyse niet toe een uitspraak te doen over procedureel succes (i.e. succes van de MRI-procedure).
Ten aanzien van de belangrijke uitkomstmaat veiligheid was de bewijskracht redelijk, waarbij afgewaardeerd is voor imprecisie, die veroorzaakt werd door heterogeniteit in de controle-interventies. De beschikbare literatuur duidt erop dat er waarschijnlijk weinig verschil is in de veiligheid tussen dexmedetomidine en andere sedativa, met uitzondering dan van chloralhydraat dat in vergelijking met dexmedetomidine vaker gepaard gaat met bijwerkingen. Deze bevinding heeft waarschijnlijk veel te maken met het feit dat bij de in de literatuur gerapporteerde chloralhydraat sedaties slechts zelden de veiligheidsvoorwaarden van toepassing waren die wel standaard aanwezig zijn bij studies waarbij dexmedetomidine werd vergeleken met andere vormen van diepe sedaties (vb. propofol)
Ten aanzien van de belangrijke uitkomstmaat patiënttevredenheid was de bewijskracht laag, vanwege het kleine aantal patiënten en de inconsistentie in de resultaten en de vergelijkbaarheid van de interventies.
Overige evidence, niet afkomstig van RCT’s of meta-analyses:
-
Intraveneuze dexmedetomidine als mono-sedatie en in voldoende hoge dosissen heeft een effectiviteit van > 95% die vergelijkbaar is met die van Propofol bij kinderen die een MRI onderzoek moeten ondergaan (Mason, 2008)
-
Intranasale dexmedetomidine (in een dosis van 2-4 µg/kg) als mono-sedatie bij een MRI onderzoek blijkt in meerdere studies effectiever en veiliger te zijn dan chloral hydraat of midazolam. De gerapporteerde effectiviteit varieert van 65-95%, waarbij hogere dosissen van dexmedetomidine tot een hoger succespercentage leiden, zonder dat zich daarbij meer complicaties voordoen (Jackson, 2022; Olgun, 2018; Mason, 2010)
-
Intranasale dexmedetomidine doseringen voor procedurele sedatie in de literatuur variëren van 1-4 µg/kg. Het kinderformularium beveelt 2-3 µg/kg aan (met een totaal maximum van 200 µg). Daarbij wordt gebruik gemaakt van de IV-oplossing van 100 µg/ml die via een spuitje + Mucosal Atomization Device (MAD) intranasaal wordt toegediend. Belangrijk daarbij is om rekening te houden met het maximaal mucosaal absorbeerbaar volume. Dat volume ligt waarschijnlijk niet hoger dan 0,3 ml (dwz 30 µg) per neusgat. Overschrijden van deze hoeveelheid kan leiden tot ‘uitniezen’ dan wel inslikken van de vloeistof, in beide gevallen leidend tot een minder effectieve dosering. Veelvuldige intranasale toedieningen van adequate, kleine volumes (om aldus aan de totale dosis te komen) is dan aangewezen maar hierbij kan het aantal onaangename momenten voor een kind verhogen. Het is ook niet bekend of bij elke volgende toediening nog steeds sprake is van een effectieve absorptie. Het beschikbaar worden van een hoog geconcentreerde dexmedetomidine oplossing zou deze problemen kunnen verhelpen.
-
Over clonidine werd geen literatuur gevonden die aan de selectiecriteria voldeed. Orale clonidine werd wel in enkele RCT’s vergeleken met orale midazolam in het kader van premedicatie, voorafgaand aan algehele anesthesie. Een meta-analyse van Dahmani (Dahmani, 2010) toonde aan dat clonidine gepaard ging met een betere preoperatieve sedatie, minder postoperatieve onrust (‘emergence delier’) en betere postoperatieve pijncontrole. Echter, de setting van een premedicatie is wezenlijk anders dan die van een procedurele sedatie. Enkele observationele en vergelijkende studies doen vermoeden dat orale clonidine (in een dosering van meestal 4 µg/kg) een geschikt middel kan zijn voor procedurele sedatie van kinderen tijdens een EEG, zonder daarbij de kwaliteit van de registratie negatief te beïnvloeden. (Ashrafi, 2020; Mehta, 2004)
-
Het effect van dexmedetomidine op de kwaliteit van het EEG bij kinderen werd specifiek onderzocht door Mason, 2009. De conclusie was dat dexmedetomidine sedatie een EEG-patroon veroorzaakt dat vergelijkbaar is met dat van fase II slaap met enige toename in theta, alpha, en beta activiteit. Dexmedetomidine belemmerde de interpretatie van het EEG niet, wat suggereert dat het een uniek bruikbaar middel kan zijn voor EEG-sedatie bij kinderen.
-
Er bestaan aanwijzingen dat alfa-2 agonisten in het bijzonder geschikt kunnen zijn voor procedurele sedatie tijdens bepaalde procedures (vb. EEG, BERA, beeldvorming) bij kinderen met bijzondere neurologische aandoeningen (bijvoorbeeld autismespectrumstoornissen). (Keidan, 2015; Carlone, 2019; Lubisch, 2009; Luque, 2021; Sahyoun, 2023)
-
Alfa-2 agonisten in het algemeen, en dexmedetomidine in het bijzonder, hebben een grote therapeutische breedte, d.w.z. ook bij hoge doseringen blijken ze nog zeer veilig te zijn. Hoewel ze diepe slaap kunnen veroorzaken en een dosis-afhankelijke verlaging van de hartfrequentie en bloeddruk kunnen veroorzaken zijn de vitale risico’s beduidend lager dan bij vormen van diepe sedatie (vb. propofolsedatie). De kenmerken van dexmedetomidine laten daarom toe om sedatieprogramma’s (vb voor MRI onderzoek bij kinderen zonder onderliggende respiratoire of hemodynamische risicofactoren) toe te vertrouwen aan (gespecialiseerde) verpleegkundigen die specifiek voor deze vorm zijn opgeleid, zonder over alle bijzondere vaardigheden te beschikken die nodig zijn voor een matig-diepe sedatie.
-
Potentieel gevaarlijke respiratoire complicaties kunnen zich voordoen bij kinderen met slaapgebonden ademhalingsproblemen (vb. OSAS, apneu, hypoventilatie). Klinisch relevante vertraging van de hartfrequentie zou zich kunnen voordoen bij aangeboren dan wel verworven cardiale geleidingsstoornissen. (Mahmoud, 2017)
-
Het is onduidelijk wat de minimale noodzakelijke bewaking moet zijn tijdens een sedatie met alleen een alpha-2 agonist. Gezien de hemodynamische effecten wordt in het algemeen aangeraden hartfrequentie en bloeddruk te bewaken. Echter na toediening van orale clonidine (vb in het kader van premedicatie, of als behandeling voor hyperactiviteit) wordt meestal geen monitoring gerapporteerd. Tijdens intraveneuze sedatie met dexmedetomidine tijdens een (langdurig) beeldvormend onderzoek wordt doorgaans gebruik gemaakt van een oplaaddosis, gevolgd door een hoge continue dosering. In die situatie dienen minimaal ademhaling, zuurstofsaturatie en hartfrequentie te worden bewaakt. Herhaalde bloeddrukmeting kan aangewezen zijn bij kinderen met een verhoogd risico op hypotensie, maar kan ertoe leiden dat het kind telkens ontwaakt waardoor het onderzoek (bijvoorbeeld MRI) wordt bemoeilijkt. Na intranasale toediening kan overwogen worden om luchtweg en ademhaling alleen door middel van continue observatie te bewaken en alleen op indicatie gebruik te maken van technische monitoring (ademhaling, zuurstofsaturatie, hartfrequentie). Wanneer directe observatie niet goed mogelijk is, bijvoorbeeld tijdens een MRI-onderzoek is pulsoximetrie noodzakelijk en capnografie aanbevolen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Procedurele sedatie is slechts een onderdeel van een totaalbeleid gericht op procedureel comfort. Het is van groot belang voor patiënt en ouders dat zij een medische procedure op een comfortabele manier kunnen ondergaan. Dit betekent dat er alles aan wordt gedaan om angst, pijn en dwang te vermijden. Naast non-farmacologische technieken zijn er farmacologische interventies mogelijk waaronder procedurele sedatie. Procedurele sedatie op zich is evenwel geen garantie op procedureel comfort. De toegepaste sedatiestrategie moet echter niet meer stress veroorzaken voor, tijdens of na de sedatie.
Dexmedetomidine en clonidine kunnen geschikte medicijnen zijn om kinderen op een veilige en comfortabele manier door een lastige procedure heen te helpen, op voorwaarde dat in geval van een pijnlijke procedure ook effectieve procedurele analgesie wordt toegepast. Gezien het typische sedatie-profiel van alfa-2 mimetica (d.w.z. farmacologisch uitgelokte ‘natuurlijke’ slaap en de kans op ontwaken dan wel bewust meemaken van de procedure) zijn prikkelarme, kindvriendelijke omstandigheden van zeer groot belang voor een succesvolle sedatie.
De manier van toediening van dexmedetomidine (intranasaal of intraveneus) kan onaangenaam zijn en dit kan in individuele gevallen een reden zijn om van deze techniek af te zien. Bij intraveneuze toepassing moet een i.v.-toegang ook op een pijn- en angstvrije wijze worden ingebracht. Hoewel dexmedetomidine (in tegenstelling tot intranasale midazolam) niet pijnlijk is ter hoogte van de neusmucosa, vindt een aanzienlijk deel van de kinderen intranasale toediening onaangenaam.
Er zijn duidelijk aanwijzingen dat in geval van intranasale toediening in een bepaalde mate onvoldoende sedatie optreedt en er noodzaak is tot rescue medicatie, zoals bijvoorbeeld midazolam (De Rover 2023). In het geval van langdurig of complex MRI-onderzoek is het gebruik van intraveneuze dexmedetomidine minder voordelig vergeleken met propofol sedatie (Wu 2014).
Voor sommige MRI-onderzoeken bij kinderen kan een procedurele sedatie op basis van dexmedetomidine (IV of IN) een goed alternatief zijn voor een sedatie met propofol dan wel een vorm van anesthesie. Bovendien laat het hoge veiligheidsprofiel van dexmedetomidine toe om deze sedatie te laten superviseren door een specifiek in deze vorm van PSA getraind sedatie professional zonder de directe supervisie van een anesthesioloog of intensivist. Binnen de Nederlandse gezondheidszorg hebben enkele ziekenhuizen voor MRI-onderzoeken sedatieprogramma’s ontwikkeld waarbij een dexmedetomidinesedatie wordt verricht door een getraind verpleegkundig specialist. In het algemeen leidt dit tot een veilige en effectieve service en kan hiermee de wachttijd voor een MRI-onderzoek worden verkort.
Kosten (middelenbeslag)
Dexmedetomidine kost (in 2022) € 22,62 euro voor 200 microgram, wat neerkomt op € 0,113 per microgram. Een gemiddelde dosis voor een intranasale sedatie bedraagt 2-3 µg/kg, leidend tot een kost van ongeveer €0,23-0,34 per kg lichaamsgewicht.
Aanvaardbaarheid, haalbaarheid en implementatie
PSA door middel van intraveneuze of intranasale dexmedetomidine kan, mits voldaan wordt aan de juiste randvoorwaarden, bij kinderen die een MRI-onderzoek moeten ondergaan een veilig en effectief alternatief zijn voor diepe sedatie/anesthesie. Dexmedetomidine is zeker effectiever en veiliger dan een sedatie met chloralhydraat, een sedativum dat - gezien de mogelijke bijwerkingen - bij kinderen beter niet kan worden gebruikt in het kader van PSA. De farmacologische kenmerken van dexmedetomidine en in het bijzonder de hoge mate van (respiratoire) veiligheid laten toe om een kwaliteitsvol sedatie programma te ontwikkelen voor MRI-onderzoek bij kinderen zonder dat daarvoor de directe supervisie van een (kinder)anesthesioloog of intensivist noodzakelijk is. Het succes van een sedatie op basis van dexmedetomidine hangt vooral af van de mate waarin de omgeving en het proces prikkelarm en comfortgericht zijn, d.w.z. geluidsarm, gedimd licht, minimale manipulaties, aangename temperatuur en geduldige professionals. Indien aan deze voorwaarden niet is voldaan, bestaat er een grote kans op ontwaken, bewust meemaken van de procedurele gebeurtenissen en het falen van de sedatie/procedure.
Intranasale dexmedetomidine kan een effectieve en veilige vorm van sedatie zijn, voorafgaand aan een pijnlijke procedure mits er ook gebruik wordt gemaakt van effectieve procedurele analgesie en mits de procedure prikkelarm (geluidsarm, gedimd licht, weinig manipulaties, naar verwachting eenvoudige procedure) gebeurt. Indien beide voorwaarden niet zijn voldaan, dan bestaat een grote kans op ontwaken dan wel bewust meemaken van de procedurele gebeurtenissen.
De lange halfwaardetijd (hoewel kinderen meestal snel weer wekbaar zijn, slapen ze na afloop vaak nog meerdere uren) zorgt ervoor dat kinderen na afloop vaak nog lang bewaakt worden. Hoe lang de meest optimale recoverytijd is en hoe lang kinderen na afloop van een sedatie met alfa-2-agonisten moeten worden bewaakt is niet duidelijk (zie kennis lacune). De kans op respiratoire complicaties is hoe dan ook zeer laag en deze treden eigenlijk alleen op bij kinderen die al vooraf slaapgebonden ademhalingsproblemen hadden. In de Nederlandse centra waar PSA met dexmedetomidine wordt toegepast, wordt bij kinderen zonder bijkomende risicofactoren de monitor bewaking meestal gestaakt zodra ze volledig wekbaar zijn, ook als ze daarna toch weer in slaap vallen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Alfa-2 agonisten hebben een uniek sedatieprofiel dat zeer nuttig kan zijn voor bepaalde vormen van PSA. In het bijzonder voor MRI-onderzoek bij kinderen is dexmedetomidine een waardevol (en mogelijk laagdrempeliger) alternatief voor een diepe sedatie of anesthesie.
Onderbouwing
Achtergrond
Hoewel de alfa-2-agonisten Clonidine en Dexmedetomidine niet formeel zijn geregistreerd voor procedurele sedatie van kinderen, neemt hun gebruik voor deze indicatie wereldwijd sterk toe (Freriksen, 2022; Mahmoud, 2020).
Omdat dexmedetomidine in vergelijking met clonidine een veel selectievere α2 binding kent, wordt vooral dit middel toegepast voor procedurele sedatie van kinderen.
α2- agonisten veroorzaken sedatie, anxiolyse en sympaticolyse en hebben in beperkte mate een analgetica-sparend effect. Hun pijnstillend effect in het kader van medische procedures is verwaarloosbaar klein. In tegenstelling tot andere, meer traditionele sedatieve middelen zoals barbituraten, midazolam, chloralhydraat en propofol, wordt het gebruik van dexmedetomidine geassocieerd met een slechts minimale depressie van de ademhalingsfunctie en ademwegreflexen. Ten gevolge van de sympaticolytische effecten kunnen wel hypotensie en sinusbradycardie optreden, al zijn die klinisch zelden van belang. Verschillende dierstudies tonen aan dat dexmedetomidine neuroprotectief is, wat belangrijk is omdat de mogelijke neurotoxiciteit van sedativa op de jonge kinderleeftijd een belangrijk punt van zorg blijft.
Het sedatieprofiel van de α2-agonisten is duidelijk anders dan dat van de overige procedurele sedativa en wordt wel eens aangeduid als ‘het uitlokken van een diepe, natuurlijke slaap’. Hoewel kinderen vaak heel diep slapen, zijn ze toch meestal makkelijk te wekken (waarna ze dan doorgaans snel weer in slaap vallen). De diepe slaap door α2-agonisten is substantieel anders de diepe sedatie die andere middelen veroorzaken:
-
Tijdens deze diepe slaap komen luchtweg en ademhaling in principe niet in de problemen. Een handige vuistregel hierbij is dat ‘bij kinderen die tijdens hun eigen natuurlijke slaap geen slaap gerelateerde problemen van de luchtweg en/of ademhaling hebben, het zeer onwaarschijnlijk is dat ze die tijdens een sedatie met alfa-2 adrenerge agonisten wel zouden krijgen’.
-
Ondanks de diepe slaap kunnen patiënten toch makkelijk wekbaar zijn. Ook valt niet uit te sluiten dat ze informatie uit de omgeving binnenkrijgen en er een (eventueel stressvolle) betekenis aan geven. Dexmedetomidine en clonidine halen dan ook een hoge effectiviteit wanneer de sedatie in prikkelarme en comfort-gerichte omstandigheden gebeurt die vergelijkbaar zijn met wat nodig is om een spontaan slapend kind niet te wekken.
Clonidine en dexmedetomidine hebben een lange halfwaardetijd. Praktisch gevolg is dat kinderen na het eind van de procedure en afhankelijk van de totale dosis die ze hebben gekregen, nog lange tijd kunnen naslapen (gemiddeld 60-90 min). Vaak zijn ze daarbij wel al snel en volledig te wekken, maar vallen ze vervolgens weer in slaap. Hun vitale functies komen daarbij niet in het geding.
Van beide middelen kan alleen Clonidine oraal worden toegepast. De biologische beschikbaarheid van Dexmedetomidine is na orale ingestie te laag om een betrouwbare sedatie te veroorzaken. Dexmedetomidine wordt dan ook meestal intranasaal ofwel intraveneus toegepast. Voor deze toepassingen biedt het Kinderformularium sinds kort ook leeftijdsaangepaste doseringen.
Er bestaat op dit moment geen internationale consensus over hoe lang bij deze vorm van PSA een bewaakte recovery noodzakelijk is. In veel centra worden kinderen die verder geen risicofactoren hebben, ontslagen van bewaking zodra ze een keer goed wakker zijn geweest.
Conclusies / Summary of Findings
|
Moderate GRADE |
The use of intravenous dexmedetomidine as a sole sedative likely results in a longer recovery time and higher emergence delirium scores compared with the use of propofol in pediatric patients undergoing an MRI. Source: Fang, 2015 |
|
Moderate GRADE |
The use of dexmedetomidine as a sole sedative likely results in little to no difference in efficacy when compared with the use of chloral hydrate, pentobarbital or midazolam administered via any route in pediatric patients undergoing a medical procedure. Source: Fang, 2015; Kim, 2017; Lian, 2020; Lin, 2020; Tervonen, 2020; Al Taher, 2010 |
|
Moderate GRADE |
The use of intranasal dexmedetomidine as a sole sedative probably reduces the rate of adverse events when compared with the use of chloral hydrate, midazolam or pentobarbital in pediatric patients undergoing a medical procedure. Source: Lian, 2020; Lin, 2020 |
|
Low GRADE |
The use of intravenous dexmedetomidine as a sole sedative may result in little to no difference in satisfaction when compared with the use of Propopfol in patients undergoing MRI scanning Source: Fang, 2015 |
Samenvatting literatuur
Description of studies
Fang (2015) performed a systematic review to investigate the efficacy of Intravenous dexmedetomidine as a sedative for children undergoing MRI scanning compared with propofol. They performed a systematic literature search and included 5 randomised controlled trials in 337 patients aged <14 years.
Kim (2017) performed a systematic review to investigate the efficacy of intranasal dexmedetomidine as a sedative for children undergoing a medical procedure compared with a benzodiazepine (in general midazolam), opioids, ketamine or placebo administered via any route. They performed a systematic literature search and included 11 randomised controlled trials in 901 patients aged <12 years.
Lian (2020) performed a systematic review to investigate the efficacy of intranasal dexmedetomidine as a sedative compared with chloral hydrate for children undergoing a surgical or diagnostic procedure. They performed a systematic literature search and included 15 randomised controlled trials in 2128 pediatric patients. Two studies were not relevant to this guideline, because the intervention was intravenous dexmedetomidine.
Lin (2020) performed a systematic review to investigate the efficacy of dexmedetomidine as a sedative compared with other sedatives for children undergoing a medical procedure. They performed a systematic literature search and included 9 randomised controlled trials in 1076 pediatric patients.
Tervonen (2020) performed a systematic review to investigate the efficacy of intranasal dexmedetomidine as a sedative compared with other sedatives for children undergoing a minor medical procedure. They performed a systematic literature search and included 7 randomised controlled trials in 730 pediatric patients aged <14 years.
Several studies were included in multiple systematic reviews, but these were analysed only once in the results section of this guideline module.
Al Taher (2010) performed a randomised controlled trail comparing the efficacy of dexmedetomidine as a sedative with midazolam-propofol during dental procedures in children. They included 60 patients aged 4-10 years.
Results
The included studies reported on the outcomes effectiveness (measured as a scale, as success rate, a patient comfort scale, time of induction, duration of sedation and recovery time), and safety (measured as adverse effect rate). We pooled data on the outcome measures and report mean differences with 95% confidence intervals for continuous variables and risk ratios with 95% confidence intervals for dichotomous variables. We report forest plots with individual study data.
Efficacy
Sedation score
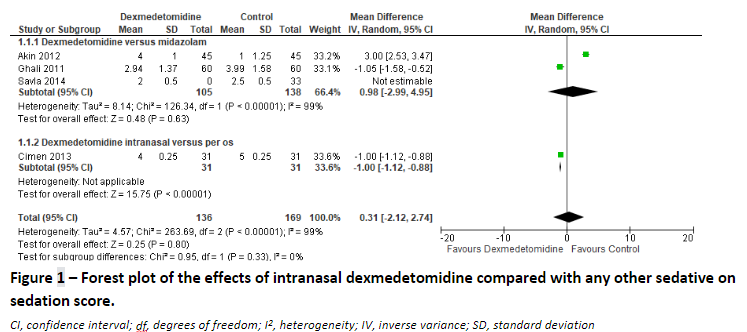
Kim (2017) reported the mean difference in sedation score in three underlying studies for the comparison dexmedetomidine versus midazolam (Akin, 2012; Ghali, 2011; Savla, 2014), and one study for the comparison dexmedetomidine versus dexmedetomidine per os (Cimen, 2013). We pooled the results over these studies to assess the effect of dexmedetomidine compared to any other sedative, and found a mean difference of 0.31 (95% CI: -2.12 to 2.74) in sedation score in favour of the control. (Figure 1)
Sedation success
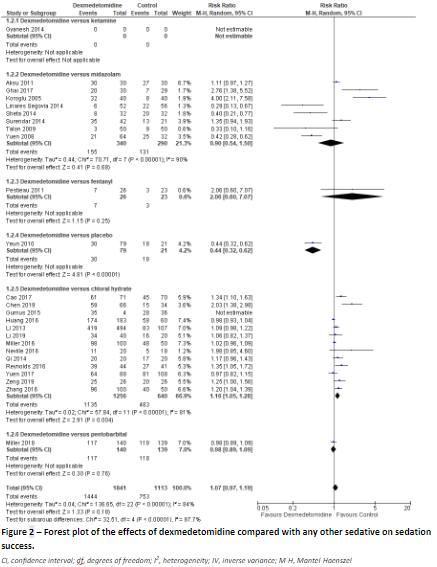
Four studies (Kim, 2017; Lian, 2020; Lin, 2020; Tervonen, 2020) reported on sedation success in 25 studies. We pooled the results over these studies to assess the effect of intranasal dexmedetomidine compared to any other sedative, and found a risk ratio of 1.07 (95% CI: 0.97 to 1.19) in favour of control. (Figure 2)
Recovery time
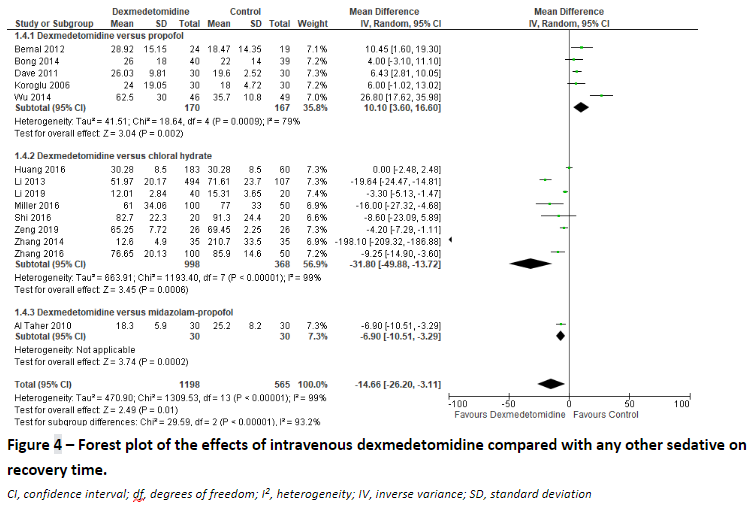
Three studies (Fang, 2015; Lian, 2020; Al Taher, 2010) reported on the recovery time over 12 underlying studies comparing intravenous dexmedetomidine with propofol (3 studies), chloral hydrate (8 studies) or midazolam-propofol (1 study). We pooled the results over these studies to assess the effect of intravenous dexmedetomidine compared to any other sedative, and found a mean difference of -14.66 minutes (95% CI: -26.20 to -3.11) favouring dexmedetomidine. (Figure 4)
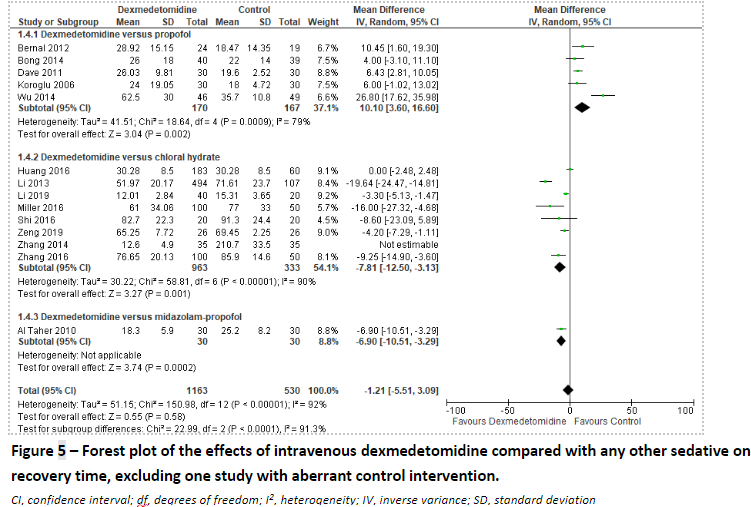
One study (Zhang, 2014) used rectal chloral hydrate as a control intervention, which may have led to the large difference in recovery time. Sensitivity analysis excluding the study of Zhang showed a mean difference of -1.21 minutes (95% CI: -5.51 to 3.09) favouring dexmedetomidine. (Figure 5)
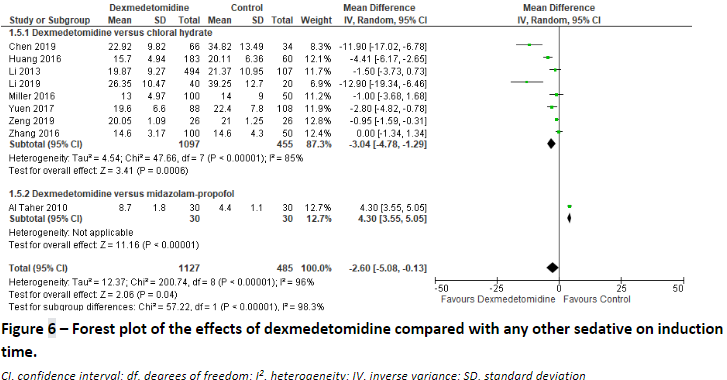
Induction time
Two studies (Lian, 2020; Al Taher, 2010) reported on the induction time over 8 underlying studies comparing dexmedetomidine with chloral hydrate and 1 study comparing dexmedetomidine with midazolam-propofol. We pooled the results over these studies to assess the effect of dexmedetomidine compared to other sedatives, and found a mean difference of -2.60 minutes (95% CI: -5.08 to -0.13) favouring dexmedetomidine. (Figure 6)
Patient comfort
One study (Fang, 2015) reported on Pediatric Anesthesia Emergence Delirium (PAED) score over 2 underlying studies comparing intravenous dexmedetomidine with propofol. Bong (2014) reported a mean difference in PAED score of 1.96 points (95% CI -0.26 to 4.18) in favour of propofol, and Wu (2014) reported a mean difference of 2.70 (95% CI 0.89 to 4.51) in favour off propofol.
Safety
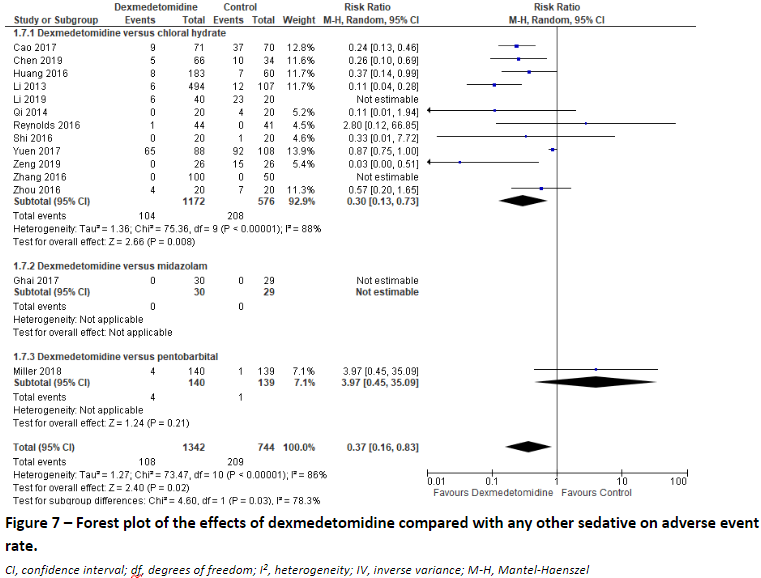
Adverse effects
Two studies (Lian, 2020; Lin, 2020) reported on adverse effects over 14 underlying studies comparing dexmedetomidine with chloral hydrate (12 studies), with midazolam (1 study), or with pentobarbital (1 study). We pooled the results over these studies to assess the effect of dexmedetomidine compared to any other sedative, and found a risk ratio of 0.37 (95% CI: 0.16 to 0.83) favouring dexmedetomidine. (Figure 7)
Level of evidence of the literature
Efficacy
The level of evidence regarding the outcome measure efficacy started as High (systematic reviews of randomised controlled trials, and was downgraded by one level to Moderate because of indirectness (bias due to the inclusion of heterogeneity in the control intervention).
Safety
The level of evidence regarding the outcome measure safety started as High (systematic reviews of randomised controlled trials, and was downgraded by one level to Moderate because of imprecision (95% confidence interval crossing the border of clinical relevance).
Satisfaction
The level of evidence regarding the outcome measure satisfaction was downgraded by two levels to Low because of conflicting results (inconsistency), and the number of included patients (imprecision).
Undesirable outcomes
The level of evidence regarding the outcome measure undesirable outcomes was not graded due to the absence of studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the beneficial and harmful effects of a procedural sedation with alfa-2 agonists in children.
| P: | children aged 0-18 who are sedated |
| I: | alfa-2-agonists dexmedetomidine and clonidine |
| C: | other forms of procedural sedation (PS) |
| O: | efficacy (procedural succes, comfort, time efficiency, satisfaction), safety (physical and psychological, short and long term), unwanted need for fixation and/or restraint |
Relevant outcome measures
The guideline development group considered efficacy as a critical outcome measure for decision making; and safety, satisfaction, and undesirable outcomes as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
For all outcome measures, the working group used the default thresholds proposed by the international GRADE working group to define minimally clinically (patient) important differences: a 25% difference in relative risk (RR) for dichotomous outcomes, and 0.5 standard deviations (SD) for continuous outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until January 12, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 674 hits. Studies were selected based on the following criteria: randomized trials comparing intranasal dexmedetomidine with any other sedative in children. 15 studies were initially selected based on title and abstract screening. After reading the full text, 10 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 5 studies, all being systematic reviews, were included.
Results
5 studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abulebda,K.;Louer,R.;Lutfi,R.;Ahmed,S.S.AComparisonofSafetyandEfficacyofDexmedetomidine and Propofol in Children with Autism and Autism Spectrum Disorders Undergoing Magnetic Resonance Imaging. J. Autism Dev. Disord. 2018, 48, 31273132.
- Ashrafi MR, Mohebbi H, Mohamadi M, Azizi E, Zamani GR, Tavasoli A, Badv RS, Hosseini F. Clonidine Versus Chloral Hydrate for Recording Sleep EEG in Children. Iran J Child Neurol. 2020 Winter;14(1):85-92. PMID: 32021632; PMCID: PMC6956965.
- Carlone G, Trombetta A, Amoroso S, Poropat F, Barbi E, Cozzi G. Intramuscular Dexmedetomidine, a Feasible Option for Children With Autism Spectrum Disorders Needing Urgent Procedural Sedation. Pediatr Emerg Care. 2019 Jun;35(6):e116-e117. doi: 10.1097/PEC.0000000000001776. PMID: 31157751.
- Dahmani S, Brasher C, Stany I, Golmard J, Skhiri A, Bruneau B, Nivoche Y, Constant I, Murat I. Premedication with clonidine is superior to benzodiazepines. A meta analysis of published studies. Acta Anaesthesiol Scand. 2010 Apr;54(4):397-402. doi: 10.1111/j.1399-6576.2009.02207.x. Epub 2010 Jan 18. PMID: 20085541.
- Freriksen JJM, van der Zanden TM, Holsappel IGA, Molenbuur B, de Wildt SN. Best Evidence-Based Dosing Recommendations for Dexmedetomidine for Premedication and Procedural Sedation in Pediatrics: Outcome of a Risk-Benefit Analysis By the Dutch Pediatric Formulary. Paediatr Drugs. 2022 May;24(3):247-257. doi: 10.1007/s40272-022-00498-y. Epub 2022 Mar 28. PMID: 35344192; PMCID: PMC9068679.
- Jackson TJ, Dawes D, Ahmad S, Martin D, Gyamtso C. Dexmedetomidine improves success of paediatric MRI sedation. Arch Dis Child. 2022 Jul;107(7):692-694. doi: 10.1136/archdischild-2021-322734. Epub 2022 Feb 21. PMID: 35190381.
- Keidan I, Ben-Menachem E, Tzadok M, Ben-Zeev B, Berkenstadt H. Electroencephalography for children with autistic spectrum disorder: a sedation protocol. Paediatr Anaesth. 2015 Feb;25(2):200-5. doi: 10.1111/pan.12510. Epub 2014 Aug 22. PMID: 25145661.
- Li,B.L.;Yuen,V.M.;Zhang,N.;Zhang,H.H.;Huang,J.X.;Yang,S.Y.;Miller,J.W.;Song,X.R.AComparison of Intranasal Dexmedetomidine and Dexmedetomidine Plus Buccal Midazolam for Non-painful Procedural Sedation in Children with Autism. J. Autism Dev. Disord. 2019, 49, 37983806.
- Lubisch N, Roskos R, Berkenbosch JW. Dexmedetomidine for procedural sedation in children with autism and other behavior disorders. Pediatr Neurol. 2009 Aug;41(2):88-94. doi: 10.1016/j.pediatrneurol.2009.02.006. PMID: 19589455.
- Luque CG, Atkins-Labelle C, Pauwels J, Costello R, Kozak FK, Chadha NK. Intranasal Dexmedetomidine increases the successful sedation of children with autism for out-patient auditory brainstem response hearing tests. Int J Pediatr Otorhinolaryngol. 2021 Dec;151:110945. doi: 10.1016/j.ijporl.2021.110945. Epub 2021 Oct 19. PMID: 34736008.
- Mahmoud M, Ishman SL, McConnell K, Fleck R, Shott S, Mylavarapu G, Gutmark E, Zou Y, Szczesniak R, Amin RS. Upper Airway Reflexes are Preserved During Dexmedetomidine Sedation in Children With Down Syndrome and Obstructive Sleep Apnea. J Clin Sleep Med. 2017 May 15;13(5):721-727. doi: 10.5664/jcsm.6592. PMID: 28356179; PMCID: PMC5406956.
- Mahmoud M, Barbi E, Mason KP. Dexmedetomidine: What's New for Pediatrics? A Narrative Review. J Clin Med. 2020 Aug 24;9(9):2724. doi: 10.3390/jcm9092724. PMID: 32846947; PMCID: PMC7565844.
- Mason KP, Zurakowski D, Zgleszewski SE, Robson CD, Carrier M, Hickey PR, Dinardo JA. High dose dexmedetomidine as the sole sedative for pediatric MRI. Paediatr Anaesth. 2008 May;18(5):403-11. doi: 10.1111/j.1460-9592.2008.02468.x. Epub 2008 Mar 18. PMID: 18363626.
- Mason KP, O'Mahony E, Zurakowski D, Libenson MH. Effects of dexmedetomidine sedation on the EEG in children. Paediatr Anaesth. 2009 Dec;19(12):1175-83. doi: 10.1111/j.1460-9592.2009.03160.x. PMID: 20017865.
- Mason KP. Sedation trends in the 21st century: the transition to dexmedetomidine for radiological imaging studies. Paediatr Anaesth. 2010 Mar;20(3):265-72. doi: 10.1111/j.1460-9592.2009.03224.x. Epub 2009 Dec 10. PMID: 20015137.
- Mason, K.P.; Lubisch, N.; Robinson, F.; Roskos, R.; Epstein, M.A. Intramuscular dexmedetomidine: An effective route of sedation preserves background activity for pediatric electroencephalograms. J. Pediatr. 2012, 161, 927932.
- Mehta UC, Patel I, Castello FV. EEG sedation for children with autism. J Dev Behav Pediatr. 2004 Apr;25(2):102-4. doi: 10.1097/00004703-200404000-00005. PMID: 15083132.
- Olgun G, Ali MH. Use of Intranasal Dexmedetomidine as a Solo Sedative for MRI of Infants. Hosp Pediatr. 2018 Jan 23:hpeds.2017-0120. doi: 10.1542/hpeds.2017-0120. Epub ahead of print. PMID: 29363517.
- de Rover I, Wylleman J, Dogger JJ, Bramer WM, Hoeks SE, de Graaff JC. Needle-free pharmacological sedation techniques in paediatric patients for imaging procedures: a systematic review and meta-analysis. Br J Anaesth. 2023 Jan;130(1):51-73. doi: 10.1016/j.bja.2022.09.007. Epub 2022 Oct 22. PMID: 36283870.
- Sahyoun C, Krauss B, Bevacqua M, Antonsen A, Jardinier L, Barbi E. Safety and Efficacy Associated With a Family-Centered Procedural Sedation Protocol for Children With Autism Spectrum Disorder or Developmental Delay. JAMA Netw Open. 2023 May 1;6(5):e2315974. doi: 10.1001/jamanetworkopen.2023.15974. PMID: 37252743; PMCID: PMC10230313.
- Stuker, E.W.; Eskander, J.P.; Gennuso, S.A. Third times a charm: Oral midazolam vs intranasal dexmedetomidine for preoperative anxiolysis in an autistic pediatric patient. Paediatr. Anaesth. 2018, 28, 370371.
- Wu J, Mahmoud M, Schmitt M, Hossain M, Kurth D. Comparison of propofol and dexmedetomedine techniques in children undergoing magnetic resonance imaging. Paediatr Anaesth. 2014 Aug;24(8):813-8. doi: 10.1111/pan.12408. Epub 2014 May 12. PMID: 24814202.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the beneficial and harmful effects of combinations of procedural sedation and procedural analgesia (PS and PA)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Fang, 2015
individual study characteristics deduced from Fang, 2015
|
SR and meta-analysis of RCTs
Literature search up to April, 2015
A: Bernal, 2012 B: Bong, 2014 C: Dave, 2011 D: Koroglu, 2006 E: Wu, 2014.
Study design: RCT
Setting and Country: A: MRI, USA B: MRI, Singapore C: MRI, India D: wrong intervention, wrong intervention E: MRI, USA
Source of funding and conflicts of interest: A: None reported B: None reported C: None reported D: E: None reported |
Inclusion criteria SR: patients’ age <18y, scheduled for MRI under general anaesthesia; studies comparing dexmedetomidine with propofol; outcomes including recovery time, sedation time, The Pediatric Anesthesia Emergence Delirium (PAED) scores, hypotension, bradycardia, hyper- tension and/or other effects
Exclusion criteria SR: combination therapies, included patients with with developmental delay, cognitive impairment, behavioral or psychological disorders, severe central nervous system diseases including brain tumors or uncontrolled seizures, children who had received more than three general anesthetics previously, and children who required sedative premedication, and studies that reported no quantitative results.
5 studies included
Important patient characteristics at baseline:
N, mean age A: 43; range: 2m-14y (not reported) B: 79; range: 2-7y (not reported) C: 60; range: 1-7y (not reported) D: ; () E: 95; range: 1-7y (not reported)
Sex: A: I: not reported%; C: not reported% B: I: not reported%; C: not reported% C: I: not reported%; C: not reported% D: I: %; C: % E: I: not reported%; C: not reported%
Groups comparable at baseline? A: not reported B: not reported C: not reported D: E: not reported |
Describe intervention:
A: Continuous infusion, mean dose 1.8 μg/kg/h B: single intravenous dose of dexmedetomidine 0.3 μg/kg C: 1 μg/kg dexmedetomidine initial dose followed by continuous infusion of 0.5 μg/kg/h D: E: 2 μg/kg dexmedetomidine initial dose followed by continuous infusion of 2 μg/kg/h |
Describe control:
A: propofol continuous infusion, mean dose 97.9 μg/kg/min B: single intravenous dose of propofol 1 mg/kg C: 3 mg/kg initial dose propofol followed by continuous infusion of 100 μg/kg/min propofol D: E: 2 mg/kg initial dose propofol followed by continuous infusion of 200 μg/kg/h propofol |
"Duration of follow-up: A: until recovered Loss to follow-up: N (%) Intervention; N (%) Control A: I: not reported; C: not reported"
"Duration of follow-up: B: until recovered Loss to follow-up: N (%) Intervention; N (%) Control B: I: not reported; C: not reported"
"Duration of follow-up: C: until recovered Loss to follow-up: N (%) Intervention; N (%) Control C: I: not reported; C: not reported"
"Duration of follow-up: D: Loss to follow-up: N (%) Intervention; N (%) Control D: I: ; C: "
"Duration of follow-up: E: until recovered Loss to follow-up: N (%) Intervention; N (%) Control E: I: not reported; C: not reported"
|
Outcome measure-1 A: duration of sedation MD 22.25 (95% CI: 1.98 to 42.52) B: duration of sedation MD 1.00 (95% CI: -10.72 to 12.72) NA NA E: duration of sedation MD 38.00 (95% CI: 22.62 to 53.38)
Higher favours propofol
Pooled effect: see forest plots
Outcome measure-2 A: recovery time MD 10.45 (95% CI: ) B: recovery time MD 4.00 (95% CI: -0.26 to 4.18) C: recovery time MD 6.43 (95% CI: ) NA E: recovery time MD 26.80 (95% CI: 0.89 to 4.51)
Higher favours propofol
Pooled effect: see forest plots
Outcome measure-3 B: PAED score 5 minutes after waking MD 1.96 (95% CI: -0.26 to 4.18) NA NA E: PAED score 5 minutes after waking MD 2.70 (95% CI: 0.89 to 4.51)
Higher favours propofol
Pooled effect: see forest plots
|
Facultative:
The study concludes that intravenous dexmedetomidine as sole medication is a safe and effective sedative for pediatric procedures. The effectiveness as a sedative is comparable to that of propofol, and the duration of recovery is longer.
Well performed SR.
Level of evidence: Low GRADE due indirectness (different comprarisons and doses), and imprecision (wide confidence intervals.
|
|
Kim, 2017
individual study characteristics deduced from Kim, 2017
|
SR and meta-analysis of RCTs
Literature search up to December, 2014
A: Akin, 2012 B: Cimen, 2013 C: Ghali, 2011 D: Gyanesh, 2014 E: Linares Segovia, 2014 F: Pestieau, 2011 G: Savla, 2014 H: Sheta, 2014 I: Talon, 2009 J: Yuen, 2008 K: Yuen, 2010
Study design: RCT
Setting and Country: A: tonsillectomy and adenoidectomy, Turkey B: minor surgery, Turkey C: tonsillectomy and adenoidectomy, Oman D: MRI, India E: minor surgery, Mexico F: bone marrow transplant, USA G: short surgery, India H: dental rehabilitation, Saudi-Arabia I: burn dressing, USA J: minor surgery, Hong Kong K: Elective surgery, Hong Kong
Source of funding and conflicts of interest: A: None reported B: None reported C: None reported D: None reported E: None reported F: Hospira Inc. G: None reported H: Research Center of King Saud University I: None reported J: None reported K: None reported |
Inclusion criteria SR: intervention intranasal dexmedetomidine, compared with a benzodiazepine, opioid, ketamine, or placebo delivered via other routes; RCT; including children <18y
Exclusion criteria SR: not reported
11 studies included
Important patient characteristics at baseline:
N, mean age A: 90; range: 2-9y (not reported) B: 62; range: 2-6y (not reported) C: 120; range: 4-12y (not reported) D: 72; range: 1-10y (not reported) E: 108; range: 2-12y (not reported) F: 53; range: 0.5-6y (not reported) G: 36; range: 1-6y (not reported) H: 64; range: 3-6y (not reported) I: 100; range: 1-18y (not reported) J: 96; range: 2-12y (not reported) K: 100; range: 2-12y (not reported)
Sex: A: I: not reported%; C: not reported% B: I: not reported%; C: not reported% C: I: not reported%; C: not reported% D: I: not reported%; C: not reported% E: I: not reported%; C: not reported% F: I: not reported%; C: not reported% G: I: not reported%; C: not reported% H: I: not reported%; C: not reported% I: I: not reported%; C: not reported% J: I: not reported%; C: not reported% K: I: not reported%; C: not reported%
Groups comparable at baseline? All studies: not reported |
Describe intervention:
A: in dexmedetomidine 1 µg/kg B: in dexmedetomidine 1 µg/kg C: in dexmedetomidine 1 µg/kg D: in dexmedetomidine 1 µg/kg E: in dexmedetomidine 1 µg/kg F: in dexmedetomidine 1 or 2 µg/kg G: in dexmedetomidine 2 µg/kg H: in dexmedetomidine 1 µg/kg I: in dexmedetomidine 2 µg/kg J: in dexmedetomidine 0.5 µg/kg K: not reported |
Describe control:
A: in midazolam 0.2 mg/kg B: dexmedetomidine po C: midazolam 0.5 mg/kg po D: in ketamine 5.0 mg/kg E: midazolam po F: in fentanyl/saline G: midazolam 0.5 mg/kg po H: in midazolam 0.2 mg/kg I: midazolam 0.5 mg/kg po J: midazolam 0.5 mg/kg po K: placebo |
"Duration of follow-up: A: until recovered Loss to follow-up: N (%) Intervention; N (%) Control A: I: not reported; C: not reported
" "Duration of follow-up: B: until recovered Loss to follow-up: N (%) Intervention; N (%) Control B: I: not reported; C: not reported
" "Duration of follow-up: C: until recovered Loss to follow-up: N (%) Intervention; N (%) Control C: I: not reported; C: not reported
" "Duration of follow-up: D: until recovered Loss to follow-up: N (%) Intervention; N (%) Control D: I: not reported; C: not reported
" "Duration of follow-up: E: until recovered Loss to follow-up: N (%) Intervention; N (%) Control E: I: not reported; C: not reported
" "Duration of follow-up: F: until recovered Loss to follow-up: N (%) Intervention; N (%) Control F: I: not reported; C: not reported
" "Duration of follow-up: G: until recovered Loss to follow-up: N (%) Intervention; N (%) Control G: I: not reported; C: not reported
" "Duration of follow-up: H: until recovered Loss to follow-up: N (%) Intervention; N (%) Control H: I: not reported; C: not reported
" "Duration of follow-up: I: until recovered Loss to follow-up: N (%) Intervention; N (%) Control I: I: not reported; C: not reported
" "Duration of follow-up: J: until recovered Loss to follow-up: N (%) Intervention; N (%) Control J: I: not reported; C: not reported
" "Duration of follow-up: K: until recovered Loss to follow-up: N (%) Intervention; N (%) Control K: I: not reported; C: not reported
" |
Outcome measure-1 A: sedation scale SMD 0.00 (95% CI: -0.41 to 0.41) B: sedation scale SMD -3.95 (95% CI: -4.82 to -3.08) C: sedation scale SMD -0.71 (95% CI: -1.07 to -0.34) G: sedation scale SMD -2.45 (95% CI: -3.33 to -1.58)
Pooled effect: see forest plots
Outcome measure-2 D: sedation success RR 0.24 (95% CI: 0.11 to 0.53) E: sedation success RR 0.29 (95% CI: 0.13 to 0.67) F: sedation success RR comparison 1 0.66 comparison 2 2.06 (95% CI: comp 1 0.30 to 1.44 comp 2 0.60 to 7.07) H: sedation success RR 0.40 (95% CI: 0.21 to 0.77) I: sedation success RR 0.33 (95% CI: 0.10 to 1.16) J: sedation success RR 0.42 (95% CI: 0.28 to 0.62) K: sedation success RR 0.44 (95% CI: 0.32 to 0.62) Outcome measure-3
Lower favours dexmedetomidine
Pooled effect: see forest plots
|
Facultative:
The study concludes that intranasal dexmedetomidine as sole medication is a safe and effective sedative for pediatric procedures. The effectiveness as a sedative is comparable to that of chloral hydrate , and the rate of adverse effects is lower.
Well performed SR.
Level of evidence: Low GRADE due to risk of bias (lack of blinding or outcome assessor , and indirectness (different comprarisons and doses).
|
|
Lian, 2020
individual study characteristics deduced from Lian, 2020
|
SR and meta-analysis of RCTs
Literature search up to October, 2019
A: Cao, 2017 B: Chen, 2019 C: Gumus, 2014 D: Huang, 2016 E: Li, 2013 F: Li, 2019 G: Miller, 2016 H: Qi, 2014 I: Reynolds, 2016 J: Shi, 2016 K: Yuen, 2017 L: Zeng, 2019 M: Zhang, 2014 N: Zhang, 2016 O: Zhou, 2016
Study design: RCT
Setting and Country: A: not reported, not reported B: not reported, not reported C: not reported, not reported D: not reported, not reported E: not reported, not reported F: not reported, not reported G: not reported, not reported H: not reported, not reported I: auditory brain stem response, USA J: not reported, not reported K: not reported, not reported L: not reported, not reported M: not reported, not reported N: not reported, not reported O: not reported, not reported
Source of funding and conflicts of interest: A: None reported B: None reported C: None reported D: None reported E: None reported F: None reported G: None reported H: None reported I: None reported J: None reported K: None reported L: None reported M: None reported N: None reported O: None reported |
Inclusion criteria SR: RCTs with patients 0-18y of age, who required sedation before surgery or a diagnostic procedure, ASA I-III, no allergy in history; and that compare dexmedetomidine (any route) with chloral hydrate without adjuvantia. Outcomes should include success rate of sedation, and may include the number of subjects who required 2 doses, sedation latency, sedation duration, sedation recovery time, total time from sedative administration to discharge, and different style of adverse events (incidence of nausea and vomiting, crying, hypotension, bradycardia etc.)
Exclusion criteria SR: patients in intensive care, adult subjects and per protocol use of additional sedative medication, unable to retrieve data; letters, reviews, and animal studies, noncomparative study design, repeated published studies
15 studies included
Important patient characteristics at baseline:
N, mean age A: 141; i 18m c14.5m (iqr i 10-25 c 8.8-23.2) B: 67; i1 40.8m i2 43.2m c 42m (i1 15.6 i2 13.2 c 14.4) C: wrong intervention; () D: 243; i1 13.97m i2 13.25m i3 13.51m c 14.07 (i1 6.97 i2 9.69 i3 6.46 c 7.91) E: 601; i1 24.5m i2 27.39m i3 25.94m i4 25.53 i5 25.43 c 23.9 (i1 15.85 i2 16.75 i3 15.55 i4 17.05 i5 16.73 c 18.70) F: 60; i1 13.95m i2 14.25m c 14.8 (i1 1.85 i2 2.54 c 3.14) G: 150; i1 13.7m i2 15.4m c 13.6 (i1 8.6 i2 8.5 c7.6) H: 40; i 41.52m c 42.24m (i 18.48 c 17.52) I: 85; i 25.6m c 23.3m (iqr i 22.0-29.0 c 19.5-27.2) J: 40; i 43.2m c 42m (not reported) K: 196; i 32.5m c 24m (iqr i 19.8-39.0 c 14.0-36.0) L: 52; i 24.6m c 25.8m (i 8.16 c 8.88) M: wrong intervention; () N: 150; i1 3.3m i2 3.3m c 3.8m (i1 1.6 i2 1.5 c 1.5) O: 40; i 4.3m c 4.5m (i 1.7 c 1.5) Sex: A: I: 63%; C: 61% B: I: i1 48 i2 52%; C: 50% C: I: %; C: % D: I: i1 47 i2 45 i3 49%; C: 58% E: I: i1 60 i2 66 i3 60 i4 65 i5 58%; C: 65% F: I: not reported%; C: not reported% G: I: i1 66 i2 34%; C: 48% H: I: 50%; C: 55% I: I: 61%; C: 56% J: I: 85%; C: 75% K: I: 72%; C: 63% L: I: not reported%; C: not reported% M: I: %; C: % N: I: i1 60 i2 44%; C: 38% O: I: 55%; C: 60%
Groups comparable at baseline? A: yes B: yes C: D: yes E: yes F: not reported G: yes H: yes I: yes J: yes K: yes L: yes M: N: yes O: yes |
Describe intervention:
A: in dexmedetomidine 2 µg/kg B: in dexmedetomidine 2 / 2.5 µg/kg C: D: in dexmedetomidine 1 / 1.5 / 2 µg/kg E: in dexmedetomidine 1 / 1.5 / 2 / 2.5 / 3 µg/kg F: in dexmedetomidine 2 / 2.5 µg/kg G: in dexmedetomidine 2 / 3 µg/kg H: in dexmedetomidine 1.5 µg/kg I: in dexmedetomidine 3 µg/kg J: in dexmedetomidine 2 µg/kg K: in dexmedetomidine 3 µg/kg L: in dexmedetomidine 3 µg/kg M: N: in dexmedetomidine 1 / 2 µg/kg O: in dexmedetomidine 2 µg/kg |
Describe control:
A: chloral hydrate 80 mg/kg po B: chloral hydrate 50 mg/kg po C: D: chloral hydrate 50 mg/kg po E: chloral hydrate 50 mg/kg po F: chloral hydrate 50 mg/kg po G: chloral hydrate 70 mg/kg po H: chloral hydrate 50-80 mg/kg rectal I: chloral hydrate 50 mg/kg po J: chloral hydrate 50 mg/kg rectal K: chloral hydrate 50 mg/kg rectal L: chloral hydrate 60 mg/kg po M: N: chloral hydrate 25 mg/kg po O: chloral hydrate 60 mg/kg po |
End-point of follow-up:
"Duration of follow-up: A: until recovered Loss to follow-up: N (%) Intervention; N (%) Control A: I: not reported; C: not reported
" "Duration of follow-up: B: until recovered Loss to follow-up: N (%) Intervention; N (%) Control B: I: not reported; C: not reported
" "Duration of follow-up: C: Loss to follow-up: N (%) Intervention; N (%) Control C: I: ; C:
" "Duration of follow-up: D: until recovered Loss to follow-up: N (%) Intervention; N (%) Control D: I: not reported; C: not reported
" "Duration of follow-up: E: until recovered Loss to follow-up: N (%) Intervention; N (%) Control E: I: not reported; C: not reported
" "Duration of follow-up: F: until recovered Loss to follow-up: N (%) Intervention; N (%) Control F: I: not reported; C: not reported
" "Duration of follow-up: G: until recovered Loss to follow-up: N (%) Intervention; N (%) Control G: I: not reported; C: not reported
" "Duration of follow-up: H: until recovered Loss to follow-up: N (%) Intervention; N (%) Control H: I: not reported; C: not reported
" "Duration of follow-up: I: until recovered Loss to follow-up: N (%) Intervention; N (%) Control I: I: not reported; C: not reported
" "Duration of follow-up: J: until recovered Loss to follow-up: N (%) Intervention; N (%) Control J: I: not reported; C: not reported
" "Duration of follow-up: K: until recovered Loss to follow-up: N (%) Intervention; N (%) Control K: I: not reported; C: not reported
" "Duration of follow-up: L: until recovered Loss to follow-up: N (%) Intervention; N (%) Control L: I: not reported; C: not reported
" "Duration of follow-up: M: Loss to follow-up: N (%) Intervention; N (%) Control M: I: ; C:
" "Duration of follow-up: N: until recovered Loss to follow-up: N (%) Intervention; N (%) Control N: I: not reported; C: not reported
" "Duration of follow-up: O: until recovered Loss to follow-up: N (%) Intervention; N (%) Control O: I: not reported; C: not reported
"
|
Outcome measure-1 B: duration of sedation MD -11.90 (95% CI: -17.02 to -6.78) D: duration of sedation MD -4.41 (95% CI: -6.17 to -2.65) E: duration of sedation MD -1.50 (95% CI: -3.73 to 0.73) F: duration of sedation MD -12.90 (95% CI: -19.34 to -6.46) G: duration of sedation MD -1.00 (95% CI: -3.68 to 1.68) L: duration of sedation MD -0.95 (95% CI: -1.59 to -0.31) NA N: duration of sedation MD 0.00 (95% CI: -1.34 to 1.34)
Lower favours dexmedetomidine
Pooled effect: see forest plots
Outcome measure-2 A: sedation success RR 1.34 (95% CI: 1.10 to 1.63) B: sedation success RR 2.03 (95% CI: 1.38 to 2.98) D: sedation success RR 0.98 (95% CI: 0.93 to 1.04) E: sedation success RR 1.09 (95% CI: 0.98 to 1.22) F: sedation success RR 1.06 (95% CI: 0.82 to 1.37) G: sedation success RR1.02 (95% CI: 0.96 to 1.09) H: sedation success RR 1.17 (95% CI: 0.96 to 1.43) I: sedation success RR1.35 (95% CI: 1.05 to 1.72) K: sedation success RR 0.997 (95% CI: 0.82 to 1.15) L: sedation success RR 1.25 (95% CI: 1.00 to 1.56) N: sedation success RR 1.20 (95% CI: 1.04 to 1.39)
Lower favours dexmedetomidine
Pooled effect: see forest plots
Outcome measure-3 D: recovery time MD 0.00 (95% CI: 0.14 to 0.99) E: recovery time MD -19.64 (95% CI: 0.04 to 0.28) F: recovery time MD -3.30 (95% CI: not estimable) G: recovery time MD -16.00 (95% CI: ) J: recovery time MD -8.60 (95% CI: 0.01 to 7.72) L: recovery time MD -4.20 (95% CI: 0.00 to 0.51) N: recovery time MD -9.25 (95% CI: not estimable)
Lower favours dexmedetomidine
Pooled effect: see forest plots
Outcome measure-4
B: induction time MD -11.90 (95% CI: -17.02 to -6.78) D: induction time MD -4.41 (95% CI: -6.17 to -2.65) E: induction time MD -1.50 (95% CI: -3.73 to 0.73) F: induction time MD -12.90 (95% CI: -19.34 to -6.46) G: induction time MD -1.00 (95% CI: -3.68 to 1.68) K: induction time MD -2.80 (95% CI: -4.82 to -0.78) L: induction time MD -0.95 (95% CI: -1.59 to -0.31) N: induction time MD 0.00 (95% CI: -1.34 to 1.34)
Lower favours dexmedetomidine
Pooled effect: see forest plots
Outcome measure-4
A: adverse effects RR 0.24 (95% CI: 0.13 to 0.46) B: adverse effects RR 0.26 (95% CI: 0.10 to 0.69) D: adverse effects RR 0.37 (95% CI: 0.14 to 0.99) E: adverse effects RR 0.11 (95% CI: 0.04 to 0.28) F: adverse effects RR not estimable (95% CI: not estimable) H: adverse effects RR 0.11 (95% CI: 0.01 to 1.94) I: adverse effects RR 2.80 (95% CI: 0.12 to 66.85) J: adverse effects RR 0.33 (95% CI: 0.01 to 7.72) K: adverse effects RR 0.87 (95% CI: 0.75 to 1.00) L: adverse effects RR 0.03 (95% CI: 0.00 to 0.51) N: adverse effects RR not estimable (95% CI: not estimable) O: adverse effects RR 0.57 (95% CI: 0.20 to 1.65)
Lower favours dexmedetomidine
Pooled effect: see forest plots
|
Facultative:
The study concludes that intranasal dexmedetomidine as sole medication is a safe and effective sedative for pediatric procedures. The effectiveness as a sedative is superior to that of chloral hydrate, as well as the time to sedation, the time to recovery, and the rate of adverse effects is lower.
Well performed SR.
Level of evidence: Low GRADE due to indirectness (different comprarisons and doses), and imprecision (wide confidence intervals)
|
|
Lin, 2020
individual study characteristics deduced from Lin, 2020
|
SR and meta-analysis of RCTs
Literature search up to July, 2018
A: Aksu, 2011 B: Cao, 2017 C: Ghai, 2017 D: Gumus, 2015 E: Koroglu, 2005 F: Miller, 2015 G: Miller, 2018 H: Reynolds, 2016 I: Yuen, 2017
Study design: RCT
Setting and Country: A: electroencephalogram, Turkey B: ophtalmic procedure, China C: computed tomography, India D: wrong intervention, wrong intervention E: wrong intervention, wrong intervention F: transthoracic echocardiography, USA & China G: transthoracic echocardiography, USA H: auditory brain stem response, USA I: computed tomography, China
Source of funding and conflicts of interest: A: Funding: Departmental resources of Erciyes University B: None reported C: Funding: Departmental resources D: E: F: Funding: Intra-departmental funding. Dean Kurth is a Section Editor of Pediatric Anesthesia G: Funding: A grant from the Children's Heart Association of Cincinnati and departmental support. No conflict of interest was reported H: None reported I: Funding: The Health and Medical Research Fund, Food and Health Bureau, Hong Kong SAR Government. No conflict of interest was reported. |
Inclusion criteria SR: RCTs with patients <12y of age; comparing dexmedetomidine (any route) with other sedatives; in English, outcomes include respiratory depression or oxygen desaturation, bradycardia, and success rate of sedation, onset time, or discovery time
Exclusion criteria SR: not reported
9 studies included
Important patient characteristics at baseline:
N, mean age A: 57; range: 6-72m (not reported) B: 141; i 18m c14.5m (iqr i 10-25 c 8.8-23.2) C: 59; range: 20-71m (not reported) D: ; () E: ; () F: 150; range: 3.2-34.1m (not reported) G: 279; range: 3-24m (not reported) H: 85; i 25.6m c 23.3m (iqr i 22.0-29.0 c 19.5-27.2) I: 194; range: 7.5-70m (not reported) Sex: A: I: not reported%; C: not reported% B: I: 63%; C: 61% C: I: not reported%; C: not reported% D: I: %; C: % E: I: %; C: % F: I: not reported%; C: not reported% G: I: not reported%; C: not reported% H: I: 61%; C: 56% I: I: not reported%; C: not reported%
Groups comparable at baseline? A: not reported B: yes C: not reported D: E: F: not reported G: not reported H: yes I: not reported |
Describe intervention:
A: wrong intervention B: in dexmedetomidine 2 µg/kg C: in dexmedetomidine 2.5 µg/kg D: E: F: in dexmedetomidine 2.0 µg/kg G: in dexmedetomidine 2.5 µg/kg H: in dexmedetomidine 3 µg/kg I: in dexmedetomidine 3 µg/kg |
Describe control:
A: B: chloral hydrate 80 mg/kg po C: midazolam 0.5 mg/kg po D: E: F: chloral hydrate 50 mg/kg po G: pentobarbital po 5.0 mg/kg H: chloral hydrate 50 mg/kg po I: chloral hydrate 50 mg/kg po |
"Duration of follow-up: A: Loss to follow-up: N (%) Intervention; N (%) Control A: I: ; C:
" "Duration of follow-up: B: until recovered Loss to follow-up: N (%) Intervention; N (%) Control B: I: not reported; C: not reported
" "Duration of follow-up: C: until recovered Loss to follow-up: N (%) Intervention; N (%) Control C: I: not reported; C: not reported
" "Duration of follow-up: D: Loss to follow-up: N (%) Intervention; N (%) Control D: I: ; C:
" "Duration of follow-up: E: Loss to follow-up: N (%) Intervention; N (%) Control E: I: ; C:
" "Duration of follow-up: F: until recovered Loss to follow-up: N (%) Intervention; N (%) Control F: I: not reported; C: not reported
" "Duration of follow-up: G: until recovered Loss to follow-up: N (%) Intervention; N (%) Control G: I: not reported; C: not reported
" "Duration of follow-up: H: until recovered Loss to follow-up: N (%) Intervention; N (%) Control H: I: not reported; C: not reported
" "Duration of follow-up: I: until recovered Loss to follow-up: N (%) Intervention; N (%) Control I: I: not reported; C: not reported
" |
Outcome measure-1
C: sedation success RR 6.29 (95% CI: 2.01 to 19.65) G: sedation success RR 0.91 (95% CI: 0.48 to 1.72)
Lower favours dexmedetomidine
Pooled effect (see forest plot)
Outcome measure-2 C: adverse effects OR no cases (95% CI: not estimable) G: adverse effects OR 0.73 (95% CI: 0.25 to 2.17)
Lower favours dexmedetomidine
Pooled effect (see forest plot)
|
Facultative:
The study concludes that intranasal dexmedetomidine as sole medication is a safe and effective premedication for pediatric procedures. The effectiveness as a sedative is superior to that of chloral hydrate, midazolam or pentobarbital, and the rate of adverse effects is lower.
Well performed SR.
Level of evidence: Low GRADE due to indirectness (different comprarisons and doses), and imprecision (wide confidence intervals)
|
|
Tervonen, 2020
individual study characteristics deduced from Tervonen, 2020
|
SR and meta-analysis of RCTs
Literature search up to December, 2019
A: Cao, 2017 B: Ghai, 2016 C: Miller, 2016 D: Neville, 2016 E: Reynolds, 2016 F: Surendar, 2014 G: Yuen, 2017
Study design: RCT
Setting and Country: A: ophtalmic procedure, China B: IV insertion and CT, India C: transthoracic echocardiography, USA & China D: laceration suture, USA E: auditory brain stem response, USA F: dental procedure, India G: computed tomography, China
Source of funding and conflicts of interest: A: None reported B: not reported C: Funding: Intra-departmental funding. Dean Kurth is a Section Editor of Pediatric Anesthesia D: not reported E: None reported F: not reported G: Funding: The Health and Medical Research Fund, Food and Health Bureau, Hong Kong SAR Government. No conflict of interest was reported. |
Inclusion criteria SR: RCTs that compare efficacy of intranasal dexmedetomidine with other sedatives administered through any route during minor procedures with blind assessment of the outcomes. Outcomes at least one of: success of the procedure, recovery time, time to discharge, emergence agitation, haemodynamic variables, respiratory depression or possible side effects
Exclusion criteria SR: animal studies and studies that investigated dexmedetomidine as premedication; any other IV sedative infused
7 studies included
Important patient characteristics at baseline: N, mean age A: 141; i 18m c14.5m (iqr i 10-25 c 8.8-23.2) B: 59; 1-6y (not reported) C: 150; range: 3.2-34.1m (not reported) D: 38; 1-5y (not reported) E: 85; i 25.6m c 23.3m (iqr i 22.0-29.0 c 19.5-27.2) F: 84; 4-14y (not reported) G: 194; range: 7.5-70m (not reported)
Sex: A: I: 63%; C: 61% B: I: not reported%; C: not reported% C: I: not reported%; C: not reported% D: I: not reported%; C: not reported% E: I: 61%; C: 56% F: I: not reported%; C: not reported% G: I: not reported%; C: not reported%
Groups comparable at baseline? A: yes B: not reported C: not reported D: not reported E: yes F: not reported G: not reported |
Describe intervention:
A: in dexmedetomidine 2 µg/kg B: in dexmedetomidine 2.5 µg/kg C: in dexmedetomidine 2.0 µg/kg D: in dexmedetomidine 2 µg/kg E: in dexmedetomidine 3 µg/kg F: in dexmedetomidine 1 / 1.5 µg/kg G: in dexmedetomidine 3 µg/kg |
Describe control:
A: chloral hydrate 80 mg/kg po B: midazolam 0.5 mg/kg po C: chloral hydrate 50 mg/kg po D: midazolam 0.4 mg/kg po E: chloral hydrate 50 mg/kg po F: in midazolam 0.2 mg/kg / in ketamine 5 mg/kg G: chloral hydrate 50 mg/kg po |
"Duration of follow-up: A: until recovered Loss to follow-up: N (%) Intervention; N (%) Control A: I: not reported; C: not reported
" "Duration of follow-up: B: until recovered Loss to follow-up: N (%) Intervention; N (%) Control B: I: not reported; C: not reported
" "Duration of follow-up: C: until recovered Loss to follow-up: N (%) Intervention; N (%) Control C: I: not reported; C: not reported
" "Duration of follow-up: D: until recovered Loss to follow-up: N (%) Intervention; N (%) Control D: I: not reported; C: not reported
" "Duration of follow-up: E: until recovered Loss to follow-up: N (%) Intervention; N (%) Control E: I: not reported; C: not reported
" "Duration of follow-up: F: until recovered Loss to follow-up: N (%) Intervention; N (%) Control F: I: not reported; C: not reported
" "Duration of follow-up: G: until recovered Loss to follow-up: N (%) Intervention; N (%) Control G: I: not reported; C: not reported
" |
Outcome measure-1
D: sedation success RR 1.98 (95% CI: 0.85 to 4.60) E: sedation success RR 1.35 (95% CI: 1.05 to 1.72) F: sedation success RR 1.31 (95% CI: 0.88 to 1.94)
Lower favours dexmedetomidine
Pooled effect (see forest plot)
|
Facultative:
The study concludes that intranasal dexmedetomidine as sole medication is a safe and effective premedication for pediatric procedures. The effectiveness as a sedative is comparable to that of chloral hydrate, but the rate of adverse effects is lower.
Well performed SR with additional advantage that it excluded unblinded studies.
Level of evidence: Low GRADE due to indirectness (different comprarisons and doses), and imprecision (wide confidence intervals)
|
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Al Taher, 2010 |
Type of study: |
Inclusion criteria: |
IV 20 mg lidocaine and 0.01 mg/kg atropine; 2µg/kg dexmedetomidine initial; 0.4 µg/kg/h maintenance |
IV 20 mg lidocaine and 0.01 mg/kg atropine; 0.05 mg/kg midazolam; 1 mg/kg propofol over 5 min; 0.5 mg/kg propofol if needed |
Duration of follow-up: Duration of follow-up: until recovered |
induction time MD 4.30 (95% CI: 3.55 to 5.05)
recovery time MD -6.90 (95% CI: -10.51 to -3.29) |
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Fang, 2015 |
Yes
Clear comparison |
Yes |
No
Description of reason of exclusion, no references |
Yes |
Not applicable |
Yes
GRADE assessment |
Yes
Different comparisons but useful for the research question |
Yes
No assessment of publication bias because <10 studies |
No
Not reported for included studies |
|
Kim, 2017 |
Yes
Clear comparison |
Yes |
Yes
Description of reason of exclusion |
Yes
Limited description |
Not applicable |
Yes
GRADE assessment |
Yes
Different comparisons but useful for the research question |
Yes
No assessment of publication bias because <10 studies |
No
Not reported for included studies |
|
Lian, 2020 |
Yes
Clear comparison |
Yes |
Yes
Description of reason of exclusion, no references |
Yes |
Not applicable |
Yes
GRADE assessment |
Yes
Different comparisons but useful for the research question |
Yes
No assessment of publication bias because <10 studies |
No
Not reported for included studies |
|
Lin, 2020 |
Yes
Clear comparison |
Yes |
No
No description of excluded studies |
Yes |
Not applicable |
Yes
GRADE assessment |
Yes
Different comparisons but useful for the research question |
Yes
Funnel plot (not shown) |
Yes |
|
Tervonen, 2020 |
Yes |
Yes |
No
Description of reason of exclusion, no references |
Yes
Limited description |
Not applicable |
Yes
GRADE assessment of quality of studies |
Yes
Different comparisons but useful for the research question |
Yes
Funnel plot (not shown) |
No
Not reported for included studies |
-
Research question (PICO) and inclusion criteria should be appropriate and predefined
-
Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
-
Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
-
Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
-
Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
-
Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
-
Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
-
An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
-
Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Al Taher, 2010 |
Probably yes;
Reason: No explanation |
Probably yes;
Reason: Opaque, sealed envelopes were used. |
Probably yes;
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Definitely yes;
Reason: Loss to follow-up was nil |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Ter Bruggen 2017 |
No quantitative results |
|
Poonai 2020 |
No underlying results |
|
Li 2020 |
All studies covered in other SRs |
|
Gyanesh 2014 |
Covered in SR |
|
Abdel-Ghaffar 2018 |
wrong intervention (inhaled) |
|
Barends 2017 |
wrong population (adults) |
|
Lewis 2020 |
Studies covered in other SR |
|
Qian 2020 |
Study of adjuvant treatment |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-08-2024
Beoordeeld op geldigheid : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Alpha-2 Agonisten voor Procedurele Sedatie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVAPSA kinderen |
|
|
Uitgangsvraag: Alfa-2- Agonisten Dexmedetomidine en Clonidine;
|
|
|
Database(s): Embase, Ovid/Medline |
Datum: 12-1-2021 |
|
Periode: |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
In overleg met de adviseur is de P van deze vraag gedefinieerd als: kinderen die gesedeerd worden. Ipv kinderen die een procedure ondergaan. De interventie is beperkt tot dexmedetomidine of clonidine.
Voor deze vraag is met de volgende elementen gezocht:
Kinderen EN sedatie EN (dexmedetomidine OF clonidine)
Alle sleutelartikelen worden gevonden met uitzondering van een brief:
In eerste instantie worden alleen de SRs en RCTs aangeboden. Indien daar niet de gewenst evidence uitkomt kunnen de observationele studies worden toegevoegd.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 12-1-2021 met relevante zoektermen gezocht naar SRs en RCTs over dexmedetomidien of clonidine als sedatie bij kinderen.De literatuurzoekactie leverde 674 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
139 |
71 |
149 |
|
RCTs |
242 |
242 |
525 |
|
Observationele studies |
194 |
146 |
(229) |
|
Overig |
|
|
|
|
Totaal |
|
|
674 (in Rayyan) |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#30 |
#27 NOT #26 NOT #25 = OBS |
194 |
|
#29 |
#26 NOT #25 = RCT |
456 |
|
#28 |
#25 OR #26 OR #27 |
789 |
|
#27 |
#18 AND #24 |
515 |
|
#26 |
#19 AND #24 |
546 |
|
#25 |
#20 AND #24 SR |
139 |
|
#24 |
#22 AND [1-1-2008]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1230 |
|
#23 |
#11 AND #22 = sleutelartikelen |
11 |
|
#22 |
#16 AND #21 |
2116 |
|
#21 |
#14 AND #17 |
8417 |
|
#20 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
535507 |
|
#19 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2500470 |
|
#18 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6283805 |
|
#17 |
#12 OR #13 |
54939 |
|
#16 |
infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab OR 'pediatrics'/exp OR 'adolescent'/exp OR adolescen*:ti,ab |
5068255 |
|
#15 |
'hypnotic sedative agent'/exp OR clonidin*:ti,ab,kw OR dexmedetomidin*:ti,ab,kw |
429531 |
|
#14 |
'sedation'/exp OR 'sedation':ti,ab |
96059 |
|
#13 |
'clonidine'/exp OR 'adesipress tts 2':ti,ab,kw OR 'adesipress tts2':ti,ab,kw OR 'arkamin':ti,ab,kw OR 'atensina':ti,ab,kw OR 'caprysin':ti,ab,kw OR 'catapres':ti,ab,kw OR 'catapres tts':ti,ab,kw OR 'catapresan':ti,ab,kw OR 'catapressan':ti,ab,kw OR 'catapressant':ti,ab,kw OR 'catasan':ti,ab,kw OR 'chlofazolin':ti,ab,kw OR 'chlophazolin':ti,ab,kw OR 'chlophelin':ti,ab,kw OR 'clinidine':ti,ab,kw OR 'clofelin':ti,ab,kw OR 'clofeline':ti,ab,kw OR 'clomidine':ti,ab,kw OR 'clondine':ti,ab,kw OR 'clonicel':ti,ab,kw OR 'clonidin':ti,ab,kw OR 'clonidine':ti,ab,kw OR 'clonipresan':ti,ab,kw OR 'clonistada':ti,ab,kw OR 'clonnirit':ti,ab,kw OR 'clophelin':ti,ab,kw OR 'clopheline':ti,ab,kw OR 'daipres':ti,ab,kw OR 'dcai':ti,ab,kw OR 'dichlorophenylaminoimidazoline':ti,ab,kw OR 'dixarit':ti,ab,kw OR 'duraclon':ti,ab,kw OR 'haemiton':ti,ab,kw OR 'hemiton':ti,ab,kw OR 'huma-clonidine':ti,ab,kw OR 'hypodine':ti,ab,kw OR 'isoglaucon':ti,ab,kw OR 'jenloga':ti,ab,kw OR 'kapvay':ti,ab,kw OR 'm 5041t':ti,ab,kw OR 'melzin':ti,ab,kw OR 'normopresan':ti,ab,kw OR 'normopresin':ti,ab,kw OR 'paracefan':ti,ab,kw OR 'st 155':ti,ab,kw OR 'sulmidine':ti,ab,kw OR 'taitecin':ti,ab,kw OR 'tenso timelets':ti,ab,kw |
44061 |
|
#12 |
'dexmedetomidine'/exp OR 'cepedex':ti,ab,kw OR 'dexamedetomidine':ti,ab,kw OR 'dexdomitor':ti,ab,kw OR 'dexdor':ti,ab,kw OR 'dexmedetomidine':ti,ab,kw OR 'mpv 1440':ti,ab,kw OR 'mpv1440':ti,ab,kw OR 'precedex':ti,ab,kw OR 'primadex':ti,ab,kw OR 'sedadex':ti,ab,kw OR 'sileo':ti,ab,kw |
12490 |
|
#11 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 |
11 |
|
#10 |
15083132 AND mehta |
1 |
|
#9 |
electroencephalography AND for AND children AND with AND autistic AND spectrum AND disorder AND keidan AND 2015 |
1 |
|
#8 |
successful AND use AND of AND intravenous AND dexmedetomidine AND for AND magnetic AND resonance AND imaging AND sedation AND in AND autistic AND children AND ahmed AND 2014 |
1 |
|
#7 |
dexmedetomidine AND for AND sedation AND during AND electroencephalographic AND analysis AND in AND children AND with AND autism, AND pervasive AND developmental AND disorders, AND seizure AND disorders AND ray AND 2008 |
1 |
|
#6 |
dexmedetomidine AND for AND procedural AND sedation AND in AND children AND with AND autism AND other AND behavior AND disorders |
1 |
|
#5 |
intramuscular AND dexmedetomidine, AND a AND feasible AND option AND for AND children AND with AND autism AND spectrum AND disorders AND needing AND urgent AND procedural AND sedation AND carlone |
2 |
|
#4 |
safety AND efficacy AND buccal AND dexmedetomidine AND for AND mri AND sedation AND in AND school AND aged AND children AND boriosi AND 2019 |
1 |
|
#3 |
use AND intranasal AND dexmedetomidine AND as AND a AND solo AND sedative AND for AND mri AND of AND infants AND olgun AND 2018 |
1 |
|
#2 |
high AND dose AND dexmedetomidine AND as AND the AND sole AND sedative AND for AND pediatric AND mri AND 2008 AND mason |
1 |
|
#1 |
, AND comparison AND of AND dexmedetomidine AND with AND propofol AND as AND sedatives AND for AND pediatric AND patients AND undergoing AND magnetic AND resonance AND imaging AND tang AND 2019 |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
16 |
14 not 13 not 12 = OBS |
146 |
|
15 |
13 not 12 = RCt |
242 |
|
14 |
9 and 11 |
291 |
|
13 |
8 and 11 |
293 |
|
12 |
7 and 11 = SR |
71 |
|
11 |
limit 10 to yr="2008 -Current" |
628 |
|
10 |
6 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
745 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
3619385 |
|
8 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2073165 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
474347 |
|
6 |
4 and 5 |
799 |
|
5 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2559951 |
|
4 |
1 and (2 or 3) |
3418 |
|
3 |
exp Clonidine/ or adesipress tts 2.ti,ab,kf. or adesipress tts2.ti,ab,kf. or arkamin.ti,ab,kf. or atensina.ti,ab,kf. or caprysin.ti,ab,kf. or catapres.ti,ab,kf. or catapres tts.ti,ab,kf. or catapresan.ti,ab,kf. or catapressan.ti,ab,kf. or catapressant.ti,ab,kf. or catasan.ti,ab,kf. or chlofazolin.ti,ab,kf. or chlophazolin.ti,ab,kf. or chlophelin.ti,ab,kf. or clinidine.ti,ab,kf. or clofelin.ti,ab,kf. or clofeline.ti,ab,kf. or clomidine.ti,ab,kf. or clondine.ti,ab,kf. or clonicel.ti,ab,kf. or clonidin.ti,ab,kf. or clonidine.ti,ab,kf. or clonipresan.ti,ab,kf. or clonistada.ti,ab,kf. or clonnirit.ti,ab,kf. or clophelin.ti,ab,kf. or clopheline.ti,ab,kf. or daipres.ti,ab,kf. or dcai.ti,ab,kf. or dichlorophenylaminoimidazoline.ti,ab,kf. or dixarit.ti,ab,kf. or duraclon.ti,ab,kf. or haemiton.ti,ab,kf. or hemiton.ti,ab,kf. or huma-clonidine.ti,ab,kf. or hypodine.ti,ab,kf. or isoglaucon.ti,ab,kf. or jenloga.ti,ab,kf. or kapvay.ti,ab,kf. or m 5041t.ti,ab,kf. or melzin.ti,ab,kf. or normopresan.ti,ab,kf. or normopresin.ti,ab,kf. or paracefan.ti,ab,kf. or st 155.ti,ab,kf. or sulmidine.ti,ab,kf. or taitecin.ti,ab,kf. or tenso timelets.ti,ab,kf. |
18559 |
|
2 |
exp Dexmedetomidine/ or cepedex.ti,ab,kf. or dexamedetomidine.ti,ab,kf. or dexdomitor.ti,ab,kf. or dexdor.ti,ab,kf. or dexmedetomidine.ti,ab,kf. or mpv 1440.ti,ab,kf. or mpv1440.ti,ab,kf. or precedex.ti,ab,kf. or primadex.ti,ab,kf. or sedadex.ti,ab,kf. or sileo.ti,ab,kf. |
6556 |
|
1 |
exp Conscious Sedation/ or exp Deep Sedation/ or sedation.ti,ab,kf. |
43407 |