Farmacologische interventie Procedurele Analgesie: topicale pijnstilling (EMLA, Rapydan, J-tip)
Uitgangsvraag
Welke farmacologische mogelijkheden zijn er om naald-gerelateerde procedures voor het kind zo pijnloos mogelijk en zo min mogelijk beangstigend te maken?
Clinical question
What can be done to make needle procedures in children as painless and as comfortable as possible?
Aanbeveling
Maak standaard gebruik van topicale pijnstilling (EMLA, Rapydan) bij naaldgerelateerde procedures, en hou de aanbevolen inwerktijd aan voor een optimaal verdovend effect.
Zorg ervoor dat de topicale pijnstilling op de juiste plek wordt aangebracht en dat alleen geprikt wordt waar de huid effectief is verdoofd.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De kwaliteit van het bewijs ten aanzien het effect van EMLA tijdens en na een naaldgerelateerde procedure bij kinderen is laag te noemen voor de cruciale uitkomstmaten pijn en patiëntcomfort. Dit komt met name doordat de betrouwbaarheidsintervallen van de samengevatte resultaten een verschil van 0 omvatten. Daarnaast verschilden de studieopzet en de gebruikte schalen om de uitkomstmaat pijn te rapporteren aanzienlijk tussen de gerapporteerde studies. Voor de belangrijke uitkomstmaat tijd tot interventie waren geen uitkomsten gerapporteerd. EMLA en Rapydan hebben echter beide tijd nodig om effectief te zijn (respectievelijk minimaal 60 en 35 minuten). Deze tijd zal meegenomen moeten worden in het plannen van de start van de procedure.
De kwaliteit van het bewijs ten aanzien van het effect van J-Tip ten aanzien van pijn en patiëntcomfort is laag en zeer laag te noemen, omdat de resultaten niet consistent waren, en de betrouwbaarheidsintervallen breed. Ook was het opvallend dat er geen verschil leek te zijn tussen jet-infiltratie van lidocaïne of placebo, maar wel ten opzichte van de controlegroep zonder jet-infiltratie.
De kwaliteit van het bewijs ten aanzien van het effect van een pleister met lidocaïne (EMLA, Rapydan) ten aanzien van pijn is laag te noemen, voor de overige uitkomstmaten is geen bewijs gevonden.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor kinderen en hun ouders/verzorgers is het belangrijk dat het ondergaan van een naald-gerelateerde procedure zo comfortabel mogelijk gebeurt. Dit betekent met zo min mogelijk pijn en met zo min mogelijk angst. Voor kinderen zijn naald-gerelateerde procedures vaak beangstigend en bovendien pijnlijk. Het is dan ook belangrijk om ervoor te zorgen dat, waar mogelijk, deze pijn tot een minimum wordt beperkt. Wanneer het kind comfortabel en niet angstig is, zal de procedure tevens een grotere kans van slagen hebben en wordt eventuele herhaling van de procedure voorkomen.
Kosten (middelenbeslag)
Het gebruik van topicale pijnstilling brengt kosten met zich mee.
Hierbij dient opgemerkt te worden dat het gebruik van EMLA-crème het goedkoopst is, gevolgd door een EMLA-pleister. Het kosten voor gebruik van Rapydan-pleister liggen 10 keer hoger dan voor EMLA-crème en meer dan 2 maal hoger dan voor EMLA-pleister.
De kosten variëren van €0,70 tot €7,00 (Medicijnkosten.nl).
Aanvaardbaarheid, haalbaarheid en implementatie
Het verdoven van de huid middels topicale pijnstilling (EMLA, Rapydan) wordt al veelvuldig toegepast en het gebruik zal bij de meeste verpleegkundigen en artsen bekend zijn. Wat in de praktijk vaak opvalt is dat niet altijd rekening gehouden wordt met de relatief lange inwerktijd (respectievelijk minimaal 60 en 35 minuten) en dat te snel met de procedure wordt gestart. Ook komt het voor dat de pijnstilling niet op de juiste plaats zit (bv niet boven een bloedvat) of dat geprikt wordt op een plek waar geen pijnstilling zat. Bij gebruik van Rapydan is slechts een kleine, smalle zone effectief verdoofd. Bij gebruik van EMLA crème kan de crème weglekken onder het afsluitend verband.
Kennis over het juiste gebruik zou dit kunnen ondervangen. Daarnaast is het van belang dat het aanbrengenoptimaal wordt afegstemd met de logistiek van de voorgenomen procedure.
In spoedeisende situaties zal het niet altijd mogelijk zijn om gebruik te maken van topicale pijnstilling; echter zal dit steeds een weloverwogen beslissing moeten zijn.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het gebruik van topicale pijnstilling (EMLA, Rapydan) voor het verdoven van de huid is uitgebreid onderzocht en daarbij effectief en veilig gebleken. Het is dan ook aan te bevelen hier standaard gebruik van te maken tijdens naald-gerelateerde procedures. Belangrijk is de aanbevolen inwerktijd aan te houden zodat de werking optimaal is. Hier dient rekening mee gehouden te worden tijdens de planning van de procedure. Daarbij dient opgemerkt te worden dat Rapydan niet geregistreerd is voor kinderen jonger dan 3 jaar.
Voor het gebruik van J-Tip is op dit moment te weinig overtuigend bewijs.
Onderbouwing
Achtergrond
Kinderen in het ziekenhuis ondergaan vaak naald-gerelateerde procedures in het kader van diagnostiek en/of behandeling. Het in de huid steken met een naald is per definitie pijnlijk en kan bij kinderen veel angst veroorzaken. Deze angst kan de procedure zodanig benadelen dat deze gestaakt moet worden of overgegaan moet worden tot sedatie.
Het gebruik van topicale pijnstilling wordt vaak toegepast om de intacte huid vooraf te verdoven.
Wij onderzochten de effectiviteit van de hiervoor in Nederland beschikbare middelen: EMLA® crème/pleister en de Rapydan®-pleister. Beiden hebben tijd nodig om in te trekken alvorens de werking maximaal is (respectievelijk minimaal 60 en 35 minuten). In spoedeisende situaties kan dit een nadeel zijn. Om deze reden onderzochten wij of de J-Tip® een goed alternatief zou zijn. Bij deze nieuwe, naaldvrije techniek wordt gebruik gemaakt van luchtdruk (zogeheten jet-infiltratie) om lidocaïne in de epidermis aan te brengen. Dit gebeurt in een fractie van een seconde en zou nauwelijks oncomfortabel zijn. Binnen 1 tot 3 minuten is de huid verdoofd en kan de procedure plaatsvinden.
Conclusies / Summary of Findings
EMLA
|
Low GRADE |
EMLA may result in little to no difference in pain during and after procedure when compared with placebo in children undergoing needle procedures.
Sources: Shahid, 2019; Foster, 2017; Abuelkheir, 2014; Choi, 2016 |
|
Low GRADE |
EMLA may reduce patient discomfort when compared with placebo in children undergoing needle procedures.
Sources: Shahid, 2019; Abuelkheir, 2014; Choi, 2016 |
|
No GRADE |
No evidence was found regarding the effect of EMLA on time to procedure start when compared with placebo in children undergoing needle procedures. |
J-tip
|
Low GRADE |
The evidence is very uncertain about the effect of jet lidocaine infiltration on pain when compared with placebo in children undergoing needle procedures.
Sources: Auerbach, 2009 |
|
Very low GRADE |
The evidence is very uncertain about the effect of jet lidocaine infiltration on patient discomfort when compared with placebo in children undergoing needle procedures.
Sources: Ferayorni, 2012 |
|
No GRADE |
No evidence was found regarding the effect of jet lidocaine infiltration on time to procedure start when compared with placebo in children undergoing needle procedures.
Sources: Ferayorni, 2012 |
Lidocaine patch
|
Low GRADE |
Lidocaine patch may reduce pain when compared with placebo in children undergoing needle procedures.
Sources: Kim, 2012 |
|
No GRADE |
No evidence was found regarding the effect of a lidocaine patch on patient comfort when compared with placebo in children undergoing needle procedures.
|
|
No GRADE |
No evidence was found regarding the effect of a lidocaine patch on time to procedure start when compared with placebo in children undergoing needle procedures. |
Samenvatting literatuur
Description of studies
EMLA
Shahid, 2019 conducted a systematic review and meta-analysis with the objective to evaluate the efficacy and safety of EMLA-cream in newborn term or preterm infants (<3 months of age), who underwent an invasive procedure with a needle. Shahid (2019) included 10 studies, of which 7 were of interest for this guideline.
Shahid (2019) included studies that compared EMLA cream with placebo, no treatment, sucrose, breastfeeding, or skin-to-skin care. The primary outcome was pain measured with a scale (Premature Infant Pain Profile (PIPP), Neonatal Facial Coding System (NFCS), Douleur Aigue Nouveau-ne behavioral scale (DAN), or the Neonatal Infant Pain Scale (NIPS)). Two of the included studies (Aziznejad, 2013; Larsson, 1998) measured pain during venipuncture with a scale in infants, and compared EMLA with placebo (Larsson, 1998) or no treatment (Aziznejad, 2013a). Six studies compared the effects of EMLA with sucrose or breast milk on pain during venipuncture (Aziznejad 2013b, Aziznejad 2013c, Biran 2011, Gradin 2002, Marcatto 2011, and Noori-Sadkam 2007). Six studies reported on patient comfort, measured as duration of crying (Abad, 2001; Achayra, 1998; Biran, 2011; Gradin, 2002; Larsson, 1998; Noori-Sadkam, 2007)
Foster (2017) conducted a systematic review on studies in newborn term or preterm infants (<3 months of age), who underwent an invasive procedure with a needle.
Foster (2017) included studies that compared EMLA cream with placebo, EMLA cream with amethocaine, EMLA with other topical anaesthetics, or amethocaine with other topical anaesthetics. Five studies compared EMLA cream with placebo (Bonetto, 2008; Kaur, 2003; Larsson, 1995; Larsson, 1998, and Stevens, 1999); two studies compared amethocaine gel with placebo (Jain, 2000a; Shah, 2008), and one study compared a tetracaine patch with placebo (Long, 2003). All studies reported on a measure of procedural pain (PIPP, NIPS). Pain cry duration, number of attempts to achieve procedural success, time to successful procedure were reported in a subset of studies, and safety was also reported in a subset of studies.
Abuelkheir (2014) conducted a randomised controlled trial to assess the effect of EMLA cream compared with placebo during routine vaccination children on pain (Modified Behavioural Pain Score, MBPS) and patient comfort (VAS scale). In total, 216 children aged 2 months to 6 years were included in this study, there was no loss to follow-up.
Choi (2016) conducted a randomised controlled trial to assess the effect of EMLA cream compared with placebo for a caudal block on pain (Multidimensional Assessment Pain Scale, MAPS) and patient comfort. In total, 41 children with a mean age of 33 (intervention) and 35 (control) months were included.
J-tip
Auerbach (2009) performed a randomized controlled trial to assess the effect of lidocaine infiltration using a pressurized device (J-tip) compared to jet-delivered placebo to reduce pain during a needle procedure in children. In total, 150 children aged 5 to 18 years who underwent venipuncture or peripheral venous canulation were included.
CAS Pain Scores at needle insertion were reported, other outcomes that were relevant to this guideline were not reported.
Ferayorni (2012) performed a randomized controlled trial to assess the effect of lidocaine infiltration using a pressurized device (J-tip) compared to jet-delivered placebo, both with a background of oral sucrose in 55 febrile children who underwent a lumbar punction. Ferayorni (2012) reported needle insertion pain score and patient comfort (as duration of crying).
Lidocaine patch/Rapydan
Kim (2012) performed a randomized controlled trial to study the effect of a lidocaine patch compared to a patch where the active substance was covered on Face, Legs, Activity, Cry, and Consolability Scale (FLACC) pain score during venipuncture preceding anaesthesia in 77 children who were scheduled for elective surgery.
Results
EMLA
Pain during venipuncture
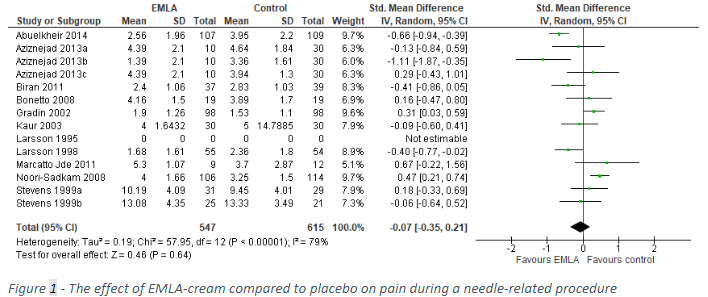
Shahid (2019) included six studies that reported pain during venipuncture (Aziznejad, 2013; Biran, 2011; Gradin, 2002; Marcatto, 2011; Noori-Sadkam, 2008; Larsson, 1998). Foster (2017) included six studies that reported pain during venipuncture (Bonetto, 2008; Kaur, 2003; Larsson, 1995; Larsson, 1998; Stevens, 1999). Also, Abuelkheir (2014) reported pain during venipuncture. As the different studies reported different measures of pain, we calculated a standardized mean difference and pooled the results. A standardized mean difference can be interpreted as the difference in number of standard deviations of the outcome measure between the intervention and the control treatment. The pooled results are shown in Figure 1. Pain during venipuncture was 0.07 SD lower after application of EMLA cream compared to placebo (95% CI: -0.35 to 0.21).
Pain after venipuncture
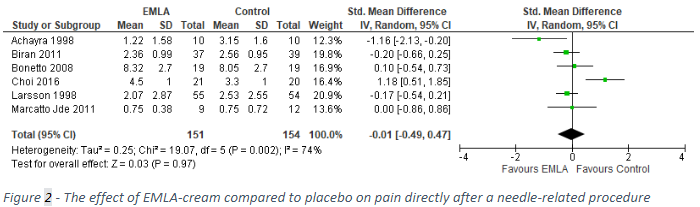
Six studies reported on the outcome pain after venipuncture (Achayra, 1998; Biran, 2011; Bonetto, 2008; Choi, 2016, Larsson, 1998; and Marcatto, 2011). As the different studies reported different measures of pain, we calculated a standardized mean difference and pooled the results. The pooled results are shown in Figure 2. Pain after venipuncture was 0.01 standard deviations lower after application of EMLA-cream than after placebo (95% CI: -0.49 to 0.47).
Patient comfort/patient satisfaction/PROM (critical outcome measure for decision making)
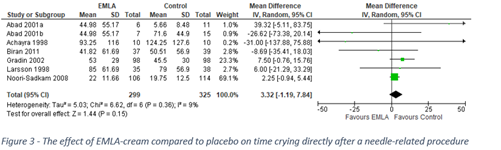
Shahid (2019) reported results of six studies that compared patient comfort, measured as time crying, between application of EMLA-cream and placebo. After application of EMLA, children cried 3.32 seconds longer than after application of placebo (95% CI: -1.19 to 7.84) The pooled results are shown in Figure 3.
Time to procedure start (important outcome measure for decision making)
Time to procedure start was not reported for the comparison EMLA versus placebo or no treatment.
J-tip
Efficacy (critical outcome measure for decision making)
Efficacy was reported in both randomised controlled trials as pain during needle insertion, both studies used different outcome measures.
Auerbach 2009 reported a Color Analog Scale (CAS) to assess pain during needle insertion, and reported a mean of 28 mm (95% CI: 21 to 35) for the jet lidocaine application, 34 mm (95% CI: 27 to 41) mm for the jet placebo application, and 52 mm (95% CI: 42 to 60) for control (no jet application). They reported a p-value of 0.23 for the difference between jet lidocaine and placebo application, and <0.005 for the difference between any of the jet applications and control.
Ferayorni 2012 reported a Neonatal Facial coding system to assess pain during needle insertion for lumbar puncture, and reported a mean pain score of 4.1 (sd: 1.3) for the jet lidocaine application, and 4.8 (sd: 0.5) for jet placebo, which leads to a mean difference of 0.7 (95% CI: 0.1 to 1.3), p=0.01, Student t test or Mann-Whitney U test (unclear)
Patient comfort/patient satisfaction/PROM (critical outcome measure for decision making)
Ferayorni (2012) reported a shorter mean duration of crying during needle insertion in children treated with the J-tip (38.5 seconds, sd 18.6 seconds) compared with children who were treated with a sham device (48.8 seconds, sd 16.2 seconds). The difference (10.3 seconds, 95% CI: 0.8 to 19.8) is greater than 0.5 SD and is considered clinically relevant.
Time to procedure start (important outcome measure for decision making)
Ferayorni (2012) reported that 70% of the lumbar punctures in their trial were successful on the first attempt in both groups. No further data were reported. The clinical relevance could therefore not be assessed.
Lidocaine patch
Efficacy (critical outcome measure for decision making)
Kim (2012) reported median and IQR for the FLACC pain scale during venipuncture, 0 (0–1) after application of the lidocaine patch and 4 (1–7) after application of the placebo patch. The difference may be clinically relevant, the FLACC is reported on a scale of 0-10.
Patient comfort/patient satisfaction/PROM (critical outcome measure for decision making)
The outcome measure patient comfort was not reported for the comparison lidocaine patch versus placebo.
Time to procedure start (important outcome measure for decision making)
The outcome measure time to procedure start was not reported for the comparison lidocaine patch versus placebo. Per study protocol, the lidocaine patch was applied for 120 minutes to achieve sufficient analgesia.
Level of evidence of the literature
EMLA
The level of evidence regarding the crucial outcome measure efficacy started as high (systematic review of randomised controlled trials) and was downgraded by two levels to low because of conflicting results (inconsistency), and confidence intervals crossing 0 (imprecision).
The level of evidence regarding the crucial outcome measure patient comfort started as high (systematic review of randomised controlled trials) and was downgraded by two levels to low because of conflicting results (inconsistency), and confidence intervals crossing 0 (imprecision).
The level of evidence regarding the important outcome measure time to procedure start was not graded because of the lack of evidence.
J-tip
The level of evidence regarding the critical outcome measure efficacy started as high (randomised controlled trials), and was downgraded by three levels to low because of conflicting results (inconsistency); and number of included patients (imprecision).
The level of evidence regarding the critical outcome measure patient comfort started as high (randomised controlled trials), and was downgraded by three levels to very low because of different study settings (inconsistency); number of included patients and confidence intervals crossing 0 (imprecision).
The level of evidence regarding the important outcome measure time to procedure start was not graded because of the lack of evidence.
Lidocaine patch/Rapydan
The level of evidence regarding the critical outcome measure efficacy started as high (randomised controlled trial), and was downgraded by two levels to low because of study limitations (risk of bias); number of included patients (imprecision).
The level of evidence regarding the critical outcome measure patient comfort was not graded because of the lack of evidence.
The level of evidence regarding the important outcome measure time to procedure start was not graded because of the lack of evidence.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)favourable effects of topical analgesia (EMLA, Rapydan) or J-tip compared with no analgesia or placebo in children (0-18 years) undergoing needle procedures?
| P: | children 0-18 undergoing a needle procedure |
| I: | topical analgesic (EMLA, Rapydan, J-tip) |
| C: | no analgesic, placebo |
| O: | efficacy, patient comfort/patient satisfaction/PROM, time to procedure start |
Relevant outcome measures
The guideline development group considered efficacy and patient comfort as critical outcome measures for decision making; and time to procedure start as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
For all outcome measures, the working group defined a 25 % difference in relative risk (RR) for dichotomous outcomes, and 0.5 standard deviations (SD) for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 8-2-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 642 hits. Studies were selected based on the following criteria: systematic reviews of RCTs or RCTs, in English. Sixteen studies were initially selected based on title and abstract screening. After reading the full text, nine studies were excluded (see the table with reasons for exclusion under the tab Methods), and seven studies were included.
Results
Seven studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abuelkheir M, Alsourani D, Al-Eyadhy A, Temsah MH, Meo SA, Alzamil F. EMLA(R) cream: a pain-relieving strategy for childhood vaccination. J Int Med Res. 2014 Apr;42(2):329-36. doi: 10.1177/0300060513509473. Epub 2014 Feb 5. PMID: 24501164.
- Choi EK, Ro Y, Park SS, Park KB. The use of EMLA cream reduces the pain of skin puncture associated with caudal block in children. Korean J Anesthesiol. 2016 Apr;69(2):149-54. doi: 10.4097/kjae.2016.69.2.149. Epub 2016 Mar 30. PMID: 27066206; PMCID: PMC4823410.
- Foster JP, Taylor C, Spence K. Topical anaesthesia for needle-related pain in newborn infants. Cochrane Database Syst Rev. 2017 Feb 4;2(2):CD010331. doi: 10.1002/14651858.CD010331.pub2. PMID: 28160271; PMCID: PMC6464546.
- Shahid S, Florez ID, Mbuagbaw L. Efficacy and Safety of EMLA Cream for Pain Control Due to Venipuncture in Infants: A Meta-analysis. Pediatrics. 2019 Jan;143(1):e20181173. doi: 10.1542/peds.2018-1173. PMID: 30587535.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What can be done to make needle procedures in children as painless and comfortable as possible?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Foster ea 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
Type of study: SR and meta-analysis of RCTs and quasi-RCTs
Literature search from 1990 to April 2015.
7/8 studies included in the meta-analysis
A: Bonetto 2008 B: Jain 2000a C: Kaur 2003 D: Larsson 1995 E: Larsson 1998 F: Long 2003 G: Shah 2008 H: Stevens 1999
Setting and country: A: Single-centre study in Argentina B: Single-centre study in UK C: Single-centre study in India D: Single-centre study in Sweden E: Single-centre study in Sweden F: Single-centre study in UK G: Single-centre study in Canada H: Double-centre study in Canada
Funding and conflicts of interest (derived from studies directly): A: Not reported B: Funded by the Higher Education Funding Council C: Not reported D: Not accessible E: ASTRA pharmaceuticals prepare and supplied EMPA and placebo for the study F: Not reported G: Funded by ‘Striving for Excellence Fund’ Mount Sinai Hospital H: Not reported |
Inclusion criteria SR: RCTs or quasi-RCTs, cluster and cross-over randomised trials.
Newborn term or preterm (or both) infants up to a postnatal age of one month requiring an invasive procedure involving puncture of skin and other tissues with a needle.
Type of interventions included: EMLA vs placebo EMLA vs amethocaine EMLA vs other topical anaesthetic Amethocaine vs placebo Amethocaine vs other topical anaesthetic
Exclusion criteria SR: Infants previously exposed to a topical anaesthetic.
Topical anaesthetica during circumcision.
N total at baseline (derived from the studies directly): A: 76 total B: I 19, C 20 C: I 30, C 30 D: Not accessible E: I 55, C 56 F: I 17, C 17 G: I 55, C 55 H: Phase 1; I 31, C 29 Phase 2; I 25, C 21
Important prognostic factors2 (derived from studies directly):
Age: A: 4.3 days ± 1.3 B: I 7 days (3-17), C 6 days (2-17) C: I 3.5 days, C 3.2 days D: Not accessible E: I 5 days (3-8), C 5 days (3-7) F: I 6 days (3-18) C 6 days (5-10) G: I 53 min (35-151) C 51 min (32-95) H: Phase 1; I 3.7 days ± 1.0 C 3.9 days ± 1.0 Phase 2; I 4.7 days ± 1.2 C 4.6 days ± 1.5
Gender (% males): A: 57% total B: Not reported C: I 63%, C: 43% D: Not accessible E: I 56%, C 48% F: I 40%, C 23% G: I 55%, C 42% H: 60% total
Groups comparable at baseline? (derived from the studies directly) A: Not reported B: Yes C: Not reported D: Not reported E: Not reported F: Not reported G: Not reported H: Yes, except for postnatal age, but this was not considered clinically important
|
Describe intervention (treatment/procedure/test):
A: EMLA cream to the skin and under occlusion for 60 minutes, then removed with a dry cloth with the procedure being performed 10 minutes later. B: Infants in the study group received 4% amethocaine gel a 1.5 g to the skin and occlusion for 60 minutes with the procedure being performed five minutes later. C: Infants received a EMLA cream 1 g cream to one square in at the site of the procedure and covered with an occlusive dressing for 60 to 90 minutes before the scheduled time of the procedure D: Infants received EMLA cream 1 g at the site of the procedure and covered with an occlusive dressing for 10, 20, 30, 40, 50, 60, 90 or 120 minutes before the scheduled time of the procedure E: Infants received a EMLA cream 0.5 g on the dorsal aspect of the hand and covered with an occlusive dressing for 60 minutes before the scheduled time of the procedure F: : Infants received a tetracaine patch formulated from hydroxypropyl cellulose discs of uniform area (0.283 cm2 ) were cut from the dried tetracaine film which, because of the formulation method, was calculated to contain tetracaine base 0.283 mg. The discs were positioned onto pressure-sensitive adhesive film to sandwich the tetracaine discs between the adhesive film and the release liner. Patches of 16 mm diameter were cut with the 6-mm disc of tetracaine film at the centre. The tetracaine patch applied on the dorsal aspect of the hand for 30 minutes before venepuncture. G: Infants in the study group received amethocaine gel 4% to the skin and covered with an adhesive Tegaderm occlusive dressing for 30 minutes before the scheduled time of the procedure. H: 1st phase infants receive EMLA 0.5 g on an occlusive dressing for 30 minutes. Five minutes before heel lancing, the dressing was removed. 2nd phase the method was the same as phase one except a larger automated lancet was used because of a change in unit policy.
|
Describe control (treatment/procedure/test):
A: Placebo cream, same procedure as intervention B: Placebo cream, same as procedure as intervention C: Placebo cream, same procedure as intervention D: Placebo cream, same procedure as intervention E: Placebo cream, same procedure as intervention F: Placebo device, same procedure as intervention G: Placebo gel, same procedure as intervention H: 1st pase Glaxal base 0.5 g, 2nd phase placebo cream containing all ingredients of EMLA except lidocaine and prilocaine. Same procedure as intervention
|
Length of follow-up (derived from the studies directly): A: Not reported B: Not reported C: 24 hours after the procedure D: Not accessible E: Not reported F: Not reported G: 2 minutes after removal of the gel H: 8 hours after application
Loss-to-follow-up (derived from the studies directly): A: Not reported B: Not reported C: I 0, C 0 D: Not accessible E: I n=5 (9.1%); screaming before skin puncture, video-equipment failure C n=4 (7.1%); screaming before skin puncture, video-equipment failure, parents withdraw consent F: I 2 (10.5%), C 0; parents withdrew consent after randomisation G: Not reported H: 14 infants withdrawn after randomization but before data collection; discharged or transferred.
Incomplete outcome data (derived from the studies directly): A: Not reported B: Not reported C: I 0, C 0 D: Not accessible E: Not reported F: Not reported G: I 2 (3.6%), C 3 (5.5%); reasons not reported H: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Pain: A: PIPP score from insertion of heel lance and up to three minutes; MD 0.27, 95% CI -1.45 to 1.99 (no statistical difference). During heel lancing; MD 0.27, 95% CI -0.75 to 1.29 (no statistical difference) B: Five seconds after insertion of the needle; median 3 amethocaine and median 16 placebo, significant difference in favour of amethocaine. Insertion of the needle; 16 of 19 (84%) amethocaine-treated infants showed little or no pain in response to insertion of the needle compared with six of 20 (30%) in the placebo group (P = 0.001). C: Neonatal Facial Coding System (NFCS) during lumbal puncture; mean 4.0 ± SE 0.3 with EMLA versus mean 5.0 ± SE 2.7 with placebo; P = 0.004 Needle withdrawal; mean 1.8 ± SE 0.3 with EMLA versus mean 3.9 ± SE 0.3 with placebo; P < 0.001 D: ‘Pain cry’ I: 54 out of 56 C: 52 out of 54 RR 1.0, 95% CI 0.9 to 1.1, P=.9705 E: 0 to 15 seconds post venepuncture; median 287 with EMLA versus median 374 with placebo; P = 0.016 60 to 70 seconds post venepuncture; median 288 with EMLA versus median 407 with placebo F: Significant difference in pain score during venepuncture between amethocaine group (median 0) compared to the placebo group (median 12.5) (P = 0.0002; n = 32) during venepuncture (this is defined as clinically effective anaesthesia (p=0.01)). G: MD -5.00, 95% CI -17.34 to 7.34; no statistically significant difference. H: PIPP score EMLA applied for 30 minutes; mean 10.19, SD 4.09 with EMLA versus mean 9.45, SD 4.01 with placebo; P = 0.48 EMLA applied for 60 minutes; mean 13.08, SD 4.35 with EMLA versus mean 13.33, SD 3.49 with placebo; P = 0.83
Pain cry: D: No statistical difference; (54 out of 56 infants uttered a ’pain cry’ with EMLA versus 52 out of 54 infants uttered a ’pain cry’ with placebo; P = 0.97)
Total cry duration: B: No significant difference; amethocaine (33 seconds, range 9 to 79; n = 4) and placebo (68 seconds, range 9 to 122. E: No difference for median total duration of crying between EMLA and placebo during venepuncture (p=0.89)
Number of attempts for successful venepuncture: B: typical RR 1.21, 95% CI 0.82 to 1.81; typical RD 0.14, 95% CI -0.14 to 0.42 (no difference). C: Lumbar puncture was traumatic on the first attempt in two cases with EMLA and three cases with placebo. No case required more than two attempts. E: Typical RR 0.98, 95% CI 0.93 to 1.03; typical RD -0.02, 95% CI -0.07 to 0.03; n = 111 (no statistical difference).
Time required for successful completion of procedure: E: Median 145 seconds with EMLA versus median 125 seconds with placebo; P = 0.01 (significantly less time to complete venepuncture in placebo group)
Safety Symptoms of MetHb: D: No clinical symptoms of MetHb.
Methaemoglobin levels of ≥ 5%: B, F, and G: did not report number of infants with methaemoglobin levels ≥5%. H: No methaemoglobin levels of ≥ 5%. Mean methaemoglobin concentration for all infants who received EMLA was 1.19%
Transcutaneous oxygen saturation: C: Comparable between EMLA and placebo groups during lumbar puncture, with maximum dip at needle insertion.
Adverse events Adverse events: Measured by meta-analysis, based on D, C, and H; Typical RR 1.65, 95% CI 1.24 to 2.19; typical RD 0.17, 95% CI 0.09 to 0.26; n = 272; NNTH 6, 95% CI 4 to 11. I2 = 92%
Measured by meta-analysis based on G; Typical RR 2.00, 95% CI 0.64 to 6.26; typical RD 0.04, 95% CI -0.03 to 0.12
Skin reactions: D: local pallor and redness C and H: temporary blanching C: temporary blanching of the skin during removal of the occlusive dressing.
All skin irritation and blanching dissipated within one hour.
B and F: reported no difference in local skin reactions.
Other adverse events: No studies reported episodes of apnoea.
No studies reported episodes of bradycardia.
No studies reported neurodevelopmental disability. |
I cannot access Larsson 1995 to extract the necessary baseline characteristics.
|
|
Shahid ea 2019
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
Type of study: SR and meta-analysis
Literature search from inception to August 2017
10/10 studies included in meta-analysis
A: Abad 2001, 41 B: Acharya 1998, 20 C: Aziznejad 2013, 42 D: Biran 2011, 49 E: Brisman 1998, 50 F: Gradin 2002, 51 G: Lindh 2000, 22 H: Marcatto Jde 2011, 43 I: Noori-Sadkam 2008, 52 J: Larsson 1998, 21 K: Lindh, 2000
Setting and country (derived directly from study article): A: Single-centre study in Spain B: Single-centre study in United Kingdom C: Iran D: Multi-centre study in France E: Single centre study in Sweden F: Multi-centre study in Sweden G: Single-centre study in Sweden H: Brazil I: Single-centre study in Iran J: Single-centre study in Sweden
Funding and conflicts of interest (derived directly from study article): A: Not reported B: Not reported C: Not accessible D: No financial relationships relevant to article E: Not reported F: The study was supported by grants from the Research Committee of Örebro County Council, from the Örebro Medical Center Research Foundation, and from the Sven Johansson Memorial Foundation. G: Not reported H: Not reported I: J: ASTRA pharmaceuticals prepare and supplied EMPA and placebo for the study |
Inclusion criteria: RCTs studying the effectiveness of EMLA cream were included.
Population of interest: infants who are at term or preterm up to a postnatal age of 3 months who required venipuncture for blood drawing or venous catheter insertion, from both inpatient and outpatient settings.
Possible nonpharmacological comparators: placebo, no EMLA (no treatment at all), sucrose, breastfeeding, and skin-to-skin care
Exclusion criteria: Not reported
N total at baseline (derived directly from study article): A: I 11 C 40 B: In total 20 patients C: Not accessible D: I 39, C 37 E: I 24, C 23 F: I 99, C 102 G: I 28, C 28 H: EMLA + placebo 9 Glucose + placebo cream 12 EMLA + glucose 9 I: I 115, C 115 J: I 55, C 56
Important prognostic factors2 (derived directly from study article):
Postnatal age: A: I 1.8 days ± 1.2 Placebo 1.7 ± 1.0 Sucrose 1.9 ± 1.3 EMLA + sucrose 2.0 ± 0.9 B: 21 days (3-65) C: Not accessible D: I 14.3 days ± 13.9 C 17.1 days ± 13.7 E: I 40 days (1-74), C 34 (1-71) F: I 4 days (1-30), C 4.5 days (1-28) G: I 80 hours ± 11 C 84 hours ± 16 H: Not reported I: I 4 days (2-15) C 4.2 (2-15) J: I 5 days (3-8), C 5 days (3-7)
Gender (% males): A: I 55% Placebo 80% Sucrose 75% EMLA + sucrose 79% B: 50% C: Not accessible D: I 48.7 % C 70.2% E: 77% in total F: I 51%, C 56% G: I 43%, C 46% H: Not reported I: I 55%, C 48.5% J: I 56%, C 48%
Groups comparable at baseline (derived directly from study article)? A: Yes for weight at birth, weight at time of procedure, and postnatal age. No for gestational age but clinical value is doubtful. B: Not reported C: Not accessible D: Yes E: Not reported F: Yes G: Yes, except that mean gestational age was different between groups (40 weeks in placebo and 39 weeks in EMLA) H: Not reported I: Yes J: Not reported |
Describe intervention (treatment/procedure/test): A: 1 g of EMLA B: 0.5 mL of EMLA C: 1 g of EMLA D: 0.5 g of EMLA and 0.5 mL of sucrose E: 1 g of placebo F: 0.5 g of EMLA cream and 1 mL of water G: 1 g of EMLA H: 0.6 g of EMLA and 2 mL of water I: 0.5 g of EMLA cream with 1 mL of water J: 0.5 mL of EMLA
|
Describe control (treatment/procedure/test): A: 2 mL of spring water, 2 mL of sucrose 24%, and 1 g of EMLA + 2 mL of sucrose B: 0.5 mL of placebo cream C: No treatment, sucrose, breast milk D: 0.5 mL of sucrose + placebo cream (0.5 g) E: 1 g of placebo cream F: 0.5 g of placebo and 1 mL of sucrose G: 1 g of placebo H: 0.6 g of placebo and 2 mL sucrose I: 0.5 g of placebo cream and 1 mL of sucrose J: 0.5 mL of placebo
|
Length of follow-up (derived directly from study article): A: 4 minutes after venepuncture B: 2.5 minutes after needle removal C: Not accessible D: 30 seconds after needle removal E: 18 hours F: 3 minutes after venepuncture G: 80 seconds H: 15 minutes after completing procedure I: Two minutes J: Not reported
Loss-to-follow-up (derived directly from study article): A: Not reported how many loss-to-follow-up; impossible to obtain a fully awake state at time of oral administration or venepuncture. B: I C ; discharged early and had venepuncture with only one cream. C: Not accessible D: Not reported E: Not reported F: I 1, C 4; <36 weeks, antibiotic treatment, seizures during procedure, and parents did not want to proceed. G: I 2, C 0; technical failure and baby cried vigorously during baseline sequence and was impossible to soothe. H: Not reported I: Not reported J: I n=5 (9.1%); screaming before skin puncture, video-equipment failure C n=4 (7.1%); screaming before skin puncture, video-equipment failure, parents withdraw consent
Incomplete outcome data (derived directly from study article): A: Not reported B: Not reported C: Not accessible D: Not reported E: Not reported F: Not reported G: Not reported H: Not reported I: I 9, C 1; reasons not provided J: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Pain during venipuncture: J, C, H, D, F, and I: SMD: 0.14; 95% CI: −0.17 to 0.45; 6 trials, n = 742; I2 = 71%; moderate-quality evidence.
Little to no reduction in pain when EMLA cream was compared with placebo, sucrose, and breastfeeding.
Pain at end of venipuncture: B, J, D, and H: SMD: −0.26; 95% CI: −0.59 to 0.07; 4 trials, n = 226; I2 = 25%; moderate-quality evidence.
Minimal-to-moderate reduction in pain score
Total duration of crying: B, J, A, D, F, and I: MD: 3.32; 95% CI: −1.19 to 7.84, 6 trials, n = 624; I2 = 9%; moderate-quality evidence.
Duration of crying was comparable in both groups
Incidence of crying: K I: 9 of 28 C: 14 of 28 RR 0.64, 95% CI 0.33 to 1.24, P=.1850.
Subgroup analysis based on gestational age at birth for pain: B, J, G, and A: There was small-to-moderate effect size in reduction in pain favouring EMLA in comparison with placebo or no treatment (SMD: −0.34; 95% CI: −0.67 to −0.00; 2 trials, n = 149; I2 = 0%)
There was no effect in reduction of pain with sucrose or breastfeeding when compared with EMLA in both preterm and term infants (SMD: 0.28; 95% CI: −0.02 to 0.58; 5 trials, n = 593; I2 = 59%)
EMLA was inferior for term infants SMD: 0.44; 95% CI: 0.22 to 0.58; 3 trials, 5 trials, n = 496; I2 = 0%)
Subgroup analysis by pain scale revealed no effect when using the DAN and PIPP scale, but when using NIPS, EMLA was inferior to control (MD: 0.80; 95% CI: 0.39 to 1.20; n = 241; I2 = 0%)
Sensitivity analysis pain: Small-to-moderate reduction in pain with placebo, sucrose, or breast milk (SMD: 0.42; 95% CI: 0.20 to 0.64; 3 trials, n = 361; I2 = 0%).
Low-risk bias studies revealed no reduction to moderate reduction in pain with EMLA cream when compared with placebo or sucrose (SMD: −0.14; 95% CI: −0.66 to 0.37; 3 trials, n = 381; I2 = 83%).
Safety Methemoglobinemia: B and I: MD 0.35%; 95% CI: 0.04% to 0.66%, 2 trials, n = 134; I2 = 58%; low-quality evidence. Moderate effect size favouring placebo over EMLA.
Did not report methaemoglobin levels of >5% or any clinical symptom.
Subgroup analysis based on different time periods of serum methaemoglobin levels (<8 hours or 8-24 hours after EMLA application): B, J, G, and A: Placebo favoured over EMLA, with low-quality evidence.
Heart rate during venipuncture: B, G, A, H, and F: MD: −1.22; 95% CI: −9.85 to 7.41; 5 trials, n = 330; I2 = 75%; low-quality evidence.
No difference in reduction in heart rate during venipuncture between groups
Heart rate after venipuncture: B, G, A, H, and F: MD: 3.74; 95% CI: −5.74 to 13.22; 3 trials, n = 254; I2 = 50%, very low-quality evidence.
No difference in reduction in heart rate after venipuncture between groups
Oxygen saturation: B and A: MD: 0.35; 95% CI: −0.77 to 1.47; 2 trials, n = 57; I2 = 20%; very low–quality evidence.
No difference in oxygen saturation between groups.
Skin-blanching: D and E: RR: 2.63; 95% CI: 1.58 to 4.38; 2 trials, n = 123; I2 = 84%, very low–quality evidence
EMLA increased risk of skin blanching
They also performed a meta-analysis under random effects model, this revealed no statistical difference. Due to counterintuitive results, a new analysis was performed with a fixed model.
|
Larsson 1998 is also reported in Foster ea 2017.
Full text article from Aziznejad ea 2013 is in Iran language. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: What can be done to make needle procedures in children as painless and comfortable as possible?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Abuelkheir, 2014 |
Type of study: RCT
Setting and country: Paediatric Clinic, Saudi Arabia
Funding and conflicts of interest: Research Group Project Grant (RGPVPP 181) from King Saud University, Riyadh, Saudi Arabia.
The authors declare no conflicts of interest. |
Inclusion criteria: - Children presenting for routine immunization
Exclusion criteria: - history of allergy to local anaesthetics or to any component of the EMLAcream - a history of uncertain drug sensitivities - active dermatitis or an open wound at the application site - prescription of an analgesic, anaesthetic or sedative <12 h before the time of vaccination congenital or idiopathic methaemoglobinaemia; glucose- 6-phosphate dehydrogenase deficiency - severe hepatic or renal disease - cardiac disease - use of class I antiarrhythmic drugs.
N total at baseline: 216 Intervention: 107 Control: 109
Important prognostic factors2: All children were between 2 months and 6 years old. Means not reported.
Sex: I: 51% M C: 48% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
EMLA approximately 0.5 g applied to an area of approximately 1 cm2 on the vaccination site |
Describe control (treatment/procedure/test):
Placebo cream (an inert cream that could not be visually differentiated from EMLA ; Bepanthen Cream, Bayer HealthCare, Leverkusen, Germany) applied to an area of approximately 1 cm2 on the vaccination site |
Length of follow-up: 15 minutes
Loss-to-follow-up: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
Incomplete outcome data: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Modified Behavioural Pain Scale (MBPS) 0–10 s after injection, mean (SD) I: 5.92 (2.17) C: 7.32 (1.73) P<.001, Mann–Whitney U-test
Patient comfort VAS at the beginning of the injection I: 1.60 (1.67) C: 3.24 (2.01) P<.001, Students t-test
Time to procedure start Not reported |
|
|
Choi, 2016 |
Type of study: RCT
Setting and country: Hospital, Korea
Funding and conflicts of interest: No information about funding or conflicts of interest |
Inclusion criteria: - age 13 months to 5 years - weight under 20 kg - ASA I - undergoing infraumbilical surgery - scheduled for caudal block for procedures such as inguinal hernia or orchiopexy
Exclusion criteria: - allergy to local anesthetics or components of EMLA cream - uncertainty about drug sensitivities - open wound at application site - severe systemic disease - cardiovascular disease - congenital or idiopathic methemoglobinemia - use of analgesics in the last 12 hours
N total at baseline: 41 Intervention: 20 Control: 21
Important prognostic factors2: Age ± SD: I: 33.0 ± 13.1 months C: 35.2 ± 15.6 months
Sex: I: 85 % M C: 76 % M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
EMLA cream was applied in the size of a coin over the sacral hiatus one hour before caudal block and the site of cream application was covered with 3M TegadermTM occlusive dressing.
|
Describe control (treatment/procedure/test):
Placebo cream (BepanthenⓇ, Bayer HealthCare, Leverkusen, Germany) was applied in the size of a coin over the sacral hiatus one hour before caudal block and the site of cream application was covered with 3M TegadermTM occlusive dressing. |
Length of follow-up: Until discharge
Loss-to-follow-up: Intervention: N 0(%) Reasons (describe)
Control: N 0(%) Reasons (describe)
Incomplete outcome data: Intervention: N 0(%) Reasons (describe)
Control: N 0(%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Multidimensional Assessment Pain Scale (MAPS) immediately after needle procedure, mean (SD) I: 3.3 (1.0) C: 4.5 (1.0) P=.001, Mann-Whitney U test
Incidence of Use of Sevoflurane during Caudal Block, n I: 5 of 20 C: 17 of 21 RR 0.31, 95% CI 0.14 to 0.68, P=.0034
Patient comfort Restless body movement (n) I: 9 of 20 C: 4 of 21 RR 2.4, 95% CI 0.86 to 6.46, P=.0940
Rigid and/or limited body movements I: 5 of 20 C: 17 of 21 RR 0.31, 95% CI 0.14 to 0.68, P=.0034
Time to procedure start Not reported |
|
|
Auerbach 2009 |
Type of study: RCT
Setting and country: Pediatric emergency department, US
Funding and conflicts of interest: financially supported through the NYU Pediatrics Joseph Dancis Trainee Research Fund.
No information about conflicts of interest |
Inclusion criteria: - age 5 to 18 years - undergoing venipuncture or peripheral venous cannulation
Exclusion criteria: - received another local anesthetic - signs of skin infection or pathology at insertion site - significant trauma or illness rewuiring rapid evaluation (Glasgow coma scale score < 15 and ⁄ or hemodynamically unstable) - altered sensorium - history of allergy to lidocaine - neurosensory deficit in the area of insertion - developmental delay precluding completion of the pain scale.
N total at baseline: 150 Intervention: 75 Control: 75
Important prognostic factors2: Age ± SD, years: I: 11.7 ± 4.0 C: 12.4 ± 4.2
Sex: I: 52% M C: 52% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Jet lidocaine at the proposed site of needle insertion. The jet lidocaine device contained 0.2 mL of 1% (2 mg) buffered lidocaine that was delivered via a carbon dioxide gas cartridge
|
Describe control (treatment/procedure/test):
Jet placebo at the proposed site of needle insertion. The placebo system was identical in appearance and sound production upon application and contained 0.2 mL of normal saline (preservative free, no benzyl alcohol) of equal (neutral) pH delivered at the same pressure.
|
Length of follow-up: 5 minutes after the needle insertion
Loss-to-follow-up: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
Incomplete outcome data: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy/Patient comfort Color analog scale (CAS) Pain Scores during needle insertion, mean (95% CI) I: 28 (21-35) mm C: 34 (27-41) mm p=.23, Student’s t-test
Time to procedure start Not reported |
|
|
Ferayorni 2012 |
Type of study: RCT
Setting and country: Pediatric emergency department, US
Funding and conflicts of interest: Supported by the Phoenix Children’s Hospital Fellowship Research Fund.
The authors declare no conflict of interest. |
Inclusion criteria: - infants < 3 moths old - weight > 4kg - presenting to ED - febrile illness - meeting clinical criteria for lumbar puncture
Exclusion criteria: - critical illness - required immediate resuscitation - developmental delay - caregiver did not speak English or Spanish
N total at baseline: 55 Intervention: 30 Control: 25
Important prognostic factors2: Age ± SD, days: I: 47.8 (SD not reported) C: 40.8 (SD not reported)
Sex: I: 47% M C: 50% M
Mean weight, kg: I: 4.6 (SD not reported) C: 4.8 (SD not reported)
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Single administration of J-Tip needle-free lidocaine delivery system (0.2 mg of 1% buffered lidocaine). Oral sucrose. |
Describe control (treatment/procedure/test):
Single administration of placebo needle-free infusion with an equivalent amount of sterile normal saline. Oral sucrose. |
Length of follow-up: No information
Loss-to-follow-up: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
Incomplete outcome data: Intervention: N 0 (%) Reasons (describe)
Control: N 0 (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Neonatal Facial coding system during needle insertion, m (SD) I: 4.1 (1.3) C: 4.8 (0.5) P=.01, Student t test or Mann-Whitney U test (unclear)
Patient comfort Duration of crying, seconds, m (SD) I: 38.5 (18.6) C: 48.8 (16.2) P=.04, Student t test or Mann-Whitney U test (unclear)
Time to procedure start 70% of the LPs were successful on the first attempt in both groups, data not reported |
|
|
Kim, 2012 |
Type of study: RCT
Setting and country: hospital, Korea
Funding and conflicts of interest: No information about funding or conflicts of interest |
Inclusion criteria: - ASA I - age 4-15 years - presenting for elective surgery
Exclusion criteria: - known sensitivity to any of the active or inactive ingredients in the active or placebo Patch - damaged, denuded, or broken skin at the designated patch site; - use of prescription-strength analgesic medication during the 24 h period prior to the procedure.
N total at baseline: 77 Intervention: 42 Control: 35
Important prognostic factors2: Age ± SD: I: 8.9 ± 2.7 C: 9.4 ± 5.4
Sex: I: 58% M C: 53% M
Mean weight, kg: I: 33.3 ± 10.8 C: 30.7 ± 9.9
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
5% lidocaine patch (Lidoderm) containing 700 mg of lidocaine in an aqueous base. Size of patch 10x14 cm. The lidocaine patch was activated and administered by removing the patch from its airtight pouch, peeling the release liner, and applying the patch to the skin on the wrist with a tape for a surgical drape |
Describe control (treatment/procedure/test):
The same patch was used, without removing the release liner. |
Length of follow-up:
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N 2(5%) Reasons (describe): inappropriate application of patch or failure or intravenous cannulation
Control: N 3(9%) Reasons (describe): inappropriate application of patch or failure or intravenous cannulation
|
Outcome measures and effect size (include 95%CI and p-value if available):
Efficacy Faces, Legs, Activity, Cry, and Consolability (FLACC) pain scale during venipuncture, median (25th–75th percentile) I: 0 (0–1) C: 4 (1–7) P<.001, Mann–Whitney U test
Patient comfort Not reported
Time to procedure start Not reported |
|
Notes:
-
Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
-
Provide data per treatment group on the most important prognostic factors ((potential) confounders)
-
For case-control studies, provide sufficient detail on the procedure used to match cases and controls
-
For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What can be done to make needle procedures in children as painless and comfortable as possible?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Johnson, 2021 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
Definitely yes;
Reason: Opaque, sealed envelopes were used and opened by an independent researcher. |
Probably yes;
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Probably yes;
Reason: Loss to follow-up was infrequent in intervention and control group. Adequate imputation methods (multiple imputation) were used. |
Definitely yes;
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
|
Tomassen, 2019 |
Definitely yes;
Reason: Central randomization with computer generated random numbers |
Definitely yes;
Reason: Opaque, sealed envelopes were used and opened by an independent researcher. |
Definitely no
Reason: Open-label trial (patients and health care providers not blinded), outcome assessors blinded (blinding of data collectors and analysts not reported) |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. Adequate imputation methods (multiple imputation) were used |
Definitely yes
Reason: All relevant outcomes were reported; |
Definitely yes;
Reason: No other problems noted |
LOW (mortality) Some concerns (body weight) HIGH (patient satisfaction) |
|
Abuelkheir, 2014 |
Probably yes;
Reason: Computer generated schedule |
No information
Reason: |
Probably yes
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Definitely yes
Reason: No loss to follow-up reported |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
|
Choi, 2016 |
Probably yes;
Reason: Computer generated random numbers |
No information
Reason: |
Probably yes
Reason: Patients, health care providers and outcome assessors blinded (blinding of data collectors and analysts not reported) |
Definitely yes
Reason: No loss to follow-up reported |
Definitely yes
Reason: All relevant outcomes were reported |
Probably no
Reason: No information about funding or conflicts of interest |
Some concerns
Reason: No information about funding or conflicts of interest |
|
Auerbach 2009 |
Definitely yes;
Reason: Off-site randomization with computer generated random numbers |
Definitely yes;
Reason: All devices were labeled as ‘‘study drug’’ with a randomly assigned number |
Probably yes
Reason: Patientsand health care providers were blinded. Outcomes were patient reported. Blinding of data collectors and analysts not reported. |
Definitely yes
Reason: No loss to follow-up reported |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No information about conflicts of interest |
LOW |
|
Ferayorni 2012 |
Probably yes
Reason: Block randomization at hospital pharmacy, method not further described. |
Definitely yes
Reason: The hospital pharmacy maintained randomization key until data analysis. |
Probably yes
Reason: Patients, healthcare providers, and data collectors blinded. Data analysts not blinded. |
Definitely yes
Reason: No loss to follow-up reported |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes;
Reason: No other problems noted |
LOW |
|
Kim, 2012 |
Probably yes
Reason: Computer-generated random numbers |
Definitely yes;
Reason: Sealed envelopes were used and opened by an independent researcher. |
Probably yes
Reason: Patients, healthcare providers, and data collectors blinded. Blinding of data analysts not reported. |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Probably no
Reason: No information about funding or conflicts of interest |
Some concerns
Reason: No information about funding or conflicts of interest |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Zempsky 2008 |
Intervention not in PICO |
|
Schmitz 2015 |
Intervention not in PICO |
|
Brenner 2013 |
Intervention not in PICO |
|
Sridharan 2018 |
Wrong scope - not only topical analgesics. Included studies also included in Shahid 2019 or older than 2008 |
|
Zempsky 2008a |
Intervention not in PICO |
|
Dziechciarz 2010 |
Not in English |
|
Lunoe 2015 |
wrong C: vapocoolant spray |
|
Ranjbar 2016 |
Not in English |
|
Shah 2015 |
Wrong I: breastfeeding, sucrose |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-08-2024
Beoordeeld op geldigheid : 02-07-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en/of analgesie bij kinderen.
Samenstelling werkgroep
- NVK: Dhr. Prof. dr. P.L.J.M. (Piet) Leroy, MUMC+ te Maastricht (voorzitter)
- NVK: Dhr. drs. M.S. (Şükrü) Genco, OLVG te Amsterdam
- NVK: Dhr. F.A.B.A. (Frank) Schuerman, Isala Kliniek te Zwolle
- Stichting Kind en Ziekenhuis: Mevr. H. (Hester) Rippen, Stichting Kind en Ziekenhuis te Utrecht
- NVAM: Dhr. L.W. (Werner) Visser MSc., UMC Utrecht te Utrecht
- Landelijke Vereniging Medische Psychologie: Mevr. B.W. (Brigitte) Thomassen, Prinses Máxima Centrum te Utrecht
- NVSHA: Mevr. drs. Y.M.E. (Yannick) Groutars, LUMC te Leiden
- NVA: Dhr. drs. M.P. (Mark) Hendriks, UMC Utrecht te Utrecht
- NVvH: Mevr. dr. C.M.G.J. (Claudia) Keyzer-Dekker, Erasmus MC Sophia Kinderziekenhuis te Rotterdam
- NVvR: Mevr. drs. A.G.M.M. (Rosanne) Koopman, Wilhelmina Kinderziekenhuis/Prinses Máxima Centrum te Utrecht
- V&VN: Dhr. F.J. (Frans) Luteijn MSc, Amsterdam UMC te Amsterdam
- LVMP: Mevr. MSc S.E.M. (Sophie) Verbeek, Amsterdam UMC te Amsterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Leroy |
Kinderarts-Intensivist - MUMC+ Maastricht Hoogleraar in de Procedurele Sedatie/Analgesie bij kinderen (PROSA) – Universiteit Maastricht Directeur Procedurele Sedatie Unit voor Kinderen - MUMC+ Maastricht
|
Editor European Journal of Pediatrics (betaald) Board Member van de International Committee for the Advancement of Procedural Sedation (ICAPS) - www.proceduralsedation.org. ICAPS is een onafhankelijke, non-profit organisatie bestaande uit een interdisciplinaire groep van experten op het vlak van procedurele sedatie bij volwassenen en kinderen (niet betaald) Course Director PROSA course. De PROSA course is een recent gebouwde 3-daagse cursus waarin zorgprofessionals de basis skills, vaardigheden en attitudes leren mbt procedureel comfort bij kinderen. In deze cursus komen ook basisaspecten van procedurele sedatie en analgesie aan bod. Deze cursus wordt georganiseerd door een non-profit stichting en financieel gesteund door de Charlie Braveheart foundation (www.charliebraveheart.com). Onderwijstaken voor deze cursus worden vergoed (betaald) Conference Director van het PROSA2020 congres (www.PROSA2020.com) (niet betaald) |
Ik ben van 2020-2025 als onderzoekspartner betrokken bij een Europees onderzoeksconsortium dat onderzoek doet naar een nieuwe Virtual reality tool voor procedurele pijnreductie bij kinderen. Het betreft een onderzoek dat gefinancierd wordt met een grant afkomstig van de EITHealth (European Institute of Innovation and Technology). De totale grootte van die grant bedraagt ongeveer 1,5 miljoen euro, waarvan ongeveer 350000 euro naar mijn eigen onderzoeksgroep gaat. Binnen Nederland en Europa word ik in het algemeen beschouwd als een van de experten op het vlak van PSA bij kinderen. Ook voor patiëntenorganisaties ben ik een boegbeeld geworden wanneer het gaat om pijn- en angstreductie bij kinderen ihkv medische verrichtingen. Dit komt ook omdat ik duidelijke standpunten inneem en daarover ook regelmatig communiceer, ook via social media. Ik meen dat mijn standpunten steeds gebaseerd zijn op een zorgvuldige lezing van de evidence en dat ze in lijn zijn met alle recent gepubliceerde richtlijnen op het vlak van PSA |
Geen actie |
|
Visser |
Opleider/adviseur Divisie Vitale Functies UMC Utrecht |
Commissielid sectie sedatie NVAM (onbetaald) Lid opleidingscommissie College Zorgopleidingen (CZO) (onbetaald) |
Ik ontvang geen research sponsoring van commerciële bedrijven en ben niet betrokken bij onderzoek van commerciële bedrijven. |
Geen actie |
|
Rippen |
Directeur Stichting Kind en Ziekenhuis (32 uur) Eigenaar Fiduz management (8-12 uur) (strategie, advies en projectmanagement) |
Lid Raad van Toezicht MEEr-groep • Lid Adviesraad Medgezel • Coördinator European Association for Children in Hospital (EACH) • Bestuurslid College Perinatale zorg (CPZ) • AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) • Penningmeester Ervaringskenniscentrum Schouders • Voorzitter Landelijke Borstvoedingsraad • Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg • Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg • Lid Algemene Ledenvergadering VZVZ • Lid beoordelingscommissie KIDZ |
Als congresdirecteur van het PROSA2020 congres krijg ik wel te maken met commerciële en farmaceutische bedrijven over mogelijke sponsoring contracten voor het PROSA2020 congres (www.prosa2020.com). Het totale bedrag van die sponsoring bedraagt < 30% van de totale congresbegroting. |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam 0,8FTE Unitleider Kindergeneeskunde |
Eigenaar Genco Med beheer bv GM BV is 100% aandeelhouder van de VATAN Kliniek BV Dienstbetrekking GencoMed B.V. 0,1FTE betaald Voorzitter St. Kindersedatie, onbetaald Congres directeur PROSA, Procedurele Sedatie en analgesie Congres, betaald Voorzitter St. Ontw. Kindergeneeskunde OLVG, onbetaald
|
Directie belangen bij eigen BV, maar geen relatie met de bezigheden van de werkgroep. Patenthouder van een medisch hulpmiddel voor het verrichten van circumcisies, geen relatie met bezigheden van de werkgroep |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg in Sophia Kinderziekenhuis ErasmusMC Rotterdam |
APLS-instructeur SSHK Riel, onkostenvergoeding wordt per dag gegeven |
|
Geen actie |
|
Hendriks |
Anesthesioloog Werkgever per 15 september 2020; UMC Utrecht, divisie vitale functies, afdeling anesthesiologie, subafdeling Wilhelmina Kinderziekenhuis. Lid Sedatiecommissie UMCUtrecht Werkgever tot 15 september 2020; RadboudUMC Nijmegen, afdeling anesthesiologie, pijn- en pallitatieve geneeskunde. |
April 2014 - maart 2020: bestuurslid en penningmeester Sectie KinderAnesthesiologie van de Nederlandse Vereniging voor Anesthesiologie (onbetaald) |
|
Geen actie |
|
Luteijn |
Sedatie Praktijk Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Intensive Care Kinderen, sedatie unit Verpleegkundig Specialist, Emma Kinderziekenhuis, Amsterdam UMC, locatie AMC, afdeling Kinderoncologie |
|
|
Geen actie |
|
Schuerman |
Kinderarts neonatoloog Isala Zwolle |
"Bestuurslid Stichting kindersedatie Nederland Doelstelling: het verzorgen van scholing ten aanzien van sedatie bij kinderen, alsmede het onderzoeken en promoten van onderzoek op het gebied van kindersedatie Ik kreeg een onkostenvergoeding" |
|
Geen actie |
|
Groutars |
SEH-arts, LUMC |
Lid sectie PSA van de NVSHA |
|
Geen actie |
|
Koopman |
"Waarnemend Radioloog Radboud UMC Fellow kinderradiologie UMCU" |
Commissie onderwijs kinderradiologie, onbetaald |
|
Geen actie |
|
Thomassen |
"Functie: Medisch Pedagogisch Zorgverlener
Werkgever: Prinses Máximacentrum Utrecht" |
Bestuurslid van de Landelijke vakgroep Medisch Pedagogische zorg |
Geen. De landelijke vakgroep is officieel geen beroepsorganisatie |
Geen actie |
|
Verbeek |
Gezondheidszorgpsycholoog K&J (BIG), Emma Kinderziekenhuis Amsterdam UMC |
Bestuurslid PROSA kenniscenturm (onbetaald) Docent PROSA-course (betaald) |
|
Geen actie |
|
Klankbordgroepleden |
||||
|
Oplaat |
Beleidsmedewerker Kinderthuiszorg (36u) |
Bestuurslid Kinderverpleegkunde.nl (onbetaald) |
|
Geen actie |
|
Engel-Meijers |
"Tandarts-pedodontoloog Amphia Ziekenhuis 0,3fte Tandarts-pedodontoloog V6-instelling Amarant 0,4fte Tandarts-pedodontoloog Kinderpraktijk Boxtel 0,025fte" |
"Bestuurslid CoBijt (Centraal overleg bijzondere Tandheelkunde) ontbetaald Commissie lid Horace Wells onbetaald" |
|
Geen actie |
|
Zirar-Vroegindeweij |
GZ Psycholoog bij het Erasmusmc-Sophia Kinderziekenhuis |
Geen |
|
Geen actie |
|
Schuiten |
Verpleegkundig specialist kindergeneenskunde OLVG |
"OLVG-onderwijs intern en extern over voorkomen va procedurele distress, deels betaald Prosa faculty, onderwijs over het voorkomen van procedurele diestress, deels betaald" |
|
Geen actie |
|
Versteegh |
"Klinisch Psycoloog Psychotherapeut Erasmus MC Sophia unit psychosociale zorg afd Kinder- cn Jeugdpsychiatrie" |
"Supervisor praktijkopleider leeromgeving psychologen Docent Rino" |
|
Geen actie |
|
Kanninga |
Arts voor Verstandelijk Gehandicapten (in opleiding tot voorjaar 2022) |
Faculty-member prosa2021 congres (betaald) |
Ik ben voorzitter van de junior-vereniging van AVG's in opleiding. Hierbij heb ik geen baat bij een bepaalde uitkomst. (Anders dan goede zorg voor deze specifieke doelgroep) |
Geen actie |
|
Van Gerwen |
Directer Vivre Kinderthuiszorg Directeur Villa Vivre Bestuurder 4kids2tell |
"Bestuurslid V&VN Kinderverpleegkunde (onbetaald) Bestuurslid/penningmeester BinkZ (onbetaald)" |
Geen financiële belangen |
Geen actie |
|
Mulder |
Anesthesioloog, Prinses Máxima Centrum |
Geen |
|
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door afgevaardigde patiëntenvereniging Stichting Kind & Ziekenhuis in de klankbordgroep. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling/wkkgz.html
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn conform het stroomschema, zie onderstaande tabel. In opdracht van de NVZ en de NVA is overigens in 2014 een onderzoek uitgevoerd door SEO Economisch Onderzoek om een schatting te maken van de effecten op kosten van de invoering van de vorige richtlijn procedurele sedatie en analgesie buiten de OK. Hieruit bleek dat de impact op kosten en de baten afhankelijk is van de procedure en de mate van centralisatie van deze procedures.
|
Module |
Uitkomst raming |
Toelichting |
|
Module: Farmacologische interventie Procedurele Analgesie: topicale pijnstilling (EMLA, Rapydan, J-tip) |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die procedurele sedatie en/of analgesie ondergaan. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Anesthesiologie, de Nederlandse Vereniging voor Kindergeneeskunde, de Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, de Nederlandse Vereniging van Anesthesiemedewerkers, de Vakgroep Medisch Pedagogische Zorg Nederland, de Nederlandse Vereniging van Spoedeisende Hulp Artsen, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Radiologie, Verpleegkundigen en Verzorgenden Nederland, Stichting Kind en Ziekenhuis, en de Inspectie Gezondheidszorg en Jeugd.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (Nederlandse Vereniging voor Anesthesiologie, 2012) op noodzaak tot revisie. Tevens zijn er via een enquête knelpunten aangedragen door stakeholders. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Richtlijn: NVA PSA kinderen |
|
|
Uitgangsvraag: Welke mogelijkheden zijn er om naald-gerelateerde procedures voor het kind zo pijnloos mogelijk en zo min mogelijk beangstigend te maken? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 8-2-2021 |
|
Periode: 2008- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
Voor deze vraag is gezocht met de volgende elementen: puncture, needle-related AND local anesthesia AND kinderen.
De SRs en RCTs zijn opgenomen in Rayyan. Indien nodig kunnen op een later moment de observationele studies worden toegevoegd. Het sleutelartikel wordt niet gevonden vanwege het studiedesign.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 8 februari 2021 met relevante zoektermen gezocht naar SRs en RCTs over de mogelijkheden om naald-gerelateerde procedures voor het kind zo pijnloos mogelijk en zo min mogelijk beangstigend te maken De literatuurzoekactie leverde unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
115 |
46 |
120* |
|
RCTs |
459 |
218 |
522* |
|
Observationele studies |
177 |
83 |
216 |
|
Overig |
|
|
|
|
Totaal |
|
|
642* |
* in Rayyan
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#17 |
#1 AND #16 |
2 |
|
#16 |
#11 OR #12 OR #13 |
751 |
|
#15 |
#13 NOT #12 NOT #11 OBS |
177 |
|
#14 |
#12 NOT #11 RCT |
459 |
|
#13 |
#7 AND #10 |
495 |
|
#12 |
#7 AND #9 |
531 |
|
#11 |
#7 AND #8 SR |
115 |
|
#10 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6340661 |
|
#9 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2500470 |
|
#8 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
533576 |
|
#7 |
#6 AND (1-1-2008)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1188 |
|
#6 |
#4 AND #5 |
1139 |
|
#5 |
infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab OR 'pediatrics'/exp |
4495155 |
|
#4 |
#2 AND #3 |
8097 |
|
#3 |
'analgesic agent'/exp AND (local*:ti,ab,kw OR topic*:ti,ab,kw) OR 'local anesthetic agent'/exp OR 'vascular guide wire'/exp OR 'injection device'/exp OR 'vapocoolant spray'/exp OR emla:ti,ab,kw OR rapydan:ti,ab,kw OR 'j tip':ti,ab,kw OR vapocoolant:ti,ab,kw OR (((topical OR local*) NEAR/3 ('pain relief' OR anesthe* OR anaesthe*)):ti,ab,kw) OR 'needle free':ti,ab,kw OR (((anesthetic OR anaesthetic) NEAR/3 (cream OR spray)):ti,ab,kw) |
339956 |
|
#2 |
'intravenous drug administration'/exp OR 'artery puncture'/exp OR 'lumbar puncture'/exp OR 'vein puncture'/exp OR 'immunization'/exp OR 'vaccination'/exp OR ('needle'/exp/mj AND 'injection'/exp/mj) OR 'injection pain'/exp OR 'injection site pain'/exp OR (((injection* OR needle*) NEAR/3 (pain OR fear OR related OR insertion OR punct*)):ti,ab,kw) OR 'guthrie test':ti,ab,kw OR 'heel prick':ti,ab,kw OR (((intramuscular OR 'intra muscular' OR arter* OR lumbar OR vein OR venous OR intravenous OR iv) NEAR/3 (access OR administration OR injection* OR infusion* OR medication* OR therapy OR transfusion OR cannulation OR catheter* OR prick*)):ti,ab,kw) OR 'blood draw*':ti,ab,kw |
996806 |
|
#1 |
needle AND related AND procedural AND pain AND clinical AND practice AND guideline |
7 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
12 not 11 not 10 OBS |
83 |
|
13 |
11 not 10 RCT |
218 |
|
12 |
6 and 9 |
171 |
|
11 |
6 and 8 |
257 |
|
10 |
6 and 7 SR |
46 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) |
3759717 |
|
8 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2087155 |
|
7 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
480758 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
502 |
|
5 |
limit 4 to yr="2008 -Current" |
539 |
|
4 |
1 and 2 and 3 |
1178 |
|
3 |
(exp Analgesics/ and (topic* or local*).ti,ab,kf.) or (exp Anesthetics, Local/ or exp Anesthesia, Local/) or emla.ti,ab,kf. or rapydan.ti,ab,kf. or j tip.ti,ab,kf. or vapocoolant.ti,ab,kf. or ((topical or local*) adj3 (pain relief or anesthe* or anaesthe*)).ti,ab,kf. or needle free.ti,ab,kf. or ((anesthetic or anaesthetic) adj3 (cream or spray)).ti,ab,kf. |
162856 |
|
2 |
exp Infusions, Intra-Arterial/ or exp Infusions, Intravenous/ or exp Infusions, Subcutaneous/ or exp Punctures/ or exp Immunization/ or ((injection* or needle*) adj3 (pain or fear or related or insertion or punct*)).ti,ab,kf. or guthrie test.ti,ab,kf. or heel prick.ti,ab,kf. or ((intramuscular or intra muscular or arter* or lumbar or vein or venous or intravenous or iv) adj3 (access or administration or injection* or infusion* or medication* or therapy or transfusion or cannulation or catheter* or prick*)).ti,ab,kf. or blood draw*.ti,ab,kf. |
597901 |
|
1 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2574655 |