Chirurgische benaderingswijze bij omgekeerde schouderprothese
Uitgangsvraag
Wat is de optimale chirurgische benaderingswijze voor plaatsing van een omgekeerde schouderprothese?
Aanbeveling
Kies bij plaatsing van een omgekeerde schouderprothese voor een deltopectorale of anterosuperior chirurgische benaderingswijze.
Overweeg bij de volgende gevallen een deltopectorale benadering:
- een grote critical shoulder angle;
- grote osteofyten ter hoogte van de onderzijde van de humeruskop;
- grote corpora libera in de sulcus bicipitalis;
- een os acromiale;
- een deficiënte subscapularispees.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het is tot op heden onbekend of er verschillen zijn in klinische uitkomsten bij de twee gebruikelijke chirurgische benaderingen voor het plaatsen van een omgekeerde schouderprothese. Er is literatuuronderzoek verricht naar de vergelijking tussen de anterosuperiore en de deltopectorale benadering. Op basis van deze studies is het onduidelijk of er een verschil is in de cruciale uitkomstmaat complicaties. Voor deze uitkomstmaat is een risicoverhouding gevonden in het voordeel van de deltopectorale benadering, maar de bewijskracht is zeer laag. Pijn, de andere cruciale uitkomstmaat, is niet beschreven in de geïncludeerde literatuur. De belangrijke uitkomstmaten konden de richting voor besluitvorming niet verder onderbouwen. Er leken geen verschillen te zijn tussen de benaderingswijzen op het gebied van scapular notching. De uitkomstmaten kwaliteit van leven en patiënttevredenheid werden in de geïncludeerde studies niet beschreven. De totale bewijskracht, de laagste bewijskracht voor de cruciale uitkomstmaten, is zeer laag, doordat het observationele data met kleine onderzoekspopulaties betreft. Op basis van deze resultaten is geen voorkeur aan te geven voor de anterosuperiore of deltopectorale benadering. Hier ligt een kennislacune. De aanbevelingen zullen daarom gebaseerd worden op aanvullende argumenten waaronder expert opinion, waar mogelijk onderbouwd met (indirecte) literatuur.
Het voordeel van de AS-benadering bij een gescheurde geretraheerde rotator cuff craniaal (supra- en infraspinatuspeesruptuur) is dat de subscapularispees niet losgemaakt hoeft te worden, omdat de onbedekte kop zich direct presenteert in de wond na losmaken van de deltoideus. Er is dus geen additionele schade aan subscapularispees (betere endorotatiefunctie) en een kleinere kans op postoperatieve luxatie. Nadelen van de AS-benadering zijn dat deze toegang (lang) niet voor alle indicaties een geschikte techniek is. Bovendien is er meer risico op notching (door niet optimale plaatsing glenoidcomponent), is er meer risico op deltoideuszwakte (door losmaken van deze spier) en de operatie kan lastiger zijn in verband met beperkt zicht of werkruimte tijdens de ingreep met als gevolg malpositie van de prothese (Beeler, 2018).
De DP-benadering kan voor elke indicatie voor een omgekeerde prothese gebruikt worden. Voordeel van de DP-benadering is verder dat de deltoideus ongeschonden blijft.
De nadelen van de DP-benadering zijn, dat wanneer de subscapularispees moet worden doorgenomen, deze daarna niet altijd te herstellen is (dit kan leiden tot endorotatiezwakte). Verder is er een hogere luxatiekans (naar anterieur) en kan de operatie lastiger zijn door minder goede toegang tot het glenoid (bijvoorbeeld bij fors gespierde habitus).
Gebaseerd op expert opinion hebben onderstaande situaties de voorkeur om technische redenen te kiezen voor een DP benadering:
- een grote critical shoulder angle (acromion dat de humeruskop ver naar lateraal overdekt). Dit beperkt de werkruimte voor de AS-benadering sterk (Beeler, 2018; Moor, 2013);
- (grote) osteofyten aan de caudale zijde van de humeruskop (operatieve bereikbaarheid);
- (grote) corpora libera in de sulcus caudaal (operatieve bereikbaarheid).
Een relatieve voorkeur voor de DP bestaat wanneer er sprake is van een deficiënte subscapularispees. In dat geval wordt bij een DP benadering geen weefselschade aan pezen toegebracht en wordt de deltoideus niet gecompromitteerd, zodat in theorie een snellere mobilisatie mogelijk is.
Een relatieve voorkeur voor de DP bestaat ook wanneer er sprake is van een os acromiale in verband met het risico op losraken van het betrokken botdeel bij manipulatie aan het acromion met als gevolg deltoideusinsufficientie.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het doel van het plaatsten van een omgekeerde schouderprothese is pijnbestrijding, het herstel van de functie van de arm en daarmee het functioneren in het algemeen, het verbeteren van de kwaliteit van leven en het verbeteren van de zelfredzaamheid.
De chirurgische benaderingstechniek die hiervoor wordt gebruikt heeft mogelijk invloed op de immobilisatieduur, maar heeft geen invloed op de uitkomst, mits de juiste techniek gekozen wordt bij de individuele patiënt.
Kosten (middelenbeslag)
De chirurgische benadering bij het plaatsen van een omgekeerde schouderprothese heeft geen invloed op kosten van een operatie, ligduur of andere kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
De keuze voor een van de twee benaderingen is sterk afhankelijk van de indicatie en de ervaring van de chirurg. Bij een juiste keuze en juist uitgevoerde operatie is in theorie eenzelfde uitkomst te verwachten. Er zijn geen extra maatregelen nodig wat betreft opleiding, personeel, instrumentarium of nabehandeling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er kan op basis van wetenschappelijke literatuur geen duidelijke aanbeveling worden gedaan welke benaderingswijze bij het plaatsten van een omgekeerde schouderprothese de voorkeur heeft. Onderstaande aanbeveling is derhalve op basis van expert opinion. De keuze voor benaderingswijze dient gebaseerd te worden op basis van operatieve bereikbaarheid en de conditie van de subscapularispees van de specifieke patiënt.
Onderbouwing
Achtergrond
Er zijn twee gebruikelijke chirurgische benaderingen voor het plaatsen van een omgekeerde schouderprothese, anterosuperior (AS) en deltopectoraal (DP). Anterosuperior wordt ook weleens omschreven als superolateraal of Mackenzie benadering. Voor de duidelijkheid wordt hier verder gebruik gemaakt van anterosuperior.
Bij een gescheurde geretraheerde rotator cuff ligt de onbedekte kop direct onder de deltoideus en het acromion. Bij de AS-benadering wordt de pars anterior van de deltoideus losgemaakt van de voorrand van het acromion. Meestal kan de subscapularis pees intact gelaten worden. Dit in tegenstelling tot de DP-benadering waar, na openen van het deltopectorale interval en verwijdering van de bursa, de subscapularispees (gedeeltelijk) dient te worden losgemaakt. Het is onduidelijk welke benaderingswijze de beste uitkomst heeft voor de patiënt.
Conclusies / Summary of Findings
|
Very low GRADE |
It is unclear whether an anterosuperior approach compared with a deltopectoral approach leads to fewer complications in patients with reverse shoulder arthroplasty.
Sources: (Aibinder, 2018) |
|
Very low GRADE |
It is unclear whether an anterosuperior approach compared with a deltopectoral approach leads to less notching of the shoulder in patients with reverse shoulder arthroplasty.
Sources: (Aibinder, 2018; Levigne, 2008) |
|
- GRADE |
It is unknown whether pain, quality of life and patient satisfaction differ in patients undergoing reverse shoulder arthroplasty with the anterosuperior approach compared with the deltopectoral approach. |
Samenvatting literatuur
Description of studies
Aibinder (2018) performed a retrospective comparative cohort study in patients who underwent reverse total shoulder arthroplasty (RSA). The aim of the study was to compare glenoid baseplate position between the anterosuperior (AS) and deltopectoral (DP) approaches in relation to the surgeon’s experience and to evaluate the effect of placement on clinical outcomes. Patients who underwent primary RSAs for cuff tear arthropathy or osteoarthritis with a rotator cuff tear were included in the study. Arthroplasties performed for proximal humerus malunions, acute proximal humerus fractures, locked dislocations, humeral head avascular necrosis, and revisions were excluded. The intervention consisted of a RSA through an AS approach which requires splitting of the anterior and middle heads of the deltoid. In the control group the DP approach was performed using the extensile internervous plane between the anterior deltoid muscle and the pectoralis major muscle. A total of 87 shoulders were included in the intervention group and 22 shoulders were included in the control group. The mean age at surgery was 73.0 years (range, 50 to 90 years). The cohort included 46 men (42%) and 63 women (58%). The dominant extremity was involved in 69 (63%) shoulders. Mean body mass index was 29.0 kg/m2 (range, 16.8 to 47.1) in the AS group and 31.2 kg/m2 (range 21.5 to 40.7) in the DP group (P = 0.10). A minimum of 2-year radiographic follow-up was available for 65 shoulders (54 AS, 11 DP) with a mean of 3.4 years (range 2 to 10.3 years). A minimum of 2-year clinical follow-up was available for 78 shoulders (66 AS, 12 DP) with a mean of 3.7 years (range 2 to 9.9 years). Initial postoperative radiographs of all 109 shoulders were assessed for glenoid baseplate positioning.
Levigne (2008) performed a retrospective comparative cohort study in patients undergoing RSA. The aim of the study was to identify the causes and consequences of scapular notching in a large series in order to propose measures to prevent occurrence. Patients were included if they underwent RSA between 1991 and 2003. The study included 337 shoulders in 326 patients (64 men and 262 women) with an average age of 72 years (range 18-87 years); of these, 64% were sedentary, and 36% were active and involved in professional or leisure activities. A total of 269 shoulders (80%) were primary arthroplasty cases,
Results
Complications (critical)
Aibinder (2018) reported radiographic glenoid loosening as a complication. In the AS approach group 35 of the 87 shoulders (40.8%) had radiographic glenoid loosening in comparison with 6 of the 22 shoulders (27.3%) in the DP approach group. The risk ratio (RR) of 1.48, with a 95% confidence interval (CI) from 0.71 to 3.06, was clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome complications comes from an observational study and therefore starts low. The level of evidence was downgraded by one level because of the limited population size (imprecision), resulting in a level of evidence which was very low.
Pain (critical)
The included studies did not report any data for the outcome pain.
Level of evidence of the literature
The level of evidence could not be assessed because there were no comparative studies identified that reported the relevant outcomes with adequate data.
Notching (important)
Two studies reported scapular notching. Aibinder (2018) reported that notching was noted in 60 of the 87 (68.5%) shoulders in the AS approach group and in 16 of the 22 (72.4%) shoulders in the DP approach group. Levigne (2008) reported that notching occurred in 60 of the 70 (86%) shoulders in the AS group and 150 of the 267 (56%) shoulders in the DP group. The pooled risk ratio of 1.22 (95% CI 0.77 to 1.96) favouring the DP approach was not clinically relevant.
Figure 1 Scapular notching after reverse shoulder arthroplasty with the anterosuperior versus the deltopectoral approach
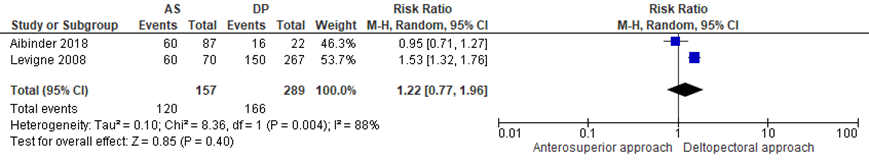
AS: anterosuperior; DP: deltopectoral; Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Level of evidence of the literature
The level of evidence regarding the outcome measure “notching” comes from observational studies and therefore starts low. The level of evidence was downgraded by one level because of the limited population size (imprecision), resulting in a level of evidence which was very low.
Quality of life (important)
There were no comparative studies identified that described the differences in quality of life between the approaches.
Level of evidence of the literature
The level of evidence could not be assessed because there were no comparative studies identified that reported the relevant outcomes with adequate data.
Patient satisfaction (important)
There were no comparative studies identified that described the differences in patient satisfaction between the approaches.
Level of evidence of the literature
The level of evidence could not be assessed because there were no comparative studies identified that reported the relevant outcomes with adequate data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (dis)advantages of the deltopectoral approach compared to the anterosuperior approach in reverse shoulder arthroplasty?
P: patients with an indication for reverse shoulder arthroplasty;
I: anterosuperior approach;
C: deltopectoral approach;
O: complications (luxation, muscle weakness), pain, notching, quality of life, patient satisfaction.
Relevant outcomes
The guideline development group considered complications and pain as critical outcomes for decision-making; and notching, quality of life, and patient satisfaction as important outcomes for decision-making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group used the GRADE-standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes (complications, notching), and 10% for continuous variables (pain, quality of life, patient satisfaction).
Search and select (Methods)
The databases Pubmed and Embase were searched with relevant search terms up to and including October 31, 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 221 hits. Studies were selected based on the following criteria: randomized controlled trials (when these were not available then comparative cohort studies), comparison of the anterosuperior and deltopectoral approach in patients with reverse shoulder arthroplasty. Initially, twelve studies were selected based on title and abstract screening. After reading the full text, ten studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included.
Results
Two studies (Aibinder, 2018; Levigne, 2008) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Aibinder, W. R., Clark, N. J., Schoch, B. S., & Steinmann, S. P. (2018). Assessing glenosphere position: superior approach versus deltopectoral for reverse shoulder arthroplasty. Journal of shoulder and elbow surgery, 27(3), 455-462.
- Beeler S, Hasler A, Götschi T, Meyer DC, Gerber C. Critical shoulder angle: Acromial coverage is more relevant than glenoid inclination. J Orthop Res. 2019 Jan;37(1):205-210. doi: 10.1002/jor.24053. Epub 2019 Jan 8. PubMed PMID: 29774949.
- Lévigne, C., Boileau, P., Favard, L., Garaud, P., Molé, D., Sirveaux, F., & Walch, G. (2008). Scapular notching in reverse shoulder arthroplasty. Journal of shoulder and elbow surgery, 17(6), 925-935.
- Moor BK, Bouaicha S, Rothenfluh DA, Sukthankar A, Gerber C. Is there an association between the individual anatomy of the scapula and the development of rotator cuff tears or osteoarthritis of the glenohumeral joint?: A radiological study of the critical shoulder angle. Bone Joint J. 2013;95-B(7):935‐941. doi:10.1302/0301-620X.95B7.31028
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Aibinder, 2018 |
Type of study: Retrospective comparative cohort study
Setting and country: single centre, United States of America
Funding and conflicts of interest: Scott P. Steinmann receives royalties from ZimmerBiomet and Arthrex and is a paid consultant for Arthrex. All the other authors, their immediate families, and any research foundations with which they are affiliated have not received any financial payments or other benefits from any commercial entity related to the subject of this article. |
Inclusion criteria: Patients that underwent primary RTSAs for cuff tear arthropathy or osteoarthritis with a rotator cuff tear were included in the study.
Exclusion criteria: Arthroplasties performed for proximal humerus malunions, acute proximal humerus fracture, locked dislocation, humeral head avascular necrosis, and revisions were excluded.
N total at baseline: Intervention: 87 shoulders Control: 22 shoulders
Important prognostic factors2: Mean age (range): 73.0 years (50-90 years)
Sex: 42% male
Mean body mass index (range): I: 29.0 kg/m2 (16.8-47.1) C: 31.2 kg/m2 (21.5-40.7) P= 0.10
Groups comparable at baseline? Yes
|
Describe intervention: Anterosuperior approach
|
Describe control: Deltopectoral approach
|
Length of follow-up: 2 years
Loss-to-follow-up (clinically follow-up): Intervention: 21 (24.1%) Reasons not reported
Control: 10 (45.5%) Reasons not reported
Loss-to-follow-up (radiographic follow-up): Intervention: 33 (38%) Reasons not reported
Control: 11 (50%) Reasons not reported
Incomplete outcome data: Intervention: 12 (13.8%) Reasons not reported
Control: 1 (4.5%) Reasons not reported |
Outcome measures and effect size (include 95%CI and p-value if available):
1. Complications Radiographic glenoid loosening I: 40.8% C: 27.3% P: 0.32
2. Patient satisfaction Not reported
3. Notching I: 68.5% C:72.4% P= 0.78
4. Pain P= 0.14
5. Function Elevation P= 0.54
External rotation P= 0.87
Internal rotation P= 0.94
6. Quality of live Not reported
|
Author’s conclusion: This study demonstrates that the AS and DP approaches are both reasonable and safe options in performing RTSA. This series shows no effect of the approach on glenoid baseplate positioning, clinical and functional outcomes, scapular notching, or deltoid function. |
|
Levigne, 2008 |
Type of study: Retrospective cohort study
Setting and country: unknown setting, France Funding and conflicts of interest: Not reported |
Inclusion criteria: Patients were included if they underwent RSA between 1991 and 2003.
Exclusion criteria: When it was a revision of a previous reverse arthroplasty, lsot to follow-up without adequate postoperative radiographic documentation and radiographic follow-up shorter than 24 months.
N total at baseline: N= 430 patients (457 shoulders)
Important prognostic factors2: Mean age (range): 72 years (18-87)
Sex: Male: 64 (19.6%) Female: 262 (80.4%)
Groups comparable at baseline? Unclear |
Intervention: Anterosuperior aproach |
Control: Deltopectoral approach |
Length of follow-up: Radiographic mean (range): 47 months (24-120 months)
Loss-to-follow-up: 56 patients Reasons not reported Incomplete outcome data: N=0 (0%) |
Outcome measures and effect size (include 95%CI and p-value if available):
1. Complications Not reported
2. Patient satisfaction Not reported
3. Notching I: 86% C: 56% P= <0.0001
4. Pain Not reported
5. Function Not reported
6. Quality of live Not reported
|
Author’s conclusion: Positioning of the baseplate definitely influences scapular notching. High positioning of the baseplate and superior tilting must be avoided. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question:
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Aibinder, 2018 |
Unlikely |
Likely |
Likely |
Likely |
|
Levigne, 2008 |
Unlikely |
Unclear |
Likely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alentorn-Geli (2015) |
Niet de juiste vergelijking (Deltopectoral approach in a prosthesis with a medialized centre versus Deltopectoral approach in prosthesis with a lateralized centre of rotation versus combination of approaches) |
|
Cowling (2017) |
Voldoet niet aan PICO, rapporteert verschil in complicaties tussen de benaderingswijze van alle operatie types (inclusief RSA, total shoulder arthroplasty, resurfacing arthroplasty en stemmed hemiarthroplasty) |
|
Lädermann (2011) |
Geen relevante uitkomstmaten |
|
Lädermann (2017) |
Voldoet niet aan PICO |
|
Lädermann (2018) |
Voldoet niet aan PICO |
|
Laver (2014) |
Narrative review, geen systematische review |
|
Mole (2011) |
Geen systematische review |
|
Nove-Josserand (2018) |
Narrative review, geen systematische review |
|
Samitier (2015) |
Niet de juiste vergelijking (Deltopectoral approach in a prosthesis with a medialized centre versus Deltopectoral approach in prosthesis with a lateralized centre of rotation versus combination of approaches) |
|
Seebauer (2005) |
Voldoet niet aan PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-11-2021
Beoordeeld op geldigheid : 11-10-2021
Algemene gegevens
De herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die een schouderprothese krijgen.
Werkgroep
- dr. J.J.A.M. van Raaij, orthopedisch chirurg bij Martini Ziekenhuis (voorzitter), NOV
- dr. T.D.W. Alta, orthopedisch chirurg bij Spaarne Gasthuis, NOV
- dr. C.P.J. Visser, orthopedisch chirurg bij Alrijne Ziekenhuis en Eisenhower Kliniek, NOV
- dr. O.A.J. van der Meijden, orthopedisch chirurg bij Albert Schweitzer Ziekenhuis, NOV
- dr. C. Th. Koorevaar, orthopedisch chirurg bij Deventer Ziekenhuis, NOV
- dr. H.J. van der Woude, radioloog bij OLVG, NVvR
- R. Schuurmans, Diagnostisch Fysiotherapeut en MSK echografist bij Flevoziekenhuis en Bergman Clinics Naarden, KNGF
- K.M.C. Hekman, fysiotherapeut en manueel therapeut bij Schoudercentrum IBC Amstelland, KNGF
- drs. G. Willemsen, voorzitter Nationale Vereniging ReumaZorg Nederland
- N. Lopuhaä, beleidsmedewerker Patiëntbelangen, ReumaNederland
Met ondersteuning van
- dr. M. de Weerd, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot september 2019)
- drs. T. Geltink, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot december 2020)
- dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Raaij (voorzitter) |
Orthopedisch chirurg Martini Ziekenhuis Groningen |
Opleider orthopedie Martiniziekenhuis Groningen; secretaris/vice voorzitter ROGO orthopedie Noordoost; voorzitter COC Martiniziekenhuis Groningen; lid regionale COC OOR Noordoost; secretaris concilium orthopedicum, lid RGS orthopedie; bestuurslid werkgroep schouder/elleboog NOV; lid LEARN Rijksuniversiteit Groningen (onderzoeksgroep opleiding/onderwijs); docent Hanzehogeschool Groningen; reviewer diverse orthopedische tijdschriften; beoordelaar/reviewer ingediende projecten ZonMW; lid editorial board Orthopedics (orthopedisch journal); voorzitter stichting ortho research noord (extern gefinancierd door Smith en Nephew en door wetenschapscommissie Martiniziekenhuis Groningen) |
Geen |
Geen actie |
|
Willemsen-de Mey |
Voorzitter Nationale Vereniging ReumaZorg Nederland |
Geen |
Geen |
Geen actie |
|
Lopuhaä |
Beleidsmedewerker Patiëntenbelangen ReumaNederland |
Geen |
Geen |
Geen actie |
|
Visser |
Orthopedisch chirurg Alrijne Ziekenhuis, Leiden |
Reviewer diverse orthopedische tijdschriften; |
Geen |
Geen actie |
|
Van der Meijden |
Orthopedisch chirurg; Albert Schweitzer Ziekenhuis Dordrecht |
Reviewer diverse orthopedische tijdschrijften |
Geen |
Geen actie |
|
Van der Woude |
Radioloog, Onze Lieve Vrouwe Gasthuis (Oost) Amsterdam |
Lid/consulent Nederlandse Commissie voor Beentumoren (onbezoldigd) |
Geen |
Geen actie |
|
Alta |
Orthopedisch chirurg Spaarne Gasthuis (Haarlem/Hoofddorp) |
Congres Commissie Nederlandse Vereniging voor Arthroscopie
Bestuurslid Europese schouder en elleboog society en hoofd Health Care Delivery committeer
Wetenschappelijke commissie wereld schouder en elleboog congres |
Geen |
Geen actie |
|
Koorevaar |
Orthopedisch chirurg Deventer Ziekenhuis |
Opleider Orthopedie Deventer Ziekenhuis. Reviewer diverse orthopedische tijdschriften. |
Geen |
Geen actie |
|
Schuurmans |
Flevoziekenhuis: Diagnostisch Fysiotherapeut en MSK echografist poli Orthopedie; Bergman Clinics: Diagnostisch Fysiotherapeut en MSK echografist op de schouderpoli van dr. van der List; |
Voorzitter Schouder Netwerk Flevoland (onbetaald) |
Geen |
Geen actie |
|
Hekman |
Fysio, -manueeltherapeut; Schoudercentrum IBC Amstelland Advanced clinical practioner; MC Jan van Goyen |
Bestuursvoorzitter Schouder Netwerken Nederland : onbetaald Gastdocent Nederlands Paramedisch Instituut : betaald |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties uit te nodigen voor een schriftelijke knelpuntenanalyse. Het verslag hiervan (zie bijlagen) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen. Bovendien werd het patiëntperspectief vertegenwoordigd door afvaardiging van patiëntenorganisaties ReumaNederland en Nationale Vereniging ReumaZorg Nederland in de werkgroep. Tot slot werden de modules voor commentaar voorgelegd aan Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die een schouderprothese krijgen. Tevens zijn er knelpunten aangedragen door stakeholders door middel van een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen in de bijlagen. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
- Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
- Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
October 31, 2019
Pubmed
("Arthroplasty, Replacement, Shoulder"(Mesh) OR "Shoulder"(Mesh) OR "Shoulder Injuries"(Mesh) OR "Rotator Cuff Tear Arthropathy"(Mesh) OR reverse shoulder arthroplast*(tiab) OR reverse shoulder replacement(tiab) OR reverse total shoulder arthroplast*(tiab) OR reverse total shoulder replacement(tiab) OR glenohumeral joint(tiab) OR humeroscapular joint(tiab) OR scapulo humeral joint(tiab) OR scapulohumeral joint(tiab) OR "rotator cuff tear arthropathy"(tiab) OR milwaukee shoulder(tiab) OR apatite-associated destructive arthritis(tiab) OR "cuff tear arthropathy"(tiab) OR shoulder(tiab) OR "cuff rupture"(tiab)) AND (("Deltoid Muscle"(Mesh) AND split*(tiab)) OR superolateral*(tiab) OR deltopectoral*(tiab) OR mackenzie(tiab) OR mckenzie(tiab) OR deltoid split*(tiab))
|
Search |
Query |
Items found |
|
Search #32 AND #33 |
||
|
Search #31 AND #33 |
||
|
Search #30 AND #33 |
||
|
Search #21 AND #28 Filters: Publication date from 2000/01/01 |
||
|
Search #21 AND #28 |
||
|
Search "Epidemiologic Studies"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) |
||
|
Search randomized controlled trial(pt) OR controlled clinical trial(pt) OR randomized(tiab) OR placebo(tiab) OR drug therapy(sh) OR randomly(tiab) OR trial(tiab) OR groups(tiab) |
||
|
Search ("Meta-Analysis as Topic"(Mesh) OR “Meta-Analysis”(Publication Type) OR metaanaly*(tiab) OR metanaly*(tiab) OR meta-analy*(tiab) OR meta synthes*(tiab) OR metasynthes*(tiab) OR meta ethnograph*(tiab) OR metaethnograph*(tiab) OR meta summar*(tiab) OR metasummar*(tiab) OR meta-aggregation(tiab) OR metareview(tiab) OR meta-review(tiab) OR overview of reviews(tiab) OR ((systematic*(ti) OR scoping(ti) OR umbrella(ti) OR meta-narrative(ti) OR metanarrative(ti) OR evidence based(ti)) AND (review*(ti) OR overview*(ti))) OR ((evidence(ti) OR narrative(ti) OR metanarrative(ti) OR qualitative(ti)) AND synthesis(ti)) OR systematic review(pt) OR prisma(tiab) OR preferred reporting items(tiab) OR quadas*(tiab) OR systematic review*(tiab) OR systematic literature(tiab) OR structured literature search(tiab) OR systematic overview*(tiab) OR scoping review*(tiab) OR umbrella review*(tiab) OR mapping review*(tiab) OR systematic mapping(tiab) OR evidence synthes*(tiab) OR narrative synthesis(tiab) OR metanarrative synthesis(tiab) OR research synthesis(tiab) OR qualitative synthesis(tiab) OR realist synthesis(tiab) OR realist review(tiab) OR realist evaluation(tiab) OR systematic qualitative review(tiab) OR mixed studies review(tiab) OR mixed methods synthesis(tiab) OR mixed research synthesis(tiab) OR quantitative literature review(tiab) OR systematic evidence review(tiab) OR evidence-based review(tiab) OR comprehensive literature search(tiab) OR integrated review*(tiab) OR integrated literature review(tiab) OR integrative review*(tiab) OR integrative literature review*(tiab) OR structured literature review*(tiab) OR systematic search and review(tiab) OR meta-narrative review*(tiab) OR metanarrative review(tiab) OR systematic narrative review(tiab) OR systemic review(tiab) OR systematized review(tiab) OR systematic research synthesis(tiab) OR bibliographic*(tiab) OR hand-search*(tiab) OR handsearch*(tiab) OR manual search*(tiab) OR searched manually(tiab) OR manually searched(tiab) OR journal database*(tiab) OR review authors independently(tiab) OR reviewers independently(tiab) OR independent reviewers(tiab) OR independent review authors(tiab) OR electronic database search*(tiab) OR (study selection(tiab) AND data extraction(tiab)) OR (selection criteria(tiab) AND data collection(tiab)) OR (selection criteria(tiab) AND data analysis(tiab)) OR (evidence acquisition(tiab) AND evidence synthesis(tiab))) NOT ("Comment" (Publication Type) OR "Letter" (Publication Type)) NOT (“Animals”(Mesh) NOT “Humans”(Mesh)) |
||
|
Search ("Deltoid Muscle"(Mesh) AND split*(tiab)) OR superolateral*(tiab) OR deltopectoral*(tiab) OR mackenzie(tiab) OR mckenzie(tiab) OR deltoid split*(tiab) |
||
|
Search "Arthroplasty, Replacement, Shoulder"(Mesh) OR "Shoulder"(Mesh) OR "Shoulder Injuries"(Mesh) OR "Rotator Cuff Tear Arthropathy"(Mesh) OR reverse shoulder arthroplast*(tiab) OR reverse shoulder replacement(tiab) OR reverse total shoulder arthroplast*(tiab) OR reverse total shoulder replacement(tiab)OR glenohumeral joint(tiab) OR humeroscapular joint(tiab) OR scapulo humeral joint(tiab) OR scapulohumeral joint(tiab) OR “rotator cuff tear arthropathy”(tiab) OR milwaukee shoulder(tiab) OR apatite-associated destructive arthritis(tiab) OR “cuff tear arthropathy”(tiab) OR shoulder(tiab) OR “cuff rupture”(tiab) |
Embase
|
No. |
Query |
Results |
|
#17 |
#6 AND #14 |
107 |
|
#16 |
#5 AND #14 |
41 |
|
#15 |
#4 AND #14 |
5 |
|
#14 |
#7 AND #12 |
378 |
|
#13 |
#3 NOT #12 (ruis, referenties over knie en heup, geen schouder) |
113 |
|
#12 |
#2 AND #11 |
496 |
|
#11 |
'reverse shoulder arthroplasty'/exp OR 'reverse shoulder arthroplast*':ti,ab OR 'reverse shoulder replacement':ti,ab OR 'reverse total shoulder arthroplast*':ti,ab OR 'reverse total shoulder replacement':ti,ab OR 'rotator cuff injury'/exp OR 'shoulder'/exp OR 'glenohumeral joint':ti,ab OR 'humeroscapular joint':ti,ab OR 'scapulo humeral joint':ti,ab OR 'scapulohumeral joint':ti,ab OR 'rotator cuff tear arthropathy'/exp OR 'milwaukee shoulder':ti,ab OR 'apatite-associated destructive arthritis':ti,ab OR 'cuff tear arthropathy':ti,ab OR 'shoulder':ti,ab OR 'irrepearable cuff rupture':ti,ab,kw OR 'shoulder disease'/exp |
124830 |
|
#10 |
#6 AND #7 |
134 |
|
#9 |
#5 AND #7 |
59 |
|
#8 |
#4 AND #7 |
7 |
|
#7 |
#3 AND (1-1-2000)/sd NOT 'conference abstract':it |
441 |
|
#6 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
5002314 |
|
#5 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2304314 |
|
#4 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
460187 |
|
#3 |
#1 AND #2 |
609 |
|
#2 |
superolateral*:ti,ab,kw OR 'deltopectoral approach'/de OR deltopectoral*:ti,ab,kw OR mackenzie:ti,ab,kw OR mckenzie:ti,ab,kw OR 'deltoid split*':ti,ab,kw OR 'mckenzie method'/exp OR ('deltoid muscle'/de AND split*:ti,ab,kw) |
3408 |
|
#1 |
'reverse shoulder arthroplasty'/exp OR 'reverse shoulder arthroplast*':ti,ab OR 'reverse shoulder replacement':ti,ab OR 'reverse total shoulder arthroplast*':ti,ab OR 'reverse total shoulder replacement':ti,ab OR 'rotator cuff injury'/exp OR 'shoulder'/exp OR 'glenohumeral joint':ti,ab OR 'humeroscapular joint':ti,ab OR 'scapulo humeral joint':ti,ab OR 'scapulohumeral joint':ti,ab OR 'rotator cuff tear arthropathy'/exp OR 'milwaukee shoulder':ti,ab OR 'apatite-associated destructive arthritis':ti,ab OR 'cuff tear arthropathy':ti,ab OR 'shoulder':ti,ab OR 'irrepearable cuff rupture':ti,ab,kw OR pseudopar*:ti,ab OR 'pseudoparalysis'/exp OR 'osteoarthritis'/de OR 'arthrosis':ti,ab OR 'degenerative joint disease':ti,ab OR 'osteo-arthritis':ti,ab OR 'osteo-arthrosis':ti,ab OR 'osteoarthritis':ti,ab OR 'osteoarthrosis':ti,ab OR 'shoulder disease'/exp |
250770 |
