Inleiden bij schouderdystocie
Uitgangsvraag
De module bevat de volgende uitgangsvragen:
- Wat is de waarde van inleiden ter voorkoming van een schouderdystocie bij verwachte foetale macrosomie?
- Wat is de waarde van inleiden ter voorkoming van een schouderdystocie bij een schouderdystocie in de anamnese?
Aanbeveling
Bespreek bij verwachte macrosomie dat de kans op schouderdystocie en complicaties daarvan mogelijk kleiner is bij inleiden voor de aterme datum, en bespreek de voor- en nadelen van zowel inleiden als expectatief beleid.
Bespreek met de vrouw met een schouderdystocie in de voorgeschiedenis het herhaalrisico van een schouderdystocie en bespreek de verschillende wijze van bevallen en maak samen een bevalplan.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de systematische literatuuranalyse komt de systematische review van Boulvain (2016) naar voren die vier gerandomiseerde studies includeert waarin de effecten van inleiden, na 37 en voor 39 weken, versus expectatief beleid worden onderzocht bij een verwachte foetale macrosomie. De studie van Boulvain (2015) weegt zwaar mee in de meta-analyse en beschrijft een onderzoekspopulatie die, gezien de modus partus (hoog percentage sectio’s), mogelijk niet de Nederlandse populatie reflecteert. De belangrijkste bevindingen zijn dat inleiden mogelijk een positief effect heeft op het voorkomen van schouderdystocie bij een verwachte foetale macrosomie (cruciale uitkomstmaat). De meta-analyse laat zien dat 24/590 (4,1%) kinderen met verwachte macrosomie een schouderdystocie hadden na inleiden, dit aantal was 41/600 (6,8%) na expectatief beleid. Verder laten de resultaten zien dat mogelijk ten gevolge van inleiden er minder kinderen met verwachte macrosomie een fractuur hebben in vergelijking met expectatief beleid (0,3% respectievelijk 2%). Er werden geen verschillen gevonden tussen inleiden versus expectatief beleid voor de uitkomsten: neonatale mortaliteit, plexusbrachialuslaesie , aantal kinderen met een apgarscore < 7, aantal kinderen met een late arteriële bloed pH (< 7,10), het aantal NICU-opnames en het aantal sectio’s.
Er zijn geen studies gevonden die het effect van inleiden versus expectatief beleid hebben onderzocht binnen een groep vrouwen met schouderdystocie in de anamnese. Het verhoogde risico op een herhaalde schouderdystocie varieert in de literatuur van 5 tot 12% (Colombara, 2011; Lewis, 1995; Meta, 2005; Overland, 2009; Smith, 1994). Een eerdere schouderdystocie wordt naast verwachte macrosomie als onafhankelijke voorspellende factor gezien (Usta, 2008). Het is aannemelijk dat inleiden bij deze groep mogelijk zorgt voor gunstige effecten (minder kans op opnieuw schouderdystocie door inleiden bij een verwacht kleiner kind), echter deze subgroep is niet onderzocht. Het is daarom onduidelijk of de voorgeschiedenis van een schouderdystocie alleen, zonder verdenking macrosomie, voldoende is voor het plannen van een eerdere inleiding. Een schouderdystocie is slecht voorspelbaar, omdat ook de grootte van het kind slecht voorspelbaar is. Omdat door een schouderdystocie complicaties kunnen optreden, zullen de opties rondom de partus, inclusief een inleiding, wel met de vrouw worden besproken.
De studie van Boulvain (2015) rapporteert dat kinderen gerandomiseerd in de groep ‘inleiding’ (met name kinderen ingeleid <38 weken) vaker fototherapie nodig hadden dan kinderen in de controlegroep (13% versus 7%). Overweeg daarom de noodzaak voor fototherapie mee te nemen in de afweging voor inleiden, en de timing daarvan, in het counselingsgesprek.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een belangrijk doel van inleiden bij een verwachte foetale macrosomie is het voorkómen van een schouderdystocie en het verkleinen van de kans op een sectio. Aangezien een schouderdystocie potentieel zeer ernstige complicaties kan hebben, is het van belang om bij een verwachte macrosomie samen met ouders in gesprek te gaan over al dan niet inleiden van de baring. Bij deze shared decision making hoort zowel het bespreken van de voor- en nadelen van een inleiding maar dienen ook de voor- en nadelen van het niet-inleiden te worden besproken. Deze overwegingen zullen per vrouw een andere waarde hebben. De kans op een sectio lijkt niet vergroot bij een inleiding in de aterme periode. Dit is door meerdere studies aangetoond, waaronder ook deze Cochrane-review van Boulvain.
Ook als er bij een vorige partus een schouderdystocie heeft plaatsgevonden is het het van belang met de ouders in gesprek te gaan over de komende partus. Afhankelijk van de morbiditeit die het vorige kind of de vrouw heeft opgelopen (lichamelijk en /of psychisch), is het van belang een passend plan te maken voor de komende partus met eventueel de mogelijkheid tot inleiden of het doen van een sectio.
Kosten (middelenbeslag)
Er is geen kostenanalyse gedaan voor inleiden versus expectatief beleid bij verwachte macrosomie. Wanneer een schouderdystocie voorkomen kan worden door middel van inleiden kunnen er potentieel veel kosten worden bespaard. Aan de andere kant zijn er meer kosten gebonden aan inleiden in vergelijking met expectatief beleid. Ook is niet bekend om hoeveel extra inleidingen het zou gaan.
Aanvaardbaarheid, haalbaarheid en implementatie
Inleiden kan mogelijk schouderdystocie voorkomen. Echter, er zullen ook vrouwen met verwachte macrosomie onnodig worden ingeleid om een schouderdystocie te voorkomen. Ook is bekend dat de inschatting van de grootte van het aterme kind lastiger en onbetrouwbaar is. Een echoscopische gewichtsschatting heeft een foutmarge van ongeveer 15% en uitwendige palpatie van de uterus is niet beter. Niet elk kind dat macrosoom wordt ingeschat is ook macrosoom en ook een niet-grootgeschattefoetus kan bij de geboorte macrosoom blijken. Bij een eerdere schouderdystocie in de anamnese zal de verloskundig hulpverlener per casus met de zwangere vrouw overwegen wat te doen bij de komende partus.
Een deel van de vrouwen zal onnodig worden blootgesteld aan een medische procedure (inleiding) als er een groot kind verwacht wordt. Dit kan mogelijk de aanvaardbaarheid van inleiden bij verdenking macrosomie schaden. Als er meer vrouwen worden ingeleid, heeft dit als consequentie dat er meer vrouwen naar de 2e lijn worden overgedragen, er meer zorgprofessionals nodig zijn rondom de zorg van een barende vrouw. Dit kan mogelijk een barrière vormen voor implementatie. Echter, gezien het feit dat schouderdystocie potentieel ernstige complicaties kan hebben en het lastig vooraf te voorspellen is, is het van belang dat de vrouw met een groot verwacht kind gecounseld wordt en samen met de hulpverlener een afgewogen keuze maakt passend bij de situatie en voorgeschiedenis van de vrouw.
Rationale van de aanbeveling
Inleiden heeft mogelijk een gunstig effect op het voorkomen van schouderdystocie (cruciale uitkomstmaat) bij een verwachte foetale macrosomie. Echter, dit is op basis van (zeer) lage bewijskracht. Daarnaast lijkt inleiden bij verwachte macrosomie geassocieerd met minder fracturen, eveneens met een lage bewijskracht. Inleiden voor 38 weken geeft een verhoogd risico op hyperbilirubinaemie bij de neonaat. (Boulvain, 2015) Er zijn geen studies verricht naar de voor- en nadelen van inleiden bij een schouderdystocie in de anamnese. Vanwege het verhoogde risico op schouderdystocie bij een schouderdystocie in de voorgeschiedenis is het verstandig de modus partus te bespreken, waarbij het inleiden van de baring één van de overwegingen is. In de studie van Boulvain (2015) werd ingeleid tussen 37 en 39 weken. De beste termijn voor inleiding wordt besloten in samenspraak met de vrouw waarbij individuele factoren zullen worden meegewogen.
Onderbouwing
Achtergrond
Van een schouderdystocie wordt gesproken als de zorgprofessional tijdens de uitdrijving van een kind in hoofdligging extra handgrepen moet toepassen om de schouders van het kind geboren te laten worden. Schouderdystocie ontstaat als de voorste, of zeldzamer, de achterste schouder van het kind haakt respectievelijk op de maternale symfyse of het sacrale promontorium en het vast komt te zitten. Er wordt grote variatie gerapporteerd in incidentie van schouderdystocie. Wanneer een schouderdystocie optreedt wordt er een verhoogde maternale/neonatale morbiditeit en mortaliteit gezien, ook al wordt deze tijdig en technisch correct opgelost. Voorbeelden van maternale morbiditeit zijn fluxus post partum en derde- en vierdegraadsperineumrupturen (OASIS: Obstetric Anal Sphincter Injuries). Een plexusbrachialuslaesie bij het kind is de meest belangrijke foetale complicatie. Schouderdystocie is slecht voorspelbaar.
De vraag is of eerder inleiden, wanneer het kind dus een lager geboortegewicht heeft, een schouderdystocie kan voorkómen. In deze module zal de plaats van inleiden worden onderzocht ter voorkoming van een schouderdystocie, waarbij specifiek aandacht is voor een verwachte foetale macrosomie of een schouderdystocie in de anamnese.
Conclusies / Summary of Findings
PICO 1
What are the benefits and harms of induction of labour at or near term to prevent shoulder dystocia in children with suspected fetal macrosomia?
|
Low GRADE |
Induction of labour, at term before 39 weeks, may reduce the number of children with shoulder dystocia compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may not reduce neonatal mortality compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may reduce the number of children with fractures (any) compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995) |
|
Very low GRADE |
It is unclear whether induction of labour, at term before 39 weeks, effects number of brachial plexus injuries compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term 39 weeks, may note reduce the number of children with an Apgar-score < 7 compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may not reduce the number of children with low arterial cord blood pH (< 7.10) compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may not reduce the number of NICU admissions compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may not reduce the number of caesarean sections compared to expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995) |
|
Low GRADE |
Induction of labour, at term before 39 weeks, may not reduce the number of third- and fourth-degree perineal tears compared with expectant management in women with suspected fetal macrosomia.
Bronnen: (Boulvain, 2015; Tey, 1995) |
PICO 2
What are the benefits and harms of induction of labour at or near term to prevent shoulder dystocia in women with history of shoulder dystocia?
|
- GRADE |
No GRADE assessment was done. There were no studies included that met the PICO criteria. |
Samenvatting literatuur
PICO 1
What are the benefits and harms of induction of labour at or near term to prevent shoulder dystocia in children with suspected fetal macrosomia?
De Cochrane review of Boulvain (2016) is used for the literature analysis. Boulvain (2016) assessed the effects of a policy of labour induction at term (37 to 40 weeks) for suspected fetal macrosomia on the way of giving birth and maternal or perinatal morbidity. Boulvain (2016) searched the Cochrane Pregnancy and Childbirth Group’s Trials Register (31 January 2016), contacted trial authors and searched reference lists of retrieved studies. They included randomised trials of induction of labour for suspected fetal macrosomia. In total, four trials involving 1190 women were included (Boulvain, 2015; Gonen, 1997; Libby, 1998 Tey, 1995). These four trials assessed induction of labour at 37 to 40 weeks for non-diabetic women when it was suspected that their baby was large. Women with diabetes were excluded from two of these trials (Gonen, 1997; Tey, 1995). In the Boulvain (2015) trial, women with diabetes treated with insulin were excluded, although 10% of included participants had gestational diabetes mellitus (GDM) controlled by diet. Limited information is available for the Libby (1998) pilot study. Boulvain (2016) searched for evidence on 31 October 2015. The studies were of moderate to good quality although it was not possible to blind the women and staff providing care to which group women had been assigned. The included studies compared induction of labour to expectant management. The following outcome measures were included: shoulder dystocia, fracture (any), brachial plexus injury, neonatal asphyxia, five-minute infant apgarscore (< 7), low arterial cord blood, third- and fourth-degree perineal tears (maternal outcome) and risk of caesarean section.
Results
Shoulder dystocia
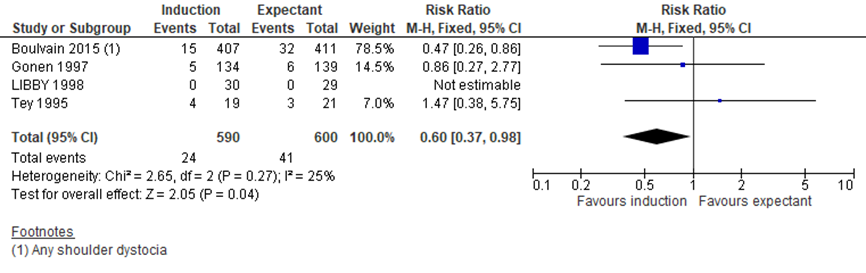
Boulvain (2016) included 4 trials assessing the difference in shoulder dystocia between the induction and expectant management group (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995). Meta-analysis showed 24/590 children (4.1%) with shoulder dystocia in de induction group and 41/600 children (6,8%) with shoulder dystocia in the expectant management group, RR= 0.60 (95%CI= (0.37; 0.98)), statistically more children with shoulder dystocia in de expectant management group (see Figure 1).
Figure 1 Forest plot with meta-analysis for the difference in shoulder dystocia between the induction and expectant management group
Neonatal mortality
Boulvain (2016) included 4 trials assessing neonatal mortality between the induction and expectant management group (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995). Meta-analysis showed 0/590 children died in de induction group and 0/600 children died in the expectant management.
Fracture (any)
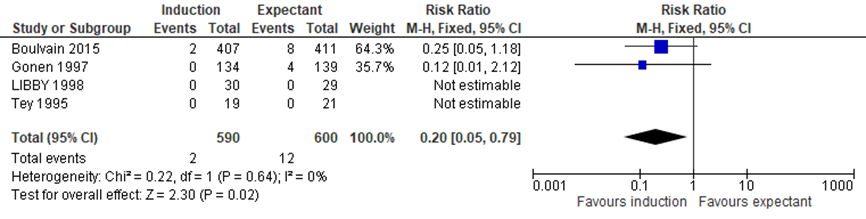
Boulvain (2016) included 4 trials assessing the difference in any fractures between the induction and expectant management group (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995). Meta-analysis showed 2/590 children (0.3%) with a fracture in de induction group, and 12/600 children (2%) with a fracture in the expectant management group, RR= 0.20 (95%CI= (0.05; 0.79)), statistically more children with fractures (any) in de expectant management group (see Figure 2).
Figure 2 Forest plot with meta-analysis for the difference in fractures (any) between the induction and expectant management group
Brachial plexus injury
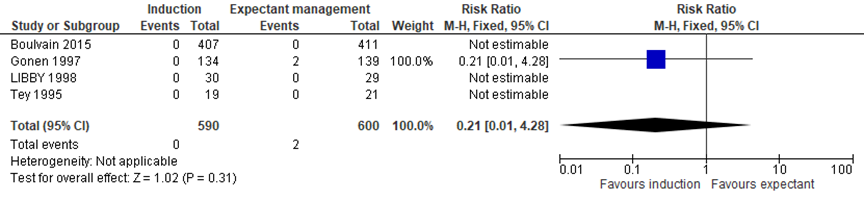
Boulvain (2016) included 4 trials assessing the difference in brachial plexus injuries between the induction and expectant management group (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995). Meta-analysis showed 0/590 children with a brachial plexus injury in de induction group, and 2/600 children (0.3%) with a brachial plexus injury in the expectant management group, RR= 0.21 (95%CI= (0.01; 4.28)), no statistically significant difference between groups (see Figure 3).
Figure 3 Forest plot with meta-analysis for the difference in brachial plexus injuries between the induction and expectant management group
Five-minute infant apgarscore (< 7)
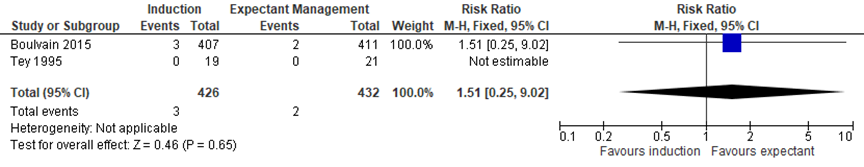
Boulvain (2016) included 2 trials assessing the difference in number of children with an Apgar-score < 7 between the induction and expectant management group (Boulvain, 2015; Tey, 1995). Meta-analysis showed 3/426 children (0.7%) with an apgarscore < 7 in the induction group, and 2/432 children (0.4%) with an Apgar-score < 7 in the expectant management group, RR= 1.51 (95%CI= (0.25; 9.02)), no statistically significant difference between groups (see Figure 4).
Figure 4 Forest plot with meta-analysis for the difference in number of children with an Apgar-score < 7 between the induction and expectant management group
Low arterial cord blood pH (< 7.10)
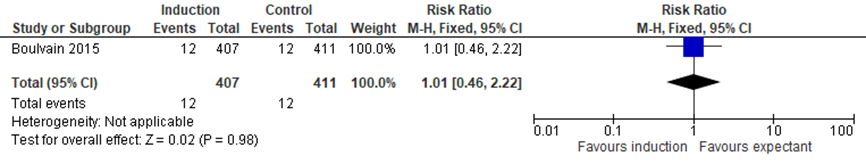
Boulvain (2016) included 1 trial assessing the difference in number of children with a low arterial cord blood between the induction and expectant management group (Boulvain, 2015). Analysis showed 21/407 children (2.9%) with a low arterial cord blood in the induction group, and 12/411 children (2.9%) with a low arterial cord blood in the expectant management group, RR= 1.01 (95%CI= (0.46; 2.22)), no statistically significant difference between groups (see Figure 5).
Figure 5 Forest plot with meta-analysis for the difference in number of children with a low arterial cord blood between the induction and expectant management group
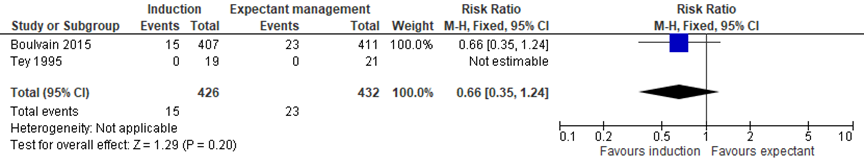
Admission to NICU
Boulvain (2016) included 2 trials assessing the difference in number of children admitted to the NICU between the induction and expectant management group (Boulvain, 2015; Tey, 1995). Meta-analysis showed 0/426 NICU admissions in the induction group, and 23/432 NICU admission (2.9%) in the expectant management group, RR= 0.66 (95%CI= (0.35; 1.24)), no statistically significant difference between groups (see Figure 6).
Figure 6 Forest plot with meta-analysis for the difference in NICU admissions between the induction and expectant management group
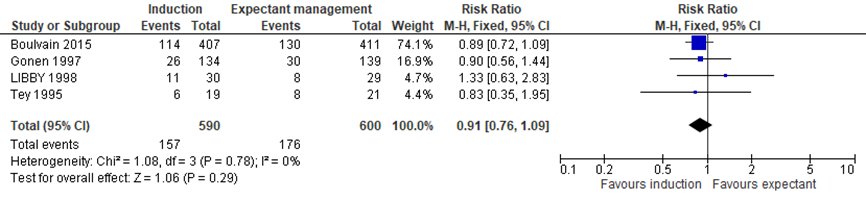
Caesarean section
Boulvain (2016) included 4 trials assessing the difference in caesarean section between the induction and expectant management group (Boulvain, 2015; Gonen, 1997; Libby, 1998; Tey, 1995). Meta-analysis showed 157/590 caesarean sections (26.6%) in the induction group, and 176/600 caesarean sections (29.3%) in the expectant management group, RR= 0.91 (95%CI= (0.76; 1.09)), no statistically significant difference between groups (see Figure 7).
Figure 7 Forest plot with meta-analysis for the difference in caesarean sections between the induction and expectant management group
Third- and fourth-degree perineal tears
Boulvain (2016) included 4 trials assessing the difference in third- and fourth-degree perineal tears between the induction and expectant management group (Boulvain, 2015; Tey, 1995). Meta-analysis showed 6/426 third- and fourth-degree perineal tears (1.4%) in the induction group, and 2/432 third- and fourth-degree perineal tears (0.5%) in the expectant management group, RR= 3.03 (95%CI= (0.62; 14.92)), no statistically significant difference between groups (see Figure 8).
Figure 8 Forest plot with meta-analysis for the difference in third- and fourth-degree perineal tears between the induction and expectant management group

Level of evidence of the literature
- The level of evidence regarding the outcome measure shoulder dystocia was downgraded because of imprecision (number of included patients), and risk of bias (blinding was not possible). The level of evidence was low GRADE.
- The level of evidence regarding the outcome measure neonatal mortality was downgraded because of imprecision (number of included patients) and risk of bias (blinding was not possible). The level of evidence was low GRADE.
- The level of evidence regarding the outcome measure fracture (any) was downgraded because of imprecision (number of included patients) and risk of bias (blinding was not possible). The level of evidence was Low GRADE.
- The level of evidence regarding the outcome measure brachial plexus injury was downgraded by two levels because of imprecision (number of included patients, single study) and risk of bias (blinding was not possible). The level of evidence was very low GRADE.
- The level of evidence regarding the outcome measure apgarscore < 7 was because of risk of bias (blinding was not possible) and imprecision (number of included patients, single study). The level of evidence was very low GRADE.
- The level of evidence regarding the outcome measure low arterial cord blood pH (< 7.10) was downgraded because of risk of bias (blinding was not possible), and imprecision (number of included patients, single study). The level of evidence was low GRADE.
- The level of evidence regarding the outcome measure NICU admissions was downgraded because of risk of bias (no blinded concealment allocation) and imprecision (number of included patients, single study). The level of evidence was low GRADE.
- The level of evidence regarding the outcome measure caesarean section was downgraded because of risk of bias (blinding was not possible) and imprecision (number of included patients). The level of evidence was low GRADE.
- The level of evidence regarding the outcome measure perineal tears was downgraded by two levels because of risk of bias (blinding was not possible), indirectness (study sample does not reflect target population) and imprecision (number of included patients, single study). The level of evidence was low GRADE.
PICO 2
What are the benefits and harms of induction of labour at or near term to prevent shoulder dystocia in women with history of shoulder dystocia?
There were no studies included (see the table with reasons for exclusion under the tab Methods).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following research questions:
PICO 1
What are the benefits and harms of induction of labour at or near term to prevent shoulder dystocia in children with suspected fetal macrosomia?
P: patients women giving birth to children with suspected fetal macrosomia;
I: intervention induction of labour;
C: control expectant management;
O: outcome neonatal outcomes: shoulder dystocia, brachial plexus injury, neonatal mortality, early neurodevelopmental morbidity, apgarscore, Low PH cord blood, birth trauma, NICU admission, death, disability in childhood.
maternal outcomes: harm to mother from intervention, maternal mortality, longer-term maternal outcomes (at three months), emergency caesarean section, post partum heamorrhage (TBL>1000ml), bloodtransfusion, thromboembolism, urinary retention requiring bladder catheter > 24 hours longer as local protocol prescribes, OASIS (Obstetric Anal Sphincter Injuries), breastfeeding failure, perineal pain, any pain, dyspareunia, urinary incontinence, flatus incontinence, faecal incontinence.
PICO 2
What are the benefits and harms of induction of labour at or near term to prevent shoulderdystocia in women with history of shoulderdystocia?
P: patients women giving birth with history of shoulder dystocia;
I: intervention induction of labour;
C: control expectant management;
O: outcome neonatal outcomes: brachial plexus injury, shoulderdystocia, offspring mortality, neurodevelopmental morbidity, apgarscore, birth trauma, NICU admission, disability in childhood.
maternal outcomes: harm to mother from intervention, longer-term maternal outcomes (at three months), emergency caesarean section, post partum heamorrhage (TBL>1000ml), bloodtransfusion, thromboembolism, urinary retention requiring bladder catheter > 24 hours longer as local protocol prescribes, OASIS (Obstetric Anal Sphincter Injuries), breastfeeding failure, perineal pain, any pain, dyspareunia, urinary incontinence,flatus incontinence, faecal incontinence.
Relevant outcome measures
The guideline development group considered offspring and maternal mortality, shoulder dystocia, brachial plexus injury as critical outcome measures for decision making; and disability in childhood, neurodevelopmental morbidity, apgar-score, NICU admissions as an important neonatal outcome for decision making. Macrosomia was undefined, we used the definition stated in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 2019-07-19. The literature search was updated at 2020-11-30. The detailed search strategy is depicted under the tab Methods. The systematic literature search (combined search PICO 1 and PICO 2) resulted in 218 hits. Studies were selected based on the following criteria, systematic review, RCTs, and cohort studies meeting the PICO criteria, published > 1990. 14 studies were initially selected based on title and abstract screening. After reading the full text, 13 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included. There was one study included in the analysis of the literature. Study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Boulvain M, Senat MV, Perrotin F, Winer N, Beucher G, Subtil D, et al. Induction of labour versus expectant management for large‐for‐date fetuses: a randomised controlled trial. Lancet 2015;385(9987):2600‐5.
- Boulvain M, Irion O, Dowswell T, Thornton JG. Induction of labour at or nearm term for suspected fetal macrosomia. Cochrane Database Syst Rev. 2016 May 22;(5):CD000938. doi: 10.1002/14651858.CD000938.pub2. Review. PubMed PMID:27208913.
- Ginsberg NA, Moisidis C. How to predict recurrent shoulder dystocia. Am J Obstet Gynecol. 2001 Jun;184(7):1427-9; discussion 1429-30. PubMed PMID: 11408863.
- Gonen O, Rosen DJD, Dolfin Z, Tepper R, Markov S, Fejgin MD. Induction of labor versus expectant management in macrosomia: a randomized study. Obstetrics & Gynecology 1997;89:913‐7.
- Kean LH. Leave alone or induce for the big baby (LIBBY). National Research Register. www.update‐software.com/NRR (accessed 10 September 2000).
- Tey A, Eriksen NL, Blanco JD. A prospective randomized trial of induction versus expectant management in nondiabetic pregnancies with fetal macrosomia (abstract). American Journal of Obstetrics and Gynecology 1995;172:293.
- Usta IM, Hayek S, Yahya F, Abu-Musa A, Nassar AH. Shoulder dystocia: what is the risk of recurrence? Acta Obstet Gynecol Scand. 2008;87(10):992-7. doi: 10.1080/00016340802415614. PubMed PMID: 18927947.
Evidence tabellen
Research question: What is the effect of calcium prophylaxis in pregnant women to prevent pre-eclampsia and preterm birth?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Boulvain, 2016
|
SR and meta-analysis of RCTs Literature search up to September 31 January 2016 A: Boulvain, 2015 B: Gonen, 1997 C: LIBBY, 1998 D: Tey, 1995 Setting and Country: A: France, Switzerland and Belguim B: Israel C: UK D: USA Source of funding and conflicts of interest: 10 A: grants from the National Board and the National Dairy Council. CoI: not stated. B: grants from the National Dairy Board and the National Dairy Council. CoI: not stated. C: a grant from the Queen Victoria Hospital Foundation and The D: not stated. COI: not stated
|
Inclusion criteria SR: all known randomised controlled trials evaluating labour induction for suspected fetal macrosomia. We planned to include cluster-randomised trials if any were identified.
Exclusion criteria SR: We planned to exclude quasi-randomised trials and studies using a cross-over design type of intervention. Important patient characteristics at baseline: A: 822 women randomised. Women with singleton fetus with cephalic presentation and no contraindications to vaginal delivery. Women were screened between 36-38 weeks' gestation and those with a fetus with an estimated weight above the 95th percentile at 37 to 38 weeks of gestation, confirmed clinically and then by sonography were included. B: 273 women with clinical or previous ultrasound suspicion of macrosomia, or with past history of macrosomia, underwent an ultrasound examination. Women were eligible if ultrasound estimated fetal weight, performed at 38 completed weeks or more, was between 4000 g and 4500 g. Women with diabetes, non-cephalic presentation, previous caesarean section, or indication for labour induction other than macrosomia were excluded. C: 40 women at 37 to 42 weeks, with an ultrasound estimated fetal weight between 4000 g and 4750 g.
D: Women 18-45 years age with large for gestational age or suspected macrosomic babies 38 to 40 + 3 weeks' gestation with singleton pregnancy, cephalic presentation with estimated fetal weight 3800 to 4500 g. Women with diabetes, major fetal malformation or previous caesarean birth excluded. Proposed sample: 474 women. |
A: Intervention: 409 women allocated to induction of labour. Labour was induced between 37+0 and 38+6 weeks and within 3 days or randomisation. The method of induction was at the discretion of the attending physician and according to local protocol. Women with unfavourable cervix had cervical ripening with misoprostol or PGE2 followed by oxytocin infusion if labour had not started. B: Immediate induction of labour using either oxytocin or prostaglandins according to cervical status. Women in the expectant management group: labour was induced at 42 completed weeks of gestation unless fetal distress was suspected. C: Immediate induction of labour using either oxytocin or prostaglandins. Women in the expectant management group: labour was induced at 42 completed weeks of gestation. D: Induction of labour was performed with PGE2 gel if the cervical status was unfavourable (Bishop score < 6), followed by oxytocin infusion.
|
A: Expectant management group B: Expectant management group C: Expectant management group D: Expectant management group
|
Endpoint follow-up: A-D: follow up until delivery
participants were no complete outcome data available: risk attrition/amount attrition?
A: 2 women in each group were lost to follow-up. Low risk. B: women in the expectant management group were lost to follow-up. C: Unclear risk; Loss to follow-up not reported D: Unclear. Loss to follow-up not reported
|
Outcome measure-1 Shoulder dystocia A: RR= 0.47 (0.26 – 0.86) B: RR= 0.86 (0.27- 2.77) C: Not estimatable D: RR= 1.47 (0.38 – 5.75) Total: 0.60 (0.37 - 0.98) Outcome measure-2 Neonatal mortality Intervention: 0/590 Expectant: 0/600 Outcome measure-3 Fracture A: RR= 0.25 (0.05 – 1.18) B: RR= 0.12 ( 0.01 – 2.12) C: not estimatable D: not estimatable Total: 0.20 (0.05 tot 0.79) Outcome measure-4 Brachial plexus injury A: not estimatable B: RR= 0.21 (0.01 – 4.28) C: not estimatable D: not estimatable Outcome measure-5 Five-minute infant Apgarscore s (<7) A: RR= 1.51 (0.25-9.02) B: not estimatable Outcome measure-6 Low arterial cord blood pH (<7.10) A: RR= 1.01 (0.46 – 2.22) Outcome measure-7 Admission to NICU A: RR= 0.66 (0.35 – 1.24) B: not estimatable Outcome measure-7 Caesarean section A: RR= 0.89 (0.72 – 1.09) B: RR= 0.90 (0.56 – 1.44) C: RR= 1.33 (0.63 – 2.83) D: RR= 0.83 (0.35 – 1.95) Total: RR= 0.91 (0.76 – 1.09)
Outcome measure-7 Third- and fourth-degree perineal tears A: RR= 3.70 ( 1.04, 13.17 ) C: not estimatable
|
Facultative: Induction of labour for suspected fetal macrosomia has not been shown to alter the risk of brachial plexus injury, but the power of the included studies to show a difference for such a rare event is limited. Also antenatal estimates of fetal weight are often inaccurate so many women may be worried unnecessarily, and many inductions may not be needed. Nevertheless, induction of labour for suspected fetal macrosomia results in a lower mean birthweight, and fewer birth fractures and shoulder dystocia. The unexpected observation in the induction group of increased perineal damage, and the plausible, but of uncertain significance, observation of increased use of phototherapy,both in the largest trial, should also be kept in mind. |
Table of quality assessment
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Boulvain 2018 |
Yes |
Yes |
Yes |
Yes (only description of individual calcium regimes is missing) |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Rydahl 2019 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Brown 2017 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Saccone 2016 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Jha 2016 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Dall'Asta 2016 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Rydahl 2014 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Gui 2013 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Eames 2013 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Bingham 2010 |
Narratieve review; studiepopulatie komt niet overeen met patiëntengroep uit PICO |
|
Caughey 2009 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Alwan 2009 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Tieu 2008 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Hankins 2006 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Sandberg 1999 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
|
Rydahl 2019 |
Studiepopulatie komt niet overeen met patiëntengroep uit PICO. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-10-2022
Beoordeeld op geldigheid :
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Inleiden bij schouderdystocie |
NVOG |
2020 |
2025 |
Elke 5 jaar |
NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Deze richtlijn is ontwikkeld in samenwerking met:
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Patiëntenfederatie Nederland
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor zwangere vrouwen met een kind met een dreigende schouderdystocie.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC locatie AMC, NVOG, (voorzitter, vanaf januari 2020)
- Dr. A.C.C. (Annemiek) Evers, gynaecoloog, werkzaam in het Universitair Medisch Centrum Utrecht, NVOG (voorzitter, tot december 2019)
- Drs. A. (Ayten) Elvan-Taspinar, gynaecoloog, werkzaam in het Universitair Medisch Centrum Groningen, Groningen, NVOG
- Dr. F. (Frédérique) van Dunné, gynaecoloog, werkzaam in het Medisch Centrum Haaglanden, Den Haag, NVOG
- Drs. A.J.M. (Anjoke) Huisjes, gynaecoloog-perinatoloog, werkzaam in de Gelre ziekenhuizen, Apeldoorn en omgeving, NVOG
- Dr. H.J.H.M. (Thierry) van Dessel, gynaecoloog, werkzaam in het Elisabeth- TweeSteden Ziekenhuis, Tilburg, NVOG
- J. (Julia) Bloeming, eerstelijns verloskundige , werkzaam in Verloskundigepraktijk Vechtdal in Hardenberg, KNOV
- MSc J.C. (Anne) Mooij, adviseur, Patientenfederatie Nederland
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis, NVOG, lid stuurgroep
- Dr. Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep
Meelezer
- Leden van de Otterlo- werkgroep (2019)
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Evers* |
Gynaecoloog, UMCU |
"Lid van Ciekwal, voorzitter 50 geboortemodules NVOG Werkgroep multidisciplinaire richtlijn extreme vroeggeboorte, NVOG" |
Geen |
Geen actie. |
|
Elvan-Taspinar
|
Gynaecoloog UMCG, Groningen |
Geen |
Geen |
Geen actie. |
|
van Dunné
|
Gynaecoloog Medisch Centrum Haaglanden, Den Haag |
Geen |
Geen |
Geen actie. |
|
Huisjes
|
Gynaecoloog Gelre Ziekenhuizen |
"Onderwijs coördinator Gelre ziekenhuizen (betaald) Voorzitter Stichting M.O.E.T. (onbetaald) Lid DB Stichting A.L.S.G. (onbetaald) Expertise-werkzaamheden (betaald) Klachtencommissie Gelre ziekenhuizen (betaald) Docent Opleiding tot Klinisch Verloskundige (Universiteit Utrecht) (betaald)" |
Geen |
Geen actie. |
|
Van Dessel
|
Gynaecoloog, Elisabeth- TweeSteden Ziekenhuis, Tilburg
|
Geen |
Geen |
Geen actie. |
|
Bloeming |
"Klinisch verloskundige praktijk Vechtdal in Hardenberg |
Geen |
Geen |
Geen actie. |
|
Mooij |
Adviseur Patientenbelang, Patientenfederatie Nederland |
Niet van toepassing |
Geen |
Geen actie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van patiëntvertegenwoordigers van verschillende patiëntverenigingen voor de Invitational conference en afvaardiging van patiëntenverenigingen in de clusterwerkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook ‘Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)’. De conceptrichtlijn wordt tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen (Vereniging van Ouders van Couveusekinderen (VOC) en Stichting Kind en Ziekenhuis).
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten rondom de zorg voor zwangere vrouwen met een kind met een dreigende schouderdystocie. Tevens zijn er knelpunten aangedragen door patiëntenverenigingen tijdens de Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1993 – juli 2019
|
1 (shoulder adj3 dystocia*).ti,ab,kw. (1349) 2 exp Labor, Induced/ or induc*.ti,ab,kw. or vaginal deliver*.ti,ab,kw. (2918803) 3 1 and 2 (412) 4 limit 3 to (english language and yr="1993 -Current") (358) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (401348) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1871699) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3210863) 8 4 and 5 (26) 9 4 and 6 (57) 10 9 not 8 (37) 11 4 and 7 (217) 12 11 not 8 not 10 (182) 13 8 or 10 or 12 (245)
= 245 |
421 (waarvan 230 over UV1a en 191 over UV1b) |
|
Embase (Elsevier) |
('shoulder dystocia'/exp OR ((shoulder NEAR/3 dystocia*):ti,ab)) AND ('labor induction'/exp OR induc*:ti,ab OR 'vaginal deliver*':ti,ab) AND (1993-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 50
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 80
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 262
= 392
|
|
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1993 – juli 2019
|
1 (shoulder adj3 dystocia*).ti,ab,kw. (1349) 2 exp Labor, Induced/ or induc*.ti,ab,kw. or vaginal deliver*.ti,ab,kw. (2918803) 3 1 and 2 (412) 4 limit 3 to (english language and yr="1993 -Current") (358) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (401348) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1871699) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3210863) 8 4 and 5 (26) 9 4 and 6 (57) 10 9 not 8 (37) 11 4 and 7 (217) 12 11 not 8 not 10 (182) 13 8 or 10 or 12 (245)
= 245 |
421 (waarvan 230 over UV1a en 191 over UV1b) |
|
Embase (Elsevier) |
('shoulder dystocia'/exp OR ((shoulder NEAR/3 dystocia*):ti,ab)) AND ('labor induction'/exp OR induc*:ti,ab OR 'vaginal deliver*':ti,ab) AND (1993-2019)/py AND (english)/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 50
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 80
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 262
= 392 |
