Behandeling Graves tijdens de zwangerschap
Uitgangsvraag
Wat is de meest optimale medicamenteuze behandeling bij een eerste episode van Graves’ hyperthyreoïdie tijdens de zwangerschap?
Aanbeveling
Behandel Graves’ hyperthyreoïdie tijdens de zwangerschap niet met block/replace, maar behandel met monotherapie.
Behandel Graves’ hyperthyreoïdie in het eerste trimester van de zwangerschap met PTU. Voor het vervolg van de zwangerschap is er geen voorkeur voor PTU of thiamazol.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op grond van de beschikbare literatuur zijn er ten aanzien van het risico op congenitale afwijkingen naar de mening van de werkgroep voldoende aanwijzingen om enige voorkeur voor PTU boven thiamazol als behandeling bij een eerste episode van thyreotoxicose tijdens de zwangerschap te adviseren. Voor de overige onderzochte maternale en perinatale uitkomsten heeft de werkgroep niet vastgesteld dat er een verschil is tussen PTU en thiamazol. De bewijskracht is voor de meeste uitkomsten als zeer laag gewaardeerd. Hierbij moet wel worden opgemerkt dat het niet meer als ethisch gezien kan worden om het in een RCT te onderzoeken. Met observationeel onderzoek is het echter zeer lastig om tot een hogere bewijskracht te komen.
Het risico op congenitale aandoeningen was verhoogd bij het gebruik van thiamazol ten opzichte van geen thyreostaticum en is als laag gewaardeerd. Dit waren afwijkingen aan de foetale schedel, aplasia cutis, en ook andere congenitale aandoeningen zoals oesofagusatresie en choane-atresie. Eenzelfde associatie werd gevonden voor PTU gebruik, maar dit effect was aanzienlijk kleiner. Daarnaast lijken de beschreven congenitale afwijkingen ernstiger bij thiamazol. Gebruik van PTU geeft echter weer een risico op acuut leverfalen, maar dit risico is zeer klein. Al met al hebben bovenstaande overwegingen, gezien de consistentie in de literatuur en de ernst van de uitkomsten, ondanks de lage bewijskracht geleid tot de huidige aanbeveling. De studies hebben overigens niet gekeken in hoeverre iemand goed was ingesteld, zodat de bijdrage van een slechte regulatie op het ontstaan van congenitale afwijkingen niet kan worden beoordeeld. Chirurgie dient overwogen te worden in geval van allergieën of bij een contra-indicatie voor thyreostatica, bij vrouwen die hoge doses thyreostatica behoeven en bij patiënten die niet therapietrouw zijn.
Waarden en voorkeuren van patiënten
Voor patiënten is er geen duidelijke voorkeur voor het gebruik van PTU of thiamazol.
Kosten (middelenbeslag)
De gemiddelde prijs per dag is voor PTU 0,11 euro en voor thiamazol 0,06 euro. De werkgroep is van mening dat het kostenaspect geen rol speelt in de geformuleerde aanbeveling.
Aanvaardbaarheid, haalbaarheid en implementatie
Omdat PTU minder vaak voorgeschreven wordt, heeft de werkgroep ervoor gekozen om een handvat te bieden aangaande de omzetting van thiamazol naar PTU en vice versa. Omdat studies ontbreken betreft het hier een handvat gebaseerd op de mening van de werkgroep.
Er zijn hier 3 scenario’s mogelijk:
- Voor de zwangerschap al behandeld voor M Graves.
- M Graves vastgesteld in het eerste trimester.
- M Graves vastgesteld na het eerste trimester.
Ad1: Indien mogelijk voorafgaand aan zwangerschap al behandelen met PTU in plaats van thiamazol, anders na bevestiging van zwangerschap thiamazol omzetten naar PTU (de relatieve werking van thiamazol versus PTU is 1:7,5 à 10; dat wil zeggen 10 mg thiamazol is vergelijkbaar met 75 à 100 mg PTU).
Ad2: Start met PTU. Vanaf week 12 tot 16 PTU eventueel omzetten naar thiamazol of anders doorbehandelen met PTU.
Ad3: Start met thiamazol in de laagst mogelijk dosering.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep adviseert PTU boven thiamazol voor de behandeling van een eerste episode van hyperthyreoïdie in het eerste trimester van de zwangerschap. Houdt er rekening dat bij een behandeling gedurende de zwangerschap de medicatie vaak verlaagd dan wel afgebouwd kan worden. Ondanks de zeer lage bewijslast is de werkgroep tot dit advies gekomen. Hier zijn twee belangrijke argumenten voor: 1. Er zijn geen nadelen aan het gebruik van PTU boven thiamazol vastgesteld. Acuut leverfalen is het enige bekende nadeel van PTU, maar dit risico is zeer klein: 2. Het belang van de uitkomst (optreden van congenitale afwijkingen) is groot.
Onderbouwing
Achtergrond
In de richtlijn Schildklierfunctiestoornissen (2012) wordt voor de behandeling van Graves’ hyperthyreoïdie in de zwangerschap gesteld dat zowel propylthiouracil (PTU) als thiamazol (= methimazol) gebruikt kan worden als monotherapie in de laagst mogelijke dosering. Behandeling met thyrostaticum in combinatie met levothyroxine (block/replace) wordt echter afgeraden tijdens de zwangerschap. Er zijn echter steeds meer aanwijzingen dat het gebruik van thiamazol in het eerste trimester de kans op congenitale afwijkingen verhoogt in vergelijking met PTU. De huidige ATA richtlijn (2017) spreekt dan ook een voorkeur uit voor het gebruik van PTU in de periode tot zwangerschapsweek 16. De voorliggende module geeft de meest recente stand van zaken weer bij vrouwen met een eerste episode van Graves’ hyperthyreoïdie.
Conclusies
Maternale morbiditeit
|
- GRADE |
Er zijn geen studies uitgevoerd naar het effect van PTU en thiamazol op maternale sterfte en morbiditeit. |
Aangeboren afwijkingen - Gebruik van thiamazol versus geen thyreostaticum
|
Laag GRADE |
Thiamazol resulteert mogelijk in meer aangeboren afwijkingen in vergelijking met geen thyreostaticum, maar het is onduidelijk hoe groot dit verschil is.
Bronnen: (Andersen, 2013; Chen, 2011; Gianantonio, 2001; Gianetti, 2015; Korelitz, 2013; Lo, 2015; Seo, 2018; Yoshihara, 2012) |
Aangeboren afwijkingen - Gebruik van PTU versus geen thyreostaticum
|
Zeer laag GRADE |
PTU resulteert mogelijk in meer aangeboren afwijkingen in vergelijking met geen thyreostaticum, maar het is onduidelijk hoe groot dit verschil is.
Bronnen: (Andersen, 2013; Chen, 2011; Gianetti, 2015; Korelitz, 2013; Lo, 2015; Rosenfeld, 2009; Seo, 2018; Yoshihara, 2012) |
Aangeboren afwijkingen - Gebruik van PTU versus thiamazol
|
Zeer laag GRADE |
Thiamazol resulteert mogelijk in meer aangeboren afwijkingen in vergelijking met PTU, maar het is onduidelijk hoe groot dit verschil is.
Bronnen: (Andersen, 2013; Chen, 2011; Clementi, 2010; Gianetti, 2015; Hawken, 2016; Korelitz, 2013; Lo, 2015; Seo, 2018; Yoshihara, 2012, Yoshihara, 2014) |
Vroeggeboorte - Gebruik van PTU/thiamazol versus geen thyreostaticum
|
Zeer laag GRADE |
PTU en/of thiamazol resulteren mogelijk niet in meer vroeggeboorte in vergelijking met geen thyreostaticum.
Bronnen: (Chen, 2011; Lo, 2015) |
Vroeggeboorte - Gebruik van PTU versus thiamazol
|
Zeer laag GRADE |
PTU resulteert mogelijk in minder vroeggeboorte in vergelijking met thiamazol, maar het is onduidelijk hoe groot dit verschil is.
Bronnen: (Chen, 2011; Yoshihara, 2012) |
Miskramen en perinatale sterfte
|
Zeer laag GRADE |
We zijn onzeker over het effect van PTU en thiamazol gebruik op miskramen en perinatale sterfte.
Bronnen: (Gianantonio, 2001; Yoshihara, 2012) |
Samenvatting literatuur
Beschrijving studies
Andersen (2013) ondernam een landelijke cohortstudie naar PTU- en thiamazolgebruik in vergelijking met geen thyreostaticum en het ontstaan van congenitale afwijkingen. Hierbij werd gebruik gemaakt van Deense registraties. Alle patiënten die een voorschrift voor PTU (n=564) en thiamazol (n=1097) hadden gedurende 6 maanden voor de zwangerschap tot de 10e week van de zwangerschap werden meegenomen. De controlegroep gebruikte geen thyreostaticum tijdens de zwangerschap, maar wel 12 maanden voor de zwangerschap en binnen 5 jaar na de geboorte (n=3543).
Chen (2011) heeft gebruik gemaakt van twee landelijke Taiwanese datasets, naar de gevolgen gebruik van PTU (n=630) en thiamazol (n=73) gedurende de zwangerschap in vergelijking met zwangere vrouwen met hyperthyreoïdie zonder thyreostaticum (n=2127). Vrouwen werden beschouwd als thyreostaticum gebruikers als ze minimaal 30 dagen een thyreostaticum gebruikten gedurende de zwangerschap (1e trimester n=581; 2e trimester n=102; 3e trimester n=20).
Clementi (2010) vergeleek PTU (n=47) en thiamazol (n=80) in het eerste trimester op het ontstaan van congenitale afwijkingen.
Gianantonio (2010) vergeleek vrouwen met hyperthyreoïdie die thiamazol gebruikten in de preconceptionele fase en/of het eerste trimester (n=241) met euthyreote vrouwen die geen thyreostaticum gebruikten (n=1089).
Gianetti (2015) voerde onderzoek uit naar PTU- (n=52) en thiamazolgebruik (n=124) gedurende het eerste trimester van de zwangerschap. De controlegroep zaten euthyreote vrouwen zonder thyreostaticum. Er werd in deze beide groepen gekeken naar het optreden van perinatale complicaties en congenitale afwijkingen.
Hawken (2016) voerde een onderzoek uit naar PTU- (n=7) en thiamazolgebruik (n=19) in het eerste trimester bij zwangere vrouwen met de ziekte van Graves.
Korelitz (2013) vergeleek zwangere vrouwen met een prescriptie voor PTU (n=1553) of thiamazol (n=1201), 6 maanden voor de zwangerschap of tijdens de zwangerschap, met zwangere vrouwen met hyperthyreoïdie zonder thyreostaticum (n=4902). Congenitale afwijkingen tot de leeftijd van 1 jaar werden meegenomen als uitkomstmaat.
Lo (2015) voerde een retrospectief cohort uit naar thyreostaticumgebruik bij zwangere vrouwen. Hierbij is onderscheid gemaakt tussen gebruik van PTU (n=30) en thiamazol (n=507) gedurende de gehele zwangerschap. Zwangere vrouwen met thyreotoxicose die geen thyreostaticum gebruikten (n=1171) dienden als controlegroep.
Rosenfeld (2009) voerde een prospectief cohortonderzoek uit naar PTU-gebruik tijdens het eerste trimester van de zwangerschap (n=180). De controlegroep waren euthyreote zwangere vrouwen die blootgesteld waren aan niet-teratogene producten zoals paracetamol (n=1066).
Seo (2018) vergeleek zwangere vrouwen met een prescriptie voor PTU (n=9930), thiamazol (n=1120) en met vrouwen zonder indicatie voor thyreostaticum (n=2.872.109) in het eerste trimester. Data werden verzameld middels een Koreaanse verzekeringsdatabase. Gedurende het eerste jaar werd gekeken naar het ontstaan van congenitale afwijkingen.
Yoshihara (2012) voerde een prospectieve cohortstudie uit in Japan naar thyreostaticumgebruik bij zwangere vrouwen met de ziekte van Graves. Alle vrouwen hadden hyperthyreoïdie, en werden ingedeeld in 3 groepen: vrouwen die PTU (n=1578), thiamazol (n=1426) of geen thyreostaticum (n=2065) kregen tijdens het eerste trimester.
Yoshihara (2014) heeft een retrospectief cohortonderzoek uitgevoerd naar vrouwen waarbij de ziekte van Graves werd gediagnosticeerd gedurende de zwangerschap (n=91). De diagnose is vooral gesteld tijdens het eerste (n=47) en tweede trimester (n=40). De vrouwen zijn behandeld met PTU (n=51) of thiamazol (n=40).
Een samenvatting van de geïncludeerde studies is weergegeven in Tabel 1. Alle studies beschrijven congenitale afwijkingen in de periode van 3 maanden tot 2 jaar na geboorte. Overigens vermelden niet alle studies de follow-up duur.
Tabel 1 Geïncludeerde studies en studiekarakterstieken
|
|
Medicatie |
Periode van medicatiegebruik |
Controlegroep |
|
Andersen, 2013 |
Thiamazol, n=1097 PTU, n=564 |
Preconceptioneel (6 maanden) tot 10e week zwangerschap |
Geen thyreostaticum, wel recept voor thyreostaticum <12 maand voor zwangerschap én <5 jaar na geboorte, n=3543 |
|
Chen, 2011 |
Thiamazol, n=73 PTU, n=630 |
1e n=581; 2e n=102; 3e n=20 |
Hyperthyreoïdie zonder thyreostaticum, n=2127 |
|
Clementi, 2010 |
Thiamazol, n=80 PTU, n=47 |
1e trimester |
- |
|
Gianantonio, 2001 |
Thiamazol, n=241 |
Preconceptioneel en/of 1e trimester |
Euthyreote vrouwen, n=1089 |
|
Gianetti, 2015 |
Thiamazol, n=124 PTU, n=52 |
1e trimester |
Euthyreote vrouwen, n=203 |
|
Hawken, 2016 |
Thiamazol, n=19 PTU, n=7 |
1e trimester |
- |
|
Korelitz, 2013 |
Thiamazol, n=1201 PTU, n=1553 |
Preconceptioneel (6 maanden) en/of gedurende de zwangerschap |
Hyperthyreoïdie zonder thyreostaticum, n=4902 |
|
Lo, 2015 |
Thiamazol, n=507 PTU, n=30 |
Hele zwangerschap |
Thyreotoxicose zonder thyreostaticum, n=1171 |
|
Rosenfeld , 2009 |
PTU, n=180 |
1e trimester |
Euthyreote vrouwen, n=1066 |
|
Seo, 2018 |
Thiamazol, n=1120 PTU, n=9930 |
1e trimester |
Euthyreote vrouwen, n=2,872,109 |
|
Yoshihara, 2012 |
Thiamazol, n=1426 PTU, n=1578 |
1e trimester |
Hyperthyreoïdie zonder thyreostaticum |
|
Yoshihara, 2014 |
Thiamazol, n=40 PTU, n=51 |
1e trimester, n=47 2e trimester n=40 |
- |
Resultaten
Maternale morbiditeit
Er zijn geen studies uitgevoerd naar thiamazol of PTU en maternale morbiditeit.
Congenitale afwijkingen
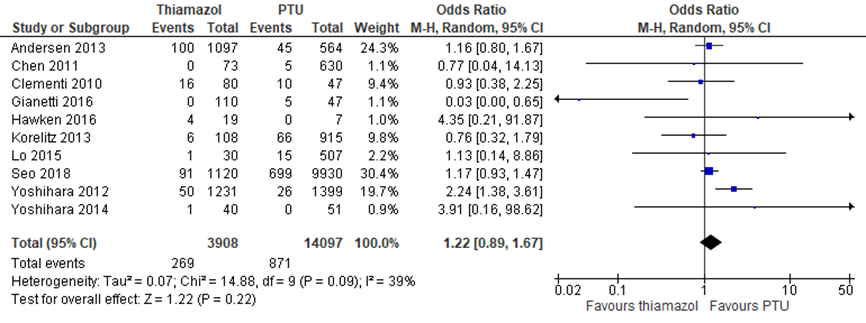
Het gebruik PTU en thiamazol op het ontstaan van congenitale afwijkingen is in 12 studies bestudeerd, waarbij verschillende vergelijkingen zijn gemaakt. Op basis van 8 studies is een meta-analyse uitgevoerd naar het effect van thiamazol versus geen thyreostaticum op congenitale afwijkingen. De Odds Ratio (OR) van 1,55 (95%-BI: 1,31 tot 1,84) geeft aan dat thiamazol een hoger risico geeft op congenitale afwijkingen (Figuur 1). PTU is niet geassocieerd met een hoger risico op congenitale afwijkingen in vergelijking met geen thyreostaticum, al lijkt er een voordeel te zijn voor geen thyreostaticum (OR 1,15 (95%-BI: 0,93 tot 1,43)) (Figuur 2). Ook bij de directe vergelijking tussen PTU en thiamazol lijkt er een trend te zijn in het voordeel voor PTU bij het risico op congenitale afwijkingen (OR 1,22 (95%-BI: 0,89 tot 1,67)) (Figuur 3).
Drie studies onderzochten thyreostaticumgebruik in de preconceptionele fase en/of tijdens de zwangerschap (Gianantonio, 2001; Korelitz, 2013; Andersen, 2013), dus deze vrouwen hebben mogelijk geen thyreostaticum gebruikt tijdens de zwangerschap. Exclusie van deze studies resulteert echter in vergelijkbare resultaten met een OR voor thiamazol in vergelijking met PTU van 1,40 (95%-BI: 1,00 tot 1,95). Bij studies die specifiek vrouwen met de ziekte van Graves hebben geïncludeerd (Hawken, 2010; Yoshihara, 2012; Yoshihara, 2014) vinden we eenzelfde resultaat voor PTU in vergelijking met thiamazol (OR 2,30 (95%-BI: 1,44 tot 3,67)). Exclusie van de studies met euthyreote controles (Gianantonio, 2001; Gianetti, 2016; Rosenfeld, 2009) resulteerde tevens in vergelijkbare ORs voor alle vergelijkingen.
Figuur 1 Thiamazol in vergelijking met geen thyreostaticum en aangeboren afwijkingen
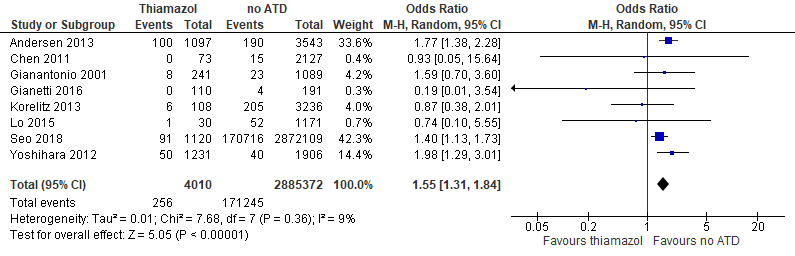
Figuur 2 PTU in vergelijking met geen thyreostaticum en aangeboren afwijkingen
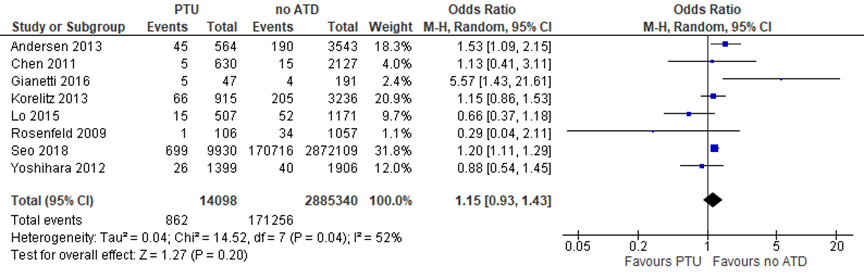
Figuur 3 Thiamazol in vergelijking met PTU gebruik en aangeboren afwijkingen
Vroeggeboorte
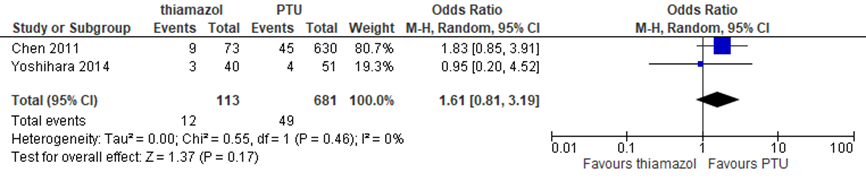
Twee studies onderzochten thiamazol en/of PTU in vergelijking met geen thyreostaticum. Er is geen verschil gevonden tussen thiamazol en/of PTU gebruik en het ontstaan van vroeggeboorte (OR 1,02 (95%-BI: 0,81 tot 1,28) (figuur 4). Daarbij zien we geen verschil tussen PTU en thiamazol gebruik, maar er lijkt een trend te zijn in het voordeel van PTU (OR 1,61 (95%-BI: 0,81 tot 3,19)) (figuur 5). Bij deze vergelijking zijn studies met euthyreote controles geexcludeerd (Rosenfeld, 2009).
Figuur 4 Thiamazol of PTU in vergelijking met geen thyreostaticum en vroeggeboorte

Figuur 5 Thiamazol in vergelijking met PTU gebruik en vroeggeboorte
Miskramen en perinatale sterfte
Yoshihara (2012) beschrijft perinatale sterfte en vindt vergelijkbare resultaten voor de PTU- (0,4%), thiamazol- (0,4%) en controlegroep (0,5%). De resultaten voor de relatie tussen thyreostaticum en miskramen staan beschreven in tabel 2.
Tabel 2 Thyreostaticum gebruik en het ontstaan van miskramen
|
|
PTU |
Thiamazol |
Geen thyreostaticum |
|
Gianantonio, 2001 |
- |
6,3% |
6,6% |
|
Yoshihara, 2012 |
10,5% |
11,3% |
- |
Bewijskracht van de literatuur
De bewijskracht voor observationele studies start op laag. De bewijskracht voor de uitkomstmaat ‘Aangeboren afwijkingen - Gebruik van thiamazol versus geen thyreostaticum’ is beoordeeld als laag. De bewijskracht voor de overige uitkomstmaten is met 1 niveau verlaagd tot zeer laag in verband met imprecisie.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van propylthiouracil (PTU) of thiamazol bij patiënten met Graves’ hyperthyreoïdie tijdens de zwangerschap?
P (Patiënt): vrouwen met Graves’ hyperthyreoïdie tijdens zwangerschap;
I (Interventie): propylthiouracil (PTU), thiamazol;
C (Controle): placebo, andersoortige behandeling, PTU versus thiamazol;
O (Outcome): maternaal: morbiditeit (zoals hypertensie, eclampsie, acuut leverfalen)
perinataal: miskraam, perinatale sterfte, aangeboren afwijkingen, vroeggeboorte.
Relevante uitkomstmaten
De werkgroep achtte maternale morbiditeit (zoals hypertensie, eclampsie en acuut
leverfalen), aangeboren afwijkingen, vroeggeboorte, miskraam en perinatale sterfte voor de
besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde congenitale afwijkingen als volgt: een bij de geboorte aanwezige afwijking, zoals bijvoorbeeld aplasia cutis congenita, craniofaciale misvormingen (choanale atresie, dysmorfie van het gelaat), exomphalos, oesofageale atresie, afwijking van de omfalomesenterische buis en ventriculair septumdefect.
De werkgroep definieerde vroeggeboorte als volgt: een vroeggeboorte is een bevalling bij een zwangerschapsduur van minder dan 37 0/7 weken.
Alle statistisch significante veranderingen werden als klinisch relevant beschouwd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 13 februari 2019 met relevante zoektermen gezocht naar studies over PTU of thiamazol gebruik tijdens de zwangerschap. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 160 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews, gerandomiseerd gecontroleerd onderzoek en observationeel vergelijkend onderzoek. Op basis van titel en abstract werden in eerste instantie 36 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 24 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 12 studies definitief geselecteerd.
Resultaten
12 onderzoeken zijn opgenomen in de literatuuranalyse. De studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen. Deze uitgangsvraag leent zich voornamelijk voor observationeel onderzoek.
Referenties
- 1 - Andersen, S. L., Olsen, J., Wu, C. S., & Laurberg, P. (2013). Birth defects after early pregnancy use of antithyroid drugs: a Danish nationwide study. The Journal of Clinical Endocrinology & Metabolism, 98(11), 4373-4381.
- 2 - Chen, C. H., Xirasagar, S., Lin, C. C., Wang, L. H., Kou, Y. R., & Lin, H. C. (2011). Risk of adverse perinatal outcomes with antithyroid treatment during pregnancy: a nationwide population‐based study. BJOG: An International Journal of Obstetrics & Gynaecology, 118(11), 1365-1373.
- 3 - Clementi, M., Di Gianantonio, E., Cassina, M., Leoncini, E., Botto, L. D., Mastroiacovo, P., & SAFE-Med Study Group. (2010). Treatment of hyperthyroidism in pregnancy and birth defects. The Journal of Clinical Endocrinology & Metabolism, 95(11), E337-E341.
- 4 - Di Gianantonio, E., Schaefer, C., Mastroiacovo, P. P., Cournot, M. P., Benedicenti, F., Reuvers, M., ... & Arnon, J. (2001). Adverse effects of prenatal methimazole exposure. Teratology, 64(5), 262-266.
- 5 - Gianetti, E., Russo, L., Orlandi, F., Chiovato, L., Giusti, M., Benvenga, S., ... & Regalbuto, C. (2015). Pregnancy outcome in women treated with methimazole or propylthiouracil during pregnancy. Journal of endocrinological investigation, 38(9), 977-985.
- 6 - Hawken, C., Sarreau, M., Bernardin, M., Delcourt, A. C., Muller, A., Lefort, G., ... & Marechaud, R. (2016, October). Management of Graves’ disease during pregnancy in the Poitou-Charentes Region. In Annales d'endocrinologie (Vol. 77, No. 5, pp. 570-577). Elsevier Masson.
- 7 - Korelitz, J. J., McNally, D. L., Masters, M. N., Li, S. X., Xu, Y., & Rivkees, S. A. (2013). Prevalence of thyrotoxicosis, antithyroid medication use, and complications among pregnant women in the United States. Thyroid, 23(6), 758-765.
- 8 - Lian, X. L., Bai, Y., Xu, Y. H., Dai, W. X., & Guo, Z. S. (2005). Effects of maternal hyperthyroidism and antithyroid drug therapy on congenital malformation of newborn infants. Zhonghua fu chan ke za zhi, 40(8), 511-515.
- 9 - Lo, J. C., Rivkees, S. A., Chandra, M., Gonzalez, J. R., Korelitz, J. J., & Kuzniewicz, M. W. (2015). Gestational thyrotoxicosis, antithyroid drug use and neonatal outcomes within an integrated healthcare delivery system. Thyroid, 25(6), 698-705.
- 10 - Rosenfeld, H., Ornoy, A., Shechtman, S., & Diav‐Citrin, O. (2009). Pregnancy outcome, thyroid dysfunction and fetal goitre after in utero exposure to propylthiouracil: a controlled cohort study. British journal of clinical pharmacology, 68(4), 609-617.
- 11 - Song, R., Lin, H., Chen, Y., Zhang, X., & Feng, W. (2017). Effects of methimazole and propylthiouracil exposure during pregnancy on the risk of neonatal congenital malformations: A meta-analysis. PloS one, 12(7), e0180108.
- 12 - Wing, D. A., Millar, L. K., Koonings, P. P., Montoro, M. N., & Mestman, J. H. (1994). A comparison of propylthiouracil versus methimazole in the treatment of hyperthyroidism in pregnancy. American journal of obstetrics and gynecology, 170(1), 90-95.
- 13 - Wu, D. B., Chen, E. Q., Bai, L., & Tang, H. (2017). Propylthiouracil-induced liver failure and artificial liver support systems: a case report and review of the literature. Therapeutics and clinical risk management, 13, 65.
- 14 - Yoshihara, A., Noh, J., Yamaguchi, T., Ohye, H., Sato, S., Sekiya, K., ... & Watanabe, N. (2012). Treatment of graves' disease with antithyroid drugs in the first trimester of pregnancy and the prevalence of congenital malformation. The Journal of Clinical Endocrinology & Metabolism, 97(7), 2396-2403.
- 15 - Yoshihara, A., Noh, J. Y., Watanabe, N., Iwaku, K., Kobayashi, S., Suzuki, M., ... & Sugino, K. (2014). Frequency of adverse events of antithyroid drugs administered during pregnancy. Journal of thyroid research, 2014.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
|
Andersen, 2013 |
Type of study: population based cohort study
Setting and country: Denmark
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: Danish nationwide register-based cohort study included live born children from 1996 to 2008.
Exclusion criteria: NA
N total at baseline: Intervention: 1,820 Control: 3,543
Important prognostic factors2: Maternal age no ATD: 25-29y: 32.7% 30-34y: 35.3% > 35y: 20.0% ATD: 25-29y: 31.0% 30-34y: 38.3% > 35y: 24.0%
Smoking during pregnancy No ATD: 24.5% ATD: 21.0%
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
We defined the child as exposed to maternal ATD in early pregnancy if the mother had at least 1 redeemed prescription of ATD in the time period ranging from 6 months before pregnancy start to the end of the 10th gestational week. |
Describe control (treatment/procedure/test):
no-ATD-exposure group (n=3543) as children born to mothers who had solely redeemed prescriptions of ATD more than 12 months before pregnancy start or more than 12 months and less than 5 years after birth of the child. |
Length of follow-up: up to 2 years.
Loss-to-follow-up: NA – selected on outcome
Incomplete outcome data: NA – selected on outcome
|
Outcome measures and effect size (include 95%CI and p-value if available):
Birth defects: PTU = 8% MMI = 9.1% MMI en PTU = 10.1% No ATD = 5.4% Non exposed = 5.7%
|
|
Chen, 2011 |
Type of study: case control (matched)
Setting and country: Taiwan
Funding and conflicts of interest: no funding source |
Inclusion criteria: - Singleton births and used prenatal care services from 1-1-2005 to 31-12-2005. - Documented diagnosis of hyperthyroidism in at least two separate medical encounters in the year before their delivery (n=2,830)
Exclusion criteria: Not described
N total at baseline: Intervention: 703 Control: 2,127
Important prognostic factors2: Matched on age (%): <20 0.95% 20-24: 10.92% 25-29: 36.64% 30-34: 36.15% >34: 15.34%
Groups comparable at baseline? Only overall baseline characteristics are described. |
Describe intervention (treatment/procedure/test):
MMI (n=73) PTU (n=630)
Defined as antithyroid drug for more than 30 days during pregnancy
|
Describe control (treatment/procedure/test):
Hyperthyroid women without ATD during pregnancy |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
No ATD = reference
Low birthweight (OR) PTU: 1.42 (1.02-1.99) PTU, adj 1.40 (1.00-1.96) MMI: 2.18 (1.01-4.48) MMI, adj 2.15 (0.98-4.45)
PTU: 0.93 (0.66-1.32) PTU, adj: 0.92 (0.66-1.31) MMI: 1.71 (0.83-3.49) MMI, adj: 1.60 (0.78-3.29)
Small for gestational age PTU: 1.05 (0.83-1.33) PTU, adj: 1.05 (0.83-1.32) MMI: 1.25 (0.70-2.22) MMI, adj: 1.25 (0.70-2.24)
Congenital anomalies PTU: 1.13 (0.41-3.11) PTU, adj: 1.10 (0.40-3.06) MMI: NA MMI, adj: NA
Adj= adjusted for mother’s highest educational level, anaemia, hyperlipidaemia, pregestational diabetes, pregestational hypertension, hyperemesis gravidarum and infant’s gender and birth order. |
|
Clementi, 2010 |
Type of study: case control study
Setting and country: USA
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: Liveborn infants, stillbirths, and terminations of pregnancy with a major birth defect and with a reported exposure to a medication during the first trimester, ascertained by one of the participating surveillance programs.
Exclusion criteria: Not described
N total at baseline: 18.131 cases with malformations and reported first-trimester exposure to medication (ATD, n=127). MMI: 80
Important prognostic factors2: No baseline table available.
Groups comparable at baseline? Not described |
Describe intervention (treatment/procedure/test):
First trimester ATD exposure (PTU/MMI)
|
Describe control (treatment/procedure/test):
None |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Congenital malformations: PTU: 10/47 |
|
Gianantonio, 2001 |
Type of study: prospective cohort study
Setting and country: European TIS
Funding and conflicts of interest: supported by Fondazione CARIVE |
Inclusion criteria:
Exclusion criteria: NA
N total at baseline: Intervention: 288 Control: 1089
Important prognostic factors: Not described
Groups comparable at baseline? Not described
|
Describe intervention (treatment/procedure/test):
all pregnant women who were referred to the TIS units participating in this study for risk assessment related to MMI use to treat their hyperthyroidism. |
Describe control (treatment/procedure/test):
The control group included 1,089 pregnant women who were referred to the TIS units because of exposure to nonteratogenic drugs |
Length of follow-up: 3-12 months
Loss-to-follow-up: 16% of the cases were lost to follow-up for the following reasons: changes of address, change of physician, failure to keep follow-up appointment, or no response to the request for follow-up data.
No loss to follow up in control group.
Incomplete outcome data: not described |
Outcome measures and effect size (include 95%CI and p-value if available):
Major malformation: I: 8/241 C: 23/1089 (live-births unknown) P=0.18
The proportion of spontaneous abortion in the patient group was not different compared with the control group (6.3% vs 6.6%). |
|
Gianetti, 2015 |
Type of study:
Setting and country: Italy
Funding and conflicts of interest: |
Inclusion criteria: The study included 169 hyperthyroid women with GD (n = 166) or TNG (n = 3)/
Exclusion criteria:
N total at baseline: Intervention: Control:
Important prognostic factors2: For example age ± SD: I: C:
Sex: I: % M C: % M
Groups comparable at baseline? |
Describe intervention (treatment/procedure/test):
1: MMI + euthyroid n=89 2: MMI + hypertheroid n=35 3: PTU + euthyroid n=32 4: PTU + hyperthyroid n=20 5: euthyroid + no ATD n=203
All women were treated with ATD at least through the whole first trimester of pregnancy. Either MMI (n = 124) or PTU (n = 52) was used based on the care-providing physicians
|
Describe control (treatment/procedure/test):
Euthyroid non-ATD Treated thyropathic Women (n = 203) |
Length of follow-up: Not described
Loss-to-follow-up: No loss to follow up
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Major congenital problems
Group 1 None Group 2 None Group 3 1 Turner syndrome 1 Down syndrome Group 4 1 Fetal goiter; 1 feeding problem; 1 born at 24 weeks of gestation, dead at his second day of life Group 5 1 Down syndrome; 1 Klinefelter syndrome; 1 genital malformation; 1 renal malformation |
|
Hawken, 2016 |
Type of study: retrospective cohort
Setting and country: France
Funding and conflicts of interest: no competing interest |
Inclusion criteria: Pregnant women with GD (progressive or not), treated with ATD and/or surgery and/or RAI therapy, discovered before or during pregnancy and followed by a hospital or open-care endocrinologist in the Poitou Charentes region.
Exclusion criteria: Hyperthyroidism linked to a disease other than GD, and patients followed by an endocri-nologist based outside the Poitou-Charentes region.
N total at baseline: 95 pregnancies of which 26 received MMI or PTU in first trimester.
Important prognostic factors2: No baseline table available.
Groups comparable at baseline? Not described |
Describe intervention (treatment/procedure/test):
PTU or MMI during first trimester
|
Describe control (treatment/procedure/test):
No control group |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
MMI: 4/19 PTU: 0/7 |
|
Korelitz, 2013 |
Type of study: Retrospectieve cohort study
Setting and country: Health insurance database study, USA
Funding and conflicts of interest: none |
Inclusion criteria: women aged 15–44 years who were enrolled for at least 24 months with prescription drug benefits and had at least two pregnancy-related medical service claims between 2005 and 2009.
Exclusion criteria: NA
N total at baseline: Intervention: MMI 1201 PTU 1533 MMI and PTU 590 Control: 4902
Important prognostic factors: not described
Groups comparable at baseline? unclear |
Describe intervention (treatment/procedure/test):
Prescription drug claims were used to determine ATD therapy. For medications such as MMI and PTU, a claim signifies that a prescription for the drug was dispensed. Prescriptions filled within 6 months before or during the pregnancy were used for analyses that focused on acute adverse events potentially associated with a specific pregnancy. |
Describe control (treatment/procedure/test):
No prescription for ATD |
Length of follow-up: up to 1 year
Loss-to-follow-up:
Incomplete outcome data:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Congenital malformation: MMI: 6/108 PTU: 66/915 MMI and PTU: 14/126 No ATD: 35/3526 |
|
Lo, 2015 |
Type of study: retrospective cohort
Setting and country: USA
Funding and conflicts of interest: national institute of health |
Inclusion criteria: - Pregnancies resulting in a live birth (1-1-1996 / 31-12-2010) among women aged 15-49 years. - We identified women with a hospitalization or ambulatory diagnosis of thyrotoxicosis with or without goiter, toxic diffuse goiter, or thyrotoxicosis without specified cause.
Exclusion criteria: Not estimated
N total at baseline: MMI, n=507 PTU, n=30 MMI & PTU, n=49 no ATD, n=1171
Important prognostic factors2: Maternal age: No ATD: 31.9 ± 5.3 ATD: 31.3 ± 5.7
Groups comparable at baseline? Yes, but described as ATD/no ATD. |
Describe intervention (treatment/procedure/test):
MMI (n=507) PTU (n=30) MMI &PTU (n=49) during pregnancy
|
Describe control (treatment/procedure/test):
Thyrotoxicosis diagnosis, no gestational ATD
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Congenital anomalies Rate per 1000 infants (95%CI) PTU 30 (17-48) MMI 33 (1-172) PTU/MMI 41 (5-140) No ATD 44 (33-58) |
|
Rosenfeld, 2009 |
Type of study: Prospective cohort study
Setting and country: Israeli Teratology Information Service
Funding and conflicts of interest: No conflict of interest |
Inclusion criteria: All women who contacted (directly or through their healthcare providers) the service between the years 1994 and 2004 for information about gestational exposure to PTU or non-teratogenic drugs.
Exclusion criteria: NA
N total at baseline: Intervention: Control:
Important prognostic factors2: Maternal age: I: 31 (28-35) C: 30 (27-33)
Previous miscarriages I: 29.1% C: 20.0%
Groups comparable at baseline? The women in the PTU group were significantly older and there was a higher proportion of past miscarriages. |
Describe intervention (treatment/procedure/test):
Women exposed to PTU between week 4 and 13.
|
Describe control (treatment/procedure/test):
Women consulting the TIS regarding exposures not known to be teratogenic, such as: antibiotics |
Length of follow-up: Our offspring follow-up in the index and control groups was preformed between the neonatal period and 6 years of age. However, in 65% of the PTU cases, it was carried out within the first 2 years of life.
Loss-to-follow-up: Not described
Incomplete outcome data: Not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
Major anomalies PTU: 1/106 No ATD: 34/1057
Preterm delivery PTU: 10/106 No ATD: 58/1057
Deliveries PTU: 102/115 No ATD: 1030/1141
Miscarriages/stillbirth PTU: 9/115 No ATD: 75/1141
Elective termination of pregnancy PTU: 4/115 No ATD: 35/1141
Median birth weight PTU: 3145 (2655-3537) No ATD: 3300 (2968-3600)
|
|
Seo, 2018 |
Type of study: Korea
Setting and country: Nationwide registry cohort
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: registered pregnancies between January 2008 and December 2014 in women aged 20 to 39 years who did not have prior childbirth records for at least 1 year before the date of delivery.
Exclusion criteria: NA
N total at baseline: Intervention: PTU, n=9930/ MMI, n=1120 Control:
Important prognostic factors: Maternal age no ATD: 25-29y: 30.3% 30-34y: 48.4% 35-39y: 15.9% ATD: 25-29y: 27.8% 30-34y: 50.5% 35-39y: 18.0%
Groups comparable at baseline? Not many characteristics are described |
Describe intervention (treatment/procedure/test):
A prescription claim for ATDs within 1 year before the date of delivery was used for analyses. The start date of a pregnancy was predefined as 38 weeks before the date of childbirth
We operationally defined a child as exposed to maternal ATDs in the first trimester if the mother had received at least 1 ATD prescription during the first trimester (from 26 to 38 weeks) before childbirth. |
Describe control (treatment/procedure/test):
Pregnancies in which women who had no prescription claims for ATDs from the beginning of pregnancy to the day before childbirth were categorized as a comparison cohort (n = 2 872 109). |
Length of follow-up: up to 1 year
Loss-to-follow-up: NA, registry study
Incomplete outcome data: NA, registry study
|
Outcome measures and effect size (include 95%CI and p-value if available):
First trimester: Congenital malformations No ATD: 5.9% PTU: 7.04% MMI: 8.13% MMI and PTU: 8.0% |
|
Yoshihara, 2012 |
Type of study: prospective cohort study
Setting and country: Japan
Funding and conflicts of interest: no competing financial interests |
Inclusion criteria: Women with Graves’ disease who became pregnant between January 1, 1999, and December 31, 2010. The diagnosis of Graves’ disease was based on the clinical examination and laboratory data
Exclusion criteria: Not described
N total at baseline: MMI, n=1426 PTU, n=1578 No ATD, n=2065
Important prognostic factors2: Maternal age, mean±SD: MMI: 31.8 ± 4.3 PTU: 32.9 ± 4.0 No ATD: 32.6 ± 4.3
FT4, mean ± SD: MMI: 1.29 ± 0.41 PTU: 1.41 ± 0.91 No ATD: 1.48 ± 0.81
Groups comparable at baseline? yes |
Describe intervention (treatment/procedure/test):
MMI, n=1426 PTU, n=1578 No ATD, n=2065
During first trimester
|
Describe control (treatment/procedure/test):
The remaining women had been treated with potassium iodide, levothyroxine, or more than one drug during the first trimester. |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
Birth weight MMI 2939 PTU 3005 No ATD 2990
Gestation length MMI 39 PTU 39.1 No ATD 39.1
Congenital malformations MMI 50 (4.1%) PTU 26 (1.9%) No ATD 40 (2.1%)
|
|
Yoshihara, 2014 |
Type of study: retrospective cohort study
Setting and country: Japan
Funding and conflicts of interest: no conflict of interest |
Inclusion criteria: 91 untreated pregnant women who came to our hospital for the first time and were newly diagnosed with GD during the period between January 1, 1999, and December 31, 2011.
Exclusion criteria: Gestational transient thyrotoxicosis was differentiated and excluded by the presence of TSH receptor antibody.
N total at baseline: MMI: 40 PTU: 51
Important prognostic factors2: age ± SD: MMI: 29.7 ± 4.9 PTU: 321 ± 4.7
Initial dose (mg/day): MMI: 30 (10-45) PTU: 300 (50-450)
Groups comparable at baseline? Only age and initial dose are described. |
Describe intervention (treatment/procedure/test):
MMI or PTU during pregnancy.
Started MMI: T1: 21/40 T2: 18/40 T3: 1/40
Started PTU: T1: 26/51 T2: 22/51 T3: 3/51
|
Describe control (treatment/procedure/test):
No control group. |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Outcome measures and effect size (include 95%CI and p-value if available):
MMI: 3/40, 7.5% PTU: 4/51, 7.8%
Congenital abnormality: MMI: 1/40 PTU: 0/51
Adverse events: MMI: 5/40 (12.5%), all cutaneous reactions. PTU: 5/51 (9.8%), hepatoxicity (n=2) and 3 with cutaneous reactions.
|
Risk of bias tabel: gerandomiseerd onderzoek
|
Study reference
|
Bias due to a non-representative or ill-defined sample of patients? |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups? |
Bias due to ill-defined or inadequately measured outcome ?
|
Bias due to inadequate adjustment for all important prognostic factors? |
|
Andersen, 2013 |
Unlikely |
Unlikely
Lost to follow up no described, but will not be different for cases and controls. |
Unlikely
Register based |
Likely
Baseline characteristics were comparable, but TSH unknown |
|
Chen, 2011 |
Unlikely
|
Unlikely
There was no follow up. |
Unlikely
Selected on outcome, therefore unlikely that outcome measurement were different for cases and controls. |
Unlikely
Adjusted the analysis for important prognostic factors. We used the crude analyses, but these were to adjusted analyses. |
|
Clementi, 2010 |
Unlikely
|
Unlikely
There was no follow up. |
Unlikely
Selected on outcome, therefore unlikely that outcome measurement were different for cases and controls. |
Likely
No adjustments for maternal age. |
|
Gianantonio, 2011 |
Unlikely |
Unlikely
Lost to follow up is limited. |
Unlikely
The interviewer was not aware whether the woman was a control or not. |
Likely
No adjustments for maternal age. |
|
Gianetti, 2015 |
Unlikely |
Unlikely
No lost to follow up |
Unlikely
Outcomes well documented |
Likely
No adjustments for maternal age. |
|
Hawken, 2016 |
Unlikely
|
Unlikely
There was no follow up. |
Unlikely
Selected on outcome, therefore unlikely that outcome measurement were different for cases and controls. |
Likely
No adjustments for maternal age. |
|
Korelitz, 2013 |
Unlikely |
Unlikely
Lost to follow up no described, but will not be different for cases and controls. |
Unlikely
Register based |
Likely
No adjustments for maternal age. |
|
Lo, 2015 |
Unlikely
|
Unlikely
There was no follow up. |
Unlikely
Selected on outcome, therefore unlikely that outcome measurement were different for cases and controls. |
Likely
No adjustments for maternal age. |
|
Rosenfeld, 2009 |
Unlikely |
Unlikely
There was no follow up. |
Unlikely
Probably not an issue for these outcome measurements. |
Likely
Maternal age and previous miscarriages were higher in the PTU group. |
|
Seo, 2018 |
Unlikely |
Unlikely
Lost to follow up no described, but will not be different for cases and controls. |
Unlikely
Register based |
Unlikely
Adjustments did not alter the association |
|
Yoshihara, 2012 |
Unlikely |
Unlikely
No loss to follow up. |
Unlikely
Probably not an issue for these outcome measurements. |
Likely
FT4 was higher in MMI and PTU group compared to control group. Numbers were not corrected for maternal age. |
|
Yoshihara, 2014 |
Unlikely
|
Unlikely
There was no follow up. |
Unlikely
Selected on outcome, therefore unlikely that outcome measurement were different for cases and controls. |
Likely
No adjustments for maternal age. |
Exclusietabellen
|
Auteur en jaartal |
Redenen van exclusie |
|
Andersen, 2014 |
Gebruikt dezelfde brondocumenten als Andersen, 2013 |
|
Andersen, 2016 |
Voldoet niet aan PICO – geen controle groep |
|
Anderson, 2017 |
Exclusie obv design - narratieve review |
|
Azizi, 2011 |
Exclusie obv design - narratieve review |
|
Barbero, 2008 |
Voldoet niet aan PICO – niet juiste patiëntengroep |
|
Chattaway, 2007 |
Exclusie obv design - narratieve review |
|
Delitala, 2018 |
Exclusie obv design - narratieve review |
|
Earl, 2010 |
Cochrane review – geen studies geincludeerd |
|
Earl, 2013 |
Cochrane review – geen studies geincludeerd |
|
Hackmon, 2012 |
Exclusie obv design - narratieve review |
|
Hackmon, 2013 |
Systematische review - individuele studies geïncludeerd |
|
Khan, 2017 |
Exclusie obv design - narratieve review |
|
Li, 2015a |
Systematische review - individuele studies geïncludeerd |
|
Li, 2015b |
Systematische review - individuele studies geïncludeerd |
|
Maia, 2013 |
Braziliaanse richtlijn |
|
Nygaard, 2015 |
Exclusie obv design - narratieve review |
|
Pearce, 2019 |
Exclusie obv design - narratieve review |
|
Song, 2017 |
individuele studies geïncludeerd |
|
Spencer, 2015 |
Voldoet niet aan PICO – nut van screening bekeken |
|
Szabo, 2005 |
Exclusie obv design - narratieve review |
|
Taylor, 2012 |
Exclusie obv design - narratieve review |
|
Ting, 2013 |
Exclusie obv design - narratieve review |
|
Tong, 2016 |
Voldoet niet aan PICO – studie naar subklinische thyroid dysfunctie |
|
Vissenberg, 2012 |
Exclusie obv design - narratieve review |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-07-2020
Laatst geautoriseerd : 01-07-2020
Geplande herbeoordeling : 01-01-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de NIV of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Goedgekeurd door:
- Nederlands Huisartsen Genootschap
- Schildklierorganisatie Nederland
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van behandeling van volwassen patiënten (leeftijd ≥18 jaar) met schildklierfunctiestoornissen. Doel van deze gedeeltelijke herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met schildklierfunctiestoornissen wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Werkgroep
- Prof. dr. E. Fliers (voorzitter vanaf 1 mei 2019), internist-endocrinoloog, NIV
- Prof. dr. R. Peeters (voorzitter tot 1 mei 2019), internist-endocrinoloog, NIV
- Dr. W.E. Visser, internist-endocrinoloog, NIV
- Dr. A. Roos, internist-endocrinoloog, NIV
- Dr. M. Medici, internist-endocrinoloog, NIV
- Dr. A.F. Muller, internist-endocrinoloog, NIV
- Prof. dr. O.M. Dekkers, internist-endocrinoloog en klinisch epidemioloog, NIV
- Dr. A.A. Bouman, SON
- R. Nix, SON (tot 1 september 2019)
Meelezers
- Dr. M.M.E. van Rumste, gynaecoloog, NVOG (vanaf 1 april 2019)
- Drs. M. Sijbom, huisarts, NHG (vanaf 1 juli 2019)
- Dr. S. van der Berg, klinisch chemicus, NVKC (vanaf 1 augustus 2019)
Met ondersteuning van
- Drs. L. Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.R. Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N.L. van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. E. Fliers, internist-endocrinoloog, NIV (voorzitter vanaf 1-5-2019) |
Hoofd- afdeling Endocrinologie en Metabolisme, Amsterdam UMC, Hoogleraar Endocrinologie UvA |
Board memberships, committees: - ETA guideline committee diagnosis and management of central hypothyroidism (2017-2018) - Executive Committee European Thyroid Association (tot 2019) - Program organizing committee ETA Annual Meeting 2017, 2018, 2019 - Member Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Voorzitter Medische Adviesraad Schildklier Organisatie Nederland (SON) |
geen |
Geen |
|
Prof. dr. R. Peeters, internist-endocrinoloog, NIV (voorzitter tot 1-05-2019) |
Erasmus MC, Internist-endocrinoloog, hoogleraar schildklierziekten |
Member of International guideline committees: American Thyroid Association Task Force: Guidelines for thyroid disease and pregnancy (not remunerated)
Board memberships and committees of professional societies: - Programme Organizing Committee of the 2019 European Congress of Endocrinology. 2018 Annual Meeting of the American Thyroid Association - Iodine Global Network (https://www.ign.org/), National representative for the Netherlands (not remunerated) - Chair of the Scientific Advisory Board of the World Iodine Association (not remunerated) - Treasurer of the Dutch Thyroid Club / Foundation for Thyroid Research (not remunerated) |
Zie transparantieregister voor financiële banden (red: diverse diensten met onkosten) vergoeding van Shire International licenising, Genzyme Europe BV, Ipsen Farmaceutica BV, Merck BV, IBSA, Bayer, - Adviesraad Eisai BV (vergoeding) |
Geen; vergoedingen waren niet gerelateerd aan de richtlijn
|
|
Dr. W.E. Visser, internist-endocrinoloog, NIV |
Erasmus MC, Internist-endocrinoloog |
Member of international committees - European Thyroid Association Task Force: Guideline on Diagnosis and Management of Resistance to Thyroid Hormone & other disorders of thyroid hormone action (2016 - present) - Educational Committee of the European Thyroid Association (2017 - present) - Chair Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Editorial Board membership - Editorial Board of Frontiers in Neurogenomics (2013 - present) - Editorial Board of the Journal of Endocrinology (2016 - present) - Editorial Board of the Journal of Molecular Endocrinology (2016 - present) - Editorial Board of the Endocrinology, Diabetes and Metabolism (2016 - present) - Editorial Board of the European Thyroid Journal (2017 - present)
Management role in International Consortia - Founder and chair MCT8 patient registry (2016 - present). - Chair rare thyroid hormone signalling disorders in Endo-ERN (European Reference Networks) (2016 - present) - Chair Thyroid Group of Endo-ERN EuRRECa (2018 - present)" |
geen |
Vergoedingen niet gerelateerd aan richtlijn (diabetes, schildklierkanker) |
|
Drs. A. Roos, internist-endocrinoloog, NIV |
Internist-endocrinoloog Martini Ziekenhuis, Groningen |
Geen |
Geen |
Geen |
|
Dr. M. Medici, internist-endocrinoloog, NIV |
Internist-Endocrinoloog radboudUMC (0,6 fte) en Erasmus MC (0,4 fte) |
Geen;
|
Erasmus Universiteit Fellowship: geen belang bij het advies van de richtlijn. |
geen |
|
Dr. A.F. Muller, internist-endocrinoloog, NIV |
Internist, Diakonessenhuis |
Zie transparantieregister (red: diverse diensten met (onkosten)vergoeding voor Novo Nordisk, Eli Lilly and Company (adviesraad), Amgen, Sanofi) |
|
Vergoedingen waren niet gerelateerd aan de richtlijn (diabetes, schildklierkanker)
|
|
Prof. dr. O.M. Dekker, internist, NIV |
Hoogleraar Interne Geneeskunde LUMC Leiden |
Collegelid CBG (betaald) Lid Gezondheidsraad (onbetaald) Voorzitter Vereniging Epidemiologie (onbetaald)" |
Geen |
Geen |
|
Dr. A.A. Bouman, SON |
Gepensioneerd (tot 1-9-2012 werkzaam als Klinisch chemicus bij het Vumc) |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenvereniging Schildklier Organisatie Nederland (SON). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Richtlijn schildklierfunctiestoornissen, 2012) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep en de adviseur concept-uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg. De module over organisatie van zorg wordt opgenomen in deel 2 van de richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist.
