Subklinische hypothyreoïdie zwangerschap bij schildklierfunctiestoornissen
Uitgangsvraag
Dient subklinische hypothyreoïdie in de zwangerschap behandeld te worden?
Aanbeveling
Routinematige behandeling met levothyroxine bij alle patiënten met een subklinische hypothyreoïdie tijdens de zwangerschap wordt niet aanbevolen.
Bij patiënten met subklinische hypothyreoïdie met een TSH > 10 mIU/L wordt behandeling met levothyroxine aanbevolen.
Overweeg behandeling in samenspraak met de patiënt bij een TSH tussen 4 en 10 mIU/L op basis van individuele patiëntfactoren (o.a. de hoogte van het TSH en gynaecologische voorgeschiedenis).
Als besloten wordt tot behandeling, doe dit zo vroeg mogelijk in de zwangerschap (bij voorkeur eerste trimester).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De verschillende studies vinden geen duidelijk effect van levothyroxine op de verschillende uitkomsten. De puntschatters voor perinatale sterfte/miskraam en vroeggeboorte zijn wel in het voordeel van levothyroxine. De bewijskracht voor deze studies is laag: het aantal events voor verschillende uitkomstmaten is zeer beperkt en het merendeel van de studies heeft geen gebruik gemaakt van een placebo controlegroep. De klinische heterogeniteit in de studies is hoog: de studies hanteren verschillende definities voor een subklinische hypothyreoïdie, variërend van een TSH ≥ 2,5 mIU/L tot een TSH ≥ 4,5 mIU/L. De studies met lagere TSH waardes betreffen vooral vrouwen in een fertiliteitstraject. Nazarpour (2018) maakt ook onderscheid tussen het effect van levothyroxine in patiënten met een TSH ≥ 4 mIU/L en vindt een risico verlagend effect voor vroeggeboorte (RR 0,39 (95%BI: 0,15 tot 0,98)) terwijl dit niet wordt gevonden in de groep met een lage TSH waarde (TSH < 4). Daarentegen vindt Casey (2017) geen effect van levothyroxine op geboortegewicht, waarbij alleen vrouwen met een TSH ≥ 4,5 mIU/L zijn geïncludeerd.
Het is mogelijk dat levothyroxine het risico op een miskraam verlaagt, ook al is het bewijs summier. In de literatuur over subklinische hypothyreoïdie en zwangerschap zijn geen nadelige effecten van levothyroxinebehandeling beschreven. Aangezien een subklinische hypothyreoïdie geassocieerd is met negatieve zwangerschapsuitkomsten en negatieve effecten op het kind (Maraka, 2016), is de werkgroep van mening dat behandeling met levothyroxine overwogen kan worden.
In deze context dient de essentiële rol van schildklierhormoon in de hersenontwikkeling van het ongeboren kind genoemd te worden (Oppenheimer, 1997). De foetus is in het eerste trimester volledig afhankelijk van de schildklierhormoon productie van de moeder, daar de foetale schildklier pas in het tweede trimester functioneel is. Aangezien een belangrijk deel van de hersenontwikkeling in het eerste trimester plaatsvindt, is waarborging van een normale schildklierstatus van de moeder derhalve van groot belang voor een normale ontwikkeling van het kind (Lee, 2022).
In de Amerikaanse ATA richtlijn (Alexander, 2017) wordt ook TPO antistoffen meegewogen bij het wel of niet behandelen van subklinische hypothyreoïdie. De werkgroep is van mening dat er momenteel onvoldoende wetenschappelijke literatuur beschikbaar is om dit aan te bevelen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Zwangeren hebben er veel voor over om de kans op een miskraam zo klein mogelijk te maken. Het onnodig toedienen van medicatie brengt mogelijk risico’s en bijwerkingen met zich mee. In de literatuur over subklinische hypothyreoïdie en zwangerschap zijn geen nadelige effecten van levothyroxinebehandeling beschreven.
Kosten (middelenbeslag)
De kosten van de medicatie zijn laag. Daarbij zijn de kosten van een extra poliklinisch ziekenhuisbezoek niet onaanzienlijk.
Aanvaardbaarheid, haalbaarheid en implementatie
Er worden geen problemen verwacht bij de aanvaardbaarheid en implementatie van deze aanbeveling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is onzekerheid over de effecten van het voorschrijven van levothyroxine aan zwangere vrouwen met een subklinische hypothyreoïdie. De richting en sterkte van de associatie voor miskraam en perinatale sterfte lijken wel in het voordeel te zijn van levothyroxine, maar de bewijskracht is zeer beperkt.
Aangezien de gevolgen van een subklinische hypothyreoïdie op uitkomsten van zwangerschap en het kind groot zijn, kan behandeling met levothyroxine wel overwogen worden bij hogere TSH waarden. Een TSH > 10 mIU/L tijdens de zwangerschap dient in ieder geval behandeld te worden met levothyroxine (zie module ‘Behandeling subklinische hypothyreoïdie’). De werkgroep is van mening dat behandeling bij een TSH tussen 4 en 10 mIU/L overwogen kan worden. Hierbij dient opgemerkt te worden dat het TSH een spectrum is; binnen deze groep geeft een hogere TSH waarde meer reden tot behandeling. Naast de hoogte van het TSH, moet rekening gehouden worden met eerder doorgemaakte complicaties rond zwangerschap en/of bevalling. Als besloten wordt tot behandeling is het belangrijk om dit bij voorkeur in het eerste trimester te laten starten. De foetus is in het eerste trimester volledig afhankelijk van de maternale schildklierfunctie, waardoor vroegtijdige behandeling het risico op bijwerkingen en nadelige gevolgen bij het kind zo klein mogelijk maakt.
Aanbevolen wordt om geen startdosering hoger dan 50 µg/dag te hanteren om het risico op overbehandeling te beperken; bij doseringen van 25 tot 50 µg/dag zijn geen bijwerkingen gemeld.
Onderbouwing
Achtergrond
Subklinische hypothyreoïdie is gedefinieerd als een verhoogd TSH in combinatie met een normaal vrij T4. De gewenste TSH range tijdens de zwangerschap wordt bepaald door de referentiewaarde buiten de zwangerschap te nemen minus 0,5 mIU/L. Patiënten kunnen zowel symptomatisch als asymptomatisch zijn.
Een subklinische hypothyreoïdie komt vaak voor tijdens de zwangerschap en is geassocieerd met negatieve zwangerschapsuitkomsten (vroeggeboorte, laag geboortegewicht, miskraam) en negatieve kinduitkomsten (verlaagd IQ, hoger risico op schizofrenie en autisme) (Maraka, 2016). Toch is het onduidelijk of milde schildklierfunctiestoornissen behandeld moeten worden.
Conclusies
|
Zeer laag GRADE |
Perinatale sterfte/miskraam
We zijn onzeker over het effect van levothyroxine op perinatale sterfte/miskramen bij zwangere vrouwen met subklinische hypothyreoïdie.
Bronnen: (Casey, 2017; Kim, 2011; Nazarpour, 2018; Zhao, 2018) |
|
Laag GRADE |
Vroeggeboorte
Levothyroxine lijkt geen effect te hebben op vroeggeboorte bij zwangere vrouwen met subklinische hypothyreoïdie.
Bronnen: (Casey, 2017; Kim, 2011; Nazarpour, 2018; Rahman, 2010; Zhao, 2018; Alcazar Lazaro, 2019) |
|
Laag GRADE |
Pre-eclampsie
Levothyroxine lijkt geen effect te hebben op het ontstaan van pre-eclampsie bij zwangere vrouwen met subklinische hypothyreoïdie.
Bronnen: (Casey, 2017; Zhao, 2018; Alcazar Lazaro, 2019) |
|
Laag GRADE |
Geboortegewicht
Levothyroxine lijkt geen effect te hebben op het geboortegewicht bij zwangere vrouwen met subklinische hypothyreoïdie.
Bronnen: (Casey, 2017; Nazarpour, 2018; Zhao, 2018; Alcazar Lazaro, 2019) |
|
Zeer laag GRADE |
Cognitief functioneren
Er is onvoldoende bewijs over het effect van levothyroxine bij zwangere vrouwen met subklinische hypothyreoïdie op het cognitief functioneren van het kind.
Bronnen: (Casey, 2017) |
Samenvatting literatuur
Beschrijving studies
Kim (2011) heeft in Korea een RCT uitgevoerd naar het effect van levothyroxine in vrouwen met subklinische hypothyreoïdie (TSH ≥ 4,5 mIU/L). Deze vrouwen ondergingen allen fertiliteitsbehandelingen. Bij de start van de fertiliteitsbehandeling werden alle vrouwen gerandomiseerd naar 50 µg levothyroxine (n=32) of geen interventie (n=32). Enkel de studie-artsen waren geblindeerd. Levothyroxine werd getitreerd tot een TSH-concentratie < 2,5 mIU/L. De gemiddelde leeftijd van de zwangere vrouwen was 36 jaar in zowel de interventie als de controlegroep (SD: interventie 2,4 en controle 2,2 jaar). De gemiddelde baseline TSH waarden waren 6,6 (range: 4,6 tot 9,8) mIU/L in de interventiegroep en 6,7 (range: 4,6-9,6) mIU/L in de controlegroep. Het aantal patiënten met TPO antistoffen was vergelijkbaar tussen de behandelarmen (81,3% in de interventie en 78,1% in de controlegroep). De uitkomstmaten waren succes van de fertiliteitsbehandeling, miskraam en vroeggeboorte.
Casey (2017) voerde een RCT uit naar het effect van levothyroxine in vrouwen met subklinische hypothyreoïdie (TSH ≥ 4mIU/L) en in vrouwen met hypothyroxinemie (gedefinieerd als vrije T4 < 0,86 ng/dl). Dit waren twee aparte trials en voor deze module zijn alleen vrouwen met subklinische hypothyreoïdie meegenomen. De vrouwen waren allen 8 tot 20 weken zwanger van een eenling. Zij ontvingen 100µg levothyroxine (n=339) of placebo (n=338) en startte hiermee bij een gemiddelde zwangerschapsduur van 17 weken. De streefwaarde van deze behandeling was een TSH tussen 0,1 en 2,5 mIU/L. De gemiddelde leeftijd van de zwangere vrouwen was 27,7 jaar (SD: 5,7) in de interventiegroep en 27,3 jaar (SD: 5,7) in de controlegroep. De mediane TSH waarde voor randomisatie was 4,5 (95% BI: 4,4 tot 4,7) mIU/L in de interventiegroep en 4,3 (95%BI: 4,2 tot 4,5) mIU/L in de controlegroep. Uitkomstmaten waren overlijden voor een leeftijd van 3 jaar, vroeggeboorte, doodgeboorte en cognitief functioneren. Cognitief functioneren was gemeten op 5-jarige leeftijd middels de Wechsler Preschool and Primary Scale of Intelligence III (WPPSI-III). Als de meting op 5-jarige leeftijd niet beschikbaar was, hebben ze cognitief functioneren op 3-jarige leeftijd meegenomen, gemeten met de Differential Ability Scales–II.
Nazarpour (2018) heeft een RCT uitgevoerd in vrouwen met subklinische hypothyreoïdie (≥ 2,5 mIU/L) en afwezigheid van TPO antistoffen. Alle vrouwen werden gerandomiseerd naar levothyroxine (n=183) of geen behandeling (n=183). Enkel de studie-artsen waren geblindeerd. De gemiddelde zwangerschapsduur bij de start van de studie was rond de 11 à 12 weken. De mediane TSH-concentraties op baseline was 3,8 (interkwartiel afstand: 2,8 tot 4,8) mIU/L in de interventiegroep en 3,6 (interkwartielafstand 3,1 tot 4,2) mIU/L in de controlegroep. De gemiddelde leeftijd was vergelijkbaar in de interventie en controlegroep met respectievelijk 27 en 26,9 jaar. Er is nog een extra controlegroep (n=1028) van euthyreote vrouwen zonder TPO antistoffen (< 50 IU/mL). Vroeggeboorte was de primaire uitkomstmaat in deze studie.
Zhao (2018) heeft een RCT uitgevoerd naar vrouwen met subklinische hypothyreoïdie, waarbij subklinische hypothyreoïdie is gedefinieerd als ≥ 2,5 mIU/L in het eerste trimester en ≥ 3 mIU/L in het tweede trimester. Patiënten werden gerandomiseerd naar 3 groepen: Groep A ontving levothyroxine na de diagnose, groep B ontving levothyroxine in het tweede trimester en groep C ontving geen medicatie. Het is niet bekend of onderzoekers geblindeerd waren voor de behandeling. De startdosering was 25 µg/d en dit werd aangepast tot maximaal 100 µg/d tot een TSH ≤ 3 mIU/L was behaald. De gemiddelde leeftijd was 27 jaar in alle groepen en een deel (A: 32%, B: 45%, C: 19%) had TPO antistoffen.
Alcazar Lazaro (2019) voerde een RCT uit naar het effect van levothyroxine in vrouwen met licht verhoogde TSH waarden (TSH tussen 2,5 en 4,9 mIU/L). Deze TSH waarden werden gemeten in het eerste trimester. Patiënten werden gerandomiseerd naar behandeling met levothyroxine (n=182) of geen interventie (n=181), startend in het eerste trimester. De vrouwen in de behandelgroep (n=181) startten met een dosering van 0,5 µg/kg levothyroxine, met als doel een TSH waarde < 3 mIU/L in het tweede en derde trimester. De gemiddelde leeftijd van de zwangere vrouwen was 32 (SD: 5,37) jaar. De gemiddelde TSH waarden in het eerste trimester was 2,53 (SD: 0,99) mIU/L in de behandelgroep en 3,24 (SD: 0,59) mIU/L in de controlegroep. Aanwezigheid van TPO antistoffen was aangetoond bij 17,1% en 17,7% in respectievelijk de behandel- en controlegroep. De primaire uitkomstmaten waren zwangerschapscomplicaties en aangeboren afwijkingen.
Resultaten
Perinatale sterfte/miskraam
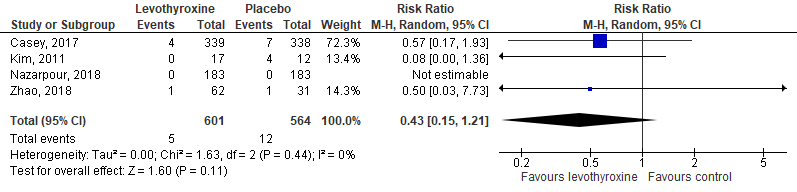
Het effect van levothyroxine op perinatale sterfte en miskramen is in verschillende studies gerapporteerd (figuur 1). Perinatale sterfte of miskraam kwam 5 keer voor in de interventiegroep en 12 keer in de controlegroep. Dit resulteert in een RR van 0,43 (95%-BI: 0,15 tot 1,21).
Figuur 1 Het effect van levothyroxine op perinatale sterfte en miskraam bij zwangere vrouwen met een subklinische hypothyreoïdie
Vroeggeboorte
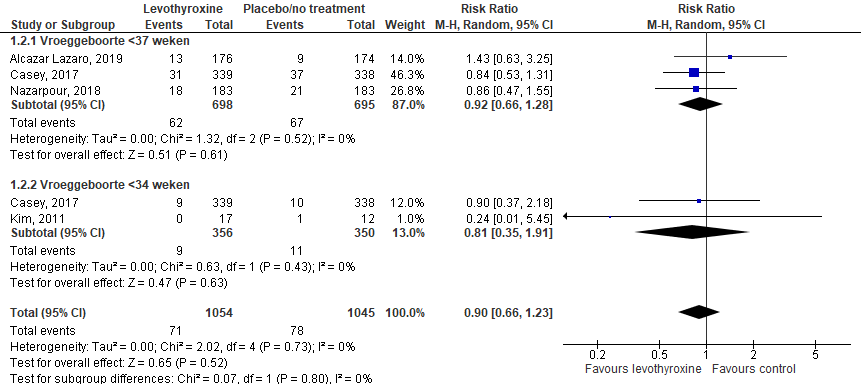
Vroeggeboorte werd in de geïncludeerde studies gedefinieerd als geboorte voor 34 (2 studies) of 37 weken (3 studies). In beide gevallen werd geen effect gevonden van levothyroxine op vroeggeboorte (figuur 2). Het RR voor vroeggeboorte ≤ 37 weken was 0,92 (95%-BI: 0,66 tot 1,28) en met de definitie van ≤ 34 weken was het RR 0,81 (95%-BI: 0,35 tot 1,91).
Zhao (2018) beschreef de definitie van vroeggeboorte niet. In deze studie werd 1 baby (3%) te vroeg geboren bij de vrouwen die werden behandeld met levothyroxine in het 1e trimester, 6 baby’s (19%) werden te vroeg geboren bij vrouwen die behandeld werden met levothyroxine in het 2e trimester en 6 baby’s in de controlegroep (19%) (p=0,11).
Figuur 2 Het effect van levothyroxine op vroeggeboorte bij zwangere vrouwen met een subklinische hypothyreoïdie
Pre-eclampsie
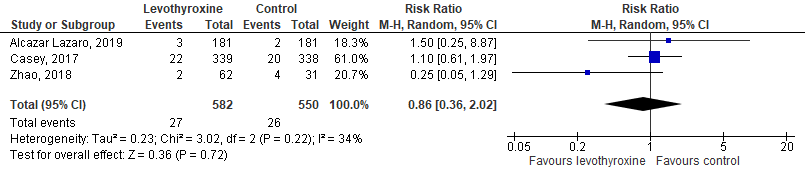
Casey (2017), Zhao (2018) en Alcazar Lazaro (2019) hebben pre-eclampsie meegenomen als uitkomstmaat. Levothyroxine gebruik tijdens de zwangerschap resulteert niet in een hoger risico voor pre-eclampsie, met een RR van 0,86 (95%-BI: 0,36 tot 2,02) (figuur 3).
Figuur 3 Het effect van levothyroxine op pre-eclampsie bij zwangere vrouwen met een subklinische hypothyreoïdie
Geboortegewicht
Geboortegewicht werd verschillend gerapporteerd in de verschillende studies. Casey (2017) vond geen verschil in het aantal baby’s met een gewicht < 10e percentiel (levothyroxinegroep: 10%, placebogroep: 8%, p=0,45). Zhao (2018) rapporteerde geboortegewicht als het aantal baby’s met een gewicht < 2500 gram. In de levothyroxinegroep had 1 baby (3,2%) een laag geboortegewicht (groep met levothyroxine in het 2e trimester) en dit kwam tweemaal voor in de controlegroep (6,5%) (p=0,36). Nazarpour (2018) vond een geen verschil in geboortegewicht tussen de levothyroxinegroep (gemiddelde: 3191 (SD: 455) gram) in vergelijking met de controlegroep (gemiddelde: 3203 (SD:497) gram). Alcazar Lazaro (2019) vond vergelijkbare resultaten, met een gewicht van 3211 (SD: 474) gram in de interventiegroep en 3249 (SD: 446) gram in de controlegroep.
Cognitief functioneren
Casey (2017) heeft als enige gekeken naar cognitief functioneren. Hierbij is gekeken naar de IQ score op 5-jarige leeftijd (of op 3-jarige leeftijd, als de meting op 5-jarige leeftijd niet beschikbaar was). De mediane score was 97 (95%-BI: 94 tot 99) in de levothyroxine groep en 94 (95%-BI: 92 tot 96) in de placebogroep (p=0,71).
Bewijskracht van de literatuur
Perinatale sterfte/miskraam
De bewijskracht voor RCTs begint op hoog. De bewijskracht voor de uitkomstmaat perinatale sterfte/miskraam is met drie niveaus verlaagd tot zeer laag door imprecisie (het gepoolde resultaat overlapt beide grenzen voor klinische besluitvorming) en risk of bias (heterogeniteit vanwege verschil in definities en in de helft van de geïncludeerde studies werd geen gebruik gemaakt van placebo-tabletten en is geen blindering toegepast).
Vroeggeboorte
De bewijskracht voor RCTs begint op hoog. De bewijskracht voor de uitkomstmaat vroeggeboorte is met twee niveaus verlaagd tot laag door imprecisie (het gepoolde resultaat overlapt de grens voor klinische besluitvorming) en risk of bias (in de helft van de geïncludeerde studies werd geen gebruik gemaakt van placebo-tabletten en geen blindering toegepast).
Pre-eclampsie
De bewijskracht voor RCTs begint op hoog. De bewijskracht voor de uitkomstmaat pre-eclampsie is met twee niveaus verlaagd tot laag door imprecisie (het gepoolde resultaat overlapt de grens voor klinische besluitvorming) en risk of bias (in de helft van de geïncludeerde studies werd geen gebruik gemaakt van placebo-tabletten en geen blindering toegepast).
Geboortegewicht
De bewijskracht voor RCTs begint op hoog. De bewijskracht voor de uitkomstmaat geboortegewicht is met twee niveaus verlaagd tot laag door imprecisie (het gepoolde resultaat overlapt de grens voor klinische besluitvorming) en risk of bias (in de helft van de geïncludeerde studies werd geen gebruik gemaakt van placebo-tabletten en geen blindering toegepast).
Cognitief functioneren
De bewijskracht voor RCTs begint hoog. De bewijskracht voor de uitkomstmaat cognitief functioneren is met 3 niveaus verlaagd tot zeer laag gezien de beperkingen in de onderzoeksopzet en imprecisie. Er is maar één studie die heeft gekeken naar cognitief functioneren van het kind, waardoor we hiervoor met twee niveaus afwaarderen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van behandeling met levothyroxine bij zwangere vrouwen met een subklinische hypothyreoïdie?
P: zwangere vrouwen met subklinische hypothyreoïdie;
I: levothyroxine;
C: geen behandeling;
O: miskraam, perinatale sterfte, vroeggeboorte, pre-eclampsie, geboortegewicht en cognitief functioneren.
Relevante uitkomstmaten
De werkgroep achtte miskraam en perinatale sterfte voor de besluitvorming cruciale uitkomstmaten en vroeggeboorte, geboortegewicht, pre-eclampsie en hersenontwikkeling voor de besluitvorming als belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- miskraam: eindigen van zwangerschap voor 24 weken;
- perinatale sterfte: overlijden van foetus vanaf 24 weken zwangerschap tot in de eerste 7 dagen na de geboorte;
- vroeggeboorte: geboorte voor 37 weken.
De werkgroep definieerde voor de uitkomtmaat miskraam, perinatale sterfte, vroeggeboorte, pre-eclampsie een verschil in relatief risico van 10% als een klinisch relevant verschil. Voor de uitkomstmaat geboortegewicht en cognitief functioneren werd een verschil van 0,5 SD gedefinieerd als klinisch relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 10 september 2019 met relevante zoektermen gezocht naar subklinische hypothyreoïdie of geïsoleerde hypothyroxinemie tijdens de zwangerschap. De zoekstrategie is samen uitgevoerd met de module over behandeling van geïsoleerde hypothyroxinemie tijdens de zwangerschap. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 252 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: RCT’s en systematische reviews gepubliceerd na 2010. Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vijf studies definitief geselecteerd.
Resultaten
Vijf RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-bias tabellen.
Referenties
- 1 - Alexander, E. K., Pearce, E. N., Brent, G. A., Brown, R. S., Chen, H., Dosiou, C.,... & Peeters, R. P. (2017). 2017 Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid, 27(3), 315-389.
- 2 - Casey, B. M., Thom, E. A., Peaceman, A. M., Varner, M. W., Sorokin, Y., Hirtz, D. G.,... & Tita, A. T. (2017). Treatment of subclinical hypothyroidism or hypothyroxinemia in pregnancy. New England Journal of Medicine, 376(9), 815-825.
- 3 - Kim, C. H., Ahn, J. W., Kang, S. P., Kim, S. H., Chae, H. D., & Kang, B. M. (2011). Effect of levothyroxine treatment on in vitro fertilization and pregnancy outcome in infertile women with subclinical hypothyroidism undergoing in vitro fertilization /intracytoplasmic sperm injection. Fertility and sterility, 95(5), 1650-1654.
- 4 - Lázaro, V. A., del Val, T. L., Lacalle, C. G., Moreno, B. T., Carvajal, G. C., Fernández, L. V.,... & Zuñiga, L. R. (2019). Slightly elevated thyrotropin levels in pregnancy in our clinical practice. Endocrinología, Diabetes y Nutrición (English ed.), 66(10), 620-627.
- 5 - Nazarpour, S., Ramezani Tehrani, F., Simbar, M., Tohidi, M., Minooee, S., Rahmati, M., & Azizi, F. (2018). Effects of levothyroxine on pregnant women with subclinical hypothyroidism, negative for thyroid peroxidase antibodies. The Journal of Clinical Endocrinology & Metabolism, 103(3), 926-935.
- 7 - Zhao, L., Jiang, G., Tian, X., Zhang, X., Zhu, T., Chen, B.,... & Ma, Q. (2018). Initiation timing effect of levothyroxine treatment on subclinical hypothyroidism in pregnancy. Gynecological Endocrinology, 34(10), 845-848.
- 8 - Lee, S. Y., & Pearce, E. N. (2022). Assessment and treatment of thyroid disorders in pregnancy and the postpartum period. Nature reviews. Endocrinology, 18(3), 158–171.
- 9 - Maraka, S., Ospina, N. M. S., O'Keeffe, D. T., Espinosa De Ycaza, A. E., Gionfriddo, M. R., Erwin, P. J., ... & Montori, V. M. (2016). Subclinical hypothyroidism in pregnancy: a systematic review and meta-analysis. Thyroid, 26(4), 580-590.
- 10 - Oppenheimer, J. H., & Schwartz, H. L. (1997). Molecular basis of thyroid hormone-dependent brain development. Endocrine reviews, 18(4), 462–475.
Evidence tabellen
Evidencetabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
|
Casey, 2017 |
Type of study: Multicenter Randomized Placebo Controlled Trial
Setting and country: 15 centers within the Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal–Fetal Medicine Units Network, USA
Funding and conflicts of interest: Study was funded by the Eunice Kennedy Shriver National Institute of Child Health and Human Development and the National Institute of Neurological Disorders and Stroke. No conflicts of interest were described. |
Inclusion criteria: Women with a singleton pregnancy who presented for prenatal care before 20 weeks of gestation were invited to undergo thyroid screening for serum thyrotropin and free T4 values. The criteria that were used to diagnose subclinical hypothyroidism at the origin of the trial were a thyrotropin level of 3.00 mU or more per liter (which was presumed to correspond to the 97.5th percentile) and a free T4 level in the normal range (0.86 to 1.90 ng per decilitre (11 to 24 pmol per liter)).
Exclusion criteria: Women who were found to have overt hypothyroidism or hyperthyroidism at the time of screening were excluded, and obstetrical providers were notified of abnormal test results for subsequent follow-up.
N total at baseline: Of the 3057 women with subclinical hypothyroidism, 800 were eligible and consented to participate in the adherence run-in phase, and 677 underwent randomization
Intervention: 339 Control: 338
Important prognostic factors2: Age ± SD: I: 27.7± 5.7 C: 27.3 ± 5.7
BMI ± SD I: 28.1 ± 6.4 C: 28.2 ± 6.4
Thyrotropin – mIU/L (95% CI) I: 4.5 (4.4 - 4.7) C: 4.3 (4.2 - 4.5)
Free thyroxin – ng/dl (95% CI) I: 1.01 (1.00-1.02) C: 1.02 (1.01-1.04)
Weeks of gestation ± SD I: 16.6 ± 3.0 C: 16.7 ± 3.0
Groups comparable at baseline? Yes, baseline characteristics did not differ significantly between groups. |
100 μg of levothyroxine daily. Women were seen monthly, and blood samples for thyrotropin and free T4 testing were sent to the same laboratory. Results were reported to the coordinating center, which notified the clinical center whether a dose adjustment was required according to the algoritm. Adjustments were made within 7 days after the blood test. The goal for women with subclinical hypothyroidism was a thyrotropin level between 0.1 and 2.5 mU per liter, with a maximum daily dose of 200 μg of levothyroxine.
|
100 µg of matching placebo daily. Women were seen monthly, and blood samples for thyrotropin and free T4 testing were sent to the same laboratory. Results were reported to the coordinating center, which notified the clinical center whether a dose adjustment was required according to the algorithm; for control group sham adjustments were communicated.
|
Length of follow-up: Beginning between 8 and 20 weeks of gestation till the age of 5 of the offspring.
Loss-to-follow-up: Intervention: 16 (5%) Reasons: not described, it was only described that 4 offspring died before the age of 3.
Control: 12 (4%) Reasons: not described, it was only described that 9 offspring died before the age of 3.
Incomplete outcome data: Primary outcome: A total of 11 children had a DAS score substituted for the WPPSI-II.
Intervention: 16 (4%) 4 offspring died before the age of 3.
Control: 12 (3%) 9 offspring died before 3 years of age.
|
Stillbirth or miscarriage (%) I: 2 (1) C: 5 (2) P-value: 0.28
Preterm birth < 34wk (%) I: 10 (4) C: 7 (3) P-value: 0.47
Preterm birth < 37wk (%) I: 31 (12) C: 20 (8) P-value: 0.11
Preeclampsia (%) I: 9 (3) C: 11 (4) P-value: 0.64
Birth weight <10th percentile (%) I: 23 (9) C: 20 (8) P-value: 0.68 Full scale IQ (WPPSI-III) I: 97 (94-99) C: 94 (92-96) Effect: 0 (-3 to 2) P-value: 0.71
DAS-II scores at 36 months I: 90 (88-93) C: 90 (87-93) Effect: 0 (-2 to 3) P-value: 0.90
|
This study consisted of two parallel trials. The other trial focused on levothyroxine treatment in subclinical hypothyroidism in pregnant women.
|
|
|
Kim, 2011 |
Type of study: Prospective Randomized Trial.
Setting and country: University-based in fertility clinic at the Asan Medical Center, Seoul, South Korea.
Funding and conflicts of interest: Funding is not mentioned. The authors declared to have no conflict of interest. |
Inclusion criteria: The study population consisted of 64 infertile patients with subclinical hypothyroidism who had undergone 64 IVF/ICSI cycles between March 2006 and September 2009. Subclinical hypothyroidism was defined as an elevated serum TSH level >4.5 mIU/L with a normal FT4 level and without frank symptoms of Hypothyroidism. All subjects had regular ovulatory cycles (duration, 21–35 days). They were in good health with normal cardiac, hepatic, and renal functions, and they had experienced spontaneous onset of puberty and normal sexual development. None of subjects had a previous medical history of subclinical and clinical hypothyroidism.
Exclusion criteria: Not described
N total at baseline: Intervention: 32 Control: 32
Important prognostic factors2: Age (years ± SD) I: 36.0 ± 2.4 C: 36.1 ±. 2.2
Free T4 (ng/dL ± SD) I: 1.2±0.2 C: 1.2±0.2 TSH (ml U/L±SD) I: 6.6±1.7 C: 6.7±1.8
Nullipara (%) I: 19 (59.4) C: 18 (56.3)
Infertility duration (months ± SD) I: 48.0±24.3 C: 44.2±23.6
Groups comparable at baseline? Yes, baseline characteristics did not differ significantly between groups. |
50 µg LT4 was administered every morning from the first day of controlled ovarian stimulation (COS) and continued up to the day of serum b-hCG measurement. If pregnancy was confirmed, an adequate dose of LT4 was given continuously throughout the pregnancy.
|
No treatment of placebo. However, even in pregnant women included in the control group, an adequate dose of LT4 was supplemented when overt hypothyroidism was detected during pregnancy. The LT4 dosage was titrated to reach and thereafter maintain serum TSH concentrations of<2.5 mIU/L in the first trimester. Serum TSH and FT4 levels were remeasured every 4–6 weeks, and symptoms of clinical hypothyroidism were investigated on every visit for routine prenatal examination throughout the pregnancy. One of 12 pregnant patients included in the control group was diagnosed as having overt hypothyroidism at 24 weeks’ gestation, and she received LT4 treatment throughout the pregnancy.
|
Length of follow-up: Throughout pregnancy until delivery.
Loss-to-follow-up: Intervention: none 0 (0%) Reasons n.a.
Control: none 0 (0%) Reasons n.a.
Incomplete outcome data: Intervention: none described Reasons n.a.
Control: none described Reasons n.a.
|
Miscarriage rate I: 0 (0/17) C: 33.3 (4/12) P-value: 0.021
Preterm birth I:0 (0/17) C: 1 (1/12) P-value: -
|
|
|
|
Nazarpour, 2018 |
Type of study: Single blind randomized controlled trial.
Setting and country: Prenatal care centers of the Shahid Beheshti University of Medical Sciences, Iran.
Funding and conflicts of interest: This work was financially supported by the Research Institute for Endocrine Sciences. The authors declared to have no conflict of interest. |
Inclusion criteria: SCH was defined as a normal FT4I (1 to 4.5) despite an elevated TSH level (2.5 to 10 mIU/L). SCH was defined as a normal FT4I (1 to 4.5) despite a reduced TSH level (,0.1 mIU/L).
Exclusion criteria: Overthyperthyroidism, overt hypothyroidism and TPOAb positivity and twin pregnancies. Overt hyperthyroidism was defined as a TSH level <0.1 mIU/L and an FT4I >4.5. Overt hypothyroidism was defined as a TSH level >10 mIU/L or TSH level .2.5 mIU/L and an FT4I <1. TPOAb level > 50 IU/mL was considered TPOAb positivity.
N total at baseline: Intervention: 183 Control: 183
Important prognostic factors2: Maternal age( years ± SD): I: 27.0±5.34 C: 26.9±4.74
Gestation at first visit (weeks ± SD) I: 11.4±4.10 C: 12.2±4.36
History of infertility (%) I: 9 (4.9) C: 8 (4.4)
Groups comparable at baseline? There was no testing on differences between the groups at baseline, but absolute differences were small. |
In group A, patients were treated with an LT4 morning dose of 1 mg/kg/d, initiated 4 to 8 days after the first prenatal visit and maintained throughout pregnancy.
|
No treatment or placebo.
|
Length of follow-up: Throughout pregnancy until delivery.
Loss-to-follow-up: Intervention: 7 (%) Reasons not described
Control: 5 (%) Reasons not described
Incomplete outcome data: Intervention: none described Reasons n.a.
Control: none described Reasons n.a.
|
Preterm delivery (%) I: 18 (9.8) C: 21 (11.5) P-value: > 0.05
Stillbirth (%) I: 0 C: 0 P-value: > 0.05
Birth weight (grams ± SD) I: 3190.82 ± 455.13 C: 3203.1 ± 497.1 P-value: > 0.05
|
|
|
|
Zhao, 2018 |
Type of study: Randomized Controlled Trial
Setting and country: China
Funding and conflicts of interest: This study is supported by the grant from Shanghai Jiading District Health and Family Planning Commission. The authors declared to have no conflict of interest. |
Inclusion criteria: Between January 2014 and October 2016, all the women with single pregnancy were invited to undergo thyroid screening (include anti-TPO test) when conducting their first antenatal visit before 10 weeks of gestation. SCH was defined as normal serum free T4 while TSH concentration was upper than 2.5 mIU/L in the first trimester or greater than 3 mIU/L in the second trimester. The reference values were 0.55–4.78 mIU/L for TSH, 3.1–6.8 pmol/L for FT3 and 10.9–21.7 pmol/L for FT4.
Exclusion criteria: Women were excluded on previously set exclusion criteria: pre-existing thyroid disease (Hashimoto’s thyroiditis or Graves’ disease n=4), history of thyroid-interfering drug (polyperridone, phenytoin sodium, etc.) used within three months before the visit (n=2), associated with acute or chronic infection (n=2), and iodine deficiency (n=1).
N total at baseline: 98 eligible participants were randomized to three groups. Of these, two participants withdraw their informed consent forms and three subjects were lost during follow-up or delivery at other hospital, so their data were not included. It is not known to which groups those 5 subjects lost to FU belonged.
Intervention A: 31 Intervention B: 31 Control: 31
Important prognostic factors2: Age (years ± SD): IA: 27.2±2.3 IB: 27.5±2.1 C: 27.4±2.4
Primiparity (%) IA: 30 (96.7) IB: 28 (83.9) C: 26 (77.4)
BMI ± SD IA: 26.2±5.3 IB: 26.1±4.9 C: 26.3±5.6
TPOAb+ (%) IA: 10 IB: 14 C: 6
Groups comparable at baseline? Yes, baseline characteristics did not differ significantly between the groups. |
Group A received levothyroxine on the second day diagnosed as SCH (8–10 weeks). Group B administered treatment at the follow-up visit in the second trimester (13–16 weeks). The levothyroxine regime was set with starting dose of 25 µg/day and adjusted to a maximum 100 µg/day until the TSH concentration decline to <3 mIU/L.
|
Group C did not receive levothyroxine or another treatment during the whole gestation.
|
Length of follow-up: Throughout pregnancy until delivery
Loss-to-follow-up: This information was only described for the total group, not separately for each group.
Total group: 5 (%) Reasons: The 98 eligible participants were randomized to three groups. Of these, two participants withdraw their informed consent forms and three subjects were lost during follow-up or delivery at other hospital, so their data were not included.
Incomplete outcome data: Intervention: None Reasons n.a.
Control: None Reasons n.a.
|
Preterm labor (%) IA: 1 (3.2) IB: 6 (19.4) IC: 6 (19.4) P-value: 0.107
Pre-eclampsia (%) IA: 0 IB:2 (6.5) IC: 4 (12.9) P-value: 0.118
Low birth weight (%) IA: 0 (0) IB: 1 (3.2) IC: 2 (6.5) P-value: 0.356
Pregnancy loss (%) IA: 0 (0) IB: 1 (3.2) IC: 1 (3.2) P-value: 0.599
|
|
|
|
Alcazar Lazaro, 2019 |
Type of study: RCT
Setting and country: Hospital, Spain
Funding and conflicts of interest: The authors declared to have no conflict of interest. |
Inclusion criteria: pregnant women with their first trimester TSH antenatal screening performed in the Hospital Severo Ochoa between January the 1st 2015 and August the 31st 2017.
Exclusion criteria: previous treatment with levothyroxine, overt hypothyroidism, voluntary pregnancy,termination, twin pregnancies, recurrent abortion (more than 2 previous abortions) and subclinical hypothyroidism (TSH ≥ 5 mcU/mL and normal free thyroxine (fT4)).
Important prognostic factors2: Age (years ± SD): I/C: 32.14 ± 5.37 TSH in mcU/ml (1st trimester): I: 3.24 ± 0.59 C: 2.53 ± 0.99
FT4 (1st trimester) I: 1.08 ± 0.13 C: 1.10 ± 0.12
Groups comparable at baseline? Yes, baseline characteristics did not differ significantly between groups. |
Treatment was started with levothyroxine at an initial dose of 0.5 µg/kg of body weight and adjusted as needed in the following visits to reach a TSH level below 3 in the second and third trimester of gestation as proposed by guidelines.
|
No treatment
|
Length of follow-up: Throughout pregnancy until 6 months after delivery.
Loss-to-follow-up: none
|
Preeclampsia I:3 (1.9%) C: 2 (1.4%) NS (0.72)
Preterm delivery (before week 37) I:13 (6.2%) C: 9 (4.4%) NS (0.40)
Newborn weight (g) I: 3211.32 ± 474.45 C: 3249.3 ± 446.7 NS (0.456) |
|
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Casey, 2017 |
Separate randomization sequences were prepared with the use of the simple urn method with stratification according to clinical site. Numbered trial-regimen kits were prepared, and at randomization, each patient was assigned to the next sequentially numbered kit. |
Unlikely
Separate randomization sequences were prepared with the use of the simple urn method. |
Unlikely
The sham adjustment in doses in the placebo group, implicates blinding of participants to treatment allocation. |
Unlikely
Blinding of care providers not mentioned. However, outcome measures are objective. |
Unlikely
Assessor blinding not mentioned. However, outcome measures are objective. |
Unlikely
Trial outcomes listed in the methods section/study protocol are also reported. |
Unclear
Reasons for lost to FU are not described, but % lost to FU did not differ a lot between the groups (5% versus 4%). |
Unlikely
Analysis was performed on a intention-to-treat principle. |
|
Kim, 2011 |
The subjects were randomized by the use of sealed envelopes and a computer-generated list. |
Unlikely
Subjects were randomized by the use of sealed envelopes and a computer-generated list. |
Likely
The control group did not receive any treatment or placebo. |
Unclear
Blinding of care providers not mentioned. However, outcome measures are objective. |
Unclear
Assessor blinding not mentioned. However, outcome measures are objective. |
Unlikely
Trial outcomes listed in the methods section are also reported. |
Unlikely
None of the participants was lost to FU. |
Unlikely
Participants included in the analysis are exactly those who were randomized into the trial. |
|
Nazarpour, 2018 |
The subjects were randomly assigned and a computer-generated list was created to achieve balance across treatment groups using permuted blocks of four. |
Unlikely
Subjects were randomly assigned to two groups and a computer-generated list was created to achieve balance across treatment groups using permuted blocks of four. A sealed opaque envelope was allocated to each subject. |
Likely
The control group did not receive any treatment or placebo. |
Unlikely
The midwife who did not participate in any subsequent phases of the study, was the only person who knew which group each patient belonged to. |
Unlikely
The midwife who did not participate in any subsequent phases of the study, was the only person who knew which group each patient belonged to. |
Unlikely
Trial outcomes listed in the methods section are also reported. |
Unclear
Reasons for lost to FU were not described. |
Unlikely
No participants were excluded from the primary intention-to treat analysis for protocol violations. Participants with missing data were excluded from the analysis, but due to low numbers bias is unlikely. |
|
Zhao, 2018 |
Subjects were 1:1:1 assigned according to random number table.
|
Unlikely
Subjects were 1:1:1 assigned according to random number table.
|
Likely
The control group did not receive any treatment or placebo. |
Unclear
It was an open label study. However, outcome measures are objective. |
Unclear
It was an open label study. However, outcome measures are objective. |
Unlikely
Trial outcomes listed in the methods section are also reported. |
Unclear
Numbers of lost to FU are not described on group level. |
Likely
The data of subjects lost to FU were not included in the analysis and numbers of lost to FU are not described on group level. |
|
Alcarzar Lazaro, 2019 |
Randomization method not described. |
Unclear
Only stated that patients were randomized. |
Likely
The control group did not receive any treatment or placebo. |
Unclear
Blinding is not described. |
Unclear
Blinding is not described. |
Unlikely
Trial outcomes listed in the methods section are also reported. |
Unlikely
None of the participants was lost to FU. |
Unlikely
Participants included in the analysis are exactly those who were randomized into the trial. |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ma, 2016 |
Resultaten weergegeven voor effect van screening, niet apart weergegeven voor patiënten die wel/niet behandeld worden met levothyroxine. |
|
Brenta, 2013 |
Richtlijn (Latin America) zonder zoekstrategie |
|
Chen, 2018 |
Systematische review – individuele studies meegenomen |
|
Lazarus, 2012 |
Studie naar effect van screening |
|
Li, 2017 |
Systematische review – individuele studies meegenomen |
|
Maraka, 2016 |
Systematische review van prospectieve studies |
|
Nazarpour, 2017 |
Geen subklinische hypothyroïdie |
|
Nazarpour, 2019 |
Systematische review – individuele studies meegenomen |
|
Rahman, 2010 |
De getallen in het artikel (en erratum) lijken niet te kloppen |
|
Rao, 2018 |
Systematische review – individuele studies meegenomen |
|
Rao, 2019 |
Systematische review – individuele studies meegenomen |
|
Reid, 2010 |
Eerdere versie van Reid, 2013 |
|
Reid, 2013 |
Studie naar effect TPO antistoffen |
|
Stagnaro-Green, 2017 |
Commentaar op Casey 2017 |
|
Thompson, 2018 |
Systematische review – individuele studies meegenomen |
|
Vissenberg, 2012 |
Systematische review – individuele studies meegenomen |
|
Yamamato, 2018 |
Systematische review – individuele studies meegenomen |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-11-2021
Laatst geautoriseerd : 23-02-2023
Geplande herbeoordeling : 01-01-2027
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2026 bepaalt het bestuur van de NIV of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Deze richtlijn is goedgekeurd door:
- Nederlands Huisartsen Genootschap
- Schildklier Organisatie Nederland
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van behandeling van volwassen patiënten (leeftijd ≥ 18 jaar) met schildklierfunctiestoornissen. Doel van deze gedeeltelijke herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met schildklierfunctiestoornissen wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met schildklierfunctiestoornissen.
Werkgroep
- Prof. dr. E. Fliers (voorzitter vanaf 1 mei 2019), internist-endocrinoloog, NIV
- Prof. dr. R. Peeters (voorzitter tot 1 mei 2019), internist-endocrinoloog, NIV
- Dr. W.E. Visser, internist-endocrinoloog, NIV
- Dr. A. Roos, internist-endocrinoloog, NIV
- Dr. M. Medici, internist-endocrinoloog, NIV
- Dr. A.F. Muller, internist-endocrinoloog, NIV
- Prof. dr. O.M. Dekkers, internist-endocrinoloog en klinisch epidemioloog, NIV
- Dr. A.A. Bouman, SON
- Dr. M.M.E. van Rumste, gynaecoloog, NVOG (vanaf 1 april 2019)
- Drs. M. Sijbom, huisarts, NHG (vanaf 1 juli 2019)
- Dr. S.A.A van den Berg, klinisch chemicus, NVKC (vanaf 1 augustus 2019)
- Drs. J.H. Scheffer, bedrijfsarts, NVAB (vanaf 1 september 2020)
Met ondersteuning van
- Drs. L. Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.R. Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. N.L. van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. E. Fliers, internist-endocrinoloog, NIV (voorzitter vanaf 1-5-2019) |
Hoofd- afdeling Endocrinologie en Metabolisme, Amsterdam UMC, Hoogleraar Endocrinologie UvA |
Board memberships, committees: - ETA guideline committee diagnosis and management of central hypothyroidism (2017-2018) - Executive Committee European Thyroid Association (tot 2019) - Program organizing committee ETA Annual Meeting 2017, 2018, 2019 - Member Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Voorzitter Medische Adviesraad Schildklier Organisatie Nederland (SON) |
Geen |
Geen |
|
Prof. dr. R. Peeters, internist-endocrinoloog, NIV (voorzitter tot 1-05-2019) |
Erasmus MC, Internist-endocrinoloog, hoogleraar schildklierziekten |
Member of International guideline committees: American Thyroid Association Task Force: Guidelines for thyroid disease and pregnancy (not remunerated)
Board memberships and committees of professional societies: - Programme Organizing Committee of the 2019 European Congress of Endocrinology. 2018 Annual Meeting of the American Thyroid Association - Iodine Global Network (https://www.ign.org/), National representative for the Netherlands (not remunerated) - Chair of the Scientific Advisory Board of the World Iodine Association (not remunerated) - Treasurer of the Dutch Thyroid Club / Foundation for Thyroid Research (not remunerated) |
Zie transparantieregister voor financiële banden (red: diverse diensten met onkosten) vergoeding van Shire International licenising, Genzyme Europe BV, Ipsen Farmaceutica BV, Merck BV, IBSA, Bayer, - Adviesraad Eisai BV (vergoeding) |
Vergoedingen waren niet gerelateerd aan de richtlijn
|
|
Dr. W.E. Visser, internist-endocrinoloog, NIV |
Erasmus MC, Internist-endocrinoloog |
Member of international committees - European Thyroid Association Task Force: Guideline on Diagnosis and Management of Resistance to Thyroid Hormone & other disorders of thyroid hormone action (2016 - present) - Educational Committee of the European Thyroid Association (2017 - present) - Chair Thyroid Network of Dutch Endocrine Society (NVE) (2017 - present)
Editorial Board membership - Editorial Board of Frontiers in Neurogenomics (2013 - present) - Editorial Board of the Journal of Endocrinology (2016 - present) - Editorial Board of the Journal of Molecular Endocrinology (2016 - present) - Editorial Board of the Endocrinology, Diabetes and Metabolism (2016 - present) - Editorial Board of the European Thyroid Journal (2017 - present)
Management role in International Consortia - Founder and chair MCT8 patient registry (2016 - present). - Chair rare thyroid hormone signalling disorders in Endo-ERN (European Reference Networks) (2016 - present) - Chair Thyroid Group of Endo-ERN EuRRECa (2018 - present)" |
Geen |
Vergoedingen niet gerelateerd aan richtlijn (diabetes, schildklierkanker) |
|
Dr. A. Roos, internist-endocrinoloog, NIV |
Internist-endocrinoloog Martini Ziekenhuis, Groningen |
Geen |
Geen |
Geen |
|
Dr. M. Medici, internist-endocrinoloog, NIV |
Internist-Endocrinoloog radboudUMC (0,6 fte) en Erasmus MC (0,4 fte) |
Management role in International Consortia
Memberships (inter)national committees:
Editorial Board memberships:
|
Erasmus Universiteit Fellowship: geen belang bij het advies van de richtlijn. |
Geen |
|
Dr. A.F. Muller, internist-endocrinoloog, NIV |
Internist, Diakonessenhuis |
Zie transparantieregister (red: diverse diensten met (onkosten)vergoeding voor Novo Nordisk, Eli Lilly and Company (adviesraad), Amgen, Sanofi) |
|
Vergoedingen waren niet gerelateerd aan de richtlijn (diabetes, schildklierkanker)
|
|
Prof. dr. O.M. Dekker, internist, NIV |
Hoogleraar Interne Geneeskunde LUMC Leiden |
Collegelid CBG (betaald) Lid Gezondheidsraad (onbetaald) Voorzitter Vereniging Epidemiologie (onbetaald)" |
Geen |
Geen |
|
Dr. A.A. Bouman, SON |
Gepensioneerd (tot 1-9-2012 werkzaam als Klinisch chemicus bij het Vumc) |
Geen |
Geen |
Geen |
|
Drs. J.H. Scheffer, NVAB |
Bedrijfsarts |
Geen |
Geen |
Geen |
|
Dr. M.M.E. van Rumste, gynaecoloog, NVOG |
Gynaecoloog, Catherinaziekenhuis |
Geen |
Geen |
Geen |
|
Drs. M. Sijbom, huisarts, NHG |
Huisarts |
Geen |
Geen |
Geen |
|
Dr. S.A.A van den Berg, klinisch chemicus, NVKC |
Klinisch Chemicus, Erasmus MC |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenvereniging Schildklier Organisatie Nederland (SON). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Richtlijn schildklierfunctiestoornissen, 2012) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep en de adviseur concept-uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg. De module over organisatie van zorg wordt opgenomen in deel 2 van de richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
