Schildkliercarcinoom - Locoregionale recidief behandeling
Uitgangsvraag
Wat is het beleid bij patiënten met een locoregionaal recidief?
Aanbeveling
Lymfekliermetastasen > 1 cm van een schildkliercarcinoom dienen bij voorkeur chirurgisch verwijderd te worden. Bij een klinisch occult locoregionaal tumorrecidief / residu in de hals kleiner dan 1 cm dat radioactief jodium opneemt kan het effect van 131I behandeling worden afgewacht.
Bij locale recidieven van een schildkliercarcinoom dient een zo volledig mogelijke resectie te worden verricht. De radicaliteit van de ingreep dient afgewogen te worden tegen de morbiditeit die met die radicaliteit gepaard gaat. Hierbij dient uiteraard de aard en localisatie van de tumor, de conditie van de patiënt en de levensverwachting te worden meegewogen.
Locoregionale recidieven van een schildkliercarcinoom dienen in een level 1-ziekenhuis voor schildklierchirurgie te worden behandeld in een multidisciplinair team.
De werkgroep is van mening dat bij schildkliercarcinoom radiotherapie valt te overwegen bij extranodale groei en tumor positieve resectieranden waarbij er geen of beperkte radioactief jodium opname is.
Overwegingen
Lokale recidieven in reeds geopereerd gebied kennen een hoog risico van morbiditeit bij re-operatie. Uitwendige radiotherapie is vooral van waarde als aanvulling op chirurgie bij positieve resectieranden of ongunstige pathologische kenmerken zoals trachea invasie of dedifferentiatie. Een combinatie van behandelingen is bij recidieven meestal noodzakelijk. De afweging welke vorm van therapie het beste is voor de individuele patiënt kan het beste worden gemaakt door een team van ervaren behandelaars, zeker wanneer ook gedacht wordt aan uitgebreide chirurgie, zoals radicale halsklierdissectie, dissectie van het bovenste mediastinum, laryngectomie, trachearesectie, pharyngectomie/ en/of proximale oesofagusresectie.
Daar waar voor de primaire behandeling de voorkeur van de werkgroep uitgaat naar postoperatieve radiotherapie bij alleen macroscopische irradicaliteit, valt dit bij een recidief ook bij microscopische irradicale resectie te overwegen. Recidieven worden uitsluitend in level 1-ziekenhuizen behandeld.
Onderbouwing
Conclusies
Er zijn aanwijzingen dat chirurgische behandeling van een lokaal recidief en recidief in level VI gaat gepaard met een 0-20% risico op permanente hypoparathyroidie en/of recurrens uitval.
Niveau 3: C Coburn (16) Kim (32) Kouvaraki (33) Leboulleux (34)
Pai 2010 (59) Palme 2005 (38)
Er zijn aanwijzingen dat een selectieve halsklierdissectie van levels IIa, III, IV, Vb en VI de voorkeur heeft boven ‘lymph node picking' bij lymfekliermetastasen van gedifferentieerd schildkliercarcinoom in niet eerder geopereerd gebied. Bij een recidief na halsklierdissectie is een completerende dissectie soms nog mogelijk.
Niveau 3: Musacchio (22) Kouvaraki (33)
Shah 2012 (40)
Er zijn aanwijzingen dat klinisch occulte jodiumopnemende locoregionale recidieven of residuklieren (< 1cm) van een schildkliercarcinoom in opzet curatief kunnen worden behandeld met 131I.
Niveau 3:Coburn (16) Grebe (50)
Creach 2010 (48)
Er zijn aanwijzingen dat indien chirurgische behandeling niet mogelijk is, 131I opnemende lymfekliermetastasen van een schildkliercarcinoom behandeld kunnen worden met 131I.
Niveau 3:Pacini (49)
Er zijn aanwijzingen dat na een irradicale resectie en bij minimale tot afwezige radioactief jodium opname van een locoregionaal recidief van een schildkliercarcinoom aanvullende uitwendige radiotherapie een verbetering van overleving kan geven.
Niveau 3: Simpson (56) D Farahati (55)
Samenvatting literatuur
Inleiding
Bij recidieven in de hals wordt onderscheid gemaakt in drie vormen:
- Lokaal recidief
Het lokaal recidief treedt op ter plaatse van de verwijderde schildklier. Een dergelijk recidief kan ontstaan door onvoldoende radicale chirurgie en onvoldoende effect van 131I-ablatie. Chirurgische oorzaken zijn een onvolledige resectie, bijvoorbeeld vanwege tumoringroei in de n. recurrens en trachea. In dergelijke gevallen is de radioactief jodiumablatie soms onvoldoende vooral bij te grote tumorresten of door relatieve ongevoeligheid voor 131I. - Regionaal recidief (level VI)
Het recidief is gelegen in het centrale halskliercompartiment (level VI). Dit is een regionaal recidief vlakbij het schildklierbed, gelegen in de oesofagotracheale groeve en in het bovenste deel van het voorste mediastinum. Hier liggen de lymfeklieren waarin frequent de eerste metastasen optreden. Wanneer deze lymfeklieren niet (allemaal) bij de primaire thyreoidectomie zijn verwijderd kunnen deze zichtbaar worden op een 131I-postablatiescan. Wanneer deze klieren teveel tumorweefsel bevatten, of de tumor intrinsiek minder gevoelig is voor 131I, worden ze soms niet volledig vernietigd door de 131I behandeling. Het onderscheid met een lokaal recidief is vaak moeilijk omdat beide recidieven zijn gelegen in het centrale halscompartiment. - Regionaal recidief (lateraal level II-V)
De derde plaats waar een regionaal tumorrecidief kan optreden in de hals is het laterale halscompartiment (levels I-V). Na de klieren centraal in de hals is dit het volgende lymfeklierstation waar metastasen van het schildkliercarcinoom worden aangetroffen.
Ondanks de goede prognose van het gedifferentieerd schildkliercarcinoom zal ongeveer 15-35% een locoregionaal recidief of afstandsmetastasen ontwikkelen. [Randolph 2012 (1)] (2) (3) De kans op recidieven is afhankelijk van multipele factoren en meerdere auteurs hebben getracht deze risicofactoren te groeperen en de behandeling op deze risicogroepindeling af te stemmen. [Kim 2012 (4)] (5) Mannelijk geslacht, hoger tumorstadium, multifocaliteit, tumor ingroei in omliggende structuren, lymfekliermetastasen en kapseldoorbraak verhogen de kans op een locoregionaal recidief. [Baek 2010 (6)] (7) (8) (9) (10) (11) (12) (13) (14) Ook inadequate chirurgie initieel is een belangrijke risicofactor [Kouvaraki 2004 (15)]. Circa 50% van de recidieven worden ontdekt in de eerste 2 jaar na initiële behandeling doch zelfs na meer dan 10 jaar kan het eerste recidief optreden. (9) (16) Hoewel patiënten met een locoregionaal recidief meestal nog goed behandelbaar zijn, loopt de mortaliteit bij multipele recidieven op tot circa 40-50% omdat deze patiënten frequent afstandsmetastasen onwikkelen [Palme 2004, Holer 2009 (17) (18)]. Deze afstandsmetastasen zijn de belangrijkste oorzaak van overlijden waarbij de overlevingskansen toch nog rond de 50% liggen. [Nixon 2011, Magarey 2013 (19) (20)] (8) Patiënten met alleen een recidief in de lymfeklieren overlijden zelden aan de ziekte, maar het optreden van een lokaal recidief geeft een grotere kans op mortaliteit met in de literatuur opgegeven percentages tussen 17 en 64%. (5) (21) (22) (23) Ook bij patiënten bij wie de primaire tumor macroscopisch niet volledig kan worden verwijderd, ligt de kans op overlijden ten gevolge van de ziekte relatief hoog. (5) (10) (24) Er kan onderscheid gemaakt worden tussen macroscopische ziekte dat met beeldvormend onderzoek gevisualiseerd kan worden en microscopische ziekte die ontdekt wordt door aantoonbaar thyreoglobuline zonder dat dit in beeld kan worden gebracht. Het is belangrijk om macroscopische recidieven en metastasen zo vroeg mogelijk te ontdekken omdat dit belangrijk is voor de behandeling en mogelijk invloed heeft op de prognose. (9) (16)
Wanneer er op de post-ablatie scintigrafie residuele ziekte in de hals wordt gezien, wordt dit in ongeveer 80% van de gevallen middels 131I therapie gecureerd. Bij de overige patiënten is chirurgie meestal nog curatief [Creach 2010 (25)].
Onder macroscopisch aantoonbaar locoregionaal recidief of persisterende ziekte wordt de aanwezigheid van schildkliercarcinoomweefsel in het schildklierbed of in de hals of mediastinum verstaan, al dan niet na een periode van remissie. Met afstandsmetastasen worden alle metastasen buiten bovengenoemd gebied bedoeld.
Een recidief kan aangetoond worden door klinisch manifeste metastasen, meestal in de hals, echografisch aangetoonde recidieven in de laterale hals of level VI of biochemisch door een stijgende Tg spiegel. Bij een stijgende Tg-spiegel is een echografie van de hals, eventueel aangevuld met gerichte aspiratie cytologie het eerste diagnosticum [Seo 2012, Torlontano 2004 (26) (27)]. Een jodiumscan kan gebruikt worden om afstandsmetastasen aan te tonen en de gevoeligheid voor aanvullende jodiumtherapie in kaart te brengen. Wanneer de jodium scan (en echografie) negatief zijn, kan een FDG-PET-CT-scan uitkomst bieden. Vooral bij tumoren die geen jodium (meer) opnemen is dit een waardevol diagnosticum [Riemann 2013 (28)]. Hoewel de 18FDG-PET-scan minder gevoelig is dan echografie, kunnen klieren retropharyngeaal en afstandsmetastasen betrouwbaarder worden gevonden. FDG-positieve en jodiumnegatieve tumoren hebben een aggressiever beloop [Vural 2012 (29)].
Literatuurbespreking
Therapie, locoregionaal
Behandelingsmogelijkheden
Er zijn geen gerandomiseerde studies betreffende de behandeling van tumorrecidief van het schildkliercarcinoom. Dit komt enerzijds door het zeldzame voorkomen van het schildkliercarcinoom maar ook door de variatie in lokalisatie en wisselende tijdsintervallen waarin recidieven optreden.
Aanbevelingen omtrent de behandeling van locoregionale recidieven zijn gebaseerd op retrospectieve series. (9) (12) (16) (30) (21) (22) (23) (31) (32) (33) (34) (35) (36) (37) Er wordt onderscheid gemaakt in klinisch occulte recidieven die alleen zichtbaar zijn op een radioactief jodiumscan of middels echo zijn aangetoond en de klinisch opgemerkte recidieven.
De reguliere behandelingsmogelijkheden bestaan uit 1) chirurgie, 2) 131I therapie 3) uitwendige radiotherapie of een combinatie van deze modaliteiten.
Chirurgie
Lokaal recidief en regionaal recidief level VI
Na een totale thyreoidectomie en zeker wanneer een centrale halsklierdissectie is verricht, zal chirurgische excisie van een lokaal recidief of een lymfeklierrecidief in level VI technisch lastig zijn. Een heroperatie in dit gebied betekent opereren in littekenweefsel waarin veelal de n. recurrens en de bijschildklieren zijn gelegen [Palme 2005, Shaha 2008 (38) (39)]. Er is een hoger risico op permanente hypoparathyroidie en paralyse van de n. laryngeus recurrens [Pai 2010] In de literatuur wordt een risico tussen de 0% en 5% op recurrensparalyse en een risico tussen 0% en 20% op hypoparathyroidie gerapporteerd. [Magarey 2013, Shah 2012 (20) (40)] (41) (42) Bij chirurgie moet een partiele trachearesectie overwogen worden bij invasie van de trachea [Sywak 2003 (43)]. Zenuwmonitoring is mogelijk effectief bij het voorkomen van permanente schade aan de nervus recurrens en maakt een meer complete resectie mogelijk [Kim 2004]. Vi-a de hals kunnen meestal ook hoog-mediastinale kliermetastasen veilig worden verwijderd [Kim 2004, Khoo 2003 (44) (45)].
Wanneer het recidief beperkt is en 131I opneemt, verdient een behandeling daarmee in eerste instantie de voorkeur. (16) (34) Indien 131I onvoldoende effect heeft en wanneer het een groot recidief betreft, moet de afweging worden gemaakt tussen complexe chirurgie, met veelal resectie van (een deel van) de trachea en/of larynx en een grote kans op beschadiging van de n. recurrens en bijschildklieren en de mogelijkheden van uitwendige radiotherapie. (3)
Regionaal recidief (Lateraal level II-V)
Indien laterale halskliermetastasen optreden in een niet eerder geopereerd deel van de hals, kan met een selectieve halsklierdissectie (levels IIa, III, IV, Vb) een goede controle worden bereikt [Hasney 2010, Farrag 2009, Ferris 2012]. (zie module Behandeling van lymfekliermetastasen. De morbiditeit is gering wanneer vena jugularis interna, musculus sternocleidomastoideus, nervus accessorius, phrenicus en vagus worden gespaard. (31) Bij een goede gevoeligheid van de tumor voor 131I kan men qua radicaliteit van de resectie terughoudend zijn met het opofferen van hierboven genoemde structuren. (10) (13) (14) (24) (46)
Ook na een een selectieve halsklierdissectie of een ‘berrie-picking' operatie, is een completerende of gemodificeerde radicale halsklierdissectie meestal nog goed mogelijk, zij het dat de kans op ingroei in zenuwen en bloedvaten en dus ook de kans dat deze structuren moeten worden opgeofferd is toegenomen. Een MRI-scan is bij deze patiënten aan te raden om de exacte uitbreiding aan te tonen en invasie van vitale structuren uit te sluiten. Wanneer een halsrecidief niet palpabel is doch op echografie goed gezien wordt, is markering met radio-actief Technetium gelabeled Albumine of intraoperatieve echografie een overweging [Martino 2010 (47)]. Externe radiotherapie kan worden overwogen bij dergelijke recidieven, maar in de literatuur zijn geen goede gegevens bekend omtrent de effectiviteit hiervan.
Radioactief Jodiumtherapie
Bij beperkte lymfekliermetastasen die zichtbaar zijn op de postablatie-scan is een expectatief beleid verantwoord omdat het overgrote deel van deze metastasen gecureerd worden met 131I [Creach 2010 (48)]. Wanneer een recidief in de hals chirurgisch niet of lastig te verwijderen is, kan 131I overwogen worden. Pacini meldde een genezingspercentage van ruim 75% bij patiënten met lymfekliermetastasen die met 131I werden behandeld. (49)
Recidieven die niet op een 131I scan worden gevisualiseerd, hebben een ongunstiger prognose. 337 Deze recidieven worden indien mogelijk operatief behandeld. Postoperatief kan aanvullende externe radiotherapie gegeven worden (zie hieronder). Indien recidieven 131I opnemen, is nabehandeling met 131I meestal aangewezen. 131I is effectiever bij een klein tumorvolume. (50) Er is geen vergelijkend onderzoek bekend van de verschillende modaliteiten. Wel zijn er aanwijzingen dat de gecombineerde behandeling van locoregionale recidieven vaak zeer effectief is. (9) (10) (16)
De klinisch occulte recidieven hebben vaak een gunstiger prognose en zijn veelal goed behandelbaar met alleen 131I therapie (14) (51) (52) Het is niet duidelijk tot welke grootte halskliermetastasen met uitsluitend 131I behandeld kunnen worden.
Radiotherapie
Literatuur over de waarde van radiotherapie is erg schaars. In reviews wordt in het algemeen aangegeven dat uitwendige radiotherapie is aangewezen bij een recidief, waarbij geen tot zeer beperkte 131I opname is en waarbij na chirurgie sprake is van microscopische rest. (53) (54) In enkele studies geeft postoperatieve radiotherapie een verlenging van de ziektevrije overleving. (55) (56)
Overige therapieën
Wanneer bovenstaande therapieën niet mogelijk of zinvol zijn, zijn er nog enkele alternatieven.
Voor beperkte recidieven is ethanol injectie of radiofrequente ablatie (RFA) beschreven. Dit moet gezien worden als een experimentele behandeling [Magarey 2013, Kim 2008 (20) (57)]. Bij patiënten waarvoor een standaard antitumor behandeling ontbreekt is inclusie in een trial met thyrosine kinase inhibitoren soms een optie [Bible 2012 (58)].
Referenties
- 1 - Randolph GW, Duh QY, Heller KS et al. The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension. Thyroid: official journal of the American Thyroid Association 22(11), 1144-1152 (2012). # http://www.ncbi.nlm.nih.gov/pubmed/23083442
- 2 - Beasley NJ, Lee J, Eski S, Walfish P, Witterick I, Freeman JL. Impact of nodal metastases on prognosis in patients with well-differentiated thyroid cancer 13. Arch Otolaryngol Head Neck Surg 2002 Jul+ADs-128(7):825-8.
- 3 - Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994 Nov+ADs-97(5):418-28.
- 4 - Kim KM, Park JB, Bae KS et al. Analysis of prognostic factors in patiënts with multiple recurrences of papillary thyroid carcinoma. Surgical oncology 21(3), 185-190 (2012). # http://www.ncbi.nlm.nih.gov/pubmed/21855321
- 5 - Shaha AR. Implications of prognostic factors and risk groups in the management of differentiated thyroid cancer. Laryngoscope 2004 Mar+ADs-114(3):393-402.
- 6 - Baek SK, Jung KY, Kang SM et al. Clinical risk factors associated with cervical lymph node recurrence in papillary thyroid carcinoma. Thyroid 20(2), 147-152 (2010).#http://www.ncbi.nlm.nih.gov/pubmed/19785522
- 7 - Chow SM, Law SC, Chan JK, Au SK, Yau S, Lau WH. Papillary microcarcinoma of the thyroid-Prognostic significance of lymph node metastasis and multifocality. Cancer 2003 Jul 1+ADs-98(1):31-40.
- 8 - Beasley NJ, Walfish PG, Witterick I, Freeman JL. Cause of death in patients with well-differentiated thyroid carcinoma. Laryngoscope 2001 Jun+ADs-111(6):989-91.
- 9 - Hamby LS, McGrath PC, Schwartz RW, Sloan DA, Simpson WG, Kenady DE. Management of local recurrence in well-differentiated thyroid carcinoma. J Surg Res 1992 Feb+ADs-52(2):113-7.
- 10 - Lerch H, Schober O, Kuwert T, Saur HB. Survival of differentiated thyroid carcinoma studied in 500 patients 53. J Clin Oncol 1997 May+ADs-15(5):2067-75.
- 11 - Nishida T, Nakao K, Hashimoto T. Local control in differentiated thyroid carcinoma with extrathyroidal invasion 13. Am J Surg 2000 Feb+ADs-179(2):86-91.
- 12 - Palme CE, Waseem Z, Raza SN, Eski S, Walfish P, Freeman JL. Management and outcome of recurrent well-differentiated thyroid carcinoma. Arch Otolaryngol Head Neck Surg 2004 Jul+ADs-130(7):819-24.
- 13 - Paloyan E, Walker RP, Lawrence AM. Guidelines for the use of radio-iodine, thyroid hormone, and treatment of metastatic disease in patients with differentiated thyroid cancer. Surg Oncol Clin N Am 1998 Oct+ADs-7(4):665-80.
- 14 - Vassilopoulou-Sellin R, Schultz PN, Haynie TP. Clinical outcome of patients with papillary thyroid carcinoma who have recurrence after initial radioactive iodine therapy 68. Cancer 1996 Aug 1+ADs-78(3):493-501.
- 15 - Kouvaraki MA, Lee JE, Shapiro SE et al. Preventable reoperations for persistent and recurrent papillary thyroid carcinoma. Surgery 136(6), 1183-1191 (2004). # http://www.ncbi.nlm.nih.gov/pubmed/15657574
- 16 - Coburn M, Teates D, Wanebo HJ. Recurrent thyroid cancer. Role of surgery versus radioactive iodine (I131). Ann Surg 1994 Jun+ADs-219(6):587-93.
- 17 - Palme CE, Waseem Z, Raza SN et al. Management and outcome of recurrent well-differentiated thyroid carcinoma. Arch.Otolaryngol.Head Neck Surg. 130(7), 819-824 (2004). # http://www.ncbi.nlm.nih.gov/pubmed/15262757
- 18 - Holler T, Theriault J, Payne RJ et al. Prognostic factors in patiënts with multiple recurrences of well-differentiated thyroid carcinoma. J Oncol 2009, 650340 (2009). # http://www.ncbi.nlm.nih.gov/pubmed/19841680
- 19 - Nixon IJ, Ganly I, Palmer FL et al. Disease-related death in patiënts who were considered free of macroscopic disease after initial treatment of well-differentiated thyroid carcinoma. Thyroid 21(5), 501-504 (2011). # http://www.ncbi.nlm.nih.gov/pubmed/21476889
- 20 - Magarey MJ, Freeman JL. Recurrent well-differentiated thyroid carcinoma. Oral Oncology 49(7), 689-694 (2013). # http://www.ncbi.nlm.nih.gov/pubmed/23623403
- 21 - Czaja JM, McCaffrey TV. The surgical management of laryngotracheal invasion by well-differentiated papillary thyroid carcinoma 54. Arch Otolaryngol Head Neck Surg 1997 May+ADs-123(5):484-90.
- 22 - Musacchio MJ, Kim AW, Vijungco JD, Prinz RA. Greater local recurrence occurs with +ACI-berry picking+ACI- than neck dissection in thyroid cancer 12. Am Surg 2003 Mar+ADs-69(3):191-6.
- 23 - Stojadinovic A, Shoup M, Nissan A, Ghossein RA, Shah JP, Brennan MF, et al. Recurrent differentiated thyroid carcinoma: biological implications of age, method of detection, and site and extent of recurrence. Ann Surg Oncol 2002 Oct+ADs-9(8):789-98.
- 24 - Samaan NA, Schultz PN, Hickey RC, Goepfert H, Haynie TP, Johnston DA, et al. The results of various modalities of treatment of well differentiated thyroid carcinomas: a retrospective review of 1599 patients. J Clin Endocrinol Metab 1992 Sep+ADs-75(3):714-20.
- 25 - Creach KM, Gillanders WE, Siegel BA et al. Management of cervical nodal metastasis detected on 131I scintigraphy after initial surgery of well-differentiated thyroid carcinoma. Surgery 148(6), 1198-1204; discussion 1204-1196 (2010). # http://www.ncbi.nlm.nih.gov/pubmed/21134552
- 26 - Seningen JL, Nassar A, Henry MR. Correlation of thyroid nodule fine-needle aspiration cytology with corresponding histology at Mayo Clinic, 2001-2007: an institutional experience of 1945 cases. Diagn Cytopathol 2012: 40: E27-E32. # http://www.ncbi.nlm.nih.gov/pubmed/22619156
- 27 - Torlontano M, Attard M, Crocetti U et al. Follow-up of low risk patiënts with papillary thyroid cancer: role of neck ultrasonography in detecting lymph node metastases. J.Clin.Endocrinol.Metab 89(7), 3402-3407 (2004). # http://www.ncbi.nlm.nih.gov/pubmed/15240622
- 28 - Rapkin L, Pashankar FD. Management of thyroid carcinoma in children and young adults. J Pediatr Hematol Oncol. 2012 May;34 Suppl 2:S39-46. doi: 10.1097/MPH.0b013e31824e37a6. Rev 2011;32:798-826. # http://www.ncbi.nlm.nih.gov/pubmed/22525405
- 29 - Vriens D, de Wilt JH, van der Wilt GJ, Netea-Maier RT, Oyen WJ, de Geus-Oei LF. The role of [18F]-2-fluoro-2-deoxy-d-glucose-positron emission tomography in thyroid nodules with indeterminate fine-needle aspiration biopsy: systematic review and meta-analysis of the literature. Cancer 2011; 117(20): 4582-94. # http://www.ncbi.nlm.nih.gov/pubmed/21432844
- 30 - Asakawa H, Kobayashi T, Komoike Y, Tamaki Y, Matsuzawa Y, Monden M. Prognostic factors in patients with recurrent differentiated thyroid carcinoma 56. J Surg Oncol 1997 Mar+ADs-64(3):202-6.
- 31 - El Ghani F, van den Brekel MW, De Goede CJ, Kuik J, Leemans CR, Smeele LE. Shoulder function and patient well-being after various types of neck dissections. Clin Otolaryngol Allied Sci 2002 Oct+ADs-27(5):403-8.
- 32 - Kim MK, Mandel SH, Baloch Z, Livolsi VA, Langer JE, Didonato L, et al. Morbidity following central compartment reoperation for recurrent or persistent thyroid cancer. Arch Otolaryngol Head Neck Surg 2004 Oct+ADs-130(10):1214-6.
- 33 - Kouvaraki MA, Lee JE, Shapiro SE, Sherman SI, Evans DB. Preventable reoperations for persistent and recurrent papillary thyroid carcinoma. Surgery 2004 Dec+ADs-136(6):1183-91.
- 34 - Leboulleux S, Rubino C, Baudin E, Caillou B, Hartl DM, Bidart JM, et al. Prognostic factors for persistent or recurrent disease of papillary thyroid carcinoma with neck lymph node metastases and/or tumor extension beyond the thyroid capsule at initial diagnosis. J Clin Endocrinol Metab 2005 Oct+ADs-90(10):5723-9.
- 35 - Musholt TJ, Musholt PB, Behrend M, Raab R, Scheumann GF, Klempnauer J. Invasive differentiated thyroid carcinoma: tracheal resection and reconstruction procedures in the hands of the endocrine surgeon 2. Surgery 1999 Dec+ADs-126(6):1078-87.
- 36 - Ooi LL, Soo KC. Tracheo-oesophageal groove clearance in well differentiated thyroid carcinoma 79. Ann Acad Med Singapore 1992 Sep+ADs-21(5):699-700.
- 37 - Wada N, Duh QY, Sugino K, Iwasaki H, Kameyama K, Mimura T, et al. Lymph node metastasis from 259 papillary thyroid microcarcinomas: frequency, pattern of occurrence and recurrence, and optimal strategy for neck dissection. Ann Surg 2003 Mar+ADs-237(3):399-407.
- 38 - Palme CE, Freeman JL. Surgical strategy for thyroid bed recurrence in patiënts with well-differentiated thyroid carcinoma. J.Otolaryngol. 34(1), 7-12 (2005). # http://www.ncbi.nlm.nih.gov/pubmed/15966469
- 39 - Shaha AR. Revision thyroid surgery - technical considerations. Otolaryngologic clinics of North America. 2008; 41: 1169-83, x. # http://www.ncbi.nlm.nih.gov/pubmed/19040977
- 40 - Shah MD, Harris LD, Nassif RG et al. Efficacy and safety of central compartment neck dissection for recurrent thyroid carcinoma. Archives of otolaryngology--head & neck surgery 138(1), 33-37 (2012). # http://www.ncbi.nlm.nih.gov/pubmed/22249626
- 41 - Miccoli P, Antonelli A, Spinelli C, Ferdeghini M, Fallahi P, Baschieri L. Completion total thyroidectomy in children with thyroid cancer secondary to the Chernobyl accident. Arch Surg 1998 Jan+ADs-133(1):89-93.
- 42 - Wilson DB, Staren ED, Prinz RA. Thyroid reoperations: indications and risks. Am Surg 1998 Jul+ADs-64(7):674-8.
- 43 - Sywak, M., Pasieka, J. L., McFadden, S. et al. (2003). Functional results and quality of life after tracheal resection for locally invasive thyroid cancer. American Journal of Surgery, 185(5), 462-467. # http://www.ncbi.nlm.nih.gov/pubmed/12727568
- 44 - Kim MK, Mandel SH, Baloch Z et al. Morbidity following central compartment reoperation for recurrent or persistent thyroid cancer. Arch.Otolaryngol.Head Neck Surg. 130(10), 1214-1216 (2004). # http://www.ncbi.nlm.nih.gov/pubmed/15492172
- 45 - Khoo ML, Freeman JL. Transcervical superior mediastinal lymphadenectomy in the management of papillary thyroid carcinoma 16. Head Neck 25(1), 10-14 (2003). # http://www.ncbi.nlm.nih.gov/pubmed/12478538
- 46 - Sherman SI. Thyroid carcinoma. Lancet 2003 Feb 8+ADs-361(9356):501-11.
- 47 - Mallick U, Harmer C, Yap B et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med. 2012;366(18):1674-85. # http://www.ncbi.nlm.nih.gov/pubmed/22551128
- 48 - Creach KM, Gillanders WE, Siegel BA et al. Management of cervical nodal metastasis detected on 131I scintigraphy after initial surgery of well-differentiated thyroid carcinoma. Surgery 148(6), 1198-1204; discussion 1204-1196 (2010). # http://www.ncbi.nlm.nih.gov/pubmed/21134552
- 49 - Pacini F, Cetani F, Miccoli P, Mancusi F, Ceccarelli C, Lippi F, et al. Outcome of 309 patients with metastatic differentiated thyroid carcinoma treated with radioiodine. World J Surg 1994 Jul+ADs-18(4):600-4.
- 50 - Grebe SK, Hay ID. Thyroid cancer nodal metastases: biologic significance and therapeutic considerations. Surg Oncol Clin N Am 1996 Jan+ADs-5(1):43-63.
- 51 - DeGroot LJ, Kaplan EL, McCormick M, Straus FH. Natural history, treatment, and course of papillary thyroid carcinoma. J Clin Endocrinol Metab 1990 Aug+ADs-71(2):414-24.
- 52 - Robbins RJ, Schlumberger MJ. The evolving role of (131)I for the treatment of differentiated thyroid carcinoma. J Nucl Med 2005 Jan+ADs-46 Suppl 1:28S-37S.
- 53 - Mazzaferri EL, Kloos RT. Is Diagnostic Iodine-131 Scanning with Recombinant Human TSH Useful in the Follow-Up of Differentiated Thyroid Cancer after Thyroid Ablation? J Clin Endocrinol Metab 2002 Apr+ADs-87(4):1490-8.
- 54 - Mazzarotto R, Cesaro MG, Lora O, Rubello D, Casara D, Sotti G. The role of external beam radiotherapy in the management of differentiated thyroid cancer. Biomed Pharmacother 2000 Jul+ADs-54(6):345-9.
- 55 - Farahati J, Reiners C, Stuschke M, Muller SP, Stuben G, Sauerwein W, et al. Differentiated thyroid cancer. Impact of adjuvant external radiotherapy in patients with perithyroidal tumor infiltration (stage pT4). Cancer 1996 Jan 1+ADs-77(1):172-80.
- 56 - Simpson WJ, McKinney SE, Carruthers JS, Gospodarowicz MK, Sutcliffe SB, Panzarella T. Papillary and follicular thyroid cancer. Prognostic factors in 1578 patients 12. Am J Med 1987 Sep+ADs-83(3):479-88.
- 57 - Kim BM, Kim MJ, Kim EK, Park SI, Park CS, Chung WY. Controlling recurrent papillary thyroid carcinoma in the neck by ultrasonography-guided percutaneous ethanol injection. European radiology 18(4), 835-842 (2008). # http://www.ncbi.nlm.nih.gov/pubmed/18040692
- 58 - Bible KC. Treating advanced radioresistant differentiated thyroid cancer. Lancet Oncol 13(9), 854-855 (2012).#http://www.ncbi.nlm.nih.gov/pubmed/22898677
- 59 - Pai SI, Tufano RP. Reoperation for recurrent/persistent well-differentiated thyroid cancer. Otolaryngol Clin North Am 43(2), 353-363, ix (2010). # http://www.ncbi.nlm.nih.gov/pubmed/20510718
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 16-02-2015
Laatst geautoriseerd : 16-02-2015
Geplande herbeoordeling :
Versie: 2.0, Consensus based 2015-02-16 , Evidence based 2007-06-01
Actualisatie
Deze module is goedgekeurd op 3 juli 2014.IKNL bewaakt samen met betrokken verenigingen de houdbaarheid van deze en andere onderdelen van de richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Houderschap richtlijn
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de verenigingen van beroepsbeoefenaren die de richtlijn autoriseren.
Integraal Kankercentrum Nederland draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken.
Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Algemene gegevens
Inleiding
Schildkliercarcinoom is een zeldzame aandoening. De incidentie is 2/100.000/jaar bij mannen en 4,5/100.000/jaar bij vrouwen. De cijfers van de Nederlandse Kankerregistratie (NKR) geven een stijging van de incidentie weer, van 356 nieuwe patiënten met schildkliercarcinoom in 2001 tot 611 in 2011. Gezien de relatief gunstige prognose en het ouder worden van mensen in het algemeen is de prevalentie hoog. De prevalentie is toegenomen van 2988 in 2007 naar 3821 in 2012. De 5-jaars relatieve overleving was 15 jaar geleden 74% en bedraagt nu 84%.
De meest voorkomende vormen van schildkliercarcinoom zijn het papillair schildkliercarcinoom en het folliculair schildkliercarcinoom; samen 80-85% van alle schildkliercarcinomen, in een verhouding van papillair: folliculair van 4:1. In Nederland was de incidentie in 2011 respectievelijk 395 en 104. Papillaire en folliculaire schildkliercarcinoom worden ook wel aangeduid als gedifferentieerd schildkliercarcinoom. Door de specifieke tumorkarakteristieken (jodiumopnemend vermogen, productie van thyreoglobuline) vormen de goed gedifferentieerde papillaire en folliculaire schildkliercarcinomen wat betreft behandeling en follow-up een aparte groep. Deze goed gedifferentieerde schildkliercarcinomen worden in deze richtlijn besproken.
De resterende groep schildkliercarcinomen (10-15%) bestaat uit medullair (ongeveer 5-10%) en anaplastisch (ongeveer 6%) schildkliercarcinoom. De behandeling en follow-up van deze tumoren blijft in deze richtlijn buiten beschouwing. Het medullaire schildkliercarcinoom is weliswaar een gedifferentieerde tumor, maar wordt niet tot de goed gedifferentieerde schildkliercarcinomen gerekend gezien de origine uit de C-cellen in plaats van uit folliculair epitheel, de andere tumor biologie en de behandeling. Voor de diagnostiek, behandeling en follow-up wordt verwezen naar de internationale richtlijnen van de ATA en de ETA.
In 2007 werd de eerste Nederlandse richtlijn gedifferentieerd (niet-medullair) schildkliercarcinoom gepubliceerd, die is gebaseerd op de principes van ‘Evidence Based Medicine'. De richtlijn werd ontwikkeld op initiatief van de Nederlandse Vereniging voor Nucleaire Geneeskunde en de Nederlandse Vereniging voor Endocrinologie in samenwerking met het Kwaliteitsinstituut voor Gezondheidszorg CBO en de Vereniging van Integrale Kankercentra.
In 2012 werd, zoals vastgelegd in de richtlijn, een nieuwe multidisciplinaire werkgroep geïnstalleerd voor een volledige herziening van de eerste versie van de richtlijn op initiatief van de Nederlandse Vereniging voor Endocrinologie en in samenwerking met Integraal Kankercentrum Nederland (IKNL). In deze werkgroep zijn zorgverleners vanuit verschillende (para)medische disciplines betrokken.
Knelpuntenanalyse
De resultaten van de knelpuntenanalyse, zie Aanverwant.
Doel en doelgroep
Doelstelling
De richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het betreft een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een (mogelijk) schildkliercarcinoom. De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. De richtlijn kan door de professional gebruikt worden bij de klinische besluitvorming. Bij de besluitvorming is de professional zich ervan bewust dat keuzes altijd gemaakt worden in samenspraak met de patiënt (shared decision making). Het is van belang de patiënt goed te informeren over de verschillende opties en hem/haar te betrekken bij de besluitvorming omdat dit leidt tot een hogere patiënttevredenheid en betere uitkomsten van zorg. 987 988 989 990 991 992.
De richtlijn Schildkliercarcinoom geeft aanbevelingen over diagnostiek, behandeling, nacontrole, nazorg en organisatie van zorg bij patiënten met (een mogelijk) schildkliercarcinoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op wetenschappelijk bewijs dan op ervaringen en meningen, de transparantie te vergroten en de diversiteit van handelen door professionals te verminderen.
Gezien de complexiteit van zowel de diagnose, de behandeling, en de follow-up van schildkliercarcinoom, worden organisatorische aanbevelingen gedaan om tot kwalitatief hoogstaande zorg voor deze patiënten in Nederland te komen. De richtlijn wordt tevens gebruikt bij het ontwikkelen van (digitaal) patiëntenvoorlichtingmateriaal van Schildklier Organisaties Nederland (SON).
Doelpopulatie
De richtlijn is van toepassing op alle volwassen patiënten (> 18 jaar) met een (mogelijk) gedifferentieerd (niet-medullair) schildkliercarcinoom.
Doelgroep
De richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling, follow-up en voorlichting en begeleiding van patiënten met een gedifferentieerd schildkliercarcinoom, zoals internist-endocrinologen, kno-artsen, internist-oncologen, nucleair geneeskundigen, chirurgen, pathologen, radiologen en radiotherapeuten, huisartsen, oncologieverpleegkundigen, verpleegkundig specialisten, diëtisten en IKNL-consulenten.
Samenstelling werkgroep
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in april 2012 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle bij de diagnostiek en behandeling van patiënten met een gedifferentieerd schildkliercarcinoom betrokken medische en paramedische disciplines, een vertegenwoordiger van de Schildklierstichting Nederland en medewerkers van Integraal Kankercentrum Nederland.
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties, alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging.
Werkgroepleden 2014
Voorzitter
Mw. prof. dr. Thera Links, internist-endocrinoloog, Universitair Medisch Centrum Groningen, gemandateerd namens de NIV
Procesbegeleider/contactpersoon
Mw. Janina Schrier, MSc, adviseur richtlijnen IKNL, j.schrier@iknl.nl / 06-53 67 94 21
Drs. Jos de Groot, adviseur richtlijnen IKNL (tot mei 2013)
Leden
Prof. dr. M.W.M. van den Brekel (namens Nederlandse Vereniging KNO, Antoni van Leeuwenhoek) Mw. M.A. Dagelet (namens NFK)
Dr. L.J.M. de Heide (namens NIV, Medisch Centrum Leeuwarden)
Dr. M.J.R. Janssen (namens NVNG, Radboudumc)
Mw. dr. H.W. Kapiteijn (namens NIV, Leids Universitair Medisch Centrum)
Prof. dr. J. Kievit (namens NVVH, Leids Universitair Medisch Centrum)
Dr. J.M.H. de Klerk (namens NVNG, Meander Medisch Centrum)
Dr. E.G.W.M. Lentjes (namens NVKC, Universitair Medisch Centrum Utrecht)
Prof. dr. A. van der Lugt (namens NVVR, Erasmus Medisch Centrum)
Mw. dr. F.H. van Nederveen (namens NVVP, Laboratorium voor Pathologie Dordrecht)
Mw. A. Ormeling (namens NFK)
Prof. dr. J.Th.M. Plukker (namens NVVH, Universitair Medisch Centrum Groningen)
Mw. J. van der Putten-Van Gils (namens V&VN, Leids Universitair Medisch Centrum)
Prof. dr. J.W.A. Smit (namens NIV, Radboudumc)
Dr. C.H.J. Terhaard (namens NVRO, Universitair Medisch Centrum Utrecht)
Dr. M.R. Vriens (namens NVVH, Universitair Medisch Centrum Utrecht)
Mw. dr. J.E. van der Wal (namens NVVP, Martini Ziekenhuis)
Ondersteuning
Mw. T.T.M. (Thekla) Bluemink-Holkenborg, secretaresse IKNL
Dhr. dr. J. Vlayen, literatuuronderzoeker, ME-TA
Werkgroepleden 2007
Kernredactie
Mw. dr. T.P. Links, internist-endocrinoloog, Universitair Medisch Centrum Groningen, voorzitter
Drs. L.J.M. de Heide, internist-endocrinoloog, Medisch Centrum Leeuwarden
Mw. M.S.C. van Heerden, secretaresse, namens Integraal Kankercentrum Noord- Nederland, Groningen
Mw. drs. E.W. Klokman, adviseur, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
Mw. drs. C.J.G.M. Rosenbrand, senior adviseur, Kwaliteitsinstituut voor de Gezondheidszorg CBO, Utrecht
Mw. Drs. Y. van der Wel, hoofd medische zaken, Integraal Kankercentrum Noord-Nederland, Groningen
Werkgroep
Dr. M.W.M. van den Brekel, KNO-arts, Nederlands Kankerinstituut, Amsterdam
Drs. W.I. de Bruin, nucleair geneeskundige, Medisch Spectrum Twente, Enschede
Prof.dr. A.P. Bruïne, patholoog, Academisch Ziekenhuis Maastricht
Dr. A.A.M. Franken, internist-endocrinoloog, Isala Klinieken, Zwolle
Prof.dr. J.F.Hamming, chirurg, Leids Universitair Medisch Centrum, Leiden
Mw. dr. D.A.K.C.J.M. Huysmans, nucleair geneeskundige, Catharina Ziekenhuis, Eindhoven
Prof.dr. J. Kievit, chirurg, Leids Universitair Medisch Centrum, Leiden
Dr. J.M.H. de Klerk, nucleair geneeskundige, Meander Medisch Centrum, Amersfoort
P.F. Lakwijk, Schildklierstichting Nederland, Amersfoort
Dr. M. van Leeuwen, Radioloog, Universitair Medisch Centrum Utrecht
Dr. E.G.W.M. Lentjes, klinisch chemicus, Universitair Medisch Centrum Utrecht
Prof.dr. P.C. Levendag, radiotherapeut, Erasmus Medisch Centrum, Rotterdam
Dr. W.I.B. Mastboom, chirurg, Medisch Spectrum Twente, Enschede
Prof.dr. J. Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden
Dr. H. van Overhagen, radioloog, HagaZiekenhuis, Den Haag
Mw. drs. R. van Pel, patholoog, Nederlands Kankerinstituut, Amsterdam
Drs. H. van Pelt, medisch maatschappelijk werk, Medisch Centrum Leeuwarden
Drs. J. Puylaert, radioloog, Medisch Centrum Haaglanden, Den Haag
Drs. A.P.M. Schellekens, klinisch chemicus, Catharina Ziekenhuis, Eindhoven
Mw. I. Siersema, verpleegkundige, Universitair Medisch Centrum Utrecht
Prof.dr. J.W.A. Smit, internist-endocrinoloog, Leids Universitair Medisch Centrum, Leiden
Dr. C.H.J. Terhaard, radiotherapeut, Universitair Medisch Centrum Utrecht
Mw. prof.dr. E.G.E. de Vries, internist-oncoloog, Universitair Medisch Centrum Groningen
Drs. P. Wessels, Huisarts, Hilversum
Prof.dr. W.M. Wiersinga, internist-endocrinoloog, Academisch Medisch Centrum, Amsterdam
Dr. J.H.W. de Wilt, Chirurg, Erasmus MC, Rotterdam
Mandaterende verenigingen/organisaties
Nederlandse Vereniging voor Heelkunde
Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde
Nederlandse Vereniging voor Klinische Chemie
Nederlandse Vereniging voor Internisten
Nederlandse Vereniging voor Nucleaire Geneeskunde
Nederlandse Vereniging voor Pathologie
Nederlandse Federatie van Kankerpatiëntenorganisaties
Nederlandse Vereniging voor Nucleaire Geneeskunde
Nederlandse Vereniging voor Radiologie
Nederlandse Vereniging voor Radiotherapie en Oncologie
Verpleegkundigen & Verzorgenden Nederland
Schildklier Organisatie Nederland
Belangenverklaringen
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld.
De belangenverklaringen bij aanvang van het traject vindt u via:
- belangenverklaringen deel 1
- belangenverklaringen deel 2
De belangenverklaringen bij afronding van het traject worden nog geplaatst.
Inbreng patiëntenperspectief
Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van patiënten. Deze input is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande werkwijze is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject hebben de patiëntvertegenwoordigers knelpunten aangeleverd. Dit is gerealiseerd door het organiseren van een focusgroepbijeenkomst in juni 2012. Op basis van de uitkomsten van de focusgroepbijeenkomst is één uitgangsvraag geselecteerd die is uitgewerkt volgens de evidence based methodiek.
-
Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de procesbegeleider en de voorzitter aanwezig waren.
Het gesprek heeft plaatsgevonden ten tijde van het literatuuronderzoek van de evidence based vragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies uit de literatuur.
- Het perspectief van de patiënt met schildkliercarcinoom is zo breed mogelijk geïnventariseerd met behulp van het International Classification of Functioning, Disability and Health (ICF)-model. Hierbij valt te denken aan de beleving van de patiënt op het niveau van functies, activiteiten en maatschappelijke participatie.
-
De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is met name terug te vinden in de overige overwegingen en in de aanbevelingen.
-
De inventarisatie was beschikbaar toen de (sub)werkgroep begon met schrijven van overige overwegingen en aanbevelingen, en is daarin meegenomen.
-
De patiëntvertegenwoordigers waren aanwezig bij alle vergaderingen van de richtlijnwerkgroep. De patiëntvertegenwoordigers hebben de conceptteksten beoordeeld teneinde het patiëntenperspectief in de formulering van de definitieve tekst te optimaliseren.
-
De Nederlandse Federatie van Kankerpatiëntenorganisatie (NFK) is geconsulteerd in de externe commentaarronde.
Methode ontwikkeling
Consensus based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de oncologische en palliatieve zorgpraktijk, inclusief borging daarvan.
Als onderdeel van elke richtlijn stelt IKNL een implementatieplan op.
Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme. Informatie hierover is te vinden op www.iknl.nl/opleidingen.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor de verschillende disciplines. Het implementatieplan wordt ontwikkeld naar aanleiding van het definitieve document
Werkwijze
Werkwijze werkgroep
De werkgroep is in april 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met schildkliercarcinoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 120 professionals gereageerd en knelpunten geprioriteerd en/of ingebracht. Op basis van de uitkomsten van de enquête zijn vijf uitgangsvragen geselecteerd die zijn uitgewerkt volgens de evidence based methodiek. De overige knelpunten zijn consesusbased uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Voor de consensus-based revisie van de bestaande richtlijnteksten raadpleegden de werkgroepleden de door hen zelf verzamelde relevante literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen herzien. Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van patiënten. Zie ‘Inbreng patiëntenperspectief’.
De werkgroep heeft gedurende achttien maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd. De conceptrichtlijn is op 30 januari 2014 ter becommentariëring aangeboden op Richtlijnendatabase en Oncoline en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen en de landelijke en regionale tumorwerkgroepen. Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de conceptrichtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Circa 60 respondenten (zowel individuen als groepen) maakten van deze mogelijkheid gebruik. Een landelijke bijeenkomst op 16 april is georganiseerd naar aanleiding van de publicatie van de conceptrichtlijn en ter afsluiting van de commentaarfase. Alle commentaren werden vervolgens beoordeeld en verwerkt door de richtlijnwerkgroep. De richtlijn is inhoudelijk vastgesteld op 3 juli 2014. Ten slotte is de richtlijn ter autorisatie/accordering gestuurd naar de betrokken verenigingen/instanties.
Financiering
Deze richtlijn is gefinancierd door Integraal Kankercentrum Nederland (IKNL). De inhoud van de richtlijn is niet beïnvloed door de financierende instantie.
Procesbegeleiding en verantwoording
IKNL is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg. IKNL draagt bij aan het verbeteren van de zorg rond kanker door het verzamelen van gegevens, het opstellen van richtlijnen, het bewaken van kwaliteit en het faciliteren van samenwerkingsverbanden. Ons doel is de beste zorg voor iedere patiënt.
IKNL werkt aan multidisciplinaire richtlijnontwikkeling voor de oncologische en palliatieve zorg. Naast het reviseren van richtlijnen faciliteert IKNL ook het onderhoud, het beheer, de implementatie en de evaluatie van deze richtlijnen.
De kwaliteit van ontwikkelen, implementeren en evalueren van evidence en consensus based richtlijnen waarborgt IKNL door aan te sluiten bij de criteria opgesteld in de Richtlijn voor Richtlijnen (maart 2012), AGREE II en de Medisch specialistische richtlijnen 2.0.
Uitgangsvragen 2007
Diagnostiek
- Wat is de a-priori kans op schildkliercarcinoom / gedifferentieerd schildkliercarcinoom in de eerste lijn?
-
Wat is de definitie van een "nodus", is er een minimale maat voor diagnostiek?
-
Welke diagnostiek kan verricht worden door / via de huisarts en wanneer dient verwijzing plaats te vinden en naar wie?
-
Welke plaats neemt FNA in bij de diagnostiek van schildklierafwijkingen? Hoe betrouwbaar is FNA/kan FNA zijn?
-
Hoe kan de verwerking van cytologisch materiaal worden geoptimaliseerd en hoe dient de verslaglegging van schildklier FNA te zijn?
-
Is er een indicatie voor FNA bij een multinodulair beeld? Zo ja, wat is de consequentie van een FNA uitslag "folliculaire proliferatie" of "Hürthle cell proliferatie" bij een multinodulair beeld?
-
Wat is de indicatie voor echo, TSH bepaling (routine?), calcitoninebepaling en scintigrafie? En wat is de toegevoegde waarde hiervan?
-
Is er een plaats voor scintigrafie in de besluitvorming tot een diagnostische hemithyreoidectomie bij een folliculaire laesie?
-
Kan preoperatief ook groei buiten de schildklier worden vastgesteld? Welke patiënten zijn beter uit in een centrum en hoe identificeer je die?
-
Welke zijn klachten of afwijkingen suggestief voor maligniteit en hoe worden deze meegewogen in de besluitvorming tot een diagnostische hemithyreoidectomie of een totale thyreoidectomie?
-
Hoe kan de beoordeling van histologisch materiaal worden geoptimaliseerd en gestandaardiseerd?
-
Hoe is het beleid bij een positieve familie anamnese voor papillair schildklier carcinoom bij een patiënt met een nodus?
-
Wat zijn de diagnostische criteria voor "papillair carcinoom folliculaire variant" (PCFV)? Wat te doen bij focaal papillaire kenmerken?
-
Wat zijn de diagnostische criteria voor "minimally invasive" folliculair carcinoom? en hoe dient daarbij het klinisch beleid te zijn?
-
Dient de TNM classificatie standaard ingevoerd te worden bij de rapportage of alleen de ingrediënten hiertoe?
Primaire chirurgie en ablatie
- Wat is de behandeling van lymfekliermetastasen?
-
Wat is een (on)gunstige uitgangspositie en welke classificatie moet hiervoor gehanteerd worden?
-
Wat is de plaats van halsklierdissectie indien preoperatief sprake is van een maligniteit?
-
Wat is de waarde van een SN procedure?
-
Wat is de plaats van externe radiotherapie (+/- chemotherapie) bij gedifferentieerde T4 tumoren en welke dosis en doelvolume/fractionering zou moeten worden toegepast?
-
Wat is de hoogte van de ablatie?
-
Wat is de plaats van het pre-ablatie scintigram ?
-
Is het zinvol peroperatieve vriescoupes te verrichten?
-
Wat is het beleid bij stembandstilstand postoperatief?
-
Is pre-postoperatieve controle van de stembanden zinvol?
-
Hoe wordt perioperatieve zorg vastgesteld en afgestemd met overige subwerkgroepen?
-
Zijn er specifieke maatregelen ten aanzien van kinderen nodig?
-
Zijn er specifieke maatregelen ten aanzien van zwangerschap nodig?
Follow up (algemeen) 1
- Welke kwaliteitseisen worden gesteld aan thyreoglobuline bepaling?
-
Welke strategie moet worden gevolgd bij aanwezigheid van Tg-antilichamen?
-
Onder welke omstandigheden moet Tg worden afgenomen: on or off thyroxine, of na recombinant hTSH (rhTSH)?
-
Is er een grenswaarde aan te geven voor de Tg of de stijging ervan die moet leiden tot actie?
-
Wat is de waarde van Tg-mRNA in de follow-up?
-
Indicatie van rhTSH voor de I-scintigrafie?
-
Welk radiopharmacon dient er gebruikt te worden, 123I, of 131I, in welke dosis en wanneer?
-
Welke waarden van TSH en Tg zijn adekwaat voor onthouden of geven van I-therapie bij negatieve scan?
-
Wat is de waarde van de echografie in de follow-up?
-
Welke controle en welke diagnostiek is nodig na de initiële ablatie therapie?
-
Is er altijd een reden voor het nogmaals onttrekken van schildklierhormoon en het doen van I-scintigrafie en dient dit dan na bv 3 of 6 mnd plaats te vinden? Moeten subgroepen worden onderscheiden in verband met risico's?
-
Is er een streefwaarde voor de TSH, met name voor suppressietherapie, en hoe moet deze worden bepaald?
-
Dient er een routine X-thorax te worden gemaakt?
-
Is er ander localiserend onderzoek nodig en in welke volgorde? Tc-Sesta-MIBI, Thallium, Pet-scan?
-
Wat zijn de consequenties voor follow-up met betrekking tot Tg suppressie therapie?
-
Is er een modificatie van de richtlijn tijdens zwangerschap en bij kinderen?
-
Hoe dient de substitutietherapie te zijn, voorafgaand aan I-scintigrafie?
-
Is er een rol voor jodiumbeperkt dieet voorafgaand aan I-scintigrafie?
Follow up (recidief) 2
- Tweede therapie bij afstand jodium opnemende metastasen en/of inoperabel processen: standaard dosis of vooraf tracer/dosimetrie?
-
Toe te dienen dosis afhankelijk van uptake en/of lokalisatie metastasen?
-
Wat is de frequentie van 131I therapie bij succes ? Wat is de maximale cumulatievedosis 131I?
-
Hoe wordt succes bepaald? Hoe wordt succes gedefinieerd? daling van Tg?
-
Plaats van rTSH bij 131I therapie?
-
Wat zijn de indicaties voor uitwendige radiotherapie?
-
131I, externe radiotherapie of chirurgie bij locale recidieven in de hals? Wat is de rol van probe guided surgery?
-
Wat te doen bij een geïsoleerd recidief in de hals zonder voorafgaande behandeling hals? na voorafgegane locale therapie hals? na al voorafgaande halsklierdissectie?
-
Wat is de plaats van radiofrequente ablatie?
-
Wat te doen bij negatief tracer onderzoek? Blinde dosis 131I? Tracer onderzoek nodig voorafgaande aan blinde therapeutische dosis?
-
Wat te doen bij negatieve post-therapie scan en aantoonbaar Tg en positief beeldend ander onderzoek?
-
Is er een indicatie voor chirurgie voor niet in de hals gelegen metastasen? Altijd bevestiging PA nodig voor verdere behandeling?
-
Wat is de plaats van Lithium in de voorbereiding van de behandeling met 131I?
-
Wat is de rol van bisfosfonaten bij skeletmetastasen?
-
Embolisatie?
Organisatie van zorg
Multidisciplinaire werkgroep schildkliercarcinoom?
- Heeft ieder ziekenhuis een multidisciplinaire werkgroep schildkliercarcinoom?
-
Zo niet, in welk gremium worden de patiënten met schildkliercarcinoom besproken?
-
Wat is de minimale vs optimale samenstelling van de werkgroep?
-
Welke eisen stelt men aan de deelnemers van de werkgroep?
-
Hoe vindt inbedding van de werkgroep plaats, zowel lokaal als regionaal?
-
Is een landelijk PA-panel/registratie patiënten wenselijk/noodzakelijk?
Behandeling schildkliercarcinoom
- Is centralisatie van behandeling wenselijk of noodzakelijk en hoe wordt dit dan georganiseerd? Wat zijn de criteria voor behandelcentra en wie bepaalt dat?
-
Welke eisen stelt men aan betrokken chirurg/internist/radioloog/patholoog/nucleair geneeskundige?
-
Wanneer en hoe te verwijzen naar behandelcentra?
-
Wat is de rol van de huisarts in het diagnostisch en behandeltraject?
Patiënteninformatie
- Op welk moment is de patiënt een schildkliercarcinoompatiënt?
-
Welke eisen stelt dat aan de begeleiding van de patiënt?
-
Wat betekent dit voor de behandeling en de samenstelling van de multidisciplinaire werkgroep?
-
Aan welke eisen dient de patiënteninformatie te voldoen?
-
Welke eisen stelt dit aan de patiëntenorganisaties (van kankerpatiënten en van patiënten met schildkliercarcinoom)?
Wetenschappelijke onderbouwing
Module is uitgewerkt volgens consensus based methodiek.
Consensus based methodiek
Methode
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies , de overwegingen en de verantwoording.
Consensus based teksten zijn gebaseerd op evidence. Deze evidence is door de werkgroepleden zelf verzameld en verwerkt. Voor consensus based richtlijnteksten is er geen systematisch literatuuronderzoek uitgevoerd en worden de artikelen niet methodologisch beoordeeld. Er wordt geen level of evidence toegekend aan de studies en er wordt geen niveau van bewijs toegekend aan de conclusies. De formulering van de conclusie hangt af van de onderliggende artikelen (zie tabel 1 en 2).
Tabel 1. Formulering van conclusies voor diagnostische interventies
|
Conclusie gebaseerd op |
Formulering |
Goede kwaliteit betreft: vergelijking met referentietest, beschrijving indextest en onderzochte populatie, voldoende grote serie van opeenvolgende patiënten, tevoren gedefinieerde afkapwaarden, blindering van index en referentietest. |
Het is aangetoond dat... |
Matige kwaliteit betreft: vergelijking met referentietest, beschrijving indextest en onderzochte populatie, maar niet alle kenmerken die bij goede kwaliteit worden genoemd. |
Het is aannemelijk dat... |
|
Er zijn aanwijzingen dat... |
|
De werkgroep is van mening dat... |
Tabel 2. Formulering van conclusies voor therapeutische interventies
|
Conclusie gebaseerd op |
Formulering |
|
Het is aangetoond dat...
|
|
Het is aannemelijk dat... |
|
Er zijn aanwijzingen dat... |
|
De werkgroep is van mening dat... |
Methode voor het formuleren van ‘Overwegingen'
Naast de conclusies uit de literatuur zijn er andere overwegingen die kunnen meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin wordt de context van de dagelijkse praktijk beschreven en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
Per uitgangsvraag:
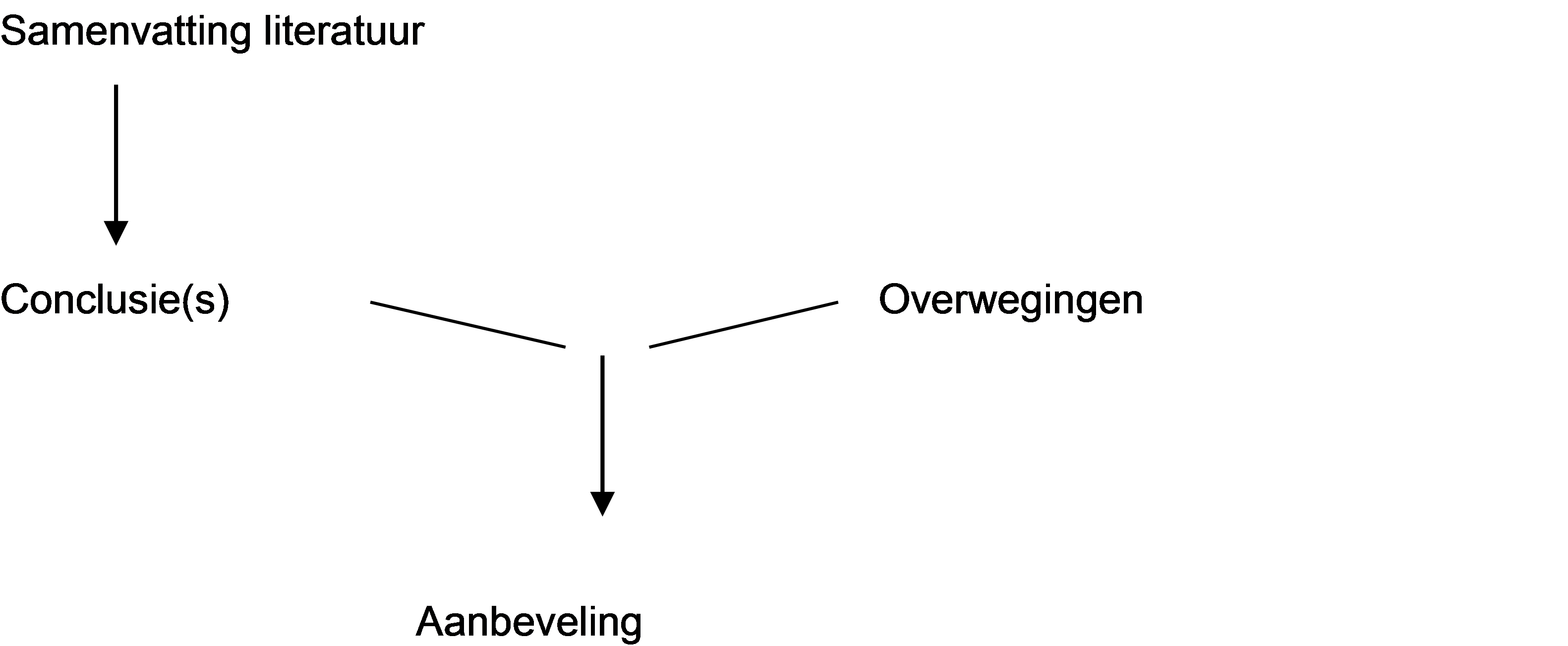
Figuur 1. Van bewijs naar aanbeveling
Checklist ‘overwegingen'
Eén of meerdere conclusies leiden tot één aanbeveling. Bij evidence based richtlijnen wordt voor de formulering van de aanbeveling één checklist ‘Overwegingen' ingevuld. Deze checklist en de bijbehorende uitleg kunnen ook worden gebruikt bij het schrijven van de overwegingen. Als een bepaald diagnostisch instrument of bepaalde behandeling volgens de conclusies niet werkzaam is, dient geen gebruik gemaakt te worden van dit diagnostisch instrument of deze behandeling. Overwegingen dragen dan niet bij en worden niet beschreven.
|
Items |
A) Wordt het item meegewogen in het opstellen van de concept aanbeveling? |
B) Indien ja, beschrijving van deze overwegingen. Deze tekst wordt weergegeven in de richtlijn onder het tabblad 'overwegingen'. |
|
1. Klinische Relevantie |
□ Ja □ Nee |
|
|
2. Veiligheid |
□ Ja □ Nee |
|
|
3. Patiënten perspectief |
□ Ja □ Nee |
|
|
4. Professioneel perspectief |
□ Ja □ Nee |
|
|
5. Kosten effectiviteit |
□ Ja □ Nee |
|
|
6. Organisatie |
□ Ja □ Nee |
|
|
7. Maatschappij |
□ Ja □ Nee |
|
Uitleg items checklist ‘overwegingen'
1. Klinische relevantie: bepalen door professionals en evt. literatuuronderzoek
- Sterkte van het effect vergeleken met geen interventie
- Consistentie van het beschikbare bewijs uit de verschillende studies
- Generaliseerbaarheid
- Voorbeeld: een bepaalde behandeling kan een significante verbetering van symptomen geven die patiënten echter niet als zodanig ervaren, dus klinisch niet relevant
2. Veiligheidsissues: bepalen door professionals en evt. literatuuronderzoek
- Bijwerkingen, risico's of complicaties op korte en lange termijn
- Gebruik bij co-morbiditeit / gelijktijdig gebruik medicatie en/of interventie
- Voorbeeld: fysieke comorbiditeit kan bepaalde behandelingen uitsluiten.
3. Patiëntenperspectief: bepalen door professionals, patiënten en eventueel literatuuronderzoek
- Voorkeuren / te verwachten compliance / te verwachten tevredenheid / kwaliteit van leven
- Voorbeeld: diagnostiek of behandeling waarvoor minder ziekenhuisbezoek nodig is; behandeling die makkelijker toe te dienen is; behandeling die sneller effect laat zien
4. Professioneel perspectief: bepalen door professionals
- Kennis en ervaring met technieken/therapie
- Risico's die professional loopt bij het toepassen van de interventie / tijdbesparing of het verlies aan tijd door het invoeren van de interventie
- Houding, normen en waarden van de professional
- Voorbeeld: een nieuwe techniek die nog niet alle professionals beheersen.
5. Kosteneffectiviteit: bepalen door professionals, indien gewenst en mogelijk kosteneffectiviteits-analyse door expert
- Kosteneffectiviteit in verhouding tot bestaande ingrepen/behandelingen voor deze ziekte
6. Organisatorische factoren: bepalen door professionals
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen
- De wijze waarop de organisatie van de zorg aangeboden dient te worden / grootte van de verandering in het organisatie-zorgproces / infrastructuur voor implementatie
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijke factoren: bepalen door professionals
- Vergoeding door verzekeraars / Industriële belangen / Ethische overwegingen / Juridische overwegingen / Politieke en strategische consequenties
- Voorbeeld: indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling worden aanbevolen.
Checklist formuleren van aanbevelingen
|
Conclusie |
Effect overwegingen op concept aanbeveling |
Classificatie aanbeveling |
Formulering aanbeveling |
|
Hoge mate van bewijs (het is aangetoond/ aannemelijk) |
Versterkt concept aanbeveling of is neutraal |
Sterke aanbeveling |
Er dient |
|
Hoge mate van bewijs (het is aangetoond/ aannemelijk) |
Verzwakt concept aanbeveling |
Aanbeveling |
Er wordt geadviseerd |
|
Lage mate van bewijs (er zijn aanwijzingen/ de werkgroep is van mening dat) |
Versterkt concept aanbeveling of is neutraal |
Aanbeveling |
Er wordt geadviseerd |
|
Lage mate van bewijs (er zijn aanwijzingen /de werkgroep is van mening dat) |
Verzwakt concept aanbeveling |
Geen aanbeveling |
Er kan geen aanbeveling worden gegeven. Optioneel: de werkgroep is van mening dat |
Methode voor het formuleren van aanbevelingen
In de praktijk kunnen er per uitgangsvraag meerdere conclusies zijn, met verschillend niveau van bewijs. Indien er meerdere conclusies bij de uitgangsvraag zijn geformuleerd is het van belang de conclusies te prioriteren. Het niveau van bewijs van de conclusie die het meest van belang is voor het formuleren van de aanbeveling wordt meegenomen in de checklist ‘formuleren van aanbevelingen'.
Evaluatie
Tijdens de ontwikkeling van de richtlijn zijn indicatoren voor de evaluatie van de aanbevelingen in de richtlijn opgesteld. Met gegevens uit de NKR en eventuele andere bronnen registreren we deze indicatoren. Hiermee stellen we vast in hoeverre de richtlijn wordt nageleefd. De resultaten van de evaluatie nemen we mee in de volgende revisie van de richtlijn. Ook kunnen de resultaten voor een aanpassing van de implementatie, in lopende trajecten, zorgen. De indicatoren voor deze richtlijn worden ontwikkeld naar aanleiding van het definitieve document.
Verklarende woordenlijst
|
CB |
consensus based |
|
DTC |
Gedifferentieerd schildkliercarcinoom (Differentiated thyroid cancer) |
|
EB |
evidence based |
|
ESR |
european standardized rate |
|
PPV |
positieve voorspellende waarde (positive predictive value) |
|
NPV |
negatieve voorspellende waarde (negative predictive value) |
|
RAI |
radioactief jodiumbehandeling (RadioActive Iodine) |
|
RT |
Radiotherapie |
|
Tg |
Thyreoglobuline |
|
TgAb |
anti-Thyreoglobuline antistoffen |
|
TgOFF-bepaling |
Tg-bepaling nadat tevoren de schildklierhormoonsubstitutie tijdelijk is gestaakt |
|
TgON-bepaling |
Tg-bepaling tijdens schildklierhormoonsubstitutie |
|
WBS |
whole body scan |
